En este capítulo resumiremos los datos más importantes sobre la biología de los quistes, orientados fundamentalmente a su uso práctico.
Para una información más detallada les referimos a la revisión de Clegg y Conte (1980).
Un esquema de la ultraestructura de un quiste de Artemia está representado en la Figura 2.
La cáscara del quiste está formada de tres estructura:
El corion: Capa dura formada de lipoproteinas impregnadas de quitina y hematina (= producto de descomposición de la hemoglobina; la concentración de hematina determina el color de la cáscara, variando de un marrón pálido a un marrón oscuro). La principal función del corion es la de proporcionar una protección adecuada al embrión contra rupturas mecánicas y radiaciones (ej. las radiaciones ultravioletas de los rayos solares). Esta capa puede ser completamente eliminada (disuelta) por un tratamiento oxidativo a base de hipoclorito (= decapsulación del quiste; ver apartado 5.2.).
La membrana cuticular externa: Protege al embrión de la penetración de moléculas mayores que la molécula del CO2 (= membrana compuesta de varias capas y con una función de filtro muy especial, actuando como barrera de permeabilidad).
La cutícula embrionaria: Una capa transparente y altamente elástica que queda separada del embrión por la membrana cuticular interna (que se transforma en membrana de eclosión durante el proceso de incubación).
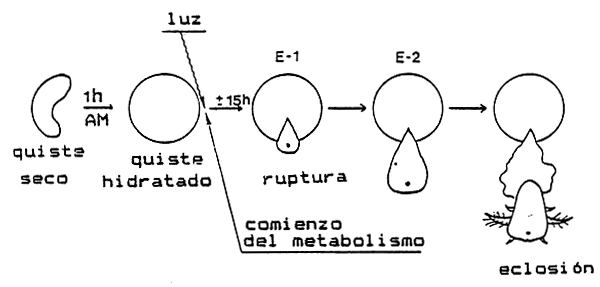
Figura 3. Desarrollo del quiste de Artemia desde la incubación en agua de mar (AM) hasta la liberación del nauplio.
El embrión es una fase indiferenciada de gástrula que se encuentra en un estado completamente ametabólico con niveles de agua inferiores al 10%; por lo que su metabolismo se haya en una fase de parada reversible. La viabilidad del embrión se ve afectada cuando los niveles de agua exceden del 10% (comenzando la actividad metabólica), y cuando los quistes son expuestos al oxígeno (por ej. poniendolos al aire); en presencia de radiaciones cósmicas de oxígeno se produce la formación de radicales libres que destruyen los sistemas enzimáticos específicos de los quistes ametabólicos de Artemia.
En la Figura 3 está representado un esquema del desarrollo de un quiste de Artemia, desde la incubación en el medio de eclosión hasta la liberación del nauplio.
Cuando se incuban en agua de mar, los quistes bicóncavos se hinchan adoptando una forma esférica en el plazo de 1 a 2 horas. Una vez completamente hidratados, el diámetro del quiste ya no varía. Transcurridas de 15 a 20 horas desde la hidratación, la cáscara del quiste, (incluyendo la membrana cuticular externa) estalla (=breaking o estado E-1) con lo que se hace visible el prenauplio rodeado de la membrana de eclosión. El embrión deja definitivamente la cáscara (estado E-2) y cuelga hacia abajo de la cáscara vacía (la membrana de eclosión puede estar aún unida a la cáscara). A través de la transparencia de la membrana de eclosión se puede seguir la diferenciación del prenauplio hasta el estado I de larva de nauplio, el cual comienza a mover los apéndices. Poco tiempo después, la membrana de eclosión se romperá (“hatching”) liberando la larva nadadora de Artemia (comenzando por la cabeza).
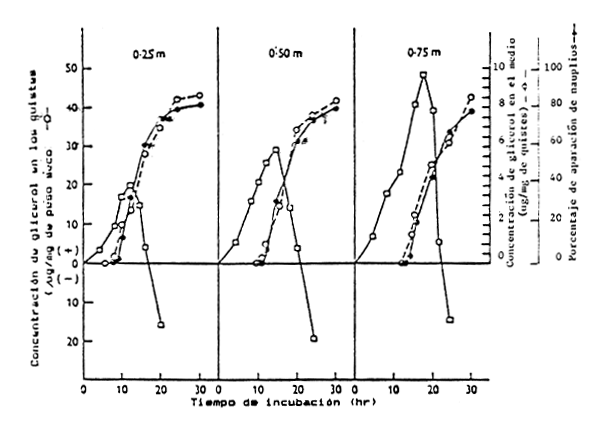
Figura 4. Relación entre la concentración de glicerol en los quistes (- □ -), el nivel de glicerol en el medio (- o -), el porcentaje de quistes en fase de “ruptura” (- • -) y el tiempo de incubación de quistes de Artemia a 3 concentraciones diferentes de NaCl (NaCl 0,25 molar = 14,6% de salinidad (según Clegg, 1964)
Los quistes secos son altamente higroscópicos, incorporando agua a gran velocidad, por ejemplo en las primeras horas el volumen del embrión hidratado aumenta más de un 100%. Una vez completamente hidratado (asimilación del 140% de agua) se puede iniciar el metabolismo activo a condición de que los quistes estén suficientemente iluminados. El efecto activador de la luz es esencial para que comience el metabolismo de la mayoria de los quistes. A intensidades de luz demasiado bajas, la tasa de eclosión se retrasa o simplemente no se produce.
El metabolismo aeróbico en el embrión enquistado asegura la conversión de la trealosa, como carbohidrato de reserva, en glicógeno (como fuente de energía) y glicerol que son acumulados por el embrión en la membrana cuticular externa. El incremento en la concentración de un producto altamente higroscópico como es el glicerol, ocasiona un mayor aumento en la asimilación de agua por el embrión a través de la membrana cuticular externa. Como consecuencia de este fenómeno se produce un aumento de la presión osmótica en el interior de la membrana cuticular externa hasta que se alcanza un punto crítico, momento en el cual se produce la ruptura de esta membrana y de la cáscara del quiste (= “breaking”). La ruptura de la cáscara va acompañada de la liberación de todo el glicerol al medio de cultivo.
Dicho de otro modo, el metabolismo de los quistes de Artemia, con anterioridad a la ruptura, es un sistema regulatorio hiperosmótico trealosa-glicerol. Esto significa que la ruptura se puede producir en ausencia de sales y que a medida que aumentan los níveles de salinidad en el medio de eclosión, se necesitan mayores concentraciones de glicerol para alcanzar el punto crítico de presión osmótica necesario para que se produzca la ruptura de la cáscara (por diferencia entre la presión osmótica dentro y fuera del quiste). De esta forma cuanto mayor es la salinidad en el medio, mayor cantidad de glicerol tiene que ser producido, alargandose con ello el período de eclosión y de ruptura y disponiendo de menos reservas energéticas para el nauplio (ver Figura 4)
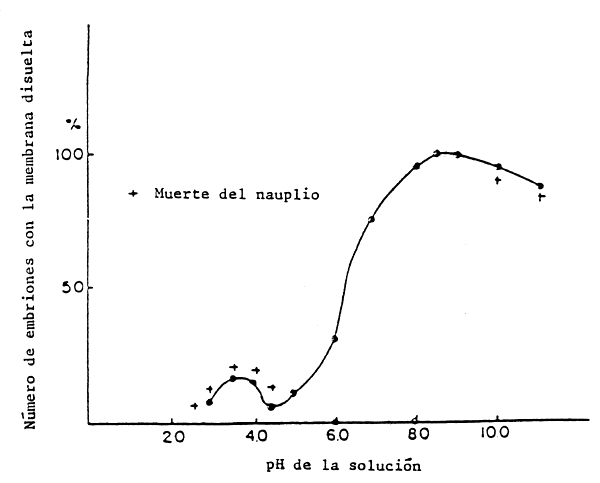
Figura 5. Efecto del pH en el medio de incubación sobre la actividad de la enzima de eclosión de los embriones de Artemia (según Sato, 1967).
Tras la ruptura de la cáscara el embrión entra en contacto directo con el medio externo a través de la membrana de eclosión. En ese momento ya es activo un sistema osmoregulatorio iónico; el desarrollo óptimo hasta larva nauplio libre y nadadora no quedará asegurado hasta que la composición iónica del medio de eclosión sea similar a la del agua de mar y con un pH comprendido en el intervalo entre 8 y 9 (ver Figura 5).
El embrión empieza entonces a diferenciarse en una larva nauplio móvil. Un enzima de eclosión es segregado en la zona de la cabeza del nauplio. Este debilita la membrana de eclosión a través de la cual el nauplio móvil se libera en el medio de cultivo.
Los quistes secos (con un contenido en agua entre el 2 y el 5%) son muy resistentes, por ej., la viabilidad de la eclosión no se ve afectada en un intervalo de temperatura entre -273 y 60°C pudiendo tolerar hasta 90°C si las exposiciones son de breve duración (en realidad las exposiciones deberán ser más cortas a medida que la temperatura aumenta).
Los quistes hidratados (completamente hidratados en el medio de cultivo) tienen una tolerancia a la temperatura muy específica (ver esquema en la Figura 6):
Una interrupción del metabolismo (= muerte del embrión) se produce por debajo de -18°C y por encima de 40°C.
Una interrupción reversible del metabolismo se produce (= sin que la viabilidad se vea afectada) en un intervalo de temperaturas que varía entre -18°C y 4°C y entre 32°C y 40°C (una exposición de larga duración a este último intervalo de temperaturas ocasiona un retraso progresivo de la tasa de eclosión. Los límites superiores e inferiores de temperatura pueden variar ligeramente de cepa a cepa).
El metabolismo activo actua en el interválo de temperatura entre 4° y 32°C; aunque si bien el porcentaje de eclosión permanece constante, los nauplios eclosionan antes a medida que la temperatura es más alta.
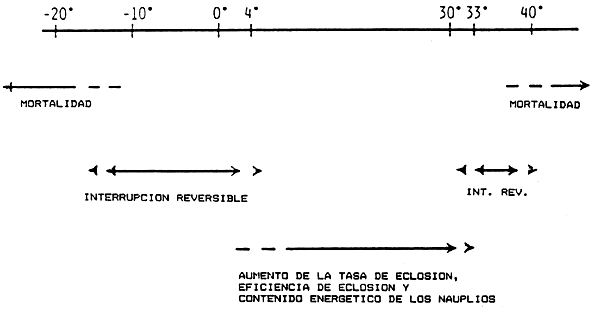
Figura 6. Diagrama esquemático del efecto de las temperaturas del agua sobre el metabolismo del quiste de Artemia para valores comprendidos entre -20°C y más de 40°C
Datos de porcentaje de eclosión (H%), eficiencia de eclosión (HE), tasa de eclosión, peso seco naupliar, contenido energético naupliar y biomasa de eclosión (HO) de nauplios de Artemia eclosionados de quistes de diversos orígenes bajo condiciones estandar (35% ; 25°C)
| Origen de los quistes | H% | HE | T0 | T10 | T90 | Ts | Peso seco indv. del nauplio (μg) | Contenido energético indv. del nauplio (10-3 julios) | HO biomasa naupliar (mg/g de quistes |
| (nauplios/g) | (hrs) | (hrs) | (hrs) | (hrs) | |||||
| San Francisco Bay, Ca-USA | |||||||||
| lote 288–2596 | 71.4 | 267,200 | 15.0 | 15.5 | 20.5 | 5.0 | 1.63 | 22.48 | 435.5 |
| lote 288–2606 | - | 259,200 | 16.4 | 16.9 | 23.2 | 6.3 | |||
| lote 236–2016 | - | 249,600 | 25.8 | 28.4 | 37.6 | 9.2 | |||
| San Pablo Bay, Ca-USA | 84.3 | 259,300 | 13.9 | 15.1 | 20.1 | 5.0 | 1.92 | 21.33 | 497.7 |
| Macau, Brasil lote 871 172 | 82.0 | 304,000 | 15.7 | 19.3 | 23.7 | 4.4 | |||
| lote 87 500 | - | 182,400 | 16.4 | 16.0 | 29.1 | 13.1 | 1.74 | 22.52 | 529.0 |
| Mayo 178 | - | 297,600 | 14.7 | 17.5 | 21.9 | 4.4 | |||
| Barotac Nuevo, Filipinas | 78.0 | 214,000 | 14.7 | 15.7 | 22.0 | 6.3 | 1.68 | 22.74 | 359.5 |
| Great Salt Lake, UT-USA | 43.9 | 106,000 | 14.1 | 14.7 | 21.7 | 7.0 | 2.42 | 22.35 | 256.5 |
| Shark Bay, Australia | 87.5 | 217,600 | 20.3 | 21.1 | 28.1 | 7.0 | 2.47 | 23.33 | 537.5 |
| Chaplin Lake, Canada | 65,600 | 14.3 | 15.7 | 33.0 | 17.3 | 2.04 | 21.94 | 133.8 | |
| Buenos Aires, Argentina | 62.8 | 193, 600 | 16.1 | 17.3 | 22.6 | 5.3 | 1.72 | 22.02 | 333.0 |
| Lavalduc, Francia | 75.8 | 182,400 | 19.5 | 20.5 | 30.5 | 10.0 | 3.08 | 21.76 | 561.8 |
| Tientsin, China | 73.5 | 129,600 | 16.0 | 17.1 | 27.2 | 10.1 | 3.09 | 22.05 | 400.5 |
| Margherita di Savoia, Italia | 77.2 | 137,600 | 18.7 | 20.0 | 25.3 | 5.3 | 3.33 | 21.76 | 458.2 |
| Quistes de referencia de Artemia | 45.7 | 211,000 | 18.0 | - | 32.2 | - | 1.78 | 22.62 | 375.6 |
Leyenda de la abreviaciones:
T0 = tiempo hasta la aparición de los primeros nauplios
T10 = tiempo hasta que se alcanza el 10% de eclosión
T90 = tiempo hasta que se alcanza el 90% de eclosión
Ts = T90 - T10 = medida de la sincronía de eclosión
En la Tabla II se recogen datos específicos para varias cepas de Artemia. Para más detalles sobre la metodologia analítica ver Apéndice I.
| = | Número de nauplios que pueden ser producidos a partir de 100 quistes hidratados y conteniendo un embrión; en este criterio no se incluyen impurezas o quistes defectuosos, ej. cáscaras rotas, arena, sal, etc. |
Este criterio se refiere al tiempo transcurrido desde que comienza la incubación (hidratación de los quistes) hasta la liberación del nauplio (eclosión). Considerandose los siguientes intervalos de tiempo:
| T0 = | Tiempo de incubación hasta que aparecen los primeros nauplios nadadores. |
| T10 = | Tiempo de incubación hasta que aparece el 10% del total de losnauplios eclosionables. |
| T90 = | Tiempo de incubación hasta que aparece el 90% del total de los nauplios eclosionables. |
| T5 = | T90 - T10; este valor da una idea de la sincronía de la eclosión. |
| = | Número de nauplios que se producen a partir de 1 gramo de quistes secos cuando se les incuba bajo condiciones estandar de eclosión (48 horas de incubación, agua de mar de 35‰ saturada de oxígeno a 25°C, mínimo de 1000 lux de iluminación y pH entre 8.0 y 8.5). |
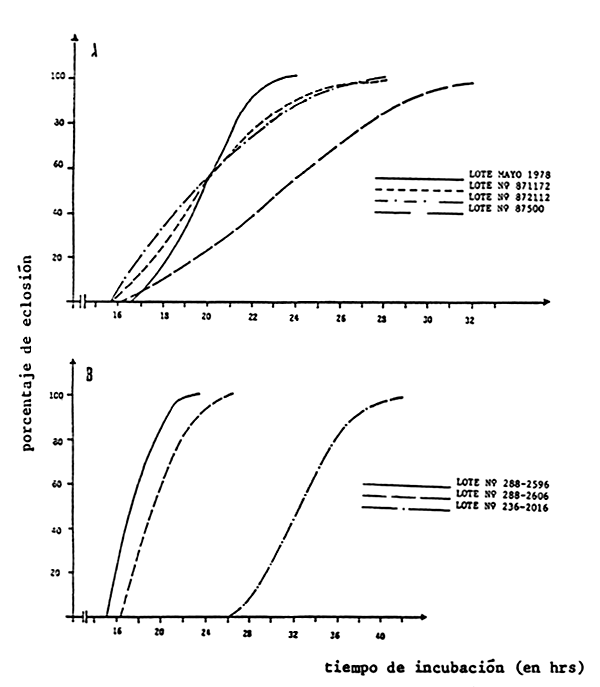
Figura 7. Curvas de eclosión de diferentes lotes de quistes procedentes de
Macau, Brasil (A) y San Francisco Bay, California_US (B) (según
Vanhaecke y Sorgeloos, 1982).
(las curvas de eclosión fueron calculadas de la siguiente forma: los valores
medios de las 4 submuestras, tomadas cada hora, por ensayo, están expresadas
como porcentaje del valor máximo de eclosión; en cada prueba se empleó
para calcular las líneas de regresión no lineales el porcentaje medio
de los tubos duplicados según el método de las polinomiales ortogonales; un
análisis de varianza de esas líneas de regresión muestran el mejor ajuste
que representa la curva de eclosión):
| = | Peso seco de biomasa de nauplios que son producidos a partir de 1 gramo de quistes secos cuando son incubados bajo las condiciones estandar de eclosión (ver apartado 3.5.3.). |
| = | HE X peso seco individual del estado I de nauplio de la misma cepa producido bajo las condiciones estandar de eclosión (ver Tabla II). |