Por:
Emilio Castro C.M.Sc. - Fundación Chile
Gonzalo Mena L.M.V. - Universidad de Chile
La acuicultura como fuente de producción de alimentos no es una idea nueva. Esta ya se practicaba 2000 años antes de Cristo, en China (Méndez y Munita, 1989).
A pesar que en Inglaterra se iniciaron los cultivos de salmónidos el año 1868, es sólo durante la década de 1960 que, en Europa, Japón y U.S.A. se desarrolló e implementó la tecnología necesaria para la crianza de salmones en cautiverio, al utilizar estructuras flotantes (balsas-jaulas) en el mar. Este tipo de cultivo ha sido impulsado fundamentalmente por la disminución del recurso silvestre. De esta forma, se ha establecido una nueva área productiva con un crecimiento explosivo y un mercado en continua expansión.
La producción mundial de salmones fue del orden de 969,675 tm, en 1989, siendo de ellas 800,000 tm, producto de la captura de salmónidos silvestres. Sin embargo, las proyecciones para 1990 indicaban una notoria disminución de la captura a 700,000 tm, siendo por lo tanto necesario, para satisfacer la demanda, un incremento en la producción mundial de salmones en cautiverio (Méndez y Munita, 1989).
El cultivo comercial de salmónidos en Chile se inicia a fines de la década de los '70, aunque ya en 1932 se había introducido y establecido el cultivo de la trucha arcoiris (Oncorhynchus mykis) y en 1969 se realiza la primera tentativa de introducir salmón del Pacífico o coho (Oncorhynchus kisutch) en nuestro territorio (Méndez y Munita, 1989).
La X y XI regiones presentan condiciones geográficas, climáticas y sanitarias ideales para el cultivo de salmónidos, junto a los bajos costos de producción que la acuicultura tiene en nuestro país, en comparación a Europa o América del Norte.
Así,en el año 1982 se produjeron 80 tm de salmón y truchas, en 1991 la producción alcanzó 42,468 tm y en 1992 esta se elevó a 58,043 tm sobrepasando con creces las 45,000 tm esperadas para el año 1995. Los valores exportados ese año superaron los US$ 269 millones, aumentando en un 169% en relación a 1991 (Méndez, 1990). Estas cifras, que exceden los mejores pronósticos de años recientes, permiten anticipar que Chile podría cosechar no menos de 95,000 a 100,000 tm de estas especies en 1995–96, con un valor comercial de US$ 450 a 500 millones. Antes de alcanzar estas cifras es necesario analizar la factibilidad de colocar estos productos en el mercado internacional y la incidencia que esto pueda tener sobre los precios o pueda producir una eventual aparición de acciones proteccionistas de los mercados consumidores (Castro, E., 1993, comunicación personal).
El criterio fundamental de aceptación del salmón, por parte del público consumidor, es el impacto visual dado por la coloración rosada o roja de su carne. Esta es la característica distintiva de esta especie y lo que contribuye a darle el sello de exclusividad a su imagen, a diferencia de otros productos alimenticios de origen animal que son juzgados básicamente por su sabor, textura, frescura, etc. Por consiguiente, el grado de pigmentación de la carne es un factor preponderante en la determinación del precio de mercado que alcance el salmón, en cualquiera de sus formas de presentación.
La coloración de la carne de estos peces anádromos está dada por la absorción y depósito de carotenoides en su carne (Kanemitsu y Aoe, 1987). Estos carotenoides pueden ser sintetizados solamente por plantas, levaduras y fitoplancton, siendo múltiples las fuentes de carotenoides para los peces de vida silvestre: crustáceos, algas, pequeños peces y otros, que actúan como organismos acumuladores (Steven, 1948).
En los salmónidos bajo condiciones de crianza artificial, al no contar con una fuente de pigmentos en su dieta, la coloración de su carne es blanca, debido a que son incapaces de sintetizar estos compuestos.
Los carotenoides encontrados en salmónidos corresponden básicamente a astaxantina (3.3'-dihidroxi-4.4'-diceto -β-caroteno) y cantaxantina (4.4'-diceto-β-caroteno) (Steven, 1948). También es posible encontrar, aunque en menores concentraciones tisulares, adenorrubina, zeaxantina, luteina y otros compuestos carotenoides (Hata y Hata, 1973).
Dada la fuerte expansión de la salmonicultura y la necesidad de pigmentar estos peces, se ha generado una gran demanda mundial por fuentes pigmentantes. Entre los productos utilizados se ha recurrido a fuentes naturales de carotenoides, como crustáceos o desechos del procesamiento de crustáceos, plantas, algas y levaduras, con resultados variables (Torrissen et al., 1989), y fuentes artificiales de pigmento, de las cuales sólo existen el Carophyll red 10%™ (cantaxantina sintética) y Carophyll pink 8%™ (astaxantina sintética). Estos pigmentos sintéticos son marcas registradas de F. Hoffmann-La Roche y Co. Ltda. Suiza.
Los productos sintéticos, hasta la fecha, han sido la fuente de pigmentos más utilizada en la acuicultura mundial y nacional, por ser productos estandarizados, con una alta concentración de carotenoides y de fácil manejo. Estos, sin embargo, ofrecen ese único aporte en la dieta a un precio extremadamente alto, representando entre el 15 al 20% del costo de la dieta (Sinnott, 1989), y dado que son productos importados significan una continua salida de divisas para el país. Por otro lado, su autorización como aditivo alimentario aún no es general a nivel mundial.
Estos factores, junto a lo atractivo del mercado, se proyectan ventas para el año 1993 de más US$ 10 millones y US$ 100 millones por concepto de pigmentos, a nivel nacional y mundial respectivamente, han orientado la investigación de fuentes alternativas de pigmentación, naturales, más económicas y de calidad constante.
En este marco resulta del todo relevante, poder evaluar nuevas fuentes de pigmentantes especialmente naturales, producida localmente, la cual permitiría romper de alguna manera, la dependencia de los productos importados que enfrenta la salmonicultura nacional.
La coloración rosada de los salmónidos está dada por la presencia de carotenoides oxigenados en su tejido muscular, principalmente astaxantina y en forma menos abundante cantaxantina, aunque también se pueden encontrar pequeñas cantidades de otros carotenoides como zeaxantina, luteina, capsantina, etc… (Torrissen et al., 1989).
Estos pigmentos carotenoides o xantofilas pertenecen a la familia de los carotenoides, en la cual también se ubican los carotenos, pero éstos a diferencia de los primeros poseen funciones oxigenadas, como grupos hidroxílicos (luteina y zeaxantina), grupos cetónicos (cantaxantina) o ambos (astaxantina) (Calvo, 1989).
Esta coloración, aunque depende de los pigmentos retenidos por el tejido muscular, no guarda una relación directa con la concentración muscular de carotenoides. A bajos niveles de carotenoides, la asociación es lineal entre la intensidad de pigmentación y la concentración muscular, sin embargo, por sobre los 6 a 8 mg/kg esta relación se pierde debido a que el ojo humano no tiene la sensibilidad para captar diferencias de pigmentación por sobre las concentraciones antes mencionadas (Torrissen et al., 1989). Otro factor que influye sobre esta relación es la presencia de grasa intermuscular despigmentada que, si se encuentra en alta cantidad, puede enmascarar la pigmentación visual de la carne. Así, Sinnott (1989) plantea que un prolongado ayuno previo a la cosecha, movilizaría estas grasas, y de este modo, se lograría un mejor nivel de pigmentación en el producto.
Por lo tanto, se sugiere que 4 mg/kg sería la concentración mínima requerida para alcanzar una pigmentación visual aceptable para la comercialización de la carne de los salmónidos (Torrissen et al., 1989).
En los salmónidos, como en cualquier otra especie animal, la retención de los pigmentos carotenoides depende de la interacción de múltiples factores, tales como:
El lugar de absorción de la cantaxantina fue dilucidado por Hardy y Torrissen (1987), quienes midieron el coeficiente de digestibilidad de la astaxantina en diferentes secciones del tracto gastro intestinal de los peces, con lo que determinaron que el pigmento es absorbido principalmente, en la parte posterior del intestino.
No se han realizado, hasta el momento, estudios específicos que diluciden los mecanismos de absorción de los carotenoides en el lumen intestinal de los peces. No obstante, Osborne et al., (1982) indican no haber encontrado correlación entre hipocarotenoídemia y mala absorción de los lípidos en pollos, concluyendo que hay procesos específicos para la absorción de carotenoides, Torrissen et al. (1989) y Bjerkeng et al. (1990) concuerdan con estos investigadores al plantear que la astaxantina y cantaxantina se absorben independientemente y se metabolizan por rutas diferentes. Sin embargo Storebakken y No (1992) han planteado que los carotenoides, al ser liposolubles, probablemente son emulsificados en el micelio y absorbidos junto con la bilis y lípidos a nivel intestinal.
La velocidad de absorción de la cantaxantina en trucha arcoiris fue determinada, usando cantaxantina marcada con tritio por Chouber y Luquet (1982) quienes describieron que este pigmento aparece en el plasma recién a las 3 horas, siendo su máxima concentración a las 24 horas, y que a las 72 horas todavía podían verse grandes cantidades en el plasma. Hardy y Torrissen (1987), asimismo puntualizan que la absorción de la cantaxantina en la trucha es un proceso lento, comparado con la absorción de nutrientes esenciales como los ácidos grasos y aminoácidos.
Torrissen et al. (1989), han planteado que la absorción puede ser incrementada por la incorporación de grupos hidroxílicos en el esqueleto del caroteno. Esta hipótesis también es sostenida por otros autores quienes demuestran que los coeficientes de retención obtenidos para astaxantina han sido 1.3 (Choubert y Storebakken, 1990) y 1.7 (Torrissen y Christiansen, 1991) veces más altos que para cantaxantina, lo cual estaría fundamentado por una mejor absorción intestinal, debido a la ausencia en esta última de grupos hidroxílicos en su estructura y a un mejor depósito del pigmento en el tejido muscular, de la astaxantina.
Schiedt et al. (1985), han indicado que, de acuerdo a los estudios realizados, el orden de precedencia del depósito de carotenoides en salmónidos, ubican a la astaxantina en primer lugar, seguida por adonirrubina y cantaxantina, luego estarían la zeaxantina y luteina y, finalmente, β-carotenos, los que son pobremente absorbidos. Hata y Hata (1972) concuerdan con lo anterior, excepto que basado en los grupos hidroxílicos, la zeaxantina y la luteina estarían entre la astaxantina y la adonirrubina.
Torrissen et al. (1989), también han planteado que la eficiencia de absorción difiere entre distintas especies de animales; por ejemplo los mamíferos absorben mejor los β-carotenos, en cambio, los peces y aves lo hacen con los carotenoides oxigenados (xantofilas). Es así como los salmónidos absorben cantaxantina y astaxantina 10 a 20 veces más eficientemente que luteina y zeaxantina, en cambio las aves absorben zeaxantina 3 veces mas eficientemente que astaxantina.
Otro aspecto importante en la absorción de estos pigmentos es el grado de esterificación que poseen. En trabajos realizados con trucha arcoiris en agua dulce, en mar y salmón atlántico, se observó un menor nivel de pigmentación al utilizar astaxantina esterificada como insumo pigmentante en comparación con astaxantina libre. Tanto en el plasma como en el músculo, sólo se encontró astaxantina libre, por lo que se deduce que la astaxantina esterificada fue hidrolizada en el tracto digestivo y absorbida en forma libre. Este proceso sería limitado, lo cual explicaría la diferencia observada en el grado de pigmentación alcanzado en ambos casos (Torrissen et al., 1989). Además, parece ser que la es tearasa, responsable de la hidrólisis de los ésteres en el intestino, tiene preferencia por los isómeros ópticos 3R.3R' de la astaxantina, como lo demuestra su mayor depósito en el músculo, en comparación con los otros isómeros configuracionales de este carotenoide (Storebakken y No, 1992).
Los lípidos en animales de sangre caliente, generalmente, son transportados por la linfa y la sangre como quilomicrones y lipoproteínas de muy alta densidad (VHDL). La sangre venosa pasa por el hígado, en tanto que la linfa puede ser drenada en el conducto toráxico.
En este sentido, los trabajos realizados por Kitahara (1983) en salmón chum (Oncorhynchus keta) con astaxantina y por Choubert et al. (1991), en trucha arcoiris, con cantaxantina concuerdan que, en salmónidos los carotenoides son transportados en la sangre unidos, mediante enlaces no covalentes, a lipoproteínas. Estas son sintetizadas en el hígado, donde podría ocurrir una eventual reubicación de la quilomicra en las diversas lipoproteínas portadoras. Así mismo ambas publicaciones concuerdan en que la lipoproteína de alta densidad (HDL) (Kitahara, 1983) es la principal portadora de carotenoides, con un 61.04% del total según Choubert et al. (1991).
En hembras de salmón chum, durante el desove, Kitahara (1983) observó que la astaxantina es transportada por la vitelogenina (proteína especifica de las hembras) desde el músculo o el tracto gastro-intestinal, hasta los ovarios. Una vez localizados en las ovas, estos carotenoides, principalmente astaxantina, pero también cantaxantina, luteina, zeaxantina y β-carotenos, se unen con la proteína de la yema del huevo, lipovitelina o, por el contrario, se encuentran en solución en la fracción lipídica de la yema, en forma libre o como ésteres (Miki et al., 1982).
Meyers (1986) propone clasificar a los peces, según su habilidad para convertir otros carotenoides en astaxantina, en dos grupos:
Los que pueden transformar luteina o zeaxantina dietaria a astaxantina vía adoxantina, pero no pueden utilizar β-carotenos y cantaxantina como precursores de astaxantina. Este grupo de peces comprende especies de agua dulce como la carpa (Cyprinus carpio).
Los que son incapaces de sintetizar astaxantina a partir de luteina, zeazantina, β-carotenos o cantaxantina dietaria, pero que sin embargo, pueden depositar luteina y cantaxantina sin modificación en su tejido muscular.
A este último grupo de peces pertenecen los salmónidos, los que se pueden clasificar además, según la vía metabólica inversa de reducción de la astaxantina dietaria en: aquellos que depositan astaxantina sin modificación en su tejido muscular y ovárico (Oncorhynchus y Salmo), y aquéllos en que la astaxantina dietaria es metabolizada rápidamente, a nivel muscular, a zeaxantina y luteina, vía indoxantina: Salvelinus, en consecuencia, estos peces no pueden alcanzar el típico color rosado del género Oncorhynchus, aunque sean suplementados con astaxantina dietaria (Ando et al., 1988).
Como una excepción del género Oncorhyncus, Ando et al. (1988) señalan que en el salmón chum, durante su migración río arriba, ocurre la reducción de astaxantina a zeaxantina, vía 4-ceto-zeaxantina. Además afirman que ésta es una vía metabólica presente sólo en salmónidos, no demostrada en otras especies animales. Sin embargo otros investigadores discrepan de lo anterior, indicando que esta vía metabólica también ha sido descrita en pollos y confirman la reducción de astaxantina a zeaxantina, vía β-adonixantina, y cantaxantina a β-caroteno, vía equinenona, en trucha arcoiris y en salmón atlántico (Salmo salar) (Schiedt et al., 1985).
Por otra parte, se ha informado de la transformación de astaxantina a vitaminas A1 y A2 en truchas arcoiris que no recibieron vitamina A en el alimento. En esta transformación, al parecer, no habría participación bacteriana y ocurre en la pared intestinal, lo cual ha sido demostrado por estudios in vitro con cintas y sacos de intestino de trucha arcoiris incubadas con astaxantina tritiada (Storebakken y No, 1992), este proceso sería de baja magnitud y no se lleva a cabo o se reduce significativamente en aquellos peces cuyo requerimiento de vitamina A es satisfecho por la dieta. La transformación de astaxantina a vitamina A se realizaría a través de los siguientes pasos metabólicos: reducción de astaxantina a β-caroteno, conversión de β-caroteno en vitamina A1 y finalmente por deshidrogenación la conversión de vitamina A1 en vitamina A2 (Ando et al., 1988 y Abdulrahman y Kenneth, 1988). También se ha descrito este proceso de transformación, de astaxantina a vitamina A, en ovarios de truchas sexualmente maduras, a través de la deshidrogenación de vitamina A1 a vitamina A2, la cual sería tan rápida, que este metabolito no se detectaría (Storebakken y No. 1992)
La función del hígado de los peces en este proceso de reducción de la astaxantina a vitamina A es incierta, a diferencia de lo que ocurre en los animales de sangre caliente, donde la transformación es preponderantemente hepática (Storebakken, y No, 1992).
Lo que si se ha determinado, con respecto al hígado de los peces, es que éste cumple un papel relevante como reserva de vitamina A (Storebakken et al., 1991a). Además de ser un importante órgano metabólico y excretor de carotenoides y de sus metabolitos (Hardy y Torrissen, 1987).
Esta función hepática ha sido confirmada por los resultados de Torrissen y Ingebrigtsen (1991), quienes midieron la distribución de astaxantina marcada en salmón atlántico. Estos investigadores, junto con confirmar la excresión biliar de metabolitos de astaxantina, plantearon una posible circulación enterohepática y ponen en evidencia la excresión urinaria de metabolitos de la astaxantina.
En este estudio se determinó la presencia de gran cantidad de astaxantina o sus metabolitos en la piel de estos peces, lo que concuerda con lo informado por Storebakken y No (1992), en truchas arcoiris alimentadas con cantaxantina o con astaxantina y con los resultados obtenidos en salmón chum y trucha arcoiris por Torrissen et al. (1989).
Estos altos niveles de metabolitos en la piel de los salmones parecerían indicar que este tejido participa en forma importante en el metabolismo de los carotenoides dietarios.
Se ha demostrado que la cantaxantina se deposita en el músculo blanco de la trucha arcoiris, mientras que en el músculo obscuro no sé ha determinado el depósito de carotenoides. Esto se puede atribuir a una composición desigual de la actomiosina (complejo de actina y miosina que forman la unidad contráctil de la fibra muscular) en los dos tipos de músculos o a diferencias fisiológicas entre ellos (Storebakken y No, 1992).
Henmi et al. (1987) determinaron, a su vez, que en el músculo blanco de salmones coho, keta y chum la astaxantina, cantaxantina y otros carotenoides se localizaron unidos a la actomiosina mediante enlaces débiles e hidrofóbicos. Según un estudio reciente, realizado en salmón coho por Henmi et al. (1991) este enlace no sería específico sólo para la astaxantina y la cantaxantina. Henmi et al. (1991) y Storebakken y No (1992) sugieren que uno de los anillos de la β-ionona del carotenoide, se enlaza a un sector de enlace hidrofóbico, en la superficie de la actomiosina. Los grupos hidroxílicos y cetónicos contribuyen a una mayor estabilización del complejo al formar enlaces de hidrógeno débiles con la actomiosina. Por lo tanto, la astaxantina, que forma dos enlaces de hidrógeno por cada anillo de β-ionona, se combina con más fuerza que otros carotenoides a la actomiosina. Estos investigadores, basándose en la evidencia comentada, plantean, además, que la estabilidad de los enlace de la actomiosina con la zeaxantina y cantaxantina serían similares, en tanto que el enlace con el β-caroteno sería muy inestable.
La intensidad de la pigmentación se relaciona con la cantidad de pigmento retenido en el músculo, la cual varía de acuerdo a factores fisiológicos o dietarios, siendo, el porcentaje de retención informado de 1 a 18% para salmónidos en general (Torrissen et al., 1989) y de 3 a 18% para astaxantina y 2 a 7% para cantaxantina en trucha arcoiris (Storebakken y No, 1992).
Es necesario señalar que para determinar el porcentaje de retención es muy importante conocer con exactitud la ingesta de los alimentos que contienen estos pigmentos. En los peces, dadas las características de cultivo, esto es muy difícil, incluso en condiciones experimentales. Así, por ejemplo, cuando los peces están sobrealimentados, la tasa de retención de los carotenoides se sub-estima. Este problema puede solucionarse al calcular la retención en base a, la cantidad de carotenoides retenidos por unidad de incremento en peso corporal o peso de tejidos u órganos, con la siguiente fórmula:
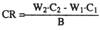
| Donde: | ||
| CR | = | cantidad de carotenoides retenidos. |
| W1y W2 | = | peso promedio inicial y final, respectivamente. |
| C1y C2 | = | concentración inicial y final de carotenoides en el tejido, respectivamente. |
| B | = | incremento en peso. |
Por lo tanto, la retención de pigmentos basada en los carotenoides retenidos de los carotenoides ingeridos podría calcularse si se conocen los requerimientos de alimento para el crecimiento (No y Storebakken, 1991a).
(i) Tamaño de los peces
Se ha determinado que en truchas arcoiris bajo los 80–100 g (Torrissen, 1989) y en salmón atlántico bajo los 200–400 g (Torrissen et al.,1989) los carotenoides se depositan principalmente, en la piel y órganos, y muy poco en el tejido muscular de estos peces, el cual permanece blanco. Torrissen et al.(1989) plantean que este fenómeno está más relacionado con la edad y el estado fisiológico de los peces, que con el peso corporal o la concentración de carotenoides en la dieta. En todo caso, la observación empírica de este hecho, ha llevado a que los salmonicultores comiencen sus programas de pigmentación por sobre los 100 o 150 g en truchas y por sobre los 350 o 400 g en salmones, debido a que una pigmentación previa les significa un gasto innecesario.
Los peces de mayor tamaño, en cambio, presentan una relación lineal entre su peso vivo y la pigmentación muscular, por lo tanto, a mayor peso más eficiente es el de depósito de estos pigmentos en el tejido muscular (Springate, 1991; No y Storebakken, 1991a). Esta mayor eficiencia, en peces inmaduros, significa que un 40 a 60% de los carotenoides retenidos por el pez son almacenados en el tejido muscular (Sinnott, 1989).
También existe una relación entre la velocidad de crecimiento (% de crecimiento) y el depósito de pigmentos en el tejido muscular. Los peces de crecimiento lento o intermedio presentan un rápido incremento en el contenido de carotenoides musculares, en cambio aquellos, con un rápido crecimiento el deposito es más lento por ser la masa muscular a pigmentar mayor (Torrissen, 1989).
(ii) Maduración sexual
Los salmónidos durante la maduración sexual movilizan los carotenoides desde su tejido muscular trasfiriéndolo selectivamente a la piel, en el caso de los machos, y a las gónadas, y en menor proporción a la piel, en el caso de las hembras (Torrisen et al.,1989).
Esta pérdida de carotenoides en el músculo de los peces maduros puede llegar a un 60%, en comparación con su contenido muscular previo (Meyers, 1986), sin embargo, ésta puede ser disminuida con aportes relativamente altos de carotenoides en el alimento durante los meses previos a la época de desove (Storebakken y No, 1992).
La maduración de los salmónidos también se ve acompañada por una disminución en la ingesta de alimentos y una notable alteración en la composición del tejido muscular, lo cual trae como consecuencia un deterioro en la calidad de la carne de estos peces. No obstante, en el caso de la trucha y el salmón atlántico (el salmón coho muere al desovar), una alta proporción de peces desovados se recupera y vuelve a tener una calidad de carne apropiada (Storebakken y No, 1992).
(iii) Factores genéticos
La habilidad de los salmónidos para depositar pigmentos en su musculatura varía tanto entre especies como entre individuos de una misma especie.
La variabilidad entre especies se puede apreciar fácilmente al observar la concentración de carotenoides musculares en salmónidos silvestres. Torrissen et al., (1989) reportan en mg/kg de peso, 1–3 en trucha arcoiris, 3–11 en salmón atlántico y 9–21 en salmón coho. Esta diferencia también se observa en salmónidos de crianza artificial aunque fluctúan en rangos menores (3 a 12 mg/kg; Sinnott, 1989) determinado por la administración artificial de pigmentos.
Al parecer, según lo indicado por Torrissen et al. (1989), la trucha de mar (“steelhead”) es la más eficiente en la retención muscular de carotenoides, seguida por la trucha arcoiris y finalmente el salmón atlántico. Storebakken y No (1992), discrepan con la clasificación anterior, indicando que la trucha arcoiris puede almacenar mayor cantidad de carotenoides a nivel muscular que el salmón atlántico y la trucha de mar, pero menos que el salmón sockeye (Oncorhynchus nerka).
Respecto a la variación dentro de una misma especie se han observado diferencias entre líneas genéticas de truchas arcoiris, salmón atlántico (Sinnott, 1989) y salmón chinook (Oncorhynchus tshawytscha) (McCallum et al., 1987). Springate (1991) plantea a este respecto que la heredabilidad de este carácter es baja y, en consecuencia, al realizar una selección genética hacia este carácter, pasaría mucho tiempo antes que se observaran resultados beneficiosos en la pigmentación.
(i) Lípidos
La cantidad de lípidos en la dieta ha demostrado tener influencia sobre el depósito de pigmentos en el tejido muscular. El coeficiente de digestibilidad, para la astaxantina y la cantaxantina, aumenta con proporciones crecientes de lípidos dietarios y esto origina contenidos más elevados de carotenoides en la carne (Sinnott, 1989 y Storebakken y No, 1992). Aunque no ha sido puesto en evidencia, la rancidez de los lípidos también debería alterar la pigmentación al formar radicales libres que, pueden acelerar la degradación oxidativa de estos pigmentos en el alimento, formando compuestos incoloros.
Además, la incorporación de lípidos de alto punto de fusión (sebos) en la dieta de los salmónidos disminuye la digestibilidad de los carotenoides y por consiguiente, su retención en el tejido muscular (Torrissen, 1985).
Es importante señalar que, las actuales proporciones de lípidos en las dietas comerciales nacionales, para salmónidos, se ubican entre 14 a 16%, un incremento en la concentración de lípidos dietarios, con el fin de elevar la retención de carotenoides pigmentantes, causaría problemas técnicos de manufacturación e indirectamente, podría causar problemas patológicos (Castro, E. 1992; comunicación personal).
(ii) Concentración de carotenoides
El contenido de carotenoides en la dieta, es el factor determinante de la concentración de éstos en el tejido muscular de los salmónidos. No obstante, la tasa de retención de estos pigmentos disminuye al incrementarse el nivel de carotenoides dietarios (Torrissen, 1985). En este sentido, Bjerkeng et al. (1990) han observado que la trucha arcoiris presenta una tasa de retención, tanto para la astaxantina como para la cantaxantina, que disminuye por sobre las 50 ppm de astaxantina dietaria. Según estos investigadores, lo anterior se debería no sólo a la saturación de receptores musculares para los carotenoides (actomiosina), sino que, además la capacidad de absorción y/o transporte de estos pigmentos hacia los tejidos también se vería copada.
Torrissen (1989) descubrió por otra parte, un efecto aditivo entre la astaxantina y la cantaxantina no esterificadas, observando que los mejores resultados de pigmentación muscular se obtenían con un 60% de astaxantina y un 40% de cantaxantina en la dieta. Sin embargo, Christiansen et al. (1991) en un estudio posterior no observaron el efecto sinérgico descrito. Storebakken y No (1992) han señalado que esta discrepancia puede atribuirse, parcialmente, a las diferentes concentraciones dietarias de carotenoides utilizadas en ambas experiencias. En el primer estudio (Torrissen, 1989), se utilizaron concentraciones totales de pigmento en un rango de 165 a 207 mg/kg lo que excede en mucho las concentraciones dietarias óptimas discutidas anteriormente (50 mg/kg), en cambio, en el segundo estudio (Christiansen et al., 1991) las concentraciones dietarias fluctuaron entre 0 y 40 mg/kg. Estos últimos investigadores plantean que el efecto sinérgico observado a altas concentraciones dietarias puede explicarse por la competencia en uno de los siguientes factores: digestión, metabolismo, transporte y excreción.
Existen dos características fundamentales de los pigmentos carotenoides que permiten entender y deducir los roles que ellos pueden llegar a desempeñar. Por una parte, el hecho de ser compuestos orgánicos coloreados (ligado esto estrechamente a la presencia de dobles enlaces conjugados en su estructura molecular), los hace actuar como agentes pigmentantes y, por otro lado, su capacidad reductora les permite desempeñarse, bajo condiciones especificas, como agentes antioxidantes (Torrisen et al., 1989)
Como pigmentantes, en humanos, la cantaxantina y astaxantina se han utilizado en la terapia de la fotosensibilización, por sus propiedades fotoprotectoras, y como bronceador; ya que pueden depositarse en el tejido subcutáneo, dando un color rojo bronceado a la piel (Sinnott, 1990).
En salmónidos, estos carotenoides, por su capacidad pigmentante de la piel, cumplen un rol fundamental en la conducta durante el desove, otorgando a los machos sexualmente maduros su color característico y así atraer a las hembras de su especie (Johnson, 1989).
Respecto a las funciones antioxidantes de los carotenoides en salmonidos, Torrissen et al. (1989) postulan que éstos se desempeñarían como un complemento de la vitamina E, al actuar, a nivel tisular, en lugares de bajas presiones parciales de oxígeno; mientras la vitamina E actúa, eficientemente, en zonas con altas concentraciones de oxígeno.
Esta última hipótesis ha sido comprobada, en parte, por Terao (1989) al demostrar que la astaxantina es mas eficiente que el β-caroteno y la zeaxantina, en retardar la hidroperoxidación del metil linoleato. Con relación a este estudio, Sanderson (1992) plantea que los peces, debido al alto porcentaje de ácidos grasos poliinsaturados que presentan, son más vulnerables a la peroxidación de sus lípidos y a daños fotodinámicos; por lo tanto concluye que, los carotenoides, gracias a su función antioxidante, cumplen un rol protector importante, tanto en peces vivos, protegiendo la salud y los procesos reproductivos, como también, retardando la rancidez de los lípidos en productos almacenados.
Al respecto, Andersen et al., (1991), almacenando, al vacío, a -17°C por 6 meses cortes transversales (“steaks”) de truchas arcoiris de cultivo con un alto contenido de astaxantina muscular (9.3 mg/kg), con “steaks” de salmón silvestre, con un bajo contenido de astaxantina muscular (4.9 mg/kg), demostraron que la mayor concentración muscular del pigmento logró reducir, significativamente, la rancidez de los lípidos en los “steaks”. Este rol protector significó una notable disminución de la concentración de este carotenoide en el tejido muscular.
Con respecto al estudio anterior, se debe resaltar la importancia que tienen los procesos oxidativos en la estabilidad del pigmento durante el almacenaje de truchas y salmones.
Así, es necesario señalar, que los pigmentos carotenoides son muy lábiles a la acción de la luz y a la presencia de oxígeno, en ausencia de estos factores los pigmentos son estables a temperaturas elevadas y por otra parte, a la oxidación lipídica, que al formar radicales libres, acelera la degradación de los carotenoides formando compuestos incoloros.
No y Storebakken (1991b) estudiaron la estabilidad del color en filetes de trucha arcoiris alimentadas con dietas suplementadas con astaxantina y cantaxantina, almacenadas al vacío durante 3 y 6 meses, a-30° y -80°C respectivamente. Una vez finalizado el período de almacenamiento, evaluaron el color de los filetes mediante un colorímetro triestímulo y el sistema CIE L*a*b*, observando: un incremento en la claridad (valor L*), un incremento en la cromaticidad con respecto al rojo (valor a*) y por lo tanto, una disminución en el tono (valor Hab) de los filetes. La caída en la concentración muscular de los carotenoides, en ambos casos, fue sólo de un 5%, no encontrándose diferencias significativas entre la estabilidad de los pigmentos en ambos filetes.
La estabilidad de la pigmentación también se ve afectada por los procesos de cocción y ahumado. Según el estudio realizado por Skrede et al., (1990) en truchas arcoiris, la cocción aumenta la claridad y decrece la cromaticidad con respecto al rojo de la carne, por lo tanto esta carne tiene un tono más amarillento que la carne cruda. En el ahumado, la carne se torna más oscura, decrece la cromaticidad tanto con respecto al rojo como también al amarillo, por lo tanto la carne ahumada tiene un tono más rojizo comparado con la carne cruda.
Se afirma que los carotenoides oxigenados desempeñan un papel muy importante en los procesos reproductivos de los salmónidos, habiéndose estudiado sus efectos sobre la maduración y fertilización de los óvulos, la fotosensibilidad de las ovas y el desarrollo embrionario. Sin embargo, los resultados han sido contradictorios; en cambio, los efectos sobre la maduración de las hembras y viabilidad de las ovas han quedado plenamente demostrados.
(i) Efecto sobre la maduración
Se ha observado que un 64.5% de hembras de trucha arcoiris suplementadas con cantaxantina maduran en la época adecuada en comparación a un 25% de aquéllas no suplementadas. Por otra parte no se presentaron efectos sobre la fertilidad de estas truchas, aunque si se observó que las hembras no suplementadas desovaron ovas levemente más pequeñas que las otras (Choubert, 1986).
(ii) Efecto sobre la calidad de las ovas y sobrevivencia de alevines
Concentraciones de 1 a 3 mg de carotenoides por gr de ovas de salmón, se asocian a porcentajes de eclosión por sobre un 60%; en cambio, bajos niveles de carotenoides se correlacionan con eclosiones por bajo un 50%. Además, ha sido demostrado que la incorporación de astaxantina y cantaxantina en alimento para alevin, mejora su tasa de crecimiento en comparación con alevines alimentados con una mínima cantidad de carotenoides. También se ha observado que la progenie de salmones atlántico privados de carotenoides oxigenados en sus dietas no sobrevivió, a diferencia de otros peces que recibieron carotenoides en los cuales su progenie sí sobrevivió y se desarrolló. En consecuencia, se recomienda una alta concentración de carotenoides en el alimento de reproductores (100 a 400 ppm en la dieta), para incrementar la calidad de sus gametos y de esta forma, aumentar la vitalidad de las ovas y por lo tanto de los alevines obtenidos de ellas (Sanderson, 1992).
Este efecto sobre las ovas y alevines de salmónidos se fundamentaría en el rol antioxidante de estos pigmentos. Karashige et al., (1990), al demostrar que la astaxantina protegía las membranas biológicas de injurias oxidativas, a través de la inhibición de la peroxidación de los lípidos mitocondriales, fundamentó esta acción protectiva antioxidante sobre ovas y alevines.
Mikulin y Soin (1975) por su parte han planteado que este efecto protector se debería a la participación de los carotenoides oxigenados en los procesos respiratorios de las ovas, aumentando así, la viabilidad de éstas.
Además del rol de los carotenoides oxigenados como agentes pigmentantes y antioxidantes se han descrito otras funciones inespecíficas de estos compuestos, entre las cuales se pueden destacar:
(i) Síntesis de vitamina A
Esta síntesis se realiza en el intestino de peces privados de vitamina A dietaria, para satisfacer los requerimientos del pez. Sin embargo, se ha determinado que es poco eficiente la transformación de astaxantina a β-caroteno y por lo tanto a vitamina A (Abdulrahman y Kenneth, 1988).
(ii) Función promotora del crecimiento
Postulada por No y Storebakken (1991a) quienes plantean que en truchas arcoiris, la astaxantina habría demostrado poseer un efecto promotor del crecimiento, debido a una mejor aceptabilidad del alimento o a un eventual efecto fisiológico.
(iii) Determinación del sabor
Josephson et al., (1991) estudiaron e identificaron los componentes del sabor del salmón cocinado y determinaron que algunos de estos componentes son derivados de la astaxantina. Ellos concluyen que los carotenoides parecen ser precursores directos de los componentes del sabor característico del “Salmon-loaf-like” (preparación culinaria hecha en base a salmón enlatado) o modulan reacciones químicas que transforman los ácidos grasos u otros lípidos precursores en los componentes del aroma característico de este plato. Estos resultados indican que los carotenoides presentes en el salmón, serían importantes en la determinación del sabor de estos salmónidos.
La astaxantina en su forma libre, esterificada o formando complejos con proteínas, es el carotenoide más abundante en los crustáceos, siendo estos la fuente natural de pigmentos para los salmónidos silvestres.
Se han realizado numerosos de estudios para evaluar la utilización de los desechos de la industria conservera como fuentes pigmentantes para las empresas salmoneras. Estos esfuerzos han resultado infructuosos porque los desechos presentan un alto contenido de humedad, cenizas y quitina, bajo contenido de proteínas y una baja y variable concentración de pigmento (0 a 200 ppm de astaxantina), lo cual hace imposible su incorporación en dietas balanceadas peletizadas. Por lo tanto, estos desechos de crustáceos no pueden ser empleados directamente en el cultivo comercial de salmónidos (Torrissen et al., 1989)
Harinas y extractos de aceites de crustáceos que contienen carotenoides también han sido investigados con resultados variables, lo cual ha dependido del contenido de pigmento en los desechos y al método con el cual estos pigmentos han sido extraídos. El uso de estas fuentes pigmentantes va a depender de los costos de producción implicados, del nivel y la disponibilidad de la astaxantina presente en ellos. Hay procesos de extracción que producen isómeros y derivados de astaxantina, que no pueden ser absorbidos por los salmónidos. Hasta la fecha el aprovechamiento de estos productos como fuentes de pigmentos para la industria salmonera de cultivo no ha sido posible (Torrissen et al., 1989).
(i) Algas
La utilización de las esporas rupturadas de la microalga Haematococus pluvialis como fuente pigmentante en truchas arcoiris fue reportado por Sommer et al. (1991), obteniendo una pigmentación inferior a la requerida comercialmente, debido al elevado porcentaje de esterificación de la astaxantina presente y a una incompleta ruptura de las esporas de la microalga.
Torrissen et al., (1989) han señalado que las algas del genero Chlorophycea tienen la habilidad de sintetizar gran cantidad de astaxantina, cantaxantina y otros pigmentos bajo condiciones desfavorables (p.ej.: deficiencia de nitrógeno), aunque también reportan la baja utilización de estos pigmentos en los peces debido a que un gran porcentaje de esta astaxantina estaría en forma de ésteres.
También se ha informado que los géneros Chlamidomonas, Chlorococcum, Neochloris y Protosiphon contienen importantes cantidades de carotenoides (hasta 25.000 ppm de astaxantina, principalmente monoésteres) (Markovits, 1991).
Markovits (1991) ha señalado que a pesar que las microalgas son la fuente natural, con el más alto contenido de astaxantina conocido, se han realizado menos intentos de explotación comercial de estos organismos, a causa de un menor grado de desarrollo de las tecnologías de su cultivo en comparación con organismos heterotróficos como las levaduras.
(ii) Plantas
Torrissen et al., (1989) reportaron la utilización en trucha arcoiris de las plantas Hyppophae rhamoides (luteina, zeaxantina, violaxantina, pero principalmente β-carotenos), Tagetes erecta (principalmente luteina) y Cucurbita marcia (zeaxantina y luteina), sin embargo, estos investigadores concluyen que estas plantas tendrían sólo un pequeño potencial de utilización como insumos pigmentantes, en dietas balanceadas de uso comercial.
Por otro lado, no todos los vegetales tendrían bajas perspectivas de utilización. Hannasch y Nélson (1990) al utilizar el extracto saponificado del pimentón rojo o paprika (principalmente capsantina y capsorrubina) como fuentes de pigmentación para trucha arcoiris y salmón atlántico, han demostrado que este extracto tiene el potencial de reemplazar un 50% de la astaxantina utilizada en la formulación de dietas prácticas. Por lo tanto concluyen, que el extracto de paprika se perfila como una buena fuente complementaria de pigmentación para la salmonicultura comercial.
Otra fuente pigmentante con buenas expectativas de utilización son las flores de las plantas del género Adonis, que es el único género del reino vegetal que ha sido reportada como fuente de esteres de astaxantina (Markovits, 1991).
Kamata (1985) por su parte estudió la utilización de extractos y pétalos enteros de Adonis aestivalis como fuente de pigmento para truchas arcoiris. Los extractos de Adonis confirieron un color rosado brillante a la carne de las truchas alimentadas con él, en cambio, en el grupo de peces alimentados con pétalos enteros se encontró una mortalidad del 38% de la población, después del primer mes de ensayo, lo que fue interpretado como resultado de la presencia de glicósidos tóxicos en los pétalos.
(iii) Levaduras
La síntesis de pigmentos carotenoides es una característica de varias especies de levaduras. En general estas levaduras pertenecen a los géneros Rhodotorula sanneii (evaluada sin buenos resultados como insumo pigmentante, en trucha arcoiris, por Savolainen y Gyllemberg, 1970), Rhodosporidium banno, Sporobolomyces kluyver y van niel, Cryptococus y Phaffia rhodozyma. Aunque existen otras levaduras que normalmente no sintetizan pigmentos pero pueden ser inducidas a hacerlo (miller et al., 1976)
La levadura Phaffia rhodozyma (Ph. rh.) pertenece a la familia Cryptococacea que sintetizan, además de pigmentos, β y γ carotenos a partir de la fermentación de azúcares. De los pigmentos que sintetiza esta levadura el 83% a 87% corresponde a astaxantina en forma libre, el resto corresponde a foenicaxantina y otros carotenoides menos importantes (Andrewes et al., 1976). Además esta levadura se caracteriza por poseer una pared celular compuesta principalmente por quitina (N-acetilglucosamina unidas por enlaces β 1–4 glucosídicos, como la celulosa) aunque también se encuentran polisacaridos unidos a proteínas ricas en cistina y lípidos.
Esta levadura fue aislada por primera vez durante los años '70, desde árboles en las montañas de Japón, Alaska y la ex Unión Soviética, por el profesor Herman Phaff de la Universidad de California-Davis (Miller et al., 1976). Estas cepas silvestres podía contener de 30 a 800 ppm de astaxantina en la levadura seca. En la actualidad mediante programas de selección y aislación de cepas mutantes, se ha llegado a concentraciones de 3.000 o más ppm de astaxantina en procesos de fermentación industrial (Johnson, 1989).
Es importante señalar que la cantidad de pigmento sintetizado por la levadura también depende de las condiciones de cultivo como: tiempo, pH, temperatura de incubación y de los medios de cultivo utilizados (fuentes de carbono, fuentes de nitrógeno orgánico, e inorgánico, sales inorgánicas) (Johnson, 1989).
Otra característica importante de esta levadura es su aporte nutritivo, el cual también va a depender, en cierta medida, de la cepa, condiciones y medios de cultivo utilizados. Johnson et al., (1980) indican que en comparación con otras levaduras la Ph. rh. tiene un bajo contenido de proteínas, aunque con un buen balance de aminoácidos esenciales para salmónidos (excepto metionina), un alto contenido de lípidos (con predominio de los ácidos palmítico, oleíco y linoleíco) que incluso podrían promover la absorción intestinal de la astaxantina, y un alto contenido de vitaminas del complejo B, especialmente niacina (1,520 ppm).
Los estudios preliminares de la utilización de esta levadura como insumo pigmentante fueron realizados por Johnson et al., (1980) en truchas arcoiris alimentadas durante 42 días con dietas secas pelletizadas. Estas dietas fueron suplementadas con Ph. rh. entera o con Ph. rh. con su pared celular rupturada por métodos mecánicos, químicos o enzimáticos. De acuerdo a los resultados obtenidos, estos investigadores sugieren que, aparentemente, para un eficiente depósito del pigmento en la trucha se requiere de una disrupción mecánica (mediante homogenización a 10,000 psi, libras por pulgada cuadrada, o moliendo con esferas de vidrio) o enzimática (hidrólisis de la pared celular usando preparados enzimáticos de Bacillus circulans) de la pared celular de la levadura. Así mismo determinaron que métodos químicos como digestión con HCl, a menudo, producen destrucción de los carotenoides y nutrientes, y en consecuencia no sería un método viable de utilizar.
En el estudio anterior se planteaba que la pared celular de la levadura no podría ser rupturada por la actividad enzimática del pez y en consecuencia ni la astaxantina, ni los nutrientes se encontrarían disponibles en la levadura entera. Sin embargo, es necesario señalar que Lindsay (1986) determinó la presencia de quitinaza en el estómago de los salmónidos, la que tal vez podría hidrolizar en alguna proporción la pared celular de la levadura, compuesta principalmente por quitina.
La posibilidad de hidrólisis de la pared celular de la levadura, junto a la corta duración de la experiencia realizada por Johnson et al., (1980) en truchas arcoiris jóvenes (70 g), que tal vez no tengan desarrollada su capacidad quitinolítica, permite plantear la necesidad de realizar más estudios al respecto.
Los pigmentos sintéticos hasta ahora son producidos únicamente por Hoffman La Roche (Basilea. Suiza), quienes comenzaron la producción de cantaxantina en 1964 y sólo recientemente, de astaxantina a nivel comercial. En décadas pasadas la cantaxantina sintética fue el pigmento más usado en el cultivo comercial de salmónidos, sin embargo, en esta última década ha sido reemplazada en forma progresiva por la utilización de astaxantina sintética pero, en general, ambos pigmentos han sido hasta ahora la única fuente disponible y confiable de pigmentos para el cultivo de salmónidos (Torrissen et al., 1989).
Es importante señalar que en la actualidad se ha limitado la utilización de astaxantina sintética en peces cuyo posible mercado sea el norteamericano (no así el mercado europeo o japonés), porque la Agencia de Alimentos y Drogas norteamericana (FDA) ha cuestionado el uso de este pigmento en la alimentación de salmónidos.
Abdulrahman Al-Khalifa, S. and Kenneth, L.S. 1988. Metabolism of astaxanthin in the rainbow trout. Comp. Biochem. Physiol., 91B (3): 563–568.
Andersen, H.J., Bertelsen, G., Christophersen, A.G., Ohlen, A. and Skibsted, L.H. 1991. Development of rancidity in salmonoids steaks during retail display. Zeits. Lebensmittel Untersuchung and Forschung, 191 (2): 119–122.
Ando, S., Osada, K., Hatano, M. and Saneyoshi, M. 1989. Comparison of carotenoids in muscle and ovary from four genera of salmonids fishes. Comp. Biochem. Physiol. 93B (3): 503–508.
Andrewes, A.G., Phaff, H. and Starr, M.P. 1976. Carotenoids of Phaffia rhodozyma, a red-pigmented fermenting yeast. Phytochemistry, 15:1003–1007.
Becerril, M.J. 1989. Pigmentación con luteina o capsantina en pollos de engorda y huevos. Tecnología avipecuaria, 10:6–9.
Bjerkeng, B., Storebakken, Y. and Llaaen-Jensen, S. 1990. Response to carotenoids by rainbow trout in the sea: resorption and metabolism of dietay astaxanthin and canthaxanthin. Aquaculture, 91:153–162.
Calvo, C. 1989. El color en alimentos: medidas intrumentales. Publ. Misc. Agri., 31:17–64.
Choubert, G. et Luquet, P. 1982. Fixation et retention musculaire de la canthaxanthine par la truite arc-en-ciel. Ann Zootech.31 (1): 1–8.
Choubert, G. 1986. Pigments carotenoïdes et reproduction des poissons. Bull. Fr. Pêche. Piscic., 300:25–32
Choubert, G. and Storebakken, T. 1990. Caretenoid digestibility in fish effect to pigment, dose, salinity, feeding rate. Abstr. 9th Int. Symp. Carotenoids, Kyoto, Japan, 20–25 May 1990.
Choubert, G.; Milicua, J.C., Gómez Martinez, R., Sance, R., Petit, H., Negresadarguez, G., Castillo, R. and Triller, J.P. 1991. Transport of cantaxanthin in serum of rainbow trout (Oncorhynchus mykiss Walbaum). Abstr. 4th Int. Symp. Fish Nutrition and Feeding, Biarritz, France, 24–27 June 1991.
Christiansen, R., Torrisen, O.J., Struknaes, G. and Esterman, R. 1991. Flesh color assessments of salmonids. Abstr. 4th Int. Symp. Fish Nutrition and Feeding, Biarritz, France, 24–27 June.
Guillaume, J. 1991. Las bases de la nutrición de los salmonidos. Primeras jornadas sobre nutrición y alimentación de pesces. Santiago, Chile, Mayo 22–23.
Hannasch, K. and Nelson, C. 1990. Efficacy of liquid Kem glo MR bran in the pigmentation of commercial atlantic salmom: Fiel trial in the Bay of Fundy. Pigmenter Research. Bulletin of Kemin Industries Inc.
Hardy, R. W. and Torrisen, O. J. 1987. Carotenoids pigmentation of salmonids. Aquaculture Magazine, 1:8–14.
Hata, M. and Hata, M. 1972. Carotenoid pigments in goldfish — IV. Carotenoid metabolism. Bull. Jpn. Soc. Sci. Fish, 38 (4):331.
Hata, M. and Hata, M. 1973. Studies on astaxanthin formation in some fresh-water fishes. Tohoku J. Agric. Res., 24 (4):192.
Henmi, H., Iwata, T., Hata, M. and Hata, M. 1987. Studies on the carotenoids in the muscle of salmons. Intracellular distribution of carotenoid in the muscle. Tohoku J. Agric. Res., 37:101–111.
Henmi, H., Hata, M. and Takeuchi, M. 1991. Studies on the carotenoids in the muscle of salmon. Bull. Jpn. Soc. Sci. Fish., 56 (11):1825–1829.
Hilton, J. and Slinger, S. 1981. Nutrition and feeding of rainbow trout. Can. Spec. Publ. Fish. Aquat. Sci., 55:15p.
Johnson, E. A. 1989. A pigment source in salmonids feed. Feed Management, 40 (12):18–21.
Johnson, E. A., Villa, T. G. and Lewis, M. J. 1980. Phaffia rhodozyma as an astaxanthin source in salmonid diets. Aquaculture, 20:123–134.
Josephson, D. B., Lindsay, R. C. and Stuiker, D. A. 1981. Volatile carotenoids related oxidation compounds contributing to cooked salmon flavor. Food Sci., Technol., 24:424–432.
Kamata, T. 1985. Study of astaxanthin diester in the flower Adonis aestivalis and its application for the pigmentation of rainbow trout. Tesis para el grado de Ph. D., University of Rhode Island.
Kanemitsu, T. and Aoe, H. 1987. On the studies of the salmons; II. Determination of muscle pigment. Bull. Jpn. Soc. Sci. Fish., 24:555–558.
Karashige, M., Okimasu, E., Masayasu, I. and Utsumi, K. 1990. Inhibition of oxidative injury of biological membranes by astaxanthin. Physiol. Chem. Phys. & Med. NRM, 22:27–38.
Kitahara, T. 1983. Behavior of carotenoid of the Chum salmon (Oncorhynchus keta) during anadromous migration. Comp. Biochem. Physiol. Chem. Phys. & Med. NRM, 22:27–38.
Lindsay, G. J. H. 1986. The significance of chitinolytic enzymes and lysosymes in rainbow trout (Salmo gairdnerii) defense. Aquaculture 51:169–173.
Markovits, A. 1991. Adonis: Potencial fuente vegetal de astaxantina. Alimentos 16 (5):49.
McCallum, I. M., Cheng, K. M. and March, B. E. 1987. Carotenoids pigmentation in two strains of chinook salmon (Oncorhynchus tshawytscha) and their crosses. Aquaculture, 67 (3/4): 291–300.
Méndez, R. 1993. Balance de la salmonicultura en 1992. Aquanoticias Internacional, 16 (5):4–11.
Méndez, R. y Munita, C. 1989. La salmonicultura en Chile. Fundación Chile, 229p.
Meyers, S. 1986. Carotenoids are important to aquaculture industries. Feedstuffs, 29:22–23.
Miki, W., Yamaguchi, K. and Konosu, S. 1982. Comparison of carotenoids in the ovarioes of marine fish and shellfish. Comp. Biochem. Physiol., 71B:7–17.
Mikulin, A. Y. and Soin, S. G. 1975. The funcional significance of carotenoids in the embryonic development of teleost. J. Ichthyol, 15(5):749–751.
Miller, M. W., Yaneyama, M. and Soneda, M. 1976. Phaffla a new yeast genus in the Deuteromycotyna (Blastomycetes). Int. J. Syst. Bacterial, 26:286.
No, H. K. and Storebakken, T. 1991b. Color stability of rainbow trout fillets during frozen storage. J. Food Sci., 56:969–984
Osborne, D. J., Hamilton, P. B. and Burmeister, H. R. 1982. Comparison of ochratoxin, aflatoxin and T-2 toxin for their effects on selected parameters related to digestion and evidence for specific metabolism of carotenoids in chicken. Poultry Sci., 61:1646
Sanderson, G. W. 1992. On the nutritional value of Phaffla yeast as a feed ingredient for salmonid fish and other animals. Literature review preparated for general distribution. Universal Bio-Ventures Lab.
Savoleinen, J. E. and Gyllemberg, H. H. 1970. Feeding of rainbow trout with Rhodotorula sannei preparations. Lebensm-Wiss. Technol., 3:18.
Schiedt, K., Lewenberger, F. J., Vecchi, M. and Gling, E. 1985. Absortion, retention and metabolic transformation of carotenoids in rainbow trout, salmon and chicken. Pure Appl. Chem., 57:685– 692.
Sinnott, R. 1989. Keep them in the pink to stay competitive. Fish Farmer, 12 (5):23–26.
Skrede, G., Storebakken, T. and Naes, T. 1990. Evaluation of color in raw, cooked and smoked flesh of rainbow trout fed astaxanthin or cantahxanthin. J. Food. Sci., 55:1574–1578.
Sommer, T. R., Patts, W. T. and Morrissy, N. M. 1991. Utilization of microalgal astaxanthin by rainbow trout. Aquaculture, 94:79–88.
Springate, J. 1991. Keeping salmon in the pink. Fish farmer, September/October:47
Steven, D.M. 1948. Studies on animal carotenoids. 1. Carotenoids of the brown trout (Salmo trutta linn). J. Exp. Biol., 25:369.
Steffens, W. 1987. Principios fundamentales de la alimentación de los peces. Editorial Acribia, S. A., 275p.
Storebakken, T., No, H. K. and Choubert, G. 1991. Interaction between astaxanthin and vitamin A in atlantic salmon. Abstr. 4th Int. Symp. Fish Nutrition and Feeding, Biarritz, France, 24–27 June.
Storebakken, T., Hung, S. S. O., Calvert, C. C. and Plisetskaya, E. M. 1991. Nutrient partitioning in rainbow trout at differente feeding rates. Aquaculture, 6:191–203.
Storebakken, T. and No, H. K. 1992. Pigmentation of rainbow trout. Aquaculture, 100:209–229.
Terao, J. 1989. Pigmentation of salmonids: factor affecting carotenoids deposition in rainbow trout. Aquaculture, 46:133–142.
Torrisen, O. J. 1985. Pigmentation of salmonids: interaction of astaxanthin and cantaxanthin on pigment deposition in rainbow trout. Aquaculture, 49:363–374.
Torrisen, O. J., Hardy, R. W. and Shearer, K. D. 1989. Pigmentation of salmonids carotenoids deposition and metabolism. CRC. Crit. Rev. Aquat. Sci., 1:209–225.
Torrisen, O. J. and Christiansen, R. 1991. Astaxanthin and cantaxanthin as pigment sources for salmonids. Abstr. 4th Int. Symp. Fish Nutrition and Feeding, Biarritz, France, 24–27 June.
Torrisen, O. J. and Yngebrigtsen, K. 1991. Tissue distribution of 14C-astaxanthin in the atlantic salmon determined by autoradiography. Abstr. 4th Int. Symp. Fish Nutrition and Feeding, Biarritz, France, 24–27 June.