En el departamento de algas se produce el fitoplanctón, alimento de los primeros estadios larvales.
Se producen tres especies :
Una diatomea : Chaetoceros sp. y
Dos flagelados : Isochrysis galbana (T iso) Platymonas suesica
Los encargados de este departamento son un biólogo y un técnico
| Agua | Temperatura | : | 24 ± 3°C sin alta variación |
| Salinidad | : | Optima 30 – 35 ‰ | |
| Filtración | : | l micrón y 0.22 micrones según la fase de cultivo | |
| Cambio | : | Cultivo en volumenes sucesivos sin recambio | |
| Aeración | : | Aire del surpresor, enriquecido con 1% de CO2 | |
| Luz | : | Fluorescentes de 40 W abasteciendo 3 000 lux (area interiores) | |
| Alimentación | : | Nutrientes según la especie y la zona de cultivo | |
Volumenes en sala
- Para todas las especies :
Solución No l
| Na2 EDTA | 45.00 | g |
| H3 BO3 | 33.60 | g |
| Na NO3 (K NO3) | 100.00 | g (116.00 g) |
| Na H2 PO4, 2H2O | 20.00 | g |
| MN Cl2, 4 H2O | 0.36 | g |
| Fe Cl3, 6 H2O | 1.30 | g |
| Solución No2 | 1.00 | ml |
Disolver en un litro de agua destilada
Solución No 2 (Trazas de metales)
| Zn Cl2 | 2.1 g |
| Co Cl2, 6H20 | 2.0 g |
| (NH4) 6 Mo7024, 4H2O | 0.9 g |
| CuSO4, 5H2O | 2.0 g |
Disolver en 100 ml de agua destilada, añadir HCl para obtener una buena disolución.
Solución No 3 (Vitaminas)
| Tiamina (Bl) | 200 mg |
| Cianocobalamina (B12) | 10 mg |
| Biotina (*) (H) | 10 mg |
Disolver en 100 ml de agua destilada.
(*) La vitamina H se utiliza únicamente para los flagelados.
- Para las diatomeas :
Solución No 4
| Sodio metasilicato | 20 g |
Disolver en 1 litro de agua destilada
Solución No 5
| K NO3 | 100 g |
Disolver en 1 litro de agua destilada
A excepción de la solución No3 (vitaminas) todas las soluciones son autoclavadas 30 minutos a 125°C.
Utilizar 1 ml de la solución No1 (+ solución No2), de la solución No4 y de la solución No5 y solamente 0,1 ml de la solución de vitaminas No3 para preparar un litro del medio de cultivo.
- Volumenes exteriores :
| Flagelados | Diatomeas | |
| KNO3 | 4 g | 4 g |
| Difosfato de sodio | 1 g | 1 g |
| Metasilicato | - | 4 g |
Cantidades por 1 m3
- Rotación de los diferentes volumenes :
| 10 ml | tubos de ensayo | 7 días | (cepas madres) |
| 250 ml | frascos | 4 a 11 días | |
| 5 l | frascos | 3 días | |
| 30 l | tanques | 3 días | |
| 300 l | tanques | 3 días | |
| 1 m3 | tanques exteriores | 2 días |
Después de 4 días de crecimiento en los frascos de 250 ml, este volumen pasa a 3 litros ; 4 días ---- 30 litros, así hasta los tanques exteriores de 1 m3 (Chaetoceros, Isochrysis).
En la mañana :
- 8:00 a.m.
Colocar los cartuchos 1 μ en los filtros
Cerrar los circuitos de agua
Sacar una muestra de todos los volumenes (de 5 litros a 1 m3) listos para una transferencia.
El biólogo deberá chequear estas muestras e inscribir sus observaciones en el “Reporte diario”.
Sacar el material estéril de la autoclave para almacenamiento en la sala de preparación.
Chequear la temperatura de la sala y de algunos tanques.
Medir el pH en los 300 litros y apuntar.
CELULA DE MALASSEZ PARA CONTAR
LAS CELULAS DE ALGAS
- 9:30 a.m.
Llenar los diferentes tanques 30 l, 300 l, 1 m3 con el agua de mar filtrada.
Si la temperatura de esta agua es superior a 25°C, llenar los tanques el día anterior para que se enfrie durante la noche.
Siguiendo la hoja “Reporte diario” del biólogo transferir los 300 litros en el l m3, los 30 l en los 300 l y las botellas de 5 l en los de 30 l.
El biólogo practica las transferencias de los volumenes pequeños : tubos de ensayo y fiolas en la sala de cepa.
- 11:00 a.m.
Añadir los nutrientes en los tanques iniciados.
Siguiendo las directivas de los biólogos de larvas pasar las diferentes cantidades necesarias de algas en los tanques de cría larval.
En la tarde :
- 1:00 p.m.
Limpiar muy bien los diferentes tanques vacíos con un detergente especial y con agua dulce caliente.
Preparar las botellas, las fiolas, los tubos de ensayo para el paso por la autoclave.
Preparar el material pequeño : tapones, tubo de vidrio, etc.
- 3:30 p.m.
Limpiar el piso de todos los cuartos con cloro y agua dulce.
Poner en órden el material.
Sacar los cartuchos de los filtros, abrir todos los circuitos de agua salada.
UNA VEZ POR SEMANA PASAR POR CLORO TODA LA TUBERIA (red agua de mar).
NOTA :
Preparación de los medios de cultivo :
- Tubos de ensayo y frascos de 250 ml deben ser esterilizados vacíos y después de haberlos llenado con agua de mar esterilizada con los nutrientes según la fórmula indicada en en el párrafo 2.
TODAS LAS MANIPULACIONES DE MATERIAL ESTERIL SE EFECTUAN CON EL MECHERO DE LADO. CUIDADO, LAS VITAMINAS SON DESTRUIDAS A MAS DE 55°C.
- Se esterilizan las botellas de 5 litros, se llenan con el medio de cultivo, y después, añadir las vitaminas.
- Tanques de 30 l, 300 l y 1 m3, llenarlas con agua filtrada (1 μ + UV), añadir los nutrientes después de la inoculación.
CUIDADO NUNCA MEZCLAR DOS ESPECIES
Identificar siempre los recipientes de cultivo (especie, fecha, origen, etc.).
Los recipientes de cultivo deben estar siempre tapados (excepto para un trabajo).
Evitar al máximo las variaciones de temperatura y dejar las puertas cerradas.
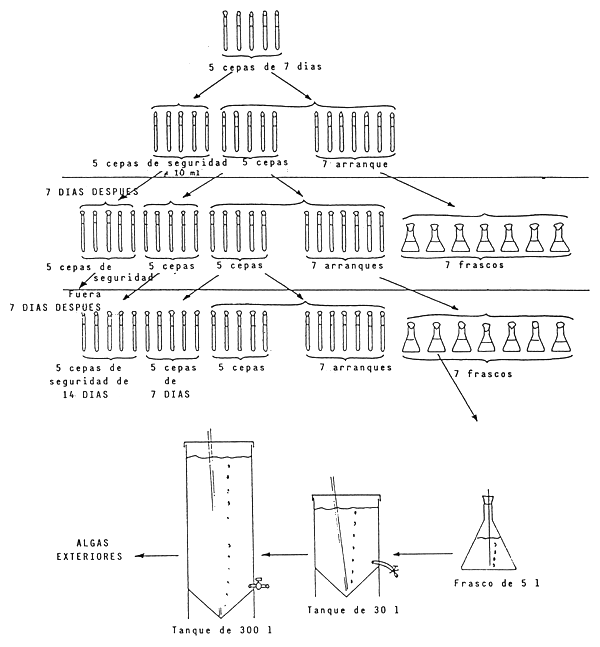
MANTENIMIENTO DE CEPAS Y SECUENCIA DE CULTIVO
Cada tubo tiene ≠ 10 ml de medio de cultivo
≠ 1 ml de inóculo
Cada frasco tiene ≠ 200 ml de medio de cultivo
≠ 11 ml de inóculo
Un tubo de inóculo, 1 o 2 tubos de arranque y 1 tubo de cepa NUNCA MEZCLAR
DEPARTAMENTO DE ALGAS REPORTE DIARIO
Fecha
| E S P E C I E | Tanque No. | Volumen Litros | Cel/ml | O B S E R V A C I O N E S |
El objectivo consiste en producir suficiente cantidad de nauplios de Artemia salina para alimentar las larvas presentes en el laboratorio desde el estadio Mysis I hasta la salida hacia la nursery.
Se ponen los huevos de Artemia salina o “cysts” (forma de resistencia encapsulada). en los tanques de eclosión para obtener los nauplios, este proceso toma de 24 a 35 horas.
Trabajando solamente con los huevos de artemia, sin usar ningún tipo de micropartículas para llevar las larvas de MI hacia PL5, se cuenta aproximadamente : 4 kg de cysts para producir l millón de postlarvas.
| Biomasa | : | Nunca más de 10 g de huevos/litro | |
| Agua | Temperatura | : | 20°– 30°C |
| Salinidad | : | 0 – 40 ‰ | |
| Filtración | : | 5 μ | |
| Cambio de agua | : | No | |
| Aeración | : | Aire del surpresor suficiente para conservar los huevos en suspensión | |
| Luz | : | Natural y oscuridad | |
| Alimentación | : | Nada | |
| Rotación de los tanques | : | ||
El tiempo de eclosión de las artemias depende de la cepa, de una manera general, es posible recuperar los primeros nauplios 24 horas después, se practica otras colectas a 30 y 48 horas. 2 días después se limpia el tanque con cloro y se empieza un nuevo cultivo.
En la mañana :
- 9:00 a.m.
Pescar en los tanques con agua desde hace 48 horas, para eso :
Tapar el tanque y esperar 10 minutos
Los nauplios de artemia son atraídos a la base del cono del tanque por la luz de la cinta transparente, los huevos livianos flotan en la superficie.
Hacer pasar muy despacio los nauplios en una malla de 200 μ y recogerlos en un filtro “casco” (malla de 100 μ). Los desechos quedan en la malla de 200 μ.
Almacenar, si fuera necesario, los nauplios en un tanque de 100 litros.
Llenar con cloro los tanques vacíos.
- 9:30 a.m.
Pescar en los tanques con agua hace 24 horas :
Mismo procedimiento que el anterior.
Cuando todas las artemias son sacadas, rellenar los tanques con agua salada para la prosecución del proceso de eclosión.
- 10:00 a.m.
Vaciar los tanques llenos de cloro y enjuagar bien.
Llenar estos tanques con 300 litros de agua dulce
Poner en estos tanques la cantidad de huevos indicada por el biólogo.
Dejar hidratar estos huevos durante l hora
Completar los tanques con 700 litros de agua de mar (filtrada 5 μ) para obtener una salinidad de 25 % (óptimo para la cepa San Francisco Bay Brine Shrimp).
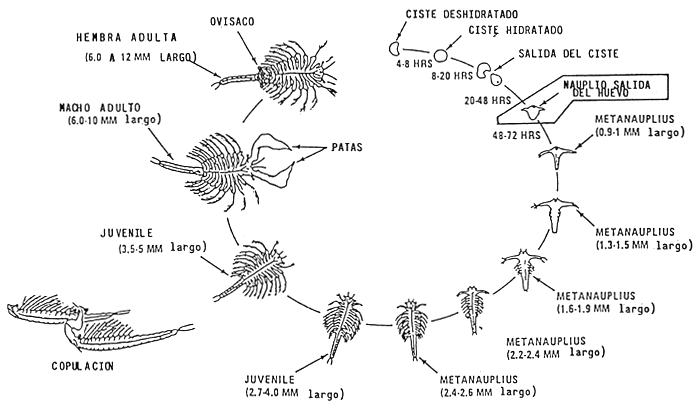
CICLO DE VIDA DEL ARTEMIA
- 10:30 a.m.
Siguiendo las órdenes de los biólogos de larvas distribuir las artemias en los diferentes tanques.
CONSERVAR LAS ARTEMIAS 15 MINUTOS EN UN BALDE DE AGUA DULCE ANTES DE SU DISTRIBUCION A LAS LARVAS.
En la tarde :
- 3:00 p.m.
Pescar una segunda vez en los tanques inciados unas 30 horas antes.
Proceder como en la mañana.
Distribución.
- 4:00 p.m.
Limpiar el piso y todo el material (baldes, filtros) con cloro.
NOTA :
La sala artemia es un área sucia del laboratorio a nivel bacteriológico, entonces las reglas sanitarias aplicadas en el laboratorio deben ser reforzadas en este lugar.
Frente a la variabilidad de la calidad entre las diferentes cepas de artemia y a veces entre los diferentes lotes de una misma cepa, antes de iniciar un cultivo con un nuevo lote, es necesario chequear :
el porcentaje de eclosión
el tiempo de eclosión
En algunos casos es necesario practicar una decapsulación. Técnica para 500 g de artemia :
Hidratar durante l hora los huevos en 10 litros de agua dulce aireada.
Durante este tiempo preparar :
disolver 50 gr de sosa (NaOH) en llitro de agua dulce, poner el frasco en la refrigeradora.
disolver 20 gr de tiosulfato en 6,5 litros de agua dulce.
Después de una hora de hidratación, recuperar los huevos en una malla de 100 μ
Preparar la solución de decapsulación :
8 “berlingots” (envases) de cloro
La solución de sosa
Completar hasta 6,5 litros de agua dulce
Decapsulación :
Poner los huevos en la solución de decapsulación bien aireada
Controlar la temperatura
Esperar 10 a 15 minutos
Enjuagar los huevos en una malla de 100 μ, con el agua de mar.
Poner los huevos en la solución de tiosulfato durante 10 minutos. Cortar la aeración y dejar decantar para sacar a la superficie los huevos vacíos.
Enjuagar los huevos con agua de mar. Están listos para la distribución.
Esta unidad sirve como fase de adaptación y preparación de las postlarvas entre la cría larval y el preengorde.
Además, permite reagrupar tanques diferentes y evitar una multiplicación de los transportes y siembras en las granjas.
El biólogo de cría larval se encarga de este departamento con la ayuda de un técnico.
| Densidad inicial | : | 15–25 PL5 por litro | |
| Agua | Temperatura | : | 24–30°C |
| Salinidad | : | 20–37 ‰ | |
| Filtración | : | No | |
| Cambio | : | 50–75 % por día | |
| Aeración | : | fuerte, continua | |
| Luz | : | natural, reducida por tela de sombra | |
| Alimentación | : | • Nauplio de artemia 1,5 a 2,5 (10) 6 por m2 y por día. | |
| • Micropeletizado 2,5 a 4,5 g/m3/día | |||
| Estas cantidades dependen de la temperatura y de la densidad. | |||
NOTAS :
- Evitar una diferencia de temperatura y/o de salinidad entre tanques de cría larval y de almacenamiento, cuando las PL5 pasan. Luego, una diferencia de 3–4 °C o de 5 ‰ en el mismo día, es posible sin problema.
- Como el agua no está filtrada se obtiene un desarrolo fitoplanctónico natural en el medio de cultivo, lo cual ayuda a la destrucción de la materia orgánica.
La luz está reducida para mantener un crecimiento regular de estas algas.
- 8:00 a.m.
- Medir la temperatura en cada tanque, así como la salinidad y apuntar.
- Sacar una muestra de postlarvas (uno o dos litros) de cada tanque y mandarla a la sala de observación.
Chequear la calidad de las postlarvas como su comportamiento, alimentación, muertas, etc.
Verificar el aspecto y la calidad del agua (turbiedad, restos de artemia, micropeletizados, desechos, etc.).
Llenar la órden de trabajo del día y especialmente duración del cambio de agua, salinidad requerida, alimentación.
- Según la órden, se practica los cambios de agua en una malla de 500 micrones, haciendo una circulación a nivel bajo.
Verificar la salinidad y temperatura del agua.
- 10:00 a.m.
Empieza la distribución de alimentos, con la primera distribución de nauplios de artemia (a nivel bajo, estando la circulación terminada). Aproximadamente 40 % del total del día.
Llenar los nuevos tanques - después de limpiarlos con agua dulce, jabón y cloro - con agua de la misma salinidad que la del tanque de cría larval de donde salen las PL 5.
Medir la temperatura del agua, y prever la aclimatización de las PL 5.
Inocular con algas exteriores para iniciar el desarrollo fitoplanctónico.
- 12:00 p.m.
Segunda distribución de nauplios de artemia
- 4:00 p.m.
Limpiar con cloro y enjuagar con agua dulce todo el material pequeño. Ponerlo en órden.
- 6:00 p.m.
Tercera distribución de nauplios de artemia
Durante la noche, empezando a las 9:00 p.m., y cada 3 horas, se hace una distribución de micropeletizados. Para lo cual, pesar la cantidad indicada en la órden de trabajo, ponerla en agua, y mezclar durante unos minutos para homogeneizar bien y separar las partículas. Repartir en todo el tanque.
La cría de animales terrestres o acuáticos a alta densidad ocasiona obligatoriamente problemas de órden patológico, aún cuando las condiciones optimas de cría están reunidas : calidad del medio, infraestructura, etc.
Las bacterias, los hongos y los virus son los agentes patógenos más frecuentes en los laboratorios de camarón.
En este capítulo vamos a describir las medidas sanitarias generales de lucha contra estas diferentes enfermedades sin olvidar que una adaptación es necesaria a las condiciones ambientales de cada proyecto.
- Necrosis externas :
El ataque bacteriano se manifiesta en la larva por una necrosis visible al microscopio.
Las necrosis empiezan muchas veces en una antena o un apéndice nuevamente formado como los uropodos de una zoea III o los pleopodos de una mysis. Las necrosis empiezan en la punta del apéndice el cual se vuelve castaño y progresan hasta la base.
En este caso se encuentra larvas débiles y muertas, muchas veces listas a mudar el viejo caparazón pegado al apéndice necrosado.
- Necrosis interna :
Esta enfermedad está relacionada con las necrosis externas y aparece especialmente cuando el laboratorio ha funcionado durante tiempo con estas necrosis externas.
Estas bacterias atacan el sistema digestivo de la larva, empezando por la boca antes de llegar al hepatopáncreas y al estómago : “estómago gris”. En tal caso las larvas dejan de comer.
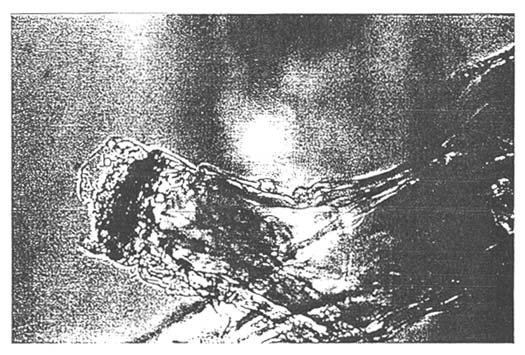
NECROSIS INTERNA
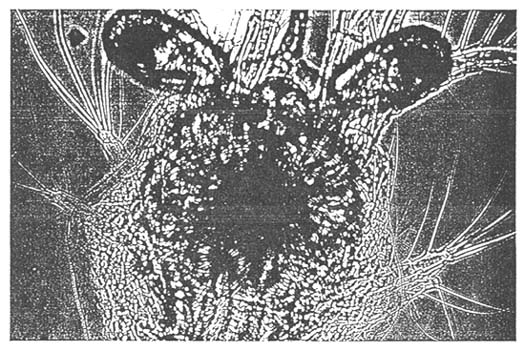
ESTOMAGO NEGRO

NECROSIS EXTERNA
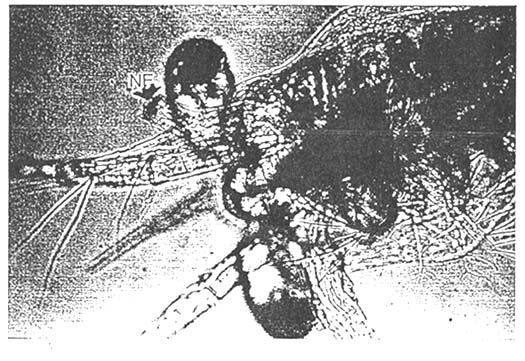
ATAQUE DE UN APENDICE
El ataque es más serio si empieza en las larvas jóvenes, en zoea I el tanque completo es destruido en 24 horas. Si las necrosis empiezan en zoea III, una parte alcanza mysis y la mortalidad dura algunos días. Las postlarvas parecen más resistentes a esta enfermedad.
- Estómago negro :
Esta enfermedad es nutricional, y está relacionada con el uso de las algas Chaetoceros. Se puede observar un conglomerado negro en el estómago.
Lo cual ocurre, cuando :
El bloom de chaetoceros se encuentra en una fase decreciente.
La densidad de chaetoceros es bastante elevada.
En este caso, controlar la calidad del cultivo de algas y su desarrollo en los tanques de cría larval. Cambiar el agua y añadir nuevas algas.
10.1.1. PROFILAXIA
10.1.1.1. Concepción del laboratorio
a) Los planos
Los diferentes departamentos del laboratorio están aislados con paredes y coladores para evitar el paso de las cepas patógenas que tienen un alto poder de contaminación.
Por ejemplo los tanques de cría larval están aislados, de dos en dos, en una cámara cerrada con bloques. Eso permite en caso de problemas de limpiar y cerrar la cámara afectada para evitar la propagación a toda la cría.
El laboratorio está abierto al exterior para asegurar un buen movimiento del aire y evitar la acumulación de aerosoles patógenos.
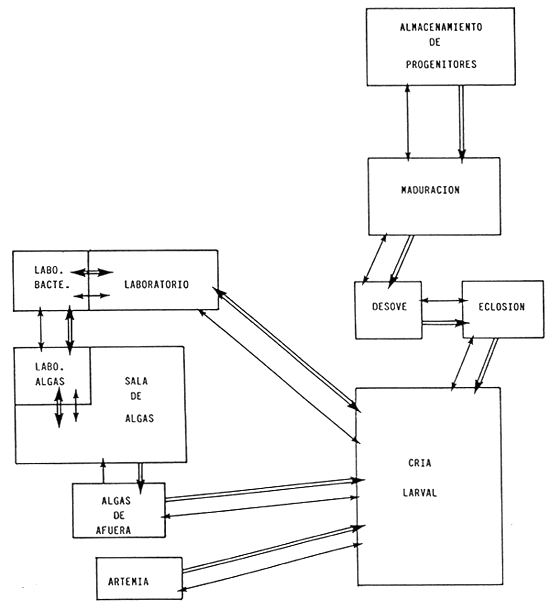
ESQUEMA DE COMUNICACION ENTRE LAS UNIDADES DE TRABAJO
Los únicos movimientos autorizados están indicados por las flechas :
Personal → y material o productos ⇒, y deben limitarse al mínimo necesario.
Cada zona entre dos unidades de trabajo debe considerarse como una esclusa sanitaria.
b) La filtración
El agua de mar, (primera fuente para la introducción de organismos patógenos) pasa por un filtro de arena (20 μ) y un filtro de cartuchos (5 μ), además en la sala de algas, el agua pasa por un filtro de 1 μ y un filtro U.V.
c) Las redes
Las redes en todo el laboratorio estár deben instaladas de manera que los tubos puedan vaciarse cada vez que se terminen las operaciones diaria. Así, es posible evitar la acumulación de “aguas muertas” y la proliferación de gérmenes patógenos.
10.1.1.2. Los tratamientos
Dos antibióticos : Furazolidon y Cloranfenicol son utilizados de dos maneras :
- Preventivo : Para evitar la propagación de gérmenes y la aparición de enfermedades. Para eso, es necesario, eliminar las bacterias patógenas del agua sin tocar las larvas.
- Curativo : para curar los animales que padecen enfermedades, en este caso el antibiótico hace efecto en las necrosis celulares.
Dosis de tratamiento preventivo :
| Día | Estadio | Furazolidon | Cloranfenicol |
| 1 | N | ||
| 2 | N | ||
| 3 | Z1 | 0,2 g/m3 | 3 g/m3 |
| 4 | Z1 | ||
| 5 | Z2 | ||
| 6 | Z3 | ||
| 7 | Z3/M1 | 0,4 g/m3 | 5 g/m3 |
| 8 | M1 | ||
| 9 | M2 | ||
| 10 | M3 | ||
| 11 | M3/P1 | 0,5 g/m3 | 5 g/m3 |
| 12 | P1 | ||
| 13 | P2 | ||
| 14 | P3 | ||
| 15 | P4 |
* Furazolidon : El antibiótico se vierte después de la circulación, cuando el tanque está lleno.
* Cloranfenicol: El antibiótico se vierte después de la circulación, cuando el nivel del agua está bajo.
Dosis del tratamiento curativo :
Se practica en dos días :
Primer día : misma dosis que un tratamiento preventivo.
Segundo día :
| Estadio | Furazolidon | Cloranfenicol |
| Z2 | 0,4 g/m3 | 5 g/m3 |
| Z3 | 0,5 g/m3 | 6 g/m3 |
| M | 0,6 g/m3 | 8 g/m3 |
| PL | 0,7 g/m3 | 8 g/m3 |
El tratamiento preventivo se usa como rutina durante todo el año, pero el tratamiento curativo se practica únicamente en caso de problemas graves en un tanque y de una manera puntual.
10.1.1.3. Los ciclos de producción
Esquema teórico de producción por ciclo :

Furazolidon : 60 días
Cloranfenicol : 22 días
Vacío sanitario : 8 días
Este esquema de base varía según la época del año y son los resultados de los antibiogramas quienes deciden siempre el cambio de antibióticos y el día del vacío sanitario. Nunca hay que esperar más de 2–3 días antes de tomar una decisión. La lectura de un antibiograma consistente precede la aparición de las necrosis en 50% de los tanques de una semana. Este plazo da un margen de tiempo para preparar la estrategia a seguir.
Esquema al año :
Número de ciclo anual : 4
Número de vacíos sanitarios :
3 de 1 semana
1 de 2 semanas
Número de cría/tanque/ciclo (promedio) : 4
10.1.1.4. Los vacíos sanitarios
Los vacíos sanitarios de una semana corresponden a un vacío parcial de :
1 unidad de larvas
1 sala de maduración
1 sala de desove
1 sala de eclosión
1 sala de cultivo de algas (30 l y 300 l).
El vacío sanitario de dos semanas, una vez al año, corresponde a un vacío total del laboratorio, excepto de la sala de cepas de algas.
Procedimiento :
Día 1 :
LLenar todos los tanques y volumenes que deben ser limpiados con agua de mar y cloro.
Bañar todo el material en estos tanques clorados.
Echar cloro en el piso y las paredes.
Filtros 20 μ y 5 μ en el cloro (para la parte concerniente).
Botar los cartuchos viejos.
Día 2 :
Vaciado general : tanques, redes, filtros.
Inyectar aire en las redes.
Enjuagar y sacar el material pequeño.
Desmontar y limpiar las válvulas.
Condenar los accesos.
Días 3–4–5–6 :
Nadie debe entrar en las áreas secas.
Día 7 :
Instalar las válvulas.
Instalar los filtros con cartuchos nuevos.
Día 8 :
Primer día de cría (nauplios).
10.1.1.5. Prevención rutinaria
Un rigor diario en el trabajo es la mejor manera de evitar problemas patológicos. Los principales factores de contaminación son en total cuatro : el agua, el personal, el material, y la alimentación.
a) El agua :
- Chequear diariamente que los filtros (20 μ y 5 μ) funcionan normalmente. Hacer un control bacteriológico una vez por semana.
- Diariamente limpiar los filtros de arena, utilizando la posición “backwash” de la válvula. Una vez por semana, abrir la tapa y durante la operación de “backwash” agitar la arena para eliminar los posos.
- A fines del día, vaciar y abrir los filtros 5 μ. Cada filtro tiene dos juegos de cartuchos : uno en el cloro y el otro trabajando (limpiar los cartuchos clorados con agua dulce antes de usarlos). Alternar cada 2 días. Hacer lo mismo con los filtros de la sala de algas.
- Después de usarlos, vaciar los tubos PVC de la red de agua y poner aire en estas tuberías.
b) El personal :
- El personal afectado a un departamento debe quedarse en este departamento. Evitar a lo máximo los intercambios.
- Usar el lavapies.
- Hay que recordar que la sala de maduración y la sala de artemia son dos salas “cargadas” en bacterias.
- Solamente el personal “algas” puede entrar en este departamento y el biólogo encargado es el único que puede entrar en la sala de cepas.
c) El material :
MUY IMPORTANTE : Cada objeto tiene una función específica en cada departamento.
d) La alimentación :
- Algas : Todas las manipulaciones de transferencia de tanque a tanque deben hacerse con un máximo de precaución y de limpieza.
- Artemia : Para destruir las bacterias patógenas,
“CONSERVAR LAS ARTEMIAS 15 MINUTOS EN UN BALDE DE AGUA DULCE ANTES DE LA DISTRIBUCION A LAS LARVAS”.
Hacer un control bacteriólogico dos veces por semana.
10.1.2. METODOLOGIA DE BACTERIOLOGIA ADAPTADA
10.1.2.1. Los medios
a) Bactopeptona (Difco 0118–01)
Preparación :
Conformarse a las cantidades indicadas en la caja.
Esterilizar
Se usa en fase líquida (sin agar) para probar la calided bacteriológica de las algas. Poner 1 ml del medio que hay que estudiar en un tubo de ensayo con 5 ml de bactopeptona, si se pone turbio, descartar estas algas.
b) Marine Broth (MB 2216) (Difco 0791–01)
Preparación :
Se usa para hacer cuentas de la totalidad de la población bacteriana y para las pruebas de sensibilidad de los antibióticos (antibiogramas).
c) TCBS agar (Difco 0650–01)
Preparación :
Disolver el polvo en agua destilada (seguir instrucciones de la caja)
Este medio permite el aislamiento específico de las bacterias tipo Vibrio.
10.1.2.2. Técnica de muestreo y de siembra
• TRABAJAR SIEMPRE DE MANERA ESTERIL CERCA DEL MECHERO
• TODO EL MATERIAL DEBE SER ESTERILIZADO DURANTE 1 HORA (AUTOCLAVE 120°C)
La técnica de muestreo cambia según el medio por estudiar : agua, aire, animales.
a) Agua
La técnica está en función de la concentración de bacterias del medio por estudiar.
- Concentración baja : concentrar en un filtro 0,22 μ (Gelman) 10 ml del medio y poner el papel filtro en la caja de Petri (ejemplo : agua de las redes).
- Concentración media : exponer 0,2 ml del medio por estudiar en la caja de Petri según el dibujo más indicado (ejemplo : agua de la cría larval).
- Concentración alta : practicar una dilución del medio, 1 ml en un tubo de ensayo de 9 ml de agua estéril y repetir : dilución (10)-1, (10)-2, (10)-3, etc. Exponer 0,2 ml del medio por estudiar en la caja de Petri.
b) Aire
Para probar la concentración en aerosoles de una sala, abrir 30 minutos una caja de Petri. Lectura 24 horas después.
c) Larvas (camarones, artemia)
- Sacar los animales (10)
- Molerlos con una varilla de vidrio al interior de un tubo de ensayo con 10 ml de agua de mar esterilizada.
- Sacar 0,2 ml de la mezcla y exponerlo en una caja de Petri.
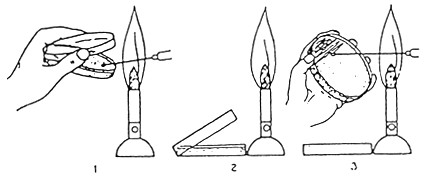
TECNICA DE SIEMBRA DE UNA CAJA DE PETRI
* La numeración de las colonias bacterianas se practica 24 después.
10.1.2.3. Técnica antibiograma
a) Preparación :
- Sacar de la caja de Petri de 24 horas una colonia bien individualizada.
- Poner esta muestra dentro de un tubo con 5 ml de agua de mar estéril.
- Agitar ligeramente y esperar 10 minutos
- Practicar lo mismo con cada tipo de colonias (clasificarlas).
- Vaciar cada tubo dentro de una caja de Petri (medio Marine Broth, MB).
- Esperar 15 minutos y sacar el exceso de líquido con una pipeta.
- Disponer los discos antibióticos (Furazolidon, cloranfenicol, y otros si fuera necesario).
- Dejar 24 horas a la temperatura ambiente.
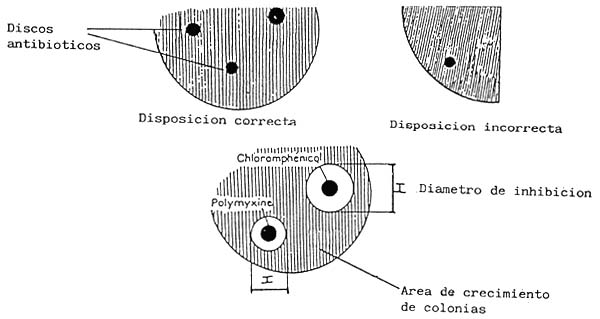
b) La lectura
La lectura se hace midiendo el diámetro de la zona de inhibición.
- Cepa sensible : es una cepa que puede ser destruida con un tratamiento a dosis habitual. I>D.
- Cepa intermediaria : es una cepa afectada con un tratamiento a dosis elevada (tipo tratamiento curativo). d < I < D.
- Cepa resistente : Esta cepa no puede ser controlada con un tratamiento antibiótico. I <d. En este caso, cambiar de antibiótico, si es posible, sino preparar un vacío sanitario.
| D (mm) | d (mm) | |
| Furazolidon | 17 | 14 |
| Cloranfenicol | 23 | 19 |
Las larvas atacadas se vuelven blanquecinas. Una observación microscópica permite detectar el mycelium, conocemos dos géneros : Lagenidium y Fusarium.
No hay tratamiento. Si solamente algunas larvas son atacadas, practicar un cambio completo de agua de cría. Pescar las larvas, eliminar las muertas y las débiles, después, limpiar todo el material utilizado en la manipulación con cloro. Empezar nuevamente la cría en agua limpia.
Si todo está contaminado, la única solución es de añadir 50 ppm de cloro en el agua y botar el tanque.
Para el tratamïneto preventivo se usa el Treflan, un fungicida capaz de inhibir la germinación de las esporas. La dosis a utilizar se encuentra en la hoja teórica de cría.
HONGOS : LAGENIDIUM CALLINECTES
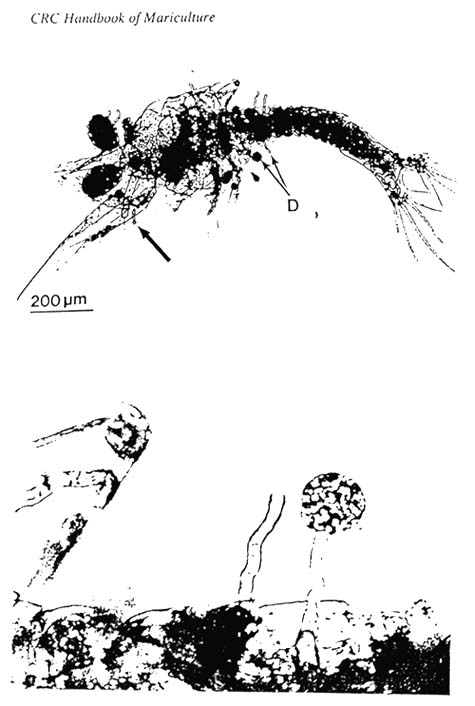
(Foto C.E. Bland, East Carolina University, Greenville, N.C.)
Las informaciones sobre los virus son muy restringidas. Varios tipos de virus fueron identificados en las diferentes especies de camarones Peneides. La mayoría de estos virus son específicos de cada especie y son realmente patógenos durante los estadios larvales. Los adultos son los únicos vectores de la enfermedad.
Cuadro de los diferentes virus conocidos y sus huéspedes :
| Virus | Huésped | Area Geográfica | |
| • | Baculovirus penai (BP) | P. duorarum | Florida, Misisipí |
| P. aztecus | |||
| P. setifeus | |||
| P. vannamei | Panamá, Costa Rica | ||
| P. stylirostris | Ecuador | ||
| • | Monodon baculovirus (MBV) | P. monodon | Filipinas, Taiwan |
| • | Baculoviral midgut gland necrosis virus (BMNV) | P. japonicus | Japón del Sur |
| • | Infectious hypodermal y hematopoietic necrosis virus (lHHNV) | P. stylirostris P. monodon | Hawai Guam |
Dos tipos de virus conciernen al P. vannamei y al P. stylirostris.
10.3.1. Baculovirus penaei (BP)
Aunque este virus fue observado en el P. stylirostris la experiencia demuestra que el Baculovirus (BP) tiene realmente influencia en el P. vannamei durante sus estadios larvales.
El ataque se caracteriza por una mortalidad masiva y repentina durante cualquier estadio larval.
VIRUS : BACULOVIRUS PENAEI (BP)
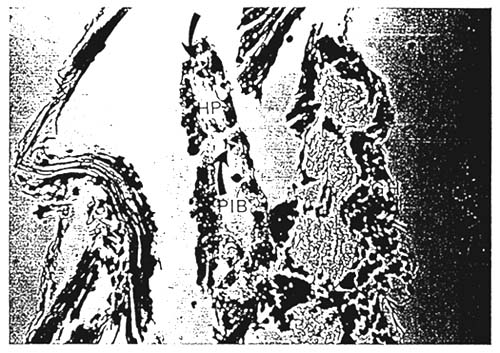
HP : Hepatopanceras
PIB : Intranuclear polyhedral bodies

Este virus infecta las células epiteliales del hepapáncreas y del tubo digestivo, apareciendo unos cuerpos de inclusión tetraédrico (ver foto) muy fácil de detectar con el microscopio. Para lo cual aplastar entre una placa y la lama cubreobjeto una larva y observar la parte del hepatopáncreas (amplificación 40).
En dos días la mortalidad de un tanque de cría es total, la contaminación de una cría a otra es “galopante”.
Se tiene casi establecido que el virus afecta las larvas solamente cuando las condiciones de cría son desfavorables o con mucho “stress” :
Resistencia a los antibióticos.
Mala calidad del alimento (algas o artemia).
Importantes variaciones fisicoquímicos del medio de cría.
Contaminación (hidrocarburos, etc.).
10.3.2. INFECTIOUS HYPODERMAL Y HEMATOPOIETIC NECROSIS (IHHN)
Este virus afecta exclusivamente al P. stylirostris al estadio juvenil de 0,05 hasta l gramo. Se presenta como pequeñas partículas cúbicas y simétricas (16–18 nm).
10.3.3. PROFILAXIA
No existe un tratamiento conocido.
Un laboratorio funcionando normalmente sin ningún factor de “stress” no debe ser afectado por el virus (B.P.). Existen dos tipos de contaminación :
10.3.3.1. Contaminación horizontal
Cuando los primeros cuerpos de inclusión triángulos, son observados, añadir sosa (NaOH) en el tanque para subir el pH del agua de cría hasta ll. Solamente la sosa es capaz de destruir los cuerpos de inclusión, el cloro no tiene ningún poder sobre el B.P. Todo el material en contacto con el agua de cría debe sufrir este mismo tratamiento.
En caso de un ataque viral la separación en camarillas es primordial evitando asi una contaminación completa en el laboratorio. Pero, si después de ciertos errores de manipulación, algunas crías fueran afectadas, sería en vano luchar, sólo un vacío sanitario total y riguroso podría erradicar la contaminación.
Durante este vacío sanitario parcial (en camarilla) o total regar las paredes y el suelo con una solución de sosa, en efecto los cuerpos de inclusión pueden resistir varios meses fuera del agua y volver a tomar ventaja de las condiciones propicias.
10.3.3.2. Contaminación vertical
Es muy importante poder individualizar los lotes de genitores a fin de destruir los adultos portadores cuando el virus es detectado en las larvas.
Estudios, en curso de serología, podran posiblemente permitir la identificación de estos adultos portadores, con un test simple.
Por último, la cría de genitores en ciclo cerrado permite trabajar solamente con los animales libres de virus.