L'extrait des glandes pituitaires est utilisé dans la reproduction artificielle de différentes espèces de poissons d'élevage, pour provoquer l'ovulation ou la reproduction induite.
Pratiquement, la glande pituitaire de tout poisson sexuellement mûr peut être utilisée aux fins de reproduction induite, en supposant que le poissondonneur soit au stade de pré-reproduction, et suffisamment gros (au-delà de 1 Kg) de manière que la glande puisse être extraite facilement.
Dans la plupart des cas, on utilise la glande pituitaire de Carpe pour les raisons suivantes :
Aux Etats-Unis d'Amérique et au Canada, les glandes pituitaires des Saumons du Pacifique sont le plus souvent extraites, du fait que ces derniers se capturent en abondance lors de leur migration de la mer vers les rivières qui sont leurs frayères naturelles.
Les hypophyses de Carpe argentée, Carpe à grosse tête et Carpe herbivore sont habituellement extraites, spécialement dans les régions à climat chaud, où ces poissons deviennent sexuellement mûrs à l'âge de 3–4 ans. Les hypophyses des Carpes Indiennes principales sont fréquemment utilisées aux Indes (Catla, Rohu, Mrigal).
La Carpe commune fournit l'hypophyse de meilleure qualité, juste avant le début de la saison de reproduction, quand le développement des gonades est parvenu au stade de l'oeuf dormant.
Quand le poisson se reproduit naturellement, il utilise le contenu hormonal de sa propre glande pituitaire. A ce moment, la glande s'est pratiquement vidée d'hormones gonadotropiques et il ne servirait à rien de l'extraire. Mais la Carpe commune reconstitue rapidement le contenu hormonal de sa glande, particulièrement en climat chaud : 2–3 mois après la reproduction, le contenu hormonal de sa glande pituitaire s'est à nouveau reconstitué.
La glande pituitaire est localisée sous le cerveau moyen (hypothalamus) avec lequel elle est reliée par un délicat conduit appelé infundibulum. Quand le cerveau de la Carpe est enlevé, ce conduit se rompt et la glande reste fixée à la base du crâne, enrobée de tissu adipeux (le cerveau entier est également enrobé de tissu adipeux).
Pour l'extraction, la calotte du crâne doit être enlevée. A l'aide d'une tarière électrique, une partie circulaire de l'os cranien est enlevée, ainsi que le cerveau et la glande.
A défaut d'électricité, l'os cranien du poisson est enlevé en se servant d'une soie à métaux, ou tranché à l'aide d'un couteau affilé.
Quand la cavité cervicale est ouverte, le cerveau doit être écarté en le soulevant vers l'avant pour parvenir à la glande et la dégager. A l'aide de fines pinces, la glande est dégagée délicatement du tissu adipeux, et extraite facilement sans l'endommager.
La glande peut être utilisée fraîche pour préparer l'extrait d'hormones, ou conservée en surgélateur, pour être utilisée ultérieurement. Sinon, la glande peut être conservée sous forme sèche, pendant plusieurs années.
Technique de conservation
La graisse et l'eau contenues dans les glandes fraîches sont à éliminer à l'aide d'acétone pure (exempte de graisse). Quelques auteurs préconisent pour ce faire, l'utilisation de l'alcool pur (ethyl - alcool, sans aucune eau).
Les hormones gonadotropiques sont solubles dans l'eau : de ce fait il est essentiel de procéder à un travail très précis et délicat dans l'extraction (élimination) de la graisse et de l'eau contenues dans les glandes.
Avant tout, il s'agit d'enlever avec précaution les tissus adipeux et autres entourant la glande, sans la casser ou l'endommager. Immédiatement après cela, la glande est mise dans une solution d'acétone concentrée, sans graisse.
Pour des raisons bien évidentes, le poisson doit être tué avant de procéder à l'ablation de l'os cranien. Le plus commode est de transpercer le coeur. Si le poisson est tué en le frappant au crâne avec un objet lourd, le cerveau sera inondé de sang, ce qui rend l'extraction de la glande beaucoup plus difficile.
En pratique on enlève en une fois, le plus possible de glandes pituitaires, selon la quantité disponible de poissons-donneurs.
Dès que l'extraction des glandes est terminée, l'acétone dans laquelle les hypophyses baignaient doit être évacuée et remplacée par une nouvelle solution mélangée aux glandes.
Le renouvellement de l'acétone est à répéter 2 fois, à 8–10 heures d'intervalle. Après 24–30 heures, la dernière solution d'acétone est enlevée et les glandes sont dispersées sur une assiette plate. Quand l'acétone est totalement évaporée, ce qui est fait en l'espace de quelques minutes, et que son odeur n'est plus perceptible, les glandes sont mises dans un flacon et maintenues pressées au fond par un tampon d'ouate (coton) ; le flacon est bien fermé hermétiquement par un bouchon. Le flacon peut être scellé (étanche) à l'aide de cire d'abeille ou de cire de bougie, de manière à interdire toute moisissure des glandes.
Les glandes séchées à l'acétone selon cette technique peuvent être consrvées pendant plusieurs années, sans rien perdre de leur contenu hormonal.
ILLUSTRATIONS COMMENTEES
SUR LE COURS DE FORMATION
“REPRODUCTION ET ALEVINAGE DE CARPE COMMUNE”
| Dr ELEK WOYNAROVICH 1980 |
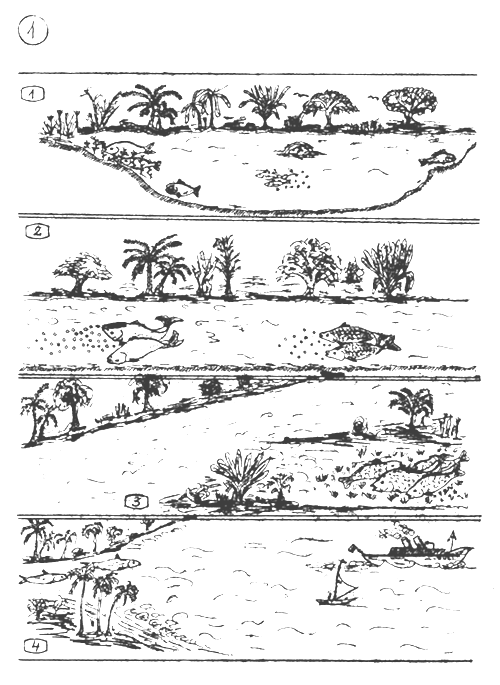
L'environnement naturel de reproduction des différentes espèces de poissons.
Poissons qui se reproduisent en eaux fermées (lacs, étangs, etc…), y trouvant leur zone frayère adéquate. Bon nombre d'entre eux pratiquent une protection parentale, particulièrement en régions tropicales et sub-tropicales, du fait de l'existence de beaucoup d'espèces de prédateurs.
Poissons qui se reproduisent en rivières. Les oeufs pélagiques éparpillés, flottent et roulent dans le tumulte des courants qui les dérivent vers les zones calmes de l'aval où ils éclosent. Les larves et jeunes alevins se développent dans les eaux peu profondes se situant en bordure des rivières, ou dans les zones avoisinantes inondées.
Poissons qui se reproduisent en zones herbeuses fraîchement inondées par les rivières ou les lacs en crue. Ils abandonnent leurs oeufs sur place. Les larves et alevins se nourrissent des organismes animaux qui se développent abondamment sur les herbes pourrissant dans l'eau. Au début de la reproduction, ce milieu n'est pas encore infesté de trop nombreux prédateurs (oeufs et larves).
Poissons qui vivent en eaux douces où ils croissent jusqu'à maturité, et migrent en mer pour s'y reproduire. Le jeune frai et alevins de ces espèces regagnent les rivières ainsi que les lacs (et lagunes) connexes.
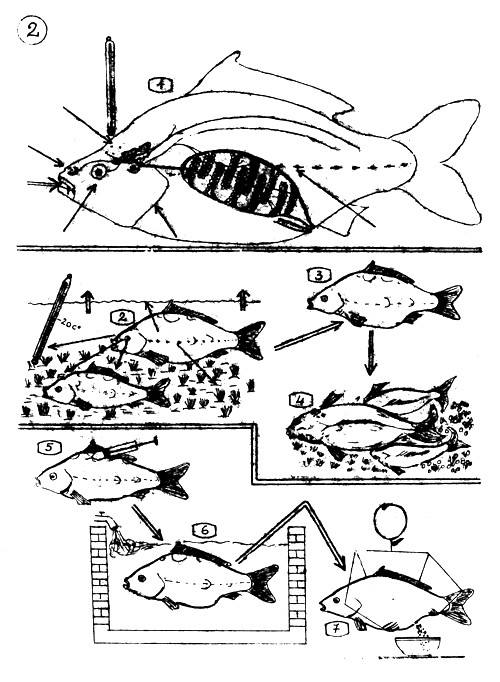
La reproductíon naturelle et l'ovulation induite de la Carpe commune.
Organes sensoriels, cerveau, glande pituitaire, ovaire, qui jouent le rôle principal dans le processus de la reproduction naturelle. L'ovaire “informe” le cerveau que les oeufs sont matériellement prêts pour leur développement final.
Les organes sensoriels “informent” le cerveau que les conditions de l'environnement favorables à la reproduction, sont réunies. Le cerveau (Hypothalamus) donne l'ordre à la glande pituitaire de libérer ses hormones gonadotropiques.
La Carpe femelle se retire vers la zone frayère, tandis que les hormones stimulent et déclenchent la pré-ovulation et l'ovulation, sans interruption (maturation finale).
Quand l'ovulation s'accomplit (oeufs mûrs tombant dans la cavité ovarienne), la Carpe femelle apparaît soudainement dans la zone de frai où les mâles sont déjà en attente et elle commence à éjecter ses oeufs.
5–7. Ovulation induite.
Les géniteurs de Carpe sont injectés de doses adéquates d'extrait hypophysaire (glande pituitaire) qui contient suffisamment d'hormones gonadotropiques pour déclencher l'ovulation et la production de sperme.
Les géniteurs sont gardés en bassins (sexes séparés) où l'on maintient des conditions d'environnement appropriées : calme, apport en oxygène, etc… L'ovulation s'accomplit dans ces bassins (papille génitale des femelles suturée.).
Les oeufs mûrs sont extraits des femelles et fertilisés artificiellement avec le sperme des mâles.
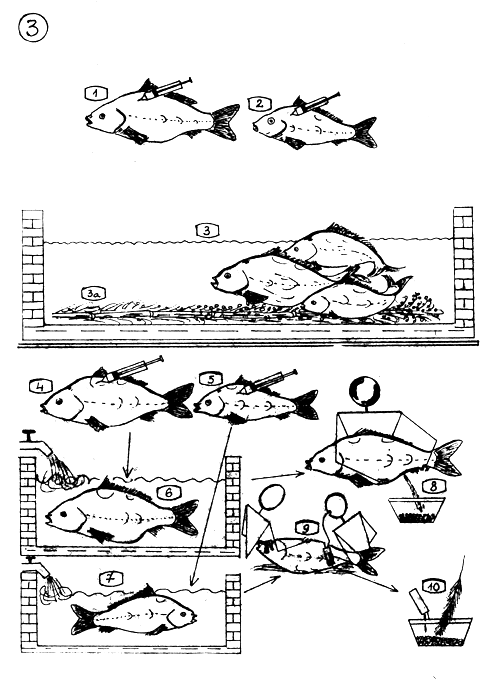
Techniques de Reproduction artificielle.
1–3. Reproduction induite.
Les femelles et …
… les mâles sont injectés de doses adéquates d'extrait hypophysaire puis sont introduits dans un bassin dont le fond est partiellement couvert de collecteurs d'oeufs (3a) (kakabans, tapis d'herbes, branches de pin ou de bambou, etc…).
Après 6 à 8 heures, selon la température, les géniteurs se reproduiront naturellement au-dessus des collecteurs d'oeufs.
4–10. Ovulation induite.
La femelle reçoit deux injections d'extrait de glande hypophysaire. La première dose égale 10% de la seconde. Seçonde dose : 3 à 5 mg. de glande séchée à l'acétone par kilo de poids vif du géniteur.
Le mâle reçoit une seule dose de 1–2 mg. d'hypophyse au moment où la femelle reçoit sa seconde injection.
La femelle est gardée séparément …
… des mâles.
Après un certain laps de temps (qui dépend de la température) la femelle sera en ovulation ; le flot jaillissant d'oeufs mûrs est extrait.
La laitance du mâle est récoltée dans un collecteur de sperme.
Les produits sexuels sont mélangés “secs” et fertilisés artificiellement.
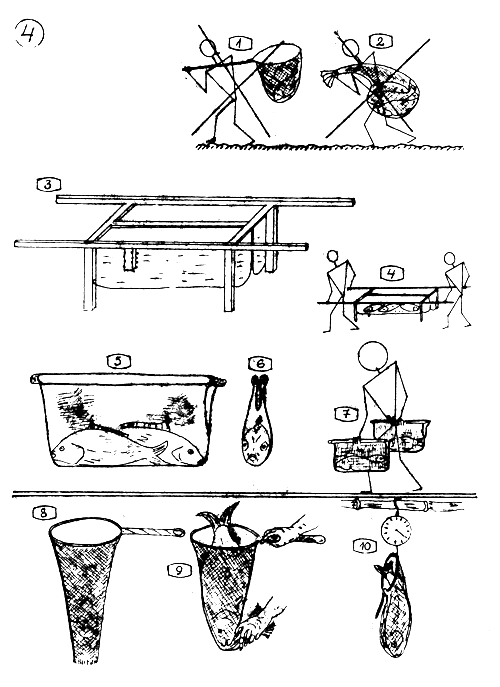
Transport et Manipulation des géniteurs.
1–2. Les géniteurs, et particulièrement les femelles “gravides” sont des animaux très sensibles. Ne jamais les transporter brutalement ou les transférer dans des épuisettes, dans des sacs ou par d'autres rudes moyens similaires, contre-indiqués.
Hamac pour le transport des géniteurs, composé d'un cadre en bois ou en tuyau métallique, et d'une poche en toile de bâche ou autre matériel imperméable. Ici, un hamac double. Les dimensions de la toile de la poche sont : 85 cm de long, 30 cm de haut et 15–17 cm de large. Les pieds ont 45 cm et les poignées de transport, 60 cm.
Comment transporter les géniteurs dans un hamac.
5–6. (Sacoche) - Un cabas (sac) pour transporter 1 ou 2 géniteurs. Fait d'un demi-sac maintenu rigide à l'aide de 2 bâtons (poignées de transport).
Comment transporter des géniteurs dans un cabas (sacoche).
Epuisette aux deux extrémités ouvertes …
… pour manipulation facile et prévenante …
… et pour peser les géniteurs.
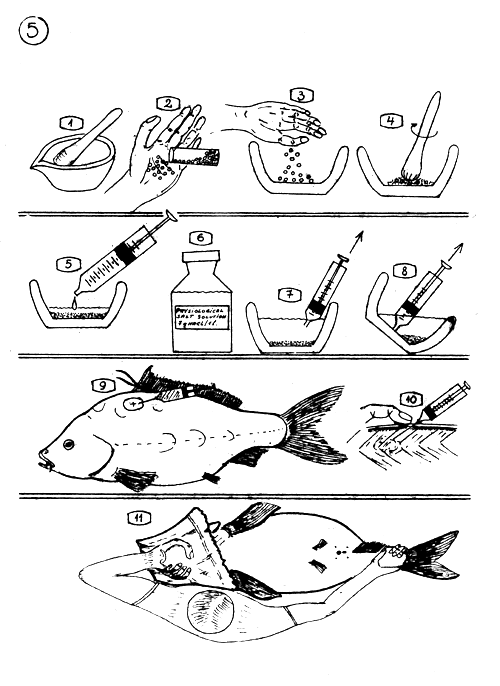
Préparation de la solution d'hormones hors des glandes pituitaires séchées à l'acétone.
Le mortier et le pilon pour réduire finement en poudre les glandes sèches.
Comptage des glandes sèches. La dose (nombre) est calculée selon le poids moyen des glandes.
Les glandes comptées sont mises dans le mortier …
… et réduites finement en poudre.
La solution physiologique salée-mesurée, est ajoutée et bien mélangée aux glandes réduites en poudre (mélange au mortier).
La solution salée est composée de 7–8 gr. de sel ordinaire pour 1 litre d'eau distillée (ou la solution physiologique pour usage humain, disponible en pharmacie).
7–8. Prise des doses de solution hors du mortier, à l'aide d'une seringue, en évitant d'aspirer les “débris” (tissus de glandes sèches).
Où pratiquer l'injection. L'ellipse indique l'endroit.
L'aiguille de la seringue est enfoncée au travers du muscle dorsal que l'on masse au doigt pendant et après l'injection.
Comment tenir la Carpe femelle pendant la suturation de la papille génitale.
Une main saisit la tête enveloppée dans une serviette et l'autre main, la queue (au niveau du pédoncule caudal).
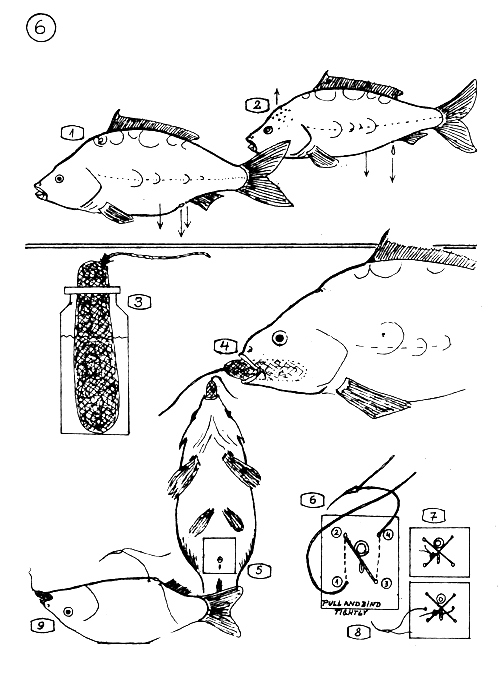
Les signes des géniteurs montrant leur maturité pour la propagation induite.
La Carpe femelle a le ventre (abdomen) mou ou semi-mou; l'anneau anal est saillant et élargi; la papille génitale est rouge et saillante.
Le mâle a un aspect svelte; le ventre (abdomen) n'est pas gonflé ; il libère quelques gouttes de laitance (sperme) sous une légère pression de l'abdomen. Quelquefois une rugosité apparaît à la tête.
3–9. Anesthésie et Suturation de la Carpe femelle.
Préparation du “tampon-saucisse” mis à tremper dans une solution anesthésique de MS 222 (0,2 – 0,3 gr MS 222 dans 50 – 80 cm3 d'eau). La “saucisse” est faite d'un petit sac rempli d'ouate ou de coton.
Introduire le tampon imbibé de solution dans la bouche de la femelle. Le poisson s'endort rapidement.
La partie où procéder à la suturation.
La séquence des points de suturation (selon le nombre).
Suturation en deux points …
… et en trois points.
La position dans laquelle la femelle doit être maintenue pendant la suturation.
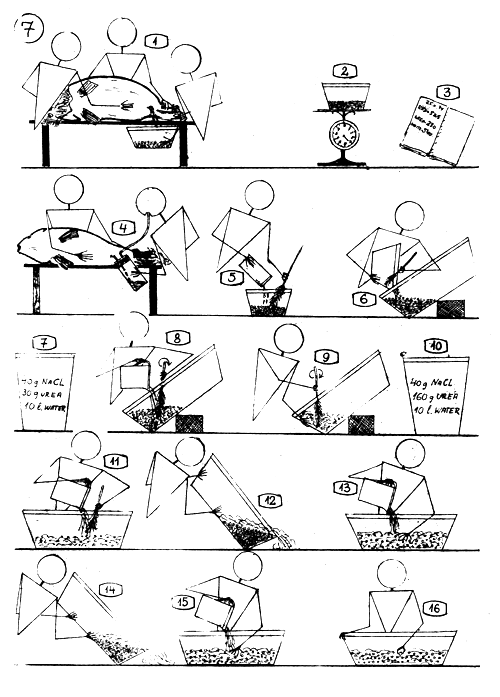
Extraction, Fertilisation et Traitement des oeufs de Carpe
Extraction des oeufs de la femelle, par pression manuelle légère et répétée le long de l'abdomen, après avoir coupé et enlevé les fils de suturation de l'orifice génital.
Pesée des oeufs secs …
… et enregistrement du poids.
Récolte du sperme à l'aide d'un collecteur de laitance.
Les produits sexuels sont mélangés “secs”.
Si le poids des oeufs atteint le demi-kilo, ou davantage, les déverser dans un plus grand récipient en plastique, de 10–20 l.
Au préalable, préparer la solution fertilisante : 40 g. de sel ordinaire (NaCl) et 30 g. d'urée (Carbamide) dans 10 l. d'eau.
Ajouter à la masse d'oeufs, 1 à 3 dl de solution fertilisante et mélanger ensemble, délicatement.
Ajouter ensuite un peu plus de solution fertilisante et mélanger la masse d'oeufs pendant 3 minutes (oeufs immergés).
Auparavant, préparer la solution dissolvant la matière collante des oeufs: 40 g. de sel ordinaire et 160 g. d'urée (Carbamide) dans 10 litres d'eau.
Selon la masse d'oeufs, verser 1 à 3 litres de la solution dissolvant la matière collante des oeufs et mélanger pendant 5 à 8 minutes environ.
Evacuer le liquide superflu, les oeufs reposant sur le fond.
Renouveler la solution dissolvante (1–3 1.) et mélanger seulement de temps à autre le contenu du récipient.
Après 15–20 minutes, évacuer la solution chargée de déchets …
… et la renouveler avec de la fraîche; laisser reposer 15–20 minutes.
Contrôler par toucher avec les doigts, l'état de durcissement des oeufs, et s'ils sont déjà suffisamment durs … procéder au traitement au TANNIN.
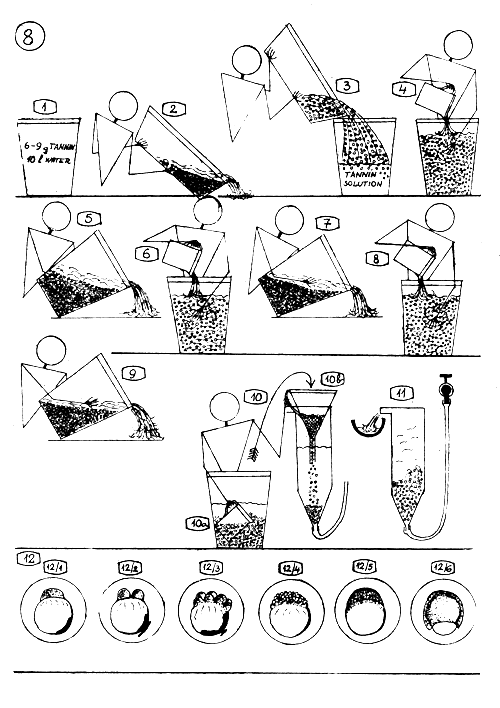
- Traitement au TANNIN des Oeufs de Carpe commune.
Préparer la solution de Tannin, séparément pour chaque lot d'oeufs, peu avant le traitement: 6–9 g. tannin (une cuillérée à café) dans 10 litres d'eau.
Quand les oeufs deviennent suffisamment durs (on le sent au toucher des doigts), évacuer la solution dissolvant la matière adhésive …
… et verser dans un seau (plastique) 2–4 litres de la solution de Tannin qui vient d'être préparée peu avant. Verser la masse d'oeufs dans le seau, rapidement et toute en même temps.
Mélanger l'ensemble une ou deux fois à la main, et après 4–6 secondes, ajouter un peu plus d'eau propre.
Laisser reposer les oeufs sur le fond du seau et évacuer le liquide superflu.
Ajouter 2–3 litres de solution de Tannin dans le seau, bien remuer et ensuite ajouter de l'eau propre.
Laisser reposer les oeufs et évacuer le superflu de liquide.
Ajouter à nouveau 2–3 l. de solution de Tannin et répéter le point 6.
Evacuer la solution et rincer les oeufs 2–3 fois à l'eau propre.
Transférer les oeufs dans les jarres d'incubation en utilisant une tasse en plastique (10a) ou une louche et un entonnoir (10b).
Régler doucement un faible débit d'eau (filtrée-oxygénée) dans les jarres d'incubation (0,3 – 0,5 litre/minute).
Les premiers stades de développement des oeufs de Carpe commune.

Traitement préventif des oeufs au Vert de Malachite.
Préparer une solution concentrée de Vert de Malachite: dans 1 litre d'eau, une cuillère à soupe ou 2–3 petites cuillérées de Vert de Malachite.
Stopper le débit d'eau dans les jarres d'incubation.
Evacuer une partie de l'eau par le trop-plein, à l'aide d'une grosse bouteille poussée du haut vers le bas.
Ajouter 5–10 cm3 (2–3 petites cuillères) de solution de Vert de Malachite dans chaque jarre à traiter.
Mélanger l'ensemble à l'aide d'une plume fixée à l'extrémité d'une longue baguette.
Laisser reposer la solution pendant 3 à 5 minutes et entre temps remuer l'ensemble (oeufs-solution) 1 ou 2 fois.
Rétablir le débit d'eau régulier dans les jarres; le courant d'eau évacuera la solution.
Le développement de l'embryon des oeufs de Carpe commune.
9–11. Manipulation des oeufs pendant leur incubation.
Enlever des jarres les mauvais oeufs par siphonage. Les mauvais oeufs flottent au-dessus des bons ; ils sont blancs et opaques.
Les oeufs prêts à éclore sont siphonés dans un seau et …
… transférés dans de grandes jarres d'éclosion etd'élevage des larves.
Nourrissage des larves avec des jaunes d'oeufs durs (cuits).
Faire bouillir les oeufs pendant 6 à 8 minutes.
Retirer le jaune d'oeuf, émietter et mettre dans un petit sac en tissu à très fine maille (2a) - (tissu pour filet à plancton ; maille de 100–150 microns). Presser doucement le contenu du sac, dans l'eau (2b) diluant ainsi le jaune d'oeuf qui reste alors en suspension.
Verser le jaune d'oeuf en suspension (dilué) dans les jarres d'élevage où les larves ayant déjà gonflé d'air leur vessie natatoire, sont prêtes à prendre leur première nourriture.
Préparation d'un conduit d'alimentation.
5–9. Installation de jarres d'éclosion et d'élevage des larves.
Jarres installées, prêtes à recevoir des oeufs de Carpe embryonnés, transportés d'une Ecloserie. Les jarres sont placées en série, en aval du côté sec de la digue d'un étang, lequel alimente les jarres, en eau filtrée.
Application d'un filtre cylindrique en tête de l'adduction d'eau.
Préparation d'un filtre cylindrique - Morceau de treillis métallique ou feuille de treillis plastique dur, découpé et assemblé en forme de cylindre …
… et recouvert d'un tissu filtrant à fine maille (tissu plastique de préférence, à maille de 0,5 – 1 mm.), et…
… fixé à la tête du tuyau d'adduction d'eau.
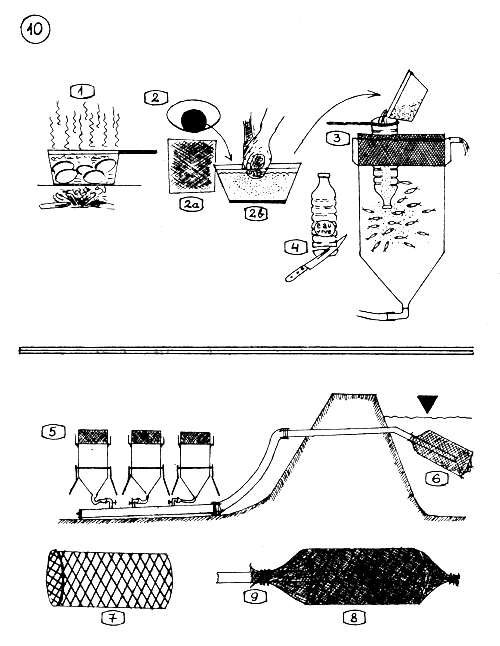
Conditionnement et Emballage des Oeufs de Carpe, pour leur Transport.
Le transport des oeufs peut s'effectuer dès que l'embryon est parvenu au milieu de son stade de développement, comme montrent les figures 2 et 3 (en pratique et à coup sûr, après 40–48 H. d'incubation des oeufs).
Juste avant le transport, les oeufs sont traités pour la dernière fois au Vert de Malachite …
… et bien rincés dans les jarres.
Pour l'empaquetage des oeufs, on utilise des caissettes en bois (40 × 20 × 7 cm) dont le fond est constitué d'un treillis en plastique assez rigide ou d'un tamis à fine maille.
On garnit l'intérieur de la caissette d'un morceau de tissu de flanelle ou de coton (90 × 90 cm) bien imbibé d'eau.
On retire les oeufs des jarres, à l'aide d'une tasse …
… et on les répand avec précaution sur la flanelle, en une couche de 1-1,5 cm d'épaisseur.
Les parties débordantes du tissu sont repliées sur les oeufs.
Les caissettes sont empilées l'une sur l'autre (en laissant un écart de 1–2mm entre elles), maintenues liées par une corde.
Le lot de caissettes est placé dans un plus grand carton dont le fond est couvert de petites branches feuillues de bambou (ou d'autres feuillages …).
Les mêmes branches feuillues sont mises sur les côtés du carton, autour des caissettes, puis le dessus est couvert d'un morceau de plastique-mousse épais, trempé d'eau fraîche et propre. Le carton est alors refermé, et ficelé. Les oeufs sont emballés - conditionnés, et prêts à supporter parfaitement un transport d'une durée de 6 à 8 heures, au moins.
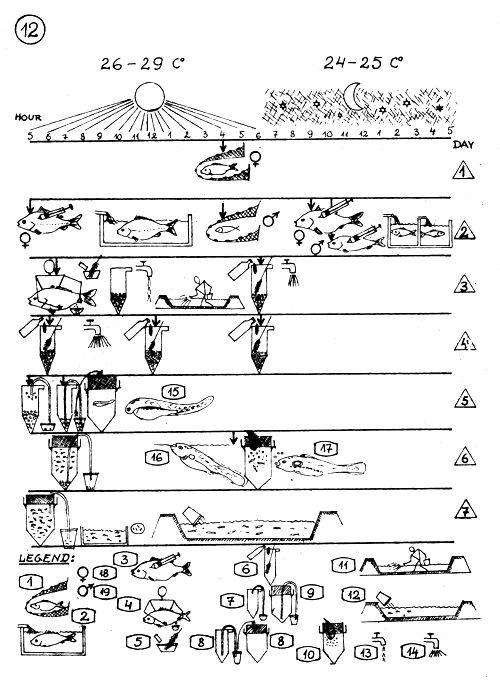
Horaire des différentes activités pendant la reproduction artificielle de la Carpe commune, en climat chaud.
Température diurne : 26–29°C. Température nocturne : 24–25°C.
L E G E N D E :
Capture des géniteurs (mâles et femelles tenus séparément).
Maintien des géniteurs en bassins (bacs de stabulation - en ciment) - (alimentation en eau, continue).
Injection des géniteurs - Première et seconde injection aux heures indiquées par la flèche.
Extraction des oeufs et de la laitance au temps indiqué par la flèche.
Fertilisation et Traitement des oeufs (voir les détails pages 7 – 8).
Traitement des oeufs au Vert de Malachite (voir les détails, page 9).
Enlèvement des mauvais oeufs.
Transfert des oeufs prêts à éclore, dans les jarres d'éclosion et d'élevage des larves.
Enlèvement des mauvais oeufs et des débris des jarres d'élevage des larves.
Nourrissage des larves au jaune d'oeuf dur (voir page 10).
Mise sous eau, fumure et fertilisation des étangs de premier alevinage.
Comptage et mise en charge du jeune frai dans les étangs de premier alevinage.
Faible débit d'eau dans les jarres (0.3–0.5 litre par minute).
Fort débit d'eau dans les jarres (1–2 litres par minute).
Larve venant tout juste d'éclore.
Larve aspirant des bulles d'air en surface et gonflant sa vessie natatoire.
Larve commençant à se nourrir.
Femelle.
Mâle.
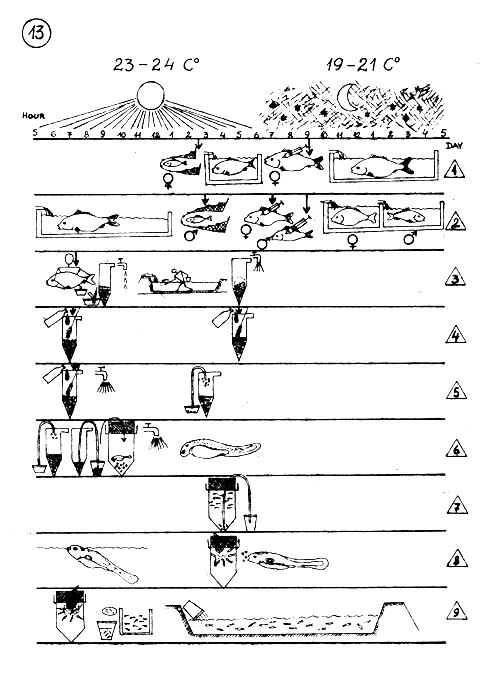
Horaire des différentes activités pendant la reproduction artificielle de la Carpe commune, en climat tempéré.
Température diurne : 23–24°C. Température nocturne : 19–21 °C.
L E G E N D E : (la même qu'en page 12).
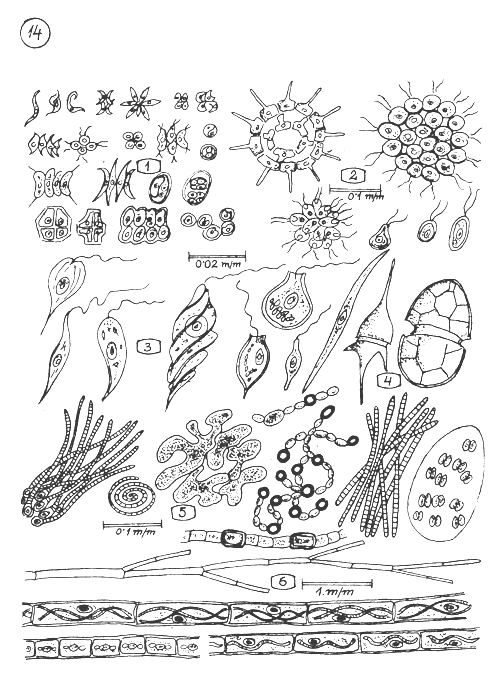
Plantes microscopiques (Algues - Phytoplancton) en groupes, dans les eaux pélagiques et les eaux littorales.
Différentes formes (espèces) d'algues vertes (approximativement de la dimension indiquée).
Colonies plus grandes d'algues vertes.
Algues euglénophites.
Algues avec capsule dure (Dinoflagellates).
Algues bleu-vert provoquant souvent des “fleurs d'eaux” dans les eaux pélagiques.
Algues filamenteuses croissant sur les substrats des eaux littorales.
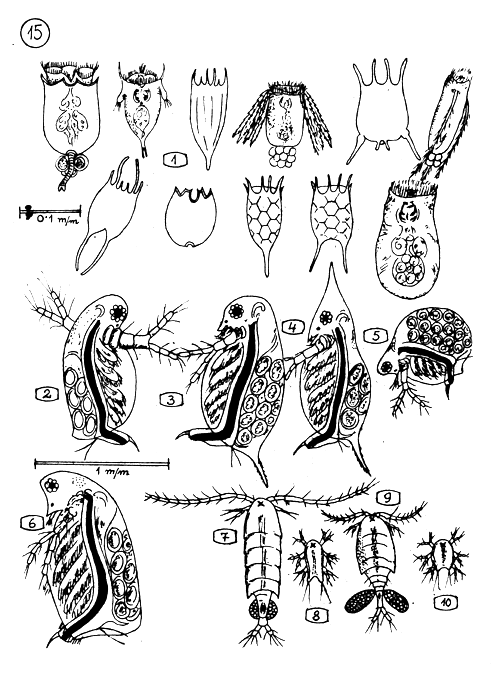
Les Animaux Planctoniques (Zooplancton) les plus importants en Etang piscicole.
Rotifères (Rotatoria) dont les nome scientifiques ne sont pas mentionnés ici - Leur taille approximative est indiquée sur la mesure de référence.
2–6. CLADOCERES (puces d'eau)
Diaphanosome
3.4. Daphnie
Moina
Sida
7–10. COPEPODES
Diaptomus
Larve de Diaptomus nauplii
Cyclops
Larve de Cyclops nauplii.
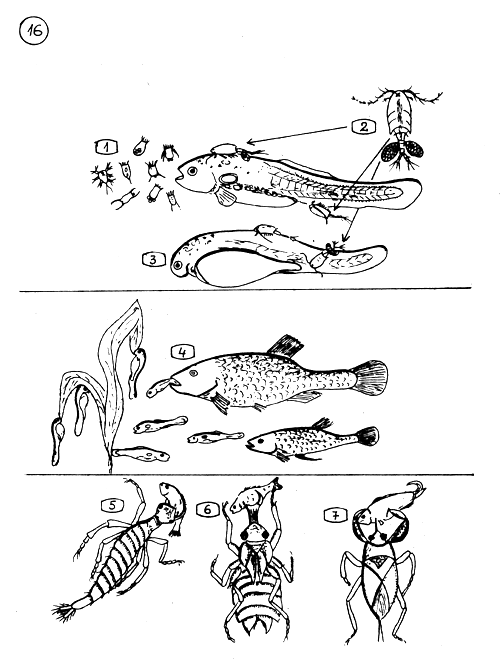
La première nourriture naturelle et les ennemis de la jeune Carpe.
Les Rotifères et les larves nauplii de Copépodes constituent la nourriture naturelle adéquate de la très jeune Carpe.
Les Cyclops adultes très carnivores attaquent les larves (3) et le frai de Carpe. Ils écorchent les blessures faites dans la peau tendre de jeunes poissons avec leurs pattes épineuses, et les tuent.
Les Gambusia consomment beaucoup de larves et de jeune frai de Carpe, du fait qu'ils sont de taille similaire à celle des larves de moustiques. Les très jeunes poissons (frai) ne peuvent échapper à ce danger.
5–7. Principaux Insectes Prédateurs.
Dytiques (larve de dytique)
Larve de Libellule
Scorpion d'eau.
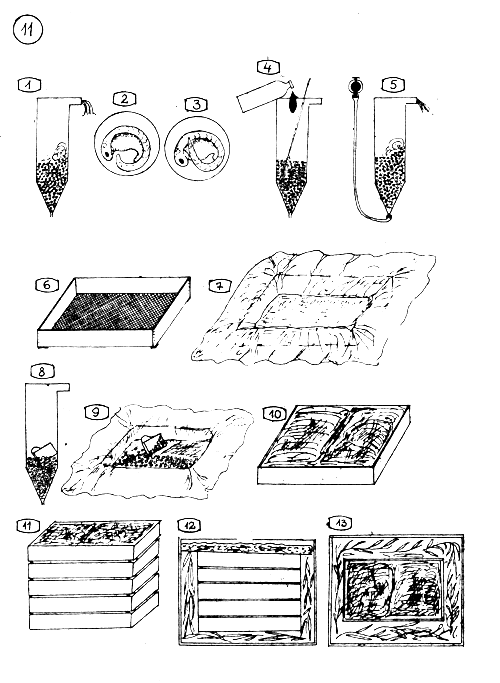
Extraction de la Glande Pituitaire (Hypophyse) de la Carpe commune.
Localisation de la glande pituitaire par rapport au cerveau, aux yeux et aux opercules.
Le cerveau de la Carpe commune vu du dessus …
… et vu du dessous, avec la glande pituitaire (en noir).
Vue de profil du cerveau avec l'infindubulum (conduit) qui relie le cerveau moyen à la glande pituitaire.
5–9. Comment ouvrir la boite cranienne pour l'extraction de la glande.
La calotte cranienne est sciée comme l'indique la flèche …
… ou tranchée à l'aide d'un couteau solide et affilé …
… où une partie circulaire de l'os cranien avec le cerveau et la glande est extraite de la tête du poisson, à l'aide d'une tarière électrique.
Pour le procédé d'extraction électrique, le poisson doit être maintenu fixé dans une forme spéciale en bois (console).
La console en bois, sans poisson.
10–13. Extraction de la glande par la cavité buccale (par endessous).
La cavité buccale est ouverte au couteau comme l'indique la flèche.
Tube perforateur à tranchant vif (utilisé en laboratoire chimique).
Stick pour pousser dehors le prélèvement contenu à l'intérieur du tube perforateur.
Le tube perforateur est placé sur la base du crâne et enfoncé vers la glande par mouvements semi-circulaires. Le tube perforateur est retiré par le même mouvement. Le contenu de la cavité du tube doit comprendre la glande pituitaire et une partie du cerveau.
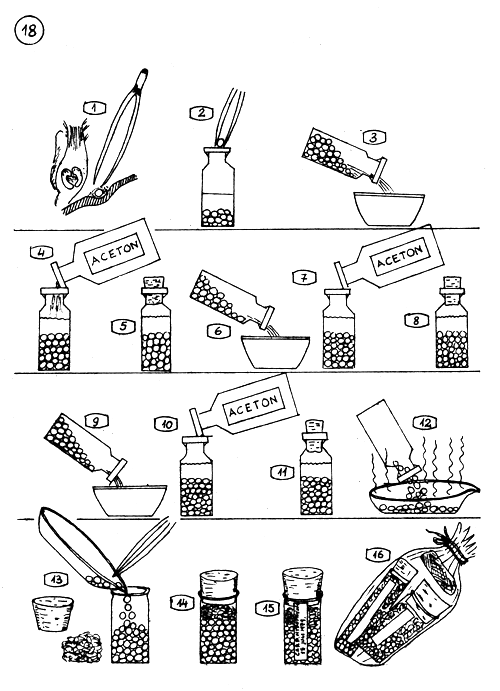
Conservation des glandes pituitaires dans l'acétone.
Le cerveau est tourné sur le côté pour dégager la glande : celle-ci est retirée délicatement à l'aide de pinces fines. Les tissus adipeux enrobant la glande sont enlevés …
… et celle-ci est mise dans l'acétone pure (acétone pure : sans graisse).
3.4. Quand l'extraction de nombreuses glandes est terminée, l'acétone est changée une première fois.
Les glandes baignent dans l'acétone pendant 8–10 heures.
6.7. L'acétone est changée une seconde fois.
Les glandes baignent dans l'acétone pendant 8–10 heures.
9.10. L'acétone est changée pour la troisième et dernière fois.
Les glandes restent dans la dernière solution d'acétone fraîche, pendant 4–6 heures.
L'acétone est évacuée et les glandes répandues sur une assiette plate (en porcelaine ou en verre). L'acétone volatile s'évapore rapidement.
13.14. Les glandes déjà sèches (sans odeur d'acétone) sont mises dans un flacon en verre ou en plastique pouvant être bien bouché ; un tampon de coton propre (ouate) est pressé sur les glandes et le flacon bouché, hermétiquement.
Une étiquette est collée sur le flacon avec les références écrites, renseignant : l'origine et la date, le poids moyen des glandes, l'opérateur, etc…
Les glandes doivent être protégées de l'humidité et des moisissures. Les flacons sont gardés hermétiquement fermés, dans un sac en plastique dans lequel on ajoute un sachet contenant un produit absorbant l'humidité : silicogel, ou dans un discicateur.
