by
B. Ezenwa
Federal Department of Fisheries
Lagos, Nigeria
Abstract
The paper presents a review of the status of fish seed production in Nigeria. Current intensive efforts by the Federal Department of Fisheries are aimed at ensuring an adequate supply of fry to fish farmers. Due to the abundance of natural seed artificial breeding of Tilapia spp., Mugil spp., Liza spp. and Hemichromis spp. is not practised and efforts are concentrated on improvement of nursery practices, expansion of holding facilities, and development of adequate distribution systems. Breeding and fingerling production techniques of common carp, first introduced into Nigeria in 1954, follow European methods and have increased fingerling production from 10 000 in 1971 to 40 000 in 1974. Present production of carp fingerlings in state government stations supplies the present needs in the country. Surveys indicate the availability of 2.5 million mullet fry per annum in the Lagos area and adequate numbers from the Niger Delta to stock 10 000 ha of ponds per annum. Mullet fry, acclimatized to fresh water, are presently being distributed to farmers for polyculture tests. Preliminary studies are also underway to establish fingerling production centres for Chrysichthys nigrodigitatus, a valuable species suitable for culture in both fresh and brackish water ponds.
Résumé
L'auteur fait le point de la situation de la production d'alevins au Nigeria. Les efforts intensifs actuellement déployés par le Département fédéral des pêches visent à assurer des livraisons adéquates d'alevins aux pisciculteurs. Compte tenu de l'abondance d'alevins naturels, on ne recourt pas à la reproduction artificielle dans le cas de Tilapia spp., Mugil spp., Liza spp. et Hemichromis spp.; tous les efforts sont axés sur l'amélioration des pratiques d'alevinage, l'accroissement de la capacité de stockage et l'élaboration de système de distribution appropriés. Les techniques de fécondation et de production d'alevins de carpes communes, introduites pour la première fois au Nigeria en 1954, s'inspirent des méthodes européennes et ont permis d'augmenter la production d'alevins, qui est passée de 10 000 unités en 1971 à 40 000 en 1974. La production actuelle d'alevins de carpes dans les stations piscicoles gouvernementales répond aux besoins du pays. Des enquêtes signalent la disponibilité de 2,5 millions d'alevins de mulet par an dans la zone de Lagos ainsi que d'une quantité appropriée dans le delta du Niger suffisant à peupler 10 000 ha d'étangs par an. Des alevins de mulet acclimatés en eau douce sont actuellement distribués aux pisciculteurs pour réaliser des essais de polyculture. Des études préliminaires sont également en cours en vue d'établir des centres de production d'alevins de Chrysichthys nigrodigitatus, espèce très prisée convenant à la culture tant dans les étangs d'eau douce que d'eau saumâtre.
With increased research at the Federal Department of Fisheries, Lagos, fish seed production and supply in Nigeria may no longer constitute a major problem to fish farmers and pond owners. Areas of greater activity include work on various species of brackish and freshwater fish, shrimps and oysters. Along the coastal belt, exploration for new fry grounds is being intensified. Mullet seed are found in abundance all year round. Oysters are also abundant and adequate; of the three collectors tested for spat collection (Ajana, 1973) spat settle better on hard timber than old oyster shells or asbestos. Shrimp (Penaeids) seed are seasonal.
In Nigeria there is a wide variety of natural fish seed to draw upon (Table I) and induced breeding of fish is practised on a very low scale. Efforts are concentrated on full exploitation of local feeds, fertilizers, control of predators and parasites and general fish pond management to ensure maximum fish seed production.
2.1 Carp seed
Carp were introduced from Europe in 1954 as 100 g fingerlings of which 50 percent were scaled and 50 percent mirror carp. Presently, carp culture is very profitable to Nigerian fish pond owners and government agencies. Most communities depend on government agencies who are better equipped for the breeding and distribution of carp fry.
Some state governments in the Federation, e.g., Benue Plateau State, East Central State and Western State, have perfected techniques for mass breeding of carp. The Panyam fish farm (Fig. 1) in Benue Plateau State, the first pilot carp project, planned and constructed in 1951 by K.K. Zwilling, now has breeding ponds totalling 148 acres (60 hectares) distributed as follows:
| Name of pond | Area | Fry production (6 months basis) | |
| acres | (hectares) | ||
| Sura Ponds | 18 | (7.3) | 24 000 |
| Arna Ponds | 24 | (9.7) | 16 000 |
| Yashi Ponds | 6 | (2.5) | 16 000 |
| Sarki Ponds | 100 | (40.3) | 20 000 |
| Total | 148 | (60.0) | 76 000 |
The ponds used here for breeding are modified Hofer ponds, and breeding operations are in accordance with normal practice in European farms. Brood fish of 5 to 7 kg weight are selected for shape, health and growth rate. The eggs hatch in less than three days and within two months, with proper feeding and fertilization, the larvae attain a weight of 15 to 30 g and are ready for distribution to fish farmers in the Federation. The number of storage ponds is being increased to accommodate a maximum stocking density of 60 000 to 80 000 per hectare.
The above method is also used for carp fry production in government demonstration fish ponds (Umuna - Okigwi, East Central State). Since the end of the civil war, fry production here has gradually increased from 10 000 fry in 1971 to 20 000 in 1972, 30 000 in 1973 and over 40 000 in 1974. Further expansion work on breeding and fry storage ponds is going on for increased carp fry production.
Production of carp fry has also been perfected at Agodi fish farm (Ibadan - Western State); in Masqa fish farm at Funtua (Zaria - North Central State); government fish ponds at Etinan and Opobo (South-Eastern State). These stations, together with the pilot carp project at Panyam produce more fry than needed at present in Nigeria.
2.2 Mullet seed
Six species of mullets have been identified in Lagos (Fagade and Olaniyan, 1973), and of these Liza falcipinnis is the most abundant in our research ponds. Pillay (FAO/UN, 1965) lists four species from his investigations in the Niger Delta. Of these, Mugil grandisquamis and M. falcipinnis were most common.
Essentially reared in brackish water ponds, mullet seed (20 to 30 millimetres fry of mixed species) have been acclimatized to fresh water conditions for polyculture in the inland states of Nigeria (Ezenwa, 1973). The availability of mullet seed in Nigerian coastal waters, on a year-round basis, encouraged further exploitation of these species in fresh water. In his survey of the availability of mullet fry in the Lagos Lagoon area (Oni, 1973) reports that mullet fry tend to congregate in shallow tidal pools at low tide where they can be collected with drag net. From the numbers recorded during his survey it is estimated that more than 2.5 million fry (22 to 50 millimetres) can be collected per annum around Lagos. This would be more than sufficient to stock over 400 hectares of fish ponds in Nigeria. Pillay's (FAO/UN, 1965) records and occasional collection trips made in the Niger Delta indicate that the quantity of mullet fry available would be sufficient to meet the annual demand for at least 10 000 hectares of ponds. Full exploitation of this available mullet seed resource is being carried out by the aquaculture section of the Federal Department of Fisheries, Lagos. Mullet fry, acclimatized to fresh water, are now being distributed by air and road to some states and private fish farmers in the Federation for polyculture tests. Survival rates at receiving stations vary from 90 to 95 percent, while preliminary results from recent pond grow-out tests are very encouraging.
TABLE I
Summary of data on other available fish seed in Nigeria
(modified after Sivalingam (1973))
| Species | Popularity with consumers | Availability of seed for stocking | Known feeding habits | Salinity tolerance ppt | Remarks |
| Local species: | |||||
| Tilapia spp. | average | year round and adequate | algae, phytoplankton, detritus, various supplementary feed | 0 to 26 or more depending on species | Hard and good as standby species in absence of more popular species for stocking. Uncontrolled breeding a disadvantage |
| Catfish (Chrysichthys nigrodigitatus) | very good | year round but inadequate | bivalves - supplementary feed - groundnut cake and palm kernel cake essential | 0 to 26 | Hardy. Supplementary feed absolutely necessary. Has grown well with tilapia and mullets |
| Mullets (Mugil spp., Liza spp.) | good | year round and adequate | detritus, phytoplankton, algae. Supplementary feed (?) | 0 to 35 | Has given good results in brackish waters. Experiments in fresh water under way |
| Mud catfish (Clarias sp.) | very good | year round but inadequate | omnivorous, supplementary feeds | 0 to 25 | Can be stocked very densely provided supplementary feed is given. Now cultured with tilapia |
| Heterotis niloticus Bonga (Ethmalosa sp.) | low good | seasonal and inadequate | phyto- and zooplankton phytoplankton | fresh water only 0 to 35 | Smaller sizes favoured; larger sizes said to be of lower taste. Comes into ponds with the tide. Appears to be sensitive to oxygen deficiency; delicate and does not keep long once out of water |
| Penaeus duorarum | very good | seasonal | detritus of both plant and animal origin | 0.5 to 35 | Comes into ponds with the tide. Delicate and limbs easily damaged. Has grown to about 20 g in ponds |
| Macrobrachium sp. | very good | seasonal | detritus of both animal and vegetable origin | fresh to about 10 | Caught in abundance in certain areas |
| Nile perch (Lates niloticus) | very good | scarce | predatory | fresh water only | Good predator species for tilapia, but preys also on carps. Fast growth? |
| Hemichromis fasciatus | low | adequate | predatory | 0 to 26 | Good predator species for tilapia. Does not grow beyond about 20 cm. When grown with large carps feeds on tilapia fry and fingerlings only |
| Snappers (Lutjanus spp.) | good | inadequate | predatory | 1 to above 30 | Good predator species for tilapia in brackish water ponds |
| Gymnarchus spp. | good | inadequate | predatory | fresh water only | Good predator for tilapia. Fast growth |
| Elops sp. | low | inadequate | predatory | 1 to 26 | Comes into ponds with the tide. Delicate and sensitive to oxygen deficiency, does not keep long out of water |
| Oysters | good | almost throughout the year and adequate | phytoplankton | 2 to 32 | Of the three collectors tested for spat collection, spat settles better on hard timber than old oyster shells or asbestos. Better settlement in the shade than in open areas. Settlement more abundant in depths between about 30 and 100 cm from water surface. Available all along the coastline in the brackish water areas. Can grow to about 8 g wet meat weight in one year under natural conditions |
| Exotic species already introduced: | |||||
| Common carp (Cyprinus carpio) | very good | year round and adequate (1974 statistics) | omnivorous | fresh, tolerates low salinities | Responds well to fertilizer and supplementary feeding |
| Exotic species worth introducing: | |||||
| Grass carp (Ctenopharyngodon idellus) | ? | Nil | feeds on grass and weeds | fresh water only | Some ponds are noted for the dense growth of grass and weeds. If introduced into these ponds they are expected to keep the vegetation under control |
| Silver carp (Hypophthalmichthys molitrix) | ? | Nil | phytoplankton | fresh water | Should increase production from ponds rich in phytoplankton |
2.3 Seed of Chrysichthys nigrodigitatus (catfish)
Preliminary tests in brackish water ponds indicate that the indigenous catfish, C. nigrodigitatus is suited to this type of culture (Sivalingam, 1970). This species can be cultured in fresh water ponds and, like the carp, is highly prized and in great demand in various parts of Nigeria. There are enough fry (though seasonal) in brackish and freshwater areas for experimental purposes, but this supply is inadequate for stocking private farms. To solve this problem, and with an aim to establishing fry/fingerling production centres through the practice of controlled breeding techniques, the Department has first initiated a detailed biological study of the fish in its natural environments - brackish and fresh water.
2.4 Other available fish seed in Nigeria
(See Table I)
Ajana, A.M., 1973 Oyster collection and culture at Kuramo waters. Annual Report, Federal Department of Fisheries, Lagos, Nigeria, pp. 66–9
Bayagbona, E.O., V.O. Sagua and M.A. Afinowi, 1971 A survey of the Shrimp resources of Nigeria. Marine Biology, 2(2): 178–89
Bulletin de I'I, F.A.N., 1963 Carp farming on the Jos Plateau. Paper prepared by Federal Fisheries Service, Lagos, Nigeria t. XXV, series A
Ezenwa, B., 1973 Acclimatization experiments with mullet fry for culture in fresh water ponds. Annual Report, Federal Department of Fisheries, Lagos, Nigeria, pp. 60–5
Fagade, S.O. and C. Olaniyan, 1973 The food and feeding interrelationship of the fishes in Lagos Lagoon. J.Fish Biol., 5:205–25
FAO/UN, 1965 Report of the Government of Nigeria on investigations of the possibility of brackish-water fish culture in the Niger Delta. Based on the work of T.V.R. Pillay. Rep.FAO/EPTA, (1973) 52 p.
Oni, A., 1973 On the availability and seasonal variation in abundance of mullet fry in the Lagos harbour mouth area. Annual Report, Federal Department of Fisheries, Lagos, Nigeria, pp. 57–9
Sivalingam, S., 1970 Fish culture possibilities around Lagos Lagoon and results of recent trials. Federal Fisheries Occasional Paper No 13
Sivalingam, S., 1973a Review of the Status and Potential of Aquaculture in Nigeria. Federal Fisheries Occasional Paper
Sivalingam, S., 1973b On the grey mullets of the Nigerian Coast, prospects of their culture and results of trials. Federal Fisheries Occasional Paper
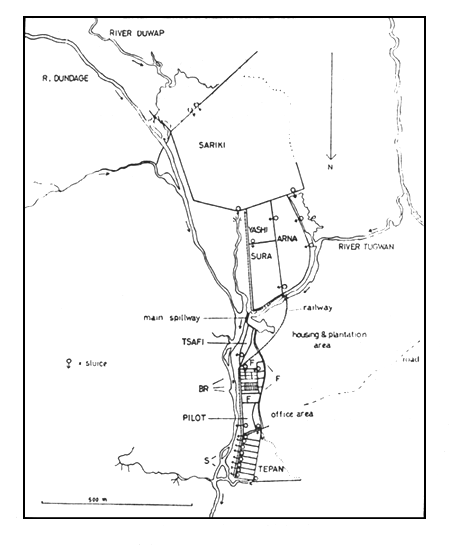
Fig. 1. Plan of ponds and the flow of water at the Panyam fish-farm.
par
J.C. Micha1
FAO Expert
BP 1401 Bangui
République Centrafricaine
1 Adresse actuelle : Laboratoire Ecologie Animale
Rue de Bruxelles 61 5000 Namur
Belgique
Résumé
Des essais préliminaires avec Clarias lazera commencés en 1970 en République Centrafricaine ont fait la preuve de l'excellent potentiel de ce poisson-chat local pour la pisciculture. Certains problèmes associés à l'élevage de cette espèce demeurent néanmoins à résoudre. Les résultats techniques de reproduction induite, quoique prometteurs, sont encore inconsistants; la survie des larves est relativement faible en étangs où lesravages causés par les grenouilles sont un problème sérieux. L'amélioration de la reproduction de la production d'alevins, la pisciculture en étang et les méthodes d'exploitation nécessitent la continuation des travaux.
Abstract
Preliminary tests with Clarias lazera initiated in 1970 in the Central African Republic demonstrated the excellent potential of this native catfish for fish culture. A number of problems associated with the culture of this species remain to be resolved. Results of induced breeding techniques, although promising, are still inconsistent; larval survival is relatively low especially in ponds where predation by frogs is a major problem. Additional work is required to improve on breeding, fingerling production, pond culture and management methods.
Après la seconde guerre mondiale, l'Afrique s'intéresse à la pisciculture afin de combler le déficit protéique dans le régime alimentaire des populations locales. C'est au Shaba (Katanga), province du Zaïre (Congo Belge) que commencent les premières études systématiques sur les possibilités d'élevage de poissons africains appartenant à la famille des Cichlidae, les tilapia.
Le fait d'avoir introduit ces poissons dans un milieu artificiel proche de leur milieu naturel permet d'obtenir très aisément leur reproduction. Dès lors on vulgarise leur élevage et la pisciculture des tilapia connaît un développement spectaculaire pendant les années 1950 à 1960 (Meschkat, 1967; Huet, 1957). Toutefois la production de ces poissons présente quelques inconvénients. Leur reproduction anarchique en étangs d'élevage a comme conséquence la surpopulation entraînant le nanisme. Aussi, après l'indépendance accordée aux pays africains, cette activité connaît en l'absence d'encadrement important une régression tout aussi spectaculaire (Micha, 1973a).
Néanmoins, un certain intérêt pour la pisciculture subsiste parmi la plupart des états africains. Et c'est dans le cadre d'un projet régional de perfectionnement et de recherche en pisciculture subsidié par le programme des Nations Unies pour le développement et exécuté par la FAO et le Centre Technique Forestier Tropical que je me suis occupé de rechercher de nouvelles espèces locales intéressantes pour l'élevage (Micha, 1973b). Très rapidement j'ai pu constater l'intérêt des silures et en particulier des Clariidae pour la pisciculture. En 1970, des échantillons de Clarias capturés au Centre Piscicole de la Lanja à Bangui ont été envoyés au Docteur J.P. Gosse du Musée Royal des Sciences Naturelles à Bruxelles. D'après ses déterminations, trois espèces de Clarias composaient les échantillons: Clarias lazera, C. bithypogon Sauv. et C. submarginatus Peters.
Une seule de ces espèces atteint une taille adulte intéressante pour l'élevage, c'est C. lazera dont le poids maximum signalé est de 12,8 kg. Les 2 autres espèces atteignent un poids maximum de 150 à 200 g et des individus matures de 15 à 20 g sont fréquents. L'élevage de ces 2 dernières espèces n'est donc pas à envisager puisque l'on risquerait de retrouver le problème des tilapia. J'ai donc centré mes efforts sur C. lazera.
Le premier travail fût de capturer des géniteurs qui ont été récoltés pour la plupart dans les étangs de barrages, dans la zone d'inondation de l'Ubangui puis stockés dans les étangs. La première reproduction constatée fût le 15 octobre 1970 dans l'étang A7 (of. Tableau I) où 5 mâles et 5 femelles de poids moyen voisin de 0,5 kg avaient été placés le 14 octobre 1970. Depuis lors de multiples essais de reproduction ont été effectués en étang, en bac de béton, en cage et en aquarium avec plus ou moins de succès.
Les modalités de la reproduction de C. lazera n'étant pas connues au début de mes travaux de multiples essais ont été tentés afin de déterminer le substrat pour la ponte (de Kimpe et Micha, 1974). Ces expériences, n'ayant actuellement aucun intérêt pour la poursuite et l'amélioration de la reproduction et de l'alevinage du C. lazera, ne sont donc pas reprises.
2.1 Maturité et cycle de reproduction
Des larves de C. lazera nées en bac ont été suivies au cours de leur croissance en étangs.
De l'observation de différents stocks d'âge connu, il ressort que mâles comme femelles arrivent à maturité entre 7 et 10 mois et sont capables de se reproduire. La ponte des femelles est inégale quel que soit leur âge. La plupart pondent partiellement et leur ventre reste gonflé. Certaines pondent totalement leurs ovules et présentent alors après la ponte, un ventre plat.
Le cycle de reproduction est mal déterminé. Dans la nature la période optimale de reproduction se limite aux mois de juillet, août, septembre et octobre. Toutefois on trouve des femelles à maturité, en dehors de cette saison de reproduction.
En étangs, il est possible d'avoir des géniteurs matures tout au long de l'année. La technique utilisée est de placer pendant 2 à 3 mois, 5 à 10 femelles non matures et 4 à 5 mâles de C. lazera de poids voisin de 200 à 300 g dans les étangs de production à tilapia. Lors de la vidange, ces géniteurs de Clarias sont examinés et utilisés pour la reproduction. Comme il y a généralement une vidange de tilapia par mois on repère mensuellement des géniteurs à maturité et on induit la reproduction. De cette façon, on a pu obtenir mensuellement des larves de C. lazera pendant un cycle annuel complet. Toutefois les pontes sont très inégales et sont généralement plus difficiles à réussir en dehors de la saison optimale de reproduction naturelle et plus particulièrement aux mois de novembre et décembre. A ce moment les pontes sont généralement très partielles, les femelles ne libèrent que quelques centaines d'ovules, et parfois la ponte n'est pas suivie d'éclosion. Ce problème des pontes partielles se retrouvent d'ailleurs tout au long de l'année. C'est ainsi que, des femelles ayant pondu partiellement suite à l'injection de l'hormone Doca, présentaient deux mois plus tard des signes de maturité. A nouveau injectées, elles ont encore pondu partiellement mais les pontes apparaissent nettement moins bonnes.
2.1 Reproduction naturelle
Diverses observations en milieu naturel laissent présumer que C. lazera vient se reproduire lors de la montée des eaux dans la zone d'inondation, zone d'eau calme et peu profonde.
Afin de déclencher la reproduction en étangs, des géniteurs mâles et femelles (Tableau I) sont placés le matin dans un étang vide que l'on remplit dans la journée, ce qui simule en fait l'inondation. Généralement on aperçoit le soir même vers 17–18 h la formation de couples. La reproduction se déroule près de la surface le long des berges enherbées. Les femelles déposent leurs oeufs sur les végétaux ripicoles et parfois sur le gravier propre à proximité de l'arrivée d'eau. Il n'y a pas de garde parentale. Pour vérifier l'éclosion, il suffit de récolter le lendemain quelques végétaux ayant servi de substrat et de les placer dans un seau d'eau. Le second jour après la ponte, l'éclosion doit avoir lieu.
Le grand intérêt de cette pratique est qu'elle est presque naturelle et que la présence de géniteurs dans l'étang limite l'introduction des deux espèces de grenouilles prédatrices (Dicroglossus occipitalis (Günther) et Xenopus muelleri (Peters).
Elle présente toutefois de nombreux inconvénients: reproduction aléatoire et limitée généralement aux mois de juillet, août, septembre, octobre, saison de reproduction optimale. Il est cependant possible, après avoir maintenu pendant plusieurs mois un stock important de géniteurs dans un petit étang, de provoquer la reproduction en dehors de cette saison en les changeant brusquement d'étang que l'on remplit dans la journée.
Toutefois, les pontes restent généralement partielles et la survie des alevins mauvaise. La récolte n'a jamais dépassé 145 ind./are. Cela s'explique notamment par le fait que les Clarias présentent des signes de cannibalisme certain, les géniteurs mangeant leurs alevins.
2.3 Reproduction induite
Dans le but d'obtenir des larves de C. lazera “sur commande” tout au long de l'année, divers essais d'induction de la reproduction par injection d'hormones ont été tentés. Par souci de concision et de réalisme les divers essais qui ont été tentés pour obtenir des pontes par induction ne sont pas repris ici et seules les pratiques qui ont donné des résultats, bien qu'inégaux, sont décrites. Il faut signaler toutefois que l'injection d'hormones hypophysaires provenant de Tilapia nilotica, Heterotis niloticus et C. lazera a donné des résultats pendant la saison de reproduction intensive. Vu son coût, ses difficultés et ses résultats, cette technique n'est pas à généraliser dans le cadre des tentatives de développement de la production de Clarias. Les essais d'injection d'hormones mammalliennes, telles que HCG et LH n'ont jamais abouti à des pontes de Clarias. Par contre l'injection d'un corticosteroïde de synthèse la désoxycorticostérone acétate (Doca) a un effet certain sur l'ovulation et permet d'obtenir des pontes dans les 24 heures après injection. La dose de Doca utilisée est de l'ordre de 5 mg/100 g de poisson. En deçà de cette dose, la reproduction n'a pas lieu et au-deçà, l'injection peut provoquer la mort du poisson. Les injections intramusculaires n'ont jamais donné satisfaction mais bien les injections intrapéritonéales. Elles se font ventralement, partant latéralement sous la base de la nageoire pectorale en direction du coeur mais sans l'atteindre (Fig. 1). Il faut également faire attention à ne pas atteindre l'oesophage. Après injection, il faut constater que le liquide injecté ne ressorte pas. Généralement, il faut éviter d'injecter plus de 5 à 8 cc de liquide par poisson. Comme la désoxycorticostérone acétate n'est soluble qu'en solution huileuse et que les concentrations disponibles n'existent qu'en 5 et 10 mg/cc (au-delà de cette concentration il y a précipitation) les géniteurs à utiliser ne doivent pas dépasser 1 kg. Le coût de cette hormone achetée en bcîte de 100 et importée par avion de Belgique revient à Bangui à CFA.F. 90 l'ampoule de 50 mg.
2.3.1 Reproduction induite en étang (Tableau II)
Un des inconvénients de la reproduction naturelle en étang est qu'elle est aléatoire. En injectant les femelles avec la Doca, on est certain d'induire la reproduction au moment voulu. On procède de la même façon que pour la reproduction naturelle en laissant les géniteurs en liberté dans l'étang. De cette façon les couples s'apparient en liberté dans l'étang. De cette façon les couples s'apparient en liberté et on évite le problème de l'absence de fécondation, observé en bac de béton, lors de la mise en présence d'une femelle injectée et d'un mâle immature.
Toutefois les résultats de survie d'alevins sont très inégaux de 1 à 915 ind./are. Dans l'ensemble il apparaît préférable d'utiliser des femelles n'ayant jamais subi d'injection au préalable. L'utilisation de femelles injectées ayant pondu partiellement et réutilisées deux mois plus tard donne des résultats plus médiocres.
Cette technique présente le même inconvénient que la reproduction naturelle en étang à savoir cannibalisme des alevins par les géniteurs.
Une amélioration possible de cette technique serait de capturer les géniteurs à la senne 1 à 3 semaines après avoir constaté les pontes.
2.3.2 Reproduction induite en cage (Tableau III)
Des cages grillagées de 1,50 × 0,75 m sont placées dans la partie supérieure de l'étang, vers l'arrivée d'eau, avec une couche de gros gravier sur le fond. On remplit l'étang le matin et on injecte les femelles que l'on garde séparées jusqu'à 17 h. A ce moment on place un couple de Clarias par cage et on vérifie qu'il y ait une profondeur d'eau de 20 à 30 cm dans la cage. La reproduction a lieu pendant la nuit. Le lendemain on retire les géniteurs, les cages sont retirées trois jours après l'éclosion.
L'avantage de cette technique sur la précédente est la vérification possible de l'importance des pontes et de l'éclosion.
Elle présente l'inconvénient de laisser libre cours à l'introduction des grenouilles prédatrices. De plus il est impossible de connaître la quantité de larves dans l'étang. On préférera donc à cette technique les pontes en bac de béton avec récupération et comptage des larves pour un empoissonnement de densité bien déterminé.
2.3.3 Reproduction induite en bac de béton (Tableau IV)
Le principe de cette reproduction est de forcer la ponte dans les 24 heures. Elle est délicate à réaliser car il faut choisir un couple mature et la difficulté réside souvent dans le choix du mâle. Elle est traumatisante pour les géniteurs qui se blessent parfois mortellement. Mais elle présente le grand avantage de pouvoir vérifier l'importance des pontes et de l'éclosion et de récupérer par comptage un nombre de larves connues. De plus l'éclosion et le développement des larves pendant 3 à 4 jours se fait à l'abri de la prédation.
Cette reproduction s'effectue dans des bacs de béton de 1,3 à 2,6 m2 à fond couvert partiellement ou entièrement de gros gravier qui sert de substrat pour les pontes.
Les géniteurs sont capturés à la senne dans un étang de stockage, on choisit les femelles les plus matures, on les pèse et on leur injecte une dose de Doca adéquate. Les injections doivent être terminées à 07.30–08.00 h. On place les femelles dans des petits bacs de stockage de 0,5 m2 avec 30 cm de profondeur d'eau. Les mâles sont placés deux à deux dans des bacs semblables puis on récupère une heure plus tard le mâle le plus intact et le plus agressif, c'est-à-dire le plus motivé pour la reproduction. Les mâles sélectionnés sont alors placés seuls dans les petits bacs de stockage. Vers 17.30 h avant la tombée de la nuit on introduit l'eau dans les bacs préparés pour la reproduction. On règle le tuyau de vidange de façon à ce que la profondeur d'eau atteigne 25 à 30 cm d'eau. On assure un léger écoulement continuel pour avoir une bonne oxygénation. On place alors les Clarias par couple dans ces bacs. La reproduction commence parfois vers 18.00 h mais a toujours lieu pendant la nuit. Le lendemain on constate les pontes, on enlève les géniteurs, on pèse les femelles de façon à avoir une idée de l'importance de la ponte. L'éclosion a lieu le jour suivant, aussi il faut couper l'arrivée d'eau pour éviter la fuite des larves par le tuyau de vidange.
Ici également on utilisera de préférence des femelles “fraîches” qui n'ont jamais été injectées.
2.3.4 Discussion
Les résultats de reproduction induite chez C. lazera effectuée à Bangui sont très irréguliers. En effet la ponte est soit totale, soit partielle, soit nulle et le pourcentage d'éclosion varie de 0 à 71.
Pour tenter de comprendre ces irrégularités il faut bien distinguer deux phénomènes consécutifs dans la reproduction: maturation des ovocytes correspondant au développement des gonades; et ovulation correspondant à l'expulsion des ovules matures.
(a) Maturation des ovocytes
La maturation des ovocytes est un phénomène lent, cyclique et saisonnier. Toutefois dans les conditions artificielles d'élevage en régions tropicales, on trouve des individus de Clarias lazera, présentant tout au long de l'année des gondades développées. Il est toutefois difficile de savoir si la maturité préreproductive est atteinte. La pression manuelle sur le ventre des femelles suivie d'une expulsion d'ovules semble être un critère insuffisant. Un critère plus fiable serait l'émission d'oeufs, par pression abdominale, présentant une vésicule germinale périphérique (à vérifier au binoculaire).
Pour activer ou provoquer la maturation des ovaires, on peut injecter des hormones gonadotropes. Toutefois des recherches récentes viennent de prouver l'existence d'une spécificité importante des gonadotropines de poissons. C'est pourquoi, il est préférable d'utiliser un extrait hypophysaire homologue ou d'une famille proche des animaux à traiter (Devaraj et al., 1972; Zanuy et Carillo, 1972; Breton et al., 1973; Donaldson, 1973; Carreon et al., 1973). Dans le cas du Clarias, il faudrait de préférence des extraits hypophysaires de Clariidae.
Actuellement on trouve dans le commerce des extraits hypophysaires d'une seule espèce de poissons, la carpe.
Remacle (1972, 1973) travaille sur Carassius auratus. Partant d'individus immatures, il a constaté, après 18 jours et 3 injections d'extraits hypophysaires de carpe, une violente maturation des testicules des mâles et l'accomplissement de la vitellogenèse chez les femelles.
Sur le plan pratique on pourrait donc essayer l'injection d'hormones hypophysaires de carpe. Ces extraits ont une activité gonadotropique garantie. Théoriquement, l'injection de tels extraits hypophysaires (200 mg/poisson) devrait permettre l'accomplissement total de la spermatogenèse et de la vitellogenèse au bout de 8 jours et les Clarias devraient pouvoir se reproduire sans autre intervention.
(b) Ovulation
L'ovulation est un phénomène fugace, qui est généralement déclenché par le jeu des partenaires en reproduction.
Toutefois dans les conditions artificielles de reproduction en bac de béton, les femelles n'acceptent pas facilement le mâle et les tentatives de reproduction dégénèrent souvent en combats mortels. C'est pourquoi on injecte une hormone interrénale, la Doca, qui agit directement sur les ovaires et provoque l'expulsion des ovules, permettant ainsi le déroulement de la reproduction.
Très récemment des auteurs canadiens ont obtenu des résultats intéressants avec une nouvelle substance synthétique, le citrate de clomiphène, utilisé à présent en clinique pour le traitement de certaines formes d'infertilité. Le mode d'action précis du clomiphène reste encore en discussion. La plupart des auteurs postulent un effet de stimulation du système hypothalamo-hypophysaire avec intervention à la fois sur la maturation des ovocytes et sur l'ovulation. Cette substance est disponible en poudre ou en solution alcoolique.
En conclusion, les résultats discordants de reproduction obtenus à Bangui par injection de Doca chez C. lazera s'expliquent, semble-t-il, par l'utilisation de femelles n'ayant pas terminé leur vitellogenèse. La Doca provoque en effet l'expulsion d'ovules à vitellus incomplet. Un premier remède: la reconnaissance, sur les ovules obtenus par pression abdominale, d'une vésicule germinale périphérique. Seules de telles femelles peuvent être injectées avec la Doca. Une seconde solution, qui devrait garantir des résultats constants, serait l'injection d'hormones hypophysaires de carpe à défaut d'hormones de Clariidae. Enfin des essais avec le clomiphène citrate, nouvelle substance pleine de promesses, devraient être tentés. Dans ce cas, le dosage est toutefois primordial: de faibles doses peuvent être stimulatrices, de fortes doses inhibent l'ovulation.
A la température moyenne de 26°C, l'éclosion a lieu dans les 24 heures après la ponte. Pour déterminer le pourcentage d'éclosion, il suffit de récupérer dix cailloux et de compter séparément le nombre d'oeufs champignonnés et le nombre de disques adhésifs témoins d'une éclosion.
| Cailloux | Oeufs éclos | Oeufs non éclos | % éclosion |
| 1 | 52 | 27 | 65,8 |
| 2 | 31 | 18 | 63,3 |
| 3 | 45 | 24 | 65,2 |
| 4 | 36 | 13 | 73,5 |
| 5 | 24 | 7 | 77,4 |
| 6 | 11 | 2 | 84,6 |
| 7 | 40 | 7 | 85,1 |
| 8 | 20 | 11 | 64,5 |
| 9 | 25 | 14 | 61,1 |
| 10 | 26 | 16 | 61,9 |
| Total | 310 | 139 | 69,0 |
L'évolution et la métamorhose des larves ont été décrites dans ma thèse de doctorat (Micha, 1973b). Toutefois, il faut préciser le moment et l'importance des mortalités des larves lors de leur récolte et de leur déversement en étang. Pour ce faire on a récolté quotidiennement avec des épuisettes à mailles fines des larves de Clarias qu'on a placé dans de petits bacs à dissection. Vingt-quatre heures après manipulation on a déterminé le nombre de larves mortes et vivantes.
| Age (jours) | Nombre de larves récoltés | Nombre de larves mortes après 24 h | % mortalité |
| 2 | 300 | 6 | 2,0 |
| 3 | 300 | 4 | 1,3 |
| 4 | 300 | 20 | 6,7 |
| 5 | 300 | 53 | 17,7 |
| 6 | 300 | 66 | 22,0 |
| 7 | 300 | 130 | 43,3 |
| 8 | 300 | 290 | 96,7 |
| 9 | 300 | 298 | 99,3 |
Ces résultats montrent qu'il faut donc récolter les larves avant l'âge de 7 jours pour les déverser en étang, car à partir de ce moment la mortalité enregistrée devient très élevée et les essais de survie de larves en étangs ne sont plus significatifs. Cette mortalité est à mettre en relation avec l'absence de nourriture dans ces bacs de reproduction. Les larves cherchent en effet de la nourriture vers l'âge de 3 jours. Dès le 6ème et 7ème jour, les mortalités correspondent sans doute à l'épuisement des réserves vitellines.
Quelle que soit la technique utilisée, reproduction naturelle ou induite en étang et reproduction en cage, les résultats ont été très inégaux allant de 1 à 915 individus récoltés par are. Ils montrent toutefois la possibilité d'obtenir une bonne récolte d'alevins de l'ordre de 1 000 ind./are, ce qui serait satisfaisant.
Pour mieux contrôler les facteurs qui interviennent dans la survie des larves, on préférera la technique de reproduction en bac avec empoissonnement de l'étang. On connaîtra ainsi l'âge et le nombre de larves mises en charge. Cette pratique a le grand inconvénient de laisser libre cours à l'introduction des grenouilles prédatrices.
Pour limiter cette prédation, on évitera la mise en eau précoce de l'étang et on le remplira le jour même de l'empoissonnement. L'installation de tôles protectrices serait intéressant à essayer à titre expérimental. Apparemment, il ne faut pas trop espérer des différents traitements de fumure de l'étang. Une bonne fumure organique avec fientes de poules éventuellement complétée par une légère fumure minérale assure certainement une production suffisante de plancton pour alimenter les petites larves de Clarias en densité de 1 000 à 2 000 ind./are, pendant leurs 2 à 3 premières semaines. Ensuite une alimentation en granulés de 50, 100 puis 150 g par jour au cours de 3 semaines suivantes doit être suffisante pour les étangs de 4 ares. On récoltera les Clarias, après 30 à 40 jours d'étang avec la cage de capture, pour les placer dans un étang de grossissement pendant 1 à 2 mois.
Pour ma part, je reste convaincu que les divergences de résultats de survie des larves proviennent surtout de la présence et de l'abondance relative de l'une ou l'autre grenouille prédatrice Xenopus et Dicroglossus à un moment déterminé. Et les résultats de diverses fumures ne seront significatifs qu'à l'abri de cette prédation.
Les essais de production de Clarias ont d'abord visé à dégrossir le problème et à montrer les possibilités de croissance de cette espèce en fonction des disponiblités locales. Ils ont porté sur l'alimentation avec drèche, graines de coton, granulés ainsi que sur l'association porcs-poissons et canards-poissons. De l'ensemble des résultats, il ressort que l'empoissonnement doit être effectué avec des alevins calibrés de 10 à 20 g.
En ce qui concerne les granulés, ce sont les moins chers à base de protéines végétales qui donnent le meilleur résultat. La densité est de 200 ind./are et le temps d'exploitation, doit être d'environ 5 mois. Au-delà de ce temps d'exploitation, la biomasse limite est atteinte, la croissance ralentit et le taux de conversion des granulés augmente considérablement. La distribution de granulés sera de 4 à 5 pour cent/jour de la biomasse totale, mais distribuée moitié le matin, moitié le midi.
Les résultats avec graines de coton et dròche de brasserie sont à peu près semblables à ceux obtenus avec la drèche mais toute la production est marchande.
Enfin l'association porcs-Clarias donne des résultats beaucoup plus intéressants que l'association canards-poissons.
De toute façon, la production de C. lazera s'améliore puisque en 1972 le poids de C. lazera vendu à la station de la Landja fut de 776 kg et en 1973 il est passé à 2 113 kg.
Au cours de cette première phase du travail sur C. lazera, il ressort que cette espèce présente d'excellentes qualités pour l'élevage en pisciculture et ouvre des perspectives inégalées jusqu'à présent en Afrique. Toutefois de sérieuses difficultés subsistent. Les résultats de reproduction même induite restent très inégaux.
La survie des alevins qui, en bac de béton, meurent après la résorption de la vésicule vitelline vers l'âge de 5 à 6 jours, reste à étudier. En étang, il semble que la mortalité des larves provient en grande partie de la prédation. Toutefois des résultats intéressants ont été enregistrés et des récoltes de l'ordre de 400 à 1 000 ind./are ont été effectuées. Elles restent cependant occasionnelles car certaines récoltes sont de l'ordre de 1 à 40 ind./are, ce qui est insignifiant.
J'exprime tous mes remerciements au Ministère des Eaux et Forêts de la République Centrafricaine pour sa coopération dans cette étude. Toute ma gratitude va également au personnel local et en particulier à M. Z. Maletoungou pour son appui logistique.
L'aide de l'Organisation pour l'Alimentation et l'Agriculture et du Centre Technique Forestier Tropical fut très appréciée. Enfin que M.P. de Kimpe, Directeur du projet, soit remercié pour l'intérêt qu'il a bien voulu me prodiguer.
Breton, B., R. Billard, et B. Jalabert, 1973 Spécificité d'action et relations immunologiques des hormones gonadotropes de quelques Téléostéens. Ann.Biol.Anim.Bioch.Biophys. 13, 3:347–62
Carreon, J.A., R.F. Ventura, et G.J. Amazan, 1973 Notes on the induced breeding of Clarias macrocephalus Günther. Aqua. 2, 1:5–16
de Kimpe, P. et J.C. Micha, 1974 First guidelines for the culture of Clarias lazera in Central Africa. Aqua. 4 (sous presse)
Devaraj, K.V., Varghese, T.J. et G.P. Satyanarayana Rao, 1972 Induced breeding of the freshwater catfish Clarias batrachus (Linn.) by using pituitary glands from marine catfish. Curr.Sci.41, 24:858–70
Donaldson, M.E., 1973 Reproductive endocrinology of fishes. Amer.Zool., 13:909–27
Huet, M., 1957 Dix années de pisciculture au Congo Belge et au Rwanda Urundi. Publ.Dir.Agr. Forêts et Elev., Bruxelles, 109 p.
Meschkat, A., 1967 The status of warmwater fish culture in Africa. FAO Fish.Rep., 44:88–122
Micha, J.C., 1973a L'Afrique et la pisciculture. Courrier de l'Association CEE, Bruxelles, 21:45–8; 22:48–51
Micha, J.C., 1973b Etude des populations piscicoles de l'Ubangui et tentatives de sélection et et d'adaptation de quelques espèces à l'étang de pisciculture. Edit.C.T.F.T. Paris, 110 p.
Micha, J.C., 1974 La pisciculture africains. Espèces actuelles et espèces nouvelles Zoologie et Assistance Technique Edit. FULREAC, 381 p.
Pandey, S. et W.S. Hoar, 1972 Induction of ovulation in goldfish by clomiphene citrate. Canad.J.Zool.50, 12:1679–80
Remacle, C., 1973 Action des hormones sexuelles et des gonadotropines sur le testicule de Carassius auratus L., en culture organotypique. Seventh Conference of European comparative endocrinologists. Budapest, Hungary, 1 p.
Remacle, C. et J. Demal, 1972 Culture organotypique de glandes génitales de Téléostéens. J. Embryol. exp. Morph.Vol.27.1, 25–41
Zanuy, S. et M. Carillo, 1972 Applicación de los hormones gonadotropas en piscicultura. Publ. Tec.Dir.Gral Pesca, 10:221–31
TABLEAU I
Reproduction naturelle de C. lazera en étangs
| Etang (numéro) et superficie (ares) | Date empoissonnement | Femelles (kg) | Mâles (kg) | Date récolte | Densité (ind./are) | Observations | |
| A7 | (3,7) | 14.10.70 | 0,6 | 0,5 | 4.12.70 | 116 | Femelles encore toutes grosses. Donc reproduction partielle |
| 0,5 | 0,6 | ||||||
| 0,5 | 0,5 | ||||||
| 0,4 | 0,5 | ||||||
| 0,5 | 0,5 | ||||||
| A7 | (3,7) | 8.12.70 | N = 5 | N = 5 | 4. 1.71 | Présence d'alevins Clarias mais non comptés | Femelles encore grosses |
| A2 | (3,7) | 5. 1.71 | 1,2 | 1,0 | 12. 1.71 | Présence d'alevins Clarias mais non comptés | Femelles encore grosses |
| A2 | (3,7) | 6. 8.71 | N = 9 ± 0,3 | N = 9 ± 0,3 | 7. 9.71 | Présence d'alevins Clarias et de Tilapia | Baisse de niveau étang après la ponte |
| 20. 8.71 | N = 3 ± 0,3 | N = 3 ± 0,3 | |||||
| A5 | (4,5) | 20. 8.71 | 1,0 | 1,1 | 19.10.71 | Présence d'alevins Clarias et de 7,9 kg do Tilapia | Baisse de niveau étang après la ponte |
| 1,0 | 1,0 | ||||||
| 1,0 | 0,9 | ||||||
| A3 | (4,3) | 19. 8.72 | N = 26 | N = 16 | 18.10.72 | 23 | Déplacement du stock de géniteur suivi de reproduction non contrôlée |
| A7 | (3,7) | 5. 2.73 | 0,6 | 0,7 | 17.4.73 | 102 | Femelles encore grosses |
| 16.3.73 | 0,5 | 0,5 | |||||
| 0,7 | 0,8 | ||||||
| 0,6 | 0,6 | ||||||
| L1 | (10,5) | 7. 7.73 | N = 44 mâles | + femelles | 7. 9.73 | Présence d'alevins Clarias mais non comptés | Déplacement du stock de géniteur suivi de reproduction non contrôlée |
| F3 | (2,0) | 23. 9.73 | 2,4 | 2,3 | 6.11.73 | 145 | Pas de grenouilles adultes - Femelles à ventre dégonflé mais encore grosses |
| 3,0 | 1,8 | ||||||
| 2,8 | 2,9 | ||||||
| 1,5 | 2,4 | ||||||
| F4 | (2,0) | 23. 9.73 | 2,4 | 1,2 | 6.11.73 | 110 | Pas de grenouilles adultes - Femelles à ventre défonflé mais encore grosses |
| 2,6 | 3,0 | ||||||
| 3,0 | 3,2 | ||||||
| 1,4 | 2,5 | ||||||
| L5 | (1,8) | 21.10.73 | N = 46 | N = 37 | Présence d'oeufs sur les herbes le 5.10.73 | Déplacement du stock de géniteur suivi de reproduction non contrôlée | |
TABLEAU II
Reproduction induite de C. lazera en étangs
| Etang (numéro) et superficie (ares) | Date d'empoissonnement et d'injection | Femelles | Mâles | Récolte | Observations | ||||
| Poids (kg) | Doca (mg) | Poids (kg) | Doca (mg) | Date | Densité (ind./are) | ||||
| A2 | (3,7) | 23. 6.72 | 0,6 | 25 | 0,5 | - | 1. 8.72 | 220 | Reproduction partielle car femelles encore toutes grosses à la vidange. Présence de Tilapia |
| 0,5 | 25 | 0,8 | - | ||||||
| 0,6 | 25 | 0,6 | - | ||||||
| 0,5 | 25 | ||||||||
| B4 | (32,0) | 4. 8.72 | 1,400 | 70 | 1,5 | - | 29.9.72 | 156 | Reproduction partielle |
| 1,340 | 70 | 1,0 | - | ||||||
| 1,280 | 50 | 1,4 | 50 | ||||||
| 8. 8.72 | 1,0 | 50 | 1,0 | - | |||||
| 16 | (4,0) | 18. 8.72 | 1,840 | 90 | 1,8 | - | 19.10.72 | 915 | La femelle en cage a très bien pondu (perte de poids de 40 g). Bonne récolte d'alevins |
| 2,400 | 120 | 2,1 | - | ||||||
| 1,520 | 75 | ||||||||
| 1,8 | 90 | ||||||||
| + cage | 0,8 | 40 | 1,0 | - | |||||
| A6 | (4,0) | 27.10.72 | 0,900 | 40 | 1,600 | - | 3.1.73 | 39 | L'étang n'est pas rempli le soir pour la ponte donc mauvaises conditions |
| 0,720 | 35 | 1,400 | - | ||||||
| 0,750 | 35 | 1,040 | - | ||||||
| 0,840 | 40 | 1,000 | - | ||||||
| 30.10.72 | 1,200 | 50 | |||||||
| A4 | (4,3) | 2.11.72 | 1,400 | 70 | 1,1 | - | 9. 1.73 | 270 | Trois femelles encore grosses |
| 1,100 | 50 | 1,0 | - | ||||||
| 0,960 | 50 | 0,9 | - | ||||||
| 0,900 | 30 | 1,0 | - | ||||||
| A6 | (4,0) | 10. 1.73 | 0,950 | 50 | 1,0 | 50 | 474 | Toutes les femelles encore grosses | |
| 1,000 | 50 | 1,0 | - | ||||||
| 0,900 | 50 | ||||||||
| A4 | (4,3) | 25.1.73 | 1,100 | 50 | 0,590 | 30 | 5.4.73 | 181 | |
| 0,540 | 25 | 0,426 | 20 | ||||||
| 0,550 | 25 | 0,6 | - | ||||||
| 0,480 | 25 | 0,5 | - | ||||||
| 0,486 | 25 | 0,7 | |||||||
| 0,500 | 25 | ||||||||
| 0,472 | 25 | ||||||||
| A6 | (4,0) | 20. 3.73 | 1,2 | 50 | 1,6 | 50 | 8. 5.73 | 46 | Trois des femelles ont déjà été injectées et se sont reproduites deux mois auparavant sur A6 |
| 1,2 | 50 | 1,3 | - | ||||||
| 1,1 | 50 | 1,0 | - | ||||||
| 0,8 | 50 | 1,1 | - | ||||||
| A3 | (4,3) | 18.4.73 | 2,0 | 100 | 1,4 | - | 14.6.73 | 119 | |
| 1,5 | 75 | 1,1 | - | ||||||
| 0,7 | 35 | 1,8 | - | ||||||
| 0,9 | 45 | ||||||||
| A0,0 | (2,1) | 20.4.73 | 1,620 | 80 | 1,5 | - | 20.6.73 | 1 | Une femelle morte suite à l'injection |
| 0,760 | 38 | 0,9 | - | ||||||
| 0,680 | 34 | 0,7 | |||||||
| A4 | (4,3) | 24.4.73 | 1,2 | 50 | 1,3 | - | 25.6.73 | 74 | |
| 1,2 | 50 | 1,1 | - | ||||||
| 1,1 | 50 | 1,1 | - | ||||||
| 1,0 | 50 | ||||||||
| A6 | (4,0) | 9.5.73 | 1,6 | 80 | 1,7 | - | 9.7.73 | 18 | Toutes les femelles ont été injectées et se sont reproduites deux mois auparavant sur A6 |
| 1,5 | 75 | 1,5 | - | ||||||
| 1,5 | 75 | 1,5 | - | ||||||
| 1,2 | 60 | 1,4 | - | ||||||