L'étude du milieu aquatique est un vaste sujet qui comporte des recherches sur les composants physiques, chimiques et biologiques et sur la manière selon laquelle ils varient à la fois dans l'espace et le temps. Seules les grandes lignes principales de l'étude sont décrites dans cette section. En dépit du fait que le milieu aquatique, en particulier la mer, a été étudié intensément, peu de relations entre les poissons et leur environnement ont été établies qui soient utiles aux biologistes halieutiques. C'est probablement parce que le milieu est complexe et que les réactions du poisson vis-à-vis de lui ne sont pas directes comme, par exemple, celles entre l'effectif des classes d'âge et les températures de l'eau que l'on peut rarement s'attendre à trouver des relations simples.
A la fois pour cette raison et pour la raison qu'aucun laboratoire ne peut entreprendre seul d'étudier tous les aspects de ce sujet le directeur d'un laboratoire engagé dans la recherche halieutique pratique doit décider quel travail donnera des résultats utiles. Les décisions seront prises sur la base de quels aspects du travail sur le milieu dans la même région ou d'autres se sont montrés d'une valeur réelle.
Deux études potentiellement utiles sont la distribution des poissons en relation avec les caractéristiques du milieu et la productivité potentielle des masses d'eau. Cette section se concentrera surtout sur ces études.
Les programmes d'échantillonnage doivent être planifiés. Le type d'observations nécessaires doit être établi comme liste de stations. Une station est définie comme un point géographique où des observations sont effectuées. Il existe des principes de la planification des stations, lesquels sont généralement applicables: (a) les lignes de stations (coupes) doivent être perpendiculaires aux isolignes supposées des caractéristiques devant être échantillonnées (une isoligne est une ligne le long de laquelle la caractéristique étudiée, p.ex. la température, est la même); (b) la distance entre les stations doit être commandée par le taux supposé de changement le long de la coupe, des propriétés à mesurer; (c) la fréquence d'échantillonnage doit être en relation avec le taux supposé de changement avec le temps. La distance entre les stations doit être commandée par le taux supposé de changement de la caractéristique échantillonnée plus le taux supposé de variation est grand plus petite doit être la distance entre les stations. Dans la mer il y a des profondeurs standard d'observation qui conviennent dans la plupart des circonstances. Ce sont, 0, 10, 20, 30, 50, 75, 100, 150, 200, 300, 400, 500, 600, 800, 1.000, 1.200, 1.500, 2.000 m et à des intervalles de 1.000 m par la suite, où cela est possible.
Après avoir décidé du nombre de stations et de la fréquence des échantillonnages à y faire il faut embarquer suffisamment d'équipement, de produits chimiques et de récipients pour mettre les échantillons.
En mer la personne ayant la plus grande expérience de la navigation, généralement un des officiers de quart voit si le navire est exactement à la position de la station décidée auparavant par le chercheur. Ce dernier en prend note ainsi que des détails de l'observation effectuée.
La température est la caractéristique physique du milieu la plus largement relevée parce qu'il est facile de la mesurer. Il a été établi que c'est la caractéristique du milieu qui se relie le plus facilement à la ditribution et au rassemblement des poissons. La manière la plus facile de relever une température de l'eau de surface est de remplir un seau d'eau sous le vent du navire, loin de toute évacuation d'eau de refroidissement ou autre et ensuite de lire la température avec un petit thermomètre à lecture différée.
Cependant il faut un équipement spécial pour relever les températures en profondeur. Le même équipement est souvent utilisé aussi pour prélever des échantillons d'eau.
Les bouteilles Pettersen-Nansen (Fig. 7.1) sont probablement l'instrument le plus approprié pour les prélèvements d'eau à des profondeurs allant jusqu'à 200 m. Elles ne doivent pas être utilisées au-delà de cette profondeur parce que des changements de température peuvent se produire quand on les ramène de plus grandes profondeurs. En utilisant une seule bouteille Pettersen-Nansen on obtient la température à chaque profondeur devant être échantillonnée en descendant successivement la bouteille à chaque profondeur, en la fermant à l'aide d'un messager (un poids coulissant sur le cable) après qu'elle soit restée au moins une demie minute à cette profondeur, et en la récupérant. La température est alors lue immédiatement à l'aide d'une loupe pour thermomètre.
A des profondeurs dépassant 200 m les températures sont relevés avec des thermomètres montés soit dans des armatures à renversement soit attachés à des bouteilles à renversement pour prélever de l'eau (Fig. 7.1). On peut utiliser jusqu'à sept bouteilles ou armatures à la fois, espacées sur le même câble, pour prélever des échantillons aux profondeurs voulues. La première est actionnée par un messager qui ensuite libère le messager suivant et ainsi de suite. Les thermomètres sont utilisés par paires, l'un est protégé et l'autre est nu, et souvent on emploie deux jeux l'un servant de témoin à l'autre.
Un thermomètre protégé est ainsi appelé parce qu'il est enfermé dans un tube de verre scellé qui le protége de la pression de l'eau. (Fig 7.2) Le thermomètre non protégé n'a pas cette protection et la pression de l'eau comprime le verre et fait que la température lue sur le thermomètre non protégé est plus élevée que celle lue sur le thermomètre protégé. Parce que la pression de l'eau est proportionnelle à la profondeur, la profondeur, vraie à laquelle l'échantillon a été prélevé peut être calculée.
On peut obtenir une estimation grossière de la profondeur du prélèvement d'après l'angle que fait le câble avec la verticale et la longueur de câble dévirée. C'est satisfaisant pour les angles du câble de 5° à plusieurs centaines de mètres, mais seulement jusqu'à 100 m pour les angles plus grands. La raison des différences entre la profondeur calculée et la profondeur réelle est que le câble ne forme pas une ligne droite du navire à la bouteille de prélèvement et que la vitesse des courants modifie l'angle dans l'eau. Si des systèmes de courants sont superposés et courent dans des directions opposées l'angle du câble changera en conséquence quand le câble les traversera.
Le thermomètre principal est d'une construction spéciale. Il se compose d'un réservoir d'expansion principal (Fig. 7.2) et d'un autre plus petit à l'autre extrémité du tube. Le tube capillaire présente deux constrictions (Fig. 7.2). Le thermomètre est descendu avec le réservoir principal en bas et le meroure du réservoir principal se dilate pour remplir le capillaire et une partie du petit réservoir d'expansion. Quand le messager frappe la bouteille et ren\?\erse l'armature la colonne de mercure se casse à la constriction inférieure laissant une colonne de mercure qui est maintenant isolée du réservoir d'expansion principal et dont le volume dépendra de la température au point de prélèvement. Le volume de ce mercure et par conséquent la température qui est enregistrée dépendra encore de la température à laquelle se fait la lecture du thermomètre principal. Chaque thermomètre principal est donc associé à un thermomètre auxiliaire pour indiquer celle-ci (Fig. 7.2). La précision de lecture des thermomètres principaux est de 0,01°C et celle des thermomètres auxiliaires de 0,1°C, généralement on emploie un lecteur spécial comportant un éclairage et une loupe.
Quand on effectue une série d'observations de température (appelée une palanquée) la bouteille du fond est descendue à la profondeur correcte et y est maintenue au moins cinq minutes pour permettre à chaque thermomètre de se mettre à la température de la couche qu'il doit enregistrer. Le premier messager est alors envoyé pour fermer la première bouteille. La fermeture de cette bouteille et des suivantes est vérifiée en tenant le câble; chaque fermeture est indiquée par une secousse sur le câble. Au-delà de 500 m, ces secousses ne sont pas ressenties et il faut chronométrer le messager, il se déplace à une vitesse de 250 m par minute. Quand les bouteilles sont récupérées elles doivent être maintenues verticales, en position renversée, jusqu'à ce que les températures de tous les thermomètres aient été lues. Après la lecture ils doivent être rangéservoir le réservoir en bas, pour éviter la formation d'un bouchon d'air dans les thermomètres.
Il faut effectuer une série de corrections à la température lue sur le thermomètre protégé pour obtenir la température au point où l'échantillon a été prélevé. Ces corrections doivent compenser:
(a) la dilatation ou la contraction de la colonne de mercure enregistreuse résultant de la différence entre la température au point de prélèvement et celle à la lecture, comme on l'a déjà décrit
(b) les légères irrégularités dans le tube capillaire, exigent “l'indice de correction” qui est obtenu en étalonnant le thermomètre à différentes températures. La plupart des thermomètres ont été étalonnés par l'U.S.Bureau of Standards, le N.P.L. ou le P.T.R. qui délivrent avec des certificats donnant l'indice de correction qui doit être appliqué à différentes lectures du thermomètre. Il faut aussi connaître le volume du petit réservoir du thermomètre principal jusqu'à la lecture de 0°C sur le capillaire appelé le V° (degré volume). Il est donné sur chaque thermomètre. La correction totale à faire à la température lue sur le thermomètre est donnée par la formule:
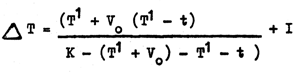
dans laquelle
ΔT = la correction
T¹ = température lue sur le thermomètre à renversement protégé
t = température lue sur le thermomètre auxiliaire
associé au thermomètre à renversement
protégé
V0 = volume de mercure au-dessous
de la marque 0°C à 0°C, exprimé en
degrés centigrades ( = degré volume)
K = coefficient thermique réciproque de dilatation du système
thermomètre
I = indice de correction pour les erreurs de
l'échelle de thermomètre
V, I et K sont des constantes fournies avec le thermomètre. Comme K est habituellement 6°100 ou 6 300 et que la somme des autres termes est approximativement de 100, le degré de précision désiré (0,01°C) peut être obtenu en utilisant la formule suivante:
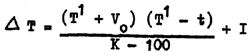
qui est la formule utilisée couramment.
dans laquelle Tw est la lecture corrigée du thermomètre protégé. La formule pour corriger la température du thermomètre non protégé est:
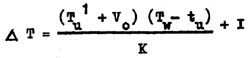
dans laquelle Tu¹ = température lue sur le thermomètre à renversement non protégé
tu = température lue sur le thermomètre auxiliaire associé au thermomètre à renversement non protégé
et Vo, K et I sont les mêmes constantes que oi-dessus mais sont les valeurs pour le thermomètre à renversement non protégé.
dans laquelle Tu est la lecture corrigée du thermomètre non protégé. La profondeur en mètres, à laquelle la température a été prise (D), appelée profondeur thermométrique, est donnée par:
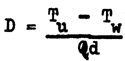
dans laquelle Q = coefficient de pression du thermomètre non protégé
d = densité moyenne de la colonne d'eau de mer au-dessus du point de renversement
et les autres symboles sont identiques à oeux décrits auparavant.
Q est une constante donnée avec le thermomètre et d est obtenu dans des tables.
Lafond (1951) donne les détails complets de ces formules et des méthodes de traitement des données de température.
L'Appendice 7.1 donne un exemple pratique.
Dans beauooup de cas il peut être sage de relever les températures de surface de la mer à des intervalles fréquents quand le navire fait route parce que des changements rapides indiquent généralement des divergences et des convergences de courants qui peuvent être importantes pour la distribution du poisson. La température de surface peut être mesurée facilement en prélevant l'eau avec un seau ou, sur les grands navires, en utilisant un thermographe fixé à la prise d'eau du condenseur. Ce dernier donne un enregistrment continu.
L'enregistrement continu du profil température-profondeur est effectué par un bathythermographe (Fig. 7.3) qui enregistre la température et la profondeur correspondante sur une lame de verre fumée. Il peut être mis à l'eau quand le navire est arrêté ou en route. Le bathythermographe est descendu dans l'eau de surface et y est maintenu pendant 30 secondes pour permettre au thermomètre de se mettre à la température de la surface avant de le faire descendre à la profondeur désirée. La longueur de câble nécessaire pour atteindre une profondeur donnée dépendra de la vitesse du navire et des caractéristiques du câble. Normalement il est recommandable de faire plusieurs essais pour obtenir un facteur de conversion câble/profondeur. La température de surface doit aussi être relevée avec un seau et un thermomètre quand le bathythermographe est mis à l'eau. Aprés la récupération de l'instrument, la lame est conservée en y portant les données d'identification nécessaires, en la lavant à l'eau douce, en la trempant dans un vernis à l'acétate d'amyle et ensuite en la faisant sécher sur un chassis. Les enregistrements du bathythermographe sont lus en plasant les lames sur une grille standard dans le lecteur fourni avec l'instrument. Les températures réelles ne sont pas lues avec la même exactitude que sur un thermomètre, la précision prévue étant normalement d'environ 0,1°c. Mais le bathythermographe fournit un enregistrement continu de la température et de la profondeur correspondante qui est obtenu rapidement et qui, pour beaucoup de fins fait plus que compenser la précision réduite. On dispose maintenant de bathythermographes à grande portée, ils sont projetés par une charge depuis le bord du navire faisant route et le relèvement température-profondeur est transmis au navire par fil, lequel automatiquement se détache du navire quand il a été déroulé entièrement.
Les bathythermographes sont particulièrement utiles pour fournir la mesure exacte à la fois de la profondeur et de l'intensité du thermocline. C'est une surface de discontinuité marquée de température agissant comme un mécanisme physique qui sépare deux couches d'eau. L'eau au-dessous du thermocline peut être désoxygénée et inhabitable pour les poissons. Dans quelques lacs comme le lac Kivu, le thermocline est permanent et les lacs sont toujours stratifiés. En eau douce, le changement de densité avec la température est beaucoup plus important qu'en eau salée, en particulier aux températures au-dessus de 20°C.
Les données de température trouvent une application aux problèmes pratiques des pêcheries principalement où la distribution d'une espèce est limitée par des frontières océaniques ou quand une espèce se rassemble à ces frontières. Les exemples de ces phénomènes sont, en gros, divisés en trois catégories, celles où:
Le meilleur exemple de la première catégorie est peut-être la distribution de la morue de la mer de Barentz qui est limitée par l'isotherme de 2°C. Au début de l'été, quand une petite surface seulement de la région est couverte par de l'eau du fond plus chaude que 2°C on trouve les morues concentrées dans cette eau plus chaude, et là les taux de capture peuvent être élevés (Fig. 7.4). Plus tard dans l'été, comme l'eau plus chaude s'étale vers l'est, la morue se disperse sur cette plus grande surface à température plus élevée et les taux de capture baissent (Fig. 7.5).
Il y a plusieurs exemples dans la seconde catégorie. King and Hida (1957) ont montré que les thons à nageoires jaunes se rassemblent dans les zones à la fois de convergence et de divergence des courants du Pacifique équatorial et que dans ces zones, quand le divergence est étroite, les captures sont 2 à 3 fois plus élevée que dans les courants principaux (Fig. 7.6). De façon semblable, on a montré que les harengs Atlanto-Scandiens se concentrent à la frontière très étroite de température entre l'eau chaude et l'eau froide au large de la côte est de l'Islande pendant l'été (Benko et Seliverstov, 1971). Dans l'est de la mer du Nord au printemps, les harengs se pressent sur le bord occidental de l'écoulement froid de la Baltique où ils rencontrent l'eau plus chaude de la mer du Nord. Dans de tels cas l'association entre le rassemblement des poissons et la température n'est probablement pas direct. Dans les cas du hareng de la mer du Nord l'eau froide peu salée s'écoulant de la Baltique assure la stabilité verticale qui, à sa tour, conduit à une explosion du phytoplancton et du zooplancton au début du printemps plus tôt que dans le reste de la mer du Nord. C'est probablement le niveau élevé de disponibilité de nourriture dans cette zone, plutôt que directement la température, qui provoque le rassemblement des harengs. Des mécanismes similaires peuvent s'appliquer dans les autres oas cités.
La troisième catégorie, de poissons se concentrant dans les zones de remontée d'eau, est illustrée de la meilleure manière dans les pêcheries d'anchoveta au large de la côte du Pérou et du nord du Chili, dans la pêche de la sardinella au large de la côte occidentale d'Afrique. Dans les deux cas, les pêches ont lieu dans des zones où les courants remontent le long du plateau continental, produisant une nourriture très riche dans les zones. De nouveau, l'association entre la température et le poissons dans ces cas est probablement indirecte avec la nourriture comme maillon direct.
Tout à fait à part des circonstances qui permettent aux données de température d'être employées pour prédire les aires des concentrations les plus élevées de poissons et des pêches les plus profitables, la température a un effect direct sur le métabolisme du poisson. Le poisson peut tolérer seulement des températures comprises entre certaines limites et, entre ces limites il existe une bande optimum plus étroite pour la croissance et la reproduction. Normalement, dans les aires où une espèce de poisson est établie depuis longtemps, la température ne s'écartera pas des limites de tolérance de l'espèce, mais des variations de température à l'extérieur des limites optima pour la reproduction peuvent amener des variations du succès de recrutement. Dans l'ouest du Groenland, la pêcherie de morue n'existait pas avant 1920 parce que l'eau était trop froide pour la morue. Maintenant il semble que l'eau devient de nouveau trop froide. Les classes d'âge jusqu'à celle de 1968 ont été très réduites et il est douteux que le stook continuera à exister.
Dans la bibliographie il y a de nombreuses références aux effects des variations de température altérant le calendrier et le succès de la reproduction. Mankowski (1950) déclare que les basses températures retardent et que les températures élevées avancent la ponte de la morue baltique. Simpson (1953) a montré que des températures anormalemente basses sur les aires de reproduction ont forcé la plie de la mer du Nord à se reproduire ailleurs. Woodland (1964) et Galloway (1941) décrivent les effects léthaux de basses températures sur le poisson.
On s'attendrait à ce que le succès de la survivance des oeufs et larves, mesurée par les variations d'effectif de classe d'âge, montre les plus grands changements avec la température parce qu'il semblerait qu'â ces stades les espèces seraient plus sensibles aux déviations des exigences de température optimum. Kurita (1959) a mis en relation les variations d'effectif de la classe d'âge de la sardine japonaise avec les variations de température. Chase (1955) a établi des relations similaires pour l'églefin du Georges Bank, Benko et Seliverstov (1971) pour le hareng Atlanto-Scandien et Posthuma (1971) pour le hareng de la mer du Nord. Il existe de nombreux cas de relations similaires dans la bibliographie pour un grand nombre d'espèces dans beaucoup de zones marines, mais il reste le fait que ce sont toutes des corrélations rétrospectives avec une latitude considérable pour le choix original de la variable température. Que l'on entende rarement parler de nouveau des relations après la publication initiale, peut suggérer que leur valeur de prédiction est faible.
Il y a peu de preuves directes de la mortalité associée à des températures anormales, chez l'adulte ou aux stades larvaires. Galloway (1941) a relevé une grande mortalité des poissons dans les zones côtières de Floride associée à des changements drastiques de température, alors que Simpson (1953) pour l'hiver froid de 1946-47 a relevé des mortalités de soles, de morues et de merlans dans la mer du Nord méridionale.
Des descriptions détaillées des méthodes d'analyse pour la large gamme de substances se trouvant dans l'eau pour lesquelles on peut faire des analyses sont données dans le Manuel des méthodes employées en biologie halieutique et dans les ouvrages cités ici (p. ex. Strickland et Parsons, 1960). Dans ce manuel nous décrirons seulement les conseils sur la facon de prélever les échantillons et les préserver pour l'analyse des substances principales, et on examinera plusieurs des applications les plus importantes de ces analyses.
Généralement, les échantillons d'eau pour les analyses chimiques sont prélevés soit à la même station soit à un choix des stations et profondeurs où on mesure la température. Pour prélever les échantillons un tube de oaoutchouc avec un tube de verre d'environ 15 cm de long enfoncé dans une extrémité est fixé au goulot de la bouteille de prélèvement, la valve à air en haut de la bouteille est ouverte et l'air est aspiré. Les échantillons pour le dosage d'oxygène, si cela est nécessaire, sont prélevés les premiers, suivis de oeux destinés à d'autres analyses chimiques. Les bouteilles dans lesquelles les échantillons doivent être conservés sont d'abord rinoées avec un peu de l'eau de l'échantillon avant de les remplir avec cette eau. L'analyse de la chlorinité est l'une des plus importants dans le milieu marin. Les résultats sont utilisés pour en dériver la salinité et la densité de l'eau qui à leur tour sont utilisées pour caractériser des mases d'eau et pour tracer leur origine, leurs mouvements et leur mélanges. Les variations de salinité dans les zones au large sont relativement faibles mais elles peuvent être considérables dans les zones côtières par suite des variations de l'écoulement. Ces variations peuvent affecter l'équilibre osmotique des poissons et la flottabilité d'oeufs pélagiques.
Les échantillons pour l'oxygène dissous sont mis dans des bouteilles sombres de 250 ml, dont le volume est exactement connu, munies de bouchons de verre rodés. En prélevant l'échantillon il faut maintenir le tube de verre près de fond de la bouteille de prélèvement pour s'assurer qu'aucune bulle d'air ne pénètre dans l'échantillon, et ou laisse couler l'eau quand la bouteille est pleine. Le tube est enlevé et le bouchon de verre est mis en place quand la bouteille est complétement remplie, il faut prendre soin que le bouchon n'entraine aucune bulle d'air dans la bouteille. Si ces précautions ne sont pas observées de l'oxygène de l'air se dissoudra dans l'échantillon et il en résultera un dosage erronné. Pour fixer les échantillons pour dosage d'oxygène, on ajoute 1 ml de chlorure de manganèse près du haut de la bouteille de l'échantillon, puis ensuite 2 ml de mélange iodure-alcali sont ajoutés en enfoncant le bout de la pipette d'environ 1 pouce (2,5 cm) au-dessous de la surface. Le bouchon est remis en place immédiatement et les produits chimiques sont mélangés très soigneusement pendant au moins quinze secondes pendant lesquelles le bouchon doit être maintenu fermement en place.
Dans la mer une basse teneur en oxygène est rarement critique pour la survivance des poissons mais cela peut se produire dans certains endroits sous les tropiques, où il se forme sous la surface une couche à minimum d'oxygène, et près du fond de dépressions mal aérées, telles que les couches profondes de la mer Noire. L'épuisement de l'oxygène est très courant dans les eaux douces, dans les lacs stratifiés et des marais. Paroe que l'oxygène est produit par les végétaux par la photosynthèse la teneur en oxygène de l'eau peut aussi donner une indication utile, assez grossière, de la quantité de synthèse d'hydrates de carbone qui a eu lieu récemment dans cette masse d'eau.
Les échantillons pour la salinité sont mis dans des bouteilles de 200–300 ml avec des bouchons de verre munis de rondelles de caoutchouc. Les bouteilles sont remplies presque complètement, en laissant un espace de 5–10 ml seulement sous le bouchon pour permettre l'expansion. Ces échantillons n'exigent pas d'autre traitement avant l'analyse.
Les phosphates, les nitrates et les silicates sont des sels nutritifs importants dont la disparition dans l'eau limite la production organique. Les quantités de ces éléments nutritifs dans une zone indiquent la fertilité potentielle de cette zone et des processus biologiques qui ont eu lieu ou qui ont lieu. Les échantillons pour le dosage des phosphates doivent remplir la bouteille jusqu'à 2 cm au dessous du bouchon. Six gouttes (½–1 ml) de chloroforme sont ajoutées, le bouchon est mis en place et la bouteille est secouée vigoureusement jusqu'à ce que l'échantillon devienne laiteux. Ensuite, les échantillons sont conservés dans un réfrigérateur et analysés le plus tôt possible.
Les échantillons pour les nitrates sont mis dans de petites bouteilles avec des bouchons de verre rodés en laissant beaucoup d'espace pour permettre l'expansion. Ces échantillons sont conservés sans traitement chimique dans un congélateur jusqu'à l'analyse. Les échantillons pour les silicates sont mis dans de petites bouteilles de plastique et conservés dans un réfrigérateur, sans agent de préservation, jusqu'à l'analyse.
D'autres détails sur les analyses d'eau de mer sont données par Strickland et Parsons (1960).
La mesure de l'intensité de la lumière à différentes profondeurs a de la valeur parce qu'elle est reliée à la fois à l'activité photosynthétique des végétaux, qui fournit la production primaire, et à l'écologie et la distribution en profondeur des animaux. La migration verticale diurne de beaucoup d'organismes marins suggère qu'ils suivent une intensité optimum de la lumière. En outre, la réaction de quelques espèces vis-à-vis des engins de pêche est partiellement régie par leur capacité de les voir et cela dépend de l'intensité de la lumière à la profondeur où elles se trouvent. Généralement, dans la mer l'énergie lumineuse à différentes profondeurs n'est pas mesurée directement mais elle est calculée d'après la mesure du coefficient d'extinction de l'eau et de l'intensité de radiation à la surface. Le coefficient d'extinotion peut être mesuré soit visuellement soit avec des instruments d'optique. La méthode visuelle la plus simple est le disque de Secchi qui est un disque blanc de 20 cm de diamètre. Il est descendu dans l'eau attaché à un câble du côté à l'ombre du navire. La profondeur à laquelle il devient invisible est mesurée en mètres. Il est descendu 2–3 m plus profond et il est ensuite remonté à la surface, la profondeur à laquelle il redevient visible est aussi notée. La moyenne de ces deux profondeurs est convertie en coefficient d'extinction selon l'équation X = 1,7/D, dans laquelle X = coefficient d'extinction, et D = la moyenne des profondeurs de disparition du disque de Secchi en mètres. Le coefficient d'extinction peut aussi être mesuré par des mesureurs d'extinction qui possèdent un éclairage électrique 60–200cm au-dessus d'une cellule photoélectrique.
Bien que la pollution soit un problème grandissant, en particulier dans les mers entourant des pays hautement industrialisés, elle n'est pas comprise dans ce manuel pour deux raisons. Premièrement, le contrôle efficace à la fois des métaux lourds et organochlorures toxiques exige un niveau d'expertise et de complication de l'équipement qui est le sujet de publications spéciales. Deuxièmement, à ce jour il n'existe pas de preuve de l'effet direct des polluants sur la productivité de n'importe quel stock de poissons marins sauf pour des incidents isolés près d'une source de pollution. Il y a beaucoup de preuves que la pollution peut affecter sérieusement la capacité du poisson à servir d'aliment (Ackefors et al., 1970) mais c'est là un problème pour les autorités de la santé publique plutôt que pour les biologistes marins.
Parce que le domaine des recherches sur le plancton est si étendu il n'est pas couvert en détail dans oe manuel, sauf pour deux aspects qui ont l'application la plus directe aux problèmes pratiques des pêches. Ce sont, d'abord l'estimation de la production primaire et la biomasse totale du planoton, qui sont les guides à la capacité potentielle d'une zone de supporter des stocks de poisson, et en second lieu l'application des études d'oeufs et de larves pour rechercher le moment et le lieu de la reproduction des poissons et dans l'évaluation des stocks de poissons.
La méthode la plus simple et la plus précise d'évaluer la production brute d'une aire est de mesurer les pigments photosynthétiques de la population végétale. Le taux de photosynthèse est ensuite calculé d'après les concentrations de chlorophylle, les données sur la lumière et la transparence en utilisant une relation générale entre la lumière et le taux de photosynthèse. Cela donne une valeur seulement pour la production brute; pour évaluer la production nette il faut une valeur de la perte due à la respiration et il est plus difficile de l'obtenir. Cependant, pour la plupart des buts pratiques des pêcheries les valeurs de la production brute conviennent assez bien.
La technique consiste à prendre un échantillon de 1 à 5 1, selon la richesse en phytoplancton, à un certain nombre de profondeurs dans la zone photosynthétique en utilisant une bouteille Pettersen-Nansen ou toute autre bouteille à eau appropriée. Ces échantillons sont ensuite filtrés à travers des filtres à membrane de cellulose de 0,4–0, 65 m ( m prononcer mu-em, égal à 10-6 mètres) de dimension des pores, qui ont été converts avec suffisamment de MgCO3 finement pulvérisé pour donner environ 10 mg/cm² sur la surface du filtre. Une dépression aspirante de ⅔ d'atmosphère appliquée aux filtres accélère la filtration. Ces filtres peuvent être conservés, dans le noir, sur gel de silice à 1°C jusqu'à deux mois bien qu'il soit préférable d'extraire le pigment du filtre humide immédiatement, et d'effectuer la mesure spectrophotométrique sans délai.
Le pigment est extrait du phytoplancton en mettant le filtre dans de l'acétone à 90 % pendant au moins 10 minutes. Il est préférable que les extraits soient traités immédiatement, mais ils peuvent être gardés pendant plusieurs heures à la température de la pièce dans le noir. La mesure des pigments est effectuée avec un spectrophotomètre, avec une largueur de bande de 3 m ou moins et des cellules avec une piste lumineuse de 4–10 cm, l'extinction est lue à 750, 663, 645 et 630 m en comparant à un témoin d'acétone à 90 %. L'extinction à 750 m est ensuite soustraite de celle aux autres valeurs et les réponses divisées par la piste lumineuse de la cellule utilisée exprimée en centimètres. Si ces extinctions corrigées sont e663, e645, et e630 la concentration de chlorophylle a dans l'extrait par l'acétone à 90% est = 11,64e663-2,16e645+0,10e630. Si cette valeur est ensuite multipliée par le volume de l'extrait en millimètres cube et divisée par le volume de l'eau de mer filtré en litres, la concentration de chlorophylle dans l'eau de mer est obtenue en g par litre. Une desoription complète des techniques pour le dosage des pigments végétaux dans l'eau de mer est donné dans “Determination of Photosynthetic Pigment in Sea Water”, Monograph on Oceanographic Methodology, Unesco, 1966.
La concentration de chlorophylle a calculée comme indiqué ci-dessus, donne une mesure convenable de la biomasse de phytoplanoton. S'il faut une estimation de la production brute en termes de poids de carbone produit par jour, l'équation suivante permet de le calculer:
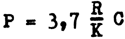
dans laquelle P = photosynthèse en g de carbone/m²/jour
R = photosynthèse relative
comme le donne un graphique dans Ryther et Yentsch (1957) qui relie l'activité photosynthétique relative à la radiation de surface pour la valeur appropriée de radiation de surface. K est le coefficient d'extinction par mètre mesuré comme il est décrit page 160 et C=g de chlorophylle par mètre cube.
Un des problèmes principaux dans la mesure de la biomasse du zooplancton est qu'aucun engin n'est approprié pour échantillonner la large gamme de taille des organismes qui se trouvent dans le plancton, allant des protoz`oaires d'environ 2 aux célentérés ayant jusqu'à 1 m de diamètre. En principe, cette difficulté pourrait être surmontée en utilisant plusieurs engins à chaque station pour couvrir tous les principaux groupes de taille. Cependant, il y aurait alors un chevauchement important dans les gammes de taille prélevées par les différents engins, de telle façon que lorsque leurs captures doivent être additionnées pour donner la biomasse totale des organismes seraient comptés plus d'une fois. Dans cette situation la meilleure solution est probablement d'adopter un seul engin qui donne un échantillonnage convenable de la gamme de taille des organismes qui constituent le gros de la biomasse du plancton et accepter le fait que l'estimation est une sousestimation parce qu'une proportion du plancton a été omise à cause de la sélection des mailles ou l'évasion.
Un filet à plancton avec une ouverture de mailles de 200 m est le meilleur compromis. Un filet approprié de cette dimension de maille a été décrit en détail par le groupe de travail 2 du CIEM/SCOR/UNESCO (Anom., 1968) qui a été institué pour conseiller sur la standardisation de l'échantillonnage du plancton. Le groupe de travail a recommandé que ce filet soit utilisé en oblique s'il est remorqué à 1,5 noeud environ. Cependant, c'est trop lent pour les grands organismes qui s'évaderont du filet à cette vitesse. Pour les décapodes pélagiques et les poissons larvaires dans les derniers stades il faut une vitesse de 4 noeuds.
Les profondeurs auxquelles il est nécessaire d'effectuer des prélèvements pour mesurer la biomasse du zooplancton peuvent être déterminées seulement par des expériences effectuées looalement. Cependant, des prélèvement effectués par des traits obliques ou verticaux d'une profondeur maximum de 200 mètres à la surface donnent généralement une estimation suffisamment précise de la biomasse du zooplancton. La question des avantages respectifs des traits obliques ou verticaux pour mesurer l'abondance de plancton n'a pas été pleinement résolue. Les traits verticaux ont l'avantage que le volume d'eau filtrée est mesuré plus facilement mais d'autre part ils sont très susceptibles à la variation produite par la disposition en taches du plancton à petite échelle. En faisant le bilan, il semblerait qu'une estimation plus valable est obtenue par les traits obliques parce qu'ils égalisent largement la disposition en taches du plancton et donnent ainsi une meilleure estimation représentative d'une aire assez grande. Les mailles des filets à plancton s'obstruent si le plancton (phytoplancton ou zooplancton) est dense. Pour cette raison les filets à plancton doivent toujours être munis de compteurs de débit de l'eau afin de pouvoir calculer le volume d'eau filtré.
Deux instruments de prélèvement sont le Gulf III (Fig. 7.7) et l'échantillonneur Bongo (Fig. 7.8) qui peuvent être remorqués obliquement. Ils sont munis de cônes filtrants à ouverture de maille de 250 m. Les échantillons de zooplancton doivent être conservés dans du formol à 4 % tamponné par du borax ou de éclats de marbre. Pour déterminer la biomasse de l'échantillon, la méthode la plus simple est de mesurer le déplacement de volume en filtrant l'échantillon à travers un morceau d'étamine de soie fine (No. 25). Le morceau de soie et le plancton retenu sont ensuite placés sur du papier absorbant pendant 10 minutes après quoi l'échantillon est mis dans un cylindre gradué contenant un volume d'eau connu. L'augmentation de volume dans le cylindre est relevée comme étant le volume de déplacement du plancton. Le poids de la biomasse (poids humide) peut être obtenu en transférant ce qui est récolté dans un cylindre de verre de poids connu qui a une base de nylon à mailles fines. Quand la majeure partie de ce qui a été conservé est déversé on utilise une pompe aspirante pour enlever le reste. Le matériel est lavé ensuite avec de l'eau sous aspiration, laquelle est continuée pendant un court moment pour faire passer de l'air dans le plancton avant de le peser. Les résultats de ces estimations sont exprimés en poids ou en volume sous 1 m² de surface de la mer d'après le volume d'eau filtré par l'engin de prélèvement mesuré par le compteur de débit et la profondeur à travers laquelle l'engin d'échantillonnage a été trainé.
Bien que ces méthodes donnent les résultats les plus précis et comparables, on peut obtenir des informations utiles en remorquant de simples filets à zooplancton. Si on n'emploie pas de compteur de débit les résultats ne sont pas quantitatifs mais si on suit chaque fois une procédure standard les résultats sont comparables qualitativement. Un exemple d'étude qualitative de ce type est donné par Green et Holden (1960).
On s'attendrait à ce que le poids de la biomasse de plancton soit de la plus grande applicabilité au problèmes de la pêche dans deux sphères principales. Pour les espèces pélagiques de poissons qui se nourrisent directement du plancton on pourrait espérer qu'il y ait une relation entre les centres à abondance élevée du zooplancton et les concentrations de poissons et ainsi des taux de capture élevés. Bien qu'en termes généraux cela se soit montré vrai pour un certain nombre d'espèces de poissons, la relation détaillée est normalement loin d'être simple et sa valeur comme méthode de guidage d'une flotte de pêche vers les fonds les plus productifs semblerait très limitée. Il peut y avoir deux raisons à cela: d'abord, il peut s'écouler un laps de temps entre l'établissement du plancton et le rassemblement des poissons dessus; ensuite, les aires de plus grand rassemblement des poissons sont probablement celles où il n'y a pas de plancton paroe qu'il a été mangé en entier.
L'autre domaine dans lequel l'estimation du zooplanoton paraîtrait susceptible de donner des résultats pratiques utiles pour les pêches est dans la prédiction de la force des classes d'âges. L'hypothèse la plus largement acceptée est que les variations de dimension des classes d'âge des poissons teléostéens très féconds provient des changements de la quantité de nourriture disponible d'une année à l'autre, le manque de nourriture appropriée étant tenu pour être le facteur principal provoquant la mortalité de poissons larvaires. Bien que cela paraisse acceptable sur des bases théoriques (Gulland, 1965), le concept soulève des problèmes d'interprétation chez les espèces qui ne montrent pas un type similaire de variation de la force des classes d'âge (Jones, sous presse), mais qui se reproduisent dans la même aire, au même moment et ont des préférences alimentaires similaires. Il est vrai certainement que personne n'a encore réussi à montrer une relation à long terme convaincante entre la dimension de la classe d'âge et l'abondance de nourriture pour auoune espèce. Ce peut être dû à l'insuffisance des données disponibles plutôt qu'à des prémisses de base peu sontenables.
L'autre application majeure de l'échantillonnage du planoton dans les problèmes pratiques des pêches est celle d'établir avec précision le moment et le lieu de la reproduction et la dimension du stock de reproducteurs. Le calendrier peut être établi d'après un examen du cycle de reproduction, comme il est discuté dans la section 5. Il peut être possible de déterminer l'aire de reproduction d'après le lieu de capture, mais les poissons peuvent rester à un stade de maturité avancée pendant une période de temps considérable avant de pondre, pendant ce temps ils peuvent parcourir une grande distance. Une technique plus précise est d'étudier l'aire en ce qui concerne la présence d'oeufs ou de larves de l'espèce considérée par des prélèvements de plancton. Avant une telle étude il faut obtenir le plus possible d'informations sur le moment et le lieu de capture de poissons prêts à la reproduction. L'emploi de oes données permettra de réduire au minimum l'aire et la durée de l'étude.
Un groupe de travail du CCMRR sur les études des oeufs et larves de poissons a recommandé que pour prélever des oeufs et larves de poissons, autres que les larves de grandes tailles, le meilleur instrument disponible est un échantillonneur Bongo de 60 cm. Il est muni de filets à mailles de 0,505 et 0,333 mm et remorqué en oblique à 1,5 à 2,0 noeuds, de la profondeur maximum à laquelle on trouve les oeufs et les larves de l'espèce objet des recherches jusqu'à la surface (Anon., 1971). Ces vitesses sont satisfaisantes pour les oeufs et les très jeunes larves qui ne peuvent pas échapper au filet. Pour capturer les stades larvaires plus avancés il faut de plus grandes vitesses (jusqu'à 4 noeuds). Un manuel de la FAO pour les études d'oeufs et de larves de poissons est en cours de préparation. Ces études doivent être faites sur une grille de stations, à des distances fixes de l'une à l'autre, couvrant l'ensemble de l'aire qui, d'après d'autres données disponibles peut renfermer des centres de ponte. De facon similaire, ces grilles doivent être répétées à des intervalles de temps régulièrs pendant toute la période, qui de nouveau d'après d'autres sources d'information, peuvent renfermer une activité de reproduction.
Avant de commencer les enquêtes sur les oeufs et larves il vaut mieux que les stades planotoniques des espèces étudiées puissent être identifiés de facon qu'il n'y ait pas de possibilité de confusion aveo une autre espèce ayant des oeufs et des larves très semblables. Si deux espèces dont les oeufs sont extrêmement difficiles à séparer aux stades précoces, pondent dans la même aire à peu près au même moment il faut utiliser un stade ultérieur de développement qui peut être clairement attribué à chaque espèce. Cela introduira des erreurs parce que les ceufs auront dérivé depuis l'aire de ponte et se seront dispersés sur une surface plus large que celle occupée initiallement pendant la période de la ponte au stade utilisé. De façon similaire, à moins que le temps écoulé de la ponte au stade utilisé soit connu, il y aura un décalage dans l'estimation du début, de la fin et du moment de l'activité maximum de reproduction.
Dans les stades précoces d'une pêcherie quand les oeufs et stades larvaires n'ont pas été identifiés il n'y a pas à choisir mais grouper les oeufs et les stades larvaires précoces par espèce. L'identification ne peut être effectuée qu'en élevant les oeufs et les larves au laboratoire, ce qui n'est pas facile à faire.
L'estimation de l'abondance d'un stock de poissons à partir des prospections sur les oeufs et les larves du plancton provoque des demandes similaires à celles de l'identification du moment et du lieu de reproduction. Le concept fondamental de l'estimation de l'abondance de cette façon est comparativement simple. La production totale d'un stade d'oeuf ou larvaire d'une espèce est obtenue à partir d'une série d'études couvrant une saison de reproduction. A partir de la connaissance de la fécondité moyenne de femelles mûres l'abondance totale du stock de femelle mûres peut alors être caloulée en appliquant l'équation:
M = P/F
dans laquelle P = estimation de la production d'oeufs
F = fécondité moyenne des femelles mûres.
L'abondance totale du stook exploité est obtenue à partir des proportions dans les captures industrielles de poissons femelle mûres à celle de mâles mûrs et de poissons immatures combinés. Puisque la fécondité d'un poisson est proportionnelle à son poids, le stock peut aussi être estimé en poids en utilisant la relation fécondité par unité de poids plutôt que la fécondité moyenne.
Le problème principal est d'obtenir une estimation de la production d'oeufs pendant une saison de ponte. Cela est obtenu en échantillonnant sur l'aire de distribution des oeufs aveo suffisamment d'intensité pour donner une représentation adéquate des changements de densité des oeufs. Normalement les comptes d'oeufs totaux pour chaque étude sont obtenus en échantillonnant une grille de stations placées régulièrement à des distances fixes l'une de l'autre. Cela simplifie le calcul ultérieur. Pour l'efficacité maximum de l'estimation il y a beaucoup à dire pour l'échantillonnage à des distances plus rapprochées dans les aires des concentrations les plus élevés, où la variabilité est normalement élevée, et à des stations plus largement espacées sur les bords de la distribution où la variabilité est normalement la plus basse. Il est nécessaire d'échantillonner toute la gamme des profondeurs dans lesquelles les oeufs sont distribués par des traits obliques avec un Gulf III ou un filet Bongo. Il doit être muni d'un compteur de débit afin que le nombre total d'oeufs pêchés puisse par la suite être converti en nombre sous 1 m² de surface. Les nombres pêchés à chaque station sont ensuite transformés en nombres dans le volume total de distribution; pour une grille de stations espacées régulièrement la moyenne des observations de la station est multipliée par le volume que chaque station représente; pour une grille à espacements irréguliers on trace des lignes isométriques, le volume dans chaque isoligne est mesuré et ce volume est multiplié par le nombre d'oeufs.
Parce que la production d'oeufs varie avec le temps pendant une saison de ponte, il est nécessaire d'effectuer un certain nombre d'études pendant la saison de ponte. Pour obtenir des estimations de la production journalière d'oeufs, la production totale d'oeufs par chaque étude est divisée par le nombre de jours qu'il faut pour que l'oeuf passe par le stade utilisé dans l'analyse à la température régnant au moment de cette étude. Le résultat final est une série d'estimations de la production d'oeufs journalière à divers moments de la saison de ponte. Pour obtenir la production saisonnière totale il existe deux moyens. Pour beaucoup d'espéces la production d'oeufs pendant une saison suit une courbe normale; la surface sous ce type de courbe peut être estimée à partir de la connaissance des valeurs en trois points quelconques de la courbe. Naturellement, au stade initial des recherches il est nécessaire d'effectuer plus de trois croisières pour déterminer si la production saisonnière d'oeufs est normale.
Si la production saisonnière d'oeufs ne suit pas une courbe normale on obtient une estimation de la production totale de deux facons. Une méthode consiste à prendre la production totale d'oeufs pendant la croisière et de la peser comme suit. Soit:
P = production totale d'oeufs pour l'étude
d = durée de l'étude en jours
2b = le nombre de jours entre cette étude et la précédente
2c = le nombre de jours entre cette étude et la suivante.
Alors la production d'oeufs estimée pour la période (b+c+d) jours, est:
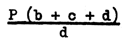
Pour la première et la dernière étude la production d'oeufs doit être basse et pour la première étude b peut être pris égal à zéro et il en est de même pour d à la dernière étude. L'autre méthode est de reporter les totaux des études en ordonnées en fonction de du milieu de cette croisière et de mesurer la surface au-dessous de la courbe obtenue. Si la courbe d'intensité de ponte saisonnière n'est pas normale d'autres études seront nécessaires pour donner une précision comparable à celle d'une courbe normale. Le nombre nécessaire d'études ne peut pas être défini tant qu'une étude pilote n'a pas été effectuée pour déterminer comment la ponte varie avec le temps. Une discussion de l'emploi de ces études pour estimer la dimension des stocks et les limites de confiance de ces estimations est donnée par Saville (1964).
Exemple:
Neuf prospections ont été effectuées en Mars 1971 pour échantillonner l'abondance d'oeufs d'églefin. Pendant chaque étude on a fait des prélèvement à 32 stations, les stations étant séparées par 20 milles marins dans un système de grille à carrés.
(a) Pendant la prospection du 10–12 Mars les données nécessaires relevés dans chaque station étaient:
| Numéro de station | Nombre d'oeufs au stade I dans chaque échantillon | Volume d'eau filtré (mètres cube) | Profondeur du trait (mètres) | Nombre d'oeufs au stade I sous 1 m² |
|---|---|---|---|---|
| A | B | C | AxC/B=D | |
1 | 0 | 55 | 10 | 0,00 |
2 | 1 | 62 | 31 | 0,50 |
3 | 1 | 58 | 42 | 0,72 |
4 | 0 | 65 | 63 | 0,00 |
5 | 1 | 70 | 64 | 0,91 |
6 | 8 | 63 | 63 | 8,00 |
7 | 10 | 61 | 42 | 6,89 |
8 | 4 | 62 | 31 | 2,00 |
9 | 2 | 60 | 20 | 0,67 |
10 | 25 | 54 | 30 | 13,89 |
11 | 40 | 58 | 40 | 27,59 |
12 | 1 | 45 | 45 | 1,00 |
13 | 0 | 50 | 52 | 0,00 |
14 | 15 | 63 | 45 | 10,71 |
15 | 75 | 65 | 47 | 54,23 |
16 | 0 | 60 | 25 | 0,00 |
17 | 0 | 61 | 21 | 0,00 |
18 | 90 | 58 | 36 | 55,86 |
19 | 35 | 56 | 48 | 30,00 |
20 | 1 | 63 | 63 | 1,00 |
21 | 0 | 61 | 58 | 0,00 |
22 | 75 | 60 | 43 | 53,75 |
23 | 15 | 59 | 40 | 10,17 |
24 | 1 | 57 | 22 | 0,39 |
25 | 0 | 66 | 30 | 0,00 |
26 | 10 | 65 | 38 | 5,85 |
27 | 20 | 75 | 50 | 13,33 |
28 | 0 | 57 | 61 | 0,00 |
29 | 0 | 59 | 83 | 0,00 |
30 | 2 | 50 | 75 | 3,00 |
31 | 1 | 65 | 62 | 0,95 |
32 | 0 | 53 | 71 | 0,00 |
Les oeufs traversent le Stade I en 2,5 jours. Calculer la production quotidienne moyenne d'oeufs dans l'aire étudiée pendant la durée de l'étude ( 1 mille marin carré = 343 × 104 mètres carrés).
Le nombre moyen d'oeufs par mètre carré dans l'aire étudiée d'après les données dans la colonne D = 9,45.
Production quotidienne moyenne d'oeufs = 9.45/2,5 = 3,77 par mètre carré.
Chaque station représente 20² milles marins carrés
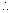 Aire étudiée = 400 × 343 × 104 × 32 m²
Aire étudiée = 400 × 343 × 104 × 32 m²
= 43904 × 106 m²
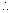 Production totale quotidienne d'oeufs pendant la période de cette étude
Production totale quotidienne d'oeufs pendant la période de cette étude
= 43904 × 3,77 × 106 = 165518 × 106.
(b) D'autres études effectuées sur cette aire en 1971 ont donné les estimations suivantes de la production quotidienne d'oeufs:
| Période de l'étude | Production quotidienne d'oeufs estimée |
|---|---|
3–5 Mars | 3290 × 106 |
6–8 " | 49106 × 106 |
10–12 " | 165518 × 106 |
13–15 " | 212086 × 106 |
16–17 " | 243750 × 106 |
19–21 " | 175208 × 106 |
23–25 " | 83690 × 106 |
26–28 " | 22115 × 106 |
29 Mars - 1er Avril | 925 × 106 |
Calculer la production totale annuelle d'oeufs du stock.
Pointer ces valeurs avec les dates du milieu de chaque croisière comme dans la Fig. 7.9 sur une échelle appropriée.
La surface au-dessous du graphique est égale à 153,25 grands carrés.
Chacun de ceux-oi représente 2 × 1 × 1010 oeufs sur l'échelle utilisée
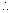 Production totale annuelle = 153,25 × 2 × 1010
Production totale annuelle = 153,25 × 2 × 1010
= 306,5 × 1010
(c) La relation fécondité-longueur du stock est F = 1,309L3,2 dans laquelle F = fécondité et L = longueur d'une femelle en centimètres.
Si la longueur moyenne des reproducteurs est 28 cm et le rapport des sexes des poissons mûrs est 1:1, calculer le nombre de poissons dans le stock mûr.
La fécondité moyenne du stock de femelles mûres est = 1,309 × 283,2 = 55,973
On a employé des techniques similaires pour les espèces qui déposent leurs oeufs sur le fond; des échantillons sont dragués sur les fonds de ponte et les aires qui les entourent. Cependant il n'existe pas de technique appropriée pour échantillonner les poissons d'eau douce dont la majorité attachent leurs oeufs à des plantes. Aussi les larves ne sont pas distribuées dans un endroit pélagique comme le sont ceux de poissons marins.
Anon., 1971 Report on the ACMRR Working Party on Fish Egg and Larval Surveys. ACMRR 6/71-WP4
Ackefors, H. et al., 1970 A survey of the mercury pollution problem in Sweden with special reference to fish. Oceanogr. mar. Biol., 8:203–22
Benko, Iu.K. et A.S. Seliverstov, 1971 Influence of some factors on the abundance of Atlanto-Scandian herring year-classes. Rapp. P. - V Réun. Cons. perm. int. Explor. Mer, 160:153–7
Galloway, J.C., 1941 Lethal effect of the cold winter of 1939–40 on marine fish at Key West, Florida. Copeia, 1941(2):118–9
Gulland, J.A., 1965 Survival of the youngest stages of fish and its relation to year-class strength. Spec. Publ. int. Commn.nthw. Atlant. Fish., (6):363–71
Holden, M.J. et J. Green, 1960 The hydrology and plankton of the River Sokoto. J. Anim. Ecol., 29:65–84
Jones, R., 1973 Density dependent regulation of the members of cod and haddock. Rapp. P. - V. Réun. Cons. int. Explor. Mer, 164:156–73
King, J.E. et T.S. Hida, 1957 Zooplankton abundance in the central Pacific. Part 2. Fish Bull. U.S. Fish Wildl. Serv., 57(118):365–95
Kurita, S., 1959 Causes of fluctuations in the sardine population off Japan. In World Scientific Meeting on the Biology of Sardines and Related Species, edited by H. Rosa, Jr. and G. Murphy. Rome, FAO, 3:913–35
Lafond, E.E., 1951 Processing of Oceanographic Data. H.O. Pub. No. 614. U.S. Hydrographic Navy Hydrographic Office, 144 pp.
Mankowski, W., 1950 The influence of thermal conditions on the spawning of fish. Bull. Inst. morsk. ryb., Gdynia, (5):65–70
Posthuma, K.H., 1971 The effect of temperature in the spawning and nursery areas on recruitment of autumn-spawning herring in the North Sea. Rapp. P. - V. Réun. Cons. perm. int. Explor. Mer, 160:175–83
Ryther, J.H. et C.S. Yentsch, 1957 The estimation of phytoplankton production in the ocean from chlorophyll and light data. Limnol. Oceanogr., 2:281–6
Saville, A., 1964 Estimation of the abundance of a fish stock from egg and larval surveys. Rapp. P. - V. Réun. Cons. perm. int. Explor. Mer, 155:164–70
Simpson, A.C., 1953 Some observations on the mortality of fish and the distribution of plankton in the southern North Sea during the cold winter 1946–47. J. Cons. perm. int. Explor. Mer, 19:150–77
Strickland, J.D.H. et T.R. Parsons, 1960 A manual of sea water analyses (with special reference to the more common micro-nutrients and to particulate organic material). Bull. Fish. Res. Bd. Can., (125):185 p.
UNESCO, 1968 Zooplankton sampling. Monogr. oceanic Method., (2):174 p.
Woodhead, P.M.J., 1964 The death of fish and sublittoral fauna in the North Sea and English Channel during the winter of 1962–63. J. Anim. Ecol., 33(1):169–77.
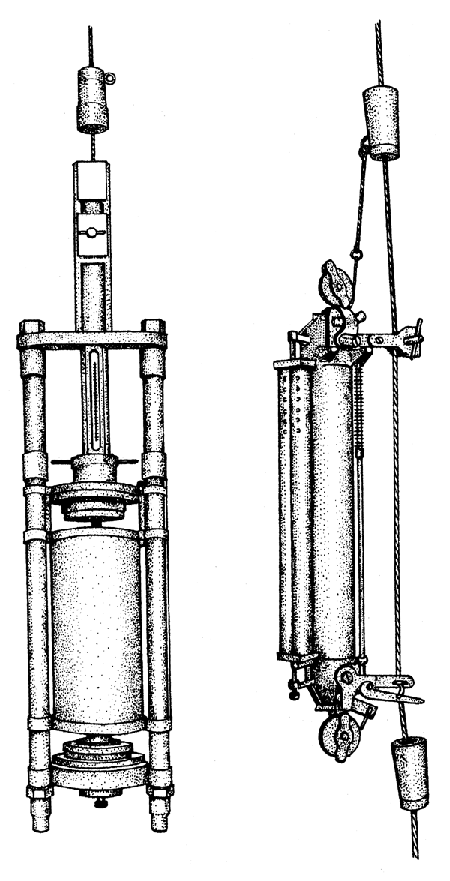
Fig. 7.1 Bouteille à eau Pettersen-Nansen (à gauche) et à renversement (à droite)
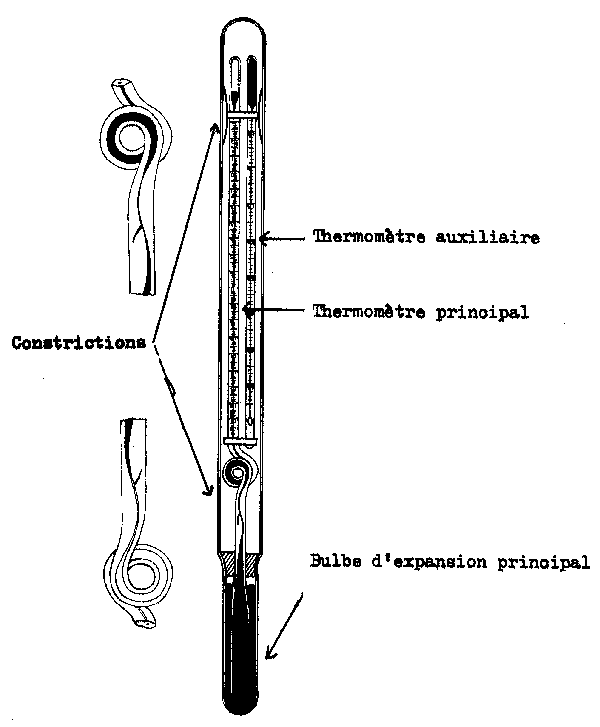
Fig. 7.2 Thermomètre à renversement (protégé contre la pression) et constrictions du tube capillaire
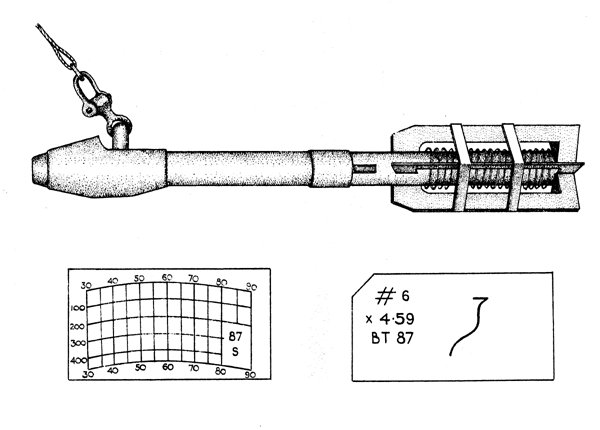
Fig. 7.3 Bathythermographe, grille de lecture enregistreur et enregistrement typique
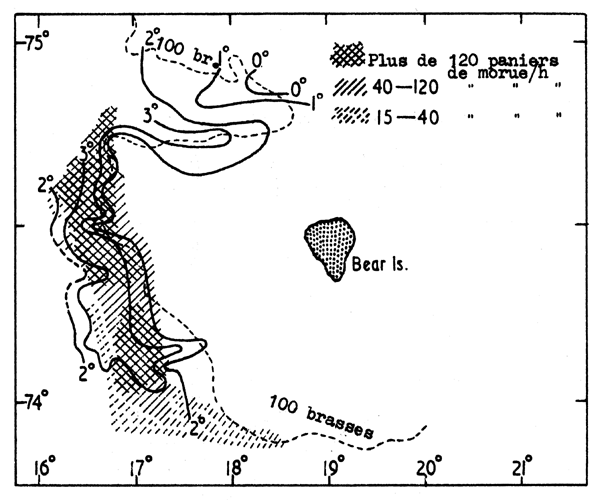
Fig. 7.4 Distribution de la morue et des températures de fond dans la zone de l'île aux Ours au début de l'été
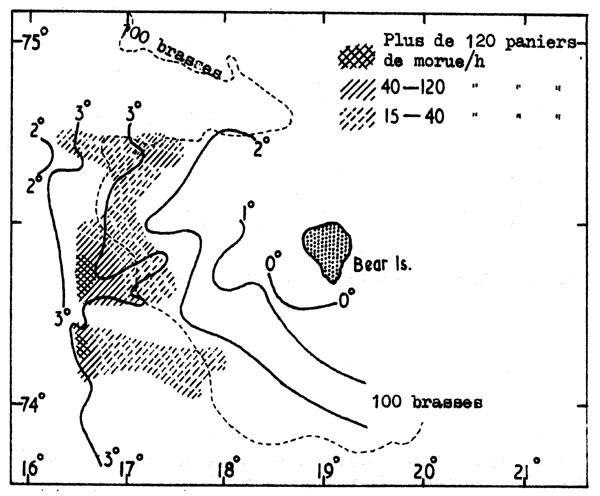
Fig.7.5 Distribution de la morue et des températures de fond dans la zone de l'île aux Ours plus tard dans l'été quand l'eau chaude s'est étalée vers l'est
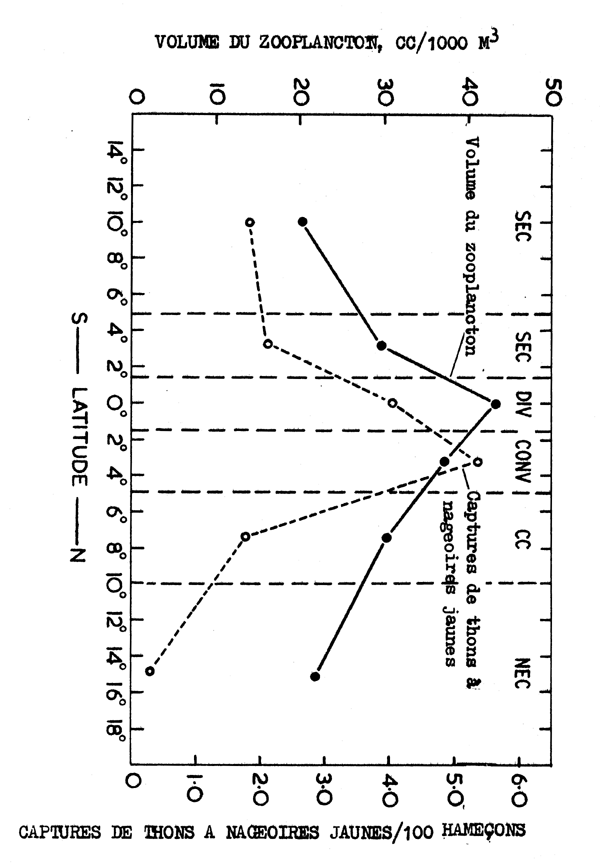
Fig. 7.6 Variations avec le système de courants des captures du thon à nageoires jaunes et du volume du zooplancton
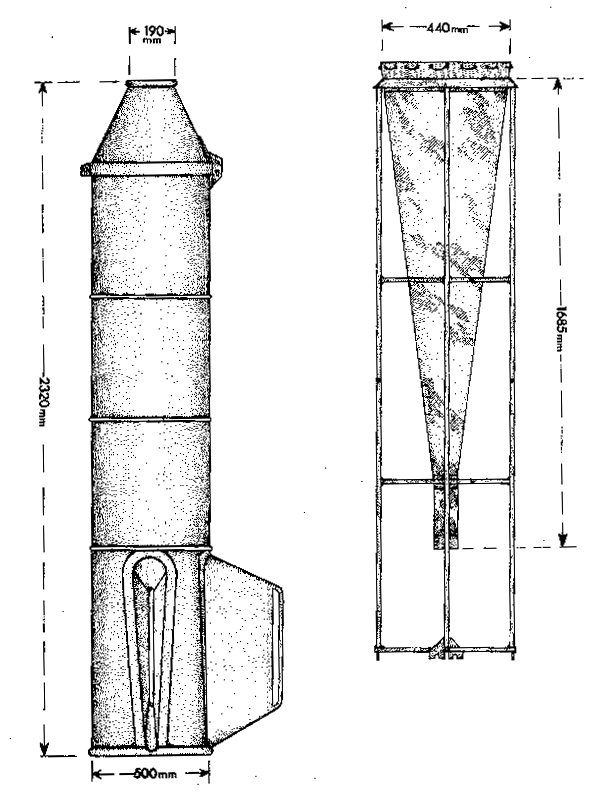
Fig. 7.7 Modification hollandaise de l'échantillinneur Gulf III
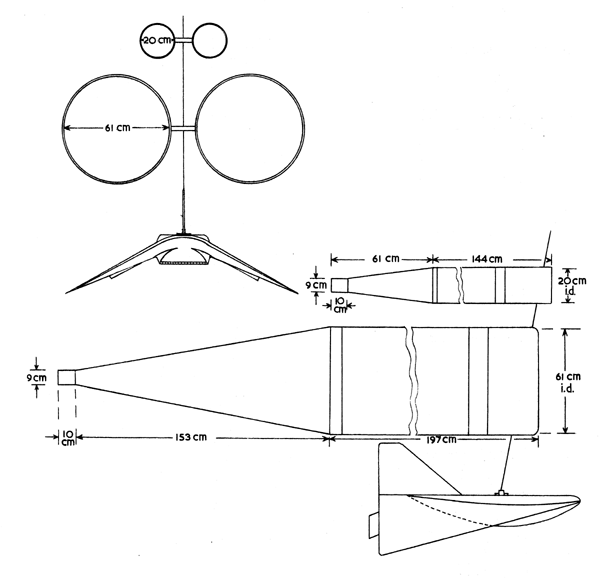
Fig. 7.8 Vue latéral d'échantillonneurs Bongo
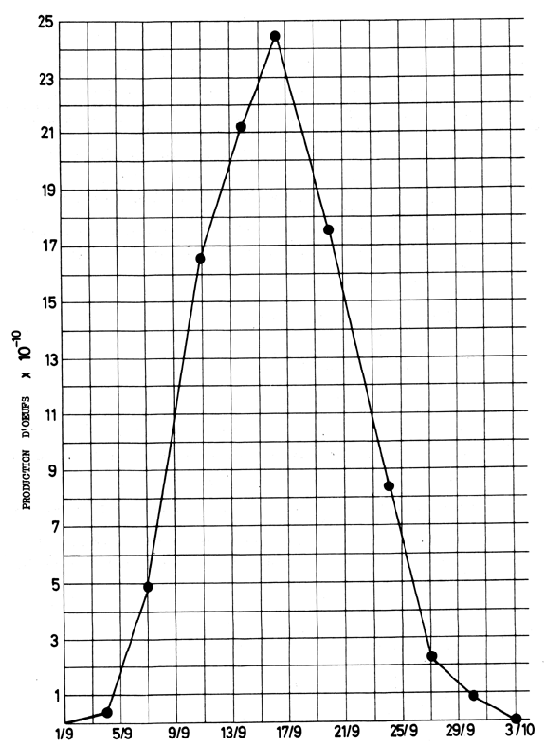
Fig. 7.9 Graphique de la production d'oeufs/temps pour l'étude des oeufs d'églefin
Cet exemple est extrait de Hydrographic Department Professional Paper No. 19, “Temperature and Salinity Measurements using reversing water bottles”, publié par l'Hydrographic Department, Ministry of Defense (Navy), Londres, 1967. Cette publication donne un compterendu point par point de la manière d'effectuer ces mesures.
T¹ = température lue sur le thermométre à renversement protégé = 3,40°C
t = température lue sur le thermométre auxiliaire = 19,5°C
Vo = volume du petit réservoir jusqu'à 0° sur le capillaire des thermométres à renversement protégés = 67°C
K = coefficient thermique des thermomètres à renversement protégés = 6100
I = indice de correction des thermomètres à renversement protégés = 0,07°C
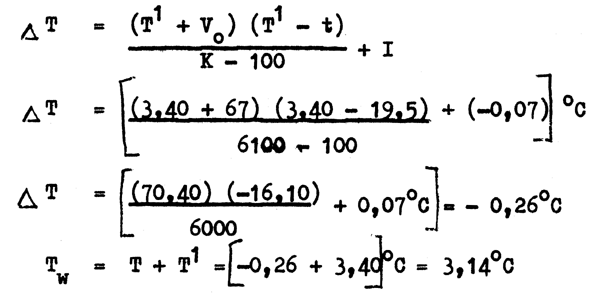
Tw = T + T¹ = [-0,26 + 3,40]°C = 3,14°C
C'est-à-dire, température réelle au point de renversement = 3,14°C
T¹u = température lue sur le thermomètre à renversement non protégé = 13,50°C
tu = température lue sur le thermomètre auxiliaire = 19,7°C
Vo = volume du petit réservoir jusqu'à 0°C sur le capillaire du thermomètre à renversement non protégé = 159°C
K = coefficient thermique du thermomètre à renversement non protégé = 6300
I = indice de correction du thermomètre à renversement non protégé = - 0,15°C
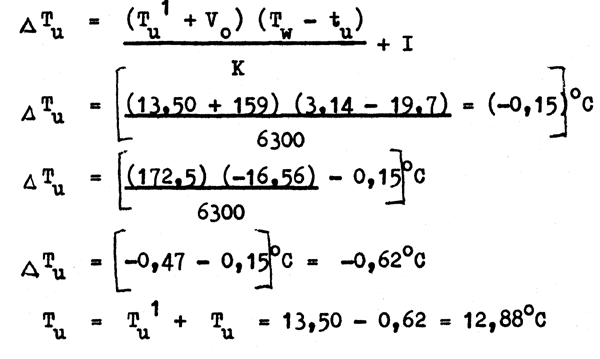
Tu = T¹u + Tu = 13,50 - 0,62 = 12,88°C
C'est-à-dire, la température réelle au point de renversement plus l'effet de la température est 12,88°C (= Tu).
Pour calculer la profondeur:
d = densité moyenne de l'eau de mer à la profondeur de renversement = 1,029
Q = coefficient de pression du thermomètre à renversement non protégé = 0,00954
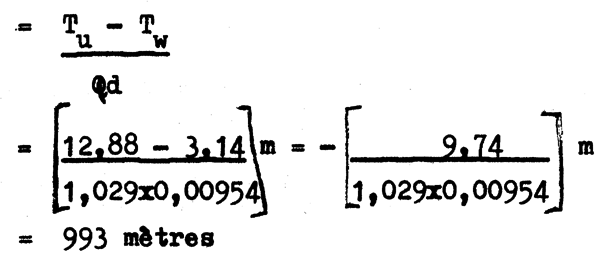
La profondeur réelle à laquelle le renversement a été effectué était 993 mètres au lieu des 1000 mètres indiqués par la poulie-compteur enregistrant la longueur de câble dévirée.