En las aguas corrientes de los principales cauces fluviales se encuentran dos categorías de pequeños animales: el verdadero zooplancton y los que componen la deriva orgánica. A menudo es muy difícil distinguir entre ambas y, en muchos casos, los organismos que las integran son muy similares. En las corrientes torrenciales y de orden inferior, la mayor parte de la deriva procede del arrastre de organismos acuáticos bentónicos y de insectos terrestres caídos de la vegetación inclinada sobre el agua o barridos hacia el cauce por la escorrentía de superficie. En los ríos mayores de flujo lento disminuye la importancia de estos organismos desalojados y arrastrados, aumentando proporcionalmente la importancia de un verdadero zooplancton. Kammeyn y Novotny (1977) identificaron cuatro componentes de la deriva orgánica en el río Missouri: i) materia orgánica en partículas (MOP); ii) macroinvertebrados; iii) larvas de peces; y iv) zooplancton. Las concentraciones de MOP y los detritos oscilaban entre 11 mg/m³ en los brazos fluviales, pasando por 783 mg/m³ en el borde del cauce principal, y 2331 mg/m³ en el cauce principal de tramos canalizados. Los tramos no canalizados tenían menos material: 18 a 135 mg/m³ en los brazos, 64 a 111 mg/m³ en los bordes del cauce y 111 a 505 mg/m³ en el propio cauce principal. Aunque la concentración de MOP puede aumentar en los tramos canalizados del Missouri, Morris el al. (1968) comprobaron una tendencia opuesta según la cual los valores medios de los organismos de la deriva en los tramos no canalizados eran de 1980 mg/m³, y sólo 230 mg/m³ en los tramos canalizados. Estas estimaciones indican que por un punto determinado del río pasan durante un día unos 526 kg de organismos a la deriva en un tramo no canalizado y 204 kg/día en un tramo canalizado. lgual que otros investigadores, Morris et al. concluyeron que la composición por especies de la deriva orgánica era muy distinta de la del bentos en los cauces de los grandes ríos y más parecida a la composición del “aufwuchs”, aunque alrededor del 20% del peso de la deriva correspondía a formas terrestres (alóctonas). La cantidad de organismos a la deriva aumentaba por la noche, con densidades que duplicaban a menudo las diurnas: anteriormente se ha descrito una acentuada periodicidad diaria de la deriva en muchos ríos templados (véase Hynes, 1970). También en aguas tropicales aumenta el número de organismos por la noche, y particularmente a la caída de la noche (Elouard y Leveque, 1977). La abundancia de larvas y peces juveniles en la deriva, que no presenta esa periodicidad, puede atribuirse en parte al movimiento río abajo de larvas y formas postlarvales vesiculadas, y en parte a la presencia de individuos que se alimentan de los organismos a la deriva.
No hay mucha información sobre el zooplancton en los ríos, en particular los tropicales, pero los estudios realizados indican que los factores que influyen sobre la densidad del zooplancton son análogos a los que influyen sobre el fitoplancton. La propia abundancia de fitoplancton es seguramente una de las principales circunstancias condicionantes, y es normal que después de una proliferación de fitoplancton venga una gran abundancia de zooplancton, como comprobó Bonetto (1976) en el río Paraná (Fig. 4.1).
Sin embargo, las variaciones en la abundancia de zooplancton se han atribuido básicamente a diferencias en el flujo de la corriente, desempeñando también un papel secundario otros varios factores como la turbiedad, la concentración de oxígeno disuelto y la conductividad. En regímenes normales de corriente, se encuentran sólo bajas densidades de zooplancton en los cauces principales de los ríos. Por ejemplo, en el río Mekong se han encontrado sólo unos 5 250 individuos/m³ de protozoos, crustáceos y rotíferos (Sidthimunkra, 1970). Rzoska (1974) hizo notar también las pequeñas cantidades de zooplancton encontradas en el Sudd, aunque Holden y Green (1960) habían observado números mayores de hasta 16 000 individuos/m³ en el río Sokoto. De hecho, hay considerables diferencias entre la fauna zooplanċtónica del cauce principal y la de las aguas lénticas de los brazos laterales y de la zona inundable, y el zooplancton de las aguas tanto lóticas como lénticas fluctúa en abundancia según las estaciones. Mientras que en el río Paraná superior se encontraron sólo 1 000 individuos/m³ de zooplancton con aguas altas, había 10 000 individuos/m³ con aguas bajas. Análogamente en el Nilo Azul en Jartum había crustáceos planctónicos a razón de unos 20 000 individuos/m³ durante los períodos de flujo moderado, pero su número crecía hasta 100 000 individuos/m³ con aguas bajas (Talling y Rzoska, 1967). En el Sudd del Nilo las densidades eran también más altas en la estación seca (media de 4 460 individuos/m³ en cuatro lugares) que en la húmeda (media de 2 070 individuos en los mismos lugares). La abundancia de zooplancton en los ríos de la zona templada puede ser estacionalmente alta en comparación con la de las aguas tropicales, como en el Danubio donde Enaceanu (1964) registró sólo 550 individuos/m³ en invierno, que se elevaron a más de 1 millón de individuos/m³ en la cúspide de septiembre. Esta superabundancia de organismos puede haberse debido al enriquecimiento de las aguas del Danubio con contaminantes domésticos e industriales, pero no hay duda de que, si las condiciones del flujo fuesen desfavorables, no habría ocurrido ese fenómeno.
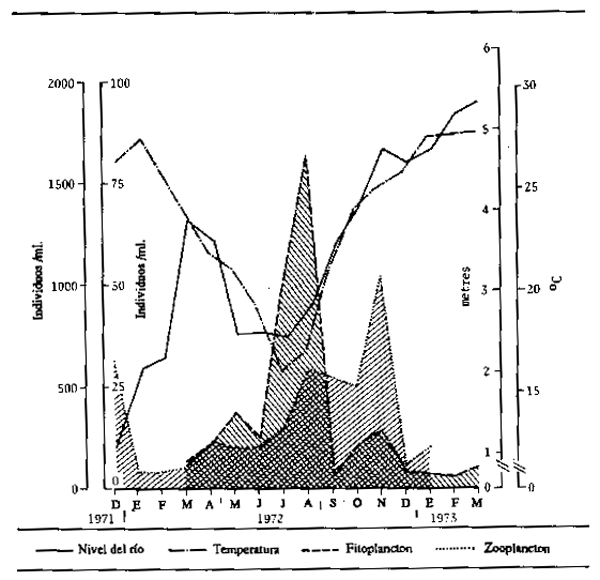
Figura 4.1 Variaciones en la abundancia de fitoplancton y zooplancton en el río Paraná en función de la temperatura y del nivel del agua. (Según Bonetto, 1976)
El zooplancton es mucho más común en las charcas y los remansos de la zona de anegamiento, donde su abundancia por unidad de volumen suele estar en relación inversa con la cantidad de agua del sistema. Vranovsky (1974), por ejemplo, encontró que la biomasa media de zooplancton era de 14 a 15 veces mayor en el brazo lateral Baka del Danubio que en la corriente principal (media de 6,75 g/m³ durante dos años en el río). Durante los períodos de flujo lento o detenido, había biomasas muy acrecidas, especialmente en los brazos laterales aislados, donde se registraban valores de hasta 30 veces superiores a los del río principal. Análogamente Sidthimunka (1970) pudo registrar 131 000 individuos/m³ en el río Mong, mientras que sólo había unos 5 000 en la corriente principal del Mekong. También en las aguas estacionarias de las zonas tropicales de anegamiento es general la tendencia a aumentar las concentraciones de organismos en la estación seca, como ocurre con el fitoplancton. No obstante, igual que en el caso del fitoplancton, el descenso en la densidad relativa puede deberse únicamente a un efecto de dilución, siendo en realidad mayor en la estación húmeda que en la seca el número de organismos existentes en el llano anegado. Bonetto (1975) comprobó aumentos en el zooplancton por unidad de volumen incluso durante las crecidas del Paraná, aunque en otros lugares del sistema se registraron los valores más bajos durante el mismo período (Bonetto y de Ferrato, 1966). Los aumentos en la diversidad específica tienen lugar a menudo simultáneamente con aumentos en números absolutos. Los ríos expuestos a acusadas variaciones térmicas anuales tienden a tener cúspides de abundancia de zooplancton en los meses de primavera y verano (Bonetto y de Ferrato, 1966; Bonetto, 1975), o en la primavera y el otoño (Ertl, 1966; Osmera, 1973), que no siempre coinciden con el período de estiaje. La abundancia de organismos varía, y considerables números se encuentran ocasionalmente en los lagos permanentes. En los Cuadros 4.1 y 4.2 se presenta un resumen de las estimaciones sobre la abundancia de zooplancton en aguas estacionarias de las zonas de anegamiento.
| Río | Biomasa g/m³ | Autoridad | |
|---|---|---|---|
| Danubio: | |||
Dyje: | |||
| Localidad 1 | 2.0-4.6(471.6 máx.) | Osmera,1973 | |
| Localidad 2 | 7.75 | ||
| Localidad 3 | 7.5 | ||
Baka: | |||
| Brazos laterales | 6.75 (media de 2 años) | Vranovsky, 1974 | |
| Amazonas: | |||
Lago Redonod | 1.61 | Marlier,1968 | |
| Nilo Sudd: | |||
Aljab | 0.002-0.001 | Monakov,1968 | |
Shambe | 0.002-0.40 | ||
Jor | 0.021-0.049 | ||
No | 0.138-0.107 | ||
Atar | 0.246 | ||
| Magdalena: | 0.92(media de 4 lagunas, abril) | ||
| 1.95(media de 5 lagunas, junio) | Mikkola y Arias, 1976 | ||
| 1.53(media de 6 lagunas, agosto) | |||
El flujo se hace también más lento cuando el agua queda remansada tras una presa, de manera que las concentraciones de zooplancton alcanzan altos niveles en los embalses así formados. Esta elevada concentración de organismos da lugar a que el zooplancton sea muy denso en el punto de descarga del embalse, disminuyendo gradualmente aguas abajo. Dzyuban (en Mordukhai-Boltovski, 1979) pudo comprobar que la regulación del flujo a raíz de la construcción del embalse de Volgograd había producido grandes cambios en la composición y la abundancia del zooplancton en el Volga superior, que dependen ahora del zooplancton descargado desde el embalse, junto con la tendencia del río a restaurar un tipo reofílico de comunidad. La abundancia de zooplancton disminuye así aguas abajo del punto de descarga. Cambios similares han ocurrido en el delta, principalmente por el descenso del volumen general de agua y la supresión de la crecida de primavera. Las elevadas concentraciones de zooplancton eran mucho más comunes en las charcas de la llanura del delta superior, donde las especies con alta capacidad de reproducción partenogenética llegaban a 3 g/m³. La vida de estas charcas se ha acortado y pueden haber desaparecido, con la consiguiente reducción de la masa total de zooplancton. En cambio, un aumento de la vegetación emergente ha proporcionado hábitats favorables para las formas fitofílicas, perifíticas y bentónicas. Extensos trabajos realizados sobre el zooplancton del Nilo revelaron cambios análogos por debajo de las diversas presas. Por ejemplo, los datos de Brook y Rzoska (1954) sobre el plancton fluvial por encima y por debajo de Gebel Aulia pusieron de manifiesto un cambio, predominando los copépodos del lago y los cladóceros aguas abajo de la presa. Al añadirse los embalses de Roseires y Aswan, el Nilo ha quedado sometido a una regulación múltiple que lo ha convertido en un sistema de cascadas en el que la comunidad de zooplancton ha evolucionado desde una fauna dominada por especies fluviales a una más típica de los sistemas lacustres. En el bajo Nilo por debajo de la presa de Aswan, la densidad de zooplancton variaba entre 12 000 y 133 000 individuos/m³, observándose un aumento más o menos constante de la densidad aguas abajo. Desde que se cerró la presa, este tramo fluvial inferior se ha convertido en una masa hídrica semiléntica.
| Río | Número de individuos/m³ | Observaciones | Autoridad | |
|---|---|---|---|---|
| Danubio: | ||||
Laguna Erec | 110 000 | Mínimo: diciembre | Ertl, 1966 | |
4 006 000 | Máximo: abril | |||
Laguna Husie | 616 000 | Mínimo: febrero | ||
8 493 000 | Máximo: junio | |||
Dyje: localidad 1 | 10 000 | Mínimo: febrero | Osmera, 1973 | |
500 000 | Máximo: mayo-julio | |||
localidad 2 | 2 000 | Mínimo: crecida de primavera | ||
10 000 000 | Máximo: junio | |||
| Missouri: | ||||
Remansos | 6 670 | Media: abril-Octubre | Kallemeyn | |
| y Novotny, 1977 | ||||
| Dvina: | 247 999 | 400 000 | Zhadin y Gerd, 1970 | |
| Oka: | 950 000 | Primavera | ||
1 281 000 | Verano | |||
| Paraná: | ||||
Laguna Don Felipe | 17 000 | Mínimo: junio | Bonetto y De Ferrate, 1966 | |
1 200 000 | Máximo: octubre | |||
Laguna Los Espejos | 26 000 | Mínimo: julio | ||
277 000 | Máximo: diciembre | |||
Laguna Flores | 12 000 | Mínimo: enero | ||
830 000 | Máximo: septiembre | |||
Laguna Totoras | 80 000 | Mínimo: aguas menguantes | ||
| noviembre | Bonetto et al., 1948 | |||
930 000 | Máximo: crecida | |||
| agosto | ||||
Laguna González | 6 330 000 | Mínimo: aguas menguantes | ||
| octubre | Bonetto et al., 1948 | |||
24 000 000 | Máximo: estiaje | |||
| diciembre | ||||
Laguna La Brava | 536 000 | Mínimo: crecida | ||
| mayo | Bonettoet al., 1948 | |||
761 000 | Máximo: estiaje | |||
Laguna Sirena | 12 000 | Mínimo: estiaje | CECOAL, 1977 | |
536 000 | Máximo: crecida | |||
| Magdalena: | ||||
Los Ponches | 5 380 000 | Máximo: estiaje | Arias, 1977 | |
Machado | 4 360 000 | Máximo: estiaje | ||
Pinalito | 25 300 | Máxima: estiaje | ||
| Sokoto: | 27 000 | Máximo: estación seca | Holden y Green, 1961 | |
| Mekong: | ||||
Pantano Nong pla pak | 38 500 | Muestra aleatoria | Sidthimunka, 1970 | |
Ríos Ping y Nan | 136 234 | Caudal efluente | Junk, 1976 | |
Bung Borapet | 122 279 | Caudal afluente | ||
| Amazonas: | ||||
Lago Preto de Eva | 738 000 | Media | Marlier, 1967 | |
Lago Calado | 107 087 | Junk, 1976 | ||
| Nilo: | ||||
Laguna Aljab | 180 | Enero | Monakov, 1968 | |
3 000 | Mayo | |||
Laguna Shambe | 600 | Febrero | ||
3 000 | Mayo | |||
Laguna Jor | 2 700 | Febrero | ||
12 400 | Mayo | |||
Laguna No | 8 000 | Febrero | ||
53 000 | Mayo | |||
Laguna Atar | 59 000 | Abril | ||
a Estas cifras se basan a menudo en pocas observaciones, por lo que no reflejan necesariamente todas las variaciones de los parámetros medidos.
Kallemeyn y Novotney (1977) concluyeron también que el zooplancton disminuía aguas abajo de los principales embalses del río Missouri, donde la presencia de zooplancton está en estrecha correlación con la descarga de los ríos Lewis y Clark. Hesse et al. (1982) documentaron un descenso del 51% en la abundancia de organismos 16 km más abajo del punto de descarga, del 61% a 38 km y del 70% a 145 km. Elevadas concentraciones de zooplancton proceden también de la introducción en el cauce principal del río de organismos procedentes de regajos y remansos. En el Missouri se han acumulado así mayores cantidades en los tramos no canalizados del río, donde había 6 670 individuos/m³ en los remansos, 12 110 individuos/m³ en regajos, 10 864 individuos/m³ en el cauce principal junto a la orillas del río y 12 245 individuos/m³ en el propio cauce principal. Se registró una abundancia máxima en mayo con 370 mg/m³ cuando las lluvias desbordaron de los remansos, disminuyendo a menos de 20 mg/m³ en invierno. Vranovsky (1974) observó el mismo fenómeno en el Danubio, donde los valores máximos de la biomasa de zooplancton (300–600 mg/m³) correspondieron a otoño y la cantidad media de zooplancton a la deriva que pasó por un punto determinado llegó a ser 260 g/s en 1967 gracias a la aportación de organismos de los brazos laterales.
Las variaciones estacionales repentinas de los números totales de zooplancton parecen deberse sobre todo al aumento de rotíferos, aunque los otros componentes principales del zooplankton, los copépodos y los cladóceros, tienen también floraciones características. Los nauplios son comunes, y con frecuencia son arrastrados de las aguas estacionarias hacia el cauce principal durante las crecidas. Los rizópodos han sido también señalados como elemento importante del plancton en esa época (Holden y Gree, 1960; Gree, 1963).
Se ha encontrado alguna correlación entre la conductividad y los números de zooplancton en la vegetación que flanquea el cauce principal del río Zambeze, donde tanto la conductividad como los números de zooplancton (110 000 cladóceros y copépodos por m³) alcanzaban sus máximos durante la estación seca. Ambos parámetros eran mínimos durante las crecidas máximas, cuando el zooplancton estaba casi por completo ausente.
La vegetación parece también decisiva, y el número de organismos zooplanctónicos suele encontrarse en aguas que tienen por lo menos alguna vegetación (Bonetto, 1975). Su densidad aumenta asimismo en o cerca de la interfaz agua/vegetación, bajo las alfombras de vegetación flotante y en asociación con las plantas sumergidas. Esto implica que hay una sucesión de organismos planctónicos dentro de las aguas estacionarias de la zona de anegamiento que corresponde a la evolución general de esas masas hídricas, desde las aguas de superficie libre hasta las de densa vegetación, según el análisis hecho por Botnariuc (1967). Los estudios comparativos que demuestran esto son pocos, aunque Green (1972 y 1972a) ha demostrado tal sucesión en los lagos de la llanura inundable del río Suiá Missú en Brasil. Como las zonas con vegetación son en general más productivas que las aguas de superficie despejada, puede suponerse una evolución comparable en la productividad por unidad de superficie. Sin embargo, esto se compensaría con la disminución del tamaño de cada masa hídrica al pasar, por entarquinamiento, de la situación de agua despejada a la de pantano. Los trabajos realizados por Ertl (1966) sobre las lagunas danubianas y por Novotna y Korinek (1966) sobre la zona de anegamiento del Elba revelan que la densidad de la población influye sobre la composición y la abundancia del zooplancton. Lamentablemente, faltan estudios detallados sobre interrelaciones ecológicas de esta índole en las lagunas tropicales, aunque cabe suponer que se dan allí relaciones similares.
Suele considerarse que las densidades de zooplancton son bajas en las principales masas de agua de la llanura, pero que las aguas someras litorales de la parte anegada pueden contener cantidades considerables de formas planctónicas. Los mayores niveles de conductividad y temperatura y la disponibilidad local de oxígeno pueden estimular floraciones de zooplancton que pueden observarse bien en los bordes del agua. Es de lamentar que exista poca información cuantitativa en apoyo de esta observación, pues estas zonas han sido relativamente poco investigadas; pero los elevados valores del zooplancton de las aguas remansadas del Danubio en Baka y Dyje que se recogen en los Cuadros 4.1 y 4.2 pueden atribuirse al hecho de que esas masas hídricas son de índole principalmente litoral (profundidad inferior a 1,5 m) y tienen una considerable vegetación sumergida. Comparando las zonas litoral y pelágica de las aguas remansadas, Osmera (1973) constató que la biomasa media de la zona litoral era 7,75 mg/l en comparación con 1,64 mg/l en la zona pelágica de la misma laguna.
Las condiciones adversas de la crecida plantean ciertos problemas de supervivencia para los organismos planctónicos que son fácilmente arrastrados y barridos por la fuerza mayor del flujo. No obstante, los organismos zooplanctónicos reaparecen rápidamente cuando se restablecen modelos más favorables de flujos suaves. Este hecho se ha atribuido a la existencia de reservas de organismos en hábitats situados aguas arriba, pero Moghraby (1977) consideró que los 50 a 100 organismos/m existentes en las charcas laterales del Nilo Azul eran insuficientes para servir de fuentes para la regeneración de la población. En cambio, demostró que los adultos o los huevos de muchas especies entran en una diapausa al descender las temperaturas y al aumentar las concentraciones de limo durante la primera fase de la crecida. Encontró abundantes reductos de individuos en diapausa en varios tipos de depósitos en el fondo del agua y comprobó experimentalmente que salían de ese estado únicamente cuando descendían las concentraciones de limo y se elevaban las temperaturas hasta los niveles normales de la estación seca.
La vegetación flotante sirve de sustento para ricas y variadas comunidades animales, sea como mesofauna que vive libre en el agua entre los tallos de las plantas, sea como epifauna en las masas de raíces de las plantas flotantes (pleuston). Los estudios más detallados al respecto son los relativos a las masas de raíces de los prados flotantes de Paspalum repens y Echinochloa polystachya en el sistema amazónico, donde se identificaron muchas especies de crustáceos, ninfas de insectos, oligocetes y moluscos. Junk (1973a) distinguió tres biotopos principales según la ninfas y la flora. El primero de ellos -el biotopo de aguas blancas corrientes- consiste en los rodales de vegetación que bordean el cauce principal del río. La densidad de la fauna sobre el borde exterior expuesto es baja, posiblemente a causa de la corriente que arrastra a los organismos y de las grandes cantidades de sedimentos inorgánicos que obstaculizan la alimentación. La densidad de la fauna crece al pasar del borde al centro del rodal o alfombra flotante, pudiendo llegar hasta 100 000 individuos/m², aunque la norma es en torno a 50 000 individuos/m². La biomasa aumenta de un peso en seco de 0,3 g/m² (peso en húmedo 1,5 g/m²) en los bordes a un peso en seco de 4,2 g/m² (peso en húmendo 20 g/m²) en lugares abrigados en el interior del rodal. Un segundo biotopo -lagunas de aguas blancas sedimentadas bien oxigenadas- experimenta fluctuaciones anuales de nivel bastante amplias que destruyen periódicamente la vegetación acuática. Durante los períodos de crecimiento óptimo aparecen gran número de individuos, normalmente en el orden de 100 000 a 300 000/m², aunque se han registrado densidades de hasta 700 000/m². La densidad de la fauna se distribuye de manera uniforme y la biomasa varía entre 2,5 y 11,6 g/m² de peso en seco (peso en húmedo, 12 a 62 g/m²). Marlier (1967) encontró valores similares de 3,9 a 13,9 g/m² en seco (18,9 a 39,7 g/m² en húmedo) en tres muestras de vegetación flotante en otro lago de este tipo. El tercer biotopo -lagos de aguas blancas sedimentadas- tiene espesos rodales de vegetación con poco o ningún oxígeno disuelto. Los regímenes hídricos son más estables que los del anterior tipo de laguna. En la zona periférica de las masas de vegetación, la abundancia de fauna es aproximadamente la misma que en el lago bien oxigenado, pero varios grupos de organismos desaparecen rápidamente por la escasez de oxígeno, y la densidad es muy baja (0,16 a 0,29 g/m² en seco) incluso sólo a pocos metros del borde exterior.
Esta comunidad es también muy importante en el Paraná medio, donde la abundancia y la densidad de Eichhornia, Pistia, Salvinia y Azolla ofrece un sustrato para la muestra (Bonetto, Dioni y Pignalberi, 1969). Como ejemplos, Bonetto et al., (1978) encotraron 17 000 individuos/m² de moluscos, oligocetes, sanguijuelas, ácaros, crustáceos e insectos en Salvinia herzogii durante el verano (época de aguas altas) y 9 200 individuos /m² durante el invierno en la laguna La Brava del alto Paraná; Varela et al. (1978) describen en detalle las asociaciones de flora y fauna en las islas flotantes o “embalsados” de la misma laguna; el CECOAL (1977) encontró un valor máximo de 20 000 individuos/m² en verano, bajando a 4 000 individuos/m² en invierno para la Azolla y la Pistia. También en el sistema del Paraná se encontraron más de 100 grupos (especies o géneros) en las masas estoloníferas sumergidas de Eichhornia (Poi de Neiff y Neiff, 1980), donde se observaron también cambios estacionales en el predominio de organismos y diferencias entre la fauna asociada a las plantas en el río y en la laguna. Los máximos llegaron aquí a 262 000 individuos/m² dentro del complejo Paspalum repens/Salvinia herzogii (Poi de Neiff, 1981). También en América Latina, Zárate y Cubides (1977) encontraron una gama de biomasas de 6,56 a 130,7 gm/m² de peso en húmedo (media de 35,14 g/m²) en 17 estaciones sobre lagunas en el sistema del Magdalena. Los autores identificaron 67 grupos de invertebrados en las masas de raíces de Eichhornia. Similares distribuciones de organismos se han comprobado en los pantanos africanos de papiros, donde la zona próxima a la interfaz con el agua despejada se consideró como el hábitat más rico del sistema (Rzoska, 1974). Se han encontrado muchas especies de oligocetes, briozoos, protozoos, crustáceos, insectos y moluscos entre los papiros, carrizos, Echinochloa y Eichhornia del Nilo Sudd (Monakov, 1969). Pocas muestras cuantitativas se han tomado en este hábitat, pero con una red de estanque se capturaron en 5 minutos hasta 547 crustáceos (Rzoska, 1974). Monakov (loc. cit), quien intentó también cuantificar la biomasa de Entomostraca, encontró que la orilla era de 10 a 100 veces más rica que el agua despejada del Sudd.
Petr (1968) encontró entre 5 000 y 16 000 individuos/m² en las raíces de Pistia en el lago Volta. En el Sudd, Rzoska (1974) halló hasta 300 unidades animales por planta de Pistia, aunque las densidades aumentaban en los tramos tranquilos del río, sobre todo en los pantanos, alcanzando el máximo en las lagunas fluviales. Shepherd (1976) observó pocos individuos en la vegetación flotante de la laguna Bangula, donde había una media de 388 unidades de insectos, oligocetes, crustáceos y moluscos por metro cuadrado de Nymphaea, encontrándose una congregación análoga de 210 individuos/m² en la Pistia.
El peso de los animales asociados a las raíces de Eichhornia es también elevado en las ciénagas del río Magdalena, donde Kapetsky et al. (1977) comprobaron una media de 35,1 g/m² en 17 lugares de muestra de 10 masas hídricas diferentes. Los valores variaron entre 6,9 y 130 g/m².
Las investigaciones sobre la vegetación sumergida en dos lagos del delta marítimo del Danubio revelan las considerables diferencias que puede haber en las densidades de fauna según la distribución de las plantas de apoyo. En el lago Porcu, el Ceratophyllum demersum cubre alrededor del 64% del fondo y la Nitellopsis obtusa alrededor del 4%, mientras que en el lago Rosu el fondo está ocupado por C. demersum en el 14% y por N. obtusa en el 53%. Ambas plantas forman un tipo similar de sustrato y acogen especies similares de oligocetes, tricópteros y quironómidos; sin embargo, en el lago Porku las cantidades totales de 1,8 kcal/m² (0,36 g/m²) en mayo y 93,4 kcal/m² (18,7 g/m²) en agosto son superiores a las del lago Rosu, 2,2 kcal/m² (0,44 g/m²) en mayo y un máximo de 18,7 kcal/m² (3,74 g/m²) en junio. Las diferencias en la biomasa se han atribuido a la mayor densidad de organismos soportados por el Ceratophyllum (lzvoranu, 1982).
Una comunidad particular se ha identificado en las umbelas del Cyperus papyrus (Thornton, 1957). Consiste principalmente en formas terrestres cuya vida transcurre en este hábitat especial, pero que contribuyen al suministro alimentario alóctono de las aguas pantanosas.
Hynes (1970) ha revisado la bibliografía sobre el bentos fluvial y ha concluido que elementos similares de la fauna de sustratos duros son comunes a los ríos y las corrientes de agua de todo el mundo. La fauna bentónica de los rabiones y los tramos pedregosos es más rica que de los tramos cenagosos y las charcas del ritrón, tanto en número de especies como en biomasa total. Las comunidades de los ríos soviéticos se han clasificado sobre la base del sustrato y de la velocidad de la corriente de la siguiente manera (Zhadin y Gerd, 1970):
— Comunidades litorreófilas que habitan sobre sustratos sólidos en aguas corrientes y consisten principalmente en grandes insectos.
— Comunidades psamorreófilas que se asientan en lechos arenosos en aguas corrientes y consisten en pequeños atrópodos y protozoos que viven en los intersticios de la arena.
— Comunidades argilorreófilas que habitan en sustratos arcillosos y son principalmente sésiles o excavadoras.
— Comunidades pelorreófilas que viven en el limo en aguas corrientes.
— Comunidades pelófilas que se encuentran en el limo en aguas estancadas.
— Formas fitófilas que viven en los remansos ricos en plantas.
La fauna bentónica, por lo general, se desarrolla mejor en fondos estables. En los fondos móviles, las larvas de insectos sésiles con sus estructuras de conductos o tejidos sensitivos son fácilmente desplazados, como lo son igualmente los moluscos movientes. Otras formas móviles como Asellus o Gammarus están también expuestas a los riesgos de daños mecánicos.
Se ha concluido pues que la biomasa está estrechamente relacionada con el tipo de comunidad. En el Dniéper, por ejemplo, los litorreófilos tenían una masa estable de alrededor de 1 kg/m², los pelorreófilos de unos 10 g/m² y los psamófilos en torno a 1 g/m², aunque pelófilos aislados en lagos desconectados llegaban a más de 100 g/m².
En el Danubio, las comunidades pelorreófilas (con 16,5 a 99,2 g/m²), psamopelorreófilas (con 22,7 a 69,2 g/m²) y argilorreófilas (con 71,6 g/m²) tenían todas biomasas considerablemente superiores a la de la comunidad psamorreófila.
Russev (1967 y 1981) ha descrito también la distribución de la biomasa según el lugar y el tipo de fondo en el Danubio, con valores medios de 72,5 g/m² sobre lecho de hojas, 47,4 g/m² sobre barro, 26,4 g/m² sobre arcilla y 0,24 g/m² sobre arena, que es un sustrato mucho menos estable. Por otra parte las velocidades del agua superiores a 2 a 3 m/s inhiben el desarrollo del bentos en el centro del cauce, haciendo que se concentre principalmente en las zonas protegidas de cantos rodados del litoral (Russev, 1982). La biomasa media en los tramos búlgaros de río era de 35,22 g/m², de los cuales 34,21 g/m² eran moluscos. Valores medios similares de 38,9 g/m² (total) y 34,21 g/m² (moluscos) se obtuvieron en otoño. La biomasa por unidad de superficie varía considerablemente según el nivel del agua. La biomasa media (con moluscos) era sólo de 0,76 g/m² con aguas altas (abril-agosto), mientras que con aguas medias era de 1,94 g/m² y con aguas bajas 6,34 g/m². Los valores mucho más elevados obtenidos al retirarse las aguas se atribuyeron al desalojo y transporte río abajo del bentos en épocas de fuerte crecida y a la dispersión de los organismos bentónicos sobre una extensa superficie durante la crecida.
En los ríos tropicales, Bishop (1973) ha escrito sobre la similitud de las comunidades reófilas en los bosques húmedos de Africa, Sri Lanka, Sudamérica tropical y río Gombak en Malasia. Los tramos bajos de los ríos tienen muchas características en común, pero se dispone de relativamente poca información sobre la fauna bentónica de los ríos de curso lento y cargados de limo que riegan los llanos inundables. Lo que se sabe es que hay en general una fauna pobre consistente en un número relativamente pequeño de especies, lo que concuerda con las conclusiones de Zhadin y Gerds sobre la escasa biomasa de pelorreófilos en los ríos rusos. Bonetto y Ezcurra (1964) llegaron a conclusiones similares a partir de observaciones sobre el río Paraná, estableciendo que la fauna bentónica disminuye en diversidad y abundancia a medida que la corriente es más lenta. Los valores máximos pueden llegar a más de 71 000 individuos/m² en la región de Yacireta, en comparación con 17 000 en Posadas, 23 000 en ltuzaingo y 13 000 en lta bate (CECOAL, 1979). Datos del Amazonas (Junk, 1971) revelan también que la fauna es pobre en el río principal, aunque los experimentos realizados con sustratos artificiales en los que se establecieron 12 900 individuos/m² en cuatro días revelaron que las poblaciones de los ríos de aguas negras son más numerosas de lo que se pensaba. Monakov (1969) concluyó también que la fauna del fondo es monótona en los cauces principales del Sudd, donde sólo pequeños grupos de quironómidos y oligocetes habitan en los fondos arenosos y fangosos. En general, la biomasa oscilaba entre 0 y 0,2 g/m², aunque Rzoska puso en duda esta conclusión en vista del escaso número de muestras tomadas. Más abajo, entre la presa de Aswan y el mar, el macrobentos está dominado por moluscos aunque hay también algunos policetes y oligocetes. Cuantitativamente, la biomasa varía entre 1 y 9 g/m³, elevándose al valor excepcional de 53,61 g/m³.
Diferencias en la composición por especies se han comprobado también en algunos ríos. Por ejemplo, la fauna de moluscos del Níger consta principalmente de abundantes Aetheria elliptica, Aspatharia, Mutela dubia y Viviparus unicolor en los tramos fangosos, en contraste con raros individuos de Corbula fluminialis, Mutela rostrata, Caelatura aegyptica y Cleopatra bulminoides en los tramos arenosos (Blanc et al., 1955). Amplias congregaciones de moluscos bivalvos existen también el el Volga, el Dniéster, el Dniéper y el Don. En el Volga, la Dreissena contribuye a la producción local con varios kg/m². Por lo demás, el bentos del río es pobre en el cauce principal. También se ha documentado una biomasa bentónica considerable de 400 g/m² en los muchos tributarios del Mekong (Sidthimunka, 1970), que se debía igualmente, casi por completo, a una concentración de moluscos.
En el río Missouri no hay datos sobre las poblaciones bentónicas antes de la construcción de los embalses, pero los estudios de Morris et al. (1968) indican que hay relativamente poca diferencia en la biomasa bentónica por unidad de superficie entre los tramos canalizados y los no canalizados. En el primer caso, la biomasa media se calculó en 0,08 g/m², y en el segundo en 0,07 g/m². Estas medias, sin embargo, ocultan considerables variaciones según los lugares, ya que dentro del río la biomasa variaba entre 0,019 (0,048) 0,99 g/m² en los tramos no canalizados del cauce principal, mientras que en los canalizados las variaciones eran de 0,002 (0,007) 0,002 g/m². En las orillas fangosas, la biomasa era más densa en los tramos canalizados con 0,058 (0,803) 2,678 g/m² que en los no canalizados en los que era 0,111 (0,267) 0,349 g/m². La escasez general de bentos se atribuyó a la naturaleza general del río Missouri, que tiene sustratos móviles, elevada carga de limo, niveles fluctuantes del agua y falta de vegetación acuática, todo lo cual actúa contra la elevada producción de organismos bentónicos. Sin embargo, en los sectores canalizados se operó una pérdida general del bentos al reducirse el espacio disponible para colonización en un 67% respecto a los tramos no canalizados. Anteriormente Berner (1951) había hallado valores similares entre 0,024 g/m² en medio del cauce y 0,258 g/m² más cerca del borde, y había señalado el contraste de los bajos valores del Missouri con los del lllinois, de flujo más lento, donde Richardson (1921) halló una media de 29,23 g/m² en una época en que el río tenía todavía sus lagos en la zona de anegamiento. Schramm et al. (1974) resumieron los datos sobre el bentos del Mississippi medio, que revelan diferencias similares entre tramos canalizados y no canalizados. Sobre esta base, subrayan la importancia de la zona del cauce para la producción bentónica.
La información obtenida sobre aguas remansadas y estacionarias de la zona de anegamiento apunta a la existencia de biomasas algo mayores que en el río principal. En las porciones rumanas de las llanuras inundables del Danubio se ha calculado una biomasa media de 20,06 ± 9,35 g/m² en 12 lagos (Academia Republicii Socialiste Romania, 1967), y en los lagos del delta del Volga se hallaron valores entre 7 y 48 g/m². Monakov (1969) documentó biomasas de zoobentos consistentes principalmente en oligocetes, quironómidos y moluscos entre 0,58 y 4,7 g/m² en cinco lagos de la zona de anegamiento de Sudd. Los valores medios de 2,95 g/m² para el período de aguas altas pero menguantes y 2,07 g/m² para las aguas bajas contrastan con 0 0,2 g/m² en el cauce principal. Las biomasa bentónicas citadas para los pantanos de Nong Pla Pak en la llanura del Mekong (Sidthimunka, 1970) eran del mismo orden, con 1,75 g/m² en una época en que la biomasa bentónica en el río principal era únicamente 0,12 g/m². Análogamente una media de 1,51 g/m² (campo de 0 a6,51 g/m²) de organismos bentónicos se encontró en las ciénagas del sistema del Magdalena (Mikkola y Arias, 1976). Aquí se halló una media de 1,9 g/m² en las aguas despejadas de las ciénagas, mientras que los hábitats más recogidos tenían una densidad media de 3,1 g/m². Arias (1977) encontró valoresde 1,76 ± 1,81 g/m² para las aguas despejadas de 18 ciénagas de este sistema, mientras que las zonas de ensenadas recogidas tenían valores de 2,96 ± 1,51 g/m². Estas variaciones de la biomasa se atribuyeron a las condiciones desoxigenadas de las aguas más profundas de las ciénagas.
La tendencia de las aguas litorales a soportar más bentos que las aguas más profundas ha sido confirmada por otros muchos investigadores. Bonetto et al. (1978) proporcionaron información detallada sobre la fauna bentónica de dos lagunas del río Riachuelo, tributario del sistema del Paraná. En la laguna Totoras, el bentos era máximo durante el período de estiaje, cuando los números totales pasaban de 114 000 individuos/m². En verano, durante las aguas altas, la densidad fue muy inferior, con 46 500 individuos/m². En esta laguna también había considerables diferencias entre las diversas zonas del lago, con la máxima abundancia en la zona sublitoral y la mínima en el centro. Análogas diferencias entre el litoral y las aguas despejadas por una parte y entre estaciones por otra se encontraron en la laguna González que, por su gran eutroficación, soportaba menos organismos. En la laguna La Brava, el mesobentos y el macrobentos contenían entre 17 500 y 95 300 individuos/m² en época de estiaje y 1 700 a 57 000 individuos/m² con aguas altas, según la situación en el lago. Particularmente significativas en esta masa hídrica eran las tecamebas, cuyos números pasaban a veces de 1,5 millones de células/m² con aguas bajas, y sólo 0,6 millones con aguas altas.
Tres lagunas temporales en la sabana inundable de Río Branco, al norte del Brasil, tenían pesos medios de bentos de 0,16 a 0,88 g/m². Había algunas variaciones según la profundidad, y las muestras arrojaron valores de hasta 2,52 g/m². Los 0,25 g/m² (peso en seco) obtenidos del Lago de Rodondo son congruentes con el orden de biomasa hallado en las lagunas, pese a la opinión de Marlier (1967) de que era un valor demasiado bajo. No obstante, se han documentado valores más altos para algunos lagos amazónicos: Fttkau et al. (1975), por ejemplo, hallaron un peso medio anual entre 0,14 y 6,20 g/m² de bentos, y los estudios realizados por Reiss (citado por Sioli, 1975) revelaron también biomasas de hasta 6,2 g/m² en el centro de los lagos de la várzea amazónica. En cambio, las muestras tomadas del lago Tupé, un lago fluvial típico, y de algunos lagos de várzea de aguas negras, llevaron a Reiss (1977) a concluir que la zona profunda de esas masas hídricas son las más pobres en fauna bentónica de todos los biotopos lacustres amazónicos. No obstante, los valores para la zona litoral son mucho más elevados, llegando a 104 g/m².
La gama de densidades en las lagunas de zonas de anegamiento africanas y latinoamericanas sugiere valores extremos que van de 0 a alrededor de 6 g/m² y valores medios de unos 2 g/m² para los ríos tropicales. Rzoska (1974), no obstante, consideró que los valores de esas zonas deben tratarse con cautela, ya que las emergencias cíclicas de efemerópteros. Chaoborus y quironómidos pueden influir profundamente sobre la vegetación arraigada y sobre la biomasa. Poblaciones localizadas muy densas de otros organismos pueden aparecer también cuando las condiciones son particularmente favorables. Botnaruic (1967), por ejemplo, observó densidades de moluscos de hasta 2 657 g/m² en aguas profundas del lago Crapina en la llanura danubiana. Los valores no suelen ser tan elevados, y Russev (1967) citó trabajos rusos sobre el brazo de Kiliya, de 8 580 km², en el delta del Danubio, donde la biomasa media era 9,45 g/m². En el mismo trabajo se indicaba una producción anual de 19 235 t (224, 19 g/m²) para la totalidad del brazo. El estudio de Lellak (1966) sobre el bentos de los remansos de Checoslovaquia puso de manifiesto la fuerte innfluencia de la presencia o ausencia de peces. Cuando éstos faltaban, las densidades de larvas de Chironomus y Chaoborus eran muy altas. Análogamente, Enaceanu (1957) comprobó que la biomasa bentónica era mayor en los recintos en que estaban excluidos los peces (226, 12 kg/hm² de media en julio-octubre) que en los fondos de acceso abierto a los peces (70,98 kg/hm² para el mismo período) en la misma laguna. En las charcas del llano donde la densidad y la composición de las poblaciones ícticas aisladas por el descenso de las aguas de crecida están expuestas a variaciones, pueden aparecer diferencias en el bentos como resultado de la diversidad de presiones predatorias. Aunque los autores antes citados han observado fluctuaciones estacionales en el bentos de las aguas estacionarias de la llanura, Bonetto (1975) consideró que estas comunidades eran las menos afectadas por las diferencias del nivel de agua entre todas las que viven en esos hábitats.
La vegetación sumergida, cuando existe, también actúa como centro de concentración para invertebrados bentónicos. El examen por la Academia Republicii Socialiste Romania (1967) de 1 550 g de Potomogeton perfoliatus, recogido en una superficie de 0,5 m², reveló la existencia de 10 489 individuos de larvas de insectos, crustáceos y moluscos. El peso total de 87,3 g equivalente a 175 g/m² es razonablemente elevado para la fauna bentónica de este sistema, que varía normalmente en torno a una media de 20 ± 9 g/m². Los valores en la laguna Bangula oscilaban entre 0,005 g/m² bajo Pistia, 0,06 g/m² en aguas despejadas, 0,378 g/m² en Ceratophyllum y 0,977 g/m² bajo Nymphae. Los números de individuos presentes en Ceratophyllum eran todavía relativamente bajos, 4 386 individuos/m², pero las densidades eran notablemente mayores que las encontradas en Nymphaea y Pistia. Importantes concentraciones de invertebrados, entre ellos ácaros, caracoles y especies fitófagas de insectos y moluscos, estaban presentes en Egeria naias de la laguna Totoras, donde había en invierno 10 000 individuos y en verano 320 000 por 1 000 g de planta.
En la llanura inundable propiamente dicha, donde se produce una desecación estacional, las poblaciones de macroinvertebrados en la época de crecida están menos estudiadas. Observaciones personales han revelado enormes densidades de caracoles pulmonados en el fondo y en la superficie del agua de las zonas inundadas. Carey (1967 y 1971) comprobó la gran abundancia y la amplia distribución de ninfas de efemerópteros, larvas de tricópteros, larvas de quironómidos, hemípteros y moluscos en las zonas inundadas del río Kafue, especialmente en los bajíos sumergidas de Najas y Ceratophyllum. La profusión de moluscos en la zona de anegamiento se ha observado también en el delta central del Níger (Blanc et al., 1955). En el río Paraná, Bonetto, Dioni y Pignalberi (1969) señalaron el limitado número de especies que contribuían a la biomasa total. Particularmente abundantes eran las unionáceas, que aportaban la contribución más importante, pese al bajo contenido de calcio y al nivel relativamente bajo de pH. El hecho de que los moluscos puedan contribuir significativamente al bentos en estas condiciones se confirma por su presencia en las aguas negras amazónicas. Algunas de éstas, no obstante, son tan pobres en minerales que sólo se encuentran pequeños ferrisidas con caparazones de conchiolina (Fittkau, 1967).
En las selvas amazónicas inundadas con aguas blancas, los organismos bentónicos son comunes y tienen dos cúspides de producción, una al empezar la inundación y la segunda después de las máximas crecidas en junio-julio. Los trabajos de Reiss (1977) sobre las aguas negras del lago Tupé pusieron también de manifiesto dos cúspides de abundancia para el bentos litoral. Una tenía lugar al subir las aguas, cuando se anotaron 2 559 individuos/m², y la segunda con aguas bajas, con una presencia de 1 248 individuos/m². Las densidades mínimas durante el descenso de las aguas fueron de unos 623 individuos/m². La composición de la fauna cambiaba por completo entre las cúspides de aguas mínimas y de crecida. En el estiaje, los quirómidos dominaban la fauna, con una representación menor de oligocetes, ácaros y corixídeos. Durante las crecidas, los Chaoboridae y los Ostracoda adquirían rápidamente importancia a expensas de los otros grupos. De todas maneras, las selvas de lgapó inundadas por aguas negras quedan en general muy empobrecidas; Irmler (citado por Sioli, 1975) encontró una masa bentónica de sólo 0,2 g/m² en esa zona.
En las zonas de rápida fluctuación del nivel hídrico que están expuestas a desecación estacional, es evidente que deben existir mecanismos para sobrevivir a la estación seca. Fittkau et al. (1975) consideraron tres mecanismos posibles: migración, letargo y recolonización. Hynes (1975) consideró también que, en vista del alto grado de adaptación que se requiere para que los huevos queden protegidos o para enterrar la larvas de manera que sobrevivan a la época estival, la recolonización es con mucho la estrategia más fácil para superar la sequía. Esto implica un crecimiento muy rápido de las larvas, y en efecto la mayoría de las larvas y ninfas en el río Ghana estudiadas por él se desarrollaban plenamente en un mes. Whyte (1971) ha señalado incluso que algunas especies de quironómidos terminaban su crecimiento en tres semanas. Los estudios sobre ríos de Rodesia expuestos a desecación estacional han revelado que el restablecimiento de la fauna después de reanudarse anualmente el flujo puede ser muy rápido (Harrison, 1966). Las larvas de oligocetes, crustáceos e insectos aparecen en un plazo de diez días, y hay una forma de sucesión en virtud de la cual la composición por especies típica de las charcas se restablece y estabiliza en un mes. Las conclusiones de Harrison indican también que los caracoles pulmonados y los oligocetes sobreviven a la sequía por letargo estival. Algunos crustáceos menores pueden tener huevos durmientes. La mayor parte de los insectos recolonizan la zona por el movimiento de los adultos voladores desde masas hídricas más permanentes.
Los crustáceos decápodos, que forman parte de la comunidad macrobentónica, son un elemento de particular importancia en la fauna de los ríos tropicales. Ecológicamente pueden ponerse junto a los peces en atención a su tamaño, su posición en la cadena alimentaria, su comportamiento y su importancia económica como organismos comestibles. En particular las especies de Macrobrachium son la base de la pesca en muchos ríos tropicales (véase Kensley y Walker (1982) para el Amazonas; Robertson (1983) para el río Sepik, FAO/NU (1971 para el río Oueme e Inyang (1984) bara el bajo Níger) y han sido también adoptados en muchos lugares para la piscicultura. Actividades similares se realizan con Astacus, Procamberus y Pacifastacus en las aguas templadas de los Estados Unidos y de Europa.
La “comunidad” de neuston no es objeto de mucha atención por parte de quienes estudian la ecología de las zonas tropicales de anegamiento. Sin embargo, de observaciones personales se desprende la abundancia de formas que viven en la interfaz aire/agua. Larvas de mosquitos y varias formas de caracoles pulmonados son muy comunes, lo mismo que los que marchan sobre el agua (hemípteros y coleópteros), ácaros y arácnidos, sobre todo en el agua abrigada entre los tallos de la vegetación flotante. Cabe suponer que esta comunidad se extiende considerablemente durante la época de crecida, aunque hasta ahora no se han recogido observaciones que apoyen esta suposición.
Hay en las zonas de anegamiento gran cantidad de larvas e individuos adultos de varias especies de ranas y sapos. La mayoría de las zonas limítrofes de la llanura y todos los pantanos permanentes y temporales están colonizados y, en las zonas más desoxigenadas, los renacuajos son con frecuencia las únicas formas de vida vertebrada. Los anfibios aparecen también con rapidez en las charcas temporales más aisladas. No se han hecho muchos trabajos sobre la ecología y la dinámica de las poblaciones anfibias de los ríos, aunque es indudable que son un componente importante de la fauna de la llanura inundable, y probablemente contribuyen al reciclaje rápido de los detritos y el cieno convirtiéndolos en carne que pueden utilizar las especies predatorias de peces, reptiles y aves. Las ranas se explotan comercialmente por sus ancas, sobre todo en China y Rumanía. Sin embargo, estos recursos han sido excesivamente explotados, o las existencias han sido reducidas por la contaminación en algunos lugares, por ejemplo en Francia, donde actualmente están protegidas.
Varias familias de reptiles han permanecido estrechamente asociadas con el agua, cuatro grupos de las cuales (cocodrilos, monitores, iguanas y tortugas) se encuentran regularmente en o cerca de los ríos y las aguas estacionarias permanentes o temporales de sus zonas de anegamiento. También algunas especies de serpientes han adoptado hábitos acuáticos o semiacuáticos. Varias formas de cocodrilos están distribuidas por el mundo tropical, y estaban antaño muy asociadas con los ríos de crecida. No obstante, han sido objeto de matanzas generalizadas y están ahora prácticamente ausentes de sus antiguos entornos. La importancia economica del cocodrilo como consumidor de peces ha sido objeto de estudios, principalmente de Cott (1961). Aunque los cocodrilos comen gran cantidad de peces, también devoran otros organismos que son a su vez predadores de peces. No está por lo tanto muy claro que se les pueda considerar competidores importantes del hombre en cuanto a la pesca. Fittkau (1970 y 1973) ha sugerido una segunda función de los cocodrilos en la ecología de algunos tipos de aguas tropicales. En los bosques húmedos pobres en nutrientes, los elementos más grandes de la comunidad sirven como receptáculos de nutrientes, que acumulan lentamente los pocos minerales disponibles (Fittkau y Klinge, 1973). Este sistema depende en buena medida de la abundancia de sus especies capaces de realizar en máxima escala el almacenamiento y el reciclaje de los nutrientes de origen alóctono. Se cree que un proceso similar tiene lugar en las aguas negras, igualmente pobres en nutrientes, de las zonas de bosques húmedos. En estos sistemas acuáticos, el bajo nivel de nutrientes no permite una gran producción primaria, y la cadena alimentaria comienza sobre todo con la introducción de material alóctono. Los peces que entran en los lagos de la desembocadura son alóctonos a ese sistema particular y son devorados por una serie de grandes predadores, entre los cuales los caimanes son tal vez los más significativos. Un caimán de tamaño medio puede comer diariamente entre el 0,6 y el 0.8% del peso de su cuerpo, y producir excrementos por un peso entre el 0.20 y el 0.26% de su cuerpo con iones de nitrógeno, fósforo, calcio, magnesio, sodio y potasio. Su contribución al balance de nutrientes de esos entornos sería, según Fittkau, localmente superior y complementaria a los nutrientes derivados del agua de lluvia, que es por su parte la fuente principal de nutrientes del conjunto del sistema. En los lugares de donde han sido eliminados los cocodrilos se han observado descensos en la prodcción pesquera, posiblemente por disminuir la producción primaria basada en los nutrientes de los excrementos.
Las aves son un elemento muy destacado del ecosistema de las zonas de anegamiento. Igual que en la mayoría de los humedales, varios tipos de aves acuáticas son muy comunes, pero es dudoso que la mayora parte de ellas se relacionen directamente con las poblaciones ícticas. De todas maneras las aves piscívoras son también abundantes y son posiblemente las que ejercen mayor presión desde el exterior del sistema acuático. Reizer (1974) por ejemplo enumeró 37 especies de ictiopredadoras en el río Senegal, y Shepherd (1976) anotó 19 especies en el río Shire. Las aves pueden capturar gran variedad de especies de todos los tamaños, y en la comunidad de aves piscívoras parece haber una especialización según los tamaños y los tipos particulares de presas.
En general, el ciclo vital de las aves acuáticas está muy vinculado a las crecidas. Las épocas de cría de las aves coinciden con las de los peces, y los volatones salen de sus nidos precisamente cuando son más abundantes los pececillos que pueden servirles de alimento. La actividad predatoria es particularmente intensa durante el período de descenso de las aguas, cuando muchos peces quedan varados en charcas temporales (Lowe-McConnell, 1964; Bonetto, 1975).
El impacto de las aves sobre la población íctica puede ser muy fuerte, y los estudios respecto a Africa indican que las capturas de peces realizadas por ellas pueden ser superiores a las capturas de la pesca. En el río Senegal, por ejemplo, Reizer (1974) presentó cifras calculadas por Morel de 100 000 a 200 000 garzas y cormoranes y 2 000 pelícanos tan sólo en el delta. El consumo de peces se ha calculado entre 500 y 1 000 gramos diarios para el flechador Anhinga rufa y para la garza, 1 000 a 2 000 gramos para un pelícano y 250 gramos para el martín pescador, Ceryle rudis. Según esto, las aves capturan unas 70 000 t/año de peces, en comparación con una pesca anual de unas 50 000 toneladas.
Bowmaker (1963) estimó la ración diaria del cormorán Phalacrocorax africanus en 78 g/día, lo que arroja un consumo de 286 t/año del lago Bangweulu. Esta estimación puede ser diez veces inferior a la realidad en vista de los datos de Reizer y de los de McIntosh (1978), quien determinó que el cormorán europeo (Phalacrocorax carbo L.) come diariamente 650 a 700 gramos de peces. Bowmaker concluía que el cormorán africano no es perjudicial para la pesca, sino que en realidad podría ser beneficioso por su uso de especies no comerciales y por sus excrementos que fertilizan el agua. Otros datos sobre ríos de zonas frías indican que los martín-pescadores comen alrededor de 14 kg de peces por km de corriente, las golondrinas de mar consumen unos 63 kg por km de río y los mergánsares o cuervos marinos toman unos 25 kg/km. Estas cifras equivalen respectivamente al 2,3%, 14,1% y 4,2% de la mortalidad total (Alexander, 1979).
Varios mamíferos acuáticos y semiacuáticos figuran en la ecología de los ríos, aunque su papel dista de ser siempre claro. Los castores, confinados a la zona templada septentrional, tienen una enorme influencia sobre el sistema acuático. Su hábito de construir diques conduce a la inundación más o menos permanente de grandes extensiones de la llanura, creando condiciones pantanosas en buena parte de los valles. Los propios diques condicionan las características de la corriente, y los residuos orgánicos aumentan la diversidad y la riqueza del hábitat para los peces. Las poblaciones de castores se han reducido radicalmente en varias partes de Europa y América del Norte y sus diques se han destruido con miras a mejorar la circulación del agua. Este proceso, junto con la limpieza de ramas muertas, tocones y otras obstrucciones naturales del lecho del río, ha aumentado la sequedad en los fondos de los valles y ha privado a muchos ríos templados de orden inferior de una parte considerablede sus zonas de anegamiento. Las nutrias abundan en los sistemas templados y tropicales. Parece que se alimentan de peces en gran proporción; pero al no ser elevadas las densidades de población, el impacto de esa actividad predatoria es probablemente bajo, en la mayoría de los casos. De todos modos tienen una mala reputación entre los pescadores por su hábito de sustraer o estropear los aparejos de pesca, tales como trampas o redes. Según Alexander (1979), las nutrias consumen unos 13 kg de truchas/km en corrientes de agua fría, frente a 25 kg/km consumidos por los visones. Estas cifras equivalenal 3,0% y 5,6% de la mortalidad total respectivamente.
En los ríos africanos, los hipopótamos aportan una gran cantidad de fertilizante al sistema acuático al alimentarse de vegetación terrestre y transformarla en excrementos que van al agua en forma facilmente accesible para el fitoplancton. Las densidades de hipopótamos eran antaño muy elevadas en la mayoría de las aguas interiores africanas, y deben haber contribuido considerablemente a los insumos y el reciclaje de nutrientes. Sin embargo, han sido eliminados en gran parte del continente y su número se ha reducido notablemente incluso dentro de los confines de zonas protegidas.
En América Latina y otros continentes, los miembros de la familia de los sirenios parecen desempeñar un papel similar en los balances de nutrientes, particularmente en los ríos y lagos de aguas negras del Amazonas. El dugong (Dugong dugon) está distribuido por toda la región indopacífica (Husar, 1975). El manatí africano Trichechus senegalensis se encuentra en los ríos de Africa occidental y abunda bastante en Camerún, Gabón y en el sistema del río Níger (Nishiwaki et al., 1982). El Trichechus manatus se extiende desde Florida al nordeste del Brasil (Maranhao), y el Trichechus inguinis se encuentra en todo el sistema fluvial del Amazonas. Los estudios sobre la alimentación de los sirenios (Best, 1981) indican que los manatíes consumen diariamente alrededor del 8% de su peso total corporal en plantas acuáticas, mientras que el dugong come alrededor del 14%. Sus alimentos preferidos son plantas más altas que no interesan normalmente a otros organismos, de manera que no están en competencia trófica activa con otros elementos de la comunidad.
Muchos grandes sistemas fluviales tienen especies de delfín de la familia Platanistidae. El Platanista gangetica se encuentra en el Ganges, el Brahmaputra y otros ríos de la cuenca del Ganges. El Platanista minor habita en el lndo y penetra en el Zambeze, el Lipotes vexellifer ocupa el Yangtsé, el Inia geoffrensis está distribuido por el sistema amazónico juntamente con el Sotalia fluviatilis, el único delfínido de agua dulce que se encuentra también en el Orinoco. El Pontoporia blainvillei habita en los tramos inferiores de los ríos Paraná y Uruguay, en el estuario de Río de la Plata y en las aguas costeras adyacentes. El Orcaella breviostris, que habita primariamente en las aguas costeras poco profundas de Asia sudoriental, penetra en muchos ríos como el lrrawaddy, el Ganges, el Brahmaputra y el Mekong, así como en masas hídricas menores del archipiélago indonesio (Watson, 1981). Todos estos delfines se alimentan de peces y crustáceos, utilizando sus largos hocicos para escarbar en el fondo. En el Amazonas, las dos especies coexistentes se distinguen por características ecológicas muy diferentes (Ferreira, 1983). El Sotalia es un delfín social que habita en las aguas despejadas del cauce del río y se alimenta de pececillos jóvenes que devora enteros. Consume diariamente un peso aproximado del 6,6% de su cuerpo. El Inia es un animal más solitario que busca peces grandes y solitarios en el fondo, destrozándolos antes de consumirlos. Consume diariamente el 3.1% del peso de su cuerpo. Las dietas se solapan en cierta medida en los bordes del cauce. El Inia se alimenta principalmente durante las crecidas del río, cuando los peces se derraman sobre la zona de anegamiento, y se le ha observado a muchos kilómetros del río en el lgapo. El Sotalia se alimenta sobre todo durante el estiaje, cuando se concentran en el río los peces gregarios pelágicos. Extrapolando lo que se sabe de la función ecológica de otros mamíferos de agua dulce, los delfines desempeñan dos papeles principales en el ecosistema. Primero, pueden contribuir a mantener el equilibrio de nutrientes especialmente en los ríos en que éstos escasean, más o menos en la forma descrita respecto a los caimanes del Amazonas. Segundo, pueden consumir cantidades significativas de peces afectando así a la dinámica de las poblaciones dentro del río. Actualmente se dispone de poca información sobre la que basar una conclusión respecto al papel de estas especies, aunque Ferreira (1983) indica que grandes cantidades de peces se consumen estacionalmente. Este hecho puede ser especialmente importante para la actividad pesquera en el caso del lnia que, al capturar especies grandes y comercialmente preferidas, compite directamente con los pescadores. Los cardúmenes de peces menores que sirven de alimento al delfín Sotalia no han sido todavía objeto de actividades pesqueras, por lo que tienen poca o ninguna importancia económica. Pese a esta competencia el lnia, igual que la mayoría de los delfines de agua dulce, está muy protegido por la tradición, y no se le hace daño ni se come su carne.
Varios animales salvajes y domésticos utilizan también la zona inundable durante la fase seca, pero de esto se tratará en un próximo capítulo.