La riqueza y la variedad de los hábitats fluviales ofrecen una gama de posible organismos sustratos alimentarios. Pueden originarse éstos en el propio sistema acuático (fuentes alimentarias autóctonas) o fuera del sistema (fuentes alimentaria alóctonas), aunque todos ellos dependen en último término de materiales de origen externo en forma de limo aluvial, nutrientes disueltos, material arrastrado dentro del sistema con la escorrentía o productos en descomposición en zonas anegadas. Estos nutrientes forman la base de las numerosas fuentes alimentarias que se indican a continuación:
| Autóctonas | ||
| Comunidad planctónica | — | fitoplancton |
| — | zooplancton | |
| — | organismos a la deriva | |
| Comunidad bentónica | — | cieno y microorganismos asociados |
| — | detritos gruesos, restos vegetales o animales en descomposición | |
| — | insectos y pequeños crustáceos | |
| Comunidad vegetal | — | plantas, incluidas algas filamentosas y sumergidas y vegetación superior flotante o emergente |
| Comunidad epilítica-epifítica | ||
| (“Aufwuchs”) crustáceos, etc. | — | algas epifíticas o epilíticas |
| — | microorganismos asociados, insectos, | |
| — | esta categoría puede incluir la flora y la fauna de las raíces de la vegetación flotante, así como algunos detritos incorporados, la capa de légamo que se encuentra en las partes sumergidas de las plantas o las rocas sumergidas consistente en detritos, bacterias y algas. | |
| Comunidad neuston | — | insectos y larvas de superficie que viven en la interfaz aire/agua |
| Peces | — | incluidos huevos, larvas y juveniles |
| Otros vertebrados | — | anfibios, reptiles, aves y pequeños mamíferos acuáticos |
| Alóctonas | ||
| Materia vegetal | — | hojas, raíces, flores, frutos y semillas de plantas que crecen cerca |
| del agua o cuelgan sobre ésta y que contribuyen a enriquecer la | ||
| deriva y los detritos | ||
| Materia animal | — | insectos, arácnidos, gusanos, etc., que caen al agua o son arrastra- |
| dos a ella desde el entorno terrestre |
En los ríos, la producción primaria está localizada más en la proliferación de plantas superiores que en el fitoplancton. Las algas epifíticas y epilíticas son abundantes únicamente en los bordes de la masa vegetal o sobre y otros soportes. Las plantas superiores son en sí mismas útiles para la alimentación tan sólo cuando son jóvenes y tiernas, aunque los frutos y las semillas entran ciertamente en la dieta alimentaria de algunas especies. La principal contribución de las plantas superiores al flujo de nutrientes se realiza por la descomposición y el consiguiente enriquecimiento de los detritos. Como los alimentos vegetales primarios aceptables no son corrientes en los hábitats de las llanuras fluviales inundadas, las especies puramente herbívoras son relativamente raras. Las especies que comen plantas superiores o fitoplancton suelen tener una fuente alternativa de alimentación. En el caso de los ramoneadores de plantas superiores como la Tilapia zillii, los peces suelen recurrir a detritos vegetales, para cuyo consumo están igualmente bien adaptados. La escasez de fitoplancton en los sistemas de aguas corrientes significa que esta fuente de alimentación, tan común en los lagos, es también de importancia secundaria.
La ausencia general de organismos alimentados con fuentes primarias significa que otros tipos de alimento dominan en la dieta de las especies fluviales. Hay cuatro categorías de particular importancia, según el paraje dentro del sistema fluvial. Son las siguientes:
Bentos, que es particularmente importante en las corrientes de cabecera y en los tramos rejuvenecidos. Los organismos bentónicos son particularmente abundantes en los tramos pedregosos y a menudo torrenciales de las corrientes de orden inferior, pero su abundancia decrece río abajo hasta que, en los tramos medios, forman una parte relativamente secundariade la dieta. La procedencia de la alimentación tiende así en esos tramos a alternar entre una serie de formas de vida que se encuentran en el fondo, generalmenteen los intersticios de las rocas, en los rabiones, y una deriva de esos organismos bentónicos autóctonos y de material alóctono en las charcas. La existencia de microbentos en esos espacios entre las rocas favorece a los peces de pequeño tamaño, de manera que los individuos jóvenes de muchas especies pasan en los rabiones las primeras etapas de su desarrollo.
Fango y detritos: Las sedimentaciones del fondo ofrecen realmente dos tipos de alimento bastante diferentes. Los devoradores de detritos utilizan un material vegetal grueso en descomposición, junto con microorganismos y comunidades animales asociados, que comprenden buen número de especies, particularmente en las corrientes de cabecera y en los hábitats forestales donde se acumula la hojarasca en los remansos de las charcas o junto a la vegetación flotante, donde el mantillo es también abundante. El detrito grueso resultante es muchas veces característico de las corrientes de orden inferior y se hace más fino con la marcha de la corriente hasta que, en el potamón, forma un fango orgánico fino.
El fango mismo contiene aminoácidos y otros productos orgánicos de descomposición que los peces pueden utilizar en combinación con las bacterias saprofitas y los microorganismos protozoarios. Bakare (1970) analizó este elemento de la dieta del Citharinus y el Labeo en el río Níger. Cuanto más fina es la partícula, mayor es su valor alimentario; el tamaño preferido de las partículas era entre 0,10 y 0,05 mm, aunque se tomaron partículas de hasta 0,18 mm. Las fracciones más finas contenían cantidades relativamente mayores de carbono y nitrógeno en comparación con las más grandes. El tamaño de la partícula y el contenido alimentario del depósito, que el pez parecía capaz de detectar, eran los factores principales que limitaban la distribución de esas especies. Cuando se recogieron las muestras, alrededor del 70% de los sedimentos del fondo eran útiles como alimento. Bakare observó que los sedimentos del fondo perdían rápidamente C y N durante la crecida, cuando el C. citharus se alimentaba activamente. La desecación periódica del fango puede recargar el contenido orgánico mediante la incorporación del estiércol y de otra materia animal y vegetal en descomposición. Estudios similares de Quirós et al. (1981) en el lago artificial de Salto Grande, un embalse fluvial del río Uruguay, permitieron apreciar las fuertes correlaciones entre, por una parte, la materia orgánica total y las concentraciones de nitrógeno orgánico en diferentes lugares del lago y, por otra, la captura de especies iliófagas y consumidoras de detritos como Prochilodus platensis, Pseudocurimata gilberti, P. nitens, Curimatorbis platanus, así como Plecostomus y Loricaria anus. Bowen (1980) aportó más pruebas de la capacidad de ciertas especies de peces para alimentarse de los aminoácidos presentes en el fango del fondo, descubriendo que las sustancias eran prontamente absorbidas a lo largo del intestino del Oreochromis mossambicus que vive en el lago Valencia, en Venezuela. Se requieren jugos gástricos infrecuentes para liberar las proteinas de esta forma de detritos, y se ha comprobado que el O. mossambicus tiene ácido gástrico con un pH inusualmente bajo (,5) para los peces (Bowen, 1981). Anteriormente, Bowen (1919a) había establecido que el agregado detrítico bentónico contenía ricos residuos orgánicos (hasta el 45,7% de hidratos de carbono y del 1,8 al 14,2% de proteínas), gran parte de los cuales se presentaban en forma de material amorfo sin vida. Tanto Bakare como Sandon y Tayib (1953) encontraron una elevada proporción de deglutidores de cieno en las poblaciones de peces de los ríos Níger y Nilo. En el Níger, el 10% de las especies se nutren exclusivamente de esa fuente, y otro 10% la incluyen como elemento importante de su dieta. El número de especies, sin embargo, no es una guía suficiente para medir la abundancia de peces que se alimentan con cieno. En el sistema de La Plata, por ejemplo, el 60% de la ictiomasa de las charcas del llano inundado se localiza en la principal especie que come cieno (iliófagos), Prochilodus platensis (Bonetto, Dioni y Pignalberi, 1969). Los peces del género Prochilodus son deglutidores de cieno muy corrientes en América Latina y se encuentran en igual abundancia en otros sistemas como el del Mogi Guassu (Godoy, 1975) y el Magdalena (Kapetsky et al., 1976). Goulding (1980) confirma también que los peces que se alimentan con cieno y detritos de los géneros Prochilodus, Semaprochilodus y Curimatus constituyen una gran parte de la biomasa en las llanuras inundadas forestales pobres en nutrientes de los ríos amazónicos por él estudiados.
Material alóctono: Muchos investigadores han observado la cantidad de material alóctono consumido por los peces en los sistemas fluviales. Tal material externo no sólo es una de las dos fuentes principales de alimentación en las corrientes de las cabeceras, sino que en las llanuras forestales surcadas por ríos de aguas negras la lluvia de materia animal y vegetal caída desde las ramas que cuelgan sobre las aguas es la única fuente apreciable de alimentos, y todas las cadenas alimentarias se inician en ella. Ríos típicos de esta categoría son el Amazonas y el Zaire, respecto a los cuales Geisler et al., (1973), Roberts (1973) y Goulding (1980 y 1981) han observado que los alimentos de procedencia terrestre son particularmente importantes. Observaciones análogas se han hecho en la cuenca del Mekong, especialmente en el bosque inundado que rodea al Grand Lac. La mayoría de las especies en estos hábitats muestran gran flexibilidad en el tipo de alimentos alóctonos consumidos, pero algunos peces, como los frugívoros de los ríos forestales tropicales, se han especializado en ciertos alimentos particulares. En efecto, el estudio más exhaustivo realizado sobre tales especies (Goulding, 1980) indica que algunas especies amazónicas de Characidae, Cynodontidae, Anostomidae, Pimelodidae, Doradidae y Auchenipteridae comen especialmente frutos o semillas en el Amazonas durante la época de crecida hasta el punto de que más del 87% del alimento total consumido por Colossoma, Mylosoma, y Brycon en la estación húmeda eran frutos o semillas. Las diversas especies muestran incluso preferencias por tipos particulares de frutos o semillas en relación con su dentición. La mayoría de tales especies dejan de alimentarse durante la estación seca o se orientan hacia otras fuentes de alimentación, que en muchos casos pueden consistir en otros materiales alóctonos como hojas o flores, pero que pueden ser también, como en el caso de las pirañas, animales vivos. El hábito frugívoro ha sido descrito o mencionado por investigadores de otras zonas forestales. Los frutos, las semillas y las flores forman un componente de la dieta de Notopterus notopterus, Paralaubuca typus y Clarias batrachus en el Mekong (Bardach, 1959); Distichodus atroventralis y D. sexfasciatus del Zaire (Matthes, 1964); Leptobarbus melanotaenia, Puntius bulu, P. binotatus, P. bramoides, P. sealei, Botrachocephalus mino y Choderhinus modestus de Borneo Norte (Inger y Chin, 1962); Leptobarbus hoeveni de Sumatra (Vaas et al., 1953). Tan (1980) informa que los peces Tor tambroides, Acrossocheilus hexagonolepis, Leptobarbus hoeveni, Puntus bulu y P. daruphani se congregan en torno a Ficus variegata, Eugenia sp., Diptocarpus oblongifolius, Dypoxylon angustifolium y Elateriospermus tapus para comer los frutos maduros que caen en el agua. Otras especies se han adaptado para capturar organismos exteriores al sistema acuático, encontrándose el ejemplo más extremo de ellas en el “pez arquero” ((Toxotes)), que dispara gotitas de agua a los insectos que se posan en la vegetación ribereña para derribarlos al agua. Fittkau (1973) ha ilustrado el tipo de ciclos simplificados nutriente-alimento-consumidor que se encuentran en los lagos-esteros de los tributarios del Amazonas (Fig. 6.1). El papel del alimento que viene de fuera del sistema acuático no se limita a los ríos forestales, pues algunas especies que habitan en las sabanas dependen también en gran medida de esta fuente (Kelley en FAO/NU, 1968a). Las adaptaciones a este respecto son tales que se ha comprobado que los Brycinus spp. saltan deliberadamente contra los tallos de las plantas de arroz para hacer caer las semillas que consumen (Matthes, 1977).
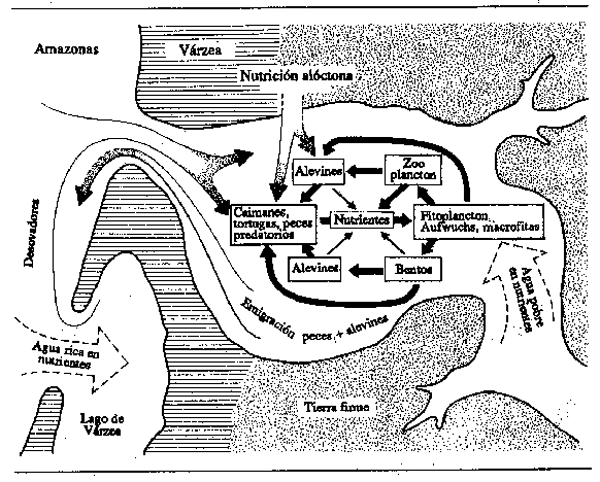
Figura 6.1 El ciclo de nutrientes en el lago-estero de un tributario de un tributario del Amazonas. (Según Fittkau, 1973)
El hábito predatorio de los peces para con otros peces y grandes invertebrados es relativamente insignificante en las corrientes pequeñas. De hecho, cuanto más pequeño e inestable es un curso de agua, menos probable es que la conducta predatoria afecte significativamente a la estructura de su población (Moyle y Li, 1979). En algunas pequeñas corrientes de aguas frías, unas condiciones más estables permiten que peces predatorios como la trucha desempeñen un papel más significativo. Las truchas, por ejemplo, causan el 15% de la mortalidad total de otros peces en los ríos estudiados por Alexander (1979). La importancia relativa de las especies predatorias tiende a aumentar río abajo, hasta el punto de que Bayley (1983) halló que los piscívoros predatorios daban cuenta de la mayor parte de la productividad de peces pequeños y medios en los tramos forestales del Amazonas. En las sabanas inundables, las formas que se alimentan en el fondo tienden a dominar por peso, aunque suele haber sólo pocas especies en este nivel trófico. Además, en algunos sistemas los crustáceos decápodos realizan el papel primario de basureros y los peces quedan limitados a los eslabones superiores de la cadena alimentaria. En el potamón, las estructuras de las comunidades suelen contener una proporción muy elevada de especies predatorias, y los predadores piscívoros suelen ser muy comunes. La abundancia relativa de estos elementos de la comunidad tiende a aumentar durante la estación seca, lo que conduce al fuerte predominio de los peces predadores sobre los forrajeros que algunos autores han comprobado. Por ejemplo, Mago-Leccia (1970) notó que hasta el 75% de la población de algunas charcas de la zona inundable del Orinoco consistía en piscívoros como el Hoplias malabaricus. Lowe-McConnell (1964) y Bonetto, Dioni y Pignalberi (1969) señalaron igualmente la abundancia de piescívoros y la ausencia de peces pequeños en las charcas inundadas de los ríos Rupununi y Paraná respectivamente al final del período seco. Yo he observado el mismo fenómeno en el río Ouemé, y otros varios autores se han referido de pasada al mismo hecho en relación con otros sistemas africanos. Extrañamente, la crecida prolongada y estabilizada en los pantanos de Everglade normalmente fluctuantes produjo también un aumento de las especies predatorias según Kushlan (1976). Este cambio se debió a la migración al pantano de grandes especies predatorias que normalmente no toleran las condiciones extremas de los pantanos. Cambios similares pueden preverse cuando se represan las aguas del llano inundado para aumentar el tiempo de inundación.
Lowe-McConnell (1975) concluyó que hay una sucesión lineal de fuentes alimentarias dominantes en los arroyos y los ríos. Los peces en los arroyos de las cabeceras dependen sobre todo de alimentos alóctonos. Al crecer la corriente, los herbívoros y los predadores generales que se alimentan de invertebrados bentónicos se hacen más importantes. Finalmente en los tramos inferiores, la acumulación de detritos y el fango blando sirven de apoyo a una serie de especies deglutidoras de cieno, aunque los piscívoros son también abundantes. Nikolsky (1937) describió esta misma sucesión en el Amu Darya y el Syr Darya y la puso en relación con el aumento de longitud y complejidad de los intestinos de los peces al avanzar aguas abajo por estos ríos. Este progreso en los tipos de alimentación concuerda con las predicciones del concepto de continuum fluvial y está también en correspondencia con progresiones similares en otros organismos.
Los hábitos alimentarios de las diversas especies de peces fluviales han sido descritos por muchos autores. En general se han analizado como una “estática” trífica que, enfocando la dieta de una manera limitada en el espacio o en el tiempo, tiende a asignar a los peces categorías o nichos tróficos. Esto ha llevado a suponer que las considerables especializaciones de dentición, estructura maxilar, forma corporal y tracto alimentario corresponden a verdaderos nichos alimentarios propios de las especies. Un examen más detenido de esta suposición revela que la situación es bastante más compleja. En los sistemas estables como los ríos de caudal constante, puede suponerse que la especialización lleva a las especies a adoptar una posición fija en la comunidad, mientras que en los sistemas fluctuantes representados por los ríos de crecida las especializaciones, pueden ser más valiosas en una u otra de las fases del sistema. Ha habido algún debate respecto a si la ventaja se produce durante tiempos de abundancia (generalmente la crecida), cuando hay suficiente alimento de diversa índole, o en épocas de escasez cuando la especialización agudizaría la capacidad de competir por los recursos disponibles. En apoyo de esta última hipótesis Zaret y Rand (1971) encontraron que la superposición de conductas tróficas en un río panameño era mínima durante la estación seca, cunado la abundancia de alimento era menor. Por ejemplo el Astyanax, que normalmente ocupa la superficie durante la estación húmeda rica en nutrientes, es empujado hacia las aguas medias por el más especializado Gephyrocharax durante la estación seca. Allí, el acceso a su dieta usual tropieza con el Roeboides y. en consecuencia, abandona su orientación normal hacia los insectos alóctonos para adoptar una dieta puramente vegetariana. En aguas más templadas, Angermeier (1982) encontró también un aumento en la variedad de presas seleccionadas por nueve especies de peces fluviales de los Estados Unidos durante épocas de escasez, mientras que las mismas especies explotaban todas prácticamente los mismos recursos alimentarios en tiempos de abundancia. Otros varios autores han encontrado mayor especialización durante el período de crecida. Matthes (1964) halló mayores grados de especialización durante las crecidas del río Zaire. Lowe-McConnell (1964 y 1967) concluyó también que la crecida es el período en que los peces están más segregados tróficamente en el Rupununi. Esto ha sido igualmente documentado respecto a los peces frugívoros del Amazonas por Goulding (1980), ya que diversas especies se concentran en tipos particulares de frutos y semillas durante las crecidas pero son menos selectivas durante la estación seca. En contraste directo con las conclusiones de Zaret y Rand (1971), Power(1984) estableció que las especies en un río panameño se concentraban en los sustratos principales cuando el alimento era abundante, pero diversificaban su opción al escasear la comida.
El hábito de modificar la dieta estacionalmente, observado por la mayoría de estos autores, ha sido también comentado por otros. Por ejemplo cabrera et al. (1973) descubrieron que la dieta del Basilichthys bonariensis en el sistema del Plata podía dividirse en tres componentes principales: elementos constantes (algas, cieno, restos vegetales); elementos estacionales (cladóceros, copépodos, diatomeas, malacostráceos, gasterópodos y peces, todos los cuales aparecían principalmente en la crecida); elementos ocasionales (rotíferos y ostrácodos). Este régimen alimentario, en el que una categoría trófica básica ellos, parece muy común. Incluso especies como la piraña (Serrasalmus spp.) que son conocidas por su ferocidad predatoria pueden adoptar otra dieta de detritos vegetales o cieno durante la estación seca (Mago-Leccia, 1970; Goulding, 1980). Algunas de estas especies son claramente ejemplos de una adaptación a un tipo de alimento que sirve igualmente como alimento alternativo, como en el caso de los micófagos deglutidores de cieno como Heterotis, Oreochromis niloticus o Alestes spp. que pueden hacerse consumidores de plancton en aguas lénticas. Muchas especies seleccionan una sucesión de tipos alimentarios al avanzar la época de las crecidas. Entres estas especies, son típicas las Brycinus estudiadas por Daget (1952), que cambian de una dieta de insectos y semillas o incluso de vegetación superior durante la crecida a alimentarse con fitoplancton cuando las aguas empiezan a retirarse. Análogamente, Colossoma bidens o C. macropomum se concentran en frutos alóctonos durante la crecida en Amazonas para pasarse a los crustáceos planctónicos autóctonos con el estiaje (Honda, 1974). En la sabana inundable del río Apure, las mismas especies tienen una dieta mucho más variada, incluyendo entre sus alimentos materia procedente de peces, aves y otros animales.
Las preferencias alimentarias tienden también a cambiar al crecer los individuos. y la dieta de los peces juveniles a menudo es muy distinta de la de los adultos de la misma especie. El Prochilodus platensis joven, por ejemplo, se alimenta de diatomeas y crustáceos planctónicos, mientras que los adultos comen únicamente cieno (Vidal, 1967). Los casos más notables a este respecto son los juveniles de los principales predadores piscívoros, como Lates niloticus o Hydrocynus, que comen pequeños crustáceos o incluso fitoplancton. El plancton parece desempeñar un papel muy importante en la dieta de los peces más jóvenes, y muchos de los movimientos descritos como migratorios parecen destinados a poner a los alevines en contacto con esta fuente de alimentación.
La respuesta de los peces a la concentración de su alimento preferido viene ilustrada por las conclusiones de Quirós respecto a los peces iliófagos del sistema del Paraná. También Power (1984) concluyó que las concentraciones de Ancistrus spinosus y otros bagres loricados de los arroyos panameños correspondían a la productividad de las algas de que se alimentan. Había de 6 a 7 veces más peces en las zonas soleadas de los arroyos, donde las algas se reproducían hasta 7 veces más deprisa que en las zonas sombreadas. El crecimiento de las algas se acelera en aguas someras (20 cm), pero los peces no penetran en esas aguas a causa del peligro de los predadores. Sin embargo, en otras corrientes de Panamá, Angermeier y Karr (1983) concluyeron que la distribución por biomasa de los grupos de peces en busca de alimento no guardaba en general correlación con la disponibilidad de sus principales recursos alimentarios.
Knoppel (1970), en su estudio sobre la ecología de los nutrientes de 49 especies de los ríos y lagos de la tierra firme y la llanura amazónicas se vio obligado a concluir que no había especialistas en esos hábitats, es decir que los recursos eran prácticamente comunes. No obstante, el estudio de Knoppel se limitó a un pequeño río forestal en el que todas las especies se concentraban en productos alóctonos como fuente más abundante de alimentos, y se limitó también a una estación. En otros sistemas, es conveniente y posible en general clasificar a los peces en amplias categorías de grupos tróficos según sus hábitos alimentarios predominantes. Por ejemplo, Matthes (1964) distinguió las siguientes categorías en la cuenca del río Zaire:
Deglutidores de cieno, que comen limo muy fino juntamente con los microorganismos y los productos orgánicos en descomposición que contiene. En las charcas de la zona de anegamiento, este nicho ecológico está ocupado por el Phractolaemus ansorgii.
Consumidores de detritos, que ingieren principalmente restos vegetales, hojarasca y las comunidades animales asociadas, p. ej. Stomatorhinus humilior, Clarias buthupogon, Clariallabes variabilis, C. brevibarbis, C. melas, Channallabes apus.
Omnívoros, que están ampliamente representados por todas las familias y la mayor parte de los géneros en las masas hídricas de la llanura por Stomatorhinus fuliginosus y Ctenopoma fasciolatum.
Herbívoros, que pueden a su vez separarse en:
i) microherbívoros, que comen algas y diatomeas
ii) macroherbívoros, que comen plantas superiores.
Estos no estaban representados en las charcas, pero en los prados flotantes adyacentes consumen este tipo de alimento Neolebias gracilis, Distichodus affinis y Synodontis nummifer.
Consunidores de plancton, que son raros por la falta de plancton en el entorno fluvial, pero que están de todos modos representados por el Aplocheilichthys myersi en la vegetación flotante.
Carnívoros, el grupo más importante, que se subdivide así:
i) Mesopredadores, que se alimentan sobre todo de insectos y crustáceos, que pueden ser:
a) devoradores de materia alóctona o neuston, como Pantodon buchholzi, Ctenopoma nigropannosum o Ctenopoma ansorgei en las charcas.
b) peces de fondo que comen insectos y moluscos del fondo, como Polyterus retropinnis Stomatorhinus polli, Clarias submarginatus, Kribia nana
c) ramoneadores carnívoros que habitan en la vegetación flotante y se alimentan de los pequeños insectos y crustáceos que encuentran allí, por ejemplo Xenomystus nigri, Nannocharax schoutedeni, Hemistichodus mesmaekersi, Heterochromis multidens o Ctenopoma kingsleyae
ii) Macropredadoras
a) predadores generales que se alimentan de peces o de invertebrados mayores como crustáceos decápodos o larvas de insectos. En las charcas de la llanura, Clarias platycephalus es uno de ellos.
b) predadores piscívoros que se alimentan sólo de peces. Aunque Matthes no documentó ninguna especie de este grupo en las charcas de la llanura, peces como Parachanna obscurus, Hydrocynus vittatus o Lates niloticus han sido comprobados en tales hábitats en otros lugares.
c) “fin nippers”, que son representativos de los predadores especializados en general.
Otros autores han presentado tabulaciones parecidas, por ejemplo Marlier (1967), quien investigó sobre los hábitos alimentarios de los peces del Lago Redondo en la várzea amazónica (Cuadro 6.1) y Vaas (1953), quien clasificó la ictiofauna del río Kapuas, en Borneo occidental (Cuadro 6.2).
Las relaciones tróficas de las comunidades del río y del llano inundable pueden resumirse como una estructura alimentaria general del tipo indicado en la Fig 6.2. No todos los elementos de este diagrama están necesariamente presentes en todos los entornos. Cono hemos visto, el fuerte predominio de los alimentos alóctonos en los ríos y arroyos forestales y de orden inferior favorece las secuencias que arrancan de esta fuente nutritiva y disminuye la importancia del fitoplancton.
| No especializados | ESTENOFAGOS | Especializados |
|---|---|---|
| Carnívoros | ||
| Serrasalmus nattereri | Piscívoros | Arapaima gigas |
| Serrasalmus elongatus | Boulangerella cuvieri | |
| Eigenmannia viresecens | Ageneiosus ucayalensis | |
| Pimelodella cristata | Symbranchus marmoratus | |
| Plagioscion squamosissimus | Cichla ocellaris | |
| Geophagus surinamensis | Insectívoros | Triportheus elongatus |
| Apistogramma taeniatum | Oxydoras niger | |
| Colomesus psittacus (=asellus) | Devoradores de zooplancton | Metynnis hypsauchen |
| Astyanax fasciatus | ||
| Hypophthalmus edentatus | ||
| Herbívoros | ||
| Anodus laticeps | Semillas | Ctenobrycon hauxvellianus |
| Cichlasoma bimaculatus | Hierbas acuáticas | Metynnis maculatus |
| Cichlasoma festivum | Leporinus maculatus | |
| Frutos | Colossoma bidens | |
| Algas y aufwuchs | Poecilobrycon trifasciatus | |
| Poecilobrycon unifasciatus | ||
| Deglutidores de cieno | ||
| Curimatusspp. | ||
| Prochilodussp. | ||
| Pterygoplichthys multiradiatus | ||
| Potamorhina pristigaster |
| EURIFAGOS | |
| Predominantemente carnívoros | |
| Osteoglossum bicirrhosum | |
| Serrasalmus rhombeus | |
| Predominantemente herbívoros | |
| Fitoplancton, zooplancton | Anchoviella brevirostris |
| Hojas y semillas, insectos | Pyrrhulina brevis |
| Hyphessobrycon rosaceus | |
| Hyphessobrycon callistus | |
| Diatomeas y cladóceros | Hyphessobryconsp. |
| bentónicos y epifiticos | Cheirodon piaba |
| Algas, hierba y cladóceros | Metynnis lippincottianus |
| Aufwuchs | Corydoras sp. |
| Semillas, moluscos | Acarychthys heckeli |
| Zooplancton y plantas superiores del litoral | Pterophyllum scalare |
| a | b | c | d | e | f | g | h | i | j | k | l | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Consumidores de plancton | ||||||||||||
| Helostoma temmincki | ||||||||||||
| Thynnichthys thynnoides | XX | X | ||||||||||
| Thynnichthys polylepis | XX | XX | X | X | ||||||||
| Dangila ocellata | XX | X | X | X | ||||||||
| Dangila festiva | XX | X | X | X | ||||||||
| Consumidores de perifiton y vegetales | ||||||||||||
| Amblyrynchichthys truncatus | X | XX | X | X | ||||||||
| Osteochilus melanopleura | X | XX | X | X | XX | |||||||
| Osteochilus brevicaudata | X | XX | X | X | XX | |||||||
| Osteochilus waandersi | X | XX | X | X | XX | |||||||
| Osteochilus vittatus | X | XX | X | X | XX | |||||||
| Consumidores de plantas superiores sumergidas, plantas de tierras anegadas, frutos y semillas | ||||||||||||
| Puntius waandersi | X | XX | X | |||||||||
| Puntius nini | X | X | X | XX | X | X | X | |||||
| Puntius bulu | X | XX | X | |||||||||
| Puntius schwanefeld | X | XX | X | |||||||||
| Leptobarbus hoeveni | X | XX | ||||||||||
| Leptobarbus melanotaenia | X | XX | ||||||||||
| Pristolepis fasciatus | X | XX | ||||||||||
| Osphromenus gourami | X | X | XX | X | ||||||||
| Omnívoros que se alimentan principalmente de insectos, larvas y zooplancton | ||||||||||||
| Balantiocheilus melanopterus | X | XX | X | |||||||||
| Cyclochilus repasson | X | XX | ||||||||||
| Luciosoma trinema | X | X | X | XX | ||||||||
| Rasbora argyotaenia | X | X | X | XX | ||||||||
| Rasbora vaillanti | X | X | X | XX | X | X | ||||||
| Insectívoros de superficie | ||||||||||||
| Chela oxygastroides | X | XX | X | X | ||||||||
| Toxotes chatareus | X | X | X | XX | X | |||||||
| Omnívoros de fondo | ||||||||||||
| Barynotus microlepis | X | XX | X | |||||||||
| Pangasius pangasius | X | X | XX | |||||||||
| Pangasius polyuranodon | X | X | XX | |||||||||
| Mastacembelus armatus fayus | X | X | XX | |||||||||
| Mastacembelus argus | X | X | XX | |||||||||
| Predadores omnívoros | ||||||||||||
| Macrones nigriceps | X | XX | XX | X | ||||||||
| Macrones nemurus | X | XX | XX | X | ||||||||
| Hemisilurus chaper | X | XX | ||||||||||
| Hemisilurus scleronema | X | XX | ||||||||||
| Predadores de peces y animales pequeños, insectos, quisquillas | ||||||||||||
| Lycothrissa crocodilus | X | X | XX | |||||||||
| Kryptopterus cryptopterus | X | X | XX | |||||||||
| Kryptopterus schilbeides | X | X | XX | |||||||||
| Kryptopterus limpox | X | X | XX | |||||||||
| Kryptopterus micronema | X | X | XX | |||||||||
| Macrochirichthys macrochirus | X | XX | XX | |||||||||
| Setipinna melanochir | X | XX | ||||||||||
| Datnioides microlepis | XX | XX | ||||||||||
| Hampala bimaculata | X | X | XX | |||||||||
| Grandes predadores que comen peces de todos los tamaños, camarones, quisquillas y cangrejos | ||||||||||||
| Ophicephalus striatus | X | XX | ||||||||||
| Ophicephalus micropeltes | X | XX | ||||||||||
| Ophicephalus pleurophtalmus | X | XX | ||||||||||
| Ophicephalus lucius | X | XX | ||||||||||
| Notopterus chitala | X | XX | ||||||||||
| Wallago leeri | X | XX | ||||||||||
| Siluroides hypoothalmus | X | XX | ||||||||||
Nota: X = alimento adicional; XX = alimento principal
a Fitoplancton
b Perifiton
c Algas filamentosas
d Algas de fondo
e Plantas sumergidas, plantas terrestres inundadas, frutos y semillas
f Zooplancton pequeño
g Cladóceros, copépodos y rotíferos
h Insectos y sus larvas
i Insectos alóctonos
j Camarones
k Larvas de insectos en el fondo, gusanos
l Peces, camarones y cangrejos
Si se ponen en relación los hábitos alimentarios con los hábitats, aparecen algunas relaciones complejas, como ha puesto de manifiesto Matthes (1964) respecto al lago Tumba y a los llanos boscosos inundados adyacentes en la región de lkela. El Cuadro 6.3 ilustra estas relaciones el llano anegado durante la estación seca, donde algunos de los principales consumidores primarios de detritos son los crustáceos decápodos Macrobrachium macrobrachion y Carinida sp. que, por su tamaño y su abundancia, están desde el punto de vista ecológico más estrechamente aliados a los peces que al resto de la fauna invertebrada.
Los peces fluviales, no obstante, parecen estar poco condicionados en su alimentación y, con pocas excepciones, pueden fluctuar dentro de la estructura del grupo según la composición por especies de la comunidad íctea, la época del año y los componentes no bióticos del ecosistema. La asignación de especies a determinados nichos ecológicos puede pues ser inexacta. De hecho, los datos que se poseen de una serie de sistemas indican que: i) un mismo recurso alimentario puede ser compartido por numerosas especies diferentes, y ii) las mismas especies pueden explotar sucesivamente varios recursos diferentes durante el año. La persistencia a largo plazo de ictiofaunas consistentes en decenas de especies, los tipos de alimentación generalizados de los peces, la sucesión temporal de los productos que componen la dieta y las consiguientes superposiciones de habitos tróficos dan lugar a problemas conceptuales, por cuanto algunas comunidades parecen violar el principio de Gauss de la exclusión competitiva. Se han intentado por consiguiente interpretaciones alternativas del nicho trófico. En sistemas estables como los ríos de caudal constante, hay que suponer que el grado de especialización en la comunidad íctica conduce a un reparto más o menos definido de los recursos disponibles entre las diversas especies presentes y a la asignación de las especies a nichos más o menos fijos. Los datos disponibles parecen apoyar esta opinión, ya que la mayoría de las observaciones de sistemas donde hay un reparto más o menos estable de recursos, sea de alimentos o de espacio, proceden de arroyos y ríos menores con flujos más o menos estables. Pese a la mayor estabilidad aparente de tales sistemas, hay todavía razones para suponer que existe una considerable flexibilidad en la selección de nichos alimentarios y espaciales. Estudios detallados de las comunidades de ciprínidos de ríos menores relativamente estables de Sri Lanka muestran que incluso dentro de una familia en sistemas similares pueden encontrarse diferentes niveles de reparto. Por ejemplo, el Puntius bimaculatus y el P. titteya conviven pero no se superponen en nichos tróficos (De Silva et al., 1977). Tres especies en los mismos ríos coinciden en gran medida en la elección de alimentos, pero evitan la competencia directa prefiriendo distintos espacios vitales (De Silva y Kortmulder, 1977), y una cuarta especie coincide en dieta y espacio vital de manera que compite directamente, pero al parece coexiste sin problemas (De Silva et al., 1980). Cuando la competencia entre especies es manifiesta, las investigaciones realizadas por Werner y Hall (1979) indican que una especies puede cambiar sus hábitats tróficos (y espaciales) dentro de una gama de alimentos aceptables o accesibles, según el, rendimiento relativo de cada alimento. De esta manera, un alimento preferido en una estructura comunitaria puede ser postergado si un competidor más eficiente altera el balance del rendimiento. Estos cambios pueden ocurrir de una estación a otra, como en el caso del Astyanax en Panamá (Zaret y Rand, 1971), o de un año a otro. Los cambios anuales en la estructura trófica de una comunidad dependerían entonces de la abundancia relativa de sus especies componentes, que a su vez viene determinada por factores distintos de la disponibilidad de alimentos. A este respecto Schlosser (1982) consideró que los cambios en cuanto al éxito reproductivo temporal eran más importantes que la exclusión competitiva o la predación para determinar la organización de la comunidad Grossman et al. (1982) llegaron análogamente a la conclusión de que factores aleatorios (p.ej.variables ambientales) más bien que deterministas explicaban la falta de repetibilidad de las estructuras comunitarias en mismo río de Indiana durante período de doce años. El término “condominio”, sugerido primeramente por Wynne-Edwards (1962) para designar asociaciones de especies próximamente relacionadas de hábitats similares que pueden estar unidas ecológicamente y no están en pugna por la posesión de recursos comunes, podría extenderse para incluir las agrupaciones de especies ícticas fluviales que coexisten durante largos períodos adoptando sistemas similares de alimentación, cría y distribución espacial. La flexibilidad en la organización trófica entre comunidades ícticas fluviales implica que la competencia interespecífica no es un factor importante para regular la biomasa y la estructura de la comunidad. Esta conclusión es apoyada en cierta medida por Bayley (1983) en sus observaciones sobre los peces amazónicos.
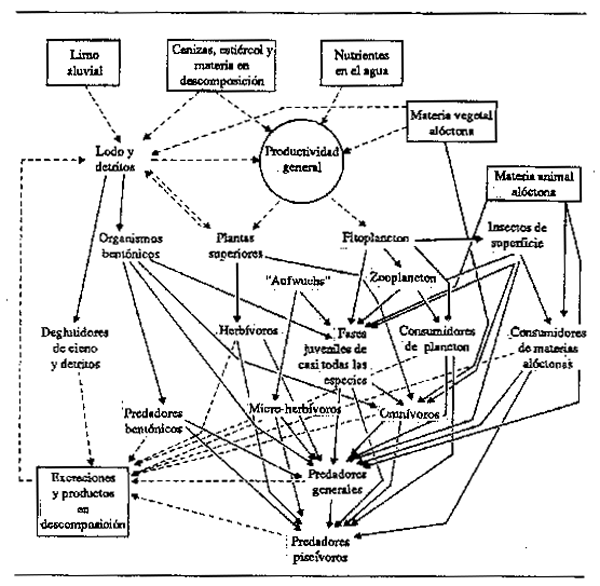
Figura 6.2 Diagrama de relaciones tróficas en una comunidad fluvial y de zona inundable. Línea de trazos = influencia; Línea continua = interacción alimentaria
| Cauce fluvial principal | Charcas y lagunas | ||||||
|---|---|---|---|---|---|---|---|
| Categoría trófica | Superficie | Fondo cenagoso | Fondo arenoso | Vegetación ribereña | Superficie | Fondo | Zonas con vegetación (pantanosas) |
| Limófagos y | Heterotis niloticus | Synodontis schall | Clarias ebriensis | Heterobranchus | Claria ebriensis | ||
| detritófagos | Citharinus latus | Labeo | Heterobranchus | longifilis | Neolebias | ||
| Labeo ogunensis | senegalensis | longifilis | Heterotis niloticus | unifasciatus | |||
| Synodontis schall | Auchenoglanis | ||||||
| occidentalis | |||||||
| Phractolaemus | |||||||
| ansorgii | |||||||
| Citharinus latus | |||||||
| Synodontis schall | |||||||
| Herbívoros micro | Labeo | Synodontis nigrita | Oreocnromis | ||||
| senegalensis | (Juv) | galileus | |||||
| macro | Distichodus | Disatichodus | |||||
| rostratus | rostratus | ||||||
| Tilapia guineensis | Tilapia guineensis | ||||||
| Zooplancton | Pellonula afzeliusi | ||||||
| Alóctonos y | Brycinus longipinnis | Brycinus | Epiplatys bifasciatus | ||||
| consumidores de neuston | macrolepidotus | Epiplatys | |||||
| sexfasciatus | |||||||
| Omnívoros | Brycinus nurse | Marcusenius brucii | Claria lazera | Synodontis nigrita | Clarias lazera | ||
| Chrysichthys | Protopterus | ||||||
| auratus | annectens | ||||||
| Chrisichtys walkeri | |||||||
| Synodontis | |||||||
| melanopterus | |||||||
| Synodontis nigrita | |||||||
| Micropredatores | Synodontis sorex | Synodontis sorex | Chromidotilapia | Chromidotilapia | Ctenopoma | ||
| Physailia pellucida | Petrocephalus | guntheri | guentheri | kingslayae | |||
| Hyperopisus | bane | Brienomyrus | Thysia ansorgii | ||||
| occidentalis | Petrocephalus | brachyistius | Barbus callipterus | ||||
| Mormyrrus rume | bovei | Hemichrromis | Pollimyrus | ||||
| Brienomyrus niger | Cyphamyrus | bimaculatus | adsperus | ||||
| Pollimyrus | psittacus | ||||||
| adspersus | Eutropiellus buffei | ||||||
| Predatores generales | Schilbe mystus | Chrysichthys | Protopterus | Malapterurus | Calamoichthys | ||
| nigrodigitatus | annectens | electricus | calabaricus | ||||
| Eutropius niloticus | calamoichthys | ||||||
| calabaricus | |||||||
| Piscívoros | Hydrocynus | Bagrus docmac | Hemichromis | Hepsetus odoe | Parachanna | Hemichromis | |
| forskahlii | fasciatus | africanus | fasciatus | ||||
| Lates niloticus | Polypterus | Polypterus senegalus | |||||
| senegalus | Gymnarchus | ||||||
| Hydrocynus vittatus | Gymnarchus | niloticus | |||||
| niloticus | Parachanna | ||||||
| Hepsetus odoe | obscurus | ||||||
| Parachanna | |||||||
| obscurus | |||||||
En los ríos y arroyos de la zona templada, el comienzo del invierno suele traer un descenso de la productividad general del sistema acuático y de la producción de organismos alimentarios. Además, la cantidad de alimentos consumidos por los peces está estrechamente relacionada con la temperatura, de manera que en las especies de zonas más templadas y árticas tiene lugar en los meses de invierno una cesación general de la nutrición. En las aguas tropicales, los efectos de la temperatura son claramente menos pronunciados; pero, desde que Chevey y Le Poulain (1940) observaron que los peces no se alimentan en el sistema del Mekong durante el estiaje, se ha aceptado generalmente que en los ríos tropicales de todo el mundo la nutrición de los peces es igualmente muy estacional. En los ríos de crecida, el ciclo de nutrición está claramente vinculado a dos factores: la existencia de alimentos y la densidad de la población. Durante la crecida, el rápido aumento de organismos nutritivos, junto con la amplia dispersión de los peces por un amplio espacio vital, favorece una nutrición intensiva. En el estiaje, cuando el entorno acuático se contrae los peces se concentran en unas pocas reservas permanentes de agua y las fuentes de alimentación se limitan o agotan, de lo que se sigue el ayuno. En los trópicos, esta situación contrsta con la nutrición más o menos continua de los peces en los lagos; aunque en algunas especies que habitan en ríos estrechamente unidos a lagos, como en el sistema Lago Chad/Yaeres, los peces dejan de alimentarse con aguas bajas pese a que unas existencias suficientes de alimentos les permitrían comer en cualquier época del año. En ciertos tramos de ríos indios cuyas zonas de anegamiento son escasas o inexistentes puede invertirse la estacionalidad de la nutrición, siendo más intensa la ingestión de alimentos durante la estación seca. Bhatnagar y Karamchandani (1970) atribuyeron este hecho a la fuerte corriente que se lleva los alimentos durante la crecida, en el caso del Labeo fimbriatus. El Tor tor se comporta de manera análoga al L. fimbriatus, aunque en este caso Desai(1970) relacionó el menor nivel de nutrición con la cría. Parece que la actividad nutritiva se detiene justo antes de la época de cría y durante ella, tanto en los ríos de crecida como en los de embalse. No obstante, hay diferencias estacionales en la disponibilidad de alimentos que dependen de la morfología del río.
La nutrición intensiva de los peces durante los períodos de abundancia les permite almacenar grandes cantidades de grasa que son suficientes no sólo para que los animales atraviesen la siguiente temporada infecunda, invernal o estival, sino también para elaborar el tejido de las gónadas como preparación para la reproducción. La desnutrición durante el invierno o el estiaje hace que los peces pierdan robustez. Daget (1956) por ejemplo comprobó este hecho respecto a la Tilapia zillii en el Níger. La Fig.6.3 muestra la variación de peso durante la estación seca utilizando como índice de cambio el factor de robustez K (siendo K = peso en gm × 105 dividido por la longitud total en mm). En el río, ocurrieron relativamente pocos cambios durante la estación seca hasta el comienzo de la reproducción, cuando hubo una reducción repentina de peso correspondiente a alrededor del 10,7% de todo el período. En una charca de la zona anegada, los peces llegaban al final de la crecida en mejores condiciones, pero perdían peso más paulatinamente durante toda la estación seca: en octubre y noviembre, los peces estaban gordos y repletos de alimentos (K = 4,52); en diciembre, se reducía la nutrición (K = 4,68); en enero, los estómagos estaban vacíos (K = 4,67);en febrero, el alimento era escaso (K = 4,39); en marzo, todavía más escaso (K = 4,48); en abril, había sólo cieno (K = 4,34); mayo (K = 4,16); junio (K = 4,2). La pérdida neta de peso durante cinco meses fue del 11%. En una segunda charca, algo más rica, la pérdida de peso fue menos rápida (línea de trazos). Daget (1952) había notado previamente cambios estacionales similares en el Brycinus. En el Amazonas, Junk (en prensa) observó cambios estacionales en contenido de grasa de 40 especies. La mayoría de ellas mostraban una acentuada estacionalidad en la composición química, con máximos contenidos de grasa durante la retirada de las aguas y mínimos durante la época de cría al final del período de estiaje.
El ciclo de nutrición abundante durante la crecida y ayuno durante el estiaje no es, tal vez, tan sencillo como parece. Las observaciones de Willoughby y Tweddle (1978) indican que niveles máximos de nutrición se alcanzan en diferentes épocas según las especies (Fig. 6.4). El consumo de alimentos del Clarias gariepinus en el sistema del Shire, por ejemplo, llegaba a su máximo justo antes de la crecida máxima, mientras que el Oreochromis mossambicus se alimentaba más intensivamente cuando se vaciaban las zonas de anegamiento. Una tercera especie, Clarias ngamensis, se nutría a un ritmo bastante constante durante casi todo el año. En las tres especies, la ingestión de alimentos era mínima con aguas bajas. Hay también indicaciones de que ciertas categorías de peces continúan alimentándose durante toda la estación seca. Las especies micróvoras como el Heterotis niloticus pueden nutrirse durante todo el año, aunque sólo a nivel de sustento durante la estación seca (Daget, 1957a). Las especies que se alimentan en superficie tienen también un suministro constante y el Brycinus macrolepidotus continúa alimentándose hasta mucho después que otras especies de Alestes y Brycinus en el Níger. El cambio en la proporción de peces predadores y forrajeros durante toda la estación seca y la desaparición gradual de los peces menores de las charcas y lagunas, como observó Lowe-McConnell (1964) hacen pensar que los predadores pueden seguir nutriéndose bien avanzada la estación seca. Goulding (1980) comprobó también que, mientras que la mayoría de los peces frugívoros amazónicos reducen considerablemente su alimentación durante la estació de aguas bajas, los caracinos predadores tienen menos disposición a hacerlo, por cuanto proporciones aproximadamente iguales de estos peces contenían alimentos en las estaciones seca y húmeda. Sin embargo, la naturaleza de la alimentación pasaba de productos fundamentalmente vegetales (semillas y frutos) en la estación húmeda a escamas de peces en la seca. Con todo, los predadores parecen interrumpir efectivamente su proceso-de nutrición en otros sistemas, y Mago-Leccia (1970), observando que las pirañas retornan al limo como sustrato nutritivo en la estación seca, notó también que los predadores no devoran a los peces pequeños en tiempo de aguas bajas. Esta continuidad en la nutrición parece ser algo excepcional, y la mayor parte de los observadores confirman el ayuno de la estación seca.
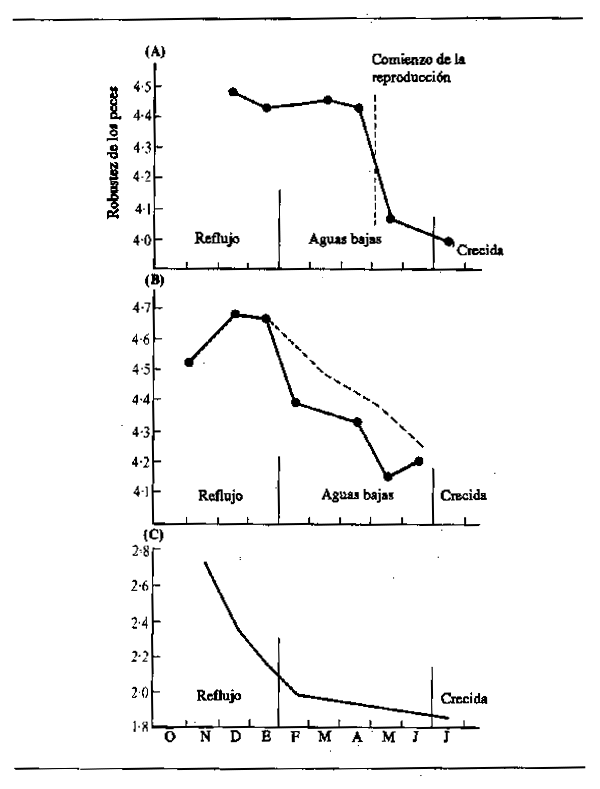
Figura 6.3 Cambios en la robustez de los peces adultos Tilapia Zillii entre octubre y julio en: (A) el río Níger, y (B) dos charcas de la zona inundable (Según Daget, 1956). Se indican también en (C) los cambios en la robustez de Brycinus leuciscus (según Daget, 1975a)
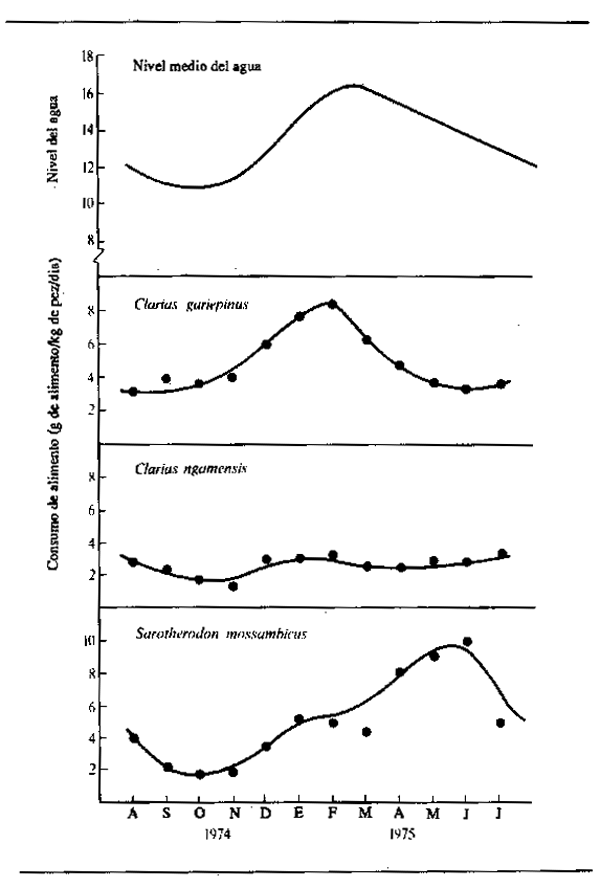
Figura 6.4 Variaciones estacionales de la ingesta alimentaria diaria de tres especies de peces en el río Shire. (Según Willoughby y Tweddle, 1978)
Los peces de casi todos los sistemas fluviales tienen círculos concéntricos o anillos bien definidos en sus escamas, huesos u otolitos, hecho que se ha observado en sistemas tropicales y subtropicales tanto como templados. Hay muchas descripciones de los anillos de los salmónidos y de las especies ícticas ordinarias. Chevey y Le Poulain (1940) estudiaron los anillos en las escamas de las especies de ciprínidos en el Mekong, y se han descrito los anillos de otros ciprínidos como Labeo spp. en los ríos de Gambia (Johnels, 1954) y de la India (Khan y Jhingran, 1975) o Catla catla en el Ganges (Natarajan y Jhingran, 1963). Se han estudiado numerosas especies de caracinos: Prochilodus scrofa (Godoy, 1975), P. platensis (Cabrera y Candia, 1964; Vidal, 1967) en América del Sur, y Brycinus leuciscus (Daget, 1952) y Alestes baremoze (Durand y Loubens, 1969) en Africa. Se han comprobado los anillos en las escamas de cíclidos de ríos de Africa (Oreochromis spp., Dudley, 1927) y América Latina (Cichlasoma bimaculatum, Lowe-McConnel, 1964). Johnels (1954) menciona también anillos en las escamas de Notopterus sp. y mormíridos. Otras partes duras del pez presentan también anillos de crecimiento. Cordiviola (1971) utilizó los huesos operculares para calcular la edad del Prochilodus platensis. Los silúridos desprovistos de escamas (Candia et al., 1973) presentan anillos claros en los otolitos y en las espinas pectorales del Parapimelodus velenciennesi, y Fenerich et al. (1975) han demostrado su existencia en los otolitos del Pimelodus maculatus. La Universidad de ldaho et al. (1971) utilizaron las espinas y las vértebras para calcular la edad de Clarias spp. de los llanos del Kafue. Otros estudios de crecimiento, como los de Bayley (1983) sobre 12 especies del sistema del Amazonas, se han basado en análisis de frecuencia de longitud sin recurrir a las estructuras.
Las marcas o los anillos se han puesto en relación con la cesación parcial o completa del crecimiento durante uno o más períodos del año. En la zona templada, se asocian claramente con la cesación invernal del crecimiento. Sin embargo, en los trópicos se han encontrado con frecuencia más anillos de los que cabría esperar si su formación dependiese solamente de una sucesión regular de estaciones. Hay que tener cuidado, por lo tanto, al interpretar los anillos en las escamas o en otras estructuras duras como indicadores de la edad o de series temporales. Sin embargo, con el estiaje la alimentación cesa por completo o queda muy reducida en la mayoría de las especies. Los peces viven de sus reservas de grasa, perdiendo algunas veces robustez hasta el punto de que se produce una reabsorción en el borde de las escamas. Durand y Loubens (1969) hacen una distinción útil entre crecimiento en peso y crecimiento en longitud. Este último es un buen indicador de cambio a largo plazo, pero al depender principalmente de las estructuras óseas no está tan expuesto a modificación durante la suspensión del crecimiento en crecimiento en peso se realiza en buena parte mediante la adición de tejidos blandos, incluida la grasa Estas reservas de grasa pueden modificarse rápidamente en condiciones adversas, como se ha visto respecto a la Tilapia zillii y al Brycinus leuciscus (Fig. 6.3), y como Durand y Loubens (1970) comprobaron respecto al Arestes baremoze, en el que el factor de robustez (K) bajó de 1,30 en abril a 1,00 en septiembre. Naturalmente hay que tener cuidado en la interpretación de los cambios de peso y robustez, ya que el desarrollo del tejido gonadial y la descarga de los huevos o de la lechaza se reflejan también en estos parámetros. Sin embargo, los cambios en K son más a menudo lentos y durante todo el período seco que bruscos y en la época de cría, como ocurriría si la descarga de productos reproductivos fuese la única causa.
Se han adelantado tres razones principales para la suspensión del crecimiento durante varios meses al año:
i) temperatura
ii) efectos asociados con la retirada del agua; y
iii) reproducción
En la zona templada, la temperatura es claramente el factor dominante, y la formación de anillos se relaciona con el invierno, pero la suspensión del crecimiento coincide con un descenso de temperatura. También en varios sistemas fluviales tropicales, por ejemplo en la cuenca del lago Chad, las temperaturas de invierno descienden por lo menos 8°C por debajo de las máximas de verano (Durand y Loubens, 1969) y coinciden con la tasa mínima de crecimiento. Análogamente en el Senegal, Reizer (1974) consideró que la mayor lentitud de crecimiento de diciembre a febrero tenía relación con el descenso de las temperaturas, y tanto en el sistema de La Plata como en los llanos de Kafue la tasa mínima de crecimiento coincide con descensos similares de temperatura. De todos modos, en la mayoría de estos ríos las aguas bajas coinciden con el invierno y es difícil distinguir los efectos de ambos factores. En los pantanos del Okavango meridional, las crecidas llegan durante la época más fría del año (Fox, 1976), lo que da lugar a tasas de crecimiento muy bajas de los peces que allí habitan. No está claro todavía el momento en que el crecimiento se detiene en esas aguas los trabajos en curso pueden arrojar alguna luz al respecto.
En los ríos ecuatoriales, el crecimiento se detiene regularmente siempre que hay cambios en la temperatura aunque sean mínimos. En estas circunstancias, Lowe-McConnell(1964)ha sugerido que las causas son la concentración excesiva de población y la menor disponibilidad de alimentos producidas por la retirada de las aguas. Tampoco esto puede ser toda la respuesta, como lo muestran los peces del lago Chad que dejan de crecer aun cuando haya en el lago alimento abundante. En el río Níger. Daget (1957) concluyó que las suspensiones del crecimiento pueden distinguirse en las escamas de especies carnívoras, herbívoras, limnívoras, insectívoras y consumidoras de plancton, pese al hecho de que los predadores y los limnívoros por lo menos tienen suficiente alimento. Por otra parte, algunos peces como los Oreochromis y Tilapia jóvenes en el Kafue reanudan su nutrición antes de que se inicien las crecidas, en una época en que las condiciones son de bastante estrechez (Dudley, 1974).
Los efectos de la densidad de población sobre la tasa de crecimiento son algo problemáticos. En el Danubio, Chitavadrivelu (1974) fue incapaz de detectar cambios en la tasa de crecimiento del Alburnus alburnus y del Rutilus rutilus, pese a las grandes diferencias en la biomasa y en la densidad de población de un año a otro. Sin embargo, Frank (1959) comprobó efectivamente aumentos en el crecimiento del Rutilus rutilus y del Abramis brama cuando la población descendía de 69 124 individuos/ha a 19 394 individuos/ha en un meandro abandonado del Elba. Atribuyó este fenómeno a la mayor disponibilidad de alimento planctónico al repartirse esta fuente de alimentación entre menos individuos. También Edwards y Brooker (1982) (Fig. 6.5) han demostrado unas claras relaciones entre la densidad de población y la tasa de crecimiento y la producción total de coto (Cottus gobio) en afluentes del río Wye. Experimentos similares con la trucha de fontana revelan un acusado descenso de la tasa de crecimiento individual a medida que aumenta el número de peces presentes por unidad de superficie (Backiel y Le Cren, 1978). Estos resultados contradictorios indican que se precisan más investigaciones sobre la cuestión de las relaciones entre la disponibilidad de alimento y la densidad de población y sus efectos sobre la cantidad de peces que se pueden pescar.
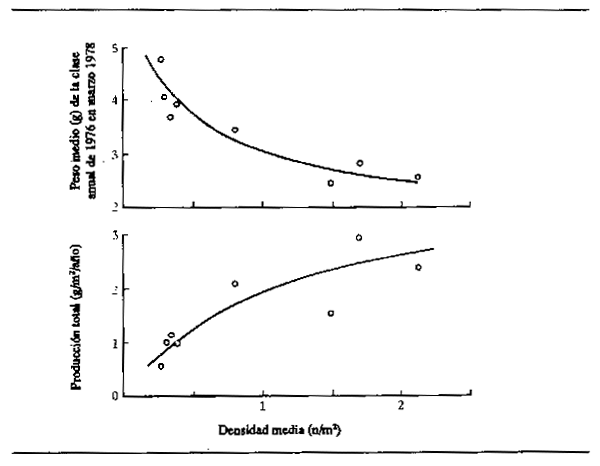
Figura 6.5 Relaciones entre densidad y (A) crecimiento y (B) producción de coto (Cottus gobio) en tributarios del alto Wye. (Según Edwards y Brooker, 1982)
La elaboración de productos gonadiales durante el período de ayuno acelera probablemente el agotamiento de las reservas de grasa y acentúa la baja condición física, que se refleja en un anillo de crecimiento. Sin embargo, es dudoso que esta sea la causa principal de las pausas de crecimiento, ya que la maduración va precedida frecuentemente por un largo período de nutrición insignificante en muchas especies. Además, aparecen anillos tanto en los peces inmaduros como en los adultos. La posibilidad de profundos ritmos fisiológicos que determinan la cesación estacional del crecimiento puede apoyarse en un experimento aislado citado por Johnels (1954): algunos Barbus gambiensis que habían sido transportados a Suecia y fueron mantenidos en condiciones uniformes en un acuario, interrumpieron de todos modos el crecimiento y originaron anillos de escamas precisamente al mismo tiempo en que lo hacían sus congéneres en el río Gambia.
Los anillos en las escamas y en otras partes duras se han utilizado para calcular el crecimiento en muchas especies. También se han deducido informaciones complementarias y estimaciones independientes a partir del análisis de las distribuciones de frecuencia de longitud en relación con el progreso de los diversos grupos de edad, así como a partir del crecimiento de peces marcados. Comparando los diversos métodos de determinación de la edad se ve que concuerdan bien, por lo menos en algunas especies (Rao y Rao, 1972; Gupta y Jhingran, 1973). Varios investigadores han utilizado el modelo de crecimiento de Von Bertalanffy:
Lt = L∞ {1 - exp [-K(t-to)]}
en el cual la longitud en el tiempo t + 1(L ) es una función de la longitud en el tiempo t (L ) según la ecuación de Ford-Walford:
Lt+1 = exp (-K Lt + L∞[1-exp (-g)]
donde K es el coeficiente de crecimiento y L es la longitud asintótica teórica que puede alcanzar la especie si creciese durante un tiempo infinito.
La mayoría de las especies parecen seguir bien este modelo respecto al crecimiento en longitud, o bien, introduciendo un factor de conversión adecuado, respecto al crecimiento en peso, como indican los ejemplos del Cuadro 6.4.
| Especies | Sexo | Ecuación de crecimiento | Autor |
|---|---|---|---|
| Alestes baremoze | m | Lt =237.8[l-e-0.8163(t-0.57)] | Durand y Loubens, 1969 |
| f | Lt =267.8[l-e-0.7172(t-0.52)] | Durand y Loubens, 1969 | |
| Catla catla | m+f | Lt =1275[l-e-0.28(t-0.11)] | Natarajan y Jhingran, 1975 |
| Labeo rohita | m+f | Lt =1015[l-e-0.276(t-0.333)] | Khan y Jhingran, 1975 |
| Labeo calbasu | m+f | Lt =1028[l-e-0.15(t-0.19)] | Gupta y Jhingran, 1973 |
| (Ganga river) | |||
| (Godavari river) | m+f | Lt =944[l-e-0.14(t+0.86)] | Rao y Rao, 1972 |
| Parapimelodus Valenciennesi | m+f | Lt =333[l-e-0.14(t-2.4)] | Candia et al., 1973 |
| Pimelodus maculatus | m | Lt =45.4[l-e-0.2104(t+0.61)] | Fenerich et al., 1975 |
| f | Lt =56.5[l-e0.1938(t+0.36)] | Fenerich at al., 1975 | |
| Prochilodus reticulatus | m+f | Lt =41.0[l-e-0.20(t-0.35)] | Espinosa y Gimenez, 1974 |
Puede verse en este cuadro que los peces macho y hembra de la misma especie tienen a menudo diferentes tasas de crecimiento y también distintos tamaños máximos, indicados por L∞. Las curvas de crecimiento de algunas especies representativas de un río africano (Níger) y del sistema de La Plata en América Latina muestran parte de la gama de variación interespecífica (Fig. 6.6). La mayoría de las especies crecen muy rápidamente en su primera temporada, característica que Lowe-McConnell (1967) consideró como propia de la adaptación. La predación es intensa en los ríos de llano inundable, por lo que es una gran ventaja para el pez crecer rápidamente hasta un tamaño demasiado grande para ser devorado antes de que desaparezca de la zona anegada la protección que ofrece la vegetación flotante. Es probable también que los peces necesiten alcanzar un tamaño suficiente para migrar en la época de retirada de las aguas. Parece haber pocas diferencias en el tamaño alcanzado en su primer año por peces que tienen una gran variedad de tamaños máximos, como hizo ver Merona (1983) en su análisis de más de cien especies africanas.
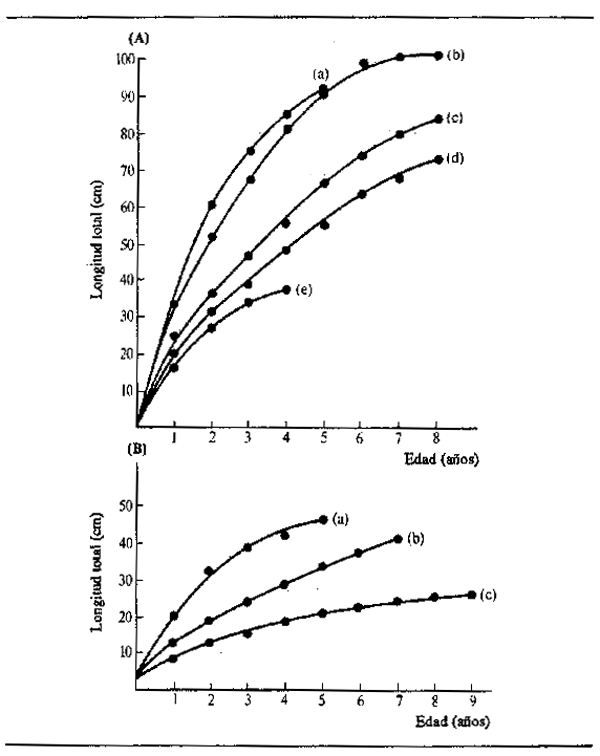
Figura 6.6 Crecimiento en longitud de peces representativos de los ríos: (A) Níger: (a) Heterotis niloticus; (b) Lates niloticus; (c) Mormyrops deliciosus; (d) Citharinus citharus; (e) Eutropius niloticus (B) La Plata: (a) Prochilodus platensis (según Cordiviola de Yuan, 1971); (b) Pimelodus maculatus (según Fenerich et al., 1975); (C)Parapimelouds valenciennesi (según Cabrera et at., 1973)
Si bien la curva de crecimiento de Von Bertalanffy describe adecuadamente el progreso en longitud año tras año, el crecimiento dentro de un mismo año no sigue el modelo. El largo período en el que el crecimiento cesa por completo o se restringe considerablemente significa que la mayor parte del estirón anual tiene lugar durante un tiempo relativamente breve. Dudley (1972), por ejemplo, comprobó que el 75% del crecimiento correspondiente al primer año del Oreochromis andersoni y el O. macrochir se producía dentro de las seis semanas de crecidas máximas en el río Kafue. El aumento de peso está todavía más sujeto a variación estacional, ocurriendo a menudo pérdidas temporales durante el estiaje.
En vista de las importantes implicaciones que el ritmo de crecimiento dentro de un año tiene para la estimación de la producción biológica, Daget Ecoutin (1976) han establecido un modelo de crecimiento modificado aplicable a las especies con prolongadas suspensiones anuales del crecimiento. Para ello es preciso introducir dos nuevos parámetros en la ecuación de crecimiento: ‘q’, que representa la duración en meses de la suspensión anual del crecimiento, y ‘t’, que es la duración del primer período de crecimiento, también en meses. El parámetro ‘t’ es necesario cuando la reproducción no coincide con el final del período de crecimiento suspendido en los procreadores. Si el período de crecimiento es 12 q meses, la curva normal de Von Bertalanffy se expresa así:
Lt = L∞ {1 exp [-g'(t-to)]}
donde t y to se expresan en meses y g' = g/12-q; obteniéndose to de la ecuación
to = t1 + (log(L-Lt) - Log L) / g'log e
El arco de la curva de crecimiento así obtenida se comprime de esta manera en 12-q meses y va seguido de una línea horizontal de q meses de longitud. Daget y Ecoutin aplicaron este modelo al Polypterus senegalus del Níger medio, obteniendo la curva de crecimiento medio que se indica en la Fig. 6.7. Cloern y Nichols (1978) propusieron una modificación similar del modelo de Von Bertalanffy teniendo en cuenta las variaciones estacionales de la tasa de crecimiento en aguas templadas:
Lt = Lmax - (Lmax - L-) exp[-a1 (t-to)-a2∫ttoexp(a3sen{(π/180)t+0}dτ)]
Este modelo, en el que L es la longitud en el tiempo (t), L max es el máximo tamaño corporal, L min es el tamaño corporal en el tiempo de incorporación de las nuevas cohortes, obtiene predicciones de crecimiento con una transición mucho más suave entre las fases de crecimiento y las de suspensión.
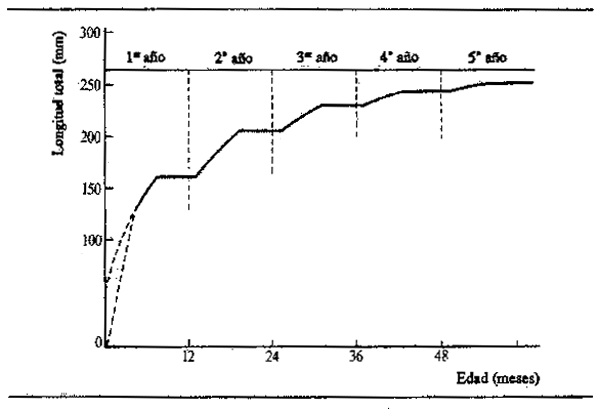
Figura 6.7 Crecimiento medio lineal del Polypterus senegalus en los primeros cinco años de vida, suponiendo una suspensión anual del crecimiento de seis meses y un periodo de crecimiento de siete meses en el primer año (T =-3). (Según Daget y Ecoutin, 1976)
Estos modelos describen situaciones en que el crecimiento se detiene por completo durante la estación seca y tienen la ventaja de basarse en modelos de crecimiento corrientes, pero son algo rígidos si se aplican a situaciones en que el crecimiento varía de un año a otro en función de las condiciones favorables o desfavorables. Tales condiciones requieren una trayectoria de crecimiento que esté menos predeterminada, y Welcomme y Hagborg (1977) tuvieron que adoptar un modelo diferente para el crecimiento dentro del año con objeto de tener esto en cuenta. Su fórmula es:
Lt+t1= Lt + G exp(t1)
Esta fórmula tiene las características de rápido aumento inicial de la longitud seguido por un período de crecimiento más lento (pero no una suspensión completa). Los valores de L para años sucesivos pueden corresponder a la relación de Von Bertalanffy, aunque no lo haga la forma de la curva dentro de un año calculada para semanas sucesivas. La ventaja de esta relación para establecer el modelo de crecimiento de los peces que habitan en la zona inundada es que el valor terminal del crecimiento anual puede cambiar según la intensidad de la inundación mediante la aplicación de un coeficiente apropiado a G.
En sus estudios sobre producción pesquera en el río Kafue, Kapetsky (1974 y 1974a) abordó un problema similar de formación de modelos dentro de estructuras de crecimiento anual. De sus propias observaciones y de las de Dudley (1972) resultaba claramente que el crecimiento en peso de Sarotherodon y Oreochromis spp. en los llanos de Kafue no se detiene por completo en la estación seca, aunque se hace mucho más lento. Kapetsky, por consiguiente, propuso rotar la relación Wt = Wo exp(Gt) sobre su diagonal e invertirla. La ecuación resultante es:
Wt = Wo+ W1 [1-exp(-gt)]
siendo W1 = Wo exp G(12). En este caso W1 = peso al final de un crecimiento anual, mientras que los segmentos individuales de t y el coeficiente de crecimiento g se expresan en meses.
Hay pocos estudios sobre variación interanual de la tasa de crecimiento de los peces del ritrón y de corrientes de orden inferior en la zona templada. Puede suponerse que, dadas las condiciones relativamente estables de esos entornos de año en año, las tasas de crecimiento son similares. No obstante, hay indicaciones de que los factores dependientes de la densidad pueden influir sobre la tasa de crecimiento en algunas especies, aunque el origen de las fluctuaciones no esté claro.
Los estudios sobre el crecimiento de las especies ícticas que habitan en el potamón han puesto de manifiesto que hay considerables variaciones en el crecimiento de un año a otro dentro las mismas especies. El examen más detallado de las posibles causas de tales variaciones se ha realizado para algunas especies de cíclidos en el río Kafue. Dudley (1972 y 1974) y Kapetsky (1974) encontraron correlaciones significativas entre algunas variables físicas y el principal incremento de crecimiento. La intensidad y la duración de la crecida en particular podrían determinar gran parte de las variaciones de año en año en el crecimiento de Tilapia rendalli, Oreochromis andersoni y O. macrochir en sus clases anuales primera y segunda. Las bajas temperaturas en la estación seca parecen también influir sobre los peces de ciertas clases anuales y dan buenas correlaciones parciales si se introducen en la ecuación después de alguna medida de la intensidad de la crecida. En el Cuadro 6.5 se presentan relaciones típicas en las que TI es un índice de temperatura, FI es un índice de crecida (flooding) tomado de la zona con arreglo a la curva de crecida (Dudley, 1972), HI 3 son índices hidrológicos que resumen la retirada de las aguas en la estación seca (Kapetsky, 1974).
Las ecuaciones de regresión de Kapetsky se utilizaron con éxito para predecir los incrementos de crecimiento de ciertas clases anuales, pero la congruencia de los resultados no es uniforme, posiblemente a causa de la brevedad temporal de las series sobre las que se basan los cálculos. Son suficientes, sin embargo, para indicar la importancia de los factores físicos externos en la determinación del crecimiento de los peces en tales sistemas. Este trabajo en el Kafue no es un trabajo aislado. Ya en 1934 Wimpenny (citado en Holden, 1963) comprobó que la producción de peces del delta del Nilo y el lago Manzala estaba en relación con el nivel de crecida, de manera que las grandes crecidas iban seguidas por producciones superiores a la media, lo que se debía en parte a unas tasas de crecimiento más elevadas de los peces en su primer año. Análogamente las condiciones de nutrición, y por lo tanto de crecimiento, de los peces no anadrómicos en el río Amur mejoran considerablemente en los años de aguas abundantes (Krykhtin, 1972, citado por Krykhtin, 1975). Los años de crecidas excepcionalmente bajas durante la sequía saheliana de 1968-74 proporcionaron una oportunidad para evaluar sus efectos sobre el crecimiento de las especies ícticas en los ríos Senegal, Níger y Logone. En el Senegal, Reizer (1974) apreció grandes diferencias en el crecimiento del Citharus citharus entre 1968, año de crecida particularmente débil, y otros años (Fig.6.8). La primera clase anual faltaba totalmente para ese año. El incremento de crecimiento del segundo año para la clase anual de 1967 en la crecida de 1968 fue 3.91 cm, mientras que la clase anual de 1966 creció 7.99 cm durante la 1967. El crecimiento en el tercer año presentó diferencias similares: un incremento de 2.32 cm para la clase anual de 1966 (crecida de 1988) y de 8.37 cm para la clase anual de 1967 (crecida de 1969). Diferencias de crecimiento se observaron también en el Níger, donde las crecidas de 1971 y 1972 fueron particularmente malas. En este río Dansoko (1975) y Dansoko et al. (1976) estudiaron dos especies de Hydrocynus, H. brevis e H. forskahlii, y comprobaron que el crecimiento, particularmente de los nacidos en el año, era débil en ambas especies en esos dos años. ElHydrocynus forskahlii, que habita únicamente en el río, mostró este efecto menos que el H brevis, que depende mucho de la zona inundable para su nutrición, pero de todas maneras las diferencias eran apreciables. Es también interesante que las clases anuales con un crecimiento deficiente en el primer año continúan desarrollándose mal aunque mejoren las condiciones en años ulteriores. Del mismo modo las clases anuales con un buen crecimiento inicial no sufren tanto en los años malos. En el Logone, Benech y Quensiere (1984)pudieron demostrar también que un mejor crecimiento, representado por el peso medio de los peces que salen del llano de Yaeres por el cauce de El Beid, está en correlación con la crecida del Logone en el caso de varias especies como Hyperopisus bebe, Brachysynodontis batensoda,Marcusenius cyprincides,Oreochromis aureus y O. niloticus.
| Especies | Año de crecimiento | Sexo | Modelo | Tasa |
|---|---|---|---|---|
| Oreochromis andersoni | 1 | M | Crecimiento (cm) = 0.02FI + 12.87 a | 0.92 |
| 1 | M | TL (mm) = 146.51-0.11 (HI2) b | 0.94 | |
| 1 | F | Crecimiento (cm) = 0.014FI + 1.98(TI) a | 0.78 | |
| 2 | M | TL (mm) = -29.47 + 1.98(TI) b | 0.90 | |
| 2 | F | TL (mm) =38.24-0.30(HI3) + 0.83(TI) b | 0.93 | |
| Oreochromis macrochir | 1 | M | Crecimiento (cm) = 0.2FI + 11.02 a | 0.90 |
| 1 | M | TL (mm) = 130.39-0.13(HI2) b | 0.92 | |
| 1 | F | TL (mm) = 130.13-0.32(HI2) b | 0.85 | |
| 2 | M | TL (mm) = 74.72.0.10(HI3) b | 0.58 | |
| 2 | F | TL (mm) = 14.69-0.18(HI3) b | 0.95 | |
| Tilapia rendalli | 1 | M | Crecimiento (cm) = 0.029Fl + 12.8 a | 0.80 |
a Dudley, 1972
b Kapetsky, 1974
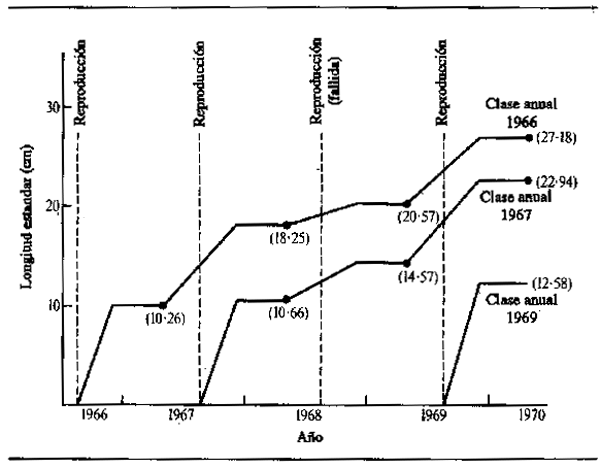
Figura 6.8 Crecimiento del Citharinus citharus en el río Senegal: clases anuales de 1966, 1967 y 1969. Números entre paréntesis = longitud total en el tiempo de suspensión del crecimiento, en centímetros. (Según Reizer, 1974)
Los peces que habitan en los ríos tienen diversos hábitos reproductivos que los adaptan a las condiciones cambiantes que se les presentan a lo largo del río y a las difficultades particulares inherentes a los sistemas de cría cuando los niveles hídricos fluctúan rápidamente y con frecuencia las condiciones son rigurosas en cuanto al flujo o la deficiencia de oxígeno. Parece que las especializaciones físicas y de comportamiento para la reproducción son más variadas que las orientadas a la nutrición en estos ecosistemas. La amplitud de la gama de adaptaciones se revela en el hecho de que casi todas las modalidades reproductivas de Balon (Balon 1975 y 1981) están representadas en los diversos ríos del mundo. Estas modalidades, que constituyen una útil clasificación ecológica del comportamiento, los parajes y los sustratos en relación con la reproducción, se enumeran en el Cuadro 6.6 junto con algunos taxones representativos. Dentro de estas modalidades se han perfilado en líneas generales varias estrategias reproductivas, que se resumen en el Cuadro 6.7.
Cuadro 6.6
Clasificación de modalidades reproductivas de peces con taxones representativos de sistemas fluviales (según Balon, 1981)
Sección etológica A: No guardadores
A.1 Desovadores en sustrato abierto
(Algunos rasgos característicos de ontogenia temprana)
Desovadores pelágicos (pelagófilos)
Numerosos huevos flotantes, órganos respiratorios embrionarios inexistentes o escasamente desarrollados, poco pigmento, ausencia de fotofobia. Ctenopoma muriei, Lates niloticus.
Desovadores en rocas y grava con larvas pelágicas (litopelagófilos)
Corión adherente al principio, pronto algunos huevos flotantes, después de al eclosión los embriones quedan en libertad pelágica mediante flotación positiva o movimiento activo, ausencia de fotofobia, estructuras respiratorias embrionarias limitadas. Prochilodus spp.
Desovadores en rocas y grava con larvas bentónicas (litófilos)
Embriones fotófobos de eclosión temprana, ocultos bajo piedras, estructuras respiratorias embrionarias moderadamente desarrolladas, pigmento tardío. Muchas especies de ciprínidos y caracinos, Barbus y Labeo.
Desovadores opcionales en plantas (fitolitófilos)
Huevos adherentes sobre objetos sumergidos, eclosión tardía, glándulas cementosas en los embriones libres, fotófobos, estructuras respiratorias moderadamente desarrolladas. Muchos ciprínidos y Rutilus rutilus.
Desovadores obligatorios en plantas (fitófilos)
La envoltura adhesiva de los huevos se pega a plantas sumergidas vivas o muertas, eclosión tardía, glándulas cementosas, ausencia de fotofobia, estructuras respiratorias embrionarias muy bien desarrolladas. Muchas especies deciprínidos, caracinos y silúridos, Puntius gonionotus.
Desovadores en arena (psamófilos)
Huevos adherentes en agua corriente sobre arena o raíces finas en arena, embriones libres sin glándulas cementosas, fototróficos, estructuras respiratorias débilmente desarrolladas, grandes aletas pectorales, grandes neuromastos con cúpulas. Muchas especies de ciprínidos y caracinos.
Desovadores terrestres (aerófilos)
Pequeños huevos adherentes desparramados fuera del agua en el césped húmedo, no fotófobos, estructuras respiratorias moderadamente desarrolladas. Brycon oetrosus.
A.2 Ocultadores de freza
Desovadores en playa (aeropsamófilos)
Desove sobre el nivel dei agua en crecidas altas; los cigotos en arena húmeda maduran con las vibraciones de las olas; pelágicos después. No representados.
Peces anuales (xerófilos)
En la fase de escisión de los huevos, los blastómeros se dispersan y quedan en una primera diapausa facultativa, más otros dos intervalos de reposo oligados; los huevos y los embriones pueden sobrevivir muchos meses en barro seco. Nothobranchius.
Desovadores en piedra y grava (litófilos)
Cigotos enterrados en depresiones de grava llamadas redds o en intersticios de las rocas, vitelos grandes y densos, plexos respiratorios extensos para respiración exógena y carotenoides para la respiración endógena, embriones libres de eclosión temprana, fotófobos, grandes alevines emergentes. Muchas especies de salmónidos.
Desovadores en oquedades (espeleófilos)
Pocos huevos grandes adherentes, necesitan ocultarse en cuevas, estructuras respiratorias embrionarias extensas, grandes larvas emergentes.
Desovadores en invertebrados vivos (ostracófilos)
Cigotos depositados mediante el oviscapto de la hembra en cavidades corporales de moluscos, cangrejos, asquidios o esponjas, vitelos grandes y densos, lóbulos o espinas y fotofobia para impedir la expulsión de embriones libres, grandes plexos respiratorios embrionarios y carotinoides, probable mecanismo bioquímico para la inmunosupresión. Rhodeus sericeus.
Sección etológica B: Guardadores
B.1 Selectores de sustrato
Desovadores pelágicos (pelagófilos)
Huevos no adherentes, positivamente flotantes, guardados en la superficie de aguas hipóxicas, estructuras respiratorias embriónicas extensas. Algunos Ophicephalus y Anabas spp.
Desovadores sobre el nivel del agua (aerófilos)
Huevos adherentes, embriones con glándulas cementosas, el macho desde el agua rocía la nidada periódicamente. Copeina arnoldi.
Desovadores en piedra (litófilos)
Huevos fuertemente adherentes, ovales o cilíndricos, pegados a un palo por fibras en racimos, la mayoría tienen embriones y larvas pelágicos libres. Loricaria parva, L. macrops y algunos cíclidos pequeños.
Desovadores en plantas (fitófilos)
Huevos adherentes pegados a diversas plantas acuáticas, embriones libres sin glándulas cementosas que nadan instantáneamente después de un prolongado período embrionario. Polypterus spp.
B.2 Desovadores en nido
Anidadores en espuma (afrófilos)
Huevos depositados en una piña de burbujas mucosas, embriones con glándulas cementosas y estructuras respiratorias bien desarrolladas. Hepsetus odoe, Hoplosternum, algunos anabántidos.
Anidadores en sustratos y materiales diversos (polífilos)
Huevos adherentes pegados por separado o en piñas sobre cualquier sustrato disponible, vitelo denso con alto contenido de carotinoides, estructuras respiratorias embrionarias bien desarrolladas, frecuente alimentación de los jóvenes con las mucosidades parentales. Notopterus chitala, Hoplias malabaricus.
Anidadores en piedras y grava (litófilos)
Huevos en envolturas esféricas o elipsoidales siempre adherentes, los embriones libres fotófobos o con glándulas cementosas oscilan con la cola hacia arriba en movimientos respiratorios, estructuras respiratorias embrionarias moderadamente o bien desarrolladas, muchos peces jóvenes se alimentan primero de las mucosidades parentales. Aequidens y otros cíclidos, algunos caracinos, p.ej. Leporinus.
Anidadores encoladores (ariadnófilos)
El macho guarda celosamente los huevos depositados en nidos aglutinados mediante un hilo viscoso producido con una secreción renal; huevos y embriones ventilados por el macho, pese a las estructuras respiratorias bien desarrolladas. Gasterosteus aculeatus
Anidadores en vegetales (fitófilos)
Huevos adherentes pegados a las plantas, los embriones libres se agarran a las plantas mediante glándulas cementosas, estructura respiratoria bien desarrollada en los embriones, asistidos por ventilación parental. Clarias batrachus.
Anidadores en arena (psamófilos)
Corión grueso adherente con granos de arena que se desprenden gradualmente o robustos huevos flotantes, el embrión libre reposa sobre grandes aletas pectorales, estructuras respiratorias embrionarias débilmente desarrolladas. Tilapia spp.
Anidadores en oquedades (espeleófilos)
Hay por lo menos dos variantes en esta modalidad: los anidadores en el techo de la cavidad tienen estructuras respiratorias embrionarias moderadamente desarrolladas, mientras que los anidadores en huecos cavados en el fondo tienen muy desarrolladas tales estructuras. Varios cíclidos.
Anidadores en anemonas (actiniariófilos)
Huevos adherentes en piña guardados en la base de la anemona marina; los padres recubren los huevos con una mucosidad contra nematoquistos, embrión libre fototrófico, planctónico, los primeros juveniles seleccionan la anemona hospedante. No representados.
Sección etológica C: Paridores
C.1 Paridores externos
Incubadores de transferencia
Huevos llevados durante algún tiempo antes de la puesta: en las aletas pelvianas ahuecadas, en una piña colgante del poro genital, dentro de la cavidad corporal (antes ovovivíparos); después de la puesta, muy similares a los no guardadores fitófilos. Callichthys, Corydoras.
Incubadores auxiliares
Huevos adherentes llevados en piñas o bolas sobre la piel esponjosa del vientre, del dorso, bajo las aletas pectorales o en un gancho en la región superoccipital, o enrollados en envolvente del cuerpo de la hembra; circulación respiratoria embrionaria y pigmentos bien desarrollados. Loricaria spp.
Incubadores bucales
Huevos incubados en la cavidad bucal después de fecundación interna, externa sincrónica o asincrónica, o bucal, junto con huevos no fecundados; los grandes huevos esféricos u ovales con vitelo denso son batidos en la cavidad bucal o bien envueltos; cuando las estructuras respiratorias embriónicas bien desarrolladas tienen que ser asistidas por el metabolismo oxidante endógeno de los carotinoides, se sueltan los alevines. Muchos cíclidos, Osteoglossum.
Incubadores en cámaras branquiales
Los huevos del pez de las cuevas (cavefish) de América del Norte se incuban en las cavidades branquiales.
Incubadores en bolsa
Huevos incubados en una bolsa externa (marsupium): labio inferior vuelto y extendido, bolsa de aleta, o bolsa ventral cubierta por una membrana o lámina, estructuras respiratorias embrionarias bien desarrolladas y pigmentos, bajo número de cigotos. Loricaria vetula y L. anus.
C.2 Paridores internos
Paridores internos facultativos
Los huevos se fecundan algunas veces internamente por accidente mediante la yuxtaposición de los poros genitales en peces normalmente ovíparos, y pueden ser retenidos dentro del sistema reproductivo de la hembra para terminar algunas de las primeras fases del desarrollo embrionario, rara vez más allá de la fase de escisión; el peso desciende durante el desarrollo de los embriones. Rivulus marmoratus, Oryzias latipes, Pantodon buchholzi.
Vivíparos lecitotróficos obligados
Huevos fecundados internamente, incubados en el sistema reproductivo de la hembra hasta el final de la fase embrionaria o más allá, sin transferencia de nutrientes de la madre at embrión; como en los peces ovíparos, el vitelo es la única fuente de nutrición y cubre la mayor parte de las necesidades respiratorias; cierta especialización, la excreción y la osmorregulación intrauterinas; el peso desciende durante el desarrollo de los embriones. Poeciliopsis monacha, Poecilia reticulata, Xenopoecilus poptae.
Oófagos y adelfófagos matrotrofos
Entre los muchos huevos que salen de un ovario, sólo uno o como máximo unos pocos embriones llegan a ser alevines y juveniles, nutriéndose a expensas del vitelo de otros huevos menos desarrollados presentes y/o periódicamente ovulados (oofagia) y, en formas más especializadas, a expensas de embriones hermanos menos desarrollados (adelfofagia); especialización para la respiración, la excreción y la osmorregulación intrauterinas, como en la anterior modalidad; gran aumento de peso durante el desarrollo intrauterino.
Trofodermos vivíparos
Los huevos internamente fecundados se transforman en embriones, alevines o juveniles cuyo intercambio nutricional y gaseoso total o parcial es suplido por la madre mediante histotrofos secretorios ingeridos o absorbidos por el feto través de las estructuras absorbentes epiteliales (equivalentes a la placenta) o de un saco vitelino; ganancia de peso pequeña a moderada durante el desarrollo embrionario. Poeciliopsis turneri, Heterandria formosa, Anableps dowi.
| Tipo de fecundidad | Estacionalidad | Ejemplos | Movimientos y cuidados |
|---|---|---|---|
| parentales | |||
| “Big bang” | Una vez en el lapsovital | Anguilla | Migraciones catádromas muy largas, cuidado parental nulo |
| Desovadores totales (fecundidad muy alta) | Muy estacionales, concentrados en crecidas anuales o bianuales | Characinos: p.ej. Prochilodus, Salminus, Alestes | Migrantes a larga distancia, desove en sustrato abierto |
| Ciprínidos: p.ej. Labeo, Barbus, Cirrhinus | |||
| Silúridos: p.ej. Schilbe | |||
| Heteropneustes, Catla catla, Labeo rohita, | Migrantes laterales locales, desove en sustrato abierto | ||
| Mormíridos | |||
| Desovadores parciales | Durante todo el tiempo de crecida | Algunos ciprínidos, characinos y silúridos, p.ej. Clarias, Microalestes acutidens | Migrantes leterales principalmente, desove en sustrato abierto |
| Variable | Propterus, Arapaima, Serrasalmus, Hoplias, Heterotis | Constructores de nidos en el fondo y guardadores | |
| Ophicephalus, Gymnarchus | Constructores de nidos flotantes | ||
| Hepsetus, Hoplosternum, Anabantidae | Constructores de nidos de burbujas | ||
| Desovadores de pequña freza (baja fecundidad) | Crecida, pero pueden empezar durante el estiaje o continuar todo el año | Tipalia, Hypostomus | Constructores de nidos con varios tipos de comportamiento |
| Aspredo, Loricaria sp. | Portadores de huevos | ||
| Osteoglossum, Sarotherodon spp. | Incubadores bucales | ||
| Potamotrygon, Poeciliae | Vivíparos | ||
| Final de las lluvias | Algunos ciprínidos | Especies anuales con huevos en reposo |
Los peces que desovan dentro de los tramos superiores del cauce principal suelen tener que luchar con la fuerte corriente y las turbulencias. En consecuencia, o bien ponen huevos adherentes que se pegan a las rocas o a las plantas (litófilos o fitófilos), o bien los ponen en grietas de los sustratos rocosos de los rabiones (litófilos). Algunos salmónidos por ejemplo cavan “redds” en grava fina con objeto tanto de proteger como de ventilar los huevos. Otras especies que desovan en ríos menores pueden poner sus huevos en aguas muy someras o en un medio terrestre húmedo (aerófilos). Por ejemplo, el grupo Brycon petrosus, según la descripción de Kramer (1978), coloca sus huevos en la salpicada en las márgenes de los ríos panameños. Otras varias especies, entre ellas Fundulus similis, F. heteroclitus e Hypomesus pretiosus tienen también un comportamiento similar. Otros peces de los ríos Amazonas, Madeira, Orinoco, Danubio y Amur, y presumiblemente de otros muchos ríos, que desovan en el cauce principal tiene huevos semiflotantes (litopelagófilos) que van a la deriva con la corriente hasta que encuentran lugares idóneos de alimentación, generalmente en llanos inundados o aguas remansadas.
Muchas especies migran a considerables distancias río arriba para desovar en el ritrón o corrientes de orden inferior donde se supone que la buena ventilación, la disponibilidad de alimentación en los rabiones y la relativa ausencia de predadores son factores que favorecen el desarrollo de los alevines. No obstante, para contrarrestar los elevados riesgos inherentes a esos entornos casi todas las especies que desovan en tales regiones producen grandes números de huevos y son desovadores totales. Las observaciones realizadas por el INDERENA (1973) en el río Magdalena muestran que no todos los migrantes aguas arriba buscan el mismo tipo de cabeceras. El Brycon moorei buscaba pequeños brazos laterales cortos apartándose del cauce principal, mientras que el Prochilodus reticulatus permanecía en el cauce, el Salminus affinis ascendía por corrientes laterales hasta zonas de fuerte flujo y el Brycon henni llegaba a los más altos tramos accesibles del río principal.
En Europa, el éxito de la cría de algunas especies depende principalmente de la presencia de sustratos idóneos. Incluso bajo regímenes hidrológicos considerablemente modificados, especies como Rutilus rutilus o Abramis brama se han mostrado capaces de cambiar el comportamiento migratorio que siguen en el Volga o en el bajo Danubio para adoptar uno más estático en las modificadas corrientes europeas, siempre que dispongan de los sustratos requeridos. Otras especies, como Chandrostoma nasus, Barbus barbus o Leuciscus idus, se han mostrado mucho menos capaces de adaptación.
Las especies migratorias pueden alterar su estrategia reproductiva para adaptarse a diferentes condiciones climáticas. Por ejemplo la Alosa sapidissima, una especie anadrómica que penetra en los ríos de la costa oriental de los Estados Unidos para desovar, cría con más frecuencia, aunque con pocos huevos por puesta, en los ríos más fríos del norte que en los más cálidos del sur (Legget y Carscadden, 1978). Esto significa que en los ríos del norte la energía disponible se emplea más en la migración para colocar los huevos y los alevines en las condiciones más favorables. Legget y Crascadden añaden que los estudios disponibles sugieren que otras muchas especies son igualmente capaces de ajustar con precisión sus estrategias reproductivas para adaptarlas a las circunstancias ambientales locales. Este comportamiento significaría que se desarrollarían poblaciones específicas para ciertos ríos y que se requeriría una capacidad de orientación para asegurar que los comportamientos correspondan a las condiciones climáticas del entorno en que se realiza el desove.
Las estrategias más diversas de reproducción y cría son las que se encuentran en los peces que desovan en las zonas anegadas, y muchas especies migran a considerables distancias en contra o a favor de la corriente para criar de manera que sus alevines estén situados en esos hábitats productivos. Se ha documentado en efecto el uso del llano anegado para el desove en la mayoría de los sistemas fluviales tropicales, y es también frecuente en los ríos de zonas templadas que tienen todavía tales zonas de anegamiento. Los diversos autores que han escrito sobre distribución de las larvas de peces en el sistema Mississippi-Missouri (p.ej. Kallemyn y Novotny, 1877) afirman que las zonas pantanosas inundables son vitales para el desove de muchas especies. Observaciones análogas se han hecho en el Danubio (p.ej. Holcik y Bastl, 1976) y en el Volga (Koblitskaya, 1985).
Los peces oscuros migratorios tienen comportamientos muy variados. La mayoría son fitolitófilos o fitófilos de sustrato abierto que pegan sus huevos o los desparraman entre la vegetación o sobre fondos despejados de la llanura inundada. Con frecuencia los parajes escogidos para la puesta de los huevos se encuentran en cauces que llevan el agua a la llanura, como en las especies Alestes del río LOngone que pones sus huevos en los cauces que alimentan los llanos de los Yaeres, mientras que propios adultos nunca penetran en la llanura. Por su parte, las especies que migran a las zonas de anegamiento de la provincia Ayuthaya de Tailandia (sistema fluvial del Chao Phrya) ilustran la selección de sustratos para el desove (Tongsanga y Kessunchai, 1966). El Crossocheilus reba desova en los arrozales inundados, igual que el Wallago attu. Otro bagre, Pangasius sutchi, desparrama sus huevos entre las hierbas y matorrales sumergidos en las márgenes someramente inundadas de los Klongs o canales. La anguila de primavera Macrognathus aculeatus desova tanto en los arrozales inundados como en los cauces, sobre fondos claros o entre la maleza. Algunas especies como el Puntius goniotus depositan sus huevos en medio de los cauces, posiblemente para que la corriente los lleve a criaderos idóneos.
Especies y géneros estrechamente relacionados muestran también comportamientos contrapuestos. Por ejemplo, el Hydrocynus brevis cría en los llanos anegados del Níger durante las crecidas, mientras que el H. forskahlii, morfológicamente similar, lo hace en el cauce principal del río durante el estiaje. Jackson y Coetzee (1982) han observado los hábitos del Labeo umbratus sudafricano que se traslada a los prados inundados para poner sus huevos adherentes entre la vegetación temporalmente sumergida, en contraste con los Barbus johnstoni y B. trapilepidotus locales, que desovan ambos en graveras de ríos de flujo rápido. Sin embargo, su conclusión de que estos tipos de comportamiento pueden extenderse para hacer una distinción fundamental entre los dos géneros no resiste un análisis más detenido, ya que algunas especies Labeo, p.ej. Labeo parvus del río Níger que habita en los rápidos, cría en las zonas de rabiones del cauce principal y algunos pequeños Barbus crían igualmente en los prados inundados de la llanura.
La mayoría de las especies de peces oscuros que, cuando más, son sólo migrantes locales practican alguna forma de cuidado parental, y en algunos géneros se encuentran diversos tipos de comportamiento. Ejemplo de ello es el género Loricaria, del que L. parva y L. macops se colocan sobre los huevos pegados a espacios despejados de las rocas. Los padres limpian y abanican los huevos de vez en cuando. La hembra del L. piracicalae tiene una piel esponjosa especial en la región ventral; el pez rueda sobre los huevos fecundados, que se adhieren a esa región. L. vetula y L. anus tienen una bolsa formada por la extensión del labio inferior de las hembras en la que se alojan los huevos, y en la especie Loricaria (Lowe-McConnell, 1964) el labio inferior se extiende en una prolongación especial de la que están suspendidas las crías. Otros loricados como el panameño L. uracantha utiliza huecos y cavidades en trozos de madera como lugares para anidar (Moodie y Power, 1982).
La formación de nidos es muy corriente entre las especies de la llanura anegable. La Arapaima gigas hace huecos en el fondo de la sabana inundada y ambos progenitores guardan los huevos allí depositados (Sánchez, 1961). Varias especies de cíclidos hacen nidos. Algunos de éstos son simplemente espacios limpiados en la roca, otros son huecos bajo las rocas o la vegetación, y otros incluso son pozos excavados, a veces de diseño complejo. El Heterotis niloticus constryue nidos en medio de masas de vegetación en las aguas marginales someras de la llanura, mientras que el Gymnarchus niloticus hace masas flotantes de hierbas acuáticas en forma de recipiente o balsa en donde depositan sus huevos (Svensson, 1933). La diferente arquitectura de los nidos de Protopterus ha sido descrita por Johnels y Svensson (1954) respecto al P. annectens y por Greenwood (1958) respecto al P. aethiopicus. La gama va desde simples zonas hundidas en un sustrato arenoso hasta complejas estructuras abovedadas de raíces de papiro. El caracino Hoplias malabaricus construye un nido sencillo en el fondo con cualquier material a su alcance, y de algunas especies de Serrasalmus se dice también que guardan masas de huevos depositados en las raíces de los árboles, y observaciones en acuarios han revelado que excavan nidos en masas vegetales (Braker, 1963).
En algunas especies se encuentran nidos flotantes. Algunos oficéfalos hacen tipos primitivos. El Ophicephalus micropeltes deja que sus huevos pelágicos floten en la superficie formando piña, rodeándolos entonces con un aro de pequeños fragmentos arrancados de la vegetación circundante (Tongsanga y Kessunchai, 1966). El macho se encarga de guardar la masa flotante. El Hepsetus odoe es especial entre los caracinos por cuanto construye un nido de espuma que se instala entre los tallos de las hierbas o la maleza en las orillas de la llanura. Nidos espumosos hechos con secreciones mucosas de uno o de ambos progenitores son comunes en otras familias. Entre los silúridos, el Callichthys callichthys y el Hoplosternum littorale construyen una balsa con burbujas y plantas acuáticas. También hacen nidos flotantes muchos anabántidos como Ctenopoma damasi en Africa (Berns y Peters, 1969) y Colisa, Betta y Trichogaster en Asia. La construcción de nidos permite que los huevos y los alevines inmediatamente después de la eclosión se concentren en un espacio protegido que uno o los dos progenitores puede defender fácilmente. Los nidos flotantes ponen además a los huevos y los alevines en contacto con las capas superiores mejor oxigenadas de la columna acuática, aspecto muy importante ya que la mayoría de las especies que hacen este tipo de nidos habitan en aguas muy desoxigenadas. Los peces innmaduros de las especies que hacen sus nidos en el fondo tienen con frecuencia filamentos branquiales para mejorar su toma de oxígeno, y los progenitores abanican el nido para producir una corriente de agua aireada. Además, los nidos suelen colocarse en los límites de las aguas crecientes, donde los niveles de oxígeno disuelto son todavía moderadamente elevados. Sin embargo, estas construcciones son vulnerables a los cambios repentinos del nivel del agua, que pueden dejar el nido varado o sumergido a una profundidad excesiva en un agua carente de oxígeno. Para evitar que esto suceda, algunos cíclidos llevan sus huevos en la boca hacia arriba o hacia abajo siguiendo el avance o el retroceso de las aguas.
El cuidado parental llega a sus formas extremas en las especies que llevan consigo a sus crías durante todo el período de desarrollo. Muchos de los cíclidos africanos y algunos de los sudamericanos, y otras especies como Osteoglossum bicirrhosum, incuban sus huevos en la boca, y continúan dando cobijo a los alevines hasta que se hacen independientes. El hábito de incubación bucal hace posible que el desove tenga lugar antes de las crecidas. Las crías pueden conservarse en un entorno bien oxigenado (la boca del padre o la madre) durante todo su desarrollo, y pueden ser depositadas en criaderos en los bordes de la llanura muy lejos de los lugares de fecundación. La mayoría de las especies que practican la incubación bucal construyen también nidos que sirven al mismo tiempo como señaladores territoriales para sus rituales de reproducción y como lugares limpios en los que se depositan los huevos antes de ser recogidos por uno de los progenitores. La mayoría de los ciprinodontios y de los caracinos glandulocaudinos han progresado incluso más y han desarrollado la fecundación interna, que en muchos ciprinodontios va unida a la calidad de vivíparos. Nelson (1964) en su estudio de los glandulocaudinos consideró que la fecundación interna es una adaptación al entorno de la zona inundada, al permitir que el apareamiento se realice cuando los peces están concentrados en los hábitats de estiaje. La puesta de los huevos, o en el caso de los ciprinodontios poecilios el nacimiento de los alevines, puede demorarse así hasta que la hembra pueda trasladarse a las aguas ribereñas poco profundas de la zona inundada.
La fecundidad y las modalidades de desove de los peces guardan relación con los tipos de comportamiento reproductivo antes descritos. Existen dos categorías principales: desovadores totales, todos cuyos huevos maduran y se sueltan en un tiempo muy breve, y desovadores múltiples, que realizan en una misma estación repetidas puestas, en cada una de las cuales sólo madura una pequeña parte de la freza.
Las especies de peces blancos que migran a largas distancias, que suelen desovar en sustratos abiertos y no practican el cuidado parental, pertenecen a la primera categoría. Sus huevos suelen ser pequeños y se producen en grandes cantidades para contrarrestar las pérdidas inherentes a este tipo de desove. Peces como el Prochilodus platensis producen entre 360 000 y 750 000 huevos por individuo entre 40 cm y 65 cm respectivamente (Vidal, 1967). Las masas de huevos de P. scrofa (lhering, 1930) y P. argenteus (Fontenele, 1953) alcanzan también esos números. Según Ringuelet et al. (1967), el Salminus maxillosus, de 52 a 100 cm, produce entre 1 152 900 y 2 610 000 huevos. La ecuación para la fecundidad de Hilsa ilisha, F = 0,9550 exp 0,5396, formulada por Pillay y Rosa (1963), predice entre 250 000 y 1 600 000 huevos por individuo en la gama de tamaños normales. La fecundidad del Alestes baremoze oscila entre 32 000 huevos para una hembra de 24,4 cm de longitud (177 gm) y 111 000 huevos para una hembra de 31,4 cm (394 mm) y se describe mediante la relación: F = 0,345 peso de la hembra en gm - 25 (Durand y Loubens, 1970). Especies realmente grandes como Lates niloticus pueden producir cantidades extraordinarias de huevos, habiéndose documentado 11 millones en algunos ejemplares (Okedi, 1971). Aunque estos ejemplos indican los números de huevos producidos por los desovadores totales, la enumeración dista de ser completa, y pueden verse más detalles en Lowe-McConnell (1975).
El desove parcial suele ir asociado a cierta medida de cuidado parental. Loa huevos son mayores, lo que se refleja su número menor por gramo de peso del ovario. La hembra de un desovador total como el Eutropius niloticus tiene 2 950 huevos/gm, mientras que las de Oreochromis sp. tienen alrededor de 135 huevos/gm (Willoughby y Tweddle, 1977). El número de huevos puestos en un solo desove es mucho más bajo que en los desovadores totales. Sin embargo, los desovadores parciales pueden criar varias veces durante cada temporada, por lo que es difícil calcular la fecundidad total del pez. La situación se complica por el hecho de que el número de alevines criados depende más de la capacidad parental para cuidarlos que de la producción ovárica. Un ejemplo típico es el cíclido incubador bucal Oreochromis leucostictus cuya producción ovárica de huevos aumenta aproximadamente en función del cuadrado de la longitud (F = 1.091 L2.156), pero cuya capacidad de incubación aumenta sólo linealmente (Incub. = 17.6 L - 78.2) (Welcomme, 1967). El hábito del desove parcial se adapta a las regiones con niveles hídricos irregulares, ya que hace tolerable la pérdida de una o más frezas por la imprevisibilidad de las circunstancias ambientales. Otro mecanismo para hacer frente a esta dificultad es el que se necuentra en especies como la Arapaima gigas, cuyos huevos maduran sólo por terceras partes cada vez, quedando disponibles el resto para el caso de que las primeras frezas se pierdan a causa de los cambios repentinos en el nivel de las aguas.
La reproducción de los peces de río es muy estacional en todo el mundo. Esta estacionalidad parece depender básicamente de dos factores, temperatura y flujo, que en las zonas templadas son más o menos sincrónicos por cuanto los aumentos del flujo resultan directamente de la fundición de la nieve y del aumento de las precipitaciones que conlleva la elevación de las temperaturas en primavera. Al acercarse a los trópicos, disminuye de manera manifiesta la influencia de la temperatura y el régimen de crecidas adquiere cada vez más importancia como principal regulador de los tiempos de reproducción. Así pues, en todo el mundo el comienzo de la reproducción de la mayoría de las especies tiende a coincidir con la iniciación de las crecidas. El desove puede tener lugar con aguas bajas, crecientes o con crecida máxima, pero sólo muy raramente durante la retirada de las aguas.
Se conocen no obstante algunas especies que crían fuera de la estación más favorecida. Los salmónidos, con su modalidad de desove invernal con aguas bajas, son un ejemplo notable en la zona templada. En los trópicos, varias especies de peces oscuros con formas elaboradas de cuidado parental pueden continuar criando bastante después de las crecidas. Las especies de Oreochromis son bien conocidas por su actividad reproductiva durante todo el año en los lagos, y parece que continúan este comportamiento en algunos ríos, por ejemplo el río Shire (Willoughby y Tweddle, 1977). Los cíclidos incubadores desovan en general con aguas bajas en los ríos (observación personal), aunque la frecuencia reproductora se reduce mucho en esta época. Muchos peces ciprinodontios desovan hacia el final de la crecida, comportamiento que se relaciona con su ciclo anual en virtud del cual los peces salen de los huevos al empezar las lluvias y se desarrollan durante el tiempo de presencia de las aguas temporales que pueblan. Al desecarse las charcas en el estiaje, los peces dejan en el fondo pequeñas camadas de huevos en estado letárgico.
Se sabe que especies de otras familias crían durante la estación seca en el río Zaire (Matthes, 1964); Roman (1966) observó que también el Micralestes acutidens cría en la zona inundada durante las crecidas pero continúa criando en toda época del año en el canal principal del río Volta, siendo la única de las formas enanas estudiadas por él que lo hace. El Dormitator latifrons continúa igualmente criando en la estación seca, aunque a menor ritmo que en el desove máximo durante la subida de las aguas en el río Chone, Ecuador (Chang y Navas, 1984). Kramer (1978), que investigó sobre los hábitos reproductores de los pequeños caracinos en un río panameño, encontró que había grandes diferencias en las épocas de cría. El Bryconamericus emperador y la Piabucina panamensis desovaban en afluentes temporales en la época de las lluvias, el Brycon petrosus y el Hyphessobrycon panamensis desovaba en la estación seca y el Gephyrocharax atricaudatus y el Roeboides guatemalensis desovaba durante todo el año. Kramer concluyó que en ambientes tropicales en que las estaciones está sólo levemente marcadas los peces ostariofisos pueden tener una mayor variedad de épocas de cría que en las regiones de acentuada estacionalidad. Análogamente, las observaciones hechas en el río Magdalena sobre el número de especies con gónadas maduras y el número de peces inmaduros presentes cada mes indican que los modelos de reproducción en este río pueden ser bastante difusos (Kapetsky et al., 1977). Sobre la base de 18 especies estudiadas, Kapetsky pudo distinguir tres grupos principales de peces por su comportamiento reproductivo: las especies que al parecer crían únicamente una vez al año, las que tienen dos o más períodos de cría y las que reproducen casi constantemente. Más de la mitad de las especies estudiadas crían de febrero a abril, o sea en el período entre el estiaje y las primeras fases de la crecida. Hay una segunda época de actividad reproductiva intensa durante la segunda fase de la crecida (octubre), pero muy pocas especies ponen huevos durante la retirada de las aguas (diciembre - enero). Esta distribución reproductiva se explica probablemente por el prolongado período de aguas altas en el sistema del Magdalena.
La considerable flexibilidad que muestra una misma especie en los tiempos de desove en diferentes cuencas fluviales dentro de una región geográfica se aprecia en el caso del Brycinus macrolepidotus (Paugy, 1982). Esta especie desova una vez durante las crecidas máximas en los ríos Níger y Senegal, o sólo durante el estiaje en el lago Chad. En el Bandama, sin embargo, la especie cría durante todo el año. Estas diferencias parecen ser función de los diferentes regímenes hídricos, ya que tanto el Níger como el Senegal son ríos de crecida, mientras que el Bandama es un río de embalse sin zonas inundables laterales. El lago Chad es evidentemente un entorno lacustre.
Pese a estas excepciones, las observaciones de la mayoría de los autores revelan que hay similaridad en la periodicidad de las épocas de críen los ríos tropicales de Asia, Africa, América del Sur y norte de Australia (Bishop, 1983). Son típicas las observaciones de Schwassmann (1978), quien comprobó que los peces que viven en los lagos de la llanura central amazónica inundable y que son desovadores totales de un solo tiempo empiezan a migrar para desovar mientras suben las aguas, probablemmente hacia parajes poco profundos recientemente inundados. Las especies Colossoma bidens, Prochilodus sp., Anodus spp., Brycon spp. y Potamorhina pristigaster tienen todas ellas ovarios totalmente desarrollados en enero a febrero y migran de los lagos hacia los cauces secundarios al llegar la crecida a los lagos de la Várzea Janauaca del Solimoes inferior. La sincronización del ciclo reproductivo con la crecida es algunas veces tan buena que, en sistemas en que la ola de crecida invierte bastante tiempo en su marcha río abajo, se demora la cría de las poblaciones del curso inferior con frecuencia hasta un mes en relación con las poblaciones ícticas del curso superior. Así lo han observado en el Mekong Sao-Leang y Dom Saveum (1955) y en el Paraná Bonetto et al. (1971). El fenómeno es también evidente comparando los datos de Daget (1954) sobre el Níger medio, donde los peces crían principalmente en julio-agosto, con los de FAO/NU (1970) sobre el Níger en Nigeria, donde la cría tiene lugar de agosto a octubre.
En algunos ríos ecuatoriales, tales como partes de los sistemas del Amazonas y del Zaire, hay dos estaciones lluviosas que producen crecidas en dos tiempos. Es esas regiones muchas especies tienen mas de una época de cría anual (Roberts, 1973). En el Zaire la mayoría de las especies crían al comienzo de las inundaciones de septiembre-octubre. Durante la crecida de abril a junio hay también un período de reproducción, aunque según Matthes (1964) es menos importante. Una cría bienal tiene lugar en los ríos que llevan al lago Victoria, por cuya corriente ascienden las especies durante las crecidas equinocciales para alcanzar los pantanos anegados cerca de las cabeceras (Welcomme, 1969). Ya se han descrito, en esta misma sección, las dos épocas mayores de cría en el río Magdalena.
En las zonas templadas, las especies ícticas suelen desovar dentro de límites de temperatura muy definidos. Si bien tales temperaturas se producen principalmente en primavera o al principio del verano cuando suben los niveles del agua, los desovadores estivales crían también al bajas las aguas en algunos sistemas como el del Mississippi (Fig. 6.9). La gama de temperaturas puede ilustrares con referencia a algunas especies norteamericanas (datos tomados de Scott yCrossman, 1973) (Cuadro 6.8).
| Familia | Especie | Temperaturas límites en °C |
|---|---|---|
| Salmonidae | Salmo trutta | 6.7–8.9 |
| Esocidae | Esox lucius | 5–12 |
| Cyprinidae | Hybognathus nuchalis | 13–20 |
| Notropsis cornutus | 15–18 | |
| Hybopsis storeiana | 21 | |
| Nocomis biguttatus | 23.9 | |
| Cyprinus carpio | 17–26 | |
| Catastomidae | Catastomus catastomus | 5 |
| Catastomus macrocheilus | 7.8–8.9 | |
| Catastomus platyrhynchus | 10.5–18.5 | |
| Ictiobus cyprinellus | 15.5–18.3 | |
| Ictaluridae | Ictalurus punctatus | 24–30 |
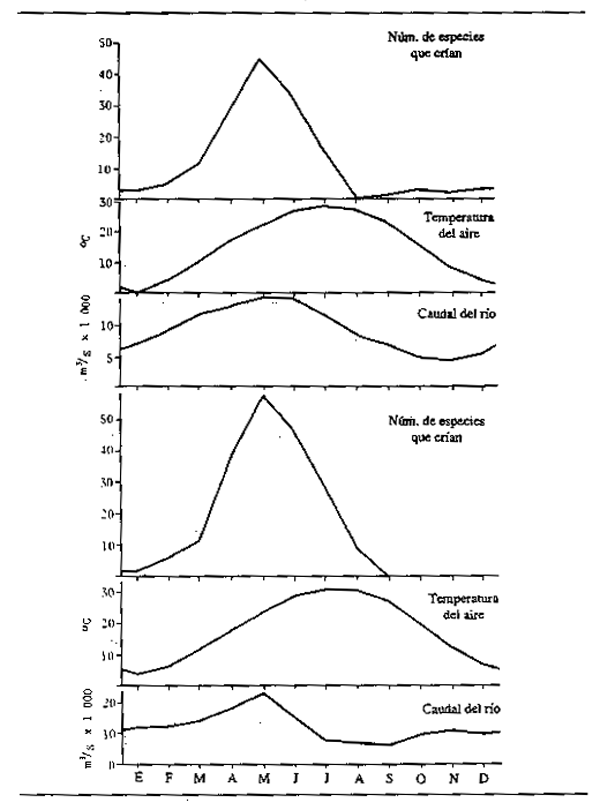
Figura 6.9 Número de especies ícticas que desovan en cada mes del año en comparación con la temperatura del aire y el caudal del río en (A) el Danubio y (B) el Mississippi
Cuando las más altas temperaturas del año se registran en la época de estiaje, puede haber cierto conflicto entre dos estímulos. En el delta del Okavango, la mayoría de las especies desovan en los meses más cálidos del año (septiembre-marzo). Este período coincide con la crecida en la cuenca norte del pantano, pero en la mayor parte del delta la crecida tiene lugar en la época más fría del año y los peces crían en período de aguas bajas (Fox et al., 1976).
Los factores que hacen iniciar la maduración y estimulan la reproducción en los ríos de llanura son en otros lugares menos claros, habiéndose tomado en consideración diversos factores, entre ellos los cambios en parámetros físicos individuales como la temperatura, la conductividad o el flujo, así como el conjunto de condiciones que marcan el comienzo de la crecida. Es probable que cada especie se vea afectada por los diversos factores de diferentes maneras y que esos inductores externos sean efectivos únicamente cuando se superponen a un ritmo fisiológico interno de peces. Una ilustración del carácter específico de las condiciones que provocan el desove es la que ofrece el Pimelodus maculatus del río Jaguari. Basile-Martins et al. (1975) consideraron que la maduración de esta especies se iniciaba cuando las temperaturas llegaban a 22°C, y que se requería una temperatura de 25°C para completar el proceso de cría. Sin embargo, la temperatura no era el único mecanismo regulatorio, ya que una elevación mínima del nivel del agua de un metro sobre el nivel de estiaje parecía también necesaria para poner en marcha el desove (Fig. 6.10). Los cambios en el índice gonadosomático (IGS), según la fórmula:

se utilizaron también para definir la época de cría del Alestes baremoze en el delta del Chari, que coincide tanto con la crecida como con el aumento de las precipitaciones (Durand y Oubens, 1970), y en esta especie Paugy (1978) concluyó que la elevada temperatura de la estación seca era necesaria para la maduración, mientras que la llegada de la crecida provocaba realmente el desove. La relación entre actividad endocrina, desove, lluvias, temperatura y duración del día se ha presentado respecto al bagre de la India Heteropneustes fossilis (Viswanathan y Sundararaj, 1974). Estos tres ejemplos junto con otras observaciones muestran las analogías subyacentes en cuanto a los tiempos de madurez y de desove. Es bien sabido que muchos de los caracinos y ciprínidos migratorios no desovan a menos que tenga lugar la crecida. Como ha observado Bonetto (1975), los individuos de Prochilodus platensis que están aislados en las lagunas anegadas no maduran cuando lo hacen los peces que se encuentran en el cauce del río. La mayoría de los investigadores indios convienen en que las grandes carpas no crían si no se produce la confluencia de las crecidas con el monzón (Parameswaran et al., 1970). En estas condiciones, tiene que disponerse también de frezaderos inundados idóneos para que la reproducción se realice con éxito, aunque un ciprínido, Cirrhinus reba, difiere en esto de los otros por cuanto puede criar incluso con aguas bajas en los ríos Cauvery y Bhavani siempre que una breve riada inicial despierte la sexualidad (Rao et al., 1972). Según Sidthimunka (1972), el Probarbus jullieni se comporta de modo análogo en el sistema del Mekong, y Krykhtin (1975) comprobó que, aunque muchos peces comestibles del río Amur crían únicamente en la zona de anegamiento cuando se eleva el nivel del agua, algunas especies (p.ej. Elopichthys bambusa, Erythroculter sp.se reproducen también cuando no suben las aguas. De hecho, muchas especies fitofílicas en los ríos europeos parecen haberse adaptado a la modificación de las condiciones después de las obras de canalización y control de inundaciones, desovando en el cauce principal en lugar de hacerlo en las zonas inundadas marginales. Sin embargo, en estas especies el principal factor externo que regula el desove parece ser la temperatura, más bien que el flujo de la corriente.
Pese a estas excepciones, puede concluirse que en la mayoría de las especies de desove total el proceso de cría está condicionado temporalmente de tal manera que si las crecidas se demoran o son insuficientes para provocar la migración, la reproducción puede fallar ese año. Las especies de desove parcial parecen ser capaces de criar siempre que se presenten condiciones idóneas y, como ya se ha indicado, algunas de esas especies crían durante todo el año. Otras muchas tienen períodos de reproducción más largos y más difusos, empezando en el cauce del río antes de la llegada de la crecida y continuando con desoves subsiguientes en la llanura, en plena época de aguas altas.
La maduración suele ser relativamente rápida en las especies fluviales. La mayoría de las pequeñas especies tropicales está preparadas para desovar al empezar la estación de las lluvias siguiente a su nacimiento y tienen ciclos vitales muy cortos (Lowe-McConnell, 1967). Especies de tamaño equivalente en la zona templada maduran algo más tarde, durante su primer año de vida o más frecuentemente durante el segundo. Las especies mayores tanto en los trópicos como en las zonas templadas demoran a menudo la maduración hasta sus años tercero o cuarto y, en casos extremos como el Aspius aspius o el Catastomus catastomus pueden no empezara desovar hasta su quinto año. Las especies instaladas en sistemas inestables pueden responder a las circunstancias desfavorables frenando el crecimiento y acelerando la maduración dentro del primer año de vida. Este comportamiento es típico de especies del género Oreochromis (Dudley, 1976).
Los tiempos de incubación de los huevos se relacionan en la mayoría de los casos estrechamente con las temperaturas del agua y son muy diversos según las especies. Por ejemplo, la incubación de los huevos los huevos de Esox lucius, que dura de 12 a 14 días entre 7 y 9°C, se reduce a 4 a 5 días con temperaturas de 17–20°C, y en la trucha de fontana el período de incubación de 148 días a 2°C se reduce a 27 días a 12°C (Cuadro 6.9).
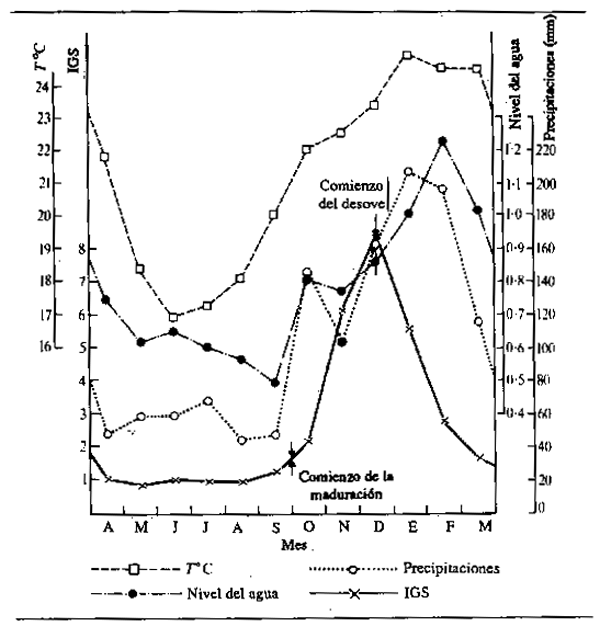
Figura 6.10 Indice gonadosomático (IGS) del Pimelodus maculatus en el río Jaguari en comparación con la temperatura (T°C), el nivel del agua en el río (m) y las precipitaciones (mm³) para 1971-73. (Según Basile Martins et al.,1975)
| Temperatura del agua, °C | Tiempo de incubación, días |
|---|---|
| 2.0 | 148 |
| 3.6 | 118 |
| 4.7 | 97 |
| 6.0 | 77 |
| 7.8 | 60 |
| 10.0 | 41 |
| 11.0 | 35 |
| 12.0 | 27 |
En virtud de las temperaturas más frías y menos previsibles, las especies de regiones templadas tienen períodos de incubación más dilatados y variables, generalmente de 5 a 10 días. En los trópicos, con temperaturas más elevadas y constantes, la incubación es rápida y en algunos peces puede ocurrir entre 16 y 24 horas después de haber sido puestos los huevos. Este desarrollo rápido se ha observado en particular en desovadores sobre sustrato abierto como Hilsa hilisha (Oillay y Rosa, 1963), Laboe rohita (Kahn y Jhingran, 1975) y Labeo victorianus (Fryer y Whitehead, 1959). Los huevos de algunas especies constructoras de nidos se desarrollan también con rapidez, aunque en los incubadores bucales los huevos pueden tardar más en madurar (4 a 5 Días) y los alevines muchas veces permanecen con el padre o la madre hasta dos semanas.
Períodos de incubación excepcionalmente largos son también comunes en algunas especies. Muchos de los desovadores de otoño o invierno de los ríos templados, como el Salmo trutta, tienen períodos de desarrollo de hasta tres meses, lo que significa que la eclosión tiene lugar por lo general al principio de la primavera. Análogamente, los huevos resistentes a la sequía de Nothobranchius spp. pueden suspender su desarrollo durante más de un año hasta que se den condiciones favorables.
Varios aspectos del régimen de crecida pueden tener un impacto para el éxito del proceso de cría o para la supervivencia de los alevines, influyendo así sobre las cohortes de peces incorporadas a la población. Es sabido que hay considerables diferencias en los números de peces jóvenes producidos cada año. Holden (1963) observó que algunas especies estaban representadas por una sola clase anual en el río Sokoto. Había también grandes variaciones en la abundancia relativa de especies, lo que revelaba diferencias de un año a otro en el éxito de la reproducción. Las especies no migratorias eran las más abundantes en un año (1955) gracias a una fuerte clase anual de 1954 junto con una buena crecida anual del río. Este mismo factor, obviamente, no fue favorable a las especies migratorias. Holden menciona también las observaciones de Wimpenny (1934) sobre el lago del delta del Nilo en el que las fuertes crecidas iban seguidas de cohortes numerosas elevando la densidad de la población íctica. Lowe-McConnell (1964 y 1967) observó amplias fluctuaciones en la abundancia de las diferentes especies en varios años, y las atribuyó al éxito desigual de la reproducción, a los breves ciclos vitales y a la maduración rápida. Se constataron fuertes clases anuales de Serrasalmus nattereri y Prochilodus en diversos años.
En el sistema del Amur, la productividad de las especies fitófilas, que crían en la planicie fluvial inundada, se relaciona también directamente con el régimen de crecidas. Las clases anuales suelen ser débiles en los años de crecida floja y fuertes cuando la crecida es potente (Nikolsky, 1956). La existencia de una relación de dependencia análoga entre la incorporación de nuevas cohortes y el régimen de crecidas en el Danubio se deduce de las fluctuaciones del rendimiento pesquero en función del nivel del agua, analizadas por Holcik y Bastl (1977).
De las fluctuaciones en el número de Oreochromis andersoni, O. macrochir y Tilapia rendalli, Dudley (1972) dedujo que la abundancia está sujeta a cambios estacionales. Además, de las diferencias en la abundancia de Oreochromis juveniles dedujo que el éxito de la cría y la incorporación de nuevas cohortes eran mucho mejores en los años con crecidas fuertes. Trabajos ulteriores sobre O. andersoni y O. macrochir revelaron que el éxito del desove podría verse menoscabado por unos elevados niveles hídricos en la estación seca. La razón de este hecho es que el desarrollo del Oreochromis se detiene normalmente bajo condiciones más severas, cuando la retirada de las aguas es más acentuada. Los peces menos desarrollados maduran y crían más pronto de lo que les correspondería en años en que el elevado volumen de agua retenida permite a los peces crecer hasta su talla normal de maduración.
Las condiciones hidrológicas extremas de los ríos sahelianos durante el período 1970-1974 han suministrado ejemplos de los efectos de la ausencia de crecidas sobre el ritmo de renovación de cohortes en varias especies ícticas. En el delta central del Níger, Dansoko (1975) y Dansoko et al. (1976) compararon la biología de Hydrocynus brevis e H. forskahlii. El H. brevis que desova en la planicie inundada y el H. forskahlii que lo hace en el cauce principal ofrecen un contraste útil, ya que los efectos de la variabilidad de las crecidas deberían reflejarse más en una especie que en la otra. Esto se confirmó por la debilidad de la nueva cohorte de H. brevis durante los años en que no hubo crecida. Una sucesión similar de acontecimientos tuvo lugar en el río Senegal, donde faltaron las nuevas cohortes de todos los peces de agua dulce en los años de bajas crecidas de 1968 y 1971, como revela el ejemplo del Citharinus citharus en la Fig. 6.8. En el río Chari, varias especies han desaparecido después de la prolongada sequía saheliana que impidió la cría en las llanuras de los Yaeres, además de producir condiciones desfavorables en el cauce y en el lago Chad. Especies mayores como Distichodus, Citharinus y Labeo, y los migratorios Alestes dentex y A. baremoze, descendieron drásticamente en abundancia y fueron sustituidos por otras especies como Hemisynodontis membranaceus y Brachysynodontis batensoda. El Oreochromis niloticus, gracias su hábito de desove múltiple, pudo recolonizar rápidamente la planicie inundable una vez que volvieron las condiciones favorables, mientras que en el caso de especies como Alestes, que son desovadores totales y cuyas nuevas cohortes son producidas mayoritariamente por las clases anuales segunda y tercera, la omisión de dos crecidas sucesivas debilitó de tal manera a la población que parece incapaz de recuperarse, máxime frente a la continuación de unas intensas actividades pesqueras (Carmouze et al., 1983)
Todo estudio de la mortalidad entre los peces de río puede ser complejo, por la interacción de las muchas causas posibles. Pueden señalarse dos grupos principales de factores naturales: i) Factores dependientes de la densidad, cuya acción es función del número de individuos de la especie o de otras especies dentro de un espacio determinado; y ii) Factores independientes de la densidad, que suelen ser no bióticos y se originan en las características físicas y químicas cambiantes del sistema fluvial. Los dos grupos de factores están interrelacionados, especialmente en los ríos con regímenes hídricos fluctuantes, ya que los cambios en el espacio vital disponible influyen constantemente sobre la densidad de las poblaciones ícticas. Del mismo modo, los diversos factores dependientes de la densidad pueden determinar el ritmo de acción de los demás; por ejemplo, las mortalidades debidas a los predadores en una fase del ciclo vital pueden reducir las poblaciones de la especie agredida de tal manera que su mortalidad ulterior por competencia interna quede considerablemente reducida. En la Fig. 6.11 se indican las vinculaciones entre algunos de estos factores respecto a los salmónidos de río en sus fases de alevines y esguines.
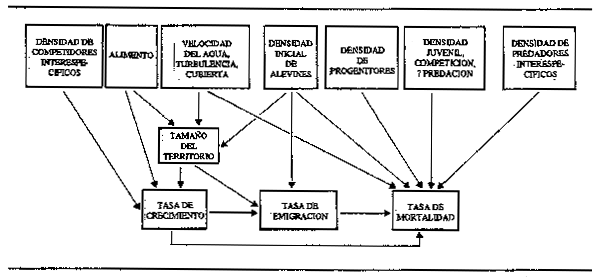
Figura 6.11 Resumen de los factores que determinan los cambios en los números de salmónidos de río en las fases de alevines y esguines (según McFadden, 1969)
A las causas naturales de mortalidad hay que añadir la producida por la pesca. Se han hecho pocos intentos de distinguir entre ambos tipos de mortalidad en las pesquerías fluviales. De todas maneras, como la mayoría de las técnicas empleadas en la pesca fluvial artesanal dependen ellas mismas de la densidad de las poblaciones ícticas, los efectos de la captura de peces pueden repercutir notablemente sobre la tasa de mortalidad por otras causas.
Uno de los principales elementos de la mortalidad natural es probablemente la muerte por encalladura o aislamiento en los ríos, las charcas del cauce principal o las masas hídricas temporales de la planicie anegada. Bonetto et al. (1969) estimaron que se pierden de esta manera unas 40 000 toneladas de peces en el sistema del Paraná, basando su estimación en la superficie de las aguas estacionarias sobre la llanura (2 millones de ha) y en unas poblaciones estacionarias de 20 kg/ha, deducidas de una pequeña muestra. Esta cifra es muy superior a las 10 000 toneladas en que se cifraron las capturas pesqueras en 1967. No hay duda de que se pierden de esta menera enormes cantidades de peces en la mayoría de los sistemas, y este notorio despilfarro ha sido objeto de muchos comentarios. La mortalidad por encalladura está evidentemente muy relacionada con el régimen de inundaciones. No es particularmente apreciable mientras suben las aguas, aunque descensos temporales pueden dejar aislados a algunos peces en charcas y pueden causar la destrucción de alevines en nidos hechos en los bordes de la crecida. Una crecida más extensa puede elevar el número total de la biomasa íctica del sistema a través de una reproducción más exitosa y un mejor crecimiento, lo que hace que toda la comunidad sea más sensible a las contracciones ulteriores del medio acuático. La forma en que se realiza el descenso de las aguas es crítica, ya que un drenaje más rápido de la llanura podría dejar a los peces menos tiempo para abandonar los hábitats que les ofreció la crecida y aumentaría las probabilidades de dejarlos aislados en parajes inadecuados. Por otra parte, hay la posibilidad de que se produzcan también algunos efectos favorables proque la mayor fuerza de la corriente puede hacer que los peces respondan mejor a tales estímulos. Sin embargo, el comportamiento de los peces durante el movimiento de regreso al cauce principal no ha sido estudiado con mucho detalle, y se necesitará bastante trabajo en el futuro. La duración del estiaje igualmente condiciona la proporción de aguas estacionarias que desaparecerán por evaporación o quedarán inutilizables como hábitat para ciertas especies. Cabe suponer que cuanto más largo y severo sea el período seco, mayor será la mortalidad por esta causa. Es difícil calcular el impacto de la mortalidad por encalladura sobre la dinámica del conjunto de la comunidad. Si todos los peces producidos durante una estación húmeda tuviesen que entrar en las aguas estacionarias permanentes al final de la crecida, podrían resultar unas densidades muy superiores a la capacidad sustentadora del agua. Ello podría conducir a un aumento correlativo de la mortalidad debida a la densidad, con una supervivencia final que no sería muy diferente de la resultante cuando se pierden por encalladura una parte de los peces.
Las muertes debidas a unas condicions hidrológicas desfavorables durante las inundaciones han sido descritas respecto a varios sistemas. En los llanos de Kafue (Tait, 1967) y en el Paraná han sido atribuidas a la desoxigenación de toda la columna de agua en las lagunas cuando el descenso de la temperatura y los fuertes vientos alteran la estratificación y producen un vuelco repentino en las condiciones. Rachas de frío análogas han sido la causa de mortalidades comprobadas en el Nilo y en el Amazonas, donde son conocidas con el nombre de “friagems” (Brinkmann y Santos, 1973). En el río Amur, se dan condiciones mortales en los inviernos de aguas escasas, cuando el cauce principal se desintegra en una serie de charcas, las cuales pierden oxígeno causando fuertes mortandades de peces adultos. (Krykhtin, 1975). También son frecuentes las mortandades de peces en los cauces de los ríos pequeños o incluso grandes producidas por temperaturas elevadas o desoxigenaciones, especialmente en los trópicos o en zonas templadas donde se dan condiciones de eutroficación o contaminación. Las muertes de peces debidas a estas causas son con frecuencia espectaculares, pues numerosísimos peces aparecen en la superficie, pero suelen ser muy localizadas en el espacio y en el tiempo.
En años de crecida excepcionalmente fuerte, puede preverse una menor supervivencia de las especies fluviales y de los alevines de desovadores en el curso alto del río. En tales casos, los huevos semipelágicos, los peces juveniles e incluso los propios adultos pueden ser arrastrados río abajo hasta sobrepasar los lugares más favorables para su desarrollo. Pueden perderse también peces para la comunidad al derivar aguas abajo las islas flotantes “sudd” en que han buscado refugio; tales islas pueden llegar a aguas salobres u otras aguas insanas donde los peces morirán. También en los sistemas estuarinos se han observado mortalidades de peces de agua dulce arrastrados hasta el mar por corrintes excesivas.
Muchas de las especies ícticas fluviales son de talla pequeña y tienen ciclos vitales de uno o a lo máximo dos años. La muerte de estos peces va asociada posiblemente al desgaste ocasionado por el desove o por la senescencia. Sim embargo, no se conocen bien los mecanismos que definen el ciclo vital de una especie, y muchos peces viven bastante más tiempo en cautividad del que probablemente vivirían en sus hábitats naturales.
La competencia intraespecífica o interespecífica es evidentemente una de las principales causas potenciales de la mortalidad relacionada con la densidad entre las especies. La rivalidad puede tener por objeto la comida o, tal vez con más frecuencia, algún otro recurso limitado como la sombra, lugares de refugio o lugares de cría. En algunas especies, en particular aquellas que, como los salmónidos, desovan cavando huecos en la grava, aumenta con la densidad el fenómeno del nido superpuesto, en virtud del cual un pez destruye los huevos de un desovador anterior. También se ha comprobado en los salmónidos que el pez que está en posesión de un territorio de alimentación excluye de él a los juveniles a densidades muy superiores a 5 alevines por metro cuadrado (Le Cren, 1965), de lo que resulta que la población se estabiliza aproximadamente a ese nivel. Le Cren pudo obtener experimentalmente una relación lineal entre el coeficiente de mortalidad (%) y el logaritmo de los números de Salmo trutta presentes en un río. Estas relaciones indican la medida en que la competencia intraespecífica directa puede influir sobre la población al aumentar la densidad de ésta.
La competencia interespecífica puede producir también diferencias locales en las tasas de mortalidad, pero en vista de la constante supervivencia común de comunidades ícticas compuestas de varias especies durante largos períodos de tiempo, no representa evidentemente una causa principal de mortalidad. Tal vez la contribución interespecífica más corriente a la mortalidad es la que procede de los predadores. Como ya se ha señalado, el papel de los predadores piscívoros en la comunidad aumenta en importancia con el orden de la corriente, y los predadores son una parte bastante considerable de la biomasa en el potamón. En esos sectores, la mortalidad de los peces pequeños y de los juveniles de especies grandes por los ataques de los predadores es probablemente máxima durante el vaciamiento de la llanura anegada una vez pasada la gran crecida. Los datos presentados en la sección de alimentación revelan que en muchos ríos tropicales los predadores no se alimentan mucho durante el estiaje. Lamentablemente, no hay datos sobre la actividad predatoria durante la crecida de las aguas. En esta época las peces buscados por los predadores tienen un espacio máximo de refugio, y están probablemente dispersos ampliamente por la zona inundada. Sin embargo, la condición de los predadores mejora durante este período, lo que indica que se alimentan en cierta medida. Los juveniles de la mayoría de las especies predadoras recurren a otras fuentes de alimentación durante las primeras fases de la crecida, pero regresan ya a la dieta piscívora hacia el fnal de la crecida. Durante la fase de vaciamiento de la planicie, los estómagos de la mayoría de los predadores están llenos, y observaciones personales en los ríos Ouemé y Níger han revelado que están atestados con juveniles de una amplia gama de especies. Entre las presas puede haber pececillos de la propia especie de los predadores, cuyos hábitos alimentarios no selectivos pueden llevarles al canibalismo. La selección por la talla de la presa, en cambio, es mucho más frecuente, y parece haber una gama relativamente reducida de tamaños en los que las diversas especies son vulnerables a los predadores.
Otros animales predadores, distintos de los peces, parecen desarrollar también su máxima actividad durante el período de drenaje de la llanura. Williams (1971) y Lowe-McConnell (1964), junto con otros varios investigadores, han prestado especial atención a las numerosas aves acuáticas que se alimentan con los peces encallados en las depresiones de la planicie inundada o con los que salen de ella por los cauces.
Otro factor que puede contribuir a la mortalidad es la enfermedad, que puede ser muy importante durante la fase de altas concentraciones de peces al final de la estación seca. Una serie de enfermedades causan estragos en las especies de salmónidos y ciprínidos en los ríos de zonas templadas. En general, están asociadas a las altas densidades de peces que se consiguen con la piscicultura intensiva, pero se extienden fácilmente a los peces en libertad. Se sabe poco de epidemiología de los peces tropicales en sus hábitats naturales, aunque Khalil (1971) registró 215 géneros de helmintos, y Awachie et al. (1977) compilaron una lista de bacterias, protozoos y crustáceos, todos ellos parásitos de los peces en aguas interiores africanas. Según Awachie et al. (1977), las condiciones lóticas en los ríos no son favorables a fuertes infestaciones con tales parásitos. No obstante, se han registrado grandes mortandades en varias especies de eleótridos del río Sepik en Papua Nueva Guinea, que se atribuyeron a la bacteria Aeromonas hydrophila, agente causal de la necrosis dérmica, y que tuvieron lugar no sólo entre las especies pobladoras de la llanura inundada sino también entre las que ocupan las corrientes de cabecera (Coates, 1984). Hay informes sobre la propagación de una enfermedad análoga por los ríos del Asia sudoriental en los primeros años ochenta. Que existen focos de infección entre las poblaciones naturales de los ríos se deduce también de la rapidez con que una serie de enfermedades aparecen y se propagan por las poblaciones de peces ornamentales después de su captura. Parece que la concentración de los peces en el hábitat y la rapidez de la corriente son factores muy determinantes. En entornos lénticos resguardados, aumenta la abundancia de organismos parasitarios. Estas condiciones se dan en las lagunas de la llanura y en las charcas aisladas del cauce principal en la estación seca, cuando la falta de agua corriente, las elevadas temperaturas y las altas densidades de población íctica favorecen la propagación de las infecciones. Del mismo modo, infestaciones con parásitos pueden comprobarse bien en criaderos donde se congregan peces jóvenes de Oreochromis y Tilapia. Cuando hay densidades excesivas de peces, ocurre también que se acumulan en el agua productos tóxicos de las excreciones, principalmente NH3 y NO2. Estos productos son nocivos para las branquias o la piel, hecho que junto con fuertes infestaciones de parásitos puede causar la muerte.
Los diversos factores que contribuyen a la mortalidad total tienden a seguir una evolución similar en sistemas fluctuantes. Aparte de las muertes debidas a condiciones desfavorables durante las crecidas, y del barrido de juveniles o peces pequeños durante este tiempo, casi todas las causas de muerte se intensifican cuando el ciclo hídrico pasa de la fase húmeda a la seca. Dado el volumen fluctuante de los componentes acuáticos del río, la ictiomasa que éste puede sustentar tiene unos límites. Los datos de que se dispone indican que la cantidad máxima de peces se alcanza durante la crecida, y la mínima apenas antes del comienzo de la siguiente crecida. Esto significa que hay una producción excesiva de ictiomasa durante la crecida que persiste durante todo el período de descenso de las aguas y que debe perderse por mortalidad total durante el estiaje. Esto implica también que la diferencia entre la cantidad de agua que queda en el sistema durante la estación seca y la cantidad de agua presente en la estación húmeda es uno de los principales factores que determinan la mortalidad. Dado el exceso de producción de ictiomasa durante la estación húmeda, el sistema biótico puede responder a las diferencias en la cantidad de agua durante la estación seca para asegurar la máxima supervivencia hasta el próximo año. La determinación de la proporción de la mortalidad total que puede aceptarse como mortalidad debida a la pesca sin afectar a esa flexibilidad de respuesta es una de las cuestiones clave en la dinámica de las comunidades ícticas fluviales y en la administración de sus recursos pesqueros.
Las tasas totales de mortalidad (Z) se derivan de la fórmula:
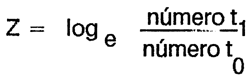
y representan la pérdida que experimenta un hábitat o componente del ecosistema por muerte de cualquier causa incluida la pesca, y la diferencia entre inmigración y emigración en el espacio estudiado. Como es natural, cuanto mayor es el espacio de la muestra para establecer Nt1 y Nt0 en relación con el tamaño de todo el sistema, más se reducirán los errores derivados de la inmigración y de la emigración y mejor representará Z la tasa de mortalidad. Se han hecho sólo muy pocas estimaciones sobre especies de peces que habitan en ríos tropicales, que se presentan en el Cuadro 6.10. Los valores de Z son en general muy altos en los primeros años de vida (Z 4), pero bajan en años siguientes (Z 1). Esto puede deberse a que los peces son menos vulnerables a los ataques de los predadores al aumentar de tamaño, y especies grandes como Colossoma tienen bajas tasas de mortalidad incluso de jóvenes, aunque la fuerte presión de la pesca se sigue ejerciendo sobre la mayoría de las especies a lo largo de sus vidas. En el caso extremos de los peces cuyo ciclo vital es muy corto, por ejemplo los uno a dos años de muchas especies de Barbus, ciprinodontios o pequeños mormíridos, los valores de Z pueden ser muy altos.
La comparación con las tasas de mortalidad de los peces de ríos de la zona templada revela que, aunque la supervivencia es mejor inicialmente en las especies de zonas templadas, sus tasas de mortalidad tienden a elevarse con la edad.
Un conocimiento exacto de las tasas de mortalidad es esencial para el cálculo de la producción en las comunidades animales. La falta de un conocimiento preciso de este parámetro para la pesca fluvial tropical es una grave rémora para la comprensión de la dinámica de tales poblaciones, aunque pueden tomarse indicaciones de la tasa de mortalidad a partir de la demostración de Pauly (1980) de la relación inversa entre mortalidad y la longitud asintótica de los peces.
El modelo exponencial simple de mortalidad Nt = Noe-zt se ha utilizado ampliamente para describir la mortalidad de los peces año por año. Si se utiliza para describir las curvas de mortalidad durante un año, da por supuestas unas condiciones ambientales estables como las de los ríos de caudal constante o los canales y predice una pérdida máxima al principio del período considerado. Sin embargo, este modelo no describe adecuadamente las mortalidades en un año determinado en los ríos con regímenes hidrológicos fluctuantes. Para representar más adecuadamente las oscilaciones de la mortalidad bajo esos regímenes, Kapetsky (1974) sugirió que la forma de la curva de mortalidad podría representarse rotando sobre su eje diagonal la curva de descenso exponencial en el número. Se obtiene así una curva de esta forma: Nt = No - No exp - zT[(exp zt)-1], donde z es un coeficiente de mortalidad semanal, N es el tiempo de incorporación de la cohorte, t = tiempo en semanas y T = 52 semanas. Esta curva da una tasa de mortalidad que aumenta constantemente durante todo el año (Fig. 6.12). Aunque no totalmente satisfactorio, este modelo es una generalización útil que puede usarse en modelos de productividad más amplios. Las variaciones estacionales de mortalidad antes descritas indican muy poca mortalidad durante la estación húmeda y una mortalidad mayor a medida que avanza el año. La mayoría de las causas de mortalidad (predadores, pesca, enfermedad, entornos hostiles, etc.) parecen vinculadas a la densidad, y por esta razón Welcomme y Hagborg (1977) redujeron el número de peces en una población de zona inundada simulada insertando en el modelo exponencial simple un parámetro de mortalidad dependiente de la densidad: Nt + 1 = Nt exp (-zM)
| Especie | Río | Año | Autor | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |||
| ZONA TROPICAL | |||||||||||
| Polypterus senegalus | Chari | 0.54 | 0.53 | Daget y Ecoutin, 1976 | |||||||
| Brycinus leuciscus | Niger | 1.20 | Daget y Ecoutin, 1976 | ||||||||
| Hidrocynus brevis | Niger | 3.08 | 0.98 | Dansoko, 1975 | |||||||
| Hidrocynus forskahlii | Niger | 2.49 | 2.67 | Dansoki, 1975 | |||||||
| Oreochromis andersoni | Kafue | 2.47 | 0.65 | 0.65 | 0.65 | 0.65 | 1.70 | 0.58 | 0.58 | Kapetsky, 1974a | |
| Oreochromis macrochir | Kafue | 3.98 | 0.70 | 0.70 | 0.70 | 0.70 | 0.70 | Kapetsky, 1974a | |||
| Tilapia rendalli | Kafue | 4.61 | 1.40 | 1.40 | 1.40 | 1.40 | Kapetsky, 1974a | ||||
| Serranochromis angusticeps | Kafue | 3.12 | 2.20 | Kapetsky, 1974a | |||||||
| Hepsetus odoe | Kafue | 2.74 | 1.84 | 1.84 | 1.84 | Kapetsky, 1974a | |||||
| Comunidad total* | Bandama | 2.67 | Daget et al., 1973 | ||||||||
| Colossoma macropomun | Amazonas | 0.45 | 0.45 | ||||||||
| ZONA TEMPLADA | |||||||||||
| Salmo trutta | Arroyo Bere | 2.10 | 1.34 | 1.81 | Mann, 1971 | ||||||
| Cottus gobio | Arroyo Bere | 1.66 | 1.33 | Mann, 1971 | |||||||
| Rutilus rutilus | Támesis | 0.42 | 0.42 | 0.68 | 0.70 | 0.92 | 1.00 | 1.26 | 1.86 | Mann, 1971 | |
| Rutilus rutilus | Danubio | 0.69 | 0.98 | 0.65 | 0.70 | 0.56 | 0.61 | 0.68 | 0.75 | Chitravadivelu, 1972 | |
| Alburnus alburnus | Támesis | 1.29 | 1.29 | 1.29 | 3.90 | 4.80 | 4.10 | Mann, 1971 | |||
| Danubio | 0.88 | 0.86 | 0.82 | 0.84 | 0.73 | 0.63 | Chitravadivelu, 1972 | ||||
| Leuciscus leuciscus | Támesis | 0.60 | 0.60 | 0.60 | 0.60 | 0.56 | 1.15 | 1.28 | 1.46 | Mann, 1971 | |
| Perca Fluviatilis | Támesis | 0.98 | 0.98 | 0.98 | 1.61 | 1.49 | 1.39 | 1.45 | 1.47 | Mann, 1971 | |
| Gobio gobio | Támesis | 0.88 | 0.88 | 0.88 | 0.88 | 2.52 | 4.24 | Mann, 1971 | |||
* Especies dominantes: Labeo coubie y Alestes rutilus
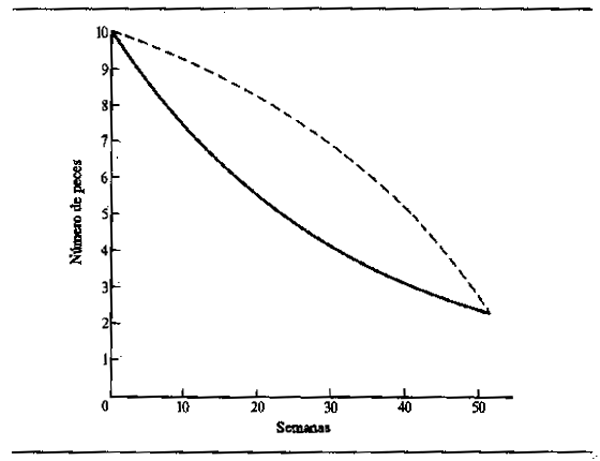
Figura 6.12 Cambios en el número de peces de un grupo de edad durante 52 semanas según las predicciones de un modelo exponencial simple (—) y del modelo de Kapetsky (1974) para la zona de anegamiento(-----): z = 1.5
En esta simulación, z se obtuvo de un coeficiente de mortalidad característico de determinadas especies ícticas de la zona de anegamiento; M se calculó a partir de una fórmula M = aB en la que B es el peso por unidad de volumen del pez en el sistema. M se ajustó a la unidad en una biomasa preseleccionada, típica de un sistema de zona de anegamiento, produciendo tasas de mortalidad más bajas cuando las densidades descendían por debajo de la biomasa y tasas de mortalidad mayores con grandes densidades. Los resultados de esta simulación se muestran en la Fig. 6.13.
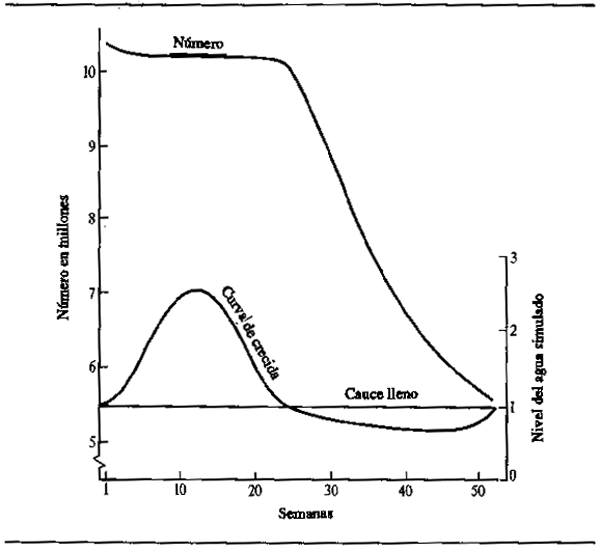
Figura6.13 Cambios en el número de peces en un grupo de edad durante 52 semanas suponiendo que la incorporación de la cohorte se realiza al comienzo de la primera semana después de la generación, según la simulación de Welcomme y Hagborg (1977). Se indican también los niveles del agua adoptados en la simulación.
Se dispone de estimaciones de la ictiomasa o población de peces de muchos ríos, y existe información suficiente para permitir una comparación preliminar entre aguas de regiones tropicales y templadas. Las estimaciones de la población íctica suelen hacerse mediante una o más de tres técnicas básicas: pesca múltiple hasta agotar la ictiomasa, experimentos de marcación y recaptura, y envenenamiento de una zona de muestra para matar los peces. El cálculo de la población total de peces mediante estos métodos no es totalmente fiable, dados los errores de muestreo de diversa índole, pero la combinación de varios métodos y la toma de muestras en grandes extensiones mejoran la fiabilidad de la estimación.
La densidad de la población presente en los ríos cuyo régimen hídrico es fluctuante depende en gran medida de la cantidad de agua que llevan en el momento de tomarse la muestra. Las densidades de población (ictiomasa por unidad de superficie) son generalmente mayores durante el estiaje, cuando los peces se concentran, que con las aguas altas cuando están dispersos, aun cuando el peso total de los peces en el sistema pueda ser superior durante las crecidas. Además, el grado de explotación influye sobre la población, siendo probable la reducción de la ictiomasa media al aumentar la presión de la pesca. Como en muchos ríos las actividades de pesca son muy intensas, particularmente en los trópicos, los valores de la ictiomasa son presumiblemente inferiores de lo que serían en entorno virgen o inexplotado. La comparación entre diferentes sistemas es por lo tanto difícil, y sólo es legítima sobre la base de muestras tomadas durante la misma fase del ciclo de crecida y teniendo en cuenta el estado de explotación de los recursos.
Las diferencias en la población de peces del cauce principal pueden guardar relación con parámetros ecológicos como la pendiente. En general hay un aumento progresivo en la ictiomasa a medida que el río sigue su curso: por ejemplo, en el río Luanza del Zaire, Malaisse (1969 y 1976) encontró 1,3 kg/km, 26.1 kg/km y 31.7 kg/km en tramos sucesivos en el sentido de la corriente (véase también el Cuadro 6.11). Gran parte de este aumento puede atribuirse al ensanchamiento progresivo del cauce del río, si bien la población de peces (ictiomasa/unidad de superficie) no puede aumentar a ese ritmo. No obstante, cuando el desnivel del río aumenta las ictiomasas son menores, como en el caso del río Kaloma en el que un tramo con mayor declive tenía una ictiomasa de 7 kg/km y su situación era intermedia entre un tramo superior con 21 kg/km y un tramo inferior con 91 kg/km (Balon y Coche, 1974). Esto implica que la productividad total puede tender a aumentar a lo largo del cauce, con mayores poblaciones río abajo, aunque son precisos muchos más trabajos para aclarar la ecología de las pequeñas corrientes tropicales.
En la mayoría de los ríos, los flujos son demasiado rápidos en el cauce principal durante las crecidas para que puedan tomarse muestras exactas. En consecuencia, casi todas las estimaciones han de hacerse en tiempo de aguas bajas. La Universidad de Michigan et al. (1971) partieron del supuesto de que durante las crecidas la ictiomasa del río Kafue no diferiría mucho de la existente en las aguas despejadas del llano inundado donde, sobre la base de capturas repetidas con redes de cerco y de muestras obtenidas con rotenona en aguas despejadas, se estableció una ictiomasa de 337 kg/ha. Las muestras tomadas en el cauce con aguas bajas condujeron a una ictiomasa menor de 204 kg/ha. A la luz de los trabajos de Kapetsky (1974), esta estimación en la estación seca puede ser algo baja, ya que él concluyó que la población de las cinco principales especies comerciales era muy distinta en tres tramos separados del río Kafue, a saber: 106,5 ±29,21;576,7±129,2; y 386,6± 63,9 kg/ha. Estas diferencias se atribuyeron a diferencias en la intensidad de la pesca según los tramos. La discrepancia entre la media de 342,2 ± 59,9 kg/ha y la densidad de 204 kg/ha establecida por la Universidad de Michigan podría explicarse en parte por la reducción del volumen de agua por un factor de 0, 7 entre las dos series de muestras; pero, dado que la estimación de la Universidad se basa en todas las especies ícticas, la diferencia real entre las dos estimaciones es muy probablemente mayor de lo que parece.
En el río Chari, Loubens (1969) realizó una estimación de la población de peces en una charca de 360 m² separada del cauce principal al bajar las aguas, obteniendo 15 138 peces/ha con un peso de 861 kg/ha. Resultados más completos son los que ofrecen Daget et al. (1973), cuya muestra obtenida con rotenona en dos lugares del río Bandama permitió evaluar los cambios que tienen lugar en la estación seca. Las fórmulas fueron:
Log dj = 1.63292 - 0.003202j y Log dj = 1.67286 - 0.003166j
para la reducción en número (dj) con el tiempo en días (j). En un lugar se observó una reducción de 3 417 peces/ha el 31 de enero a 1 411 peces/ha el 30 de mayo, y la biomasa bajó de 125 kg/ha a 50 kg/ha en el mismo período. En el otro lugar, 2 271 peces/ha el 31 de enero quedaron reducidos a 996 peces/ha el 2 de agosto, con una pérdida de biomasa de 144 kg/ha resultante de pasar de 257 kg/ha a 113 kg/ha. Las estimaciones más bajas de la población obtenidas en el Mekong por Sidthimunka (1970), de 6,0 y 7,4 kg/ha, se atribuyeron a dificultades en la toma de muestras: una muestra tomada del afluente Mong dio el valor mucho más alto de 137,4 kg/ha. Hay datos sobre otros ríos pequeños en Tailandia que arrojan niveles muy similares de población íctica: 118, 186 y 81 kg/ha para los ríos Bori Pat, Lami Pi y Muak Lek respectivamente (Geisler et al., 1979). También Bishop (1973) calculó una ictiomasa de 179 kg/ha en el arroyo Gombak de aguas negras en Malasia, aunque esta estimación se hizo suponiendo una eficiencia de tan sólo el 20% del equipo eléctrico de pesca aplicado a unas capturas equivalentes a unos 38 kg/ha.
Estudios inéditos de pesca relativos a la cuenca baja del Mekong, preparados bajo los auspicios del Comité del Mekong, presentan valores de 60 kg/ha para el curso superior del río Mun, afluente del Mekong, y de 91,9±51,7 kg/ha para otros 11 afluentes. El valor de 60 kg/ha para el río Mun es una media de varias estimaciones que van desde 120 kg/ha con aguas bajas hasta 5 kg/ha en el período de aguas crecientes. El descenso progresivo de la ictiomasa por unidad de superficie se atribuye a la dispersión de los peces cuando aumenta el volumen de agua. Río abajo, en la principal zona inundada la ictiomasa se calculó en 135 kg/ha; pero como este y otros valores citados proceden de la pesca los autores consideran que son bajos y que excluyen probablemente los peces de un año, que como se ha indicado contribuyen a la mayor parte de la ictiomasa. La productividad básica del agua puede influir también sobre la población de peces, especialmente cuando ésta es explotada. En ríos de aguas negras, pueden preverse valores relativamente bajos de la ictiomasa, tales como 88,7 ± 75,7 kg/ha en el río Baram (Watson y Balon, 1983), aunque Geisler et al. (1979) no encontraron correlación entre el nivel de nutrientes y la población íctica en los ríos amazónicos, y el análisis de la población de peces en comparación con la conductividad no da resultados significativos. Se precisan bastantes más datos de aguas negras para comprender mejor su ecología.
Se ha trabajado mucho sobre las poblaciones de peces de los ríos de la zona templada para determinar su ictiomasa (Cuadro 6.11). Por ejemplo, Mann (1965) encontró una ictiomasa total de 659 kg/ha en el río Támesis, valor que consideró elevado para ríos de zona templada, aunque Backiel (1971) estimó que la ictiomasa total en el río Vístula puede ser entre 200 y 1 100 kg/ha. En ríos belgas de diversos órdenes, Timmermans (1961) y Huet y Timmermans (1963) encontraron entre 130 y 300 kg de peces/ha utilizando la pesca eléctrica. Philippart (1978) dedujo que la ictiomasa total en el río Ourthe correspondía a 315 kg/ha, es decir aproximadamente 900 kg/km. Dentro de estos valores medios, la biomasa fluctúa en función de varios factores como la temperatura o la profundidad del agua, pero la principal correlación se establece con la anchura del cauce según la fórmula:
Ictiomasa = 6.9569×1.8456(r = 0.919)
Un análisis detallado de 40 ríos belgas revela que la biomasa principal es 197,8 ± 137,8 kg/ha, aunque en tramos de potamón como los de los ríos Ourthe o Semois se sitúa entre 250 y 350 kg/ha. Timmermans, así como Cuinat (1971) para los ríos franceses, establecieron una relación inversa:
Según esto, los ríos pequeños con fuerte declive tienen una biomasa mayor por unidad de superficie, por lo menos en Europa. Philippart (1978a) propuso un modelo modificado:
B = -295 + 0,19A + 5,72T + 17,58S + 16,8W
donde A = alcalinidad; T = temperatura media; S = declive medio (slope); y W = anchura media (width), sobre la base de la serie de ríos belgas. Valores análogos se han obtenido para los ríos de otras regiones templadas, aparte de Europa. Por ejemplo, el Horokiwi en Nueva Zelandia lleva hasta 311 kg/ha de peces (Allen, 1951), y la ictiomasa en los ríos trucheros de América del Norte puede llegar a 471 kg/ha (McFadden y Cooper, 1962). Swingle (1954) contó 143 kg/ha en los tramos profundos del río Coosa y 154 kg/ha en las zonas poco profundas. La ictiomasa en las aguas profundas de otros grandes ríos de Alabama variaba entre 51,2 y 1 730 kg/ha, cifra esta última alcanzada en el río Tenson que tiene una zona de anegamiento particularmente extensa. Más al norte, Mahon et al. (1979) encontraron entre 11 126 y 74 765 individuos/ha, equivalentes a 32,4 a 190 kg/ha, en el río Speed de Ontario.
Este breve examen de las poblaciones de peces en los ríos de todo el mundo muestra una amplia gama de valores en todas las latitudes. Puede ser sorprendente, sin embargo, descubrir que apenas hay base para suponer una mayor capacidad biogénica en los trópicos. De hecho, valores entre 100 y 600 kg/ha son comunes en todas las regiones continentales.
Los cauces secundarios y los brazos fluviales ciegos, que tienen muchas de las características de las aguas estacionarias del llano inundado pero que permanecen conectados al cauce principal durante casi todo el año, son hábitats más ricos que el río principal.
Quizá los estudios más detallados de las poblaciones de peces en las aguas fluviales remansadas son los realizados sobre el Danubio. Bastl et al. (1969), Holcik (1972), Holcik y Bastl (1973 y 1976) y Chitravadivelu (1974) han investigado los brazos fluviales Biskupicke, Zofin y Voyka utilizando métodos de marcación y recaptura, así como de capturas repetidas. Sus trabajos han llevado a la conclusión general de que la ictiomasa varía entre 300 y 500 kg/ha. Se comprobó la presencia de unas 20 especies, aunque el número de especies variaba según la superficie del brazo estudiado. Las densidades de población eran altas en verano, cuando los peces buscan refugio en el brazo lateral escapando de la corriente del cauce principal. En otoño, la ictiomasa decrecía, al desaparecer los peces mayores de las aguas más someras. Valores muy bajos, con frecuencia inferiores a 100 kg/ha, iban asociados a la crecida inhabitualmente fuerte que dispersaba a la población, o a la contaminación que era muy frecuente en algunos brazos laterales del Danubio. Una ictiomasa similar se comprobó en el brazo Poltruba del río Elba, donde Oliva (1960) halló una densidad de población de Rutilus rutilus y Alburnus alburnus de 222,3 kg/ha utilizando rotenona. Como esta densidad se calculó sólo para dos especies, la ictiomasa total sería probablemente algo mayor. Hasta 22 350 peces/ha encontró Loubens (1969) en un brazo secundario del Chari, aunque el 98% eran peces pequeños de menos de 10 cm de longitud. En cambio, el 96% de los 2 150 kg/ha correspondía a los pocos peces de talla superior a esa medida. La misma masa hídrica remansada tenía 5 616 kg de peces/ha al final de una crecida, descendiendo a 1 600 kg/ha dos meses más tarde. Una cuarta muestra del mismo lugar un año después produjo sólo 369 kg/ha, lo que revela la variabilidad de un año a otro que puede esperarde de una misma masa hídrica. Otras aguas remansadas del Chari dieron una densidad estimada de 2 166 kg/ha para una superficie de 6 000 m². En el Bandama, Daget et al. (1973) probaron que las densidades de población pueden aumentar en ese tipo de aguas. Al contrario de las tendencias comprobadas en el cauce principal, el número de peces en un brazo fluvial menor se elevó de 1 408 individuos/ha a 3 311 individuos/ha en junio, lo que correspondía a un aumento en peso de 149 kg/ha en marzo a 350 kg/ha en junio. Estas cifras, junto a las del cauce principal, revelan que hay algún movimiento durante la estación seca desde las charcas despejadas del río principal hacia los hábitats más sombreados de los remansos. La cifra dada por Sidthimunka (1970) de 219,8 kg/ha para un remanso de la corriente principal del Mekong era también bastante más alta que las estimaciones hechas para el propio río principal, aunque la cifra de 125 kg/ha dada por los estudios sobre el Mekong respecto a un agua remansada y sin corriente es análoga a la del río principal. En el gran río Tombigbee de Alabama, la ictiomasa en un remanso utilizado por Swingle (1954) para una muestra era mucho mayor, con 2 084 kg/ha, que las zonas tanto profundas como someras de la corriente principal, con 457 y 570 kg/ha respectivamente.
Las poblaciones de peces en los lagos de la llanura danubiana presentan densidades similares a las que alcanzan en los remansos. Balon (1967), en su muestra de 13 masas hídricas, encontró entre 335 y 318 632 peces/ha. La composición de la población variaba considerablemente de una muestra a otra. La ictiomasa tenía también un amplio margen de variabilidad: 230,4 ± 277,6 kg/ha. Era mínima durante la época de aguas altas (136 ± 127 kg/ha en julio) y máxima durante el estiaje (480 ± 334 kg/ha). Otras observaciones de masas hídricas estacionales danubianas realizadas por Holcik et al. (1981) arrojaron una media de 366,7 ± 293,6 kg/ha. En el río ruso Nyamunas, las crecidas de primavera inundan la llanura llevando grandes cantidades de peces a los viejos meandros y a los cauces artificiales; éstos quedan aislados en verano, y Gaygalas y Blatneve (1971) estmaron que alrededor de 200 kg/ha de peces permanecían allí en otoño. Como los pescadores con caña capturan alrededor del doble de esa cifra, la biomasa total en primavera se aproxima probablemente a 500 kg/ha. Las lagunas del sistema canadiense de Irvine Creek descritas por Halek y Balon (1983) mantienen poblaciones ícticas de 132,6 ± 57,7 kg/ha. Gran parte de las variaciones entre lagunas o charcas se ha atribuido a la duración de la conexión entre ellas y el río. Las lagunas en que esta conexión persiste durante algún tiempo tienen mayor densidad de peces nacidos en el año y por lo tanto una biomasa media más elevada.
En los ríos tropicales, las poblaciones de peces de las charcas de la llanura tienden a ser algo más numerosas, aunque en algunos llanos anegables, como los del Magdalena y del Mekong hay un movimiento considerable de salida de las depresiones hacia el cauce principal que puede explicar los bajos valores obtenidos del sistema. En el Cuadro 6.11 se resume la ictiomasa en la estación seca en las aguas estacionarias de una muestra de ríos tropicales. La ictiomasa varía al parecer en función de varios factores. Lo mismo que en otras partes del sistema acuático, las densidades de población suelen ser más altas en la estación seca. Así, cuando Kapetsky et al. (1976) calcularon que una biomasa mínima entre 0,23 y 251 kg/ha (media de 55,7 kg/ha) estaba presente en las aguas despejadas y entre 20 y 232 kg/ha (media de 79,8 kg/ha) en las zonas resguardadas de las ciénagas del Magdalena, comprobaron también una buena correlación negativa entre la densidad de población y el nivel del agua en las ciénagas. Sorprendentemente, mientras que la Universidad de Michigan et al. (1971) encontraban también que las densidades ícticas en las aguas despejadas de las lagunas del río Kafue durante la estación seca (426 kg/ha) eran mayores que durante las crecidas (337 kg/ha), las zonas dotadas de vegetación mostraban la tendencia opuesta y acogían en época de aguas altas concentraciones muy elevadas de peces (hasta 2 682 kg/ha). Las altas densidades de peces bajo vegetación flotante, sin embargo, parecen ser relativamente raras, y los pantanos permanentes, en particular los formados bajo papiros, se caracterizan por la pobreza de sus comunidades ícticas. Esta situación puede cambiar temporalmente durante la crecida, cuando las corrientes oxigenan la columna de agua situada bajo las plantas. El estudio de la Universidad de Michigan se refirió también a la pérdida de ictiomasa durante la estación seca, cuando en una laguna una población inicial de 2 639 kg/ha disminuyó en un 75% pasando a 684 kg/ha en tres meses. En una segunda laguna, un descenso similar de 3 306 a 501 kg/ha luvo lugar en 10 semanas, aunque en este caso la laguna estaba conectada al río durante algún tiempo y pudo haber habido emigración. Bonetto (1980a) estudió una población de Prochilodus platensis que colonizó la Laguna González cuando fue inundada por el río Riachuelo en 1971/72. La laguna quedó ulteriormente aislada del río, y Bonetto pudo así seguir la evolución de una sola clase anual durante varios años por extrapolación a partir de experimentos de marcación y recaptura. El aislamiento de la población respecto a otras clases anuales de Prochilodus da indudablemente una imagen algo distorsionada de lo que sucede en lagunas más normales. En el momento de la separación del río, los peces tenían probablemente alrededor de un año de edad y, tal vez a causa del limitado alimento disponible, crecieron hasta una talla final relativamente pequeña de 36 cm, en comparación con 60 cm en las lagunas conectadas con el río. La población aumentó de 232 kg/ha en el primer año a 351 kg/ha en el segundo, para descender después a 199 kg/ha en 1976, cuando finalizaron las observaciones.
La forma de la laguna y la naturaleza del fondo pueden influir también sobre la ictiomasa. En el río Senegal, las charcas estrechas y largas formadas a partir de cauces de desagGe aislados sustentan una población mucho mayor que las charcas de depresión redondeadas: 205 ± 155 kg/ha frente a 13 ± 6 kg/ha (Reizer, 1974). En el Sokoto, el análisis de Holden (1963) revela que una mayor proporción de peces prefieren fondos mixtos de arena y cieno (1 012 kg/ha), mejor que sólo arena (785 kg/ha) o sólo cieno (233 kg/ha).
Fox (1976) ha relacionado las diferencias en la población de peces con el grado de fertilización orgánica de la masa hídrica. Sus estimaciones respecto a las charcas pequeñas y no enriquecidas del delta meridional del Okavango presentaban como densidad usual 100 a 200 kg/ha, mientras que una laguna periférica muy enriquecida llegaba a 700 kg/ha. Aunque estos datos están lejos de ser concluyentes por la pequeñez de la muestra, parece razonable pensar que las aguas eutroficadas deberían sustentar mayores densidades de peces que las menos ricas en nutrientes. Las aguas negras pobres en nutrientes, en cambio, parecen sustentar poblaciones menores. Por ejemplo, ocho charcas de llanura inundables por los ríos Pacaya y Sarinia, afluentes del Amazonas peruano, dieron 89,6 ± 37,1 kg/ha (Montreuil, com. pers.). Sin embargo, todavía no se dispone de datos suficientes para establecer una relación entre el contenido en nutrientes y la población íctica de los ríos.
| Río | Tamaño de la muestra | Ictiomasa estimada, kg/ha | Autor |
|---|---|---|---|
| Apure | 1 | 982 | Mago-Leccia, 1970 |
| Candaba | - | 500–700 | |
| Chari | 2 | 701–2 166 | |
| Kafue | 8 | 444 | Universidad de Michigan et al., 1971 |
| Magdalena | 28 | 122 | |
| Mekong | 1 | 63 | Sidthimunka, 1970 |
| 390 | Mekong Fish.Studies | ||
| (com. pers.) | |||
| Mogi Guassu | 1 | 313 | Gómez y Montiero, 1955 |
| Nilo Sudd | 2 | 306–433 | Mefit-Babtie, 1983 |
| Okavango | 2 | 200–700 | Fox, 1976 |
| Ouemé | 68 | 1 835 ± 825 | FAO/UN, 1971 |
| Paraná | |||
| Lagos temporales | 18 | 959 ± 1 512 | Bonetto, 1976 |
| Lagos permanentes | 4 | 766 ± 348 | |
| Sabaki | 1 | 786 | Whitehead |
| Senegal | 8 | 110 ± 144 | Reizer, 1974 |
| Sokoto | 25 | 661 ± 557 | Holden, 1963 |
Las poblaciones de peces pueden estar también condicionadas por las inundaciones producidas anteriormente por el río, tema del que se trata con más detalle en la sección relativa al volumen de capturas. Un ejemplo de esta variabilidad es el que ofrece el Atchafalaya, brazo del bajo Mississippi, donde Bryan y Sabins (1979) documentaron un descenso de la población de peces de 795 kg/ha en 1977, frente a 904 kg/ha en 1975–76. La estimación más alta coresponde a años precedidos por buenas crecidas de primavera (1973–75), mientras que la más baja se refiere a años precedidos por crecidas débiles (1976–77).
Son raros los estudios que analizan la contribución de los diversos componentes de un sistema fluvial a la población íctica total. No obstante, la Universidad de Michigan et al. (1971) realizaron uno de tales estudios extrapolando con bastante amplitud a partir de un número limitado de muestras de cuatro hábitats diferentes del río Kafue y su llanura. Sus resultados pueden verse en el Cuadro 6.12.
Un análisis similar es el realizado por Holcik et al. (1981) sobre los tramos medios del Danubio, con los resultados que se indican en el Cuadro 6.13.
| Superficie | Ictiomasa | Ictiomasa total | ||
|---|---|---|---|---|
| (ha²) | (kg/ha) | (t) | ||
| Crecida | ||||
Laguna despejada | 126 000 | 337 | 42 462 | |
Laguna con vegetació | 16 000 | 2 682 | 42 912 | |
Pantano herboson | 136 000 | 64 | 8 704 | |
Cauce del río | 5 300 | 337 | 1 786 | |
Total | 283 300 | 338.4 | 95 864 | |
| Estiaje | ||||
Cauce del río | 4 800 | 204 | 959 | |
Laguna despejada | 113 000 | 426 | 48 138 | |
Laguna con vegetación | 14 000 | 592 | 8 288 | |
Total | 131 800 | 435.6 | 57 405 | |
| Superficie | Ictiomasa | Ictiomasa total | |
|---|---|---|---|
| (ha²) | (kg/ha) | (t) | |
| Cauce principal | 7 936.9 | 35.0 | 277.8 |
Remansos | |||
Ribera checoslovaca | 1 777.9 | 350.0 | 622.3 |
Ribera húngara | 1 336.0 | 400.0 | 534.4 |
Ambas riberas | 3 113.9 | 371.5 | 1 156.5 |
Total | 11 050.8 | 129.76 | 1 434.3 |
También se ha hecho una estimación general de la ictiomasa del río Atchafalaya, Luisiana, a partir de muestras tanto del cauce principal como de algunas lagunas. En este caso se calculó una población media de peces de 860 kg/ha para la parte baja de la cuenca y de 555 kg/ha para la parte alta (Bryan y Sabins, 1979).
Puede definirse la producción como elaboración total de tejido íctico durante un período determinado, incluidos los productos gonádicos y los materiales formados por individuos que no sobreviven al final del período (Ivlev, 1966). En el Cuadro 6.14 se presentan estimaciones de población y producción para algunos ríos. Las estimaciones de producción oscilan entre un máximo de 2 000 kg/ha/año en el Támesis y únicamente 16,2 kg/ha/año en el río Speed, pero tienen una media de 218,6335,6 kg/ha/año. Varios factores pueden influir sobre la producción, entre los cuales tal vez los más importantes sean la latitud, la productividad básica de las aguas y la estructura por edades de la población.
| Río | País | Biomasa | Producción | Autoridad | |
|---|---|---|---|---|---|
| kg/ha | kg/ha/año | P:B | |||
| Amazonas Manaus | Brasil | 1600.0 | 2800.0 | 1.75 | Bayley (1983) |
| Támesis | |||||
(0 + años) | R.Unido | 1315.0 | 2000.0 | 1.52 | Mann (1972) |
(1 + años) | R.Unido | 659.0 | 426.0 | 0.65 | Mann (1965) |
| Hinaki | N.Zelandia | 880.8 | 735.4 | 0.82 | Hopkins (1971) |
| Kafue | Zambia | 520.0 | 618.0 | 1.19 | Kapetsky (1974) |
| Ellis | Canadá | 376.0 | 375.4 | 1.0 | Mahon (1981) |
| Warkosc | Polonia | 307.5 | 161.4 | 0.5 | Mahon (1981) |
| Carrol | Canadá | 274.8 | 280.3 | 1.0 | Mahon (1981) |
| Hopewell | Canadá | 228.4 | 263.5 | 1.0 | Mahon (1981) |
| Hinau II | N.Zelandia | 217.7 | 241.7 | 1.11 | Hopkins (1971) |
| Lemki | EE.UU. | 212.0 | 136.0 | 0.64 | Goodnight y Bjornn (1971) |
| Jarama | España | 178–221 | 221–583 | 1.2–2.6 | Lobon-Cervia y Penczak |
| (1984) | |||||
| Tarrant | R.Unido | 198.0 | 596.0 | 3.01 | Mann (1971) |
| Kejin | Borneo | 173.1 | 261.5 | 1.50 | Watson y Balon (1984) |
| Bere | R.Unido | 161.7 | 270.0 | 1.69 | Mann (1971) |
| Irvine | Canadá | 149.9 | 226.4 | 1.50 | Mahon (1981) |
| Hall | R.Unido | 129.0 | 52.0 | 0.40 | LeCren (1969) |
| Swann | Canadá | 124.4 | 174.5 | 1.40 | Mahon (1981) |
| Struga | Polonia | 111.2 | 110.3 | 1.0 | Mahon (1981) |
| Deer | EE.UU. | 84.7 | 160.0 | 1.89 | Chapman (1965) |
| Utrata | Polonia | 84.5 | 289.3 | 3.4 | Penczak (1981) |
| Big Springs | EE.UU. | 84.2 | 118.0 | 1.4 | Goodnight y Bjornn (1971) |
| Mesta | Bulgaria | 80±82 | 80.0 | 1.0 | Penczak et al. (1984) |
| Dockens | R.Unido | 75.0 | 140.0 | 1.87 | Mann (1971) |
| Clemons Fork | |||||
(3er orden) | EE.UU. | 71.5 | 77.2 | 1.08 | Lotrich (1973) |
| Kejin | Borneo | 71.0 | 98.3 | 1.4 | Watson y Balon (1984) |
| Clemons Fork | |||||
(2 orden) | EE.UU. | 63.6 | 105.5 | 1.66 | Lotrich (1973) |
| Appletreeworth | R.Unido | 62.0 | 30.0 | 0.48 | LeCren (1969) |
| Black Brows | R.Unido | 59.0 | 100.0 | 1.69 | LeCren (1969) |
| Clemons Fork | |||||
(1er orden) | EE.UU. | 54.9 | 83.5 | 1.52 | Lotrich (1973) |
| Bobrza | Polonia | 50.2 | 83.4 | 1.7 | Mahon (1981) |
| Needle Branch | EE.UU. | 45.9 | 90.0 | 1.96 | Chapmann (1965) |
| Zalewka | Polonia | 43.9 | 54.0 | 1.23 | Penczak (1981) |
| Kafa | Borneo | 38.5 | 47.5 | 1.2 | Watson y Balon (1984) |
| Wolborka | Polonia | 37.4 | 35.3 | 0.94 | Penczak et al. (1982) |
| Speed | |||||
(3er orden) | Canadá | 32.3 | 54.0 | 1.67 | Mahon et al. (1979) |
| Lava | Borneo | 30.5 | 39.3 | 1.3 | Watson y Balon (1984) |
| Payau | Borneo | 27.1 | 31.2 | 1.2 | Watson y Balon (1984) |
| Lawa | Borneo | 21.3 | 33.3 | 1.6 | Watson y Balon (1984) |
| Bulu | Borneo | 21.5 | 26.0 | 1.2 | Watson y Balon (1984) |
| Hinau I | N.Zelandia | 19.6 | 42.8 | 2.18 | Hopkins (1971) |
| Speed (4 orden) | Canadá | 7.0 | 16.2 | 2.31 | Mahon et al. (1979) |
Se cree corrientemente que las aguas tropicales son más productivas que las de regiones templadas, y en los lagos no hay duda de que es así. Lamentablemente, hay pocas observaciones sobre la productividad de los ríos tropicales, pero las que existen no prestan mucho apoyo a esa idea. De hecho, la ictiomasa mínima y máxima, la media y la desviación estándar en 17 ríos tropicales, 21,4 (154.4 198.7) 861 kg/ha/año entran por completo en las cifras correspondientes a 26 ríos de zonas templadas, 7,0 (205.0300.3) 1315 kg/ha/año.
Tampoco hay hasta ahora muchos datos sobre la menor productividad de los ríos con más bajo contenido iónico, en parte porque tantos otros factores influyen sobre las características de la población íctica. Sin embargo, en los trópicos la cifra que dan Watson y Balon (1984) respecto a los ríos de aguas negras de Borneo (conductividad 50 microohmios) es bastante más baja (179,9 kg/ha/año) que la estimación de Kapetsky (1974) de 678 kg/ha/año para el río Kafue, más rico (conductividad 130 a 320 microohmios).
La influencia de la proporción de juveniles en la población es mucho más clara; el Cuadro 6.15 resume el porcentaje de la productividad total que corresponde a cada clase anual en algunas especies de peces.
| Especies | Porcentaje de productos por clase anual | Autor | ||||
|---|---|---|---|---|---|---|
| 0+ | I | II | III | IV+ | ||
| Cottus cognatus | 65.1 | 20.0 | 12.2 | 2.5 | 0.2 | Petrovsky and Waters, 1975 |
| Salvelinus | 40.8 | 41.0 | 14.7 | 3.1 | 0.4 | Dept. of Natural Resources, 1974 |
| Alburnus alburnus | 46.2 | 10.1 | 20.7 | 17.0 | 5.9 | Matthews, 1971 |
| Coltus gobio | 32.0 | 18.0 | 27.0 | 20.0 | 3.0 | Matthews, 1971 |
| Oreochromis andersoni | 61.2 | 22.8 | 12.2 | 2.2 | 1.6 | Kapetsky, 1974 |
| Oreochromis macrochir | 46.4 | 26.3 | 12.7 | 7.6 | 7.0 | Kapetsky, 1974 |
Teóricamente debería haber una gradación continua como la que se ve respecto a S. fontinalis o C. cognatus cuyos datos son el promedio de varios años; pero las diferencias en la fuerza de la clase anual debidas a las desigualdades en la incorporación de nuevas cohortes, como se aprecia respecto a A. alburnus o R. rutilus, pueden dar lugar a variaciones en la productividad total, general de un año a otro. Dada la gran significación de los peces juveniles para la productividad total, es muy importante la eficiencia del muestreo en las clases anuales más jóvenes, pudiendo producirse diferencias en las estimaciones de población según la medida en que se incluyan los peces menores en la muestra. En algunos sistemas está comprobado que hay variaciones de un año a otro, pero otros muestran una notable constancia en la productividad pese a cambios considerables en la biomasa. Por ejemplo, la producción de Salvelinus fontinalis varió menos del 20% en torno a una media de 117 kg/ha durante 11 años de muestreo en Lawrence Creek, Wisconsin. Durante el mismp período la biomasa experimentó fluctuaciones hasta casi triplicarse, de 13.5 a 99 kg/ha. Esto significa que la eficiencia de producción dependía en este caso estrechamente de la densidad, y una regresión de P/B contra biomasa dio un coeficiente de correlación muy alto (Dept. of Natural Resources, 1974). En el Cuadro 6.14 puede verse que, mientras que las poblaciones de peces tienden a ser menos numerosas en los ríos de orden inferior en comparación con los de orden superior, la productividad tiende a aumentar con la consiguiente elevación de la relación P/B. Esta elevada productividad del ritrón, especialmente en los rabiones, puede atribuirse en parte a la mayor abundancia de peces juveniles en esas zonas (Schlosser, 1982). Los cocientes Producción/Biomasa son en general indicadores útiles de la rapidez de renovación de la biomasa y, si bien la productividad está en estrecha relación con la población existente,
P = 3.3 + 1.2 B (r² = 0.85 para los datos contenidos en el Cuadro 6.14)
se producen variaciones por una serie de razones. Como ya se ha dicho, la densidad de población puede influir sobre la tasa de producción; también puede hacerlo la proporción de peces juveniles, y otro factor que se ha traído a colación es la composición por especies. Esta última puede actuar de dos maneras: primero, por la longevidad de las especies; y segundo, por su condición trófica. La hipótesis de que las especies de corta vida tienen mayores productividades (Leveque et al., 1977) no puede comprobarse a partir de los datos actualmente disponibles, aunque puede suponerse que las comunidades compuestas de especies pequeñas de corta vida tendrán mayores producciones que las comunidades de especies mayores que habiten en la misma masa hídrica. Por razones similares, puede suponerse que las especies predatorias, en parte por su tamaño generalmente grande y en parte por su posición en la cadena alimentaria, tendrán productividades relativamente menores. En este caso el valor medio de P/B en 13 observaciones sobre 7 especies predatorias, 0.54 0.16, era mucho más bajo que el valor de 1.20.5 para 95 observaciones sobre 37 especies de todas las categorías tróficas y de zonas tanto tropicales como templadas. Las dificultades inherentes a este tipo de análisis se perciben ante la amplia gama de valores de P/B obtenidos para algunas especies; S. fontinalis, por ejemplo, ha recibido índices tan diversos como 0,4 (LeCren, 1969) y 3,0 (Mann, 1971).
Se han utilizado varios métodos para estudiar y calcular las poblaciones de peces en los ríos. Los modelos varían según el tipo de río, principalmente por la mayor o menor facilidad con que pueden tomarse muestras en cada tipo de corriente. En general, las dificultades del muestreo en ríos caudalosos, que se definen normalmente como aquellos que por su profundidad no son vadeables, así como el gran número de ríos y arroyos, imponen el uso de algún tipo de modelo predictivo, que suele ser un indicador. Evidentemente estos modelos tienen que basarse en cierto número de estimaciones hechas sobre el terreno y tienen que comprobarse de vez en cuando en los propios ríos. Otro método es el de las simulaciones basadas en conceptos teóricos de la ecología de la comunidad íctica.
Modelos simples basados en características ambientales
Se han hecho varios intentos para poner en relación algunas características de la comunidad íctica con el medio en que vive. Generalmente tales modelos o indicadores se han establecido con fines prácticos para la administración de pesquerías, y no siempre está claro lo que se predice exactamente. Por ejemplo, los modelos pretenderán a menudo predecir la producción, cuando en realidad se quiere decir las capturas, de manera que hay una cierta superposición entre los modelos de que aquí se trata y los descritos en la sección relativa a previsiones de capturas.
Durante sus estudios sobre los recursos pesqueros fluviales de Bélgica y del norte de Francia Leger, y más tarde Huet, pudieron formular algunas generalizaciones en cuanto a la zonificación de los cursos de agua de la Europa templada. Sobre esta base, Huet (1949 y 1964) propuso un modelo simple:
P = BLK
para medir aproximadamente la ictiomasa disponible para la explotación en los ríos de la zona templada. En este modelo, P = productividad anual (o cosecha) del agua en kg/km de río, L = anchura media del río, B = ‘capacidad biogénica’ y K = coeficiente de productividad. Se asignaron a B valores de 1 a 10 según la cantidad de comida para peces (bentos) disponible. El coeficiente K es la suma de K1, K2 y K3, donde el valor de K1 procede de la temperatura anual media, K2 depende de la acidez del agua y K3 resume el tipo de población íctica.
Este método original fue modificado por Lassleben (1977) para calcular las capturas de peces del tramo alemán del Danubio (Kolbing, 1978). En este caso, las capturas de peces (C) en una sección del río se determinan así:
C = BK 10 kg/ha/año
donde B y los diversos componentes de K son como antes se ha dicho, excepto K3 cuyo valor puede obtenerse de una ecuación simple que establezca la proporción de cada tipos de especie presente. Este método ha dado buenos resultados en ríos septentrionales de la zona templada y ha sido extendido por Holcik (1979) a ríos mayores como el Danubio utilizando el porcentaje simple de especies reófilas y limnófilas. La capacidad biogénica del río puede calcularse utilizando la masa de invertebrados bentónicos en logar de la cantidad de vegetación acuática que se utiliza en otras fórmulas. Según Albrecht (1953 y 1959), los ríos con una biomasa de menos de 60 kg/ha pueden considerarse como pobres, con una biomasa bentónica de 60 a 300 kg/ha la capacidad es media y con 300 a 700 kg/ha es buena. Binns y Eisermann (1979) adoptaron un enfoque análogo para establecer un Indicador de Calidad de Hábitat para predecir la biomasa truchera de los ríos de Wyoming obteniendo dos modelos bastante fáciles de calcular. Su modelo de más éxito fue la expresión:
logY + 1 = [(-0.903) + 0.807 log(X1 + 1) + 0.877 log(X2 + 1) + 1.233 log(X3 +1) + 0.631 log(F + 1) + 0.182 log(S + 1)] [1,12085]
donde:
Y = biomasa de truchas prevista
X1 = flujo al final del verano
X2 = variación anual del flujo
X3 = temperatura máxima del río en verano
F = indicador alimentario consistente en el producto de:
X4 = nitrógeno en nitratos
X10 = velocidad del agua
S = indicador de refugio consistente en:
X7 = cubierta vegetal
X8 = orillas derrubiadas
X11 = anchura del río
Se asignaron a los diversos parámetros valores de 1 a 5 con arreglo a un cuadro sencillo. Este modelo, que funciona bien en los ríos trucheros para los que se compuso, ilustra la complejidad de los modeles de este tipo. Permite apreciar también el número de factores que pueden influir sobre las poblaciones de peces y sobre la productividad, así como las dificultades de realizar estimaciones fiables sobre la base de un solo factor. Este método ha sido más ampliamente elaborado por otros investigadores en los Estados Unidos utilizando Indicadores de Idoneidad del Hábitat basados en una amplia gama de parámetros. Tales parámetros suelen aplicarse a especies concretas (Rabern, 1984) y se basan en una buena comprensión de las necesidades ecológicas de las especies en cuestión, así como en información detallada sobre gran número de parámetros.
Modelos de dinámica de poblaciones de peces en ríos de llanura
Los modelos de dinámica de población y de producción obtenidos para los lagos pueden muy bien aplicarse a los ríos que tienen regímenes hidrológicos estables, tales como los ríos de caudal constante o aquellos cuyo flujo ha sido modificado por el hombre. No obstante, la situación es muy diferente en los ríos que tienen una fluctuación estacional en el nivel del agua, en los que los modelos exponenciales simples generalmente aceptados de mortalidad y crecimiento no suelen ser congruentes con lo que se sabe de la biología de los peces de la llanura inundable. Estos modelos no son adecuados, por consiguiente, para obtener estimaciones de los cambios dentro de un año en la biomasa y en la producción. Las capturas que pueden preverse en los ríos de crecida están muy probablemente en relación con el exceso de ictiomasa producida en la época de crecida por encima de lo que pueden sustentar en época de estiaje. Se necesita un conocimiento más detallado de los cambios en esos parámetros dentro de cada año para administrar tanto los recursos de peces como el régimen hidrológico. Se han propuesto otros modelos basados en supuestos de crecimiento rápido y baja mortalidad durante la crecida, y bajo crecimiento y alta mortalidad durante la estación seca. Kapetsky (1974) cotejó la producción obtenida de modelos estándar de crecimiento y mortalidad con modelos lineales y de llano inundable de esos parámetros, y halló que las estimaciones de producción para los peces a partir de la edad III daban resultados muy diferentes según el modelo utilizado. El modelo de llano inundable combina el número:
Nt = No - No exp - zT[(exp Zt)- 1)]
y el peso medio
(Wt = Wo + W1 exp gT [(-1-(expgt)]
de esta forma:
Bt = Nt Wt e.
Las estimaciones de producción son hasta 4.4 veces mayores que con los modelos exponenciales simples y el doble que con el modelo lineal. La razón radica en las diferencias entre las curvas teóricas biomasa-tiempo para los peces del grupo de edad 0 que se trazan en la Fig. 6.14 a partir de los modelos exponencial simple (a) y de llano inundable (b) para los dos valores de z y una tasa de crecimiento (G) = 5,3.
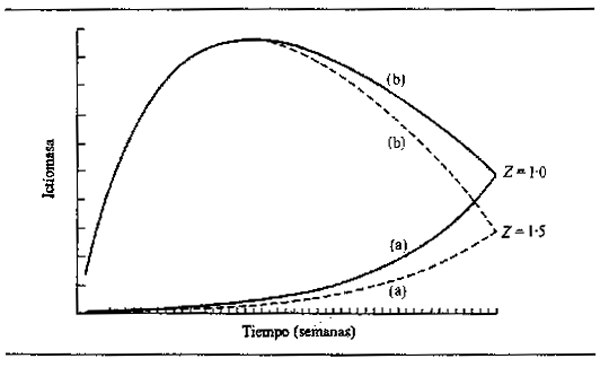
Figura 6.14 Curvas teóricas biomasa-tiempo para los peces del grupo de edad 0 durante un año calculadas a partir de (a) expresiones exponenciales simples para crecimiento y mortalidad, y (b) expresiones de “llano inundable”
Daget y Ecoutin (1976) obtuvieron también un modelo de biomasa y producción basado en su ecuación de crecimiento para peces que tienen una suspensión anual de crecimiento. La biomasa se calcula a partir de Bt = Nt Wt, donde:
Wt = 0.68 10 -5 L³t
Lt se obtiene de las fórmulas examinadas en la sección sobre crecimiento, y N se obtiene de la ecuación exponencial simple de mortalidad:
Wt = Noe-zt
El modelo fue aplicado al Polypterus senegalus, dando una buena comparabilidad con los resultados observados. Las estimaciones de producción oscilaban de 528,5 kg/ha/año (P/B = 0.56) a 281,6 kg/ha/año (P/B = 1,12) para unos coeficientes de mortalidad z = 0,04 y z = 0,10 respectivamente. Esto revela la importancia de estimar correctamente la tasa de mortalidad al obtener los valores de producción y de biomasa. El uso de un factor constante de mortalidad en este modelo es algo limitativo, y la abrupta terminación del crecimiento produce una curva anual de biomasa bastante picuda (Fig. 6.15) que no parece reflejar la situación real.
Welcomme y Hagborg (1977) propusieron una simulación más detallada de la dinámica de una comunidad íctica de zona de anegamiento, basada en una combinación de sus modelos de crecimiento y mortalidad. Con la introducción de tasas de mortalidad dependientes de la densidad, y dependiendo el crecimiento y la incorporación de nuevas cohortes de la intensidad de la crecida simulada, el modelo permitió explorar los efectos sobre una comunidad teórica de peces de los cambios en los componentes de crecida y estiaje del régimen hidrológico. La simulación dio una serie de curvas para la ictiomasa total obtenidas de regímenes hidrológicos en los que tanto la intensidad de la crecida como la cantidad de agua retenida en el sistema en la estación seca podían variar independientemente entre sí (Fig.6.16). El modelo indicó que las diferencias en los regímenes de crecida producen grandes diferencias en la ictiomasa dentro del año, mientras que la magnitud de la población que pasa al año siguiente depende sobre todo de la cantidad de agua que conserva el sistema durante el estiaje. Indicó también que cuanta más agua conserve el sistema en la estación seca, más se transmiten a los años siguientes las diferencias inducidas por el régimen de crecida. Las curvas de la Fig.6.16 se combinaron en un trazado tridimensional de ictiomasa media para diferentes regímenes de crecida y estiaje (Fig. 6.17). Los valores para la producción íctica por zona de anegamiento medio obtenidos de esta simulación concuerdan bien con las conclusiones generales sobre ríos de crecida que van de 241 kg/ha/año a 564 kg/ha/año, según el régimen de crecida, con valores P/B entre 1,35 y 1,77. Tanto la producción como la biomasa son máximas con las crecidas mayores, pero la relación por cociente entre ellas aumenta a medida que decrece la superficie máxima inundada. Este modelo, debidamente modificado en atención al crecimiento y a la mortalidad de las poblaciones locales de Oreochromis, ha sido aplicado a los lagos Alaotra e lhotry en Madagascar (Moreau, 1980, 1982). En este caso la superficie cubierta por el agua en la estación seca era
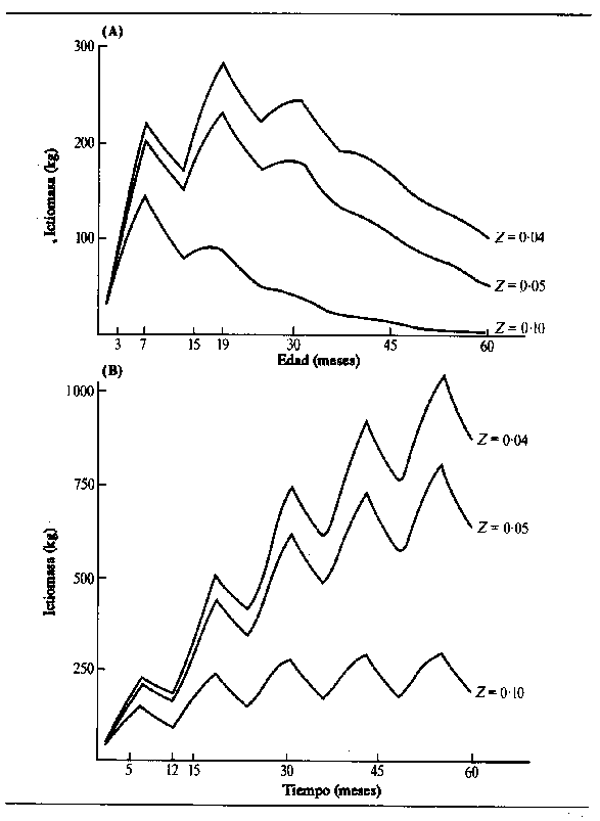
Figura 6.15 (A) Variaciones en la ictiomasa de una cohorte como función de la edad para tres coeficientes de mortalidad diferentes; (B) Ictiomasa de la población para tres coeficientes de mortalidad diferentes, suponiendo que cada año sea igual la incorporación de cohortes y que éstas se acumulen. (Según Daget y Ecoutin, 1976)
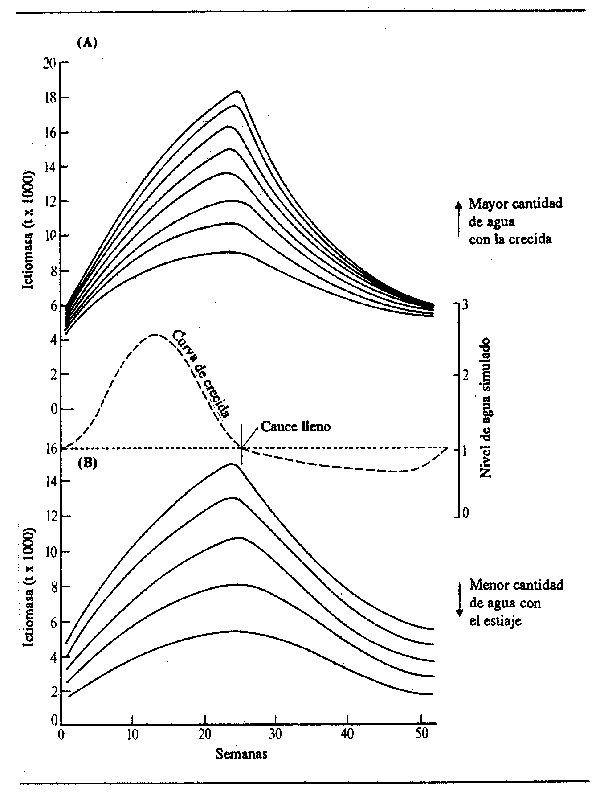
Figura 6.16 Curvas generadas por computadora para indicar los cambios temporales en la ictiomasa total con diferentes regímenes hídricos: (A) el régimen de estiaje es constante y el régimen de crecida varía; (B) el régimen de crecida es constante y el régimen de estiaje varía. Se indica también un régimen hídrico típico (-----). (Según Welcomme y Hagborg, 1877)
22 000 ha, mientras que en la estación húmeda el agua anegaba 57 000 ha. Aparte de algunas diferencias en los números de peces, las predicciones del modelo concordaban bien con los resultados obtenidos de estudios experimentales.
Estos tres modelos indican una evolución similar de la biomasa durante el año con una curva convexa ictiomasa-tiempo. Según esto, hay un rápido aumento inicial en la ictiomasa que alcanza un máximo cuando las aguas en retirada vuelven aproximadamente al nivel de cauce lleno, y que parece representar la situación real con bastante exactitud. Los modelos subrayan igualmente la gran importancia del grupo de edad 0 +, que llega a contribuir con el 80% a la ictiomasa total, según la tasa de mortalidad. Tanto la forma de la curva biomasa-tiempo como la gran preponderancia de peces juveniles tienen importantes implicaciones para la administración de la comunidad íctica con fines de pesca. Las variaciones en la producción y la ictiomasa correspondientes a las diferencias en los regímenes hídricos previstas por la simulación sugieren que variaciones equivalentes de un año a otro tienen lugar en las propias poblaciones de peces. Por los datos de que se dispone sobre muchos sistemas se sabe que las capturas fluctúan ciertamente de esa manera, y es de presumir que otro tanto ocurre con la producción y la ictiomasa.
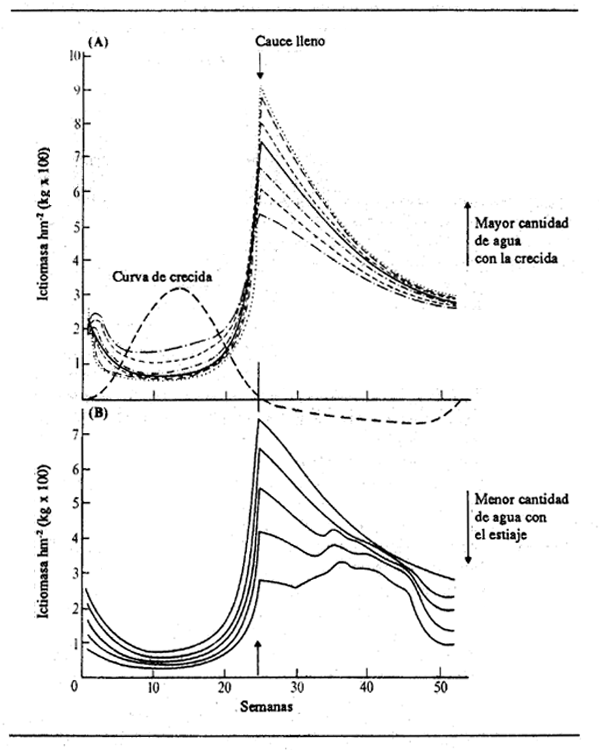
Figura 6.17 Curvas generadas por computadora para indicar los cambios. temporales en la densidad de población (kg/ha) con diferentes regímenes hídricos: (A) el régimen de estiaje es constante y el régimen de estiaje varía. Se indica también un régimen hídrico típico constante y el régimen de estiaje varía. Se indica también un régimen hídrico típico (-----). (Según Welcomme y Hagborg, 1977)
Las curvas de ictiomasa por unidad de superficie trazadas mediante simulación indican que la población está muy dispersa durante la crecida, pero se concentra rápidamente al retirarse el agua de la llanura hasta el nivel de cauce lleno (Fig. 6.17). Esta fase va seguida de una merma constante que refleja la situación real observada por Daget et al. (1973) en el Bandama y por la Universidad de Michigan et al. (1971) en el río Kafue. Los cambios en la ictiomasa por unidad de superficie se deducen también claramente de la estacionalidad de las actividades pesqueras, cuya intensidad máxima coincide con los períodos en que los peces están concentrados, al final de la retirada de las aguas y en la estación seca.