

0494-B4
Marra Dourma[1], Atsu K. Guelly[2], Kouami Kokou[3], Komlan Batawila[4], Bellefontaine Ronald[5] et Koffi Akpagana[6].
Une étude de la régénération d’Isoberlinia doka et I. tomentosa a été réalisée en zone soudanienne du Togo. Trois types de régénération sont observés: régénération par semis, drageons et rejets. Soixante quatorze placettes dans cinq stations ont été analysées. L’occurrence par station de chaque mode de régénération, la densité et la hauteur moyenne sont présentées sous forme de graphiques. Dans les milieux cultivés, les drageons sont beaucoup plus nombreux qu’en forêt classée où, par contre, près de 60% des arbres seraient issus de graines. Les régénérations par drageons et par semis sont très efficaces pour la reconstitution des forêts claires.
Mots clés: Togo, Isoberlinia, régénération, semis, drageonnage.
En Afrique, la zone soudanienne est marquée autour du dixième parallèle par une mosaïque de savanes, de forêts denses sèches et de forêts claires à Isoberlinia (Aubréville 1950; Keay 1951; Geerling 1982; Letouzey 1985). Au Togo, des formations similaires sont présentes dans les zones écologiques II et III (figure 1a) définies par Ern (1979). Les forêts claires sont principalement constituées d’Isoberlinia doka et/ou d’I. tomentosa qui sont très exploitées comme bois d’œuvre, perches pour la construction, bois de service et bois d’énergie (Ouro-Djéri 1994). Les peuplements sont souvent défrichés à des fins agricoles.
Face à ces pressions qui mettent en péril la pérennité de ces peuplements, il était utile de s’intéresser aux divers modes de régénération de ces deux espèces menacées; une meilleure connaissance notamment de la multiplication végétative de ces espèces semblait indispensable à acquérir. Selon divers auteurs (Aubréville 1950; Bellefontaine et al. 1999 et 2000), une faculté de drageonnage a été observée chez I. doka, ses racines superficielles drageonnant abondamment (notamment pour Bationo et al. [2001c] lors de la dégénérescence de l’arbre).
Ce document permet, à travers une étude du système racinaire d’I. doka et d’I. tomentosa, de déterminer la fréquence des divers types de régénération afin de pouvoir influencer les aménagements futurs de ces forêts claires.
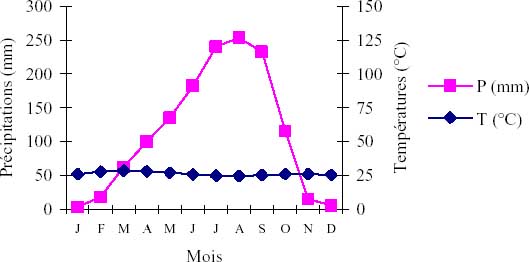
Cette étude est menée au Togo entre Sokodé et Bafilo, région qui couvre en partie les préfectures de Tchaoudjo et d’Assoli, à cheval sur les zones écologiques II et III (figure 1a). Le climat est de type soudanien caractérisé par une saison pluvieuse d’avril à octobre et une saison sèche de novembre à mars (figure 1b). C’est une zone de fortes pentes à versants rectilignes appartenant au domaine phytogéographique soudanien (White 1986).
I. doka et I. tomentosa (Caesalpiniaceae) sont de grands arbres de 10 à 15 m de hauteur, pouvant atteindre parfois 20 m. I. doka a une cime assez étroite et ouverte, son écorce grise et écailleuse est à tranche rouge alors qu’I. tomentosa a une cime plus étalée et dense, une écorce grise et écailleuse plutôt brune au-dessus et à tranche rouge pâle. Les feuilles composées sont glabres chez I. doka et tomenteuses chez I. tomentosa (Hutchinson et Dalziel 1954-1972; Brunel et al. 1984). Ces deux espèces constituent l’essentiel du cortège floristique des forêts claires des zones écologiques II et III où elles forment parfois des peuplements purs.
Figure 1a: Subdivisions écologiques du Togo (Ern, 1979) et zone d’étude.
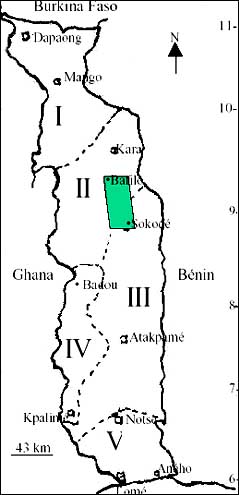
(I: zone des plaines du nord; II: zone des montagnes du nord; III: zone des plaines du centre; IV: zone méridionale des monts du Togo; V: Plaine côtière du sud Togo)
Figure 1b: Courbe ombrothermique de Sokodé.
Pour caractériser les différents types de régénération, des placettes de 10 m x 10 m sont positionnées au hasard dans divers sites ou stations: des champs (Ch), des jachères d’âges variés: <5 ans (J1), de 6 à 10 ans (J2), >11 ans (J3) et dans la forêt classée (FC). Au total, 74 placettes ont été installées. Dans chaque placette, une excavation du réseau racinaire des Isoberlinia est faite à l’aide d’une machette et d’une pioche afin de distinguer les individus issus de semis ou de drageons. Un dénombrement systématique de tous les individus est effectué. Tous ceux dont le diamètre à 1,3 m du sol est supérieur à 5 cm sont mesurés à l’aide d’un ruban. Les classes de diamètre considérées sont: A (5<d<9,9 cm), B (10<d<14,9 cm), C (15<d<19,9 cm), D (20<d<24,9 cm), E (25<d<29,9 cm) et F (d>30 cm). Les classes de hauteurs définies sont: I (h<1 m), II (1< h<4,9 m), III (10<h<14,9 m), IV (15<h<19,9 m) et V (h>15 m). L’architecture du système racinaire est schématisée sur place. Les données recueillies sont saisies et soumises à un traitement statistique.
3.1.1. Régénération
Trois types de reproduction sont observés chez I. doka et I. tomentosa: reproduction (semis), propagation végétative (drageons), multiplication végétative (rejets de souche). Les différents taux de régénération obtenus pour les deux espèces sont fonction de l’âge et des stations (figure 2a). Le drageonnage assure environ 65 à 85% de la régénération, les semis 20 à 30% et le solde pour les rejets dans les sites exploités, sauf en forêt classée où les semis représentent près de 60%.
Dans les champs, les différentes jachères et dans la forêt classée, le taux de régénération par semis d’I. doka reste relativement plus élevé que celui d’I. tomentosa (figure 2b). Par contre, la régénération par drageons d’I. tomentosa est supéreure à celle d’I. doka dans tous les sites (figure 2c).
Quant au nombre de souches ayant rejeté, il varie avec le degré d’exploitation. En effet dans les champs et les jeunes jachères, le nombre de rejets d’I. doka est plus important que celui d’I. tomentosa. Dans les jachères J1, J3 et en forêt classée, la situation inverse s’observe (figure 2d).
3.1.2. Dynamique des peuplements
La densité et la hauteur moyennes des Isoberlinia issus respectivement de la régénération par semis, drageons et rejets dans les différents sites sont illustrées par les figures 3a, 3b et 3c. Leur analyse montre que la densité des jeunes individus issus de semis est élevée par rapport à celle des individus adultes dans les champs et dans les jachères J2. Dans les jachères J1, J3 et la forêt, ce sont les individus adultes qui prédominent (figure 3a). La hauteur des individus varie de 1 à 19 m et le diamètre est compris entre 5 et 73 cm.
Pour la régénération par drageons, la densité des jeunes individus reste très élevée dans tous les sites avec une importance marquée dans les champs. Celle des individus adultes est très faible. Cette diminution régressive des jeunes individus est représentée par la figure 3b. La hauteur moyenne va de 1 à 17 m et le diamètre moyen des individus de 5 à 64 cm. Les jeunes drageons (hauteur inférieure à 4,9 m) sont le plus souvent relié à l’arbre-mère. Certains individus adultes (hauteur supérieure à 5 m) présentent parfois une autonomie vis à vis du tronc de l’arbre-mère.
Le nombre des jeunes individus issus des rejets, très élevé dans les champs et les jachères J1 et J2, diminue considérablement dans les jachères J3 et est très faible voire nul en forêt (figure 3c). La hauteur des individus varie de 1 à 11 m avec un diamètre compris entre 5 et 14 cm.
3.1.3. Morphologie et architecture du réseau racinaire
Le système racinaire d’I. doka et I. tomentosa (jeunes arbres - 5 m) est formé par une racine principale pivotante et des racines secondaires à croissance horizontale et parfois oblique. Toutes ces racines ont une forme conique. Dans les sols bien drainés, le pivot est vertical et son diamètre diminue avec la profondeur. Le réseau secondaire est traçant (superficiel ou réparti dans les 30 premiers centimètres du sol). Il varie selon l’âge et la taille de l’individu considéré.
Par contre dans les sols caillouteux des versants (entre les rochers), le pivot est confronté à de nombreux obstacles; le système devient oblique et plagiotrope. Pour un individu de 5 m de haut et 8 cm de diamètre, le diamètre du pivot diminue progressivement: de 12,7 cm, il passe à 4,5 cm à 1,5 m de profondeur. Les racines traçantes peuvent couvrir un cercle de plus 7 m de rayon.
3.1.4. Distribution spatiale des drageons
Les drageons se remarquent sur les racines traçantes superficielles ou proches de la surface (à environ 10 cm), surtout au niveau des zones de boursouflures et de renflements (photo 1). Ils sont très représentés sous la couronne de l’arbre (entre 1,5 et 3 m). Autour d’un pied-mère (adulte), 22 drageons en moyenne peuvent être observés. Ces derniers d’âges et de tailles diverses s’insèrent à des distances variables du tronc-mère. La distance d’apparition des drageons par rapport au pied-mère peut atteindre 10,5 m (ou plus sur sols bien drainées et profonds). Le nombre de drageons augmente considérablement sous l’effet de la culture itinérante sur brûlis.
Figure 2a: taux moyens de semis (s), drageons (d) et rejets (r) d’I. doka et I. tomentosa.
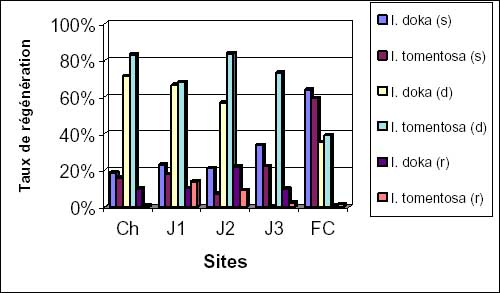
Figure 2b: taux moyens de semis d’I. doka et I. tomentosa.
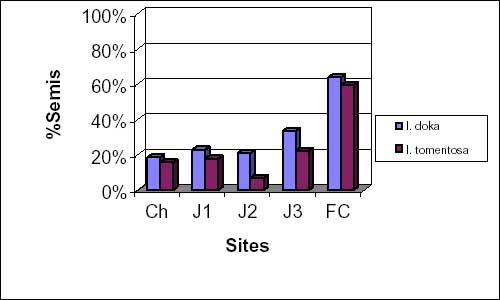
Figure 2c: taux moyens de drageons d’I. doka et I. tomentosa.
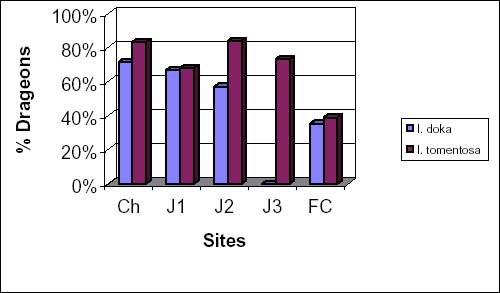
Figure 2d: taux moyens de rejets d’I. doka et I. tomentosa.
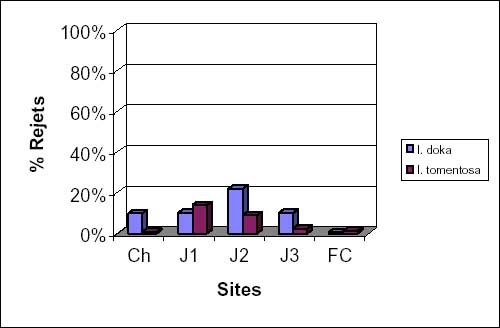
Figure 3a: densité et hauteur moyennes des individus d’Isoberlinia par semis.
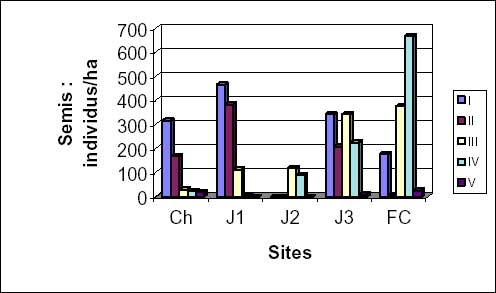
Figure 3b: densité et hauteur moyennes des individus d’Isoberlinia par drageons.
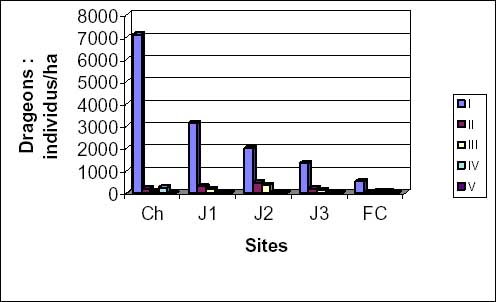
Figure 3c: densité et hauteur moyennes des individus d’Isoberlinia par rejets.
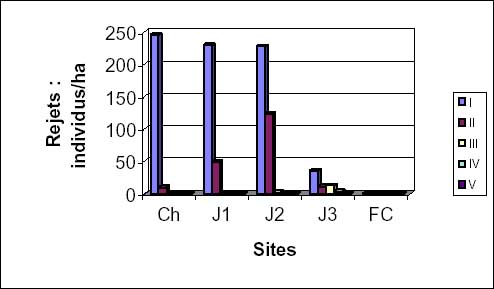
Photo 1: Drageons de racines superficielles d’I. doka sur les renflements et de boursouflures.

Les taux de régénération par semis augmentent en fonction de l’âge des jachères. Par contre, les taux de régénération par drageons augmentent en fonction des activités anthropiques (labour, feux, etc.). Le taux de rejets de souche est lié à l’importance des coupes dans les formations.
La faible durée de vie des semences (1-4 semaines), l’enveloppe séminale très mince (faible protection de l’amande) et la teneur en eau (15%) de ces graines favorisant le développement de champignons (Willan 1992) sont responsables d’une forte mortalité avant la saison des pluies (Bationo et al. 2001a). De plus, la régénération par semis est fonction de nombre de semenciers et des conditions topographiques, édaphiques et climatiques pendant la saison sèche qui suit. Tous ces paramètres expliquent les faibles taux de reproduction enregistré par les semis, en dehors de la forêt classée, où l’ombrage et diverses conditions permettent une meilleure reproduction sexuée, à moins que les semis comptés comme tels dans nos observations ne représentent des drageons affranchis de la racine de l’arbre-mère (Bellefontaine et Monteuuis 2001).
La tubérisation du pivot chez le genre Isoberlinia traduit l’accumulation des réserves (Margara 1984). Celle-ci favorise la régénération par drageons et par rejets. Il a été établi chez de nombreuses espèces ligneuses que les zones d’insertion des rejets est pourvue de réserves métabolisables (Bory et al. 1991; Clair-Maczulajtys 1985). Ces réserves sont déterminantes pour la vigueur des réitérats et pour leur nombre. Ainsi la forte capacité de ces espèces à régénérer par drageons serait liée à ces taux de réserves. Selon Bellefontaine (1997), toutes les espèces ligneuses n’ont pas la même aptitude à drageonner. Les forts taux de régénération par drageons sont le résultat de l’expression des réserves accumulées par la plante suite à un traumatisme de son appareil végétatif (aérien ou souterrain). Cette aptitude est favorisée par son réseau racinaire. L’architecture racinaire explique la capacité de la plante à exploiter les ressources du sol (Lynch 1995). La dualité (système pivotant/traçant) assure l’ancrage de la plante (Stokes et al. 1996), l’enracinement traçant assure la collecte des nutriments (Martin 1990; Coutts et Nicoll 1991). L’enracinement profond du pivot assure l’alimentation en eau pendant la saison sèche (Frensham et Kirpatrick 1992; Ouedraogo 1997).
La majorité des drageons se trouvent sous la couronne de l’arbre. Ces résultats sont analogues aux études de Pagès (1985) sur Robinia pseudoacacia en France. Le réseau racinaire superficiel favorise chez certaines espèces la régénération par drageons et leur propagation de proche en proche à partir d’un seul individu permettant ainsi la conquête de l’espace (Cassagnaud et Facon 1999). Cette colonisation expliquerait sans doute en grande partie la monospécificité des forêts à Isoberlinia.
Ces deux espèces possèdent une bonne régénération dans les champs, jachères d’âges variés et forêts (structure en L). La structure verticale des individus issus des trois types de régénération peut conduire à la reconstitution des forêts claires à Isoberlinia si les formations sont gérées à long terme, contractuellement avec l’aide des populations riveraines, suivant certaines techniques sylvicoles économiques. La régénération par semis et par drageons favorisent le mieux cette afforestation. Après cultures, la régénération par drageonnage est la mieux indiquée dans le cas d’une recolonisation de proche en proche de l’espace à partir des racines traçantes. Il serait intéressant de pouvoir l’induire dans certaines stations. Ces espèces assurent donc leur variabilité génétique par reproduction sexuée (semis) et leur pérennité par multiplication végétative (drageons et rejets).
Aubréville A., 1950. Flore forestière soudano-guinnéenne: A.O.F.-Caméroun-A.E.F. Sociétés d’éditionsgéographiques, maritimes et coloniales, Paris, 523p.
Batiano B.A., Ouedraogo S.J., Alexandre D.Y., Guinko S., 2001a. Statut hydrique de quatre Espèces ligneuses dans la forêt classée de Nazinon (Burkina Faso). Sécheresse 12, 87-94.
Batiano B.A., Ouedraogo S.J., Guinko S., 2001b. Stratégie de régénération naturelle de Detarium microcarpum Guill.& Perr. dans la forêt classée de Nazinon (Burkina Faso). Fruits, 56, 271- 285.
Batiano B.A., 2001c. Régénération naturelle de cinq espèces ligneuses de la forêt classée de Nazinon (Burkina Faso): Detarium microcarpum Guill. & Perr., Afzelia africana Sm., Isoberlinia doka Craib.& Stapf., Piliostigma thonningii (Sch.) Miln.-Redh. et Terminalia avicennioides Guill & Perr. Th. Université Ouagadougou, 174p.
Bellefontaine R., 1997. Synthèse des espèces des domaines sahélien et soudanien qui se multiplient naturellement par voie végétative, pp. 95-104, in: “Fonctionnement et gestion des écosystèmes forestiers contractés sahéliens”, Niamey, nov. 1995 (J.M. d’Herbès, J.M.K. Ambouta, R. Peltier Eds.), Ed. John Libbey Eurotext, Paris, 274 p.
Bellefontaine R. et Monteuuis O., 2002. Le drageonnage des arbres hors forêt: un moyen pour revégétaliser partiellement les zones arides et semi-arides sahéliennes? in: Multiplication végétative des ligneux forestiers, fruitiers et ornementaux, Orleans, 22-24 novembre 2000 (Coordinateurs M. Verger, H. LeBouler). CD-Rom CIRAD-INRA.
Bellefontaine R., Edelin C., Ichaou A., du Laurens D., Monsarrat A., Loquai C., 2000. Le drageonnage, alternative aux semis et aux plantations de ligneux dans les zones semi-arides: protocole de recherches. Sécheresse 4, 11, 221-226.
Bellefontaine R., Nicolini E.A., Petit S., 1999. Réduction de l’érosion par l’exploitation de l’aptitude à drageonner de certains ligneux des zones tropicales sèches, pp. 342-352, in: “L’homme et l’érosion”, Cameroun, déc. 1999 (Ed. E Roose), Bulletin du Réseau Erosion, IRD-CTA, n° 19, 608p.
Bory G. et Clair-Maczulzjtys D., 1991. Les métabolites des réserves: un outil de perception de la physiologie de l’arbre entier, pp. 97-115, in: Physiologie des arbres et arbustes en zone aride et semis-arides. Ed. Groupe d’Etudes de l’Arbre, Paris.
Brunel J.F., P. Hiepko et H. Scholz, 1984. Flore analytique du Togo: Phanérogames. GTZ éd., Eschbom, 751p.
Cassagnaud M. et Facon, B., 1999. La propagation végétative chez quelques espèces de la garrigue méditerranéenne: architecture, développement et stratégies adaptatives. Maîtrise Biologie Populations, Ecosystèmes, Université Montpellier, 20p. + ann.
Clair-Maczulajtys D., 1985. Quelques aspects de la biologie de l’Ailanthus altissima (Mill.) Swingle. Etude de la double stratégie de reproduction par graines et par drageonnement en relation avec les métabolites de réserve. Th. Univ. Paris VII, 441p.
Coutts M.P. and Nicoll B.C., 1991. Development of surface root of trees, pp 62-70, in: L’arbre. Biologie et développement, Montpellier, Naturalia Monspeliensia,61-70.
Ern H., 1979. Die Vegetation Togo. Gliederrung, Gefährdung Erhaltung. Willdenowia 9: 295-312.
Frensham R.J. and Kirpatrick J.B., 1992. Soils characteristics and tree species distribution in the Savannah of Melville Island, Northern Territory. Aust. J. Bot., 40, 311-333.
Frenshman R.J. and Bowman D.M., 1992. Stand structure and the influence of over wood on Regeneration in tropical Eucalyptus forest on Melville Island. Aust. J. Bot., 40, 335-352.
Geerling C., 1982. Guide de terrain des ligneux sahéliens et soudano-guinéens. H. Veenman, Wazeningen, 340p.
Hutchinson J. and Dalziel, J.M., 1954. Flora of West Tropical Africa. 2nd ed. Crown Agents for Overseas, London, pp 264-281.
Keay R.N.J., 1951. Isoberlinia woodland in Nigeria and their flora. Symposium de l’AETFAT, Bruxelles.
Letouzey R.,1982. Manuel de Botanique forestière. Afrique tropicale. Tome 2a. Centre Technique Forestier Tropical, Nogent-sur-Marne, 210p.
Lynch J. 1995. Root architecture and plant productivity. Plant Physiology, 109, 7-13.
Margara J. 1984. Bases de la multiplication végétative: les mécanismes de l’organogenèse. INRA (France), 262p.
Martin K., 1990. Root proliferation in recent and weathered sandy soils from Veracruz, Mexico. Journal of Tropical Ecology 6, 355-370.
Ouedraogo A., 1997. L’effet de la coupe de Detarium microcarpum Guill. et Perr. sur la régénération dans la forêt classée de Nazinon. Mém. IDR, Univ. Ouagadougou, 73p.
Ouro-Djéri, E., 1994. Approvisionnement et consommation des combustibles ligneux à Sokodé (Togo). Mém. Univ. Dschang, 96p.
Pagès L., 1985. Les taillis de Robinier du Val de Loire: croissance, biomasse, régénération. Thèse, Université Paris-Sud, 74 p. + ann.
Stokes A., Ball J., Filter A.H., Brain P. and Coutts M.P., 1996. An experimental investigation of the resistance of model rot system to up rooting. Ann. of Bot. 78, 415-421.
White F.,1986. La végétation d’Afrique. Mémoire, carte de la végétation d’Afrique. UNESCO/AETFA/UNSO.
Willan R.L., 1992. Guide de manipulation des semences forestières. Etude FAO-Forêt 20/2, Rome, 444p.
| [1] Laboratoire de Biologie
végétale et Ecologie végétale, Faculté
des Sciences, Université de Lomé, B.P. 1515, Lomé,
Togo. a) [email protected] [2] Laboratoire de Biologie végétale et Ecologie végétale, Faculté des Sciences, Université de Lomé, B.P. 1515, Lomé, Togo. b) [email protected] [3] Laboratoire de Biologie végétale et Ecologie végétale, Faculté des Sciences, Université de Lomé, B.P. 1515, Lomé, Togo. c) [email protected] [4] Laboratoire de Biologie végétale et Ecologie végétale, Faculté des Sciences, Université de Lomé, B.P. 1515, Lomé, Togo. d) [email protected] [5] CIRAD-Forêt, TA 10/D 34398 Montpellier (France) e) [email protected] [6] Laboratoire de Biologie végétale et Ecologie végétale, Faculté des Sciences, Université de Lomé, B.P. 1515, Lomé, Togo. f) [email protected] |