Para la investigación de casos de una posible virosis, es muy importante tener en cuenta que el material ha de mantenerse frío durante las fases de su manejo y estudio, motivo por el cual debe conservarse en hielo hasta tanto se haya comprobado que el virus tolera mayores temperaturas. El hielo seco NO DEBE USARSE para la preservación de material para exámenes virológicos, puesto que el dióxido de carbono produce un pH bajo, el cual afecta en forma adversa la sobrevivencia de los virus.
Es importante recordar que los virus son principalmente intracelulares y por ello se hace necesario triturar u homogenizar el material (o los materiales) para liberar el virus. La trituración puede efectuarse de manera muy económica mediante el empleo de un mortero y mazo, usando arena estéril como abrasivo.
Es también necesario tener en cuenta que, según la naturaleza sospechada de la posible virosis, el material destinado para los exámenes de laboratorio correspondientes debe transportarse de la siguiente manera:
Septicemia hemorrágica viral, necrosis hematopoyética viral, Herpesvirus salmonis: transportar el material en hielo.
Necrosis pancreática infecciosa: transportar el material en glicerol tamponado al 50%.
Al recibirse el material en el laboratorio, se prepara una solución acuosa de un producto aprobado en base a yodo orgánico que contenga quinientas partes por millón (500 ppm) de yodo disponible (como I2 libre). Esta solución recién preparada se usa para la desinfección de todo instrumental, restos de pescado y demás material una vez terminado el procedimiento correspondiente, efectuándose una exposición del material durante quince (15) minutos en la solución desinfectante.
Para fines de la Certificación Ictiosanitaria, la detección y aislamiento de cualquier agente filtrable capaz de producir un efecto citopatógeno (ECP) en las líneas celulares específicas debe considerarse como “certificable”, aún cuando el mismo agente no puede ser identificado mediante las técnicas inmunoserológicas u otras correspondientes, así como si tenga o no una patogenicidad determinada o comprobada para salmónidos u otros peces.
El siguiente procedimiento biológico básico es aceptable para la detección y aislamiento de los virus incluidos en la lista de las enfermedades transmisibles de los salmónidos consideradas en la Convención Internacional FAO/OIE para Controlar la Propagación de las Principales Enfermedades Transmisibles de los Peces:
Las muestras se homogenizan con un volumen igual de una solución fisiológica isotónica tamponada a un pH de 7,6 – 7,8 (por ejemplo: solución de Earle o de Hanks), agregando hielo picado al atomizador cuando eso sea necesario para mantener una temperatura mínima; el líquido ovárico permanece sin diluir, o puede diluirse 1:2 en casos cuando el mismo está muy turbio.
El tejido homogenizado (o triturado) o líquido ovárico se centrifuga a 1000–2000 g durante diez a quince (10–15 minutos.
Bacterias y hongos se eliminan del líquido sobrenadante mediante filtración aséptica a través de un filtro de membrana con porosidad de 0,4 – 0,5 um; para evitar cualquier pérdida apreciable de virus por absorción en el filtro, es importante recolectar el máximo volumen posible de filtrado; bacterias y hongos también pueden ser eliminados mediante el uso de una mezcla de antibióticos, a saber: estreptomicina, penicilina G y nistatina a niveles de 1000 mcg, 1000 U.I. y 500 U.I. respectivamente/ml de homogenado; cuando se utiliza la mezcla de antibióticos, la muestra así tratada debe ser mantenida durante tres (3) horas a los 20°C.
Si es necesario, se reajusta el pH a 7,6–7,8 y la muestra (tratada por filtración o con antibióticos) se inocula por duplicado en frascos o tubos que contengan el cultivo celular correspondiente en forma de monocapa; para toda prueba de rutina se emplean monocapas de las líneas celulares RTG-2 (ATCC N° CCL 45) y FHM (ATCC N° CCL 42) y es imprescindible asegurar que estas líneas celulares sean sensibles al virus que se intenta aislar; en ese sentido es conveniente notar que la línea RTG-2 no es especialmente sensible al virus de la necrosis hematopoyética infecciosa y en casos cuando se sospecha la presencia de esta enfermedad, o cuando se desea lograr el aislamiento del agente etiológico de la misma, es necesario confiar en la línea FHM.
Para el aislamiento de virus, es conveniente utilizar tubos de vidrio, de 16 × 125 mm, con tampón de rosca; para cada monocapa se emplea 1,0 ml del medio esencial mínimo (MEM) de Eagle, el cual tenga un pH de 7,6–7,8 en el caso de los virus de los salmónidos; el medio contendrá sales de Eagle, glutamina y suero de feto bovino al 10%; para controlar el desarrollo de bacterias se puede emplear una mezcla de 100 mcg de estreptomicina y 100 U.I. de penicilina G/ml, o de 50 mcg de gentamicina/ml; para controlar el desarrollo de hongos se puede emplear 25 U.I. de nistatina/ml o de 0,25 mcg de amfotericina/ml; la línea celular FHM se incuba a los 20°C y en el momento de efectuarse el inóculo con la muestra en investigación, las monocapas deben tener una confluencia del 75–90% como mínimo, así como tener menos de cuatro (4) días de edad.
Se inocula asépticamente 0,1 ml de la muestra filtrada o tratada con antibióticos/ml de cultivo celular, usando dos (2) cultivos de la línea RTG-2 y dos (2) cultivos de la línea FHM respectivamente por cada muestra: los cultivos inoculados se incuban a los 15°C en el caso de la línea celular RTG-2 y a los 20°C en el caso de la línea celular FHM; para cada lote de células inoculadas, es preciso utilizar un testigo negativo para lo cual se repite el procedimiento con 0,1 ml de solución fisiológica isotónica tamponada y estéril/ml de cultivo; después de haberse efectuado el inóculo, se deja pasar una (1) hora como período de absorción a la temperatura ambiente, después del cual se agrega el volumen normal de medio de mantenimiento.
A pesar de los considerables peligros e inconvenientes que representan para los países latinoamericanos, puede ser necesario utilizar un testigo positivo; en ese caso, se procede tal como se ha detallado en los renglones (v) y (vi) arriba, utilizando una suspensión del virus de la necrosis pancreática infecciosa (cepa ATCC N° VR - 299) que contenga 102–103 DICC del virus (DICC = Dósis Infectiva en Cultivos Celulares).
Los cultivos se incuban a la temperatura correspondiente (ver (v) arriba) y se examinan diariamiente para detectar la presencia de cualquier efecto citopatógeno (ECP); si se llega a presentar un fuerte ECP durante las primeras veinticuatro (24) horas de incubación, suele indicar la toxicidad del material inoculado en los cultivos celulares y en tales casos las células se cosechan al agitar fuertemente el tubo o frasco; la cosecha se ultrasonifica durante diez (10) segundos, se diluye 1:5 en medio de mantenimiento y se reinocula en nuevas monocapas; si se produce contaminación bacteriana o micótica de los cultivos celulares, las células se cosechan, se ultrasonifican durante veinte a treinta (20–30) segundos, se centrifugan a 1000 g durante quince (15) minutos, se filtra el sobrenadante a través de una membrana de porosidad de 0,4–0,5 um y se reinocula en nuevos cultivos celulares.
Para fines de la Certificación Ictiosanitaria, una prueba se considera negativa si no se produce ECP alguno ni en el cultivo original ni en el paso ciego correspondiente; en casos en los cuales se produce un ECP un uno o más de los cultivos celulares inoculares con el material en investigación, es mandatario proceder al aislamiento e identificación de cualquier agente filtrable; aunque una identificación presuntiva del agente productor de un ECP puede efectuarse en base a las señales clínicas observadas en el momento de tomar las muestras, así como en el tipo de ECP producido, la identificación posterior definitiva se efectúa mediante la neutralización del agente con el antisuero correspondiente y si no se produce aglutinación alguna frente a los antisueros utilizados, se hace necesario pensar en la posible presencia de un virus desconocido en el material en investigación.
Al producirse un ECP reproducible y virus-específico, se procede en primer lugar a demostrar a manera diferencial la presencia de nucleoproteinas ribo (ARN) y desoxiribo (ADN) mediante la técnica de coloración de May-Grunwald-Giemsa; los colorantes se preparan de la siguiente manera:
Colorante May-Grunwald: 2,5 g disuelto en 1000 ml de metanol al 100%; dejar envejecer durante un (1) mes.
Colorante Giemsa: 1 g disuelto en 66 ml de glicerol durante dos (2) horas a los 60°C; agregar 66 ml de metanol al 100%.
Filtrar las soluciones colorantes antes de usarse.
La técnica de coloración se lleva a cabo tal como se detalla a continuación:
Cubreobjetos de tipo Leighton se colorean in situ; cubreobjetos comunes pueden ser colocados en vidrios de reloj previa su coloración; la coloración ha de efectuarse con la monocapa celular por abajo, para así minimizar la acumulación de gránulos de colorante y demás artefactos.
Lavar CUIDADOSAMENTE tres (3) veces con solución fisiológica isotónica tamponada a pH 7,6–7,8.
Fijar durante cinco (5) minutos, en metanol al 100%.
Usando pipetas de vidrio, colorear durante diez (10) minutos con 1,0–1,5 ml de colorante May-Grunwald.
Usando pipetas de vidrio, colorear durante quince (15) minutos en colorante Giemsa diluido 1:10 en agua destilada.
Enjuagar rápidamente dos (2) veces en acetona para deshidratar el tejido; NO DEJAR SECAR la lámina o cubreobjeto.
Clarificar al enjuagar tres (3) veces en una mezcla de acetona: xilol (2:1) y tres (3) veces en una mezcla de acetona: xilol (1:2), seguido por una exposición de diez (10) minutos en xilol.
Agregar una gota de bálsamo de Canadá neutro a un portaobjeto de vidrio y colocar encima el cubreobjeto con las células empapadas en xilol para montar el preparado.
Dejar secar el preparado y examinarlo microscópicamente; la proteina ARN se colorea azul, mientras la proteina ADN se colorea de rojo-morado; puede utilizarse una prueba de ribonucleasa durante una (1) hora como testigo.
Es de mayor importancia determinar CUANTO ANTES la identidad de cualquier virus aislado en cultivos celulares y para ello se utilizan pruebas inmuno- o serológicas; sea cual sea la prueba utilizada, será necesario emplear anti-sueros estandarizados de especificidad reconocida contra los diferentes virus; en vista de la reconocida diversidad serológica de virus del grupo de la necrosis pancreática infecciosa, la confirmación serológica de cualquier virus de tipo NPI aislado debe fundamentarse en una reacción positiva frente a un anti-suero polivalente para los principales serotipos de dicho virus; pueden utilizarse tubos o placas de microtítulo para las pruebas serológicas; cultivos celulares mostrando un ECP reproducible y virus-específico deben cosecharse, ultrasonificarse durante diez (10) segundos y diluirse 1:1000 (10–3) con medio de mantenimiento; una vez efectuada la cosecha y dilución correspondientes, se procede como sigue con la prueba de seroneutralización:
Mezclar 0,3 ml de anti-suero diluido (la dilución será de acuerdo al título específico, pero normalmente es de 10-2 – 10-3) con 0,3 ml de cada una de las diluciones de la muestra; mezclar 0,3 ml de suero normal con 0,3 ml de cada una de las diluciones de la muestra; en los casos donde se utiliza un testigo positivo, llevar a cabo de la misma manera una prueba de neutralización de suero, utilizando un anti-suero homólogo y suero normal respectivamente.
Incubar las mezclas durante una (1) hora a los 15°C o a los 20°C; posteriormente se inocula 0,2 ml de cada mezcla en cultivos duplicados de la línea celular en el cual fue aislado el virus, incubándolos a la temperatura correspondiente.
Examinar los cultivos a las 24, 48 y 72 horas para detectar la presencia o ausencia de un ECP; la ausencia de un ECP en los cultivos los cuales tengan un anti-suero determinado, pero no en los que hayan sido inoculados con suero normal que no contenga anticuerpos, constituye una base para la identificación del virus; si se produce un ECP en los cultivos que hayan sido inoculados con la cosecha celular mezclada con el anti-suero, eso indica que la identidad del virus no es la que se sospechó, o bien que la concentración del virus en la dilución al 10-3 era demasiado alta como para ser neutralizada por el anti-suero específico a una dilución al 10-2; esta situación no debería pasar con el virus de la necrosis pancreática infecciosa, ya que es relativamente fácil preparar un antisuero con un título aglutinante alto, pero podría constituir un problema en las pruebas de neutralización con los dos rabdovirus (Rhabdovirus egtvedi, virus de la necrosis hematopoyética infecciosa), contra los cuales es difícil preparar anti-sueros con títulos aglutinantes altos; en estos casos, se hace necesario el empleo de técnicas de reducción de placas o inmunofluorescentes.
La prueba de reducción de placas puede ser empleada para todas las virosis incluidas en la Convención Internacional FAO/OIE para Controlar la Propagación de las Principales Enfermedades Transmisibles de los Peces: el siguiente procedimiento virológico es aceptable para fines de la Certificación Ictiosanitaria:
El fluido de un cultivo celular que muestra un ECP reproducible y virus-específico se diluye como para contener aproximadamente 10-3 UFP (Unidades Formadoras de Placas)/ml; esta dilución se mezcla con un volumen igual del antisuero correspondiente (la dilución del cual será de acuerdo con el título, pero nunca debe ser menor de 100).
Otro volumen del fluido de cultivo diluido se mezcla con un volumen igual de medio de mantenimiento; cantidades iguales de anti-suero y testigo negativo respectivamente se mezclan con una cepa viral de referencia para dar un testigo positivo.
Las mezclas se mantienen durante aproximadamente una (1) hora a la temperatura ambiente.
Cantidades determinadas de cada mezcla se inoculan a cultivos celulares de comprobada sensibilidad en cápsulas de Petri, y en los volúmenes apropiados; después de una absorción de treinta (30) minutos, los cultivos celulares se cubren con un medio que contenga agarosa al 0,5%; como testigos negativos se emplean dos (2) cultivos celulares no inoculados.
Las cápsulas de Petri se incuban durante 48–72 horas a los 15°C o a los 20°C (según el tipo de línea celular utilizado); las monocapas celulares se colorean con rojo neutro (0,2 mg/ml), y se procede a enumerar la cantidad de placas en las cápsulas de Petri; una reducción del 40% o más en el número de placas en las cápsulas de Petri inoculadas con la mezcla del virus con anti-suero se interpreta como evidencia de la presencia del virus correspondiente en el material examinado.
En la TABLA 5 se dan a conocer las principales propiedades de los más importantes virus asociados con enfermedades infecto-contagiosas de los salmónidos.
T A B L A 1
Tamaño de muestreo requerido para la detección de por lo menos un (1) portador en una población piscícola, suponiendo una incidencia mínima determinada de portadores en esa población. El tamaño del muestreo supone un nivel de confianza del 95% en la detección de portadores.
| Tamaño del lote o población | Número de peces en el muestreo cuando la incidencia mínima de portadores es: | ||||||
| 0,5% | 1,0% | 2,0% | 3,0% | 4,0% | 5,0% | 10,0% | |
| 50 | 46 | 46 | 46 | 37 | 37 | 29 | 20 |
| 100 | 93 | 93 | 76 | 61 | 50 | 43 | 23 |
| 250 | 192 | 156 | 110 | 75 | 62 | 49 | 25 |
| 500 | 314 | 223 | 127 | 88 | 67 | 54 | 26 |
| 1000 | 448 | 236 | 136 | 92 | 69 | 55 | 27 |
| 2500 | 512 | 279 | 142 | 95 | 71 | 56 | 27 |
| 5000 | 562 | 288 | 145 | 96 | 71 | 57 | 27 |
| 10000 | 579 | 292 | 146 | 96 | 72 | 57 | 27 |
| 100000 | 594 | 296 | 147 | 97 | 72 | 57 | 27 |
| 1000000 | 600 | 300 | 150 | 100 | 75 | 60 | 30 |
T A B L A 2
Formato anamnésico básico para el examen de salmónidos
| Fecha: | Localidad: |
| Especie de pez (cepa y/o raza cuando corresponda): | |
| Edad del pez: | Sexo del pez: |
| Largo total (mm): | Peso total (g): |
| Arroyo, quebrada, río, etc., de origen (nombrar): | |
| Criadero, piscifactoría, etc (nombrar): | |
| Area del estanque o pileta: Largo: Ancho: Profundidad: | |
| Origen del agua: | |
| Flujo del agua (litros/minuto): | |
| Alimento proporcionado: | |
| Frecuencia de alimentación/día: | |
| Fecha de recepción/fabricación del alimento: | |
| Tamaño del pellet (si corresponde): | |
| Fecha en la cual se observaron las primeras mortalidades: | |
| Mortalidades diarias (% de la problación): | |
| Medicamentos utilizados durante la presente epizootia: | |
| Dósis utilizada y frecuencia de administración: | |
| Eficacia del medicamento en controlar las mortalidades: | |
1. CONDICIONES FISICO-QUIMICAS DEL AGUA (marcar con una “X” donde corresponda)
| Clara ( ) Turbia ( ) Colorada ( ) Temperatura (°C): pH: | ||
| O2 disuelto (ppm): | Salinidad (%): | Dureza (ppm): |
| Nitratos (ppm): | Nitritos (ppm): | Amoniaco (ppm): |
| CO2 disuelto (ppm): | Alcalinidad: | Sales de metales pesados (ppm): |
2. CONDICION DE LOS PECES (marcar con una “X” donde corresponda)
Distribución normal en el agua ( ) Agrupados a los costados de los estanques ( ) Agrupados cerca de la entrada del agua ( ) Agrupados cerca del desagüe ( ) Distribuidos hacia la superficie del agua ( ) Boqueando ( ) Aspecto normal ( ) Con señales de letargia ( ) Con señales nerviosas ( ) Flotando sin rumbo ( ) Nadando de lado ( ) Cayendo al fondo ( ) Con movimientos espasmódicos ( ) Cor. señales de agotamiento ( ) Frotándose contra el fondo o los lados del estanque Otras señales de comportamiento anormal (señalar):
3. EXAMEN CLINICO DE LOS PECES (marcar con una “X” donde corresponda)
A. Superficie del cuerpo
Aspecto normal ( ) Coloración blanco-grisácea ( ) Capa blanco-azulada ( ) Lesiones con sangre y/o pus ( ) Congestión ( ) Ulceración ( ) Granulación ( ) Zonas necróticas ( ) Pequeños puntos en la dermis ( ) Puntos negros ( ) Puntos blancos o blanquecinos ( ) Oscurecimiento parcial ( ) Copos blancos ( ) Oscurecimiento total ( ) Presencia de ectoparásitos ( ) Tumores ( ) Otras anormalidades (señalar):
B. Tejido muscular
Aspecto normal ( ) Presencia de forúnculos ( ) Presencia de quistes ( ) Presencia de úlceras ( ) Presencia de lesiones necróticas ( ) Presencia de parásitos ( ) Señales de micosis ( ) Licuación localizada ( ) Otras anormalidades (señalar):
C. Aletas
Aspecto normal ( ) Deshilachamiento parcial o total ( ) Necrosis ( ) Congestión ( ) Presencia de puntos negros ( ) Presencia de puntos blancos ( ) Hinchamiento ( ) Presencia de hemorragias ( ) Señales de micosis ( ) Otras anormalidades (señalar):
D. Ojos
Aspecto normal ( ) Exoftalmia unilateral ( ) Exoftalmia bilateral ( ) Opacidad ( ) Hinchamiento ( ) Falta de uno o ambos ojos ( ) Congestión ( ) Presencia de puntos rojos intra-oculares ( ) Presencia de puntos rojos ( ) Hemorragias peri-oculares ( ) Puntos blancos en la lente ( ) Ceguera manifiesta ( ) Otras anormalidades (señalar):
E. Branquias y opérculos
Aspecto del opérculo normal ( ) Aspecto de las branquias normal ( ) Opérculos muy abiertos ( ) Coloración de las branquias normal ( ) Coloración rosada de las branquias ( ) Coloración rojo oscura de las branquias ( ) Branquias con aspecto anémico ( ) Congestión ( ) Hemorragias ( ) Zonas de necrosis ( ) Branquias hinchadas ( ) Fusión de los filamentos branquiales ( ) Señales de micosis branquial ( ) Presencia de abundante moco ( ) Presencia de granos de arena o arcilla en las branquias ( ) Acumulación de restos de alimento sobre la superficie branquial ( ) Señales de parásitos ( ) Otras anormalidades (señalar):
F. Cavidad abdominal
Aspecto normal ( ) Presencia de un líquido incoloro ( ) Presencia de un líquido opaco ( ) Presencia de parásitos ( ) Congestión de la pared abdominal ( ) Presencia de quistes en la pared abdominal ( ) Presencia de hemorragias en la pared abdominal ( ) Otras anormalidades (señalar):
G. Hígado
Aspecto normal ( ) Coloración rojiza ( ) Coloración marrón ( ) Coloración pálida ( ) Coloración amarillenta ( ) Presencia de quistes ( ) Presencia de hemorragias ( ) Presencia de parásitos ( ) Aspecto grasoso ( ) Otras anormalidades (señalar):
H. Vesícula biliar
Aspecto normal ( ) Hinchamiento ( ) Bilis de color verdoso ( ) Bilis de color amarillo-verdoso ( ) Bilis de aspecto acuoso ( ) Bilis de color negruzco ( ) Otras anormalidades (señalar):
I. Bazo
Aspecto normal ( ) Hinchamiento ( ) Con señales de atrofia ( ) Presencia de quistes ( ) Congestión ( ) Presencia de hemorragias ( ) Color rojo cereza ( ) Color negruzco ( ) Otras anormalidades (señalar):
J. Corazón
Aspecto normal ( ) Hinchamiento ( ) Con señales de atrofia ( ) Presencia de quistes ( ) Congestión ( ) Presencia de hemorragias ( ) Color pálido ( ) Otras anormalidades (señalar):
K. Riñón
Aspecto normal ( ) Hinchamiento parcial ( ) Hinchamiento total ( ) Congestión ( ) Con señales de atrofia ( ) Con señales de necrosis ( ) Presencia de puntos o áreas blanco-grisáceas ( ) Presencia de puntos negros ( ) Consistencia cremosa ( ) Consistencia dura al tacto ( ) Presencia de parásitos ( ) Otras anormalidades (señalar):
L. Tracto gastro-intestinal
Aspecto normal ( ) Vacío ( ) Lleno de alimento normal ( ) Lleno de moco ( ) Colocación amarillenta ( ) Congestión ( ) Hemorragias ( ) Congestión y hemorragias a nivel del recto ( ) Presencia de parásitos ( ) Presencia de necrosis ( ) Otras anormalidades (señalar):
M. Vejiga natatoria
Aspecto normal ( ) Congestión ( ) Presencia de líquido ( ) Presencia de parásitos ( ) Otras anormalidades (señalar):
N. Ciegos pilóricos
Aspecto normal ( ) Ciegos unidos ( ) Hinchamiento ( ) Presencia de zonas de necrosis ( ) Congestión ( ) Presencia de hemorragias ( ) Presencia de parásitos ( ) Otras anormalidades (señalar):
O. Gónadas
Aspecto normal ( ) Con señales de atrofia ( ) Hemorragias ( ) Congestión ( ) Señales de retención de los huevos ( ) Otras anormalidades (señalar):
P. Otras observaciones clínicas de especial importancia
(Firma del Ictiopatólogo)
T A B L A 3
Características claves para el diagnóstico de las principales bacterias ictiopatógenas
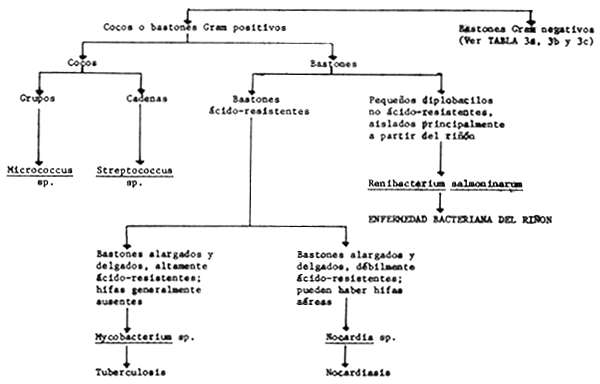
T A B L A 3a
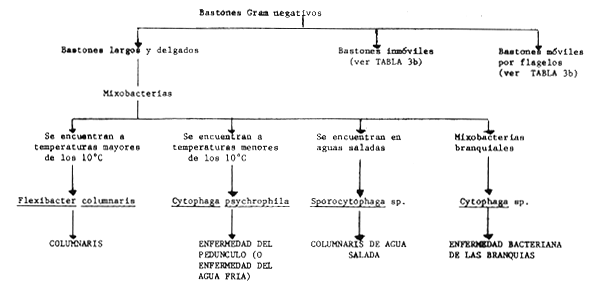
T A B L A 3b
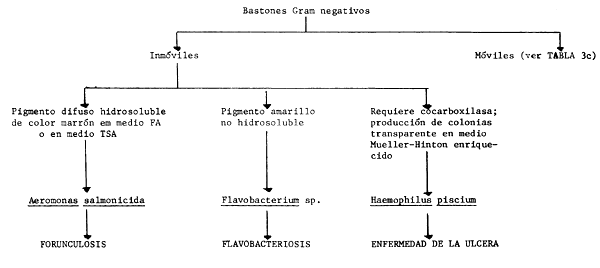
T A B L A 3c
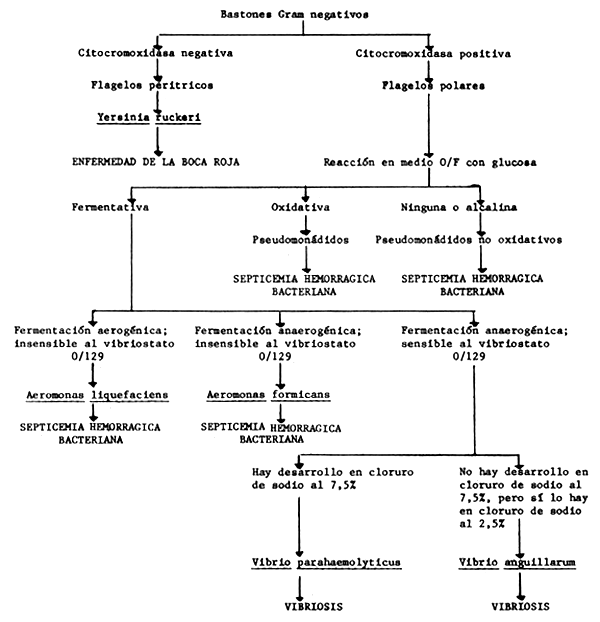
T A B L A 4
Clave para el reconocimiento de los principales grupos de zooparásitos de los salmónidos
| 1. | Organismos microscópicos, no visibles al ojo | 2 | |
| Organismos no microscópicos, visibles al ojo | 4 | ||
| 2. | Organismos unicelulares | PROTOZOOS | |
| Organismos multicelulares | 3 | ||
| 3. | Organismos ectoparasitarios, con ganchos o | ||
| ganchitos en la parte posterior del cuerpo | TREMATODOS MONOGENESICOS | ||
| Organismos bivalvos, enquistados sobre las branquias y/o aletas | MOLUSCOS | ||
| 4. | Organismos enquistados sobre la superficie del pez | 5 | |
| Organismos no enquistados sobre la superficie del pez | 8 | ||
| 5. | Quiste con un solo organismo | 6 | |
| Quiste conteniendo muchos organismos (esporozoos) | PROTOZOOS | ||
| 6. | Forma del organismo enquistado en dos valvas | MOLUSCOS | |
| Forma del organismo enquistado sin valvas | 7 | ||
| 7. | Organismo unicelular (Ichthyophthirius) | PROTOZOOS | |
| Organismo multicelular | TREMATODOS DIGENESICOS | ||
| 8. | Cuerpo algo aplanado | 9 | |
| Cuerpo no aplanado | 14 | ||
| 9. | Cuerpo segmentado | 10 | |
| Cuerpo no segmentado | 11 | ||
| 10. | Organismo con ventosas anteriores y posteriores, provisto de tracto digestivo; ectoparásitos | ANELIDOS | |
| Organismos ĉon un solo haptor anterior, el cual puede estar provisto de varias ventosas; sin tracto digestivo; parásitos intestinales | CESTODOS | ||
| 11. | Organismos con boca y cavidad digestiva; sin ano; órganos de fijación bien desarrollados | 12 | |
| Organismos sin boca y cavidad digestiva; ventosas poco desarrolladas en la parte anterior del cuerpo | 13 | ||
| 12. | Organismos provistos de ganchos y ganchitos a nivel del haptor posterior | TREMATODOS MONOGENESICOS | |
| Organismos que carecen de ganchos posteriores; ventosas oral y posterior presentes | TREMATODOS DIGENESICOS | ||
| 13. | Organos internos ausentes | CESTODOS (formas larvales | |
| 14. | Cuerpo cilíndrico | 15 | |
| Cuerpo no cilíndrico | 17 | ||
| 15. | Cuerpo plástico; organismo activo con movimientos anguiliformes; endoparásitos | NEMATODOS | |
| Cuerpo no plástico, con forma bastante rígida | 16 | ||
| 16. | Organismos con espinas sobre la proboscis anterior; parásitos intestinales | ACANTOCEFALOS | |
| Organismos con protuberancias anteriores en forma de ancla; ectoparásitos (Lernaea) | CRUSTACEOS | ||
| 17. | Cuerpo en forma de hoja aplanada, ectoparásitos (Argulus) | CRUSTACEOS | |
| Forma de cuerpo variable, pero con apéndice visibles para fijación sobre el cuerpo del pez | CRUSTACEOS | ||
T A B L A 5
Caracteres comparativos de algunos de los principales virus ictiopatógenos de importancia para los salmónidos
| CARACTERES | SHV | NOMBRE DE LA ENFERMEDAD NHI | NPI | Herpesvirus salmonis |
| Tipo de virus | Rabdovirus | Rabdovirus | Birnavirus | Herpesvirus |
| Morfología | Bala | Bala | Icosahedro | Nucleocápsido hexagonal |
| Tamaño um | 180 × 165 | 120 - 180 × 60 - 90 | 60 | - |
| Nombre | Rhabdovirus egtvedi | - | - | Herpesvirus salmonis |
| Número de serotipos | 2 | 1 | Por lo menos 3 | ? |
| Sensibilidad al éter etílico | + | + | + | + |
| Resistencia al glicerol al 50% tamponado | - | - | + | - |
| Inactivación por exposición a los 60°C durante 15 minutos | + | + | (+) | + |
| Tipo de ECP en células RTG-2 sensibles | Células redondas, lisis celular | Células de tipo racimo de uvas; marginación cromatínica; lisis celular | Células plumosas o en forma de cuerda; lisis celular | Fusión y redondamiento de las células; formación de sincitios |
| Tipo de ECP en células FHM sensibles | Células redondas; marginación cromatínica; lisis celular | |||
| Inhibición por suero anti - SHV | + | - | - | - |
| Inhibición por suero anti - NHI | - | + | - | - |
| Inhibición por suero anti - NPI | - | - | + | - |
| Principal tejido afectado | Hematopoyético | Hematopoyético | Pancreático | ? Hematopoyético |
| Edad del pez de mayor susceptibilidad | Dedinos, juveniles | Alevines, dedinos | Alevines, dedinos | Alevines, dedinos |
| Efecto patógeno sobre el pez afectado | Provoca la muerte | Provoca la muerte | Provoca la muerte | Provoca la muerte |
| Temperatura óptima para epizootias (°C) | 15 | 10–15 | 10–18 (serotipo SP); 10–24 (serotipos AB y VR) | 10 |
| Métodos de identificación | Aislamiento en la línea RTG-2; neutralización serológica; microscopía fluorescente | Aislamiento en las líneas RTG-2 y FHM; neutralización serológica; histología | Aislamiento en la línea RTG-2; neutralización serológica; histología | Aislamiento en la línea celular RTG-2; observación de sincitios e inclusiones nucleares; histología |
A P E N D I C E A
Preparación de los principales medios de cultivo y soluciones isotónicas utilizadas en ictiopatología
A.1 MEDIOS DE CULTIVO
A.1.1 Agar forunculosis (FA)
| Triptona | 10,0 g |
| Extracto de levadura | 5,0 g |
| Cloruro de sodio | 2,5 g |
| Tirosina | 1,0 g |
| Agar | 15,0 g |
| Agua destilada | ad 1000 ml |
pH: 6,8
Este medio de cultivo se encuentra disponible en el comercio como medio deshidratado (Difco Laboratories Inc., Detroit, Michigan, EE.UU. de N.A.). Para su preparación, se suspenden 33,5 g del medio deshidratado en 1000 ml de agua destilada fría y se calienta suavemente para disolver. El medio se esteriliza en el autoclave a los 121°C (es decir: 15 libras de presión durante 15 minutos).
A.1.2 Agar tripticasa soya (TSA)
Existen en el comercio dos medios deshidratados (“Trypticase Soy Agar” y “Tryptic Soy Agar”), los cuales son igualmente adecuados para el aislamiento de bacterias a partir de muestras de peces enfermos y moribundos. Cualquiera de estos dos medios puede utilizarse y su preparación se realiza según las instrucciones dadas a conocer por la correspondiente casa comercial.
A.1.3 Agar Cytophaga (medio de Carlson y Pacha)
| Triptona | 0,05 g |
| Extracto de levadura | 0,05 g |
| Extracto de carne | 0,02 g |
| Leche peptonizada | 0,5 g |
| Acetato de sodio | 0,02 g |
| Agar | 15,0 g |
| Agua destilada | ad 1000 ml |
pH: 6,8
Al disolver los ingredientes en el agua destilada, el medio se esteriliza en el autoclave a los 121°C (es decir: 15 libras de presión durante 15 minutos). Después de haberse esterilizado, se agrega antes de usar el medio 5 mcg/ml de neomicina y 10 mcg/ml de ciclohexamida respectivamente. Es muy importante que las placas, antes de ser sembradas, se dejen secar durante 48 horas a los 37°C.
A.1.4 Agar cólera (CM)
| Peptona | 10,0 g |
| Extracto de carne | 10,0 g |
| Cloruro de sodio | 20,0 g |
| Carbonato de sodio | 1,1 g |
| Sulfato laurílico de sodio | 0,1 g |
| Sacarosa | 10,0 g |
| Agar | 15,0 g |
| Agua destilada | ad 1000 ml |
pH: 8,5
Este medio se encuentra disponible como medio deshidratado en el comercio (Oxoid Ltd., Londres, Reino Unido). Para su preparación se suspenden 61,2 g del medio deshidratado de ebullición para disolver los ingredientes. Se deja enfriar hasta los 75°C y se agregan 2 ml de una solución desfibrinizada de sangre de caballo, mezclando cuidadosamente. El medio se mantiene a una temperatura de los 75°C durante unos minutos dejándolo enfriar a los 50°C antes de distribuirlo en cápsulas de Petri.
A.1.5 Agar Mueller-Hinton enriquecido
| Caldo de carne | 300 ml |
| Acido casamínico (hidrólisis ácida de caseina | 17,5 g |
| Almidón | 1,5 g |
| Agar | 15,0 g |
| Agua destilada | ad 1000 ml |
pH: 7,4
Al disolver los ingredientes en el agua destilada, el medio básico se esteriliza en el autoclave a los 115°C (es decir: 10 libras de presión durante 10 minutos). Para su empleo, el medio se calienta a los 50°C y se agrega asépticamente 5 ml de una solución acuosa estéril al 0,1% de cocarboxilasa (difosfotiamina). La esterilización de esta solución se efectúa por filtración. Es muy importante no proceder a recalentar el medio una vez agregada la cocarboxilasa, sino que las placas se preparan de inmediato, dejándolas enfriar antes de efectuarse la siembra correspondiente.
A.1.6 “Kidney disease medium - 2” (KDM-2)
| Peptona | 10,0 g |
| Extracto de levadura | 0,5 g |
| Clorhidrato de cisteina | 1,0 g |
| Agar | 15,0 g |
| Agua destilada | ad 1000 ml |
pH: 6,5
Se disuelve la peptona, extracto de levadura y clorhidrato de cisteina en agua destilada y se ajusta el pH a 6,5 mediante la adición de soda cáustica. Seguidamente se agrega el agar y se calienta para lograr su disolución. El medio básico se esteriliza en el autoclave a los 121°C (es decir: 15 libras de presión durante 15 minutos). Antes de usar, el medio básico se calienta para fundir y se deja enfriar hasta que alcanza los 45°C, momento en el cual se adiciona 200 ml de suero bovino estéril por cada litro de medio; la temperatura del suero bovino también ha de ser de los 45°C en el momento de agregarse al medio básico.
Se ha observado que los mejores resultados se obtienen cuando el medio final se utiliza dentro de una (1) semana de su preparación, dado que el medio se deteriora rápidamente cuando se almacenan las placas en la oscuridad y a la temperatura ambiente.
A.1.7 Medio de Ordal y Earp
| Triptosa | 10,0 g |
| Cloruro de sodio | 5,0 g |
| Extracto de levadura | 3,0 g |
| Clorhidrato de cisteina | 1,0 g |
| Agar | 15,0 g |
| Agua destilada | ad 1000 ml |
pH: 6,8
Este medio básico se esteriliza en el autoclave a los 121°C ( es decir: 15 libras de presión durante 15 minutos). Antes de usarse, se calienta a los 50°C y se agrega asépticamente sangre humana citrada o heparinizada a razón de 20 ml por cada 80 ml de medio básico. Una vez efectuada la adición de la sangre humana estéril, se preparan las placas para la siembra correspondiente.
A.1.8 Medio de Lowenstein-Jensen (L-J)
| Fosfato monopotásico | 2,4 g |
| Citrato de magnesio | 0,6 g |
| Sulfato de magnesio | 0,24 g |
| Asparagina | 3,6 g |
| Harina de papa | 30,0 g |
| Verde de malaquita | 0,4 g |
Este medio básico se encuentra disponible en el comercio (Difco Laboratories Inc., Detroit, Michigan, E.E.U.U. de N.A.). Del medio deshidratado, se disuelven 37,2 g en 600 ml de agua destilada fría que contiene 12 ml de glicerina pura. Se lleva cuidadosamente al punto de ebullición, agitando constantemente la mezcla para lograr una disolución uniforme y se esteriliza en el autoclave a los 121°C (es decir: 15 libras de presión durante 15 minutos). Para preparar el medio final, se calienta el medio básico estéril hasta los 60°C, agregando a cada 600 ml del medio 1000 ml de una suspensión uniforme de huevos frescos, mezclando con sumo cuidado para obtener una suspensión uniforme y sin burbujas de aire atrapadas. El medio así preparado se distribuye asépticamente en tubos de cultivo estériles con tapón de rosca, colocando los tubos posteriormente en un espesador a los 65°C durante 50 minutos para lograr la correspondiente coagulación del medio. El medio preparado ha de conservarse en la nevera hasta que sea usado.
Para la elaboración de la suspensión uniforme de los huevos frescos, es conveniente que los mismos sean expuestos previamente a una solución acuosa al 5% de jabón y la superficie debidamente limpiada con un pequeño cepillo, procurando que esa limpieza sea llevada a cabo con el cuidado correspondiente. Una vez lavados los huevos, los mismos se enjuagan con agua limpia, y se cascan en forma aséptica para que el contenido de los mismos sea recolectado en un frasco estéril que contiene perlas de vidrio. El frasco con las perlas de vidrio y los huevos se agita con el fin de obtener una emulsión uniforme, la cual puede ser agregada al medio básico tal como se ha detallado en el párrafo anterior.
A.1.9 Agar glucosado de Sabouraud (SGA)
| Peptona micológica | 10,0 g |
| Glucosa | 10,0 g |
| Agar | 15,0 g |
| Agua destilada | ad 1000 ml |
pH: 5,6
Este medio se encuentra disponible en el comercio como medio deshidratado (Difco Laboratories Inc., Detroit, Michigan, E.E.U.U. de N.A.). Para su preparación, se hidratan 65,0 g de medio comercial con 1000 ml de agua destilada fría, calentando para disolver. El medio se esteriliza en el autoclave a los 121°C (es decir: 15 libras de presión durante 15 minutos). Para su empleo, el medio básico se calienta entre los 45–50°C y se agrega asépticamente una solución acuosa estétil de penicilina G y estreptomicina para dar una concentración final de 20 U.I. de penicilina y 40 mcg de estreptomicina respectivamente por cada ml del medio. Es conveniente utilizar para estos fines una solución acuosa comercial de dichos antibióticos, procurando de esa manera que la concentración sea una que permite la adición de muy pequeñas cantidades de líquido al medio básico.
A.2 SOLUCIONES ISOTONICAS
A.2.1 Solución fisiológica isotónica de Earle
| Cloruro de sodio | 6800 mg |
| Cloruro de potasio | 400 mg |
| Cloruro de Calcio (Cl2Ca. 2H2O) | 265 mg |
| Sulfato de magnesio (SO4Mg. 7H2O) | 200 mg |
| Fosfato diácido de sodio (H2HPO4Na. H2O) | 140 mg |
| Glucosa | 1000 mg |
| Rojo de fenol | 10 mg |
| Bicarbonato de sodio | 2200 mg |
| Agua bidestilada | 1000 ml |
A.2.2 Solución fisiológica isotónica de Hanks
| Cloruro de sodio | 8000 mg |
| Cloruro de potasio | 400 mg |
| Cloruro de calcio (Cl2Ca. 2H2O) | 186 mg |
| Sulfato de magnesio (SO4Mg. 7H2O) | 200 mg |
| Fosfato disódico (HPO4Na2. 7H2O) | 90 mg |
| Fosfato diácido de potasio (H2PO4K) | 60 mg |
| Glucosa | 1000 mg |
| Rojo de fenol | 20 mg |
| Bicarbonato de sodio | 350 mg |
| Agua bidestilada | 1000 ml |
A.3 SOLUCIONES FIJADORAS
A.3.1 Fluido de Schaudin
| Solución acuosa saturada de cloruro de mercurio | 660 ml |
| Alcohol etílico al 95% | 330 ml |
| Acido acético glacial | 50 ml |
