Actualmente, cerca del 90 por ciento de la producción de peces y camarones por acuacultura en el tercer mundo y países en desarrollo (incluyendo Latinoamérica y el Caribe), es realizado en sistemas de producción en estanques de cultivo semi-intensivo o extensivo, empleando fertilización y/o estrategias de alimentación suplementaria. Aquí, y en contraste con la alimentación con dietas completas, los nutrientes requeridos en la dieta de las especies de granja, se obtienen parcial (en conjunto con una dieta suplementaria exógena) o completamente, a través de la producción y consumo de organismos vivos dentro del cuerpo de agua en el que son cultivados los organismos.
Debido a que el principio de la estrategia de alimentación por fertilización es aumentar la producción del alimento natural dentro del cuerpo de agua, tal ves es útil primero describir la cadena alimenticia acuática básica o ecosistema, y subrayar los ciclos de nutrientes primarios que operan dentro del ecosistema del estanque. Las figuras 8 y 9 muestran un modelo generalizado de un ecosistema acuático simple y un ejemplo de la trama del alimento natural en un estanque de carpa común (C. carpio), respectivamente. Todos los sistemas acuáticos, incluyendo un estanque de peces o camarones fertilizado, cuentan con la operación simultánea de dos cadenas alimenticias interligadas; una cadena alimenticia de pastoreo “autotrófica” dependiente de la luz, y una cadena alimenticia de detritus o “heterotrófica” no dependiende de la luz. Como el nombre lo sugiere, la cadena alimenticia autotrófica, sintetizadora de la materia orgánica, depende de la fijación de la energía solar por las plantas verdes durante la fotosíntesis, con producción de nueva materia orgánica a partir de dióxido de carbono y agua, y el consecuente consumo de estas plantas por animales de pastoreo. Aún cuando las plantas verdes, y en particular el fitoplancton, son los principales autótrofos o “productores primarios” que operan dentro de un ecosistema como el de los estanques, ciertas bacterias anaeróbicas no fotosintéticas y las algas verde-azules son autotróficas, debido a que son capaces de sintetizar materia orgánica (i.e. nueva biomasa celular), a partir de carbono inorgánico, usando energía química derivada de la oxidación celular de sustratos inorgánicos como el sulfuro de hidrógeno, azufre, nitrógeno, fierro divalente e hidrógeno (colectivamente éstos son denominados autótrofos quimiosintéticos en oposición a los autótrofos fotosintéticos). En contraste, los heterotróficos o consumidores de materia orgánica de la cadena alimenticia, dependen de la degradación microbiana de la materia orgánica no viva o detritus a nueva biomasa microbiana, con liberación de nutrientes inorgánicos y dióxido de carbono; la nueva biomasa microbial (principalmente bacterias), sirven como un recurso de alimento a los protozoarios, nemátodos y otros animales bénticos, y por otro lado, los nutrientes inorgánicos y dióxido de carbono liberados, están disponibles para producción fotosintética posterior por los productores primarios o autótrofos.
Todos los organismos, incluyendo autótrofos y heterótrofos, consisten principalmente de carbón-C, nitrógeno-N y fósforo-F (i.e. la composición del fitoplancton creciendo en un medio rico en nutrientes es de alrededor de 45–50% C, 8–10% N y 1% F en base seca: Edwards, 1982), y consecuentemente son dependientes del abastecimiento biológico de estos nutrientes primarios para su crecimiento. Las rutas químicas y biológicas básicas involucradas en el abastecimiento y reciclaje de C, N y F dentro de un ecosistema natural de estanque se muestran en las figuras 10, 11 y 12, respectivamente. Del entendimiento de estos ciclos de nutrientes, se puede ver que la productividad natural de los cuerpos de agua cerrados se puede incrementar con un manejo cuidadoso, mediante la adición controlada de fertilizantes químicos inorgánicos (para alimentar a la cadena alimenticia autótrofica) y/o abonos orgánicos (para alimentar a la cadena alimenticia heterotrófica).
El suelo del fondo del estanque y en particular la capa del lodo, 1 se considera como el “laboratorio químico” y “el almacén de los nutrientes primarios” del ecosistema del estanque, y como tal, juega un papel importante en el mantenimiento de la productividad del mismo (Figura 10–12: Mortimer, 1954; Huet, 1975; Vincke 1985; Wite 1986). Sin embargo, el éxito de la estrategia de alimentación a través de la fertilización del estanque, en muchos casos depende del secado inicial y/o del tratamiento químico del fondo del estanque con cal.
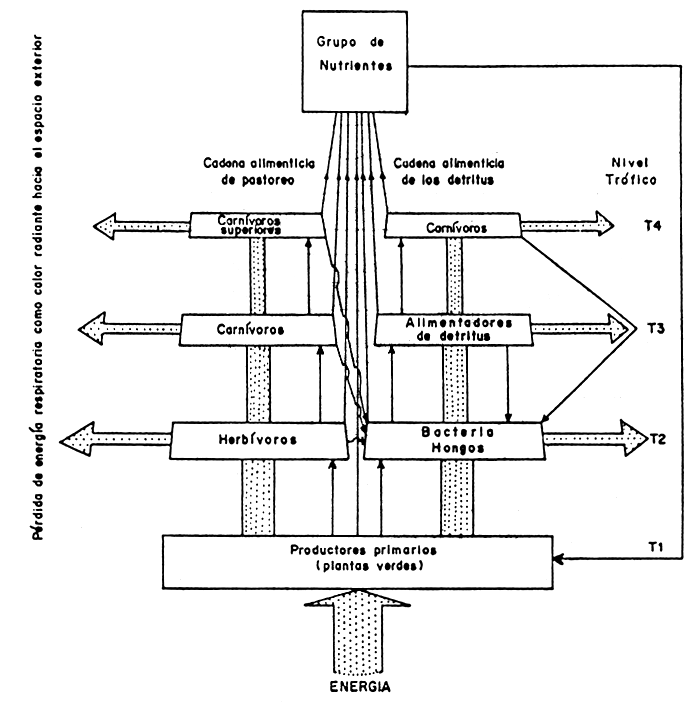
FIGURA 8
Representación generalizada de un ecosistema acuático simple. Los blocks con línea doble representan la biomasa de cada tipo de organismos. Las flechas punteadas muestran la dirección y magnitud del flujo de energía mientras que las flechas con líneas simples indican la transferencia de nutrientes a través del consumo directo, excresión o muerte y descomposición bacteriana. Energía es la cantidad de energía solar tomada por los productores primarios (algas verdes y plantas superiores). Los ecosistemas están usualmente divididos en una cadena de animales grandes de pastoreo y una cadena de microorganismos descomponedores o de detritus. (Fuente: Eltingham, 1971).
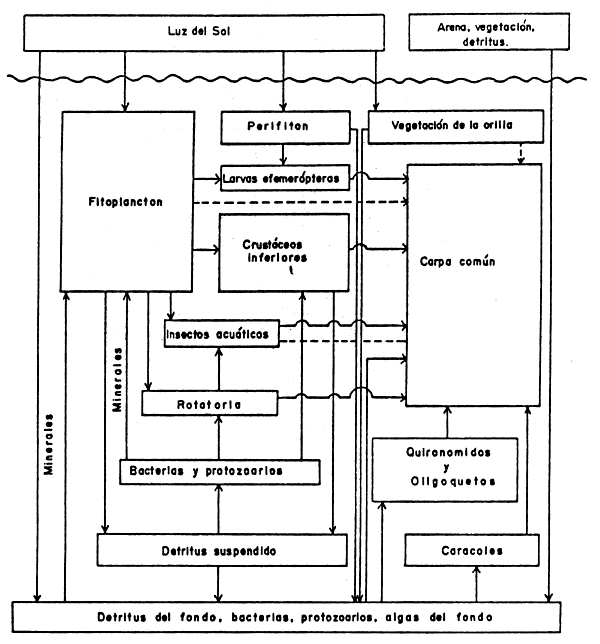
FIGURA 9
Representación esquemática de una trama alimenticia de un estanque de cultivo de carpa común (Cyprinus carpio); (Hepher and Pruginin, 1981).
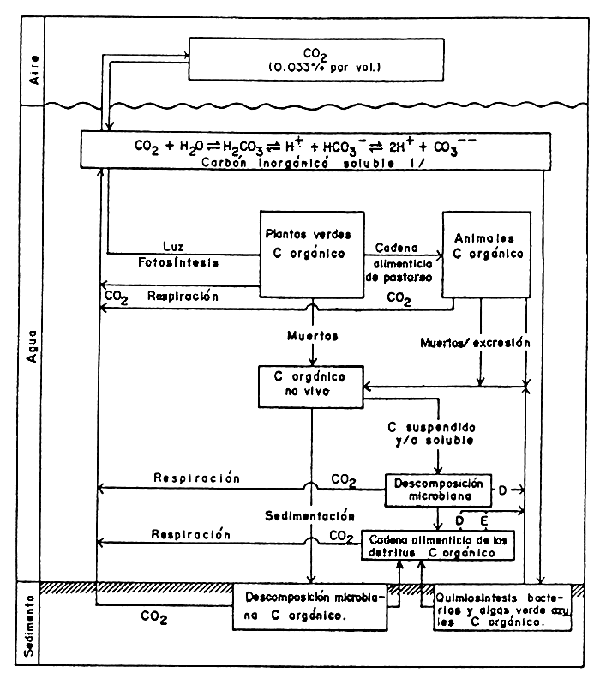
FIGURA 10
El ciclo del carbono
1 El equilibrio depende del pH; la solubilidad del CO2 se incrementa con el pH. Además de las formas de carbono inorgánico mostrado, puede ocurrir la precipitación del carbonato de calcio a partir de bicarbonato (Ca(HCO3)2 CaCO3 + H2O + CO2). El carbonato de calcio particulado y coloidal juega un papel muy importante debido a que tiene la fuerte capacidad de absorver una variedad de compuestos biológicos activos, incluyendo ácidos húmicos y fosfatos.
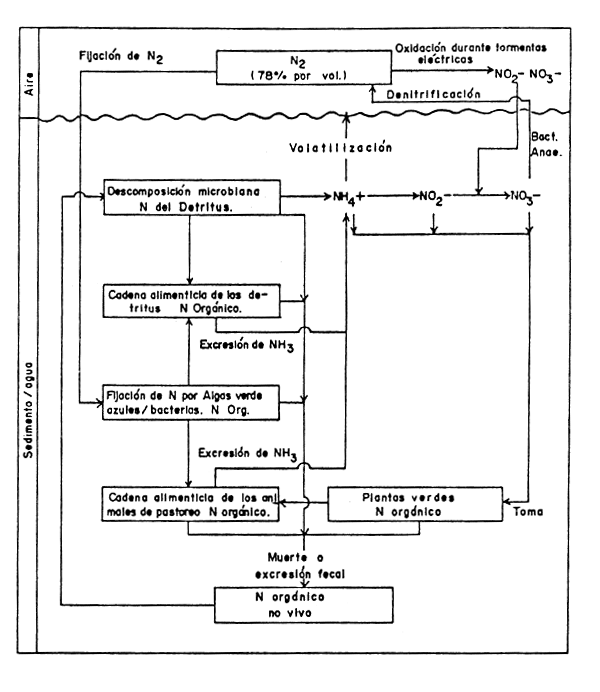
FIGURA 11
El ciclo del nitrógeno
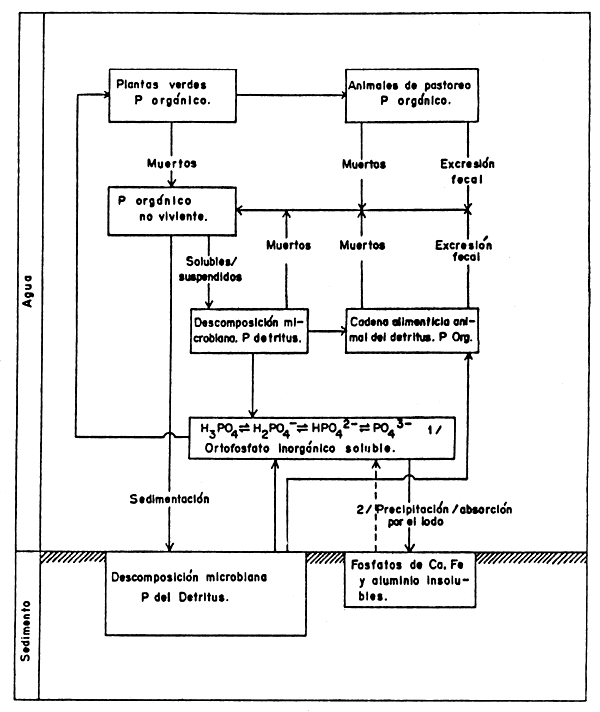
FIGURA 12
Ciclo del fósforo
1 El equilibrio depende del pH; la solubilidad de los ortofosfatos ácidos se incrementa con el pH.
2 Liberación lenta de los ortofosfatos de los sedimentos de la poza, particularmente bajo condiciones reductoras (causada indirectamente a través del metabolismo de las bacterias sulfurosas anaeróbicas).
Las ventajas de secar al aire y exponer el fondo del estanque al oxígeno atmosférico y a la luz antes de la aplicación del fertilizante han sido resumidos por Mortimer (1954), Vincke (1985), Clifford (1985), Fast (1986), Stokes and Smith (1987) y Wilson (1987), e incluye:
Mejoramiento de la textura del suelo y de la disponibilidad primaria de nutrientes para la producción futura de fitoplancton por facilitar el rompimiento y la descomposición de la materia orgánica a través de la oxidación con la consecuente mineralización de la superficie y de la capa superficial de lodo.
Reducción a la demanda de oxígeno por el sedimento lodoso una vez que la poza se ha llenado con agua.
Un suelo aireado y parcialmente oxidado, hacen al fondo más adecuado para la colonización de organismos alimenticios bénticos deseados.
La oxidación y eliminación de los metabolitos indeseables, tales como el sulfuro de hidrógeno (es un subproducto de la respiración anaeróbica de las bacterias sulfurosas), los cuales, si se permite su acumulación pueden inhibir el crecimiento del fitoplancton y de los peces o camarones cultivados.
Eliminación de los depredadores de los peces o camarones, de los parásitos y sus huevos y de macrofitas acuáticas indeseables.
Facilitar la cosecha de los peces o camarones cultivados y la eliminación de depósitos excesivos de lodo o cieno en el fondo del estanque; éstos últimos vienen a ser un valioso fertilizante para los cultivos agrícolas.
El período de secado para una adecuada mineralizacion del lodo es usualmente entre cinco a diez días, y se hace evidente al observar quebraduras y rajadas en la superficie del fondo lodoso o por la habilidad del fondo del estanque de soportar el peso de un hombre sin hundirse (Vincke 1985; Clifford, 1985; Wilson, 1987). Para el cultivo de organismos alimenticios bénticos específicos, es esencial que el fondo del estanque no se seque completamente; por ejemplo, un período de secado de 7–10 días y 3 días se recomiendan usualmente para la preparación de estanques lodosos para el crecimiento de “Lab-Lab” (capa de algas compuestas principalmente por algas azul-verdes y diatomeas) y “Lumut” (capa de algas compuesta principalmente de pastos-algas verdes filamentosos) en estanques salobres para peces o camarones, respectivamente (ASEAN, 1978). A pesar de que los estanques se secan usualmente al principio de cada nuevo ciclo de cultivo, en China los estanques para peces se secan normalmente por un solo período de 15–20 días, cada 1–3 años (FAO 1983). Sin embargo, normalmente no se recomienda el secado de los estanques con suelos costeros y de riberas de ríos tales como el llamado “arcilla de gato” y “desechos de minas” los cuales contienen pirita - FeS2 y otros minerales que contienen azufre, La sobre exposición al aire de estos minerales los oxida para formar ácido sulfúrico y compuestos de sulfato de hierro (jarosita); el suelo “ácido-sulfatado” resultante se caracteriza por tener un pH muy bajo (< de 4) y por presentar manchas o franjas amarillas de jarosita (Coche, 1985). Otras desventajas a menudo adscritas al secado del estanque incluyen, 1) pérdida en tiempo que podría ser usado para producir peces o camarones, 2) costos adicionales de mano de obra y agua (por ejemplo costo de drenaje y relleno del estanque con agua incluyendo costos de bombeo eléctrico).
De acuerdo a Thomaston y Zeller (1961) y Boyd (1986), para que un estanque de agua dulce responda apropiadamente a la fertilización, el lodo del fondo no debe ser altamente ácido y el agua superficial deberá tener un pH neutral-alcalino (7–8) y una alcalinidad total y dureza total de 20 mg/l o más como carbonato de calcio. Los lodos acídicos adsorben fuertemente fosfatos inorgánicos y los organismos alimenticios del estanque (particularmente el fitoplancton) no crecen bien en medios ambientes ácidos (pH 5–6) o en aguas con una baja base de carbón y concentración de calcio (Miller, 1976; Vincke, 1985; Fast, 1986; Boyd, 1986). Sin embargo esos imbalances pueden ser corregidos aplicando cal viva (CaO) o piedra caliza (CaCO3) al fondo del estanque o a la columna de agua antes de empezar el ciclo de cultivo o el programa de fertilización del estanque. Boyd (1986) enlista tres tipos básicos de estanques que responden favorablemente al encalado:
1) estanques distróficos con aguas fuertemente teñidas con sustancias húmicas y lodos con grandes almacenamientos de materia orgánica de lenta descomposición (calidad típica del agua: pH 5–6 alcalinidad 1–5 mg/l CaCO3, acidez = mg/l CaCO3); y 3) estanques distróficos con aguas conteniendo acidez mineral resultante de suelos ácido-sulfatados o vertientes (calidad típica del agua: pH 2–4.5, alcalinidad = mg/l CaCO3, acidez 10–250 mg/l CaCO3).
Los efectos benéficos del encalado de los estanques se puede resumir como sigue:
El encalado incrementa el pH y la alcalinidad de las aguas ácidas a niveles deseables, estableciendo una reserva alcalina o sistema bufer de pH (Mortimer, 1954 Huet, 1975 Miller, 1976; Boyd, 1982; FAO 1983; Yamada, 1986).
En virtud de sus efectos sobre la alcalinidad, el encalado incrementa la disponibilidad de carbono para la fotosíntesis (Mortimer, 1954; Miller, 1976; Boyd, 1982; Fast, 1986; Yamada, 1986).
El encalado incrementa el pH del lodo del fondo a niveles deseables y consecuentemente reduce la capacidad del lodo para absorber nutrientes para las plantas tales como fosfatos inorgánicos, incrementando por lo tanto su biodisponibilidad a los organismos que sirven como alimento en el estanque (Mortimer, 1954; Huet, 1975; Miller, 1976; Boyd 1982; FAO, 1983; Fast, 1986; Yamada, 1986).
Por la elevación del pH de los sedimentos ácidos, el encalado crea un medio ambiente más favorable para el crecimiento microbial y consecuentemente acelera la descomposición y mineralizacion de la materia orgánica en los sedimentos (Huet, 1975; Miler, 1976; Boyd, 1986; Fast, 1986; Yamada, 1986).
Por la elevación de la dureza y alcalinidad del agua; el encalado sirve como recurso directo de calcio soluble para los organismos que sirven como alimento en el estanque (Mortimer, 1954; Boyd, 1982; FAO, 1983).
El encalado ayuda en la clarificación de las aguas turbias facilitándo la floculación y precipitación de coloides orgánicos/arcilla en suspensión (incluyendo humus ácidos), por lo tanto se mejora la penetración de la luz para la fotosíntesis (Mortimer, 1954; Boyd y Scarsbrook, 1974; FAO, 1983; Yamada 1986).
El encalado sirve como un desinfectante para el estanque, pues mata los parásitos de los peces y sus huéspedes intermediarios, competidores animales y plantas verdes indeseables (Mortimer, 1954; Huet, 1975), Miller, 1976; Boyd, 1982 FAO, 1983; Yamada, 1986).
En virtud de los atributos anteriores, el encalado por lo tanto, incrementa (todo es indirectamente) la capacidad productiva natural de los estanques de agua dulce con aguas ácidas y alcalinidad y dureza total bajas (Boyd, 1982; Strumer, 1987). Por ejemplo, Zeller y Montgomery (1962) y Boyd y Scarsbrook (1974) reportaron un incremento en la producción de alimento vivo (fitoplancton, zooplancton y organismos benticos alimenticios) dentro de los estanques fertilizados que fueron pretratados con cal; el encalado incrementa la efectividad de la estrategia de fertilización empleada. Una relación similar existe para la producción de peces dentro de los estanques; pretratándolos con cal se incrementa la efectividad de la fertilización inorgánica con aumento en la producción de peces. Por ejemplo, Arce y Boyd (1975) y Hickling (1962) reportaron una elevación del 24.9% y 41.6% en la producción de tilapia, respectivamente, en estanques encalados con respecto a los no encalados y que recibieron fertilizantes inorgánicos. Sin embargo se debe mencionar que no todos los estudios han demostrado una influencia positiva del encalado sobre la producción de peces (Swingle, 1947; Miller, 1976; Boyd, 1982). Por lo tanto, sobre la base de las pruebas de encalado llevadas a cabo en estanques de peces de agua dulce en Africa, Miller (1976) concluye que el uso de cal en agua con pH mayor que 6.5 parece ser innecesario. En forma similar, con la excepción de suelos costeros ácidos-sulfurosos, el encalado no se considera que sea esencial para la preparación de los estanques de agua salobre; el agua de mar exhibe una fuerte capacidad de buffer y tiene un rango de pH entre 7.5 a 8.4 (Sturmer, 1987).
De acuerdo a Boyd (1982) los requerimientos de cal para un estanque de peces deberá representar la cantidad de carbonato de calcio requerido para elevar el pH de lodo a 5.9, de manera que la base de insaturación (proporción de cationes ácidos al total de cationes sobre el sitio de intercambio de partículas) del lodo, será 0.2 ó menos y la dureza total (y alcalinidad) estará arriba de 20 mg/l. La Tabla 12 muestra las tasas de aplicación de cal recomendada para estanques de peces tal como lo recomienda la Técnica de Boyd. Sin embargo, se debe recordar que las relaciones antes mencionadas entre la base de insaturación y alcalinidad/dureza del estanque se determinaron para estanques en Alabama, USA, difieren geográficamente (Boyd, 1986).
Idealmente, la relación pH y la base de insaturación de los lodos se deberá determinar para cada granja o región, y de acuerdo con ella calcular tasas de encalado. Un método simple para determinar el requerimiento de cal del lodo del estanque, que no requiere datos sobre la relación entre el pH y la base de insaturación ha sido desarrollado por Pillai y Boyd (1985); la tasa de encalado (Kg CaCO3/Ha) está simplemente determinado por la medición del cambio de pH en 40 ml de solución buffer (10 g de p-nitrofenol, 7.5 g de ácido bórico, 37 g de cloruro de potasio y 5.25 g dehidróxido de potasio disuelto y diluido a 1000 ml con agua destilada el pH del buffer se ajusta a 8.00= causado por la adición de 20 g de lodo molido y seco (partículas < 0.85 mm) y multiplicando el cambio del pH observado por 5600.
Las técnicas anteriores para estimar la tasa de aplicación de cal no se aplican a suelos ácido-sulfurosos debido a que esos sedimentos tienen intercambios y acidez por ácido sulfúrico. Singh (1980) recomienda trabajar el suelo (oxidación de la pirita) y un procedimiento de lavado, seguido por el encalado y fertilización inorgánica/orgánica, para el manejo de suelos ácido-sulfatados. Un procedimiento para estimar los requerimientos de cal de suelos ácido-sulfatados está dado por Boyd (1979). Ejemplos de la tasa de aplicación de cal para estanques de acuacultura sugeridos por otros investigadores se muestran en la Tabla 13.
Para la composición y valor neutralizante de materiales de encalado comúnmente usados ver a Boyd (1979) y Tacon (1987a). Sin embargo, los efectos neutralizantes de la cal viva y la cal muerta (Ca(OH)2) en aguas ácidas es más alta y más rápida que la de la piedra caliza (CaCO3), ésta última es generalmente considerada por ser el material más seguro, barato y más efectivo para encalar los estanques (Boyd, 1982). Sobre una base general, los materiales de encalado se deben añadir 2–3 semanas antes de la fertilización (Boyd, 1982 Miller, 1976), y se aplica dispersándolo homogeneamente sobre el fondo del estanque (en el caso de estanques vacíos) o en la superficie del agua.
Los efectos residuales del encalado dependen del cambio de agua en la poza, y pueden durar por algunos años si el cambio del agua no es excesivo. Por ejemplo, Boyd (1979) indica que una aplicación anual de cal del 25% de la dosis inicial de alrededor de 4400 Kg/ha de piedra caliza, fue suficiente para mantener una calidad de agua y pH del lodo adecuados o un período de ocho años con el drenado anual normal de los estanques de peces en Alabama, USA.
| Carbonato de calcio requerido de acuerdo al pH del lodo en una solución Buffer 2 | ||||||||||
| pH del lodo en agua | 7.9 | 7.8 | 7.7 | 7.6 | 7.5 | 7.4 | 7.3 | 7.2 | 7.1 | 7.0 |
| 5.7 | 91 | 182 | 272 | 363 | 454 | 544 | 735 | 726 | 817 | 908 |
| 5.6 | 126 | 252 | 378 | 504 | 630 | 756 | 882 | 1008 | 1134 | 1260 |
| 5.5 | 202 | 404 | 604 | 806 | 1008 | 1210 | 1411 | 1612 | 1814 | 2016 |
| 5.4 | 290 | 580 | 869 | 1160 | 1449 | 1738 | 2029 | 2318 | 2608 | 2898 |
| 5.3 | 340 | 680 | 1021 | 1360 | 1701 | 2041 | 2381 | 2722 | 3062 | 3402 |
| 5.2 | 391 | 782 | 1172 | 1562 | 1548 | 2344 | 2734 | 3124 | 3515 | 3906 |
| 5.1 | 441 | 882 | 1323 | 1765 | 2205 | 2646 | 3087 | 3528 | 3969 | 4410 |
| 5.0 | 504 | 1008 | 1512 | 2016 | 2520 | 3024 | 3528 | 4032 | 4536 | 5040 |
| 4.9 | 656 | 1310 | 1966 | 2620 | 3276 | 3932 | 4586 | 5242 | 5980 | 6552 |
| 4.8 | 672 | 1344 | 2016 | 2688 | 3360 | 4032 | 4704 | 5390 | 6048 | 6720 |
| 4.7 | 706 | 1412 | 2116 | 2822 | 3528 | 4234 | 4940 | 5644 | 6350 | 7056 |
TABLA 13. Ejemplos de aplicación de cal sugeridos para estanques en acuacultura.
Tasas de encalado sugeridas para el tratamiento de suelos con pH bajos 1
| Materiales de encalado (lbs/acre) 2 | |||
| pH del suelo | Carbonato de calcio | cal apagada | cal cáustica |
| 4 | 1487 | 1417 | 994 |
| 4.5 | 1320 | 1258 | 898 |
| 5 | 994 | 924 | 634 |
| 5.5 | 660 | 634 | 466 |
| 6 | 334 | 299 | 239 |
| 6.5 | 0 | 0 | 0 |
2 1 kg = 2.205 lbs, 1 ha = 2.47 acres
Tasas de encalado sugeridas para estanques basados en el pH y textura de los lodos 1
| Requerimientos de cal (Kg/ha de CaCO3) | |||
| pH del lodo | Barros pesados o arcillas | barros arenosos | arena |
| 4 | 14,320 | 7,160 | 4,475 |
| 4 – 4.5 | 10,740 | 5,370 | 4,475 |
| 4.6 – 5 | 8,950 | 4,475 | 3,580 |
| 5.1 – 5.5 | 5,370 | 3,580 | 1,790 |
| 5.6 – 6 | 3,580 | 1,790 | 895 |
| 6.1 – 6.5 | 1,790 | 1,790 | 0 |
1Fuente: Schaeperclaus, 1933 (citado por Boyd, 1982).
Guía de encalado para estanques de cultivo en Rwanda (Schmidt y Vincke, 1981
Estanques recién construidos con agua ácida (pH 4–6.5): usar por aspersión polvo de roca calcárea a una tasa de 100–2000 kg/ha sobre el fondo seco y mezclar ligeramente dentro de la superficie del lodo entonces llenar el estanque con agua. Otros estanques: aplicación mensual de polvo de caliza a una tasa de 150–200 kg/ha.
Para una revisión del uso de cal en países Africanos ver a Miller (1976).
Guía general de encalado sugerida para estanques de cultivo (Huet, 1975)
Encalado del agua: usar hasta 200kg/ha/día de cal viva (CaO).
Encalado del fondo para controlar parásitos: usar de 1000–1500 kg/ha de cal viva (CaO) o 1000 kg/ha de cianamida de calcio. Los materiales de encalado se deben esparcir en el fondo todavía húmedo.
Encalado del fondo para mejorar el lodo antes de usar otros fertilizantes: el uso de 200 a 400 kg/ha de cal viva (CaO) evita que el estanque se acidifique. Si el objetivo del encalado es incrementar el pH y la alcalinidad de un estanque ácido, en principio 200 kg/ha de cal viva (CaO) generalmente es suficiente para elevar la alcalinidad en una unidad.
Guía de encalado para estanques de cultivo de bagre africano (Viveen et al., 1985)
Para estanques recién construidos: use cal agrícola a una tasa de 200 a 1500 kg/ha y mezcle con la capa superior (5 cm) del fondo del estanque seco. Entonces el estanque se llena con agua (hasta 30 cm) y se deja por una semana antes de fertilizar.
Para estanques usados: use de 100 a 150 kg/ha de cal viva (CaO) y añádaselo al fondo del estanque húmedo para eliminar patógenos parásitos e invertebrados depredadores. Entonces el estanque se deja por un período de 7–14 días, después se llena con agua a una profundidad de 30 cm, y se ajusta el pH del agua añadiendo cal agrícola.
Tasas de encalado para estanques de cultivo en China (FAO, 1983)
Encalado de estanques con agua: usar cal viva (CaO) a una tasa de 750 – 900 kg/ha y 900 – 1125 kg/ha para estanques que contengan de 6 a 7 cm de agua y que contengan poco cieno respectivamente. Para estanques con una cantidad considerable de agua (no especificada) la tasa de aplicación es de 1875 – 2250 kg/ha/mes de cal viva.
Tasas de encalado para estanques de cultivo de carpa en Hungría (Horvath, Tamás y Tolg, 1984; ADCP, 1984)
Para estanques de crías: usar de 200 – 400 kg/ha de cal (CaO) sobre el fondo del estanque para desinfectar, seguido por aireación del fondo mediante arado.
Tasas de encalado sugeridas para Colosoma sp en Brasil (Woynarovich, 1986)
Para estanques de crías: use de 150 – 300 kg/ha de piedra caliza (CaCO3) sobre el fondo seco.
Tasas de encalado sugeridas para Macrobrachium rosenbergii en Panamá (MIDA, 1984)
Para estanques recién construidos: usar de 500 – 1000 kg/ha de piedra caliza (CaCO3) en el fondo del estanque.
Tasas de encalado para estanques rurales recién construidos en Tailandia (Edwards y Kaewpaitoon, 1984)
La acidez del estanque nuevo se prueba utilizando papel tornasol después de introducir el agua con una profundidad de 10 cm.
Para agua con pH de 4.5 – 6: 500 kg de cal viva/ha
Para agua con pH de 4.0 – 4.5: 1250 kg de cal viva/ha.
Después de un día, se debe llenar el estanque y checar la acidez nuevamente.
En acuacultura se aplican los fertilizantes químicos principalmente para incrementar la productividad primaria de los estanques. La nomenclatura química y la composición de los fertilizantes químicos simples y multinutrientes usados en acuacultura se han presentado previamente (Sección 1.2 y 3.12; Tacon, 1987a).
Los fertilizantes químicos actúan principalmente sobre las cadenas alimenticias autótrofa y de pastoreo por la estimulación directa de la producción de fitoplancton en el estanque (Hepher, 1962; McIntire y Bond, 1965; Hall, Coopery Werner, 1970; Djajadiredji y Natawiria, 1965; Boyd 1973; Miller, 1976; Guerrero y Guerrero, 1976; Cruz y Laudencia, 1980; Davidson y Boyd, 1981; Hepher y Pruginin 1981; Bishara 1978 Rubright et al., 1981; Nailon 1985; Olah et al., 1986; Pruder, 1986; King y Garling, 1986; Yamada, 1986). Por ejemplo, los estudios de Hepher (1962) mostraron que la producción de fitoplancton en estanques de peces químicamente fertilizados en Israel fue de cuatro a cinco veces más alta que los equivalentes que no recibieron fertilizantes; la productividad primaria de los estanques químicamente fertilizados variaron de una toma de carbón de 4 – 8 g/m2/día durante el verano (temperatura del agua a medio día de 25–30°C) a 2.5–5 g/m2/día durante la Primavera y el Otoño (temperatura del agua a mediodía 20–25°C. De acuerdo a Schroeder (1978) el 90% de la producción primaria total es menor de 40 micras en tamaño. Como una consecuencia directa de su efecto sobre la producción de fitoplancton, los fertilizantes químicos también aumentan la producción de zooplancton de pastoreo (McIntire y Bond, 1962; Dendy et al., 1968; Hall, Cooper y Werner, 1970 Lyubimova, 1974; Rubright et al., 1981; Torrans, 1986) y los organismos bénticos que sirven como alimento (Ball, 1949; McIntire y Bond, 1962; Sumawidjaja, 1966; Rubright et al., 1981; Boyd, 1981). Por ejemplo, Torrans (1986) reportó un rango de biomasa de zooplancton estándar de 2– 10 g/m3 en estanques estáticos fertilizados inorgánicamente.
No obstante que la producción de acuacultura en estanques químicamente fertilizados variará dependiendo del hábito de alimentación y la densidad de las especies cultivadas, es posible obtener incrementos considerables en la producción de peces y camarones (Tabla 14). Por ejemplo Schroeder (1978) reporta que la máxima producción de peces obtenida sin alimento suplementario (en estanques rústicos en Israel) son de 1–5 kg/ha/día y 10–15 kg/ha/día para estanques que no recibieron entrada de fertilizantes y que recibieron fertilizantes químicos, respectivamente; policultivos de carpa común, tilapia y carpa plateada de 4500–9500 peces por hectárea. De la misma manera, Horvat, Tamas y Tolg (1984) reportaron un incremento en la producción de peces (principalmente policultivo de carpas) en estanques rústicos en Hungría de 11–25 kg y 15– 30 kg con una entrada de fertilizantes de 200 kg de superfosfato o nitrato de amonio, respectivamente. Sin embargo, tal como se mencionó anteriormente, el éxito de aplicar una estrategia de fertilizantes químicos dependerá de la habilidad de la especie de pez o camarón cultivado para tomar ventajas del incremento de la productividad primaria dentro del estanque. Entre las especies adultas de peces y camarones que pueden alimentarse directamente de los autótrofos primarios se incluyen: del fitoplancton, la carpa plateada (Hypophthalmichthys molitrix), carpa india (Catla catla), tilapia (esculentus, aureus, niloticus, kottae, mariae, galilaeus, leucostictus, mossambicus), carpa cabezona (Aristichthys nobilis); de algas bénticas, el sabalote (Chanos chanos), tilapia (mossambicus, guineensis, melanotheron, niloticus), lisa (Mugil cephalus), pez conejo (Siganus sp.), rohu (M. lanchesteri), camarones metapeneidos (Penaeus vannamei); de plantas acuáticas vasculares, la carpa herbívora (Ctenopharingodon idella), tilapia (rendalli, niloticus, mossambicus, zilli), brema wuchang (Megalobrama amblycephala), pez conejo (Siganus sp.), rohu (Labeo rohita) y ocasionalmente especies de langostino de agua dulce (Macrobrachium sp.). Para una revisión de los hábitos alimenticios naturales de las principales especies de peces y camarones que se cultivan ver Ling (1969), Wickings (1976), Von Westernhagen (1974), Bowen (1982), Cremer y Smitherman (1980=, Bishara (1979), Cruz y Laudencia (1980=, Guerrero y Guerrero (1976), Rubright et al., (1981), Weidenbach (1982) King y Garliong (1986), New (1987), Hunter, Pruder y Wyban (1987), y Lilyestrom y Romaire (1987).
| Especies | Incremento en la producción (%) | Fertilizante utilizado | Fuente |
| Tilapia (O. mossambicus) | 440 | Fosfatos | Vander Lingen (1967) |
| Tilapia sp (híbrido) | 82–222 | Fosfatos | Lazard (1973) |
| Tilapia sp. | 214 | Fosfatos | Strum (1966) |
| Tilapia (O. niloticus) | 340 | Fosfatos | George (1975) 1 |
| Tilapia (híbrido macho) | 302–420 | Fosfatos | Hickling (1962) |
| Tilapia (O. mossambicus) | 174 | 0:8:2 (NFP) | Varikul (1965) |
| Tilapia (O. mossambicus) | 170 | 8:8:2 (NFP) | Varikul (1965) |
| Carpa (C. carpio) | 752–945 | F:A:S | Hepher (1963) |
| Carpa (C. carpio) | 109 | 0:8:2 (NFP) | Swingle, Gooch & Rabanal (1963) |
| Carpa (C. carpio) | 137 | 8:8:2 (NFP) | Swingle, Gooch & Rabanal (1963) |
| Bagre (I. punctatus) | 565 | 0:8:2 (NFP) | Swingle, Gooch & Rabanal (1963) |
| Bagre (I. punctatus) | 476 | 8:8:2 (NFP) | Swingle, Gooch & Rabanal (1963) |
| Lisa (M. cephalus) | 167 | Fosfatos | El Zarka & Fahmy (1968) |
| Camarón (P. stylirostris) | 89 | Fosfatos/Urea | Rubright et al. (1981) |
1 Citado por Hepher Y Pruginin (1981)
Se acepta generalmente que los fosfatos-F y nitrógeno-N orgánicos, son los principales nutrientes solubles que limitan la productividad de las algas en los estanques de cultivo; el fosfato-F y el nitrógeno-N vienen siendo los nutrientes limitantes primarios (i.e. los más esenciales desde el punto de vista de fertilización de un estanque) en estanques de aguas dulce y salobre, respectivamente (Miller, 1976; ASEAN, 1978; Boyd, 1982, 1986; Smith, 1984; Nailon, 1985; Vincke, 1985; Yamada, 1986; Strumer, 1987; Boyd y Minton, 1987). Se debe enfatizar que no hay dos estanques iguales y que un programa de fertilización desarrollado para una localidad puede ser totalmente inadecuado para otra; la respuesta de un programa de fertilización dependerá de la morfología, hidrología, medio ambiente, sedimentos del fondo y calidad de agua del estanque, de las especies cultivadas, del fertilizante utilizado y del método y las tasas de aplicación de fertilizante utilizado y del método y las tasas de aplicación de fertilizantes (Yamada, 1986; Boyd, 1986). Es claro, que se debe considerar a cada granja como una unidad única y el programa de fertilización desarrollado debe ser personalizado de acuerdo a ésta. Sin embargo, a pesar de este cuadro tan desanimante, se pueden hacer algunas generalizaciones con respecto a la fertilización de los estanques.
De acuerdo a Hepher (1963, 1967), no hay una justificación biológica o económica para la aplicación de dosis de fertilizantes mayores de 0.5 mg de fosfato-F/l ó 1.4 mg de nitrógeno-N/l para estanques de agua dulce en Israel; aplicaciones más altas que estos niveles generalmente se fijan como precipitados de fosfato o se pierden en el medio ambiente en forma de amonio gaseoso. Los niveles mencionados anteriormente son equivalentes a una tasa de aplicación de fertilizantes de 60 kg/ha de superfosfato simple (11 kg p2 O5/ha) y 60 kg/ha de sulfato de amonio (13 kg N/ha), aplicados a intervalos de dos semanas (0.8–1m de profundidad del agua, 8–10,000 m3 de agua/ha). Esta tasa de aplicación de fertilizantes es una dosis estándar para fertilizar estanques de semicultivo en Israel con densidades de 2000–3000 peces/ha (Hepher y Pruginin, 1981). Boyd (1982) y ASEAN (1978) sugirieron estrategias de utilización de fertilizantes químicos para mantener nitrógeno soluble y ortofosfato a 0.1–0.5 mg F/l (Boyd, 1982) y 0.95 mg de N/l y 0.11 mg F/l (ASEAN, 1978) en estanques de cultivo de agua dulce y salobre, respectivamente. El efecto benéfico de utilizar fertilizantes con nitrógeno en estanques de agua dulce ha tenido resultados variables (Hickling, 1962; Hepher, 1963; Miller, 1976; Boyd y Sowles, 1978; Boyd, 1982; Vincke, 1985; Yamada, 1986); Vincke (1985) sugiere que puede que no sea necesario el uso continuo de fertilizantes con base de nitrógeno en estanques de agua dulce, debido a la alta tasa de fijación de nitrógeno de las bacterias libres y de las algas verde-azules en éstos estanques. En la Tabla 15 se muestran ejemplos de programas de aplicación de fertilizantes que han sido probados y aprobados bajo condiciones de estanques de cultivo.
A pesar de que existen varios métodos químicos precisos para estimar la productividad primaria de un cuerpo de agua (Schroeeder, 1978; Boyd, 1979, 1982; Davison y Boyd, 1981; Olah et al., 1986), la efectividad de un programa de fertilización de un estanque se puede determinar rápidamente midiendo la turbidez (o transparencia) del cuerpo de agua, por medio de un disco de Secchi. Este método simple y práctico está basado en la suposición de que el principal recurso de turbidez dentro de un estanque es la abundancia de fitoplancton (Barica, 1975; Almazan y Boyd, 1978; Boyd, 1979, 1982). Stickney (1979) y ASEAN (1978) recomendaron una visibilidad con disco de Secchi de 30 cm para alcanzar y mantener una fertilización adecuada; lecturas mayores (> de 35 cm) y menores (< de 25 cm) de este nivel indican producción excesiva y baja de fitoplancton, respectivamente. Si no se cuenta con un disco de Secchi, la regla de dedo es sumergir un brazo hasta el codo; si apenas se alcanzan a ver las puntas de los dedos, el agua es suficientemente productiva (FAO, 1981). El método de disco de Secchi no es adecuado para estanques de agua salobres de baja profundidad para producción de algas bénticas o para uso en aguas turbias que tienen altas concentraciones de partículas de arcilla en suspensión.
TABLA 15. Ejemplos de estrategias de alimentación con estanques fertilizados.
ESTANQUES DE AGUA DULCE
Policultivo en Filipinas con langostinos de agua dulce (M. lanceifrons montalbanense) y Tilapia (nilotica, mossabica) Guerrero y Guerrero, 1976):
Aplicación quincenal de 50 Kg/ha de fosfato de amonio 16:20:00 (NPK) usando plataformas sumergidas, profundidad del agua 0.6–0.7 m.
Ver también Guerrero (1981) para monocultivo de tilapia él usó 50 Kg/ha de fosfato de amonio para mantener la productividad, y los peces se sembraron dos semanas después de iniciar la fertilización.
Producción de crías de Tilapia (nilotica) - en Rwanda (Schmidt y Vincke, 1981):
Aplicación mensual de 40 Kg/ha de superfosfato (18%) y 20–40 Kg/ha de sulfato de amonio o 10–20 Kg/ha de urea y 100 Kg/ha de piedra caliza agrícola.
Engorda de Tilapia en Costa de Marfil (Lazard, 1973: citado por Miller, 1976):
Aplicación mensual de 56 Kg/ha de superfosfato triple; dosis mensual dada en dos aplicaciones en canastas suspendidas en la superficie del agua.
Producción de crías de carpa (C. carpio) en la República de Malagasy (Vincke, 1970; citado por Miller, 1976)
Aplicación quincenal de 20–40 Kg/ha de superfosfato triple y 40–80 Kg/ha de sulfato de amonio dado cada 2–3 semanas.
Engorda de tilapia en Zambia (Strum, 1966; citado por Miller, 1976):
Aplicación mensual de 56 Kg/ha de superfosfato doble (38% P2 O5).
Policultivo de producción de crías de carpa (C. carpio, H. molitrix) y Tilapia (aurea o híbridos) en Israel (Hepher, 1962):
Aplicación quincenal de 60 Kg/ha de superfosfato (18%) y 60 Kg de sulfato de amonio.
Estanques para criadero de carpa en Hungría (Horvath, Tamas y Tolg, 1984):
Después de que los estanques fueron secados y desinfectados con cal, se llenaron a la mitad con agua (5–7 días antes de sembrar los peces) y se les añadió de 150–200 Kg/ha de nitrato de amonio o carbamida. La mitad de la aplicación se debe añadir durante el llenado de estanque, y el remanente proporcionarse en dos aplicaciones después de la primera y segunda semana de crianza. El fósforo se debe añadir en un estado semi-disuelto a 100 Kg/ha cuando se inunde el estanque.
Peces de agua dulce en general en Alabama, USA (Boyd y Snow, 1975):
De ocho a doce aplicaciones periódicas por año de 45 Kg/ha de 20:20:5 (NPK, fertilizante compuesto granular), aplicado sobre dos plataformas sumergidas; la primera aplicación es seguida por dos aplicaciones a intervalos quincenales, tres aplicaciones a intervalos cada tres semanas, y cinco aplicaciones a intervalos mensuales.
Estudios subsecuentes han mostrado que los fertilizantes con nitrógeno se pueden reducir considerablemente y omitir sin reducir la producción de peces (Boyd y Sowles, 1978).
Dobbins y Boyd (1976) también eoncontraron que los fertilizantes de potasio son generalmente innecesarios y que la tasa de aplicación estandar de fertilizantes con fósforo de 9 Kg de P2O5/ha se puede reducir a la mitad sin reducir significativamente la producción de peces.
Aplicación cada dos a tres semanas de 6.6 Kg/ha de una solución de polifosfato de amonio (fertilizante líquido; 10:34:0 NPK; densidad 1.4 g/ml; Davidson y Boyd, 1981).
Policultivo en Filipinas de sabalote (C. chanos), Tilapia (T. nilotica) y snakehead (O. striatus) (Cruz y Laudencia, 1980):
Aplicación quincenal de 50 Kg/ha de fosfato de amonio (16:20:0, NPK).
Peces de agua dulce en general en China (FAO, 1983)
Aplicación de un fertilizante compuesto (4:4:2, NPK) para mantener la concentración de 0.9, 0.9 y 0.45 mg/l, respectivamente.
Peces de agua dulce en general en Brasil/Hungría (Woynarovich, 1985):
Aplicación quincenal de 15 Kg/ha de superfosfato (18%) y 30 Kg/ha de nitrato de amonio.
ESTANQUES DE AGUAS SALOBRES
Engorda de camarón (Penaeus stylirostris) en Estados Unidos de Norteamérica (Rubright et. al., 1981):
Aplicación de 15.7 g/ha de urea peletizada (45:0:0) y 6.7 Kg/ha de superfosfato triple cada 19 días antes de sembrar los camarones y posteriormente cada 7 días después de la introducción de los animales.
Engorda de camarón (Penaeus sp.) en Ecuador/Filipinas (Clifford, 1985).
Aplicación inicial (mientras se llena el estanque) de 16.8–22.4 Kg/ha de urea y 1.1–5.6 Kg/ha urea y 1.1–2.2 Kg/ha de superfosfato triple (métodos de aplicación -plataformas, bolsas perforadas suspendidas o vaciarlo dentro de la toma de agua)
Engorda de camarón (Penaeus sp.) - USA (Colvin, 1985):
Parker et al., (1974) usaron aplicaciones semanales de 45 Kg/ha de urea junto con una dieta peletizada con 25% de proteína una vez que los camarones alcanzaron 20 mm de longitud.
Engorda de camarones (Penaeus sp.) - Ecuador (MIDA, 1985):
Substitución de alimento peletizado en Ecuador por aplicaciones semanarias de 20 Kg/ha de urea y 7 Kg/ha de P2O5, y una densidad final de camarones de 1.5–2/m2.
Engorda de camarón (Penaeus sp.) México (datos no publicados):
Aplicación inicial de 15–35 Kg/ha de urea y 5–12 Kg/ha de P2O5, seguida por aplicaciones mensuales que dependían de la productividad del agua.
Engorda de camarón (Penaeus sp.) - Brasil (datos no publicados del sector comercial):
Aplicaciones iniciales de 10–150 Kg/ha de urea (promedio 25 Kg) y 5–60 Kg/ha de superfosfato triple (promedio 15 Kg); seguido por aplicaciones mensuales que dependían de la productividad.
Engorda de lisa (Mugil capito) - Egipto (Bishara, 1979):
Aplicaciones mensuales de 20 Kg/ha de superfosfato o 18 Kg/ha de superfosfato más 18 Kg/ha de nitrato de amonio.
Incubación de tambor rojo (S. ocellatus) - USA (Colura, 1987):
Programa de fertilización usado por la GCCA/TPWD John Wilson Marine Fish Hatchery en Corpus Christi, Texas. Todas las tasas de fertilización son calculados para una hectárea:
| Día | Tratamiento |
| 1 | Llene el estanque a 1/3 de su volumen |
| 3 | Añada 12 l de ácido fosfórico y 28 l de nitrato de amonio (33% de N) |
| 6 | Disperse 455 Kg de harina de semillas de algodón (HSA) sobre la superficie del agua. |
| 8 | Termine el llenado del estanque. |
| 12 | Añada 12 l de ácido fosfórico y 28 l de nitrato de amonio |
| 14 | Siembre aproximadamente 750,000 crías |
| 16 | Disperse 114 Kg de HSA sobre la superficie del agua |
| 22 | Añada 12 l de ácido fosfórico y 28 l de nitrato de amonio |
| 24 | Disperse 114 Kg de HSA sobre la superficie del agua |
| 30 | Disperse 114 Kg de HSA sobre la superficie del agua |
| 38 | Disperse 114 Kg de HSA sobre la superficie del agua |
Programa de fertilización usado en la Estación de Investigaciones de Pesquerías Marinas Perry R. Bass, Palacios, Texas TPWD. Todas las tasas de fertilización están calculadas para una hectárea.
| Día | Tratamiento |
| 1 | Disperse 282 Kg de HSA sobre el fondo del estanque seco; llénelo a aproximadamente 100 cm de profundidad |
| 3 | Continúe llenando. Añada 9 l de ácido fosfórico y 4.6 Kg de urea (45% N) |
| 7 | Disperse 31.3 Kg de HSA |
| 10 | Disperse 31.3 Kg de HSA, siembre las crías |
| 12 | Disperse 31.3 Kg de HSA, añada 3 l de ácido fosfórico y 4.6 Kg de urea |
| 15 | Disperse 31.3 Kg de HSA |
| 17 | Disperse 31.3 Kg de HSA |
| 19 | Disperse 31.3 Kg de HSA, añada 3 l de ácido fosfórico y 4.6 g de urea |
| 21 | Disperse 31.3 Kg de HSA |
| 23 | Disperse 31.3 Kg de HSA |
| 24 | 5.7 Kg/ha de una dieta de salmón iniciación |
| 25 | Disperse 31.3 Kg. añada 3 l de ácido fosfórico y 4.6 Kg de urea |
Cultivo de “Lab-Lab” (complejo de algas bénticas azul-verdes) para sabalote (C. chanos)/estanques de camarón general (ASEAN, 1978):
El fondo del estanque se debe secar primero por un período de 7–10 días (que no se seque completamente). Desechos secos de pollo (libres de insecticidas) se deben aplicar al fondo del estanque seco a una tasa de 350 Kg/ha para incrementar el contenido de materia orgánica en los sedimentos del estanque; el crecimiento de Lab-Lab está directamente relacionada a la cantidad de materia orgánica del lodo -el crecimiento es muy abundante en suelos con 16% de materia orgánica o más. En ausencia de desechos de pollo (u otros desechos animales), se pueden aplicar fertilizantes químicos a una tasa de 50–100 g/ha 18:46:0 (NPK) o 100–150 Kg/ha de fosfato de amonio (16:20:0, NPK). Inmediatamente después de la fertilización se introducen en el estanque de 3–5 cm de agua. Después de una semana, se aplica la misma cantidad de fertilizante y el nivel del agua se eleva a 10–15 cm. La fertilización se repite después de la segunda semana y el nivel del agua se eleva a 20–25 cm. Se puede añadir agua adicional para recuperar las pérdidas por filtración y evaporación. Muchos granjeros recomiendan fertilizar cada 7 días a través del período de cultivo de peces y camarones. Para mayores detalles, ver a Padlan, Ranoemihardjo y Hamami (1975).
Yamada (1986) cita el programa de fertilización para “Lab-lab” de Ballesteros y Mendoza (1976) para el cultivo de sabalote en las Filipinas: Aplicación inicial de 100–200 Kg/ha de 18:46:0 (NPK) sobre el fondo del estanque seco y entonces se permite la entrada del agua a el estanque. Aplicaciones adicionales de fertilizantes de 50–100 Kg/ha 18:46:0 (NPK) cada 10–15 días hasta una semana antes de la siembra. Una semana después de la siembra una aplicación posterior de 15–25 Kg/ha 18:46:0 (NPK), se repite esta dósis cada 10–15 días hasta la cosecha.
Djajadiredja y Poernomo (1973) presentan un programa de fertilización para la producción de “Kelekap” (complejo de algas bénticas) para estanques de sabalote en Indonesia: los estanques se drenan primero y el lodo es fuertemente labrado a manera de dejarlo lo más suave y fino posible. Se aplican fertilizantes a una tasa de 130 Kg/ha de urea, 65 Kg/ha de superfosfato triple y 1000 Kg/ha de desperdicios de arroz (localmente conocido como “sekam”) esparciéndolo homogeneamente sobre el fondo del estanque húmedo. Inmediatamente después de la aplicación del fertilizante el nivel del agua se eleva de 3–10 cm. Después de que se nota un buen crecimiento de algas bénticas, el nivel del agua se eleva a su nivel normal de 30–40 cm y los peces se siembran. Djajadiredja y Natawiria (1965) observaron que 8.8–28.1 tons. (promedio 15.6 ton/ha) de “Kelekap” se pueden producir en dos semanas con una aplicación de 500 Kg/ha. Sin embargo, los fertilizantes químicos se usan raramente para la producción béntica de algas en Taiwan; se usa preferentemente cascarilla de arroz y sedimento de letrinas (Chen, 1973).
El procedimiento para hacer crecer “Lab-lab” se puede utilizar también en estanques de agua dulce, usando un régimen de fertilización inicial de 50 Kg/ha de 16:20:0 (de fosfato de amonio, NPK), 22 Kg/ha de 46:0:0 (urea, NPK) y estiércol de pollo a 2000–2500 Kg/ha (Bautista, 1982; Oandasan, 1982).
“Lumut” (complejo de algas verdes filamentosas y pastos verdes)/estanques de camarón en general (ASEAN, 1978):
Fondos con lodo suave con un pH de 6.8–7.5 favorecen el crecimiento del “Lumut”. Los estanques se deben secar primero por un período de tres días, se debe permitir después que le entre suficiente agua para que el suelo esté húmedo. El fondo húmedo es entonces sembrado con filamentos largos de plantas viejas ya existentes (usualmente se lleva de 2 a 4 semanas desde que se plantan hasta que el estanque está listo para la siembra de los peces). Después de que se siembran las plantas, el estanque se inunda hasta unos 30 cm, y de 3 a 7 días más tarde se fertiliza con fosfato de amonio (16:20:0 NPK) a una tasa de 18–20 g/m3 de agua, la aplicación se hace al voleo o disolviéndolo en una plataforma que se coloca 10 cm abajo del nivel del agua. Después de una semana el agua se eleva a 40 cm, posteriormente se hacen aplicaciones semanales del fertilizante a una tasa de 9–10 g/m3 de agua hasta 6 semanas antes de que se vaya a cosechar. Se deben insertar hileras de palos y pequeñas ramas dentro del fondo lodoso (líneas de 6 a 15 m de separación) con el propósito de minimizar la acción destructiva del viento y olas sobre el “lumut”. Con rompevientos adecuados, el agua se puede mantener a 60 cm de profundidad.
Además del efecto benéfico del encalado (sección 3.2.2.2) se sabe que los siguientes factores influyen en el éxito o fracaso de una estrategia de alimentación mediante fertilizantes químicos.
Luz de sol: En presencia de nutrientes inorgánicos adecuados, la producción primaria alcanza un valor máximo por la penetración de la energía solar en el estanque (Schroeder, 1978, 1980; Wohlfarth y Schroeder, 1979). Aunque Tamiya (1957) y Hepher (1962) establecen que la productividad primaria máxima en aguas tropicales es equivalente a cerca de 10 g de carbono fijado en las algas/m2/día, Talling et al., (1973) han sugerido que el límite superior para la productividad primaria bruta es de 17.8 g de carbón fijado/m2/día o la liberación de 47 g de oxígeno (en general se producen 2.6 g de oxígeno por cada gramo de carbono fijado durante la fotosíntesis; Casinelli et al., 1979; Pruder, 1986). De acuerdo a Pimentel y Pimentel (1979) cerca de 0.03% de la luz que alcanza un ecosistema acuático es fijado por el fitoplancton y las plantas acuáticas, y se calcula que sea aproximadamente 4 × 106 Kcal/ha/año o cerca de un tercio del que se fija en el habitat terrestre.
De lo anterior, se sobreentiende que el incrementar la profundidad del agua, la turbidez 1 (causada por partículas de arcilla en suspensión), el obscurecimiento del cielo y las sombras, reducirán la cantidad de luz que alcancen a los autótrofos verdes, y consecuentemente limitarán la capacidad de producción primaria de un estanque (Miller, 1975; Boyd, 1986). Además, la aplicación continua de fertilizantes químicos más allá de un cierto nivel no resultará en un incremento en la producción primaria; la cantidad de penetración de energía solar en el estanque dictará el límite superior de la producción autotrófica (Hepher, 1962; Schroeder, 1978, 1980).
Intercambio de agua: Para que los efectos benéficos del encalado y la fertilización química se realicen en la forma de incremento en la producción de fitoplancton, es esencial que el tiempo de residencia del agua en el estanque sea al menos de tres a cuatro semanas (equivalente a una tasa de intercambio en el estanque de 5%/día). Exceso en las tasas de intercambio, resultará en que los nutrientes del encalado y la fertilización se laven antes de que se puedan utilizar (Boyd y Snow, 1975; Miller, 1976; Boyd, 1986). Tasas de intercambio excesivas pueden ser un problema mayor en los trópicos durante la estación de lluvias.
Química del agua: En aguas con altas concentraciones de calcio (agua dura) y elevado pH, los fosfatos que se aplican en la fertilización se pueden perder rápidamente del agua a través de la precipitación como fosfato de calcio insoluble, siendo entonces no disponible para los autótrofos primarios (Boyd, 1982). Por lo tanto, las tasas de aplicación de fertilizantes con fosfatos debe ser más alta en aguas duras con pH altos que en aguas suaves con un pH moderado (Boyd, 1986). En vista de la relación mencionada anteriormente, los fertilizantes fosfatados nunca se deben aplicar al mismo tiempo o en la misma semana de aplicación del encalado (Viveen et al., 1985).
Fertilidad natural del suelo: Los estanques localizados en suelos fértiles de pastura, requieren tasas de aplicación de fertilizantes más bajos que los suelos infértiles de los bosques (Boyd, 1976). De la misma manera, suelos ricos de aluvión con altos contenidos de materia orgánica, requieren menores tasas de aplicación de fertilizantes que los suelos barro-arenosos para el crecimiento de las algas bentónicas verde-azules (“lab-lab”) en los estanques para peces de aguas salobres (Tang y Chen, 1967; ASEAN, 1978).
Manejo previo de los estanques: Estanques de reciente construcción requieren generalmente tasas de aplicación de fertilizantes más altas que los estanques que tienen una historia de fertilización y acumulación de sedimentos en el fondo (Hickling, 1962; Hepher, 1963; Swingle, 1965; Boyd, 1986).
Infestación de maleza acuática: Grandes acumulaciones de macrofitas acuáticas competirán con el fitoplancton por los nutrientes disponibles y luz del sol, resultando en una reducción en la producción de fitoplancton (Boyd, 1982; Miller, 1976; Boyd, 1986). La infestación de maleza se puede controlar con el encalado, cosecha mecánica o a través del uso de especies de peces herbívoros como la carpa herbívora (C. idella), tilapia (T. rendalli, niloticus, mossambicus, zilli) o pez conejo (Siganus sp.).
100:5:1, C:N:P (medio de crecimiento, Edwards, 1982)
Bacterias (general)
Solubilidad de los fertilizantes: Un fertilizante solamente será efectivo si es soluble. Aún cuando esto generalmente no es un problema para los fertilizantes basados en nitrógeno (la mayoría son muy solubles), los fertilizantes fosfatados varían en solubilidad dependiendo del tamaño de partícula y la composición química (Tabla 16; Miller, 1976; Boyd, 1979; Hepher y Pruginin, 1981). En este aspecto, los fertilizantes líquidos (sí están disponibles) se recomiendan sobre los fertilizantes granulares o en polvo, debido a que la solubilidad es mayor y la distribución de los nutrientes es más uniforme en la columna de agua (Musig y Boyd, 1980; Davidson y Boyd, 1981).
TABLA 16. Porcentaje de disolución del fósforo y el nitrógeno de fertilizantes seleccionados, después de asentarse a través de una columna de agua de 2 m a 20°C 1, 2.
| Fertilizante | Solubilidad de los nutrientes (%) | |
| Fósforo | Nitrógeno | |
| Superfosfato | 4.6 | - |
| Superfosfato triple | 5.1 | - |
| Fosfato de amonio monobásico | 7.1 | 5.1 |
| Fosfato de amonio dibásico | 16.8 | 11.7 |
| Nitrato de sodio | - | 61.7 |
| Sulfato de amonio | - | 85.9 |
| Nitrato de amonio | - | 98.8 |
| Nitrato de calcio | - | 98.7 |
1 Fuente: Boyd (1982)
2 Las solubilidades mencionadas son específicas para el estudio en cuestión.
La solubilidad también varía con el tamaño de partícula del fertilizante y la
calidad del agua.
Métodos de aplicación de los fertilizantes y frecuencia de aplicación: El método de aplicación del fertilizante usado puede tener un profundo efecto sobre el éxito de un régimen de fertilización del estanque. Esto es particularmente verdadero para los fertilizantes fosfatados en polvo y granulares, los cuales permiten estar en contacto directo con el fondo del estanque y ser rápidamente absorbidos por las partículas y así poner al fosfato en forma indisponible para las algas planctónicas. Para salvar esta dificultad, los fertilizantes fosfatados deben ser disueltos en agua antes de su aplicación, o bien, ser distribuidos en canastas flotantes perforadas, en costales perforados suspendidos o colocando plataformas dentro del agua (Figura 13). Los últimos métodos de aplicación permiten la disolución y distribución gradual de los fertilizantes por la acción de las olas y la circulación del agua dentro del estanque: esto implica que estos dispositivos no puedan ser colocados cerca de las salidas de los estanques (Vann der Lingen 1967; Vincke, 1970; Boyd y Snow 1975; Davidson y Boyd, 1981; Veveen et al., 1985; Boyd 1982; Sánchez y Quevedo, 1987).
Sin embargo se debe enfatizar que la fertilización de estanques de aguas salobres para la producción de algas bénticas (i.e. estanques de sabalote) es radicalmente diferente a la de los estanques de agua dulce, donde el objetivo principal es reducir algas planctónicas (Chen, 1973; Djajadiredja y Poernomo, 1973 ASEAN 1978). Para la preparación de los estanques para la producción de algas bénticas los fertilizantes se aplican directamente en el fondo seco y expuesto (Tabla 15).
Para el mantenimiento de la productividad primaria de los estanques, los fertilizantes se deben aplicar sobre la base de “poquito pero a menudo”, preferentemente a intervalos de una o dos semanas a través del ciclo de cultivo; el efecto residual de una dosis de fertilizante aplicado tiene una duración de solamente dos a cuatro semanas dependiendo de la estrategia de manejo del agua empleada (Hepher 1963; Boyd y Snow, 1975; Miller, 1976; Hepher y Pruginin, 1981; Boyd, 1982; Viveen et al., 1985; Vincke, 1985).
| a) Plataforma subacuática 1 | 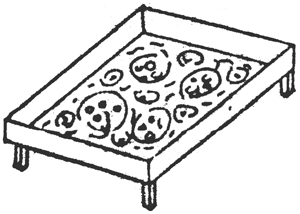 |
| b) Canasta o lata perforada flotante | 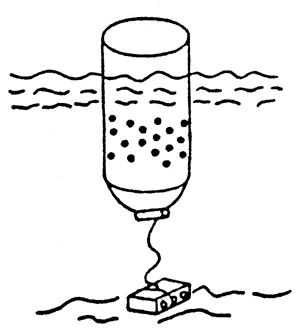 |
| c) Costal perforado suspendido | 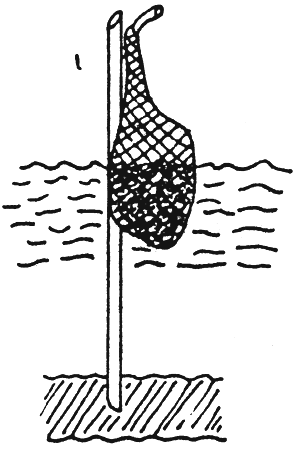 |
FIGURA 13
Métodos de aplicación mecánica de fertilizantes
| Area del estanque (ha) | Tamaño de plataforma (m) |
| 1 | 0.85 × 0.85 |
| 2 | 1.25 × 1.25 |
| 3 | 1.50 × 1.50 |
| 4 | 1.70 × 1.70 |
| 5 | 1.90 × 1.90 |
| 6 | 2.10 × 2.10 |
| 7 | 2.25 × 2.25 |
Fuente: ASEAN (1978)