por
MARCELA OLGUIN PALACIOS
Instituto Nacional de Investigaciones Biológico-Pesqueras, México
Extracto
Este trabajo ha sido enfocado principalmente al conocimiento del ciclo gonadal del camarón café, Penaeus californiensis Holmes dentro de la zona del noroeste del Pacífico mexicano, donde representa aproximadamente un 80 por ciento de las capturas. Se compara con otro peneido, P. setiferus (Linnaeus). Se incluye un análisis superficial de la producción total de las especies de Penaeus que se explotan comercialmente en la zona.
STUDY OF THE BIOLOGY OF THE BROWN SHRIMP Penaeus californiensis HOLMES
Abstract
The paper deals mainly with the gonad cycle of the brown shrimp, Penaeus californiensis Holmes in the northwest Pacific zone of Mexico, where this species constitutes about 80 percent of the catches. A comparison is made with another penaeid shrimp, P. setiferus (Linnaeus). A provisional analysis is given of the total production of commercially exploited shrimp of the genus Penaeus in this zone.
CONTRIBUTION A L'ETUDE DE LA BIOLOGIE DE Penaeus californiensis HOLMES
Résumé
Le présent document traite essentiellement de l'étude du cycle sexuel de Penaeus californiensis Holmes dans la partie nord-ouest du Pacifique mexicain, où cette crevette représente environ 80 pour cent des prises. Cette espèce est comparée avec un autre Pénéidé, P. setiferus Linnaeus. L'auteur procède ensuite à une analyse sommaire de la production totale des espèces de Penaeus qui sont commercialement exploitées dans la zone en question.
El camarón café Penaeus californiensis Holmes, 1900, es uno de los recursos marinos que mayores beneficios aporta a la economía pesquera nacional, pues soporta importantes pesquerías a lo largo del litoral del Pacífico, siendo su captura más intensa en la productiva zona del noroeste de México.
El género Penaeus ha recibido especial atención por parte de instituciones y de biólogos pesqueros de todos los países en que se explota comercialmente, como ocurre, por ejemplo, en los E.U.A. donde este recurso representa una de las pesquerías más importantes de la zona del Golfo de México.
El camarón café es de gran importancia económica para México, puesto que es una de las especies explotadas en la región noroeste durante casi todo el año. Según Carranza (1963), la industria camaronera produjo en 1961 por concepto de exportación, 518 millones de pesos, cifra que en 1965, según el Anuario Estadístico del Comercio Exterior de los Estados Unidos Mexicanos, fue de $551.450.000,001 por 27.049 toneladas de camarón en diferentes grados de industrialización. La importancia económica que este recurso tiene para México se destaca en el Cuadro I.
CUADRO I
Comparative de los principales recursos marinos explotados en el Estado de Sinaloa en el año 1962
| Nombre del recurso explotado | Por ciento del volumen total | Por ciento del valor total | |
| Camarón, incluyendo las 4 especies explotadas en el noroeste | 74,4 | 88,6 | |
| Sierra | 3,6 | 0,7 | |
| Lisa | 2,8 | 1,3 | |
| Corvina | 1,0 | 0,5 | |
| Pescado | 2,3 | 1,1 | |
| Cazón | 0,9 | Æ | |
| Ostión | 2,7 | 0,6 | |
| Carne mariscos | 0,9 | 1,1 | |
| Rana | 2,5 | 2,5 | |
| Otros | 4,7 | 2,7 | |
| Harina | 4,2 | 0,8 | |
| Fuente de información: Atlas Pesquero Nacional (Gutiérrez, 1965) | |||
Los datos del Cuadro I se refieren exclusivamente a la producción del Estado de Sinaloa, porque constituye el área total en donde pescan las embarcaciones de la flota de Mazatlán de las que se tomaron las muestras de camarón café que sirvieron para la realización de este trabajo. En el Estado de Sonora, la producción total de camarón representa el 87,1 por ciento de los 5 recursos marinos más importantes (Gutiérrez, 1965).
Según datos proporcionados por las congeladoras de la zona y elaborados en el Instituto Nacional de Investigaciones Biológico-Pesqueras, a partir de 1960 el camarón café representa el 80 por ciento de las capturas comerciales.
Sobre la base de los datos proporcionados por la Oficina de Estadística de la Dirección General de Pesca e Industrias Conexas, de la Secretaría de Industria y Comercio, se presenta a continuación un breve análisis de las actividades de la flota de Mazatlán, referente a la explotación de las cuatro especies de Penaeus de esta zona. Los datos corresponden a siete temporadas, comprendidas de 1958 a 1965. Los datos de peso del camarón en kilogramos se refieren a camarones descabezados; en la preparación de estos datos y de los gráficos correspondientes se tomaron en cuenta solamente las embarcaciones que realizaron más de cinco viajes en una sola temporada.
En la Fig. 1 se aprecia la evolución de la pesquería mencionada. En la Fig. 2 puede verse que la época de mayor producción fue la comprendida entre los años 1959 y 1962, pero en la temporada de 1962 a 1963, a pesar del incremento en el número de embarcaciones, o tal vez a causa de éste, declina la producción, lo que indica que las poblaciones de camarones no soportaron el efecto de la pesca realizada ese año. Esto es más evidente en la Fig. 3. Debe aclararse que en la elaboración de estos datos no se tomó en cuenta la flota de Salina Cruz, que también opera en la zona de Mazatlán.
De acuerdo con los datos del Registro Nacional de Embarcaiones de la Dirección General de Pesca e Industrias Conexas para el año de 1965, las cooperativas que integran esa flota son 19 y están distribuidas desde Yavaros, Sonora, hasta el Puerto de Mazatlán, Sinaloa.
Al iniciarse las operaciones anuales a finales de verano al levantarse la veda, los movimientos de la flota se realizan fundamentalmente frente a la desembocadura del Río San Lorenzo, Sinaloa, para seguir después hacia el norte. Luego se dirigen hacia el sur, hasta Punta Mita, Nayarit, y sólo excepcionalmente siguen más al sur, frente a litorales nayaritas todavía. Durante la época de veda que en Sinaloa comprende del 15 de julio al 15 de septiembre, algunas embarcaciones salen a pescar al Golfo de Tehuantepec, Oaxaca, donde no existe veda.
1 Un peso mexicano = E.U.A. $0,08
1.1 Objetivos
El conocimiento de la evolución cíclica gonadal de P. californiensis, en comparación con otros estudios de este tipo, ha sido el enfoque principal de este trabajo, en virtud de la importancia que tiene el reconocer con relativa seguridad algunos pasos de su ciclo biológico, como base para su mejor extracción y aprovechamiento.
1.2 Antecedentes
King (1948) estudió fundamentalmente la anatomía y la histología general de las gónadas en ambos sexos de P. setiferus, y como tarea principal se planteó determinar si los caracteres estructurales de las gónadas pueden servir como índice para determinar la edad y la longevidad, y si proporcionan información sobre la frecuencia de desoves de un solo individuo en una sola estación de apareamiento. De acuerdo con los resultados que obtuvo, una hembra desova más de una vez en una sola estación de apareamiento.
Cárdenas (1951) proporciona datos acerca de los artes de pesca empleados para capturar las especies de camarón que se explotan comercialmente en esta región; aborda problemas de filogenia, de taxonomía y de distribución geográfica y establece el ciclo biológico de 3 especies.
El trabajo de Núñez (1954), en la zona pesquera de la Bahía de Guaymas, Sonora, comprende principalmente aspectos bioestadísticos.
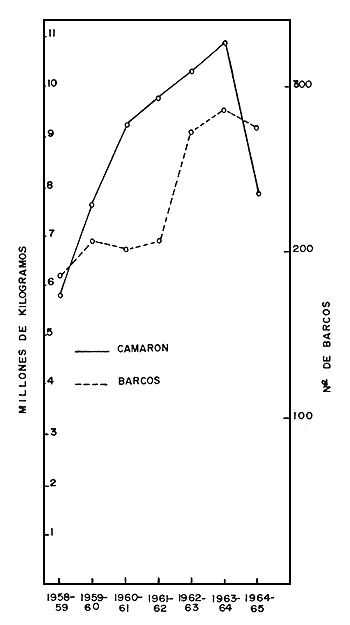
Fig. 1 Capturas anuales de la flota de Mazatlán, Sinaloa.
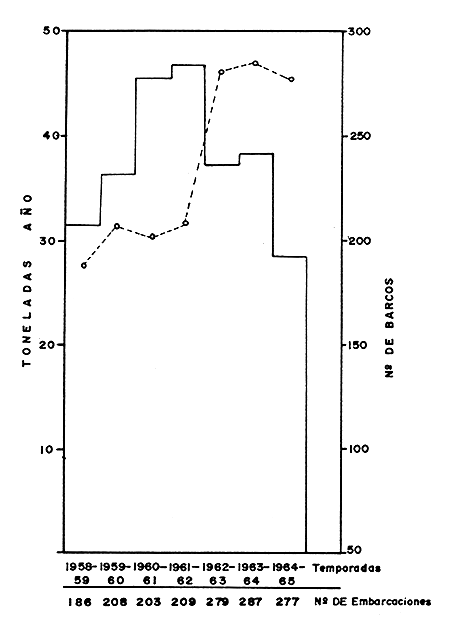 | 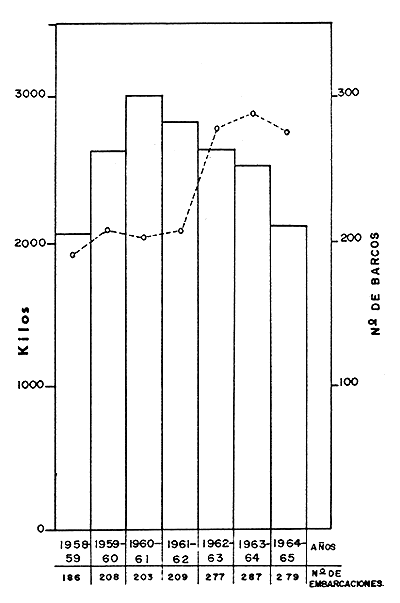 |
| Fig. 2 Promedio anual de captura por embaroación. | Fig. 3 Captura por unidad de esfuerzo. |
Chapa (1956) señaló la posibilidad de reconocer macroscópicamente la madurez sexual de varios peneidos de explotación comercial en la parte noroeste del Pacífico mexicano. Este investigador se basa en la variación de color que presenta el ovario a través del ciclo gonadal; toma también en cuenta la coloración externa, así como la diferencia de tamaño entre el macho y la hembra, cuando han alcanzado su madurez sexual.
1.3 Area de estudio
El área de estudio se localiza en la zona en que se realizan los movimientos de la flota de Mazatlán. En términos generales, esta flota opera desde los límites de los Estados de Sonora y Sinaloa en el norte, hasta Punta Mita, Nayarit, en el sur. El mapa (Fig. 4) muestra el área aproximada de captura de la flota de Mazatlán (Chapa, 1956). Se señalan las localidades de muestreo, sobre cuya base se formó el ciclo gonadal.
En el Estado de Sinaloa, con 648 kilómetros de litoral, se pescan estos peneidos abundantemente. Esta zona tiene un sistema hidrográfico formado por 118 ríos, agrupados en las 12 cuencas más importantes del Estado. En números redondos el caudal de escurrimiento de estos ríos es de 4.400 millones de metros cúbicos anuales (promedio de los anos comprendidos entre 1955–1964), según datos obtenidos en el Boletín Hidrológico No. 26, Región Noroeste, de la Secretaría de Recursos Hidráulicos 1965.
En general, los ríos en Sinaloa desembocan directamente en el mar; forman muchas veces las lagunas costeras, marismas o esteros. El clima que predomina en el litoral sinaloense es tipo semi-árido caliente, con temporada de lluvias en los períodos de verano e invierno.
Las muestras de camarón café que sirvieron para la elaboración de este trabajo fueron tomadas por el personal de la Estación de Biología Pesquera de Mazatlán, a bordo de embarcaciones de la flota camaronera de ese puerto. El material se envió preservado para su estudio al laboratorio central del Instituto Nacional de Investigaciones Biológico-Pesqueras. La toma de muestras se realizó mensualmente, y cada una de ellas, tomada al azar, estuvo formada por 50 ejemplares aproximadamente. Durante el desarrollo del trabajo se midieron 1.014 ejemplares, de uno y otro sexos y se hicieron preparaciones histológicas del aparato reproductor de 5 machos y 5 hembras de cada muestra.
Los ejemplares de muestra se lavaron con agua dulce, en algunos casos, antes de ser fijados en formol al 10 por ciento. Más tarde, siguiendo las indicaciones de Boschi (comunicación personal), este fijador se desechó y en su lugar se empleó el líquido de Bouin-Hollande, para proseguir después con la técnica modificada de Petterfi. Una vez fijados los ejemplares, se prepararon en cámara húmeda y se enviaron por avión al laboratorio central del Instituto Nacional de Investigaciones Biológico-Pesqueras.
Al llegar al laboratorio de histología se midieron los ejemplares según el método recomendado por Pérez, Acosta y Alemany (1961). Sobre esta base se tomaron longitudes totales, se determinó el sexo y se les numeró progresivamente, empezando con la captura correspondiente al mes de mayo de 1965. El número correspondiente a cada ejemplar se marcó con tinta china en un rectángulo de papel blanco colocado en la región branquial, aprovechando el caparazón mismo como sostén del papel marcado. Después de fijados los ejemplares y de haberlos medido y marcado, se hizo la disección en un promedio de 5 hembras y 5 machos elegidos al azar, en cada captura. Se disecaron, en cada caso, los ovarios completos y los testículos con su canal deferente y ampolla terminal.
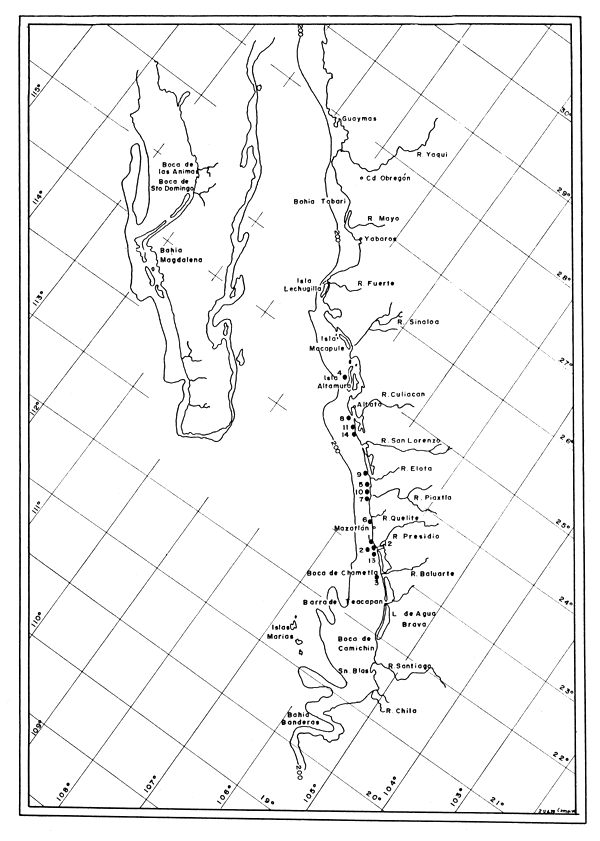
Fig. 4 Localidades de captura (tomado de Chapa, 1956).
En el caso de las hembras, y sobre todo cuando se trató de ejemplares maduros, se cortó la glándula en tres o cuatro secciones transversales, a las que se les puso el número del ejemplar seguido de una letra a, m, ó p, para indicar que la posición relativa de la sección en el individuo era anterior, medio o posterior, respectivamente. Esto fue necesario porque el ovario, que se encuentra en la parte dorsal, se extiende desde la región anterior del cefalotórax hasta la parte terminal del abdomen. Los ejemplares no disecados se guardaron en alcohol de 70°.
Se incluyeron las secciones de gónadas en parafina de 49–51° de punto de fusión y se tiñeron con Hematoxilina-Eosina. Se montaron en resina sintética y se observaron al microscopio compuesto usando luz artificial. Se procuró usar las preparaciones más representativas de cada mes. Después se ensayaron varios tipos de películas para trabajar con el fotomicroscopio y con el microscopio de contraste de fases, usando un aditamento especial para montar una cámara fotográfica. De esta serie de fotografías se seleccionó la mejor de cada mes y que fuera también la más representativa del diferente grado de desarrollo del proceso de madurez gonadal. Los óvulos y ovocitos se midieron con escalas previamente fotografiadas y reproducidas al mismo tamaño que la serie de fotografías obtenidas. Se introdujeron las siguientes variantes a la técnica sugerida por Boschi: a) se utilizó el fijador Bouin-Hollande que fue sugerido por Irma López G. en 1965, que está comprobado es un buen fijador para insectos de caparazón duro semejante al del camarón café; b) se utilizó parafina del más bajo punto de fusión existente en el mercado; c) por sugerencia de Alma Flores M., se utilizó carbonato de litio para lavar las secciones de gónadas fijadas en solución Bouin-Hollande.
Biogeográficamente puede considerarse que este peneido pertenece a la provincia panámica, que, en términos generales, abarca desde Isla Cedros, Baja California, hasta Payta, Perú (Keen, 1958). Sin embargo, de acuerdo con esta misma autora, será necesario hacer una subdivisión para esta zona, en virtud de que la distribución de las especies en la región mencionada no es uniforme.
La zona en donde la explotación del camarón café es más intensa se localiza en la costa noroeste del Pacífico mexicano, región considerada por algunos autores como subprovincia californiana. Entre otras características de esta subprovincia, se tienen los aportes que recibe en la porción norte, con los que llegan sedimentos provenientes del Río Colorado. Por otro lado, son pocas las especies tropicales que se extienden hasta ella. Para el Mar de Cortés en especial, Parker (1964), reconoce dos regiones diferentes, una al norte de Mazatlán y otra al sur.
3.1 Areas de captura
Los datos que se dan aquí proceden principalmente de informes proporcionados por investigadores y colectores que han tomado muestras en esta zona de capturas de tipo comercial o de capturas de cruceros de investigación oceanográfica; estos muestreos marcan aproximadamente el área de distribución geográfica de la especie que es objeto de este estudio.
La captura del camarón café se efectúa principalmente en zonas costeras que, por encontrarse sobre plataforma continental y por su profundidad, pueden considerarse bentónicas neríticas. La distribución batimétrica aproximada para P. californiensis es de entre 10 y 55 brazas (18 a 100 m) según datos obtenidos durante los muestreos realizados por el personal de la Estación de Biología Pesquera de Mazatlán (1965–66).
Los tipos más comunes de sustrato en que se le encuentra, son fondos limoarcillosos o fangosos. Según Rioja (1962) los fondos ocupados por los peneidos del Golfo de México son aquellos que están un poco más alejados de las playas arenosas, en fondos de fango entre 10 y 15 brazas de profundidad.
Es importante la influencia que ejercen algunos factores ecológicos tales como la salinidad, temperatura, iluminación y nutrientes, y no sólo determinan la abundancia, sino también el comportamiento de estas comunidades que, aunque permanecen durante todo el año en aguas profundas y sólo en contadas ocasiones se han colectado escasos ejemplares en bahías y esteros, no por esto dejan de considerarse poblaciones costeras, puesto que habitan, como se ha dicho antes, sobre la plataforma continental, zona en la cual juegan un papel decisivo los factores arriba citados. En términos generales, las zonas de captura del camarón café en México se extienden desde Baja California hasta Chiapas.
De acuerdo con Chapa (1956), en los litorales occidentales del territorio sur de Baja California se captura el camarón café desde la Boca de San Gregorio hasta el Cabo San Lázaro, a profundidades de 12 a 25 brazas (22 a 46 m). De Boca de los Inocentes hasta el Arroyo de la Candelaria, a una profundidad aproximada de 20 brazas (37 m).
En el Mar de Cortés (Golfo de California), en la desembocadura del Río Colorado, se pesca a profundidades de 15 a 20 brazas (28 a 37 m).
Según datos proporcionados por Victor Díaz Garcés (comunicación personal), sobre las capturas con redes de arrastre realizadas y estudiadas por Alejandro Villamar Calderón (comunicación personal) durante el crucero INIBPYO-6602, a bordo del buque motor YOLANDA se obtuvieron ejemplares de P. californiensis en las siguientes zonas de aguas protegidas: Bahía Concepción y Bahía de la Paz (Baja California) entre 10 y 11 brazas y Bahía Agua Dulce y Estero de Tastiota (Sonora) entre 7 y 25 brazas de profundidad. En otro crucero (GP-4-6601) Sergio Antonio Guzman del Próo capturó un pequeño número de ejemplares en la Bahía Magdalena y al norte de ésta.
En Sonora se le explota en Desemboque, en la desembocadura del Río Asunción. Es muy abundante en la Barra de Yavaros y en la Bahía de Guaymas, entre 8 y 25 brazas (15 a 46 m). Se le encuentra en casi todo el litoral al sur de Guaymas hasta el estero de Agiabampo, entre 10 y 15 brazas (18 a 27 m) (Chapa, 1956).
Es esta la especie dominante en las capturas comerciales de alta mar del Estado de Sinaloa desde noviembre hasta enero, a profundidades de 18 a 30 brazas (33 a 55 m); después desaparece hasta el mes de julio en que vuelve a aumentar (Lizárraga, 1964).
En el mapa (Fig. 4) se señalan con círculos negros las localidades del litoral sinaloense en las que el personal de la Estación de Biología Pesquera de Mazatlán ha capturado ejemplares de P. californiensis. Dichas localidades son: Boca del Río Presidio (1); frente a Barrón (2); Chametla, frente al Cerro Cabeza de Caballo (3); Isla Altamura (4); entre Piaxtla y San Miguel (5); frente al Faro Crestón (6); Boca del Río Piaxtla (7); El Tambor (8); La Cruz de Piaxtla (9); frente a la Isla Venados (10); Los Cocos (11); Boca Barrón (12); frente a Teacapán (13); Palma Sola (14).
En el Estado de Nayarit se encuentran poblaciones pequeñas y alejadas de la costa las cuales ya no se explotan comercialmente, y sólo en Salina Cruz, Oaxaca, vuelve a haber poblaciones dignas de explotación comercial.
4.1 Aparato reproductor femenino
Según King (1948), el aparato reproductor en las hembras de P. setiferus consta de un par de ovarios, que presentan en estado fresco una forma más o menos triangular. Conforme se desarrollan, los ovarios aumentan de diámetro y se van uniendo, de modo que en las hembras grávidas dan la impresión de estar perfectamente unidos. La glándula presenta un par de oviductos que son finos tubos que se comunican a los lóbulos laterales con los orificios o poros genitales (Fig. 5 c) localizados en la base de las coxas del tercer par de pereiópodos. Eldred (1958) compara estas aberturas con estructuras semejantes a puertas falsas, que se abren sólo en el momento del desove y que se vuelven a cerrar cuando se ha realizado esta función. Según esta misma investigadora, la región anterior del ovario de P. duorarum consta de dos lóbulos anteriores, localizados entre el estómago, siguen luego ocho pares de lóbulos también situados en la región anterior del cefalotórax y colocados dorsalmente al hepatopáncreas. Estos lóbulos se comunican con los lóbulos abdominales, que llegan hasta la parte posterior del abdomen. En los ejemplares de P. californiensis que se estudiaron para este trabajo, se encontró una separación de los dos ovarios a la altura del último segmento abdominal, sitio donde el intestino toma una posición central y dorsal (Fig. 7).
El télico (Fig. 5b) que forma parte del aparato reproductor, es una estructura externa quitinizada, colocada ventralmente entre el cuarto y quinto par de pereiópodos. Internamente está modificado presentando una estructura que recibe a los espermatóforos adheridos por el macho. Aparentemente esta cavidad funciona como una espermateca, y se denomina receptáculo seminal (Eldred, 1958). Esta modificación externa, que comprende a los somites XII, XIII y XIV, constituye un carácter para determinar el sexo en hembras no menores de 26 mm, según experiencias efectuadas con P. duorarum (Eldred, 1958).
De acuerdo con King (1948), el ovario presenta tres diferentes tipos de tejidos, a saber: a) una delgada capa externa de epitelio pavimentoso; b) una capa media de tejido conectivo, y c) una capa de epitelio germinal. El ovario se encuentra atravesado longitudinalmente por septos de tejido conectivo, y en corte transversal se advierten pequeños senos sanguíneos. Los diferentes tipos celulares que se describen en este trabajo son esencialmente:
Ovocitos: células del epitelio germinal, de forma poliédrica, con escasos nucléolos; se localizan generalmente en sitios determinados de la gónada, en forma de columna. Miden entre 27 μ y 50 μ.
Ovulos: gametos femeninos maduros. Son células que han alcanzado total desarrollo, presentan numercsos nucléolos y unas estructuras en el citoplasma llamadas cuerpos periféricos (King, 1948), o sustancia gelatinosa (Hudinaga, 1942) (Fig. 15). Histoquímicamente no se ha determinado la naturaleza de estas estructuras; King demostró que no son de naturaleza grasa ni proteica. Miden 196 μ, aproximadamente.
Ovulos residuales: Sa caracterizan por presentar núcleo degenerado, aparentemente en proceso de involución, con escasos nucléolos, encontrándose localizados básicamente en la periferia del lóbulo. Miden aproximadamente 104 μ.
4.2 Aparato reproductor masculino
El aparato reproductor masculino está constituido por un par de testículos, cada uno con un vaso deferente que se une a una ampolla terminal colocada en los coxopoditos del quinto par de pereiópodos. En esta estructura se forman los espermatóforos, que se cree salen al exterior a través del rompimiento de la membrana que forma ventralmente los coxopoditos.
El órgano copulador del macho es el petasma (Fig. 6b) que es una modificación de los endopoditos del primer par de pleópodos. Otra estructura presente en el macho, que parece tomar parte en la cópula, es el apéndice masculino (Fig. 6c), que es también una modificación del segundo par de pleópodos.
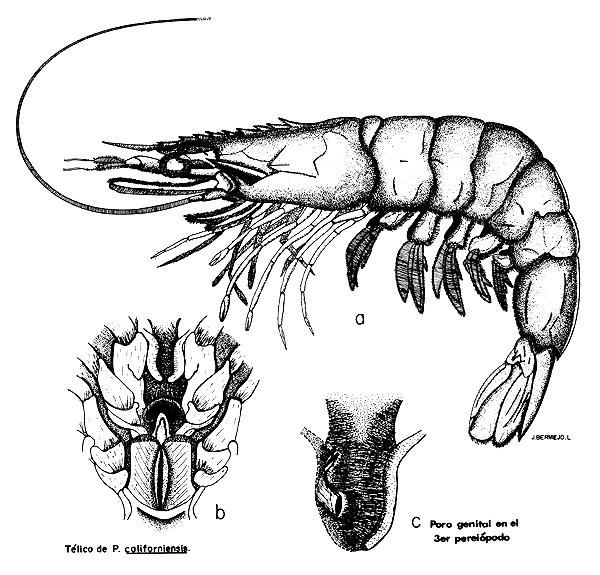
Fig. 5 Morfología externa de P. californiensis Holmes ♀.
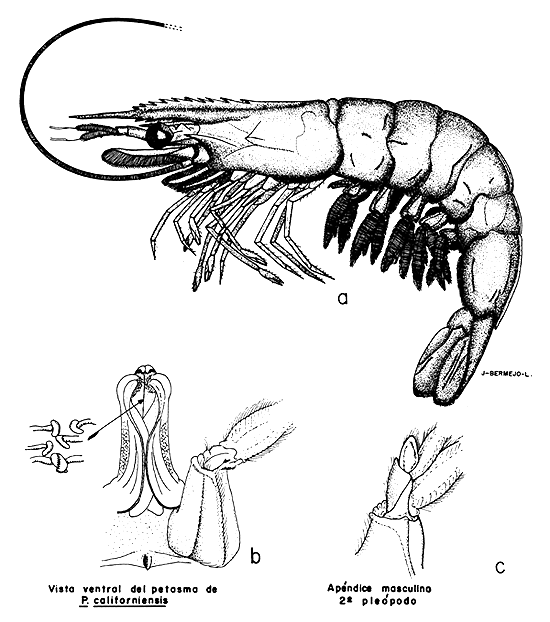
Fig. 6 Morfología externa de P. californiensis Holmes ♂.
 |  | 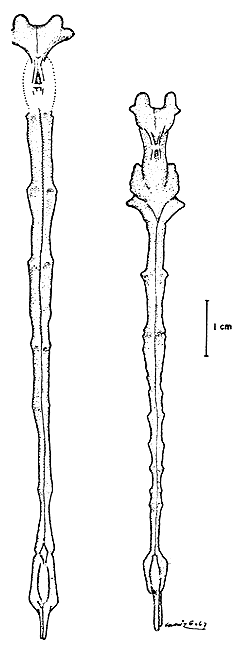 | 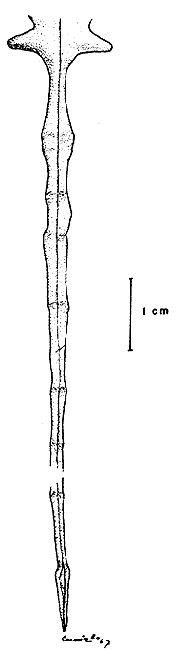 |
Fig. 7 Variación estacional en el ovario. Gónadas en el mes de marzo, con gran desarrollo de los lóbulos. En la Fig. 13 se observa el aspecto microscópico. | Fig. 8 Gónadas, mes de junio. Aspecto microscópico en la Fig. 16. | Fig. 9 Gónadas en el mes de septiembre. Detalle microscópico en Fig. 22. | Fig. 10 Gónada, mes de diciembre. Obsérvese la Fig. 26. |
4.3 Acoplamiento
De acuerdo con observaciones realizadas en acuarios o en tanques, la cópula tiene lugar, generalmente durante la noche, sin fuente de iluminación cercana, poco después de que la hembra ha mudado. En esta etapa el macho presenta caparazón duro; sigue a una sola hembra, a la que se une ventralmente (Hudinaga, 1942) y en este momento se realiza la transferencia del espermatóforo portador de los espermatozoides. Este permanece en el receptáculo seminal de la hembra, pero al mudar ésta nuevamente, pierde también el espermatóforo, por lo que si la fecundación no se ha realizado requerirá nuevamente la transferencia del espermatóforo. Cárdenas (1952) dice que se podría pensar que los orificios genitales de la hembra permanecieran abiertos para recibir mejor la aportación de los productos sexuales masculinos a medida que los óvulos van siendo expulsados, puesto que el extremo anterior del espermatóforo queda muy próximo a tales orificios. Sin embargo, los espermatóforos permanecen en el receptáculo seminal, como se dijo antes.
5.1 Resultados del análisis microscópico de la gónada femenina de P. californiensis
Según King (1948), la evolución de la gónada en las hembras de P. setiferus comprende 5 estadios diferentes, que se suceden desde que la hembra se encuentra en estado juvenil hasta que alcanza la madurez total. A las distintas etapas de diferenciación corresponde un color característico, que va cambiando paulatinamente, según fue observado por Chapa (1956) en P. californiensis. En el caso de P. setiferus, King (1948) denomina los cinco estadios sucesivos de desarrollo del ovario de la siguiente manera: no desarrollado, desarrollado, amarillo, maduro y gastado. En términos generales, en las hembras de P. californiensis estudiadas se observaron estas cinco etapas evolutivas.
A continuación se describen, mes por mes, los cambios observados en el ciclo gonadal a lo largo del año.
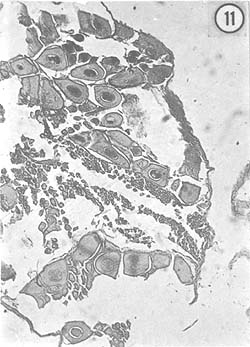
Enero: En general, la gónada de los ejemplares observados presentó aspecto de completa gravidez, con el color anaranjado intenso que es característico de esta etapa. Las preparaciones histológicas mostraron que la gónada está ocupada casi completamente por óvulos residuales. Además, en algunos animales se observaron cantidades apreciables de células epiteliales germinales, más o menos organizadas dentro del folículo. En ciertos ejemplares se observaron cuerpos periféricos en el citoplasma de los óvulos que indican maduración. La Fig. 11, seleccionada para ilustrar lo que se observó en este mes, muestra óvulos de aproximadamente 100 μ de diámetro mayor.
Febrero: Macroscópicamente, el ovario presenta una estructura semejante a la del mes anterior, tanto en lo que se refiere a tamaño como a color. Microscópicamente, la característica principal es la presencia de ovocitos en crecimiento, con una organización característica en los lóbulos del ovario. Los óvulos residuales están rodeados por células nutricias; se observaron escasos óvulos con cuerpos periféricos en el citoplasma. La Fig. 12 muestra la disposición de los ovocitos, que miden aproximadamente 27μ de diámetro mayor.
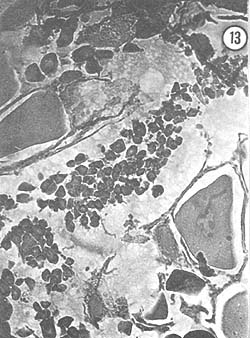
Marzo: Macroscópicamente, los ovarios no muestran grandes diferencias con respecto a lo que se observó en los meses anteriores. En términos generales tienen el mismo color anaranjado intenso, aunque el tamaño es mayor, pues ahora ocupan casi todo el espacio dorsalmente disponible en el cuerpo del animal. Histológicamente, se observó como característica principal que los ovocitos se agrupan en columna; están en activo crecimiento, presionando a los óvulos residuales hacia la periferia del lóbulo del ovario; los óvulos residuales son escasos; algunos ejemplares presentan cuerpos periféricos en el citoplasma de los óvulos. La Fig. 13 muestra el agrupamiento en columna de los ovocitos, que miden aproximadamente 45 μ; a los lados se observan óvulos residuales de 100 μ de diámetro mayor, aproximadamente, situados en la periferia del lóbulo.
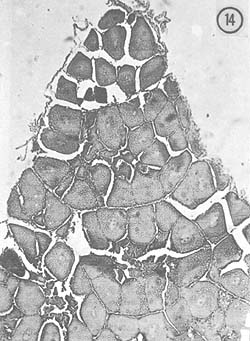
Abril: Durante este mes los ovarios ocupan generalmente todo el espacio dorsal en el cuerpo del animal, aunque se observaron también ejemplares con ovarios menos desarrollados, de color amarillo claro. Microscópicamente, se sigue notando en conjunto y como característica distintiva de este mes, el crecimiento de los ovocitos; también se observan óvulos con cuerpos periféricos, y algunos óvulos residuales. En la Fig. 14 se observan óvulos maduros, con diámetro mayor aproximado de 128 μ.
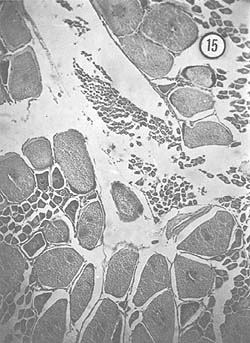
Mayo: En este mes la gónada está más desarrollada; generalmente es de color anaranjado, aunque haya ejemplares que la tienen de color verdoso. Microscópicamente, se observó como característica principal que los ovocitos presentan cierto ordenamiento dentro de los lóbulos del ovario, distribuyéndose en forma circular. A semejanza de lo que se observó en los meses anteriores, se presentan zonas de epitelio germinal, con células dispuestas en forma de columna. Algunos ejemplares presentan escasos óvulos, óvulos residuales y otros con cuerpos periféricos citoplasmáticos; estos últimos son relativamente abundantes. En la Fig. 15 se observan las diferentes características mencionadas con respecto al ordenamiento de ovocitos, que miden aproximadamente 170 μ. Se observan zonas en que se disponen en columnas, siendo su diámetro de 46 μ, aproximadamente.
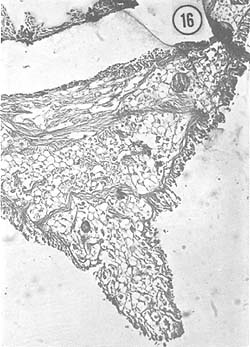
Junio: En la mayoría de los ejemplares los ovarios muestran coloración blancoamarillenta, y aunque la talla es menor que el promedio de longitud total del mes de enero, se ve que el ovario es fláccido y comienza a retraerse. En los ejemplares observados, la característica típica es la presencia de grandes óvulos residuales, rodeados de ovocitos; algunos ejemplares ya habían desovado y no mostraron óvulos residuales en esta parte del lóbulo, sino solamente las paredes que los contenían. Todavía pueden hallarse ejemplares con óvulos que tienen cuerpos periféricos citoplasmáticos. En la Fig. 16 se observa la parte posterior del ovario, en su porción terminal abdominal.
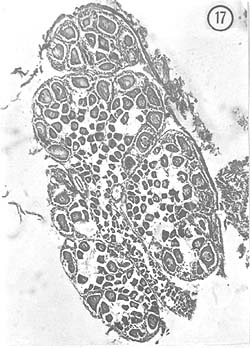
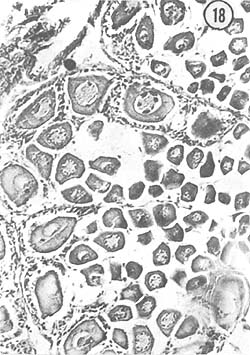
Julio: Durante el mes de julio las hembras presentaron ovarios poco desarrollados de color amarillento; aunque ocupan dorsalmente todo el cuerpo del animal, su diámetro es muy pequeño. Característicamente se observa el crecimiento de ovocitos a partir de zonas de proliferación; estos ovocitos llenan espacios considerables en los lóbulos del ovario. Algunos ejemplares presentan óvulos residuales de 78 μ de diámetro, así como óvulos con cuerpos periféricos en el citoplasma. La Fig. 17 muestra la disposición de los ovocitos (de aproximadamente 30 μ de diámetro mayor) en el ovario, y en la Fig. 18 se aprecia un detalle de los ovocitos rodeados por células nutricias.
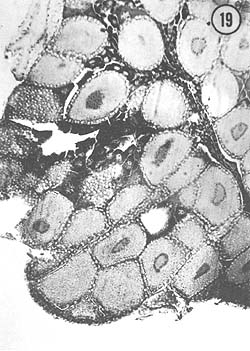
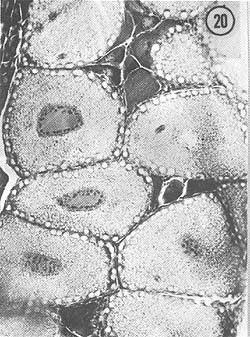
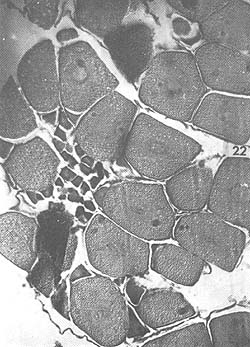
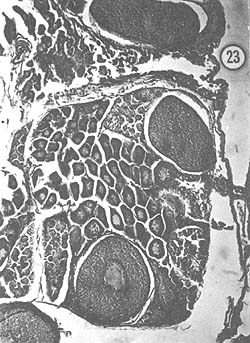
Agosto: Los ovarios, de mayor tamaño que en el mes anterior, presentan coloración amarilla, aunque algunos son anaranjados. La característica fundamental es la presencia de grandes óvulos (194 μ) con cuerpos periféricos bien desarrollados; el crecimiento de los ovocitos (138 μ) es también notable. En algunos ejemplares se observan diversos tipos de células, que diferencian zonas de proliferación del epitelio germinal y zonas de óvulos maduros. Son escasos los óvulos con núcleo involucionado durante este mes. En la Fig. 19 se observan óvulos grandes con cuerpos periféricos, así como el crecimiento notable de ovocitos. En la Fig. 20 se aprecia un detalle de varios óvulos con sus cuerpos periféricos citoplasmáticos.
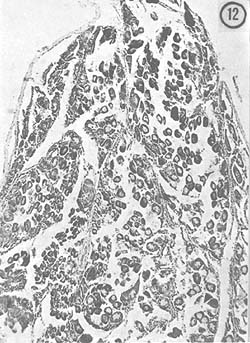
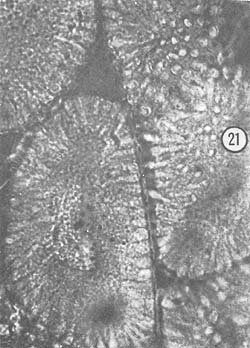
Septiembre: El tamaño de la gónada es menor que en el mes anterior, de color predominantemente blanco-amarillento. La característica principal es que los ovocitos (36 μ) están en posición central y son abundantes. También se observaron óvulos con núcleo involucionado (250 μ). Algunos ejemplares muestran todavía óvulos con cuerpos periféricos en su citoplasma. En la Fig. 22 se observan los dos tipos de células descritas como características de esta etapa.
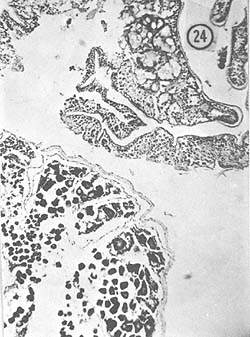
Octubre: El diámetro de la gónada femenina es mayor que durante el mes anterior, ocupa totalmente la porción dorsal y presenta color amarillo pálido. En las preparaciones se observó que los ovocitos ocupan determinadas zonas en el centro del lóbulo del ovario, pero también se presentan abundantemente óvulos residuales (210 μ) con núcleo involucionado y se ven zonas que muestran las paredes que contuvieron los óvulos. En estos ejemplares, descritos como desovados, se encuentran partes de activo crecimiento de ovocitos. En la Fig. 23 se observan óvulos con núcleo involucionado (210 μ) y los ovocitos (50 μ) llenando el lóbulo. En la Fig. 24 se observan 2 zonas diferentes, una de ovocitos en crecimiento y otra de reabsorción del tejido gonadal. Aparentemente los óvulos ya fueron expulsados de esta zona.
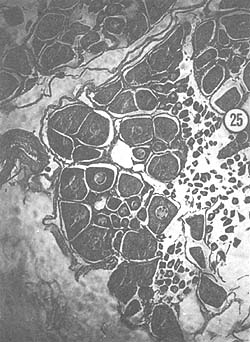
Noviembre: El ovario presentó también un color amarillo pálido aunque en algunos ejemplares se ha vuelto anaranjado. Los ovocitos (24 μ) han rodeado a los óvulos que quedan y los han empujado hacia la periferia del lóbulo del ovario. Los óvulos (90 μ) presentan núcleos y nucleólos abundantes. El número de óvulos presentes es relativamente grande, aunque por lo general se presentan diferentes tipos de células en diferentes grados de crecimiento. En las zonas de crecimiento se observan ovocitos dispuestos en columna. La Fig. 25 muestra estas diferentes zonas.
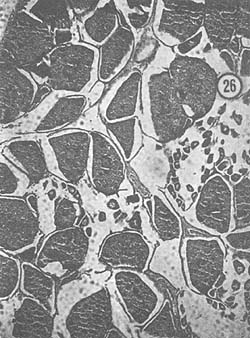
Diciembre: Las gónadas, en general, presentaron un color amarillo pálido. La característica fundamental es el intenso crecimiento de ovocitos en zonas restringidas de los lóbulos, aunque hay ejemplares que muestran óvulos reabsorbiéndose y otros con núcleos casi totalmente involucionados. Son escasos los ejemplares con cuerpos periféricos citoplasmáticos. En la Fig. 26 se observa el tejido gonadal reabsorbiéndose en algunas zonas y en otras el crecimiento de ovocitos que invade al lóbulo.
5.2 Resumen del ciclo gonadal
Se establecen las siguientes etapas de desarrollo gonadal:
a) Primera etapa de crecimiento de ovocitos
Comprende los meses de febrero, marzo y abril. Los ovarios son de color anaranjado, lo que no indica forzosamente madurez sexual, ya que la observación microscópica en el mes de abril mostró un incremento en el número de óvulos maduros. El crecimiento de los ovocitos se realiza a partir de zonas del epitelio germinal, observándose que aunque éstos persisten durante todo el año, hay una etapa de desarrollo de ovocitos, lo cual es más notorio en lo que se refiere al incremento en tamaño y cambio de posición que experimentan.
b) Etapa de maduración de óvulos y desove
Esta etapa comprende los meses de mayo, junio, julio y agosto. Los ovarios son de color anaranjado, que luego pasa a blanco y después a amarillo. Microscópicamente, en junio se observó un incremento en la proporción de hembras desovadas, con recuperación notable de ovocitos en julio. El ápice de esta etapa ocurre en agosto. Se refiere a la aparición de los cuerpos periféricos en el citoplasma de los óvulos. En las preparaciones microscópicas observadas se encontraron ejemplares con óvulos maduros, así como zonas de proliferación, con epitelio germinal en diferentes etapas evolutivas.
c) Segunda etapa de crecimiento de ovocitos
Se registra durante los meses de septiembre, octubre y noviembre. Los ovarios son de color blanco amarillento que pasa a amarillo, lo que indica se encuentran en una fase de crecimiento. Microscópicamente se observa un claro crecimiento de ovocitos, el cual ocurre gradualmente.
d) Etapa de degeneración de los óvulos
En los meses de diciembre y enero se observa un incremento de óvulos degenerados con núcleo involucionado, indicando que el tejido gonadal está reabsorbiéndose.
Sintetizando el proceso observado, se establece que a lo largo del año hay dos períodos claros de crecimiento de ovocitos, con otro marcado período de maduración; intermedios a estos dos se observan períodos de expulsión y de degeneración de los óvulos, haciéndose también notorio un período de recuperación celular, anterior al crecimiento de los ovocitos.
Macroscópicamente se observa que en los períodos de crecimiento de ovocitos, la gónada mantiene un color anaranjado. Durante el período de maduración, la gónada presenta una variación de color que va del anaranjado intenso hasta el amarillo.
Explicación de las Figuras 11 a 26
Fig. 11 - 91x. Enero. Gónada gastada. Ovulos en reabsorción. Obsérvese la disposición en columna de los ovocitos en el centro del lóbulo del ovario.
Fig. 12 - 91x. Febrero. Primera etapa de crecimiento de ovocitos. Nótese la organización de éstos, dentro del lóbulo del ovario.
Fig. 13 - 91x. Marzo. Ovocitos dispuestos en forma de columna, característicos de esta etapa de crecimiento. Los rodean óvulos en reabsorción que han sido empujados a la periferia del lóbulo del ovario.
Fig. 14 - 91x. Abril. Primera etapa de crecimiento de ovocitos, aunque es notorio también el aumento de óvulos maduros, como los que se aprecian en esta fotografía.
Fig. 15 - 91x. Mayo. Corresponde al inicio de la etapa marcada como maduración de óvulos.
Fig. 16 - 91x. Junio. Corte de ovario en la porción terminal mostrando una zona desovada.
Fig. 17 - 91x. Julio. Aspecto típico de un ovario en crecimiento de ovocitos. Compárese con la Fig. 12 y nótese cómo se trata de dos diferentes generaciones, por lo menos.
Fig. 18 - 226x. Julio. Detalle de la disposición que toman los ovocitos dentro de los folículos del ovario.
Fig. 19 - 91x. Agosto. Preparación histológica que representa típicamente la etapa de maduración, con óvulos maduros llenando todo el lóbulo del ovario.
Fig. 20 - 226x. Agosto. Detalle de la figura anterior; obsérvense los característicos cuerpos periféricos citoplasmáticos, índice de madurez de la gónada.
Fig. 21 - 355x. Agosto. Detalle de un óvulo, mostrando sus cuerpos periféricos.
Fig. 22 - 91x. Septiembre. Segunda etapa de crecimiento de los ovocitos. Nótese la presencia de núcleos involucionados en los óvulos en reabsorción.
Fig. 23 - 91x. Octubre. Estadio típico de crecimiento de los ovocitos. Obsérvense los escasos óvulos en reabsorción que se localizan en la periferia del lóbulo del ovario.
Fig. 24 - 91x. Octubre. Obsérvense dos diferentes zonas en una misma preparación histológica, perteneciente a un mismo ejemplo mostrando una porción desovada, y otra zona de activo crecimiento de ovocitos.
Fig. 25 - 91x. Noviembre. Ovocitos en crecimiento, rodeados por óvulos en reabsorción.
Fig. 26 - 166x. Diciembre. Gónada gastada. Obsérvese el núcleo involucionado en los óvulos en reabsorción.
 |  |
 |  |
 |  |
 |  |
 |  |
 |  |
 |  |
 |  |
CUADRO II
Datos condensados de las capturas analizadas
| Fecha | Captura no | Profundidad en brazas y metros | Temp.°C | Ejemplares no | Hembras | Machos | Longitud promedio hembras mm | Etapa gonadal característica (a) | Color de la gónada fijadà (b) | Fijador usado (c) |
| 21-8 -65 | 1 | 11(20) | 32 | 17 | 15 | 122 | M | Am | F | |
| 11-9 -65 | 2 | 17(31) | 30,0 | 38 | 20 | 18 | 113 | C | Ba | F |
| 15-10-65 | 3 | 10(18) | 48 | 25 | 23 | 117 | C | Am | F | |
| 30-11-65 | 4 | 32(58) | 50 | 27 | 23 | 116 | C | Am | F | |
| 16-12-65 | 5 | 20(36) | 56 | 30 | 26 | 116 | G | Am | B | |
| 19-1 -66 | 6 | 52 | 24 | 28 | 133 | G | A' | B | ||
| 15-2 -66 | 7 | 22(40) | 21,5 | 51 | 26 | 25 | 124 | C | A | B |
| 18-3 -66 | 8 | 22(40) | 24,0 | 49 | 25 | 24 | 132 | C | A | B |
| 22-4 -66 | 9 | 24,) | 50 | 30 | 20 | 137 | C | A | B | |
| 24-5 -66 | 10 | 36 | 32 | 4 | 128 | M | A | B | ||
| 17-6 -66 | 11 | 11(20) | 30,0 | 53 | 16 | 37 | 114 | M | Ba | B |
| 7-7 -66 | 12 | 30,0 | 53 | 29 | 24 | 105 | M | Ba | B |
(a) G - Gastada
C - Crecimiento de ovocitos
M - Maduración de óvulos
(b) A' - Anaranjado intenso
A - AnaranjadoBa - Blanco amraillento
Am - Amarillo
(c) B - Bouin-Hollande
F - Formol al 10%
El estudio de la anatomía macro y microscópica de los óganos reproductores de P. californiensis permite conocer la evolución que experimenta la gónada a través de sus diferentes etapas evolutivas.
En general, en los crustáceos es el complejo glandular localizado en el órgano X del seno glandular, el que aparentemente gobierna los ciclos reproductivos. El proceso está gobernado por hormonas gonadotrópicas producidas en el pedúnculo ocular, aunque en los camarones no se sabe si la glándula misma tiene funciones endocrinas como sucede en anfípodos e isópodos.
Como ocurre en los vertebrados, en los malacostráceos son factores genéticos los que gobiernan el desarrollo sexual de una soma indiferenciado y las células germinales, mediante hormonas sexuales. Como en los vertebrados hembras, el ovario de los crustáceos, en el momento de la producción del vitelo, secreta una hormona que prepara a la madre para la incubación (Charniaux-Cotton, 1960).
Según Giese (1959) la aparición de gametos maduros en las gónadas, es un método que permite determinar la etapa reproductora de un animal, obteniendo información citológica detallada, necesaria para definir las diferentes etapas en el ciclo gonadal. Este mismo autor compara otros métodos para determinar la estación de reproducción en algunos invertebrados marinos; tales métodos son: el desove, el número de larvas, la incubación de los huevecillos, o el tamaño relativo de las gónadas; sin embargo, se concluye que el método más seguro para determinar estaciones de reproducción en invertebrados marinos, es el desarrollado en este trabajo.
En el Cuadro II se observa la relación existente entre la apariencia macroscópica de las gónadas y la observada en las preparaciones histológicas.
Se determina que, para las localidades estudiadas, y en los ejemplares observados, en los estadios correspondientes al primer período de crecimiento de ovocitos, la glándula presentó como característica más marcada para esta etapa, un color anaranjado, índice de madurez. Esto se puede interpretar como que la glándula toma esta coloración aún antes de expulsar a los óvulos y permanece así algunos meses después de haberlo hecho. Los valores de longitud total de los ejemplares hembras observados, oscilan entre 113 y 137 mm, que corresponden a tallas de hembras adultas y no a ejemplares juveniles. Dentro de la etapa de maduración, se observó que hay relación entre la coloración de la gónada y lo que se observa en las preparaciones histológicas, puesto que en el mes de mayo se encontró una abundancia de hembras con óvulos mostrando cuerpos periféricos citoplasmáticos y, macroscópicamente, el color dominante en las hembras observadas era anaranjado, índice de madurez.
En los siguientes meses de este mismo estadio considerado, junio y julio, se registraron microscópicamente dos procesos bien marcados: desove y recuperación del tejido por un intenso crecimiento de ovocitos; macroscópicamente se observó un color blanco amarillento, índice de crecimiento de la gónada y en algunos casos relacionándola con los promedios de largos totales, se infiere inmadurez. El mes de julio presenta una relación directa, puesto que la longitud total promedio de las hembras estudiadas es 105 mm, que es el promedio más bajo obtenido en todos los meses estudiados y es cuando se encontró que el crecimiento de ovocitos es muy intenso; la coloración de las gónadas es, en términos generales, blanco-amarillenta y la longitud y diámetro de éstas son muy pequeños en relación con las hembras observadas en marzo o abril.
En el segundo período de crecimiento de ovocitos, se observó una coloración que varía desde el blanco-amarillento hasta el amarillo, presentando en estos meses (septiembre, octubre y noviembre), un promedio de longitud total de 113 a 117 mm que resulta menor que el del primer período de crecimiento de ovocitos. Esto va de acuerdo con lo observado por Cárdenas (1951), quien establece que las hembras de P. californiensis alcanzan su madurez sexual aproximadamente dentro del período de marzo a junio. Debido a que se está tratando en este estadio con hembras que no han desovado, y en el caso del primer período de crecimiento de ovocitos, se trata de hembras ya desovadas.
Dentro de la etapa de degeneración de los óvulos, la relación más directa encontrada entre las observaciones macro y microscópicas, fue en el mes de enero, en donde el promedio de longitud total de las hembras observadas resultó de 133 mm, de donde se infiere que se trata, en términos generales, de una muestra de una población que posiblemente ya había desovado.
Anderson, W.W. and M.L. Lindner, 1943 A provisional key to the shrimps of the family Penaeidae with special reference to American forms. Trans.Am.Fish.Soc., 73:284–319
Angelescu, V. y E. Boschi, 1959 Estudio biológico-pesquero del langostino de Mar del Plata, en conexión con la operación nivel medio. Buenos Aires, Servicio de Hidrografía Naval, H.1017:135 p.
Cárdenas, F.M., 1951 Los camarones del noroeste de México, D.F., Soc. Mexicana de Geografía y Estadística, 89 p.
Cárdenas, F.M., 1952 Descripción del espermatóforo de Penaeus stylirostris Stimpson. Revta Soc.mex.Hist.nat., 13:15 p.
Carranza, F.J., 1963 Los recursos marinos de México y su aprovechamiento. En Primera mesa redonda sobre problemas de la industria pesquera, 69 p. Publnes Inst. mex. Recurs. nat. renov.
Chapa, S.H., 1956 La distribución geográfica de los camarones del noroeste de México y el problema de las artes fijas de pesca. México, Dirección General de Pesca e Industrias Conexas, 87 p.
Charniaux-Cotton, H., 1960 Sex determination. In The physiology of crustacea, edited by T.H. Waterman, New York, Academic Press, vol. 1
Eldred, B., 1958 Observations on the structural development of the genitalia and the impregnation of the pink shrimp Penaeus duorarum Burkenroad. Tech.Serv. Fla St.Bd Conserv., (23):26 p.
Giese, A.C., 1959 Comparative physiology: annual reproductive cycles of marine invertebrates. A-Rev.Physiol., 21:547–71
Gutiérrez, O.T., 1965 Atlas pesquero nacional. Instituto Nacional de Invs. Biológico Pesqueras, 40 láminas
Holmes, S.J., 1900 Synopses of California stalk-eyed Crustacea. Occ.Pap.Calif.Acad.Sci., (7):262
Hudinaga, M., 1942 Reproduction, development and rearing of Penaeus japonicus Bate. Jap. J.Zool., 10(2):305–93
Keen, M., 1958 Sea shells of tropical West America. Stanford, University Press, 642 p.
King, J.E., 1948 A study of the reproductive organs of the common marine shrimp, Penaeus setiferus (Linnaeus). Biol.Bull.mar.biol.Lab., Woods Hole, 94(3):244–62
Lizárraga, S.M., 1964 Breves notas sobre la biología del camarón. Contr.Inst.nac.Invest. biol.-pesq., México, (12)
Núñez, F.R., 1954 The biology of Penaeus stylirostris Stimpson, a commercial species of shrimp of the west coast of México. Thesis, Stanford University, 41 p.
Parker, R.H., 1964 Zoogeography and ecology of some macroinvertebrates, particularly mollusos, in the Gulf of California and the continental slope of México. In Marine geology of the Gulf of California. Mem.Am.Ass.Petrol.Geologists, (3):331–76
Pérez-Farfante, I., I.J. Acosta y P.N. Alemany, 1961 Datos sobre la biología pesquera del camarón Penaeus duorarum Burkenroad. Ser.Estud Inst.cub.Invest.Tecnol., pp 76
Rioja, E., 1962 Caracteres biogeográficos de México y de Centro América. Revta Soc.mex.Hist. nat., 23:27–50
AGRADECIMIENTO
La autora da las gracias a los dibujantes L. Galaviz y J. Bermejo, por los dibujos, las gráficas y el mapa incluídos en este documento. De manera especial agradece la cooperación del señor Roberto Mercado Fuentes, por haber tomado todas las fotografías de este trabajo, excepto la fotografía No. 22 que fue hecha por la bióloga M.L. Sevilla, a quién le agradece también su ayuda. Finalmente, desea expresar su agradecimiento a todos los compañeros del Instituto Nacional de Investigaciones Biológico-Pesqueras que le hicieron oportunas recomendaciones con respecto al tema tratado.