Pour manipuler convenablement les graines, il faut connaître certains éléments de leur biologie. Quoique l'utilisation de semences en vue d'une régénération artificielle permette de contrôler dans une large mesure les conditions dans lesquelles elles sont récoltées, préparées, entreposées et traitées, les caractéristiques qui leur sont inhérentes ont évolué à la suite de nombreux millénaires d'adaptation à la régénération naturelle dans des conditions locales particulières. Une bonne connaissance de la phénologie de la floraison permet au récolteur de choisir la période et les méthodes de récolte des graines les mieux appropriées aux essences considérées. De même, savoir comment les graines se développent dans la nature est un atout incontestable lorsqu'il s'agit de les manipuler, de les entreposer et de les prétraiter.
Le présent chapitre consiste en un exposé très bref et simplifié de la biologie des graines des angiospermes et des gymnospermes. Il faut pourtant savoir que les détails du développement de la graine varient beaucoup d'un genre à l'autre. Le lecteur désireux d'en apprendre plus long à ce sujet pourra consulter des ouvrages classiques tels que ceux de Corner (1976), de Bhatnagar et Johri (1972), de Singh et Johri (1972), de Puritch (1972), de Allen et Owens (1972) ou de Boland et col. (1980). Il existe peu de descriptions détaillées du développement des graines des arbres forestiers tropicaux.
La graine est un organe reproducteur qui se développe à partir d'un ovule, généralement après fécondation. Les ovules sont produits tant par les angiospermes (plantes à floraison vraie) que par les gymnospermes (qui comprennent les conifères). Chez les angiospermes, les ovules sont entièrement enfermés dans l'ovaire, alors que chez les gymnospermes, les ovules sont “à nu” et généralement disposés par paires sur la face supérieure et près de la base de chaque écaille des cônes femelles. Comme les cônes ne s'ouvrent qu'au moment de la pollinisation et, plus tard, lors de la dissémination des graines, l'expression “à nu” est toute relative.
Le développement de la graine débute par la fécondation, c'est-à-dire l'union d'un noyau mâle haploïde provenant d'un grain de pollen et d'un noyau femelle haploïde à l'intérieur de l'ovule et la formation subséquente d'un nouvel organisme diploïde. La fécondation doit être précédée de la pollinisation, c'est-à-dire de l'arrivée d'un grain de pollen sur le stigmate de la fleur femelle chez les angiospermes ou à proximité du micropyle de l'ovule chez les gymnospermes. Il convient de bien faire la différence entre les deux processus distincts de la pollinisation et de la fécondation (Fritsch et Salisbury, 1947). Chez la plupart des angiospermes, l'allongement du tube pollinique est rapide et l'intervalle entre pollinisation et fécondation n'est que de quelques jours ou même de quelques heures. Chez quelques angiospermes (par exemple Liquidambar et certaines espèces de Quercus) et de nombreux gymnospermes (par exemple Pseudotsuga, Larix ou Picea), cet intervalle est de plusieurs semaines, voire de plusieurs mois, alors que chez d'autres espèces de Quercus et de nombreux Pinus, il peut atteindre 12 à 14 mois (Krugman et col., 1974; Kozlowski, 1971).
Au moment de la fécondation, un ovule d'angiosperme type consiste en une ou deux enveloppes protectrices - les téguments - et en un tissu central - le nucelle. Souvent, les téguments et le nucelle ne sont clairement différenciés qu'au niveau du micropyle, c'est-à-dire du pore minuscule dans lequel, chez de nombreuses espèces, le tube pollinique pénètre pour atteindre le nucelle. L'ovule est fixé à la paroi de l'ovaire par un filament, le funicule.
La méiose de la cellule mère dans le nucelle, suivie de plusieurs divisions cellulaires mitotiques, conduit à la formation du sac embryonnaire, une structure comportant sept cellules et huit noyaux haploïdes, qui occupe la partie centrale du nucelle (Chuntanaparb, 1975). Lorsque le tube pollinique atteint le sac embryonnaire, il libère deux gamètes mâles. L'un de ces gamètes s'unit à l'un des noyaux du sac embryonnaire - l'oosphère - pour former un zygote, qui se développe par la suite pour former la plante embryonnaire diploïde. L'autre gamète mâle s'unit à deux autres noyaux femelles - les noyaux polaires - pour former une cellule triploïde qui se transforme par la suite en endosperme, un tissu qui fait office de réserve alimentaire pour l'embryon en développement. Les cinq noyaux restants du sac embryonnaire (les deux synergides et les trois antipodes) ne jouent aucun rôle dans le développement de la graine. La fécondation de l'oosphère et la triple fusion avec les noyaux polaires sont l'une et l'autre nécessaires à la formation d'une graine viable.
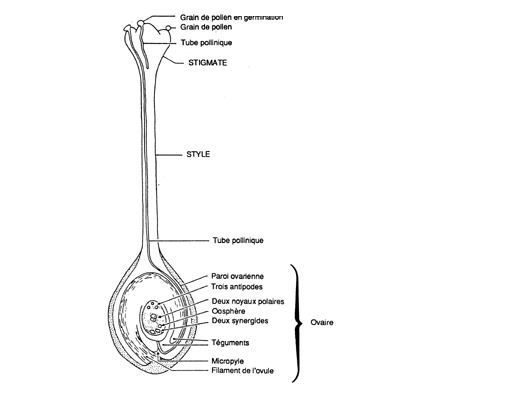 |
2.1 Coupe longitudinale d'un pistil type avant fécondation (USDA Forest Service).
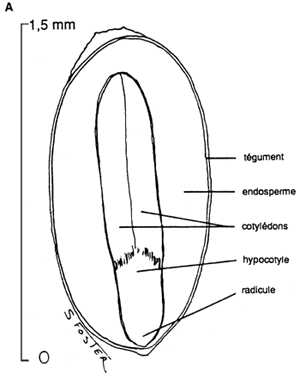 | 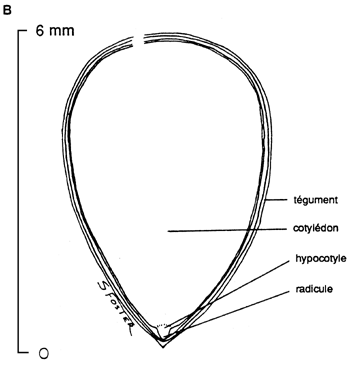 |
2.2 Coupes longitudinales de graines mûres de: (A) Paulownia tomentosa, avec un endosperme bien visible; et de (B) Tectona grandis, où l'endosperme a disparu et où le cotylédon occupe presque la totalité de la partie interne de la graine (USDA Forest Service).
| 2.3 Exemples de différentes sortes de fruits: | |
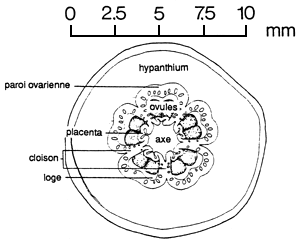 |  |
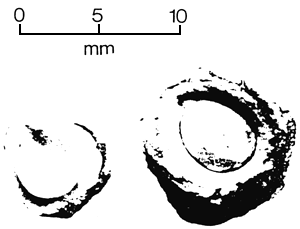
| (A) Coupe transversale d'une capsule d'Eucalyptus preissiana montrant les loges, l'axe, les placentas et les ovules (Division of Forest Research, CSIRO, Australie). | (B) Gousse ouverte avec graines d'Acacia aneura (FAO/Division of Forest Research, CSIRO, Australie). |
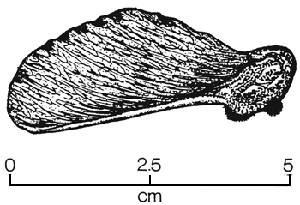 |  |
| (C) Samare de Triplochiton scleroxylon (Forest Research Institute du Nigéria). | (D) Noix (gland) de Quercus rubra (USDA Forest Service). |
 | 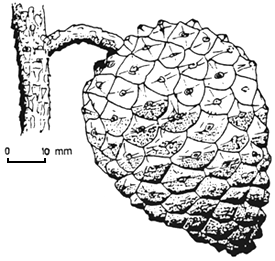 |
| (E) Drupe de Tectona grandis (S.K. Kamra). | (F) Cône de Pinus oocarpa (A.M.J. Robbins). |
La transformation de l'ovule fécondé en graine mûre se manifeste dans les divers tissus de la façon suivante (de l'extérieur vers l'intérieur):
Quoique la fonction de stockage à l'intérieur de l'embryon soit normalement remplie par les cotylédons, elle est totalement accomplie par l'hypocotyle chez Anisophyllea, Barringtonia et Garcinia; dans les graines de ces essences, l'hypocotyle gonflé remplit la cavité interne et les cotylédons sont atrophiés ou absents (Ng, 1978). C'est également le cas des genres Lecythis et Bertholletia (Lubbock, 1892), ce qui explique que le contenu comestible d'une noix du Brésil (Bertholletia excelsa) n'est ni de l'endosperme ni du cotylédon, mais de l'hypocotyle.
Chez certaines essences, l'embryon est encore petit et mal développé quand vient le temps de la dissémination des graines. Une fois la graine tombée, l'embryon a besoin d'une période supplémentaire dans des conditions d'environnement convenables pour qu'il parvienne à maturité et que la germination puisse commencer; c'est par exemple le cas de Fraxinus excelsior.
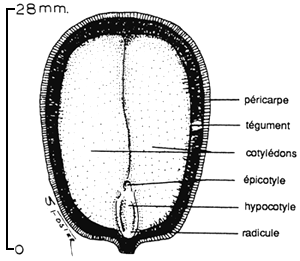
Dans le plus complexe des cas, la graine mûre peut donc être constituée de tissu diploïde issu de l'arbre mère (le tégument, testa et tegmen, et le périsperme), de tissu triploïde (l'endosperme) et de tissu diploïde issu de la nouvelle combinaison génétique propre à la descendance embryonnaire. Toutefois, le périsperme (presque toujours) et l'endosperme (assez souvent) peuvent être absents. Les constituants essentiels de toutes les graines sont l'embryon, l'enveloppe protectrice (le tégument) et une réserve de substances nutritives, qui peuvent être stockées, dans les cotylédons, l'hypocotyle, l'endosperme ou le périsperme.
Il arrive parfois que plusieurs embryons se développent dans une seule graine; cette polyembryonie a été observée chez plusieurs essences (Kozlowski, 1971). Cela reste toutefois exceptionnel.
Le développement de la graine fécondée s'accompagne normalement du développement du fruit. Dans le cas le plus simple, la paroi ovarienne s'épaissit pour former le péricarpe. Celui-ci peut être:
Chez certaines espèces, d'autres parties de la fleur, aussi bien que la paroi de l'ovaire, participent à la formation du fruit. Un bon exemple est fourni par les fruits à pépins, comme les pommes ou les poires, dont la plus grande partie est formée par le réceptacle charnu élargi, alors que le péricarpe forme le coeur. Après soudure, les bractées se développant au-dessous de la fleur - l'involucre - peuvent constituer une enveloppe protectrice partielle ou entière supplémentaire. Cette enveloppe peut être fine comme du papier, comme chez Tectona, ou plus épaisse et coriace, comme dans le cas de la cupule de Quercus. Certains fruits sont formés par coalescence d'une inflorescence entière, comme chez Morus, Chlorophora, Anthocephalus ou Artocarpus.
A l'inverse, chez plusieurs genres de sterculiaciées (par exemple Fimiana, Pterocymbium et Scaphium), la formation du fruit ne suit pas du tout la voie normale propre aux angiospermes. Peu après la fécondation, le carpelle (le follicule) se fend latéralement et se transforme en une grande aile membraneuse semblable à une écaille ou en forme de bateau; l'ovule fécondé se développe à nu près de la base ou à la base même du carpelle ouvert, comme cela se passe chez les gymnospermes. Ces fruits sont sans doute les plus primitifs de tous les fruits d'angiospermes (Corner, 1976). A maturité, les graines sont disséminées, fixées à leurs carpelles transformés en ailes.
L'intervalle entre la floraison et la maturation des graines et des fruits varie considérablement d'une espèce à l'autre, même du même genre. En ce qui concerne le genre Eucalyptus, cet intervalle varie de un mois chez E. brachyandra à dix à seize mois chez E. diversicolor (Boland et col., 1980). Chez la plupart des diptérocarpacées malaisiennes, il varie de deux à cinq mois (Tamari, 1976). Chez Tectona grandis, il faut 50 jours à compter de la floraison pour que le fruit vert atteigne sa taille maximale, mais 120 à 200 jours avant qu'il soit parfaitement mûr (Hedegart, 1975). Une étude de boutures de Gmelina arborea enracinées en pots réalisée au Nigéria a montré qu'à partir de l'apparition des boutons floraux, il fallait attendre 11 jours pour que les fleurs éclosent et 45 jours pour que les fruits parviennent à maturité (Okoro, 1978). Chez Pterocarpus angolensis, l'intervalle entre floraison et maturité du fruit est de 8 mois (Boaler, 1966). L'intervalle le plus court jamais enregistré entre la floraison et la maturité de la graine chez une essence tropicale à bois est apparemment de 3 semaines, délai relevé pour Pterocymbium javanicum (Ng et Loh, 1974). A l'opposé, chez certaines essences de Quercus tempéré, 18 mois séparent la floraison de la production de graines mûres.
Chez la plupart des espèces, la fécondation d'un ou de plusieurs ovules précède la formation du fruit. Toutefois, chez certaines espèces, des fruits se forment et parviennent à maturité sans formation d'une graine ou fécondation d'un ovule. Ces fruits, appelés fruits parthénocarpiques, se rencontrent chez plusieurs genres d'arbres forestiers, dont Acer, Ulmus, Fraxinus, Betula, Diospyros et Liriodendron (Kozlowski, 1971). La présence de fruits mûrs n'est donc pas invariablement l'indice de celle de graines parvenues à maturité, et il est encore moins possible de déduire le nombre de graines saines du nombre de fruits. Chez Tectona, le nombre de graines saines par fruit peut varier de 0 à 4 (Kamra, 1973), et l'on a enregistré des variations encore plus grandes chez d'autres genres.
Il existe donc une très grande variété de fruits chez les angiospermes. Cette variété s'explique en grande partie par la nécessité d'une dissémination des graines. Les jeunes plants ont souvent du mal à survivre et à croître sous l'arbre mère, en raison de l'absence de lumière et de l'intense compétition racinaire. La dissémination sur une vaste étendue permet presque à coup sûr à quelques graines de trouver des conditions propices à leur germination et à leur survie, même si la grande majorité périt par suite de conditions défavorables, de la compétition ou de leur destruction par les animaux ou les maladies.
La dissémination par le vent est facilitée lorsque les graines sont très légères et petites, comme chez Eucalyptus, ou que le tégument (Salix, Ceiba, Dyera) ou le péricarpe (Triplochiton, Pterocarpus, Koompassia, Casuarina, Fraxinus) comportent des ailes ou des poils servant à prolonger le vol. Il existe aussi des fruits ailés grâce à l'élargissement de sépales persistants (chez la plupart des diptérocarpacées) ou de pétales persistants (par exemple chez Gluta ou Swintonia) (Krugman et col., 1974; Ng, 1981).
La distance de dissémination des graines ou des fruits par le vent dépend non seulement de leur poids et de leur forme, mais aussi de la force des vents locaux ainsi que de l'exposition et du degré d'isolement des arbres mères. Des études portant sur les fruits ailés de Shorea contorta aux Philippines montrent que 90 pour cent des fruits ne s'éloignent pas de plus de 20 m du tronc de l'arbre mère (Tamari et Jacalne, 1984). D'après une compilation d'autres travaux sur les diptérocarpacées réunie par les mêmes auteurs, la plupart des fruits toucheraient le sol à moins de 30 m ou, au plus, de 40 m du tronc. En comparaison, les lourdes graines sans ailes telles que celles de Quercus crispula au Japon ne tombent pas au-delà des 2 à 3 m correspondant au périmètre de la cime, alors que 5 pour cent des légères graines ailées de Betula ermannii disséminées sous le vent à partir d'un rideau d'arbres mères conservés dans une zone d'exploitation peuvent parcourir une distance de 60 à 90 m (Konda, 1969, et Nakano et col., 1968, cités dans Tamari et Jacalne, 1984).
Par ailleurs, les fruits comestibles charnus et les graines arillées se prêtent fort bien à la dissémination par les oiseaux ou les mammifères. Après ingestion par les animaux, les graines, protégées par un tégument ou un endocarpe dur, traversent souvent sans dommage l'appareil digestif et sont déposées dans les fèces à une distance considérable du lieu d'ingestion. Dans de nombreux cas, les sucs digestifs contribuent même à la germination en amollissant le tégument. En Afrique, le calao est ainsi un agent de dissémination particulièrement efficace des graines de Maesopsis eminii. Le processus est parfois si efficace qu'il en devient embarrassant. Dans certains pays, les chèvres en pâture libre mangent les gousses de Prosopis et répandent les graines indistinctement sur de vastes étendues; l'excellente faculté germinative de ces graines et l'agressivité dont font preuve les jeunes plants peuvent alors transformer les plantes de ce genre en de redoutables indésirables. L'enfermement des chèvres en enclos et la récolte des graines sous contrôle strict permettent généralement de résoudre le problème. Dans d'autres cas, l'animal mange les fruits, mais rejette les noyaux ou les graines; toutefois, il transporte souvent le fruit à une certaine distance de l'arbre mère avant de laisser tomber les graines. Les rongeurs détachent les noix ou les graines des arbres et les stockent; beaucoup sont par la suite mangées, mais un certain nombre sont épargnées et peuvent germer.
Si le vent et les animaux sont les principaux agents de dissémination, l'eau contribue couramment à disséminer certaines essences poussant le long des cours d'eau, tout comme la gravité à l'égard des fruits gros et lourds tombant sur des pentes raides (Krugman et col., 1974).
Si les ovules de gymnospermes ont certains traits en commun avec les ovules d'angiospermes, ils s'en distinguent aussi par un certain nombre de différences. Dans un cône femelle type, on observe normalement un unique tégument protecteur, qui est partiellement soudé à l'écaille ovulifère portant la paire d'ovules. Sous ce tégument se trouve le nucelle qui, au moment de la fécondation, n'est nettement séparé du tégument qu'au niveau du micropyle, tout comme chez les angiospermes (Fritsch et Salisbury, 1947). La méiose qui se produit dans le nucelle, suivie par des divisions cellulaires mitotiques, conduit à la formation d'un tissu haploïde multicellulaire - le gamétophyte femelle. Au moment de la fécondation, il est davantage développé que le sac embryonnaire à huit noyaux des angiospermes et a en grande partie déplacé le nucelle. A son extrémité micropylaire, il s'est différencié en un ou plusieurs archégones, chacun contenant une grosse oosphère (Chuntanaparb, 1975).
Au moment de la fécondation, le tube pollinique libère, dans un archégone, deux noyaux mâles dont l'un fusionne avec l'oosphère. Le zygote qui résulte de cette union forme, en se développant, le nouvel embryon diploïde. Si le second noyau mâle avorte chez Pinus, il peut féconder un deuxième archégone chez d'autres genres, comme Cupressus (Fritsch et Salisbury, 1947). Il ne fusionne jamais avec les noyaux polaires femelles pour former un tissu triploïde analogue à l'endosperme des angiospermes; aucune graine de gymnosperme ne contient ce type de tissu. Pour des descriptions plus détaillées de l'embryogénie des gymnospermes, le lecteur se reportera aux ouvrages spécialisés (par exemple Singh et Johri, 1972).
La graine parvenue àmaturité est constituée d'une partie ou de la totalité des éléments suivants: (1) Le tégument ou testa, tissu diploïde formé à partir du tégument ovulaire. (2) Le périsperme diploïde, formé à partir du nucelle. Si, dans la plupart des cas, le périsperme est absorbé par le gamétophyte femelle et a totalement disparu lorsque la graine parvient à maturité, il constitue encore un tissu distinct reconnaissable chez Pinus pinea, par exemple. (3) Le gamétophyte femelle haploïde, qui sert d'organe de stockage de la nourriture destinée à l'embryon. Sa fonction est identique à celle de l'endosperme des angiospermes, et on lui attribue d'ailleurs souvent ce nom, quoique cet usage ait été désapprouvé (Bonner, 1984a). (4) L'embryon, qui comporte une radicule, des cotylédons, une plumule et un hypocotyle, tout comme l'embryon d'angiosperme. Le nombre de cotylédons varie d'un genre à l'autre et d'une espèce à l'autre dans un même genre, atteignant 18 chez Pinus, alors que les dicotylédons, qui comprennent la grande majorité des arbres angiospermes, n'en comportent que deux. Les constituants essentiels de l'embryon, de l'enveloppe protectrice et du tissu de stockage des éléments nutritifs sont présents dans toutes les graines des gymnospermes, comme dans toutes celles des angiospermes.
Quoique plusieurs archégones d'un même ovule puissent être fécondés, un seul embryon par graine parvient à maturité dans la grande majorité des cas. La polyembryonie se produit parfois, mais reste très rare chez la plupart des genres.
Après fécondation, le cône femelle, comme cela se produit chez plusieurs genres importants de gymnospermes, tels que Pinus, Picea, Pseudotsuga ou Araucaria, grossit et sa teneur en eau ainsi que ses réserves nutritives accumulées augmentent. Lorsque le cône approche de la maturité, sa teneur en eau diminue, ses réserves nutritives migrent vers les graines et il devient plus ou moins ligneux.
Chez Pinus, une fine membrane se détache de l'écaille ovulifère et se colle à la graine mûre, formant ainsi une aile (Fritsch et Salisbury, 1947). Chez Juniperus, les écailles du cône se développent ensemble pour former un fruit charnu semblable à une baie, alors que chez Podocarpus et Taxus, chaque graine produite séparément s'enveloppe partiellement d'une sorte de coupe de couleur vive, l'arille. Le cône ligneux est cependant le type de fruit le plus courant chez les gymnospermes.
Comme chez les angiospermes, l'intervalle entre la floraison et la dissémination des graines parvenues à maturité varie considérablement. Chez les pins, étant donné le très long délai précédemment mentionné entre la pollinisation et la fécondation, l'intervalle total entre la pollinisation et la maturité des cônes est habituellement de deux ans environ; en ce qui concerne les pins tropicaux, l'intervalle moyen est de 23 mois chez Pinus kesiya (Armitage et Burley, 1980) et de 18 à 21 mois chez Pinus oocarpa (Robbins, 1983b). Il s'établit à 16 mois chez Agathis robusta (Whitmore, 1977), peut atteindre 24 mois chez Araucaria cunninghamii (Walters, 1974) et varie de 21 à 24 mois chez Araucaria hunsteinii (Evans, 1982). Plusieurs genres des régions tempérées achèvent leur développement en une seule saison; c'est le cas de Pseudotsuga menziesii, chez qui l'intervalle entre pollinisation et maturité des cônes est de 5 mois (Allan et Owens, 1972).
Chez un certain nombre de genres de gymnospermes, les cônes femelles non pollinisés se développent en produisant des graines bien formées mais généralement vides. La parthénocarpie est courante chez Abies, Juniperus, Larix, Picea, Taxus et Thuja, mais elle est rare chez les pins (Kozlowski, 1971).
Chez les gymnospermes, la maturation et la dessication des cônes et des graines amènent les écailles à s'ouvrir et à libérer les graines. La dissémination est assurée par le vent et facilitée par la présence d'ailes chez certains genres comme Pinus. Chez certaines essences de pin, et notamment les pins “à cônes fermés” comme P. radiata, il existe habituellement un intervalle de plusieurs mois ou même de plusieurs années entre la maturation du cône et des graines et l'ouverture du cône permettant la dissémination. Dans quelques cas, comme chez les provenances intérieures de Pinus contorta, les cônes s'ouvrent seulement lorsqu'ils sont soumis à la chaleur intense de feux de forêt occasionnels. Par contre, les cônes des genres Abies et Araucaria se désagrègent aisément sur l'arbre quelques semaines après maturation.
La dissémination des graines par les animaux est moins fréquente, quoique les “baies” de Juniperus et les fruits charnus de Podocarpus en bénéficient. De plus, les graines des conifères des régions tempérées sont récoltées et stockées par les rongeurs et certaines peuvent germer avant d'avoir été mangées.
Certaines espèces de palétuvier sont vivipares, les graines germant avant d'être séparées de la plante mère. A l'opposé, les graines d'autres essences peuvent rester dormantes pendant de nombreuses années et germer à la faveur d'un événement rompant l'état de dormance. La question de la dormance est traitée plus loin dans le présent chapitre. Entre ces deux cas extrêmes existent de nombreuses sortes de graines susceptibles de germer peu de temps après la dissémination, pour peu que les conditions du milieu s'y prêtent.
Tout comme la fécondation amorce la transformation de l'ovule en graine, la germination transforme l'embryon contenu dans la graine en une plantule indépendante. Aux fins des essais de laboratoire, la germination est définie comme l'apparition et le développement, à partir de l'embryon contenu dans la graine, de ces structures essentielles qui sont révélatrices de la capacité de la graine de produire une plante normale dans des conditions favorables (Justice, 1972).
Au moment de leur maturité et de leur dissémination, de nombreuses graines ont perdu la plus grande partie de l'humidité accumulée pendant les phases précédentes. Par exemple, si la teneur en eau de l'embryon et du gamétophyte femelle de Pinus lambertiana atteint 50 pour cent (sur la base du poids frais) peu de temps après la fécondation, elle n'est plus que de 23 pour cent et de 38 pour cent respectivement au moment de la dissémination naturelle des graines (Krugman et col., 1974). La réduction de l'activité métabolique se traduit par un dessèchement de la graine, de sorte que l'embryon se trouve dans un état de repos temporaire qui peut, dans le cas des graines non dormantes, s'interrompre facilement pour peu que les conditions s'y prêtent. Ces conditions sont (1) une humidité adéquate, (2) une température favorable, (3) des échanges gazeux convenables et, pour certaines essences, (4) une luminosité suffisante (Krugman et col., 1974). Les valeurs optimales de ces différents facteurs varient considérablement selon les espèces, et il existe fréquemment des interactions entre eux. Quelques exemples de températures optimales pour diverses essences sont indiqués aux tableaux 9.1 et 9.2 du chapitre 9.
La germination consiste en trois processus qui se chevauchent:
une absorption d'eau, principalement par imbibition, qui provoque un gonflement de la graine et une rupture éventuelle du tégument; (2) une activité enzymatique et une augmentation des taux de respiration et d'assimilation, qui sont l'indice de l'utilisation des éléments nutritifs mis en réserve et de leur transfert vers les zones de croissance; et (3) une augmentation de taille et une division des cellules entraînant l'apparition de la radicule et de la plumule (Evenari, 1957, cité par Krugman et col., 1974).
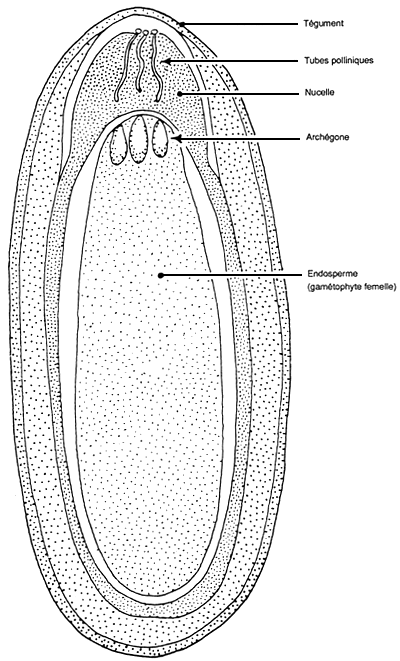
2.4 Coupe longitudinale d'un ovule de Pinus pendant la période de développement du tube pollinique précédant la fécondation (USDA Forest Service).
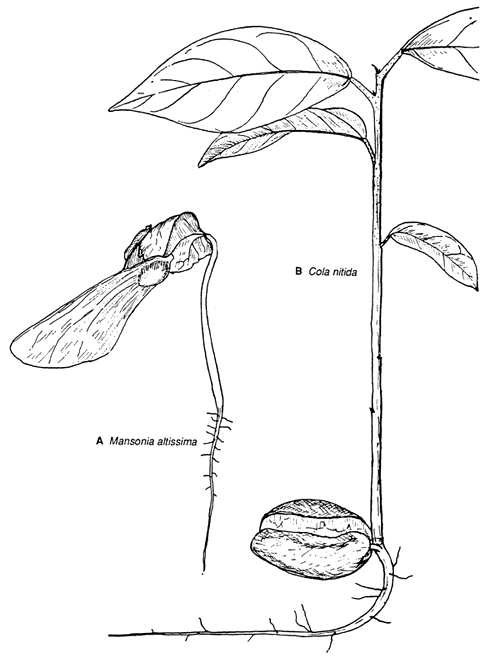
2.5 Exemples de germination chez deux sterculiacées d'Afrique de l'Ouest: (A) épigée chez Mansonia altissima; (B) hypogée chez Cola nitida (d'après De La Mensburge, 1966) (De La Mensburge, CTFT, Nogent-sur-Marne).
Dans la plupart des graines, la radicule de l'embryon est proche du micropyle, de manière à faciliter l'absorption d'eau. En gonflant, la radicule exerce une pression sur le tégument, qui commence généralement à se fendre à cet endroit. La radicule ainsi libérée se transforme en racine primaire qui s'enfonce dans le sol et produit bientôt des racines latérales. La suite du processus diffère selon que l'essence manifeste une germination épigée comme Pinus - l'hypocotyle s'allonge et soulève les cotylédons au-dessus du sol - ou hypogée comme Quercus - l'hypocotyle ne se développe pas et les cotylédons demeurent sur ou dans le sol. En cas de germination hypogée, les cotylédons peuvent avoir une simple fonction de mise en réserve ou encore une fonction haustellée (chez les espèces où la nourriture est stockée dans l'endosperme, comme les palmiers ou Scorodocarpus), alors qu'en cas de germination épigée, ils peuvent aussi remplir une importante fonction photosynthétique durant les premiers stades de croissance du jeune plant.
En cas de germination épigée, l'ancrage du jeune plant par la radicule est suivi d'un rapide allongement de l'hypocotyle, qui s'arque au-dessus de la surface du sol avant de se redresser; simultanément, les cotylédons et la plumule, entièrement débarrassés ou non du tégument, sont exposés à la lumière. La plumule se développe alors pour former la pousse primaire et les premières feuilles photosynthétiques. Chez le sous-type “durion” (Ng, 1978), l'hypocotyle s'allonge après s'être débarrassé des cotylédons encore enfermés dans le tégument (par exemple chez Durio zibethinus ou Strombosia javanica). Dans le cas d'une germination hypogée, les cotylédons restent in situ sous terre ou sur le sol pendant que la plumule s'allonge. S'il s'agit du sous-type “germination semi-hypogée” (Ng, 1978), les cotylédons sortent de terre mais demeurent sur le sol. Les deux principales sortes de germination, épigée et hypogée, et les deux sous-types, durion et semi-hypogée, sont le reflet des quatre combinaisons possibles de deux variables indépendantes, à savoir l'allongement ou non de l'hypocotyle et l'exposition au jour ou non des cotylédons. Ces quatre combinaisons se rencontrent dans les régions tropicales humides.
Même dans le cas des graines non dormantes, la vitesse de germination diffère considérablement d'une espèce à l'autre et même d'un individu à l'autre, pouvant varier de quelques jours à plusieurs semaines; une grande part de cette variation est due à des fluctuations du taux d'imbibition dans la phase initiale. Beaucoup d'essences forestières tropicales à forte teneur en eau et à tégument perméable lors de la dissémination des graines doivent impérativement germer dans les quelques semaines qui suivent la dissémination. Si les graines ne parviennent pas à trouver des conditions favorables dans ce délai, elles perdent leur viabilité et meurent.
Le terme “dormance” exprime un état dans lequel une graine viable ne germe pas, même si elle se trouve dans des conditions normalement considérées comme propices à la germination (température, humidité et environnement gazeux adéquats). Une graine viable est définie comme une graine susceptible de germer lorsque les conditions s'y prêtent, pour peu que toute dormance éventuelle ait été levée (Roberts, 1972).
Dans la nature, la dormance sert à protéger les graines de conditions temporairement propices à la germination, mais qui ne durent pas et redeviennent rapidement néfastes à la survie des jeunes plants. Ainsi, un tégument relativement imperméable à l'humidité empêche la germination à la suite des averses qui peuvent survenir au milieu d'une longue saison sèche, mais la permet pendant la saison des pluies. Dans la zone tempérée, la dormance embryonnaire qui ne peut être levée que par une exposition aux basses températures facilite la germination printanière tout en empêchant la germination automnale, qui donnerait naissance à de jeunes plants incapables de survivre aux rigueurs de l'hiver.
On a observé que l'intensité de la dormance variait selon la latitude et la provenance et qu'elle différait d'une année à l'autre, même chez des graines issues du même arbre mère. Il existe aussi une dormance différentielle à l'intérieur d'une même espèce ou d'un même lot de semences, qui a pour effet d'échelonner la germination sur une période de temps plus ou moins longue. Ainsi, alors que 50 pour cent environ des essences de la flore ligneuse de Malaisie achèvent leur germination en moins de six semaines, ce qui limite fortement l'échelonnement, certaines essences telles que la légumineuse à graines dures Parkia javanica ont une période de germination qui peut varier d'une semaine après semis pour les graines les plus précoces à deux ans pour les plus tardives (Ng, 1980). La dormance différentielle et la germination échelonnée contribuent à éviter une éventuelle destruction massive des cultures semencières à la suite d'une catastrophe climatique exceptionnelle ou d'une attaque de ravageurs isolée.
Dans la nature, un certain nombre de facteurs externes peuvent contribuer à lever plus ou moins rapidement la dormance tégumentaire, parmi lesquels les alternances de chaleur et de froid ou d'humidité et de sécheresse, le feu et l'activité des animaux, des organismes du sol, des champignons et des termites et autres insectes. La dormance due à l'immaturité embryonnaire sera interrompue pour peu que l'embryon dispose du temps nécessaire et des conditions appropriées à sa maturation, une fois la graine tombée.
Quoique les mécanismes exacts de la dormance physiologique de l'embryon et des processus qui peuvent y mettre un terme aient fait l'objet de nombreuses études, leurs causes profondes sont encore mal connues (Krugman et col., 1974). Il semble cependant que les hormones promotrices de croissance, dont la gibberelline est un exemple bien connu, et les hormones inhibitrices de croissance agissent conjointement sur le maintien ou l'interruption de la dormance. Sous les climats tempérés, l'équilibre entre inhibiteurs et promoteurs de croissance est modifié par la combinaison d'une température basse et d'une forte humidité, maintenues sur une période de temps qui varie d'une essence à l'autre. Cette combinaison se rencontre naturellement pendant l'hiver, la saison la moins propice à la croissance. Elle induit alors des changements biochimiques dans l'embryon, qui conduisent à la suspension de la dormance, au réveil du métabolisme et de la croissance embryonnaire et, enfin, à la germination.
La recherche sur la physiologie des essences tropicales n'a malheureusement pas eu l'ampleur de la recherche concernant les essences de la zone tempérée. Rien ne permet de supposer que la combinaison d'une température basse et d'une forte humidité - qu'on appelle technique de “stratification” lorsque cette combinaison est appliquée artificiellement - aurait un quelconque effet sur les graines d'essences tropicales dotées d'une dormance embryonnaire (pour peu qu'il en existe). Dans les régions tropicales sèches, au contraire, une combinaison des conditions propres à la saison la moins favorable à la croissance - température élevée et faible humidité - semblerait mieux à même de lever la dormance et de provoquer la germination durant la saison des pluies suivante. En fait, la dormance tégumentaire semble par elle-même constituer une protection adéquate pour les essences des régions tropicales sèches.
Du point de vue du forestier, la dormance présente quelques inconvénients. La gestion efficace d'une pépinière souffre considérablement d'une germination retardée et irrégulière (Bonner et col., 1974). En conséquence, on a activement cherché à imaginer des traitements artificiels efficaces pour lever la dormance, de sorte que les semences puissent germer rapidement et uniformément sur les planches des pépinières. Ces traitements sont décrits au chapitre 8.
La dormance présente toutefois certains avantages. Outre qu'elle augmente les chances de survie dans la nature, comme nous l'avons vu précédemment, elle protège la graine contre les conditions temporairement défavorables qui peuvent survenir entre la récolte et l'entreposage. Il est vrai que les semences orthodoxes de grande qualité mais non dormantes, convenablement séchées et entreposées à la bonne température, ont souvent une longévité comparable à celle des graines dormantes pendant l'entreposage. Toutefois, la dormance offre une garantie contre la perte de viabilité pendant le transport et le traitement, à laquelle les graines non dormantes sont fortement exposées lorsque les conditions ne sont pas parfaitement favorables.
Les facteurs externes peuvent avoir un effet grandement préjudiciable tant sur la quantité que sur la qualité des semences cultivées. Les facteurs climatiques peuvent compromettre l'abondance de la floraison et donc, indirectement, de la production semencière. Il semble bien que des températures supérieures à la moyenne et une sécheresse modérée au printemps et au début de l'été provoquent la formation de boutons floraux abondants dans les régions tempérées (Krugman et col., 1974). Au Nigéria, les années favorables à la production de graines de Triplochiton scleroxylon font suite à un mois d'août particulièrement sec (30 pour cent ou moins de la pluviosité moyenne), ce mois correspondant à une diminution des précipitations entre les fortes pluies précoces et les fortes pluies tardives (Howland et Bowen, 1977).
Les cas plus extrêmes d'aberrations climatiques réduisent d'ordinaire la production de fleurs et de fruits. Dans les régions tempérées, les gelées printanières tardives tuent les fleurs ou les jeunes fruits, tout comme les températures anormalement élevées ou la sécheresse. Même si ces phénomènes ne provoquent pas la mort et la chute prématurée des fruits, ils provoquent souvent de nombreux avortements ultérieurs des graines. Des vents ou des averses de grêle particulièrement forts peuvent entraîner une destruction mécanique des fleurs ou des fruits. Une pluie continue au moment de la dissémination du pollen a un effet particulièrement néfaste sur la quantité de graines produites, que la pollinisation soit assurée par le vent ou les insectes. Les arbres du genre Tectona fleurissent pendant la saison des pluies et cela explique peut-être le faible taux moyen de fécondation (1 à 3 pour cent) enregistré en Thaïlande durant la période 1967–1972 (Hedegart, 1975). La pluie empêche les insectes polliniseurs de voler et détache les grains de pollen des stigmates avant que la germination ait pu avoir lieu. Une humidité permanente pendant la période de dissémination du pollen est considérée comme le principal facteur responsable de la médiocrité de la production semencière de Pinus merkusii en Indonésie et en Malaisie. D'après Tamari (1976), plus de 90 pour cent des fleurs de diptérocarpacées plantées en Malaisie ne donnent aucun fruit.
Les oiseaux, les mammifères, les insectes, les champignons et les bactéries causent tous des dommages au moment de la floraison et de la fructification. Les insectes sont probablement responsables du plus gros des pertes touchant le plus grand nombre d'essences. Par exemple, le charançon Apion ghanaense détruit chaque année une grande partie des fleurs et des graines de Triplochiton (Jones, 1975). Les larves de Pagyda salvaris peuvent détruire jusqu'à 90 pour cent des boutons floraux de Tectona en quelques années (Hedegart, 1975). Deux espèces de bruchidés du genre Amblycerus peuvent détruire de nombreuses graines de Cordia alliodora, mais il est possible de limiter les dégâts en récoltant les semences trois semaines avant leur chute naturelle (Tschinkel, 1967). Le charançon du genre Nanophyes peut détruire jusqu'à 60 pour cent des graines de Terminalia ivorensis (Lamb et Ntima, 1971). Les mineuses des cônes du genre Dioryctria endommagent environ 60 pour cent des cônes et des graines parvenus à maturité de Pinus elliottii et de P. palustris dans le sud des Etats-Unis (Krugman et col., 1974); aux Philippines, le même genre cause aussi de graves dommages aux graines de Pinus merkusii (Gordon et col., 1972). Au Queensland et dans les îles du Pacifique ouest, il arrive que les larves de Agathiphaga, un genre de papillon de nuit, détruisent plus de 50 pour cent des graines contenues dans les cônes de plusieurs espèces de Agathis (Whitmore, 1977). Les graines de nombreuses espèces de zone sèche des genres Acacia et Prosopis sont soumises aux attaques des larves de bruchidés (Armitage et col., 1980). Les oiseaux et les mammifères, et notamment les écureuils, peuvent consommer des quantités considérables de graines en quelques années, quoique leur action serve aussi à disséminer les graines. Si les pertes causées par les ravageurs et les maladies n'ont généralement guère d'incidence les années de production semencière abondante, elles peuvent entraîner un désastre les années où les conditions climatiques compromettent la floraison.