por
Alec G. Maule
y
Howard F. Horton
Departamento de Pesca y Fauna Silvestre, Universidad del Estado de Oregon
Corvallis, Oregon, Estados Unidos
Resumen
En la primavera y verano de 1980 y 1981 se estudió por primera vez una población de luciopercas exóticos (Stizostedion vitreum vitreum) en el embalse de John Day del río Columbia. La estimación retrospectiva de la talla hasta la horquilla caudal por grupos de edades de uno a ocho años daba 243,8, 368,2, 468,4, 515,6, 623,6, 664,2 y 700,7 mm respectivamente, que representan valores próximos al crecimiento máximo anteriormente registrado. Este rápido crecimiento va unido a una alta tasa de fecundidad (82 900 huevos por kg de peso corporal), y una madurez temprana (3 años). Se considera que estos valores extremos se registrarían en condiciones óptimas de temperatura ambiental y disponibilidad ilimitada de alimentos.
Abstract
The exotic walleye (Stizostedion vitreum vitreum) population in the John Day pool (reservoir) of the Columbia River was investigated for the first time in the spring and summer of 1980 and 1981. Backcalculated fork lengths-at-age for ages 1 through 8 were 243.8, 368.2, 458.4, 515.6, 623.6, 664.2 and 700.7 mm respectively, values which approach the highest growth previously reported. This rapid growth is accompanied by high fecundity (82 900 eggs/kg/body weight) and early age at maturity (3 years). We attribute these extreme values to optimal environmental temperatures and nonlimiting food supply.
1. INTRODUCCION
El lucioperca exótico (Stizostedion vitreum vitreum) está muy extendido en los Estados Unidos y el Canadá y ha sido objeto de estudio en la mayor parte de su zona de origin (Colby, McNicol y Ryder, 1979). Aunque su introducción en la región de la costa nord-occidental del Pacífico no está documentada, este pez piscívoro de agua fría se ha encontrado en el curso medio del río Columbia (Fig. 1) y aguas abajo del embalse de Bonneville. El lucioperca exótico del río Columbia ha interesado sobre todo por las posibilidades que ofrece a la pesca deportiva y por la influencia que tiene en las poblaciones nativas de salmónidos (Carlander, Campbell y Muncy, 1978; Brege, 1981).
La construcción de embalses ha hecho que el río Columbia se haya transformado en un río salpicado de represas de pequeño caudal cuyas características físicas (Tabla I) se aproximan mucho al modelo de hábitat ideal para el lucioperca americano propuesto por Kitchell et al., (1977). La biología de este pez en el río Columbia no ha sido investigada a fondo. El objetivo del presente studio era estudiar los aspectos de su desarrollo vital en el embalse de John Day. Se analizó de manera específica su edad y crecimiento, la relación peso/longitud, su fecundidad y su talla y edad en la época de la maduración comparandolo con los datos registrados en otras zonas en los que se desarrolla naturalmente este pez. Esta información será útil para el personal de organismos de desarrollo de recursos que toma decisiones relativos al lucioperca americano y proporcionará un conjunto de datos básicos importantes para ulteriores investigaciones de este pez en el río Columbia.
2. METODOS
Se capturaron luciopercas exóticas en los primeros 23 km (canal de desagüe) aguas abajo del embalse de McNary, en el embalse de John Day del río Columbia, a 45°55' de latitud norte (Fig. 1). El canal de desagüe es poco profundo (profundidad máxima = 11 m) y su corriente es más rápida que en el depósito de cabecera, zona en la que la captura de luciopercas fue muy limitada. Las operaciones de captura se llevaron a cabo del 2 de abril al 30 de septiembre de 1980 y del 30 de marzo al 30 de septiembre de 1981. En 1980 se capturaron ejemplares con redes de enmalle hundidas de 38,1 × 1,8 m que tenían una malla variable de 3,81-, 5,08-, 6,35-, 7,52-y 10.16 cm en posición estirada, o con una red de enmalle flotante de un solo filamento de 76,2 × 3,7 m con una dimensión de malla estirada de 15,25 cm. Todas las redes estuvieron tendidos 2,5 horas como máximo. En 1981 se utilizaron redes de enmalle y un barco de 6,15 m que lanzaba descargas eléctricas con un generador de 3 500 vatios y electródos instalados en la proa, utilizando una corriente continua intermitente de 1–4 A para capturar los luciopercas.
Se anotó la longitud hasta la horquilla caudal (LH, mm), el peso (g), el sexo y el grado de madurez (Eschmeyer, 1950) y se tomó una muestra de escamas de debajo del extremo de la aleta pectoral izquierda de cada individuo. Muchos autores han señalado la dificultad de determinar la edad de los luciopercas más viejos utilizando escamas (Carlander y Whitney, 1961; Campbell y Babaluk, 1979). En consecuencia, se tomó una submuestra de otolitos sagitales (n = 86) que se conservaron en una mezcla de glicerina y agua al 50:50.
Las muestras de escamas se colocaron entre un portaobjetos y un cubreobjetos de cristal para observarlas al microscopio y se examinaron utilizando un proyector de microfichas de 43 x. Se identificaron anillos utilizando los criterios descritos por Carlander y Whitney (1961). Se observó que la mejor forma de detectar los anillos en los otolitos sagitales era quemando todo el otolito con un mechero Bunsen, sumergiéndolo en aceite o alcohol y examinándolo con un microscopio disector.
Con frecuencia hubo que repetir la operación de quema hasta que aparecieran muy claramente anillos oscuros. Christensen (1964) propuso una técnica similar, pero quebrando el otolito quemado y examinando la sección. Los resultados fueron idénticos en un 92 por ciento en una observación por lo menos de otolitos y una observación de escamas, por lo que se dejaron de extraer otolitos.
La determinación de la edad del lucioperca americano se basó en las observaciones de escamas y otolitos. Después de determinar la edad, se midió el radio y la anchura de cada anillo de la escama (43X) aproximadamente a 45° de una línea que partía del punto central y recorria el campo anterior. En esa zona de la escama era mucho más fácil detectar los anillos debido a la concentración y anastomosis de los círculos en los campos laterales.
Se determinó retrospectivamente la anchura de cada anillo (es decir los años de la vida) partiendo de la hipótesis de una relación lineal cuerpo-escama (r2 = 0,69) y utilizando el método Fraser-Lee recomendado por Carlander (1982). Estas medidas de la longitud hasta la horquilla caudal se transformaron en valores de longitud total (LT) utilizando un factor de conversión de 1,06 LH, que es la mediana no ponderada de las relaciones LT/LH comunicadas por Colby, McNicol y Ryder (1979). Esta conversión permitió comparar más fácilmente los datos obtenidos con los de otras zonas.
En el período de desove de la primavera de 1981, se extrajeron los ovarios de 27 luciopercas hembras maduras que no habían desovado. Se conservaron los ovarios en una solución de Bouin y a continuación se calculó el número de huevos utilizando el método gravimétrico recomendado por Wolfert (1969). Se realizaron regresiones simples de las características del ciclo vital utilizando un programa estadístico interactivo de computadora.
3. RESULTADOS
3.1 Talla y peso
Se tomó una muestra de 250 luciopercas exóticas cada año, cuyas tallas se indican en la Fig. 2. La longitud hasta la horquilla caudal varió de 208 a 765 mm LH (220–810 mm LT) y estuvieron representados todos los grupos de tallas intermedias. La relación peso (P)/longitud (LH) en una muestra de 324 luciopercas americanos podría describirse mejor mediante la ecuación siguiente:
Loge P = -11,426 + 3,010 Loge LH (r2 = 0,966).
Las curvas y los puntos de intersección de ecuaciones de regresión análogas del pesotalla de los ejemplares capturados en 1980 respecto de los capturados en 1981 y de machos respecto de las hembras no eran muy diferentes al nivel P<0,01 (prueba F).
3.2 Edad y crecimiento
Los promedios de las tallas por edades de todos los machos y hembras calculados retrospectivamente se indican en la Tabla II. No hubo dificultad en detectar los anillos en las muestras de luciopercas viejos debido a su rápido crecimiento y vida aparentemente breve. Aunque las hembras más grandes que los machos en cada año de vida, la diferencia no es estadísticamente significativa hasta después del segundo año, y estos resultados ressponden a los obtenidos en otras zonas (Carlander y Whitney, 1961). El conjunto de las tallas calculadas retrospectivamente indica que las tasas de crecimiento determinadas en el presente estudio son unas de las mayores registradas (Colby, McNicol y Ryder, 1979).
3.3 Fecundidad y madurez
La fecundidad media de 27 luciopercas americanos de 520 a 764 mm de LH y 1 720 a 5 905 gramos de peso era de 82 900 huevos por kg de peso corporal-1 (Tabla III). La fecundidad aquí indicada es, como en el caso de los datos relativos al crecimiento, comparable a las mayores registradas en otras partes (Colby, McNicol y Ryder, 1979). Se observó que la fecundidad (FEC) guardaba una relación lineal con el peso del pez (P):
FEC = -28,100 + 93,8 P, r2 = 0,969
y una relación curvilínear con la longitud hasta la horquilla caudal (LH):
Loge FEC = -8,4 + 3,2 Loge LH, r2 = 0,905.
Los datos relativos a la madurez con arreglo a la edad, la talla y el sexo están contenidos en la Fig. 3. La mayor parte de los machos y las hembras habían alcanzado la madurez a los tres años. Sin embargo, en muchos estudios anteriores se indicaba que los machos maduraban antes que las hembras, y no era infrecuente encontrar machos maduros a los dos años (Colby, McNicol y Ryder, 1979). Los datos relativos a la madurez en relación con la longitud hasta la horquilla caudal indican un aumento más gradual que los datos relativos a la madurez con arreglo a la edad, e inexplicablemente los machos no estaban maduros en un 100 por ciento a ninguna talla (Fig. 3).
4. DISCUSION
La tasa de crecimiento de los luciopercas exóticas del embalse de John Day del río Columbia es casi igual a la más alta anteriormente señalada (Fig. 4). Además estos peces son muy fecundos (Tabla III) y maduran pronto (Fig. 3). Estas características del ciclo vital pueden deberse a la combinación de temperaturas favorables y la disponibilidad ilimitada de alimentos. Generalmente se registran tasas elevadas de crecimiento en poblaciones de latitudes más mericionales donde probablemente las temperaturas son màs elevadas y los períodos de crecimiento más largos. La Fig. 4 contiene información relativa al embalse de Norris en Tennessee (Stroud, 1949), el lago Gogebic en Michigan (Eschmeyer, 1950) y el lago la Ronge en Saskatchewan (Rawson, 1957), así como los valores altos y bajos de las longitudes con arreglo a la edad indicada por Colby, McNicol y Ryder (1979). En relación con la latitud del embalse de John Day (45°55'), el embalse de Norris está situado al sur (36°15'N), el lago la Ronge al norte (55°07'N) y el lago Gogebic aproximadamente a la misma latitud (46°47'N). En la Fig. 4 se indica la mediana de los días-grados de crecimiento por encima de 5°C (DGC> 5°C) (Colby y Nepszy, 1981) para cada zona como medida de la energía de los sistemas. Colby y Nepszy (1981) observaron que el crecimiento del lucioperca exótico estaba directamente relacionado con los DGC>5°C y que la gama óptima era de 2 500 a 4 000 DGC > 5°C. Aunque los DGC > 5°C en el emblase de John Day están dentro de esta gama, el crecimiento es mayor de lo que cabría prever utilizando esta variable.
La temperatura del agua puede ser el factor más importante en el crecimiento de los peces (Brett, 1979). Kitchell, Stewart y Weininger (1977) presentan un modelo bioenergético del crecimiento del lucioperca exótico e indican que los óptimos y máximos térmicos para el consumo en relación con el peso concreto son de 22°C y 27°C, respectivamente, y para la respiración en relación con el peso concreto de 27°C y 32°C respectivamente. Las temperaturas del agua del emblase John Day durante la época de crecimiento corresponden o se aproximan al óptimo térmico para el consumo y, tal vez lo que es más importante, no se acercan a los máximos térmicos para el consumo o la respiración (Tabla 1). Muchos lagos de las zonas septentrionales pueden no alcanzar los óptimos térmicos (Rawson, 1957; Swenson, 1977) y los lagos de las regiones meridionales o que se estratifican en el verano pueden superar los máximos térmicos (MacLean y Magnuson, 1977), por lo que no sólo se reduce el consumo, sino que también aumenta la respiración. Dendy (1948) comunicó que en junio de 1944 la temperatura de la superficie del agua del embalse de Norris era aproximadamente de 30°C y que el lucioperca exótico parecía preferir una temperatura de unos 24°C, aunque en estas zonas se registraban concentraciones de oxígeno <3,0 ppm. La temperatura del agua del lago la Ronge no superaba los 20°C (Rawson, 1957), lo que es muy inferior a los óptimos térmicos.
Se registran excepciones a la tendencia norte-sur del rápido crecimiento del lucioperca en sistemas de intensa explotación (Forney, 1965) y/o cuando ha disminuido la competencia interespecífica (Wolfert, 1969; Forney, 1977), con la consecuencia de incrementos de las tasas de crecimiento en función de la necesidad. La cantidad y calidad de los alimentos son factores importantes del crecimiento del lucioperca (Kelso, 1972; Kerr y Ryder, 1977; Kitchell, Stewart y Weininger, 1977) y la fecundidad (Colby y Nepszy, 1981). Schupp (1978) estudió el crecimiento del lucioperca exótico en varias zonas del lago Leech en Minnesota y observó que los luciopercas de las zonas en las que el crecimiento medio era mayor se alimentaban casi exclusivamente de percas americanas de menos de un año (Perca flavescens) mientras que los luciopercas más pequeños de las zonas de menos crecimiento se alimentaban de invertebrados y pequeños piscardos. Se ha observado (Maule y Horton, 1984) que aproximadamente el 99 por ciento del contenido (volumen) estomacal de los luciopercas del río Columbia eran peces (por ejemplo, cotos comunes y ciprínidos) y que el 61 por ciento de los luciopercas de la muestra contenían alimentos. Eschmeyer (1950) comunicó que el 89 por ciento del volumen del contenido estomacal de los luciopercas del lago Gogebic eran peces, pero no informó del porcentaje de estómagos vacíos. Dendy (1946) comunicó que el volumen del contenido de los estómagos de los luciopercas del emblase de Norris eran peces en un 99 por ciento, pero que solo el 45 por ciento de los peces examinados contenía algún alimento. Rawson (1957) estudió el lucioperca del lago la Ronge e informó que los peces comprendían el 97 por ciento del volumen del contenido estomacal y el 39 por ciento de los luciopercas examinados contenían algún alimento.
Colby y Nepszy (1981) afirman que la edad de la madurez está indirectamente relacionada con el crecimiento, pero que la fecundidad probablemente esté en función de la densidad de población y la disponibilidad de alimentos. Indican asimismo que la gran variabilidad de la fecundidad del lucioperca es un mecanismo por el que este pez puede ajustar la producción a las condiciones del medio ambiente. La Tabla III contiene datos sobre la fecundidad del lucioperca exótico del embalse de Norris (Smith, 1941), el lago Gogebic (Eschmeyer, 1950) y la zona occidental del lago Erie (Wolfert, 1969), siendo la más alta la comunicada por Colby, McNicol y Ryder (1979). Si se compara la tasa de crecimiento, el contenido del estómago y la fecundidad, parece que el lucioperca del curso medio del río Columbia dispone de alimentos más favorables que los de las otras zonas consideradas en el presente trabajo.
Hackney y Holbrook (1978) comunican la existencia de una raza de lucioperca meridional que se caracteriza por un rápido y gran crecimiento y una vida breve, y una raza septentrional caracterizada por un crecimiento lento y una vida larga. Indican que el rápido crecimiento del lucioperca observado después del embalse de las aguas de las zonas meridionales y la ulterior disminución de las tasas de crecimiento unos años después se debe al cambio de la raza meridional a la raza septentrional efectuado en el marco de programas de repoblación de luciopercas. Se han documentado las migraciones de luciopercas de menos de un año aguas abajo de los emblases de los ríos Columbia, (Brege, 1981), y suponiendo que este sea un medio de colonización del río Columbia por el lucioperca exótico, biológicamente es un proceso análogo al registrado en las aguas embalsadas que ya contienen poblaciones de luciopercas. Aunque no puede descartarse la posibilidad que las características extremas del historial de este pez reseñadas en ese trabajo sean el resultado de diferencias de estirpes genéticas, se consideramos que pueden explicarse por el carácter favorable de las temperaturas y la disponibilidad de alimentos abundantes y de buena calidad por esta especie exótica. Es preciso seguir realizando investigaciones sobre el lucioperca exótico del río Columbia para documentar su crecimiento y fecundidad.
5. BIBLIOGRAFIA
Brege, D.A., 1981 Growth characteristics of younr-of-the-year walleye, Stizostedion vitreum vitreum, in John Day Reservoir on the Columbia River, 1979. Fish.Bull.NOAA/NMFS, 78:567–9
Brett, J.R., 1979 Environmental factors and growth. In Fish physiology. Vol.8. Bioenergetics and growth, editado por W.S. Hoar, D.T. Randall y J.R. Brett. Nueva York, Academic Press, pp. 599–676
Campbell, J.S. y J.A. Babaluk, 1979 Age determination of walleye, Stizostedion vitreum vitreum (Mitchill), based on the examination of eight different structures. Tech.Rep. Can.Fish. Mar.Serv., (849):23 p.
Carlander, K.D., 1982 Standard intercepts for calculating lengths from scale measurements for some centrarchid and percid fishes. Trans.Am.Fish.Soc., 111:332–6
Carlander, K.D. y R.R. Whitney, 1961 Age and growth of walleyes in Clear Lake, lowa, 1935–57. Trans.Am.Fish.Soc., 90:130–8
Carlander, K.D., J.S. Campbell y R.J. Muncy, 1978 Inventory of percid and esocid habitat in North America. Spec.Publ.Am.Fish.Soc., (11):27–38
Christensen, J.M., 1964 Burning of otoliths, a technique for age determination of soles and other fish. J.Cons.CIEM, 29:73–81
Colby, P.J. y S.J. Nepszy, 1981 Variation among stocks of walleye (Stizostedion vitreum vitreum): management implications. Can.J.Fish.Aquat.Sci., 38(12):1814–31:139 p.
Colby, P.J., R.E. McNicol y R.A. Ryder, 1979 Synopsis of biological data on the walleye, Stizostedion vitreum vitreum (Mitchill, 1918). FAO Fish.Synop., (119)
Dendy, J.S., 1946 Food of several species of fish, Norris Reservoir, Tennessee. J.Tenn.Acad. Sci., 21:275–83
Dendy, J.S., 1948 Predicting depth distribution of fish in three TVA storage type reservoirs. Trans.Am.Fish.Soc., 75:65–71
Eschmeyer, P.H., 1950 The life history of the walleye, Stizostedion vitreum vitreum (Mitchill) in Michigan. Bull.Inst.Fish.Res.Ann Arbor, (3):99 p.
Forney, J.L., 1965 Factors affecting growth and maturity in a walleye population. N.Y.Fish Game J., 12:217–32
Forney, J.L., 1977 Evidence of inter-and intraspecific competition as factors regulating walleye (Stizostedion vitreum vitreum) biomass in Oneida Lake, New York. J.Fish.Res. Board Can., 34(10):1812–20
Hackney, P.A. J.A. Holbrook II, 1978 Sauger, walleye and yellow perch in the southeastern United States. Spec.Publ.Am.Fish.Soc., (11):74–81
Hjort, R.C., B.C. Mundy y P.L. Hulett, 1981 Habitat requirements for resident fishes in the reservoirs of the lower Columbia River. Final report. Portland, Oregon, U.S. Army Corps of Engineers Contract No. DACW57–79-C-0067
Kelso, J.R.M., 1972 Conversion, maintenance and assimilation for walleye, Stizostedion vitreum vitreum, as affected by size, diet and temperature. J.Fish.Res.Board Can., 29(8):118–92
Kerr, S.R. y R.A. Ryder, 1977 Niche theory and percid community structure. J.Fish.Res.Board Can., 34(10):1952–8
Kitchell, J.F., D.J. Stewart y D. Weininger, 1977 Applications of bioenergetics model to yellow-perch (Perca flavescens) and walleye (Stizostedion vitreum vitreum). J.Fish. Res.Board Can., 34(10):1922–35
Kitchell, J.F., et al., 1977 Percid habitat: the river analogy. J.Fish.Res.Board Can., 34(10):1936–40
MacLean, J.H. y J.J. Magnuson, 1977 Inferences on species interactions in percid communities. J.Fish.Res.Board Can., 34(10):1941–51
Maule, A.G. y H.F. Horton, 1984 Feeding ecology of walleye (Stizostedion vitreum vitreum) in the mid-Columbia River, with emphasis on the interactions between walleye and juvenile anadronous fishes. Fish.Bull.NOAA/NMFS, 82(2):411–8
Rawson, D.S., 1957 The life history and feeding ecology of the yellow walleye, Stizostedion vitreum, in Lac la Ronge, Saskatchewan. Trans.Am.Fish.Soc., 86:15–37
Schupp, D.H., 1978 Walleye abundance, growth, movements and yield in disparate environments within a Minnesota lake. Spec.Publ.Am.Fish.Soc., (11):58–65
Smith, D.G., 1941 Egg production of walleyed pike and sauger. Norris Reservoir fish differ from same species in other localities. Prog.Fish-Cult., 54:32–4
Stroud, R.H., 1949 Growth of Norris Reservoir walleye during the first twelve years of impoundment. J.Wildl.Manage., 13:157–77
Swenson, W.A., 1977 Food consumption of walleye (Stizostedion vitreum vitreum) and sauger (S. canadense) in relation to food availability and physical conditions in Lake of the Woods, Minnesota, Shagewa Lake and western Lake Superior. J.Fish. Res.Board Can., 34(10):1643–54
Wolfert, D.R., 1969 Maturity and fecundity of walleyes from the eastern and western basins of Lake Erie. J.Fish.Res.Board Can., 26(7):1877–88
Tabla I
Resumen de los datos limnológicos relativos al embalse de John Day del río Columbia contenidos en Hjort, Mundy y Hulett (1981). Todos los datos se reunieron en agosto de 1979, con excepción de las temperaturas en la superficie, que se tomaron en 1981
| Característica | Gama en el embalse de John Day | Gama en la zona de estudio |
| Velocidad del agua (m/seg) | 0.1–1.4 | 0.5–1.4 |
Profundidad media utilizando el método Secchi (m) | 1.0–2.2 | 1.5–1.7 |
O2 (ppm) disuelto superficie-fondo | 16.0-8.0 | 14.0-10.0 |
Temperatura superficial media Abr.–jul.–sept. (máxima) | 7.0–24.5-20.5(24.8) C | |
Perfil de temperaturas superficie-fondo | 22.0–20.8 C | 21.0–21.0 C |
| Anchura del embalse (km) | 0.8–4.2 | 0.8–1.8 |
Profundidad en el centro del embalse (m) | 11–48 | 11–20 |
| Longitud del embalse (km) | 120 | 23 |
Tabla II
Promedio de la longitud hasta la horquilla caudal calculada retrospectivamente LH, SE y crecimiento anual de los luciopercas capturados en el embalse de John Day del río Columbia, abril–septiembre 1980–81
| Edad | |||||||||
| Machos | 1 | 2 | 3a | 4a | 5a | 6a | 7a | 8 | |
| LH (mm) | 241.0 | 363.4 | 434.5 | 484.2 | 533.0 | 562.3 | 596.4 | ||
| SE | 2.4 | 3.4 | 5.7 | 7.1 | 9.0 | 10.2 | 6.8 | ||
| N (acumulativo) | 134 | 86 | 35 | 25 | 21 | 18 | 8 | ||
| Incremento (mm) | 241.0 | 122.4 | 71.1 | 49.7 | 48.8 | 29.3 | 34.1 | ||
| Hembras | |||||||||
| LH (mm) | 243.5 | 371.3 | 466.2 | 527.5 | 589.8 | 643.4 | 684.2 | 700.7 | |
| SE | 2.4 | 3.1 | 3.6 | 4.3 | 4.6 | 4.9 | 6.2 | 10.9 | |
| N (acumulativo) | 197 | 150 | 122 | 95 | 69 | 57 | 28 | 8 | |
| Incremento (mm) | 243.5 | 127.8 | 94.9 | 61.3 | 62.3 | 53.6 | 40.8 | 16.5 | |
| Conjuntob | |||||||||
| LH (mm) | 243.8 | 368.2 | 458.4 | 515.6 | 575.6 | 623.6 | 664.2 | 700.7 | |
| SE | 1.5 | 2.2 | 3.3 | 4.1 | 4.6 | 5.6 | 7.7 | 10.9 | |
| N (acumulativo) | 446 | 277 | 189 | 142 | 104 | 85 | 40 | 8 | |
| Incremento (mm) | 243.8 | 124.4 | 90.2 | 57.2 | 60.0 | 48.0 | 40.6 | 36.5 | |
a ♀ en relación con ♂ considerablemente diferente, P < 0,01, prueba t
b comprende algunos peces cuyo sexo no se determinó
Tabla III
Fecundidad del lucioperca exótico del embalse de John Day del río Columbia, 30 de marzo a 18 de Abril de 1981, en comparación con las cifras de fecundidad registradas en el embalse de Norris en Tennessee (Smith, 1941), el lago Gogebic en Michigan (Eschmeyer, 1950) y en la parte occidental del lago Erie (Wolfert, 1969)
| Lugar | N | Gamaa | Medianaa |
| Embalse de John Day | 27 | 69,000–101,000 | 82,900 ± 1550 (ISE) |
| Embalse de Norris | 28,400–32,700 | 29,700 | |
| Lago Gogebic | 34 | 57,900–67,800 | 61,800 |
Parte occidental del Lago Erie | 78 | 56,300–123,200 | 82,500 |
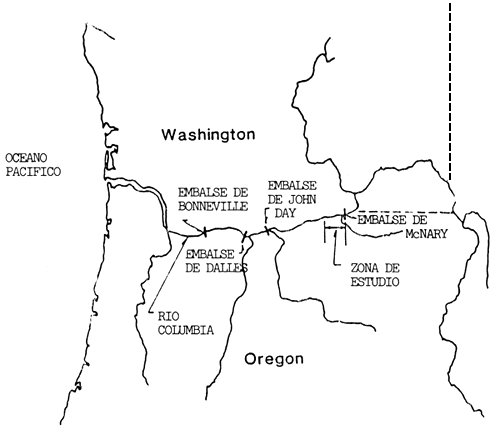
Fig. 1. Mapa del curso inferior y medio del río Columbia en el que se indica la ubicación de los principales embalses y la zona de estudio del embalse de John Day, en el que se capturaron luciopercas exóticos en 1980–81
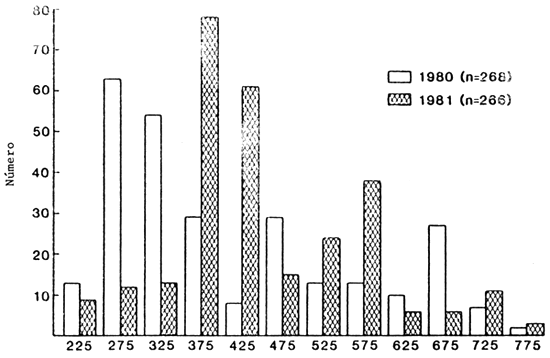
Longitud hasta la horquilla caudal (punto medio de incrementos de 50 mm)
Fig. 2. Distribución de la frecuencia de tallas de los luciopercas exóticos capturados en el embalse de John Day del río Columbia, abril–septiembre, 1980–81
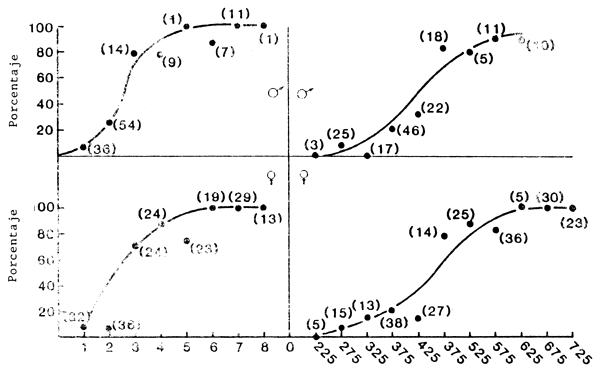
| Edad | Longitud hasta la horquilla caudal (punto medio de incrementos de 50 mm) |
Fig. 3. Porcentaje de luciopercas exóticos maduros con arreglo a la edad y la talla y al sexo de individuos capturados en el embalse de John Day del río Columbia, abril–septiembre, 1980–81. Las curvas se trazaron a ojo. (El tamaño de la muestra se indica entre paréntesis.)
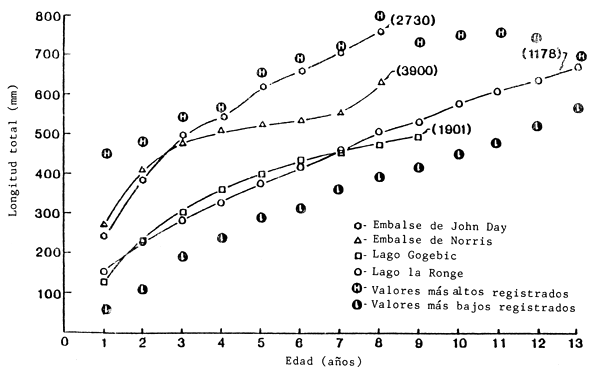
Fig. 4. Comparación de la longtitud con arreglo a la edad del lucioperca exótico en el embalse de John Day del río Columbia, el embalse de Norris en Tennessee (Stroud, 1949), el lago Gogebic en Michigan (Eschmeyer, 1950), el lago la Ronge en Saskatchewan (Rawson, 1957), y la cifra combinada de los valores altos y bajos comunicada por Colby, McNicol y Ryder (1979). Los números que figuran entre paréntesis indican la media de los días-grados de crecimento por encima de 5°C.