Table 12. Monthly sardine biomass at 10 stations in the Sanyati Basin. Extrapolated data for the basin and the whole lake are included
| Month | Biomass (kg ha-1) | Biomass (t) | ||
| Mean | Range | Sanyati Basin | Whole Lake | |
| July 1981 | 126 | 15–354 | 11 100 | 67 700 |
| August | 175 | 30–786 | 15 400 | 93 900 |
| September | 66 | 15–265 | 5 800 | 35 300 |
| October | 67 | 28–118 | 6 000 | 36 400 |
| November | 62 | 11–143 | 5 500 | 33 500 |
| December | 56 | 28–113 | 5 000 | 30 300 |
| January 1982 | 82 | 30–245 | 7 200 | 43 900 |
| February | 62 | 22–136 | 5 400 | 33 100 |
| March | No sample | |||
| April | 103 | 1–289 | 9 100 | 55 400 |
| May | 40 | 5–140 | 3 600 | 21 600 |
| June | 58 | 12–152 | 5 100 | 31 000 |
| July | 55 | 7–227 | 4 900 | 29 600 |
| August | 35 | 12–61 | 3 100 | 18 900 |
| September | No sample | |||
| October | 35 | 5–80 | 3 100 | 18 900 |
| Mean | 85.17 | 7 525 | 45 791 | |
Table 13. Clupeid biomass in three African lakes in relation to some physical characteristics
| Tanganyika | Kariba | Kainji | |
| Replacement time (yrs) | c. 10 000 | 3 | 0.25 |
| Conductivity (μS cm-1) | 566 | 80 | 73 |
| Mean depth (m) | 700 | 29 | 11 |
| Biomass (kg ha-1) | 529 | 85 | 18 |
Data from Henderson and Welcomme (1975), Coulter (1977), Herman (1978), Otobo (1979), Marshall et al. (1982)
Table 14. Instantaneous mortality coefficients (Z) for major inshore species. All data from Balon (1974) p. 439, except where otherwise indicated
| Mormyrus deliciosus | 0.37 | |
| Hippopotamyrus discorhynchus | 1.92 | |
| Mormyrus longirostris | 0.49 | |
| Hydrocynus vittatus | 0.52 | |
| Alestes imberi | 1.53 | |
| A. lateralis | 3.37 | |
| Micralestes acutidens | 2.69 | |
| Labeo altivelis | 0.58 | |
| Clarias gariepinus | 0.24 | |
| Heterobranchus longifilis | 0.39 | |
| Serranochromis codringtoni | 1.24 | (Table 11, mean) |
| Oreochromis mortimeri | 0.68 | (Table 53, mean) |
| Tilapia rendalli | 0.87 | (Table 30, mean) |
| Pharyngochromis darlingi | 4.05 |
Table 15. Mortality coefficient for H. vittatus. Data from Langerman (Unpubl.)
| Z | F | |||||
| Mwenda estuary 1981–82 | 0.58 | - | No fishing Z = M | |||
| Sanyati basin | 1979 | 0.65 | 0.07 | Fishing pressure increasing | ||
| 1980 | 0.69 | 0.11 | " | " | " | |
| 1981 | 0.73 | 0.15 | " | " | " | |
Table 16. Preliminary mortality coefficient (Z) for Limnothrissa (Unpubl.)
| Locality | Year | Relative Fishing Intensity (f) | Z (Monthly) | Z (Annual) | |
| Bumi estuary | 1980 | 0.1 | 0.48 | 5.76 | |
| " | " | 1981 | 0.2 | 0.48 | 5.76 |
| Sanyati Basin | 1978 | 1.0 | 0.54 | 6.48 | |
| " | " | 1979 | 1.6 | 0.63 | 7.56 |
| " | " | 1980 | 2.5 | 0.69 | 8.28 |
| " | " | 1981 | 2.7 | 0.68 | 8.16 |
Table 17. Mortality rates for clupeids in Lakes Kariba and Tanganyika
| Z (Monthly) | Z (Annual) | |||
| Kariba | Unexploited | 0.48 | 5.76 | |
| (Limnothrissa) | Exploited | 0.54–0.68 | 6.48–8.16 | |
| Tanganyika | Unexploited | (1) | 0.23 | 2.76 |
| (Stolothrissa) | Exploited | (1) | 0.46 | 5.52 |
| (2) | 0.43 | 5.16 |
Sources: Kariba - Marshall (Unpubl.)
Tanganyika - (1) Roest (1978)
(2) Chapman and van Well (1978)
Table 18. “Available yield” for commercially preferred species (kg ha-1yr-1). From Balon (1974) and Mahon and Balon (1977)
| Balon (1974) | Mahon and Balon (1977) | |
| M. longirostris | 15 | 2.5 |
| M. deliciosus | 14 | 7.9 |
| H. vittatus | 7 | 8.3 |
| L. altivelis | 2 | 1.0 |
| C. gariepinus | 7 | 3.2 |
| H. longifilis | 1 | 0.7 |
| S. codringtoni | 4 | 4.6 |
| T. rendalli | 12 | 12.0 |
| O. mortimeri | 101 | 103.4 |
| TOTAL | 163 | 143.6 |
Table 19. Estimated fish yields from inshore fish, Lake Kariba, using Gulland's yield equation. Mortality data from Balon (1974) differs from data used by Marshall et al. (1982). Biomass data taken from Table 11
| M | B | Y | |||||
| (Balon) | (Mitchell) | (Langerman) | (Balon) | (Mitchell) | (Langerman) | ||
| Mormyrus longirostris | 0.49 | 18 | 45 | 3.5 | 8.8 | ||
| Mormyrops deliciosus | 0.37 | 92 | 126 | 13.6 | 18.6 | ||
| Hydrocynus vittatus | 0.52 | 31 | 10 | 64 | 6.5 | 2.1 | 13.3 |
| Labeo altivelis | 0.58 | 6 | 4 | 53 | 1.4 | 0.9 | 12.3 |
| Clarias gariepinus | 0.24 | 52 | 13 | 5.0 | 1.2 | ||
| Heterobranchus longifilis | 0.39 | 14 | 7 | 2.2 | 1.1 | ||
| Tilapia rendalli | 0.87 | 97 | 22 | 190 | 33.8 | 7.6 | 66.1 |
| Oreochromis mortimeri | 0.68 | 56 | 53 | 25 | 15.2 | 14.4 | 6.8 |
| Serranochromis codringtoni | 1.24 | 13 | 12 | 33 | 6.4 | 5.9 | 16.4 |
| Total yield (kg ha-1 yr-1) | 87.6 | 60.6 | 114.9 | ||||
Table 20. Potential yield from Kariba sardine fishery, calculated by Gulland's equation (kg ha-1). Total yield is for entire lake area
| B | X | M | Y = XMB | Yield (t) | |
| 1981 (6 months) | 92 | 0.5 | 5.8 | 267 | 143 219 |
| 1982 (8 months) | 59 | 0.5 | 5.8 | 171 | 91 724 |
| 1981–82 | 85 | 0.5 | 5.8 | 247 | 132 491 |
Table 21. General growth data for major fish species in Kariba
(From Balon, 1974)
| Standard length at the end of growing season (mm) | ||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Mormyrus longirostris | 267 | 354 | 414 | 468 | 505 | 541 | 581 | |||||
| Mormyrops deliciosus1 | 183 | 277 | 368 | 454 | 538 | 604 | ||||||
| Hydrocynus vittatus | 196 | 306 | 380 | 423 | 462 | 488 | 523 | |||||
| Labeo altivelis | 79 | 129 | 192 | 242 | 282 | 294 | 365 | 381 | 400 | |||
| Clarias gariepinus | 82 | 131 | 183 | 254 | 319 | 383 | 443 | 505 | 548 | 610 | 648 | |
| Heterobranchus longifilis | 69 | 124 | 187 | 260 | 333 | 416 | 512 | 570 | 614 | 683 | 735 | 920 |
| Tilapia rendalli | 66 | 109 | 143 | 180 | 207 | |||||||
| Oreochromis mortimeri | 55 | 92 | 127 | 161 | ||||||||
| Serranochromis codringtoni | 42 | 87 | 130 | 179 | 216 | |||||||
1 Fork length from Joubert (1976)
Table 22. Number of fishermen and yield in two Zimbabwean fishing areas, Lake Kariba (data for September 1982)
| Area C.1 | Area C.2 | |
| Number of fishermen | 23 | 86 |
| Area of fishable water (ha) | 5 000 | 7 000 |
| Total catch (kg) | 8 900 | 11 200 |
| Catch/fisherman (kg) | 387 | 130 |
| Yield (kg ha-1) | 1.8 | 1.6 |
| Annual yield (kg ha-1)1 | 21.6 | 19.2 |
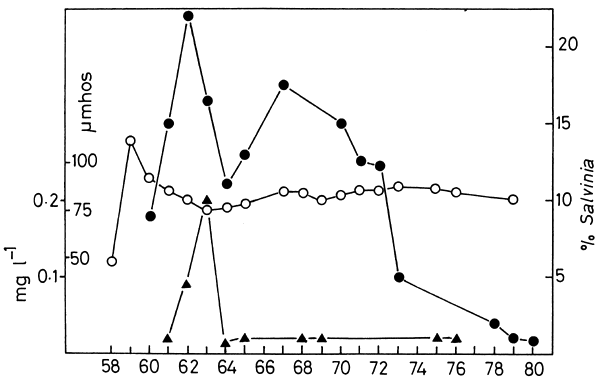
Fig. 1. The extent of Salvinia molesta on Lake Kariba in relation to conductivity and nitrate-nitrogen. ●, Salvinia; ο, conductivity; ▲, nitrate-nitrogen. (From Marshall et al., 1982)
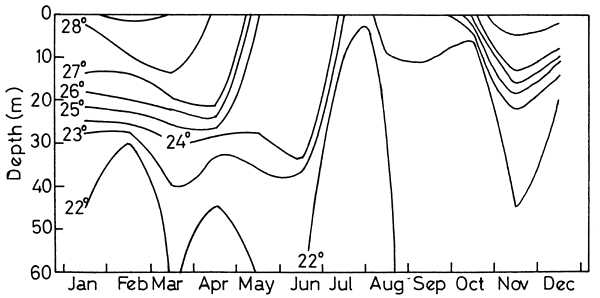
Fig. 2. Temperature profile (°C) for Lake Kariba, Sanyati Basin 1979 (From Marshall et al., 1982)
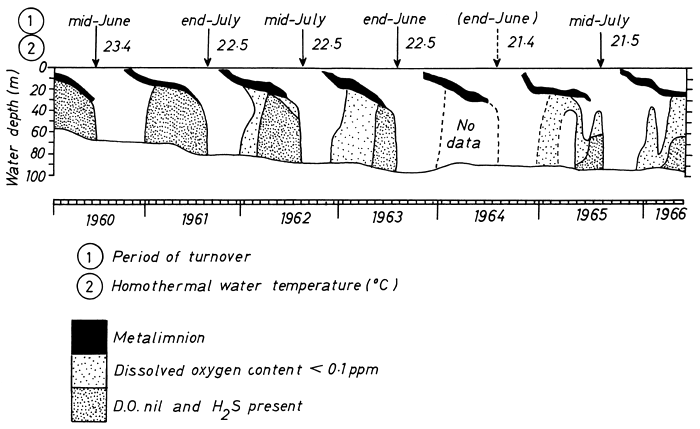
Fig. 3. Evolution of oxygen and hydrogen in Lake Kariba. (From Coche, 1974)
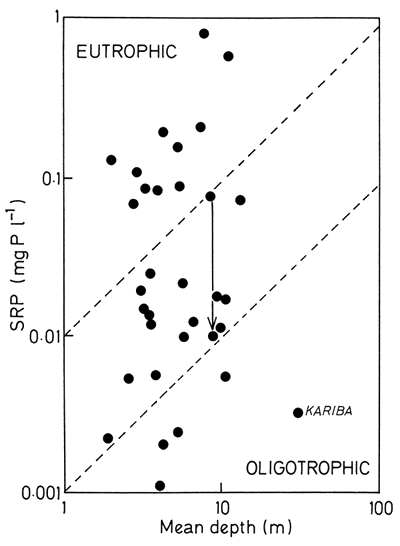
Fig. 4. Phosphorus in relation to mean depth in some Zimbabwean lakes. Redrawn from Thornton (1980)
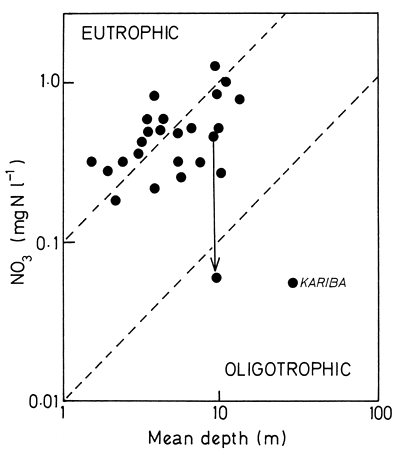
Fig. 5. Nitrate in relation to mean depth in some Zimbabwean lakes. Redrawn from Thornton (1980)
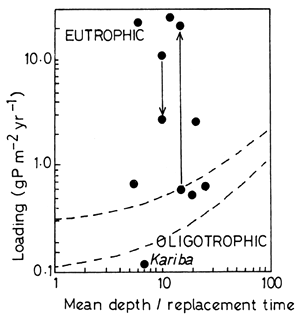
Fig. 6. A modified Vollenweider graphic presentation of phosphorus loadings to several southern African lakes. From Thornton (1980a), with data for Kariba added subsequently
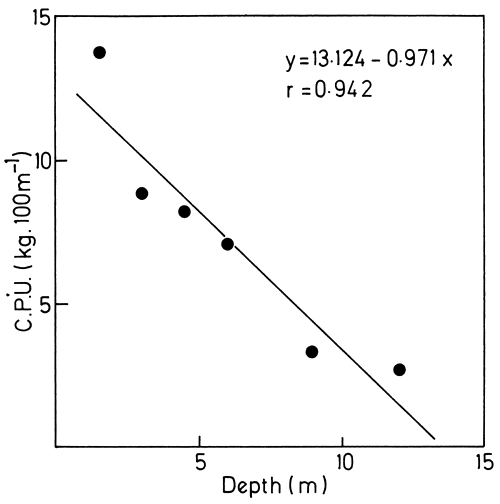
Fig. 7. The depth distribution of inshore fish species shown as C.P.U. of bottom-set gillnets. Redrawn from Coke (1968)
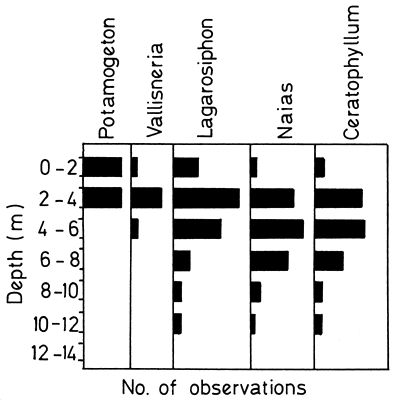
Fig. 8. Depth distribution of submerged plants in Lake Kariba. (From Kenmuir, 1980)
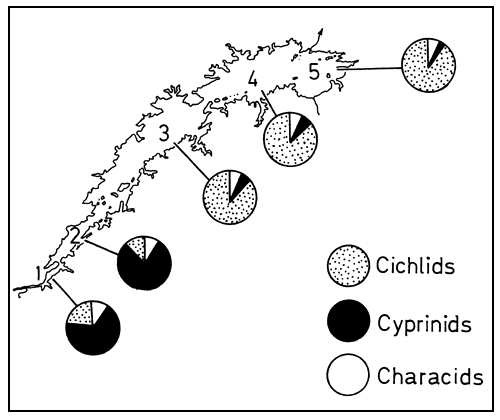
Fig. 9. The distribution of three major fish families in the main lake basins. Redrawn from Begg (1974)
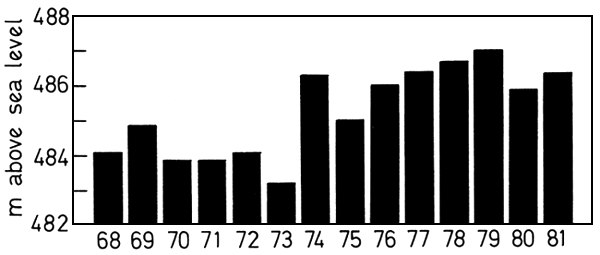
Fig. 10. Mean annual lake levels, 1968–1981
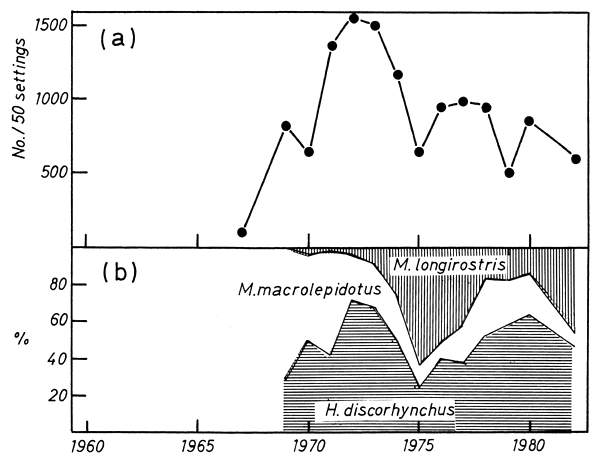
Fig. 11. (a) Numbers of mormyrids taken in 50 standard gillnet fleet settings, Lakeside Station
(b) Percent composition of main mormyrid species
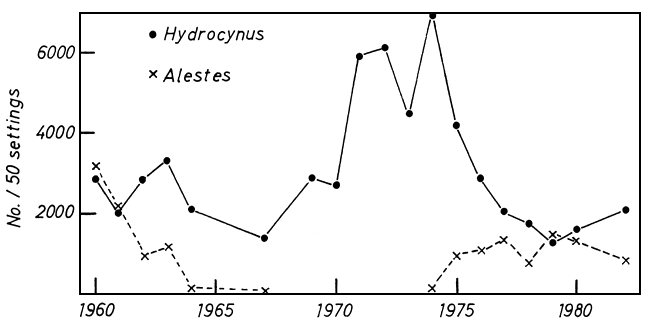
Fig. 12. Numbers of characids taken in 50 standard gillnet fleet settings, Lakeside Station
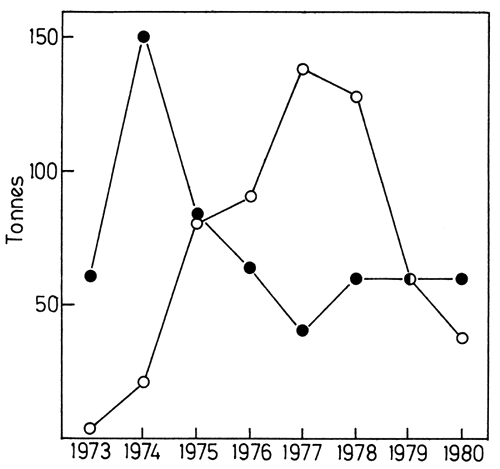
Fig. 13. Commercial catches of tigerfish 1973–1980. ●, inshore fishery; ο, pelagic fishery
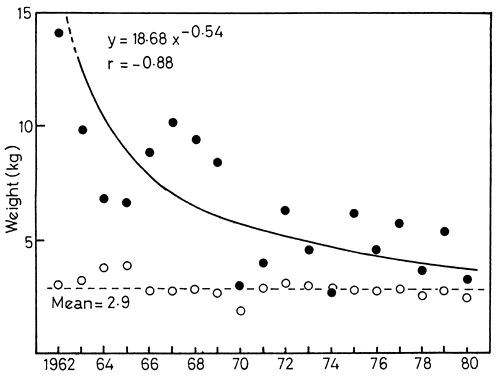
Fig. 14. Catch data from Kariba tigerfish tournaments 1962–1980. ●, catch per angler; ο mean weight of individual fish
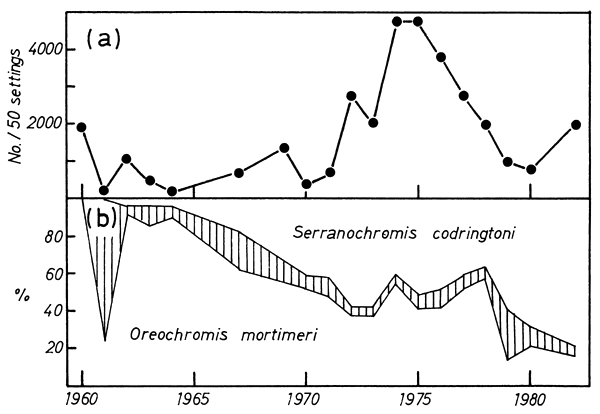
Note: shaded portion represents T. rendalli.
Fig. 15. (a) Numbers of cichlids taken in 50 standard gillnet fleet settings, Lake Side Station; (b) Percent composition of major cichlid species
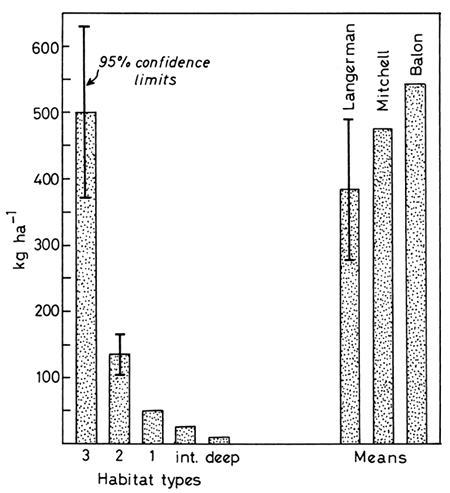
Fig. 16. Biomass estimates by various workers. Left-hand figure shows unpublished data from Langerman with biomass from various habitat types. Right-hand figure compares Langerman's data (all habitats) with estimates from Mitchell (1976) and Balon (1973)
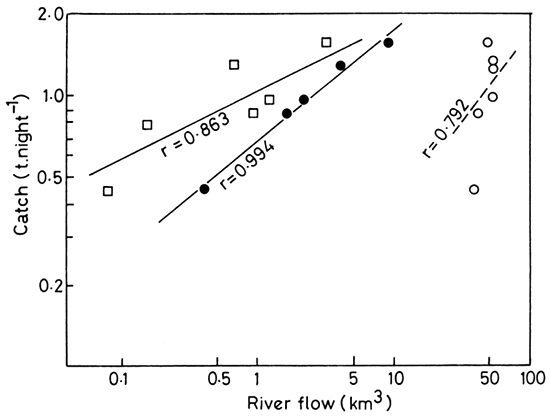
Fig. 17. The relationship between sardine catches and river flow, Sanyati basin, Lake Kariba. ●, Sanyati river; □, Gwaai river; ο, Zambezi river. (From Marshall et al., 1982)
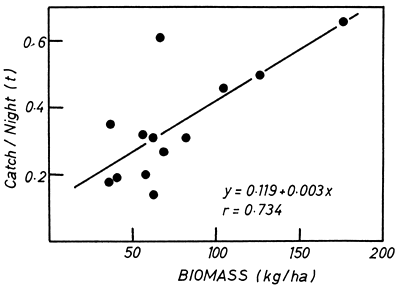
Fig. 18. Relationship between biomass estimates and commercial catches of Limnothrissa
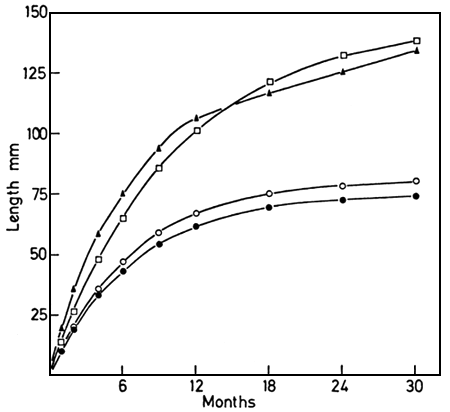
Fig. 19. Growth of Limnothrissa in three African lakes. ●, Kariba (Marshall, unpubl.); ο, Kariba (Cochrane, 1978); ▲, Tanganyika (Matthes, 1968); □, Kivu (FAO, unpubl.)
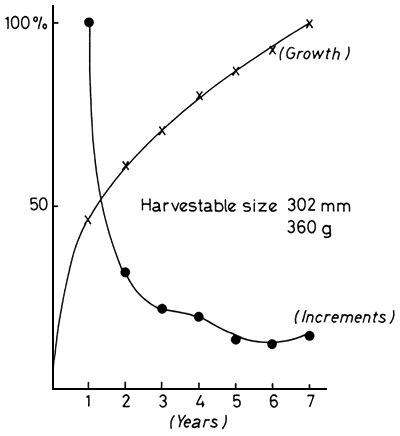
Fig. 20. Estimation of minimum harvestable size of Mormyrus longirostris (modified from Balon, 1974)
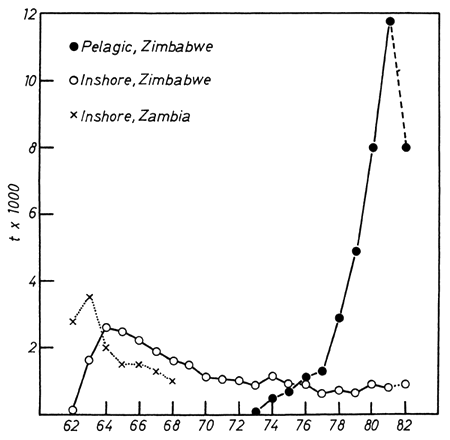
Fig. 21. Commercial fish landings, Lake Kariba 1962–82
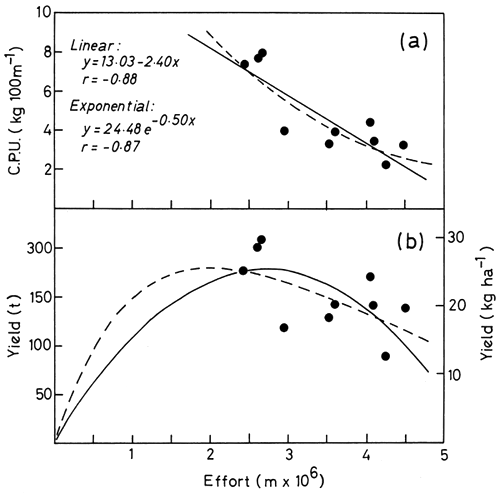
Fig. 22. (a) The relationship between effort and C.P.U. for the inshore fishery;
(b) Equilibrium yield curves predicted by the linear (—) and
exponential models
(---) Data from Zimbabwean fishing area C.2.
(From Marshall et al., 1982)
par
Jacques Moreau
Laboratoire d'Icthyologie Appliquée
Ecole Nationale Supérieure Agronomique
145, Avenue de Muret
31076 Toulouse Cédex
France
RESUME |
| Parmi les lacs artificiels étudiés dans le présent ouvrage, le lac de Mantasoa occupe une place particulière. En effet, édifié en 1935, il est le plus anciens des milieux aquatiques considérés; de plus, sa faible superficie, la disparition des espèces autochtones lors de la mise en eau, le petit nombre d'espèces intoduites et développées le rendent difficilement comparable aux grandes retenues africaines. Ainsi, la faiblesse de l'effort de pêche ne permet pas d'aborder les problèmes d'aménagement et de développement des pêches du point de vue semi-artisanal ou industriel. En revanche, la simplicité de l'écosystème a permis une approche de la démographie de l'espèce principale avec une relative précision. |
| C'est pourquoi, dans cette synthèse, l'accent est mis sur les méthodes d'étude, leur mise en application et leur fiabilité. |
| L'autre problème est celui de l'introduction d'espèces nouvelles, l'une d'elles étant très récente et de leur adaptation à un milieu à la fois pauvre et relativement frais. Cela justifie les efforts d'études pour la connaissance de la biologie de ces poissons. L'instabilité générale des populations piscicoles tropicales aurait justifié un suivi du lac pendant ces dernières années (après 1976) qui n'a pas été possible. Ceci est regrettable car les circonstances de l'adaptation de la dernière espèce introduite (Sarotherodon niloticus) ne se reproduiront pas de nouveau. |
| Enfin, il faut mentionner la modicité des moyens que les autorités locales ont consenti jusqu'à présent pour l'aménagement de cette pêcherie. |
ABSTRACT |
| Among the artificial lakes examined in the present document, Lake Mantasoa occupies a special place. Built in 1935, it is in fact the oldest of the aquatic environments examined; furthermore, its small area, the disappearance of its indigenous species when it was filled with water, and the small number of species introduced and developed afterward make it difficult to compare with the large African reservoirs. Thus, due to the low level of fishing effort there the problems of fisheries management and development cannot be discussed from a semi-artisanal or industrial point of view. On the other hand, the simplicity of the ecosystem has permitted a relatively accurate overview of the demographic evolution of the main species. |
| This synthesis therefore emphasizes study methods, their application and their reliability. |
| The other problem is that of introduction of new species, one of which is very recent, and their adaptation to an environment that is both poor and relatively cold. This justifies the study efforts undertaken to gain knowledge on the biology of these fishes. The general lack of stability of tropical fish populations would have justified monitoring the lake during the past few years (since 1976) which, however, was not possible. This is to be regretted, since the conditions of the adaptation of the most recently introduced species (Sarotherodon niloticus) will not occur again. |
| Lastly, the scarcity of the resources which the local authorities have granted so far for the management of this fishery should be mentioned. |
Le lac artificiel de Mantasoa est situé à 65 km à l'Est de Tananarive par 19° de latitude Nord et 47°55' de longitude Est.
1.1.1 Le barrage de Mantasoa
Il a été édifié en 1935 pour alimenter deux centrales électriques et pour irriguer des rizières dans la plaine de Tananarive (Fig.1 et 2). C'est donc le plus anciens des lacs artificiels étudiés ici. Il recouvre des nombreuses vallées encaissées ce qui lui confère une forme extrêmement diverticulée (Fig.3). Des rizières, un village, une ancienne route et une ancienne voie ferrée ont été ainsi immergés. Le barrage et le réservoir de Mantasoa présentent les caractéristiques suivantes:
Hauteur du barrage: 22 m.
| Cote du lac | Hauteur d'eau au droit du barrage | Superficie du plan d'eau | Volume d'eau du réservoir | |
| Minimum | 1 378.50 | 10 m | 1 150 ha | 45 000 000 m3 |
| Maximum | 1 385.50 | 17 m | 1 800 ha | 120 000 000 m3 |
La superficie n'est donc en rien comparable à celle des autres lacs évoqués.
1.1.2 Environnement général du lac
Le plan d'eau dont la cote est de 1 381 m est approvisionné par les ruisseaux qui ont creusé autrefois les vallées maintenant inondées. C'est sur la rivière Varahina qu'a été édifié le barrage de Mantasoa. La Varahina, affluent de l'Ikopa, se jette dans le Betsiboka qui rejoint le canal de Mozambique, près de Majunga.
Du point de vue géomorphologique, les reliefs entourant le lac de Mantasoa sont portés par un complexe de migmatites plus ou moins granitiques. Ces reliefs correspondent à une ancienne surface d'érosion méso-tertiaire (Bourgeat et Petit, 1969) entaillée par le réseau hydrographique, dans une certaine mesure rajeunie. Le modèle est constitué de croupes arrondies à sommets convexes ou de reliefs d'interfluves présentant des replats sommitaux de largeur variable.
Au point de vue pédologique, les sols entourant le lac de Mantasoa sont tous des sols ferrallitiques généralement rajeunis et “jaunes sur rouges” (Bourgeat, 1972). Il s'agit de sols très lessivés, acides, qui sont couverts par une végétation dense de fougères (Pteris aquilina), de graminées, et surtout de bruyères (Phillipia spp.).
Cette végétation fournit une matière organique qui évolue difficilement et participe à l'acidification des sols.
 |  |
| Figure 1. Situation générale du lac de Mantasoa | Figure 2. Environs de Tananarive (d'après carte routière) |
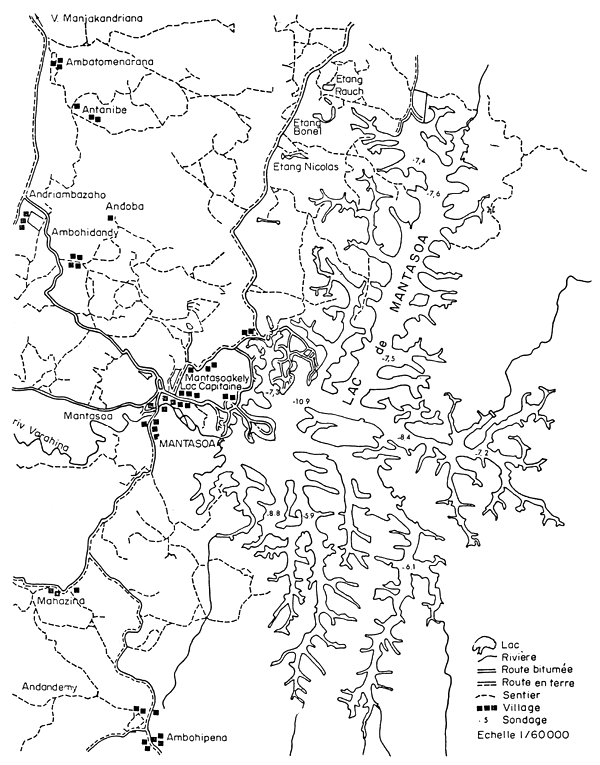
Figure 3. Lac de Mantasoa
Tableau 1. Résumé des caractéristiques du lac de Mantasoa
| Caractéristiques | Valeurs | |||
| Superficie | 12 à 18 km2 | |||
| Cote moyenne | 1 381 m | |||
| Nature du fond | sol ferralytique compact, peu de vase | |||
| Climat | ||||
| - | Ensoleillement | faible | ||
| - | t°C mini-maxi | 11, 6–21,4 | ||
| - | N jours de pluie | 196 | ||
| - | Pluviométrie (mm) | 1 455 | ||
| Facteurs physiques | ||||
| - | Couleur de l'eau | vert | ||
| - | Profondeur maxima | 10 m | ||
| - | T°C en surface | 15 à 25 | ||
| - | Transparence (m) | 1,10 à 2,20 | ||
| - | pH | 6,1 à 6,8 | ||
| - | T.A.C. (meq/l) | 0,10 à 0,20 | ||
| - | Résistivité (ohm/cm) | 21 000 à 72 000 | ||
| - | Conductivité (μ mhos) | 14 à 48 | ||
| - | Extrait sec (mg/l) | 14 à 177 | ||
| Facteurs chimiques | ||||
| - | Oxygène, % saturation : | |||
| • surface | 100 | |||
| • fond | minimum : 70 | |||
| - | M.O. milieu | acide | 2,15 à 2,45 | |
| alcalin | 1,15 à 1,25 | |||
| - | Dureté totale | 3.5 à 4 | ||
| - | Cations (mg/l) - | P | 0,8 | |
| NH4+ | 0,09 | |||
| NO3- | 1,50 | |||
| SO4-- | 0,01 | |||
| CO2 total | 8,5 | |||
| Cl- | 3,0 | |||
| SiO2 | 6,5 | |||
| - | Anions (mg/l) - | Na+ | 2,2 | |
| K+ | 2,1 | |||
| Ca++ | 0,6 | |||
| Mg++ | 0,2 | |||
| Fer | 0,15 | |||
| Facteurs biologiques | ||||
| - | Quantité globale de plancton | 3 à 9 cm3/m3 | ||
| - | Nombre de genres | |||
| + | phytoplancton: | |||
| • Cyanophycées | 5 | |||
| • Chlorophycées | 12 | |||
| • Desmidiées | 10 | |||
| • Bacillariophycées | 11 | |||
| • Euglénophycées | 1 | |||
| • Chrysophycées | 1 | |||
| Total | 40 | |||
| + | Zooplancton et benthos: | |||
| • nombre de genres identifiés | 9 | |||
| • non identifiés | oui | |||
Tableau 2. Phytoplancton, zooplancton et benthos du lac de Mantasoa:
| Familles | Genre (éventuellement espèce) |
| CYANOPHYCEES | Anabaena sp. |
| Merismopedia sp. | |
| Microcystis flos aquae | |
| Oscillatorium sp. | |
| Phormidium sp. | |
| Stigonema sp. | |
| CHLOROPHYCEES | Ankistrodesmus sp. |
| Bambusina spp. | |
| Coelastrum microsporum | |
| Micrasterias spp. | |
| Netrium sp. | |
| Oedogonium sp. | |
| Pediastrum clathratum | |
| Scenedesmus spp. | |
| Spirogyra sp. | |
| Tetrallantos lagerheimi | |
| Ulothrix sp. | |
| Zygnema sp. | |
| DESMIDIES | Arthrodesmus sp. |
| Closterium sp. | |
| Cosmarium sp. | |
| Desmidium grevillei | |
| Euastrum sp. | |
| Pleurotaenium spinulosum | |
| Staurastrum spp. | |
| Staurodesmus sp. | |
| Tetmemorus sp. | |
| Xanthidium sp. | |
| EUGLENOPHYCEES | Peridinium |
| CHRYSOPHYCEES | Dynobrion sp. |
| BACILLARIOPHYCEES | Cyclotella sp. |
| Cymbella sp. | |
| Diatoma | |
| Eunotia sp. | |
| Gomphonema sp. | |
| Gyrosigma sp. | |
| Melosira granulata | |
| Navicula sp. | |
| Pinnularia sp. | |
| Surrirella sp. | |
| Synedra sp. | |
| Zooplancton et Benthos | |
| PROTOZOAIRES | Arcella sp. |
| Centropiscis sp. | |
| Euglypha sp. | |
| Peridinium sp. | |
| ROTIFERES | Anurea |
| Brachionus calyciflorus | |
| " angularis | |
| " falcatus | |
| Trichocerca | |
| Trichotria | |
| CLADOCERES | Alona |
| Bsominopsis deitersi | |
| Chidorus | |
| Pleuroscus | |
| Autres genres | |
| COPEPODES | - |
| LARVES D'INSECTES | - |
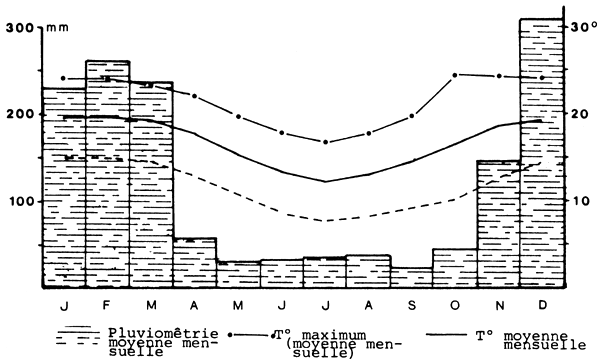
Figure 4. Le climat du lac étudié
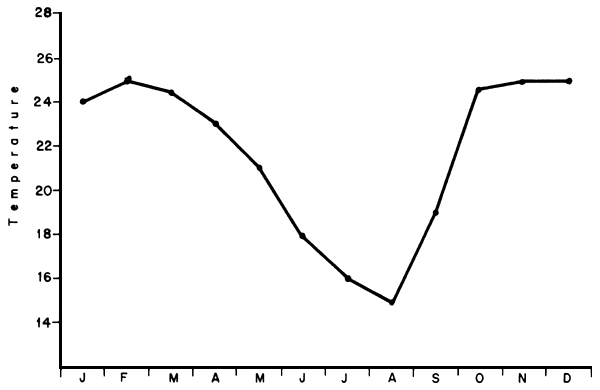
Figure 5. Evolution cyclique annuelle de la température moyenne de l'eau mesurée en surface à 16 heures
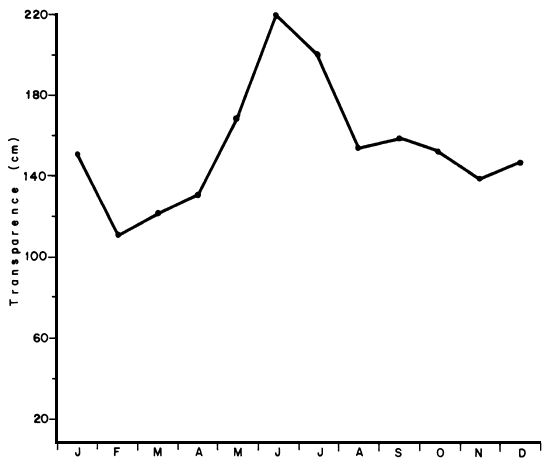
Figure 6. Evolution cyclique annuelle de la transparance de l'eau du lac de Mantasoa mesurée à 16 heures
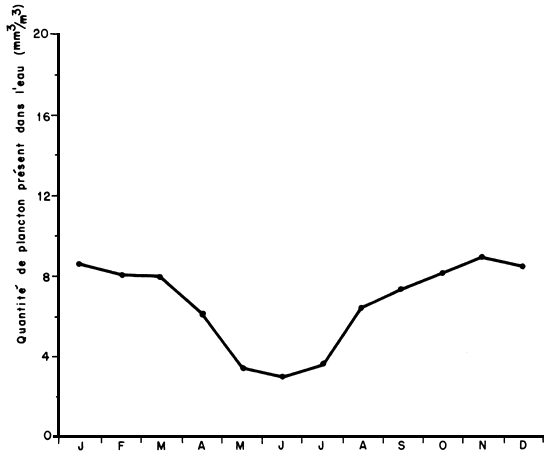
Figure 7. Quantité de plancton présent dans l'eau
Sous couvert végétal relativement dense, l'érosion est très faible et les apports solides parvenant au lac sont peu abondants.
Au sujet de la nature du fond du lac lui-même, il faut noter que, souvent, les berges descendent en pente forte (plus de 20%) et que la lame d'eau devient très rapidement épaisse; dans de telles conditions, aucune végétation aquatique ne s'est installée; dans les fonds de vallée inondées, on trouve, pratiquement intacts, des sols qui s'étaient formés à l'origine dans des conditions de relative hydromorphie.
Il s'agit de sols hydromorphes organiques à gley où la matière organique, non tourbeuse, est représentée par un humus de type “anmor”. Cette matière organique immergée ne subit que de très lentes modifications et ne participe que faiblement à la réduction du milieu.
Sur les rives du lac proprement dites, le sol, de type “jaune sur rouge” (Bourgeat, 1972), est pratiquement dépourvu de matière organique puisqu'aucune végétation aquatique n'a pu s'y installer.
1.1.3 Le climat du lac de Mantasoa
Le climat (Fig.4) se révèle froid en hiver et, en général, nuageux et pluvieux, La température descend au-dessous de 5°C mais atteint exceptionnellement 30°C. Il tombe, en moyenne, 1 485 mm d'eau par an répartis sur 196 jours de pluies. Les pluies durant une journée entière sont fréquentes et les journées ensoleillées sont relativement rares. Les vents dominants sont les vents d'Est, alizés en saison froide, qui sont essentiellement diurnes. Le climat du lac de Mantasoa est soumis très fortement à l'influence de la côte est.
En résumé, le lac de Mantasoa est un petit lac artificiel ancien situé sur un sol ferrallitique très lessivé sous climat tropical d'altitude pluvieux et frais.
Le lac de Mantasoa est un lac artificiel de dimensions modestes par rapport à celles des lacs artificiels africains auxquels il sera comparé. A partir des connaissance disponibles sur son écologie, on peut s'interroger sur ses possibilités de production piscicole.
1.2.1 Facteurs physico-chimiques
D'une façon générale, le lac semble constituer un ensemble homogène quant à ses conditions de milieu en raison de sa faible superficie, de la profondeur limitée et des possibilités de brassage par les vents (Tableau 1).
La profondeur maximale est de 17 m. Les fonds de 10 m sont fréquents et les variations de profondeur sont liées au marnage motivé par les activitiés à l'aval du barrage dont les besoins en eau sont maxima en fin de saison sèche. Les variations de cote du lac affectent aussi sa superficie; c'est ainsi qu'en étiage, se trouvent exondées des plages propres à la pratique de la pêche à la senne de rivage.
Les eaux de ce lac sont claires (turbidité de 1,1 à 2,2 m) assez fraîches (températures comprises entre 15 et 25°C) légèrement acides (pH de 6,1 à 6,8 et T.A.C. de 0,1 à 0,2 meq/l) et peu minéralisées (résistivité de 21 000 à 72 500 ohm/cm). Cette pauvreté en éléments minéraux vient de l'acidité des sols, de leur pauvreté et de la quasi absence d'érosion.
Le Phosphore est assez abondant (0,6 à 1,1 mg/l et l'azote est présent surtout sous forme nitrique (1,5 mg/l de NO3-; l'azote ammoniacal n'existe qu'à l'état de traces: 0,10 mg/l NH4+, tout comme le fer qui n'est pas apporté sous forme hydrosoluble. Il faut enfin noter la faible teneur en carbonates et en ions alcalins et alcalino terraux mais la relative abondance de la silice: 6 à 7 mg/l de SiO2.
L'oxygène dissout est souvent disponible en abondance, en raison de la fréquence des vents, surtout en surface. Dans les eaux profondes il n'a jamais été noté de désoxygénation complète.
Certains paramètres du milieu subissent des variations saisonnières nettes en rapport avec le climat: température, cote du lac, transparence, quantité de plancton présent dans l'eau (Fig. 5, 6 et 7).
La quantité globale de plancton présent dans le lac subit généralement des variations cycliques annuelles en rapport avec celles de la température et de l'ensoleillement (Fig.7).
La biomasse du phytoplancton passe par un minimum en saison fraîche par suite de la baisse de la température et de l'ensoleillement car c'est aussi une saison nuageuse.
L'arrivée des pluies provoque une baisse de biomasse par rapport au niveau atteint à la fin de la saison sèche (septembre-novembre) pour plusieurs raisons:
le phytoplancton se trouve dilué par un apport massif (eau de pluie, eau collectée dans le bassin du lac). Les variations de volume d'eau sont très importantes au lac de Mantasoa;
la quantité et l'intensité de la lumière incidente diminuent à cause de la nébulosité;
la turbidité augmente normalement en début de saison de pluie en raison de l'apport de particules terreuses arrachées au bassin versant.
1.2.2 Le phytoplancton
Les inventaires floristiques les plus récents font état de l'existence des genres répertoriés par ordre alphabétique sur le Tableau 2. D'après ce dernier, on a identifié 41 genres au lac de Mantasoa.
Sans doute en raison de la relative richesse en silice, le lac de Mantasoa est riche en Bacillariophycées (Talling, 1969; Dussart, 1966). Si l'on en croit Talling et Talling (1965), son pH acide serait en partie responsable de sa richesse en Desmidiées.
1.2.3 Le zooplancton et le benthos
Le lac de Mantasoa est pauvre en zooplancton et en benthos; celui-ci est constitué de Nématodes, Turbélariés, Gastrotriches, Tardigrades. Les mollusques sont Bulinus mariei et Lymnea hovarum. La bilharziose n'est pas signalée.
Parmi les insectes seuls les Coléoptères (Cybister) et les Diptères (Chironomidae) se rencontrent couramment.
1.2.4 Les végétaux supérieurs aquatiques
Aucune végétation aquatique ne borde les rives du lac de Mantasoa. Seules certaines criques sont tapissées de petites graminées qui, immergées, servent de nourriture aux Tilapia et de support au développement d'un important périphyton.
Le lac artificiel de Mantasoa a été établi sur le cours de rivières coulant autrefois en zone forestière et dépourvues de poissons, en dehors d'anguilles de gobiidés de petite taille et d'un Cichlidé autochtone Paratilapia polleni; il est donc surtout peuplé d'espèces introduites.
1.2.5 Les espèces présentes
Ce sont par ordre alphabétique des familles:
ANGUILLIDES: Anguilla mossambica (très rare)
CENTRARCHIDES: Micropterus salmoides introduit en 1963
CICHLIDES: T. rendalli introduit en 1955 et S. niloticus1 introduit en 1970–72
CYPRINIDES: Carassius auratus introduit, vers 1935, peu après la création du barrage
En 1976, les pêches au filet maillant et à la roténone, ainsi que l'inventaire des captures faites par quelques pêcheurs, ont permis d'établir le tableau suivant:
| Espèces | Proportions en nombre % | Proportions en poids % |
| T. rendalli | 78 | 58 |
| S. niloticus | 5 | 7 |
| Cyprinus carpio | 3 | 28 |
| Micropterus salmoïdes | 14 | 7 |
| Total | 100 | 100 |
Le lac de Mantasoa est donc caractérisé par la très faible diversité de son peuplement de poissons composé uniquement d'espèces introduites, les espèces autochtones n'ayant pu résister aux nouvelles conditions écologiques crées par la mise en place d'une zone d'eau stagnante et l'introduction de nouvelles espèces. En cela, le peuplement du lac de Mantasoa est le reflet fidèle des conditions zoogéographiques des milieux aquacoles des hauts plateaux malgaches. En effet, ces derniers sont pratiquement tous caractérisés par la très faible importance des poissons autochtones et la présence de niches écologiques originellement vides ayant, en grande partie, justifié les fréquentes introductions d'espèces étrangères répertoriées à Madagascar.
De plus, vu le petit volume d'eau que représente ce lac, il ne pouvait s'y installer de peuplement pélagique strict.
1 S. niloticus maintenant Oreochromis niloticus
Le lac de Mantasoa est sûrement peu productif. La biomasse du plancton est faible, les eaux sont claires, fraîches, légèrement acides et très peu minéralisées. En effet, le lac de Mantasoa reçoit peu d'éléments minéraux des collines voisines et les éléments importants parviennent sous forme insoluble. Il en est ainsi de beaucoup de plans d'eau sur sols peu organiques et acides. De plus, le lac de Mantasoa est peu ensoleillé. Les possibilités de photosynthèse sont donc limitées.
Le phytoplancton est composé en quantités notables de Diatomées et de Desmidiées et la végétation macrophytique est pratiquement absente.
Les invertébrés sont aussi peu abondants et le peuplement piscicole est constitué en quasi totalité d'un petit nombre d'espèces introduites.
Le lac de Mantasoa constitue donc un cas particulier qui le rendra difficilement comparable aux autres lac artificiels d'Afrique. En revanche il est très semblable au lac de Tsiazompaniry, également situé sur les hauts plateaux malgaches (Fig.2).
Le barrage de Tsiazompaniry a été édifié en 1954–56 sur la rivière Varahina-Sud dans un contexte climatique, pédologique et géologique tout à fait semblable à celui du lac de Mantasoa et pour les mêmes motivations. Les variations maximales de cote du plan d'eau sont de 9 m les superficies minimales et maximales sont de 1 800 et 3 100 ha. Avant la construction du barrage les espèces de poissons rencontrées étaient Anguilla mossambica, Gobius aenofuscus et Paratilapia polleni. Les eaux sont très peu minéralisées.
La composition du peuplement piscicole est, semble-t-il, la suivante:
| Espèce | % Nombre | % Poids |
| Tilapia rendalli | 53,5 | 25,0 |
| Cyprinus carpio | 43,0 | 70,0 |
| Micropteur salmoides | 2,5 | 2,5 |
| Sarotherodon niloticus | 0,5 | 0,5 |
| Autres | 2,5 | 2,0 |
La biologie des espèces importantes est similaire à ce qui est observé au lac de Mantasoa et développé dans les chapitres suivants. La pêche sera étudiée en même temps que celle du lac Mantasoa.
Ces deux points sont importants à étudier car ils permettent une approche méthodique du peuplement piscicole du lac et de ses possibilités d'exploitation. De plus il est important de suivre l'adaptation à ce milieu relativement froid d'espèces d'eaux beaucoup plus chaudes introduites depuis peu: Tilapia et Sarotherodon.
En milieu tropical, les études de démographie piscicole sont peu nombreuses et, pour les genres Tilapia et Sarotherodon, il ne faut citer à notre connaissance que celles de Garrod (1963), Ssentongo (1971), Gwahaba (1973) et Balon (1974).
2.1.1 Observations générales
Le lac de Mantasoa qui a une superficie relativement réduite et une faible profondeur, est pêché sur toute sa surface.
L'ensemble du cheptel piscicole, à l'exception des alevins et des petits poissons, est donc dans la phase exploitée parce que soumis à l'action de la pêche. La taille de recrutement (Lr) et celle de première capture ont été déterminées pour les engins utilisés par les pêcheurs professionnels et pour nos méthodes d'échantillonnage.
2.1.2 Détermination de Lc et de l'âge correspondant tc
D'après le tableau ci-dessous, selon l'engin et l'espèce, la taille de première capture est comprise entre 4 et 11,5 cm et l'âge correspondant varie entre 3 et 12 mois; les méthodes d'échantillonnage ont permis l'étude de très jeunes poissons âgés de moins d'un an. (Voir Chapitre suivant).
Longueur standard de première capture (Lstc) et âge correspondant (Tc)
chez T. rendalli (T.r.), S. niloticus (S.n.),
(* Méthodes utilisées dans le present travail)
| Lac | Engin de pêche | Espèce | Lstc (cm) | Tc (mois) |
| Lignes | T.r. + S.n. | 6,5 | 6 | |
| Senne de plage; mailles 3 cm (*) | T.r. | 11,5 | 12 | |
| Mantasoa | Filet dormant; mailles 3 cm (*) | T.r. | 11,5 | 12 |
| Roténone (*) | Espèces groupées | 4 | 3,5 |
Faute de pouvoir marquer les poissons et de suivre, par ce moyen, le devenir de l'effectif des différentes classes d'âge d'une année à l'autre, le présent travail a consisté à étudier les distributions de fréquence des différentes classes de taille dans des captures effectuées par des méthodes les moins sélectives possibles. Cette condition a pu être remplie, dans une certaine mesure, grâce à l'emploi de la senne de plage. Plusieurs pêches ont été pratiquées avec une senne de plage de 135 m de longueur à mailles de 3 cm noeud à noeud.
En position de pêche, la hauteur maximale de ce filet, au droit de la poche, était de 3,5 m et la hauteur minimale, à l'extrémité des ailes, de 2 m. Cette senne a été manoeuvrée par 8 à 10 hommes selon les pêches. Les renseignements ainsi obtenus ont permis l'estimation aux différents âge du paramètre selon les méthodes habituelles et avec les précautions d'usage en la matière (Ricker, 1975, Gulland, 1977).
2.3.1 Tilapia rendalli
Tilapia rendalli est la population la mieux connue car il a été possible d'y dissocier les poissons de moins de 6 mois, les individus ayant environ 1 an et enfin les plus âgés seuls considéres ici.
L'étude des histogrammes de fréquence de tailles des T. rendalli de plus d'un an a eu lieu à partir de pêches à la senne au mois de décembre qui ont permis de compter les poissons de cinq cohortes âgées de 1 an, 2 ans, 3 ans, 4 ans et plus de 4 ans. Les effectifs énoncés dans le tableau ci-après sont les résultats de séries de cinq coups de senne nécessaires pour disposer d'un échantillon abondant et pourtant imparfait.
| Age | 1 an | 2 ans | 3 ans | 4 ans | + de 4 ans | |||||||||
| Décembre 1972 | N | 176 | 110 | 50 | 22 | 14 | ||||||||
| Z | 0,47 | 0,89 | 0,89 | 0,94* | ||||||||||
| Décembre 1973 | N | 208 | 94 | 46 | 24 | 14 | ||||||||
| Z | 0,79 | 0,71 | 0,65 | 1,00* | ||||||||||
| Décembre 1975 | N | 193 | 72 | 22 | 8 | - | ||||||||
| Z | 0,99 | 1,19 | 1,04* | |||||||||||
* Calculé par la méthode de Jackson (1939)
En décembre 1972 et décembre 1973, l'effort de pêche a été identique; de cette façon, Z peut être estimé à 0,63 entre 1 et 2 ans, à 0,87 entre 2 et 3 ans et 0,73 entre 3 et 4 ans.
Pour un âge donné, les écarts entre les mesures isolées de Z sont très importants en raison du petit nombre de poissons étudiés. Z est en moyenne de 0,72 entre 1 et 2 ans, 0,91 entre 2 et 3 ans, 0,81 entre 3 et 4 ans et 0,97 chez les poissons plus âgés. A partir de 2 ans et pour simplifier, Z peut être admis constant et égal à 0,85.
2.3.2 Sarotherodon niloticus
La population de S. niloticus du lac de Mantasoa est en expansion; c'est pourquoi seul un effort de pêche constant, d'une année sur l'autre, a permis le calcul correct du taux de survie. Cet effort de pêche a été un empoisonnement à la roténone dans des biefs de 1 000 m2 chacun situés au Sud du lac. Ces zones se sont révélées très tôt riches en S. niloticus et, tous résultats groupés, il y a été capturé, en décembre 1974, 22 poissons de 1 an, 7 de 2 ans et 2 de plus de 2 ans; en décembre 1975, 32 poissons de 1 an, 10 de 2 ans, 3 de 3 ans. Z serait donc de 0,79 entre 1 et 2 ans et de 0,85 entre 2 et 3 ans.
S. niloticus est encore peu abondant au lac de Mantasoa et les données le concernant sont donc très insuffisantes. Elles sont cependant voisines de celles obtenues aux mêmes âges chez T. rendalli. Il est donc possible de considérer que les deux espèces présentent des coefficients de mortalité voisins à partir de l'âge de 2 ans (Z = 0,85). Il en est d'ailleurs souvent ainsi lorsque deux espèces biologiquement proches vivent dans un même milieu non exploité (Ricker, 1975).
2.4.1 Variations de Z avec l'âge
Sur le tableau ci-dessous, sont rassemblées les valeurs de Z aux différents âges chez les populations étudiées telles qu'elles viennent d'être évaluées.
| Lacs | Espèces | 4,5 m (1) | 1 a (1) | 1,5 a | 2 a | 2,5 a | 3 a | 3,5 a | 4 a et + |
| Mantasoa | T. rendalli | 4,5 | 2,90 | 0,72 | 0,91 | 0,81 | 0,97 | ||
| S. niloticus | 5 | 0,79 | 0,85 |
(1) Valeurs observées au chapitre suivant.
D'une façon générale, Z est très élevé au début de l'existence des poissons (chaptire suivant) et, à l'âge d'un an, Z est encore en majorité très supérieur à 1. C'est vers un an et demi que Z est le plus bas; ensuite il a tendance à augmenter de nouveau. Il est possible d'émettre des hypothèses sur la mortalité naturelle, exprimée par le coefficient M, et la mortalité par pêche, exprimée par le coefficient F, sachant que F + M = Z.
Au lac de Mantasoa, F est très faible, compris entre 0,05 et 0,10, aussi bien chez S. niloticus que chez T. rendalli de plus d'un an, car ces poissons sont très peu pêches. Au-delà de 2 ans, Z est en moyenne de 0,85; M serait donc de 0,75 à 0,80, chiffre assez élevé qui peut cependant être expliqué par les conditions d'existence difficiles des poissons du lac de Mantasoa; avant l'âge d'un an, l'importance de la prédation par Micropterus salmoides est prépondérante.
Sur les figures 8 et 9 sont portées les variations de Z avec l'âge; les graphiques en question présentent les variations de M admis constant à partir de l'âge de 2 ans, en vue de simplifications nécessitées par les calculs de production. Les parties recouvertes de pointillés représentent les variations de F. Les courbes tracées sont celles qui, dans chaque cas, ont paru être simples sans trop déformer les réalités biologiques.
L'intérêt de la présente étude démographique est limité par la faiblesse des effectifs des échantillons étudiés et par l'impossibilité dans laquelle nous avons été de procéder à des marquages. Cependant, un certain crédit semble pouvoir lui être accordé, compte-tenu des points suivants.
Les valeurs de Z obtenues pour les poissons de plus de 2 ans, toutes proches de 1, sont voisines de celles observées en Afrique chez Tilapia et Sarotherodon et chez les autres espèces de longévité analogue (5 à 8 ans).
Les valeurs de M et de F peuvent être interprétables en considérant la biologie des espèces, étudiées précédemment, et la pratique de la pêche étudiée plus loin.