La détermination du rapport des sexes (sex ratio) et de la suite des changements du stade de maturité au cours de l'année est d'une très grande importance pour édifier une connaissance précise de la biologie générale d'un stock exploité. C'est une partie de la base de l'évaluation des stocks. Pour plusieurs espèces il peut être nécessaire de maintenir des programmes courants d'analyse du rapport des sexes et des stades de maturité. Le mâle et la femelle de quelques espèces de poissons, comme la plie de la mer du Nord, les Tilapia et Sebastes, ont des taux de croissance tellement différents qu'ils doivent être traités comme des stocks séparés dans le travail de l'évaluation des stocks. Les taux de mortalité diffèrent aussi beaucoup entre les sexes. En outre, quand les captures d'une espèce contiennent un mélange de stocks, les données de maturité peuvent fournir le meilleur guide aux proportions relatives des stocks dans les captures et aux changements de oes proportions.
Cependant, les déterminations du sexe et des stades de maturité sexuelle trouvent leur application primordiale en fournissant la connaissance fondamentale de la biologie de la reproduction d'un stock. Les informations dérivées de ces analyses peuvent être utilisées en établissant l'âge et la taille auxquels les poissons atteignent leur maturité sexuelle, le moment et le lieu de la reproduction et la durée du cycle depuis le dêbut du développement de l'ovaire jusqu'à l'émission finale des oeufs. Avec les estimations de fécondité, ces informations peuvent être utilisées pour calculer la dimension d'un stock et son potentiel de reproduction. Les données ont plusieurs utilisations pratiques. L'âge et la taille à la maturité sexuelle peuvent être importants pour évaluer l'âge optimum de première capture d'une espèce, et le moment et le lieu de reproduction peuvent être utilisés pour planifier les tactiques de pêche parce que beaucoup d'espèces de poissons sont d'une capture plus facile quand ils se rassemblent pour se reproduire. Réciproquement on peut considérer sage de limiter la pêche sur un stock surexploité dans lequel le recrutement futur est mis en péril par une reproduction faible du stock.
Les deux principaux groupes de poissons, les téléostéens et les élasmobranches, diffèrent tellement dans la biologie de leur reproduction qu'il en sera traité séparément. La plupart des ouvrages sont consacrés à la description de la fécondité des téléostéens et presque tout de cela est limité aux descriptions des espèces qui pondent leurs oeufs pendant une courte période.
La détermination du sexe normalement ne présente aucune sérieuse difficulté. Chez quelques espèces, p. ex., saumon, characinidés et quelques cichlidés, ce peut être fait d'après des caractères externes sans ouvrir le poisson pour examiner les gonades. Il est possible de déterminer le sexe des plies et de beaucoup d'autres poissons plates de la mer du Nord en les tenant en face d'une source lumineuse; la cavité abdominale de la femelle est plus longue que celle du mâle (Fig. 5.1). Normalement il faut ouvrir la cavité abdominale. Même quand les gonades sont rendues visibles, la différenciation entre les sexes par examen superficiel peut être difficile ou impossible chez les petits individus vierges, comme l'ont montré Howard et Landa (1958) pour l'Anchoveta et par Schaefer et Orange (1956) pour la bonite et le thon à nageoires jaunes. Chez les spécimens qui sont au delà du stade immature vierge, la distinction entre les sexes peut être faite normalement à l'oeil nu. Les ovaires sont généralement tubulaires, et granuleux alors que les testicules sont plats, blancs et leurs bords ventraux présentent fréquemment une ligne ondulée. Chez d'autres espèces, par exemple, le hareng, les sexes des poissons vierges peuvent être distingués d'après la couleur des gonades; les ovaires sont rouges et les testioules sont blanc-gris/ brun. Les testicules ont aussi une forme plus aplatie en lame de couteau que les ovaires.
Le terme “stades de maturité” a une signification particulière, mais généralement acceptée dans la biologie halieutique. Il est employé pour signifier le de ré de maturité des ovaires et des testicules d'un poisson et non que le poisson est sexuellement mûr ou non. Ainsi, le terme “première maturité” est utilisé pour décrire un poisson qui se reproduit pour la première fois. Pour tous les autres animaux le terme “maturité” est utilisé parce qu'un animal atteint une fois la maturité (la capacité de se reproduire). “Première maturité” implique plus d'une “maturité”. L'inconsistance de l'expression et l'emploi du terme “stade de maturité” provient probablement de ce que les premiers poissons pour lesquels on a décrit des “stades de maturité” avaient un cycle de reproduction annuel, nettement marqué avec un long intervalle pendant lequel les gonades retournaient presque a leur stade vierge. Cependant, il serait plus logique de parler de stades de “maturité” et de “reproduction”.
L'estimation courante des stades de maturité est effectuée normalement en assignant aux individus des stades selon des caractères qui peuvent être différenciés à l'oeil nu. Une distinction plus poussée entre les stades peut être effectuée par l'examen histologique, mais ce n'est pas un moyen pratique dans l'échantillonnage normal parce qu'il prend trop de temps. Le but doit être d'examiner un grand nombre de poissons à de fréquents intervalles pour obtenir une image représentative du stade de maturité de la population et des changements qui y surviennent avec le temps.
Dans la littérature un grand nombre de clés pour déterminer les stades de maturité ont été proposées et décrites. Elles couvrent les différences mineures entre les espèces et celles dans une seule espèce, donnant divers degrés de raffinement. Parce que la détermination grossière à l'oeil nu signifie inévitablement jugement subjectif, un niveau de raffinement trop élevé est injustifié. Une échelle de 8 stades au plus convient probablement pour la plupart des espèces.
Les “reproducteurs totaux” sont les espèces chez lesquelles, après que la maturation des gonades a débuté, tous les oeufs ou le sperme qui doivent être émis par les poissons individuels en une seule période de reproduction, se développent synchroniquement. Leur émission a lieu pendant une courte période d'une semaine à peu près et la saison de reproduction est définie clairement. C'est le type le plus commun, au moins chez les espèces des latitudes septentionales.
La détermination de stade de maturité des reproducteurs totaux est généralement simple parce que presque tous les oeufs en développement dans l'ovaire sont au même stade. Ils peuvent assez aisément être affectés à ce stade d'après des critères visuels de taille, couleur, et texture, bien que ces stades puissent avoir une signification histologique pas très claire. Une clé typique et assez satisfaisante pour classer les stades de maturité chez les reproducteurs totaux, qui est largement applicable aux espèces de ce type, est celle de Maier (1908) donnée au tableau 5.1 Elle peut être modifiée pour s'adapter aux espèces étudiées. Par exemple, il est souvent difficile de séparer les mâles en 8 stades.
Cette échelle satisfait convenablement les exigences de base. Elle (a) distingue dans les stades de faible maturité les poissons vierges des poissons qui se sont reproduits auparavant, donnant ainsi la possibilité de fixer l'âge moyen et la gamme des âges à maturité; (b) définit clairement le stade quand l'émission d'oeufs et de laitance est en cours et quand elle est effectuée, permettant de fixer avec précision le début, le plein et la fin de la période de reproduction; (c) divise la période intermédiaire en un nombre raisonable de stades d'après lesquels on peut faire une prédiction approximative du moment de la reproduction et (d) est capable de détermination rapide avec le minimum d'équipement, permettant ainsi d'analyser de grands échantillons dans les conditions sur le terrain.
Les “reproducteurs partiels” sont ceux chez qui la reproduction par des individus a lieu pendant une durée prolongée et chez lesquels on peut trouver en même temps dans la même ovaire des oeufs en maturation à des stades de développement très différents, tels qu'avant et pendant la reproduction. On trouve cette situation chez le maquereau de la mer du Nord, par exemple, chez les sprats et chez un certain nombre d'espèces comme le Rastrelliger et le merlu chilien, dans les eaux tropicales et sub-tropicales.
L'établissement d'une échelle de maturité pour les reproducteurs partiels est plus difficile parce qu'il y a à tout moment une série de stades de développement dans une gonade individuelle et la différenciation obtenue sera inévitablement moins précise. Une clé conçue à l'origine pour Rastrelliger parait satisfaire la plupart des exigences et être applicable, avec des modifications mineures à une large gamme de reproducteurs partiels. Elle est donnée au tableau 5.2.
La détermination des stades de maturité par l'examen visuel en utilisant des clés de maturité manque de précision parce qu'elle s'appuie sur un jugement subjectif. Elle convient pour beaucoup de buts mais dans plusieurs cas une méthode plus objective est désirable. La façon la plus pratique d'arriver à cela avec le minimum de dépenses et de travail est de calculer un “indice de gonades”. Il peut être exprimé comme suit: W/L³ × 108, dans lequel W = poids des deux gonades (g), et L = longueur totale du poisson en millimètres. Puisque le poids de la plupart des poissons est étroitement proportionnel au cube de la longueur cela donne un indice qui est approximativement proportionnel au poids relatif des gonades. Pour le poisson femelle c'est aussi une mesure relative du diamètre de l'oeuf, indépendant de la longueur du poisson (Schaefer et Orange 1956).
Il n'est pas possible normalement d'effectuer un échantillonnage de la maturité sur les marchés au poisson commerciaux, souvent les poissons sont mis à terre après l'enlèvement des viscères et des gonades. Aussi, normalement les marchés au poisson ne possèdent pas les installations nécessaires pour ce genre de travail. Il est donc habituel de déterminer les stades de maturité sur des échantillons spéciaux soit mis de côté non-éviscérés dans ce but par les équipages des navires industriels, soit recueillis sur des navires de recherche. Ces échantillons peuvent ne pas être complètement représentatifs de la capture totale parce qu'il y a souvent une relation étroite entre le stade de maturité et la longueur du poisson. Il vaut donc mieux construire une clé maturité-longueur et l'employer pour évaluer les stades de maturité dans la population. On utilise exactement la même méthode que pour la construction d'une clé âge-longueur (section 4.4.2) sauf que le nombre de poissons de chaque stade de maturité remplace le nombre de poissons dans le groups d'âge dans chaque strate de longueur. La méthode de construction de la clé maturité-longueur pour obtenir les stades de maturité chez le nombre total de poissons mis à terre est donc calculée de la même façon que pour construire une clé âge-longueur pour la composition en âges des quantités totales mises à terre.
La distribution des stades de maturité dans les mises à terre industrielles peut ne pas être représentative de la distribution des stades de maturité dans la population dans la mer. Cela peut se produire parce que les poissons à différentes stades de maturité ne sont pas également disponibles ou vulnérables à la pêche. Par exemple, les harengs mûrs sont faiblement représentés dans la capture de la flotte écossaise pêchant aux filets dérivants du nord-ouest de la mer du Nord. Il y a deux raisons à cela: les poissons mûrs ne montent pas la nuit jusqu'à la profondeur pêchée par un filet dérivant dans la même proportion que les poissons à des stades de maturité moins avancés, et les lieux de ponte dans cette région sont d'une pêche difficile par les filets dérivants. De façon semblable, Schaefer et Orange (1956) ont rapporté que les thons à nageoires jaunes deviennent disponibles pour la pècherie américaine du Pacifique à l'approche de la ponte, probablement parce qu'ils se déplacent soit au large, soit dans des eaux plus profondes pour pondre. De tels phénomènes doivent apparaître dans les résultats après l'échantillonnage d'un cycle sexuel complet. Ils peuvent probablement ètre rectifiés seulement par un échantillonnage approprié de navires de recherche.
La connaissance de la fécondité d'une espèce est un facteur important de l'exploitation rationnelle d'un stock de poissons. Elle est utilisée pour calculer le potentiel de reproduction d'un stock et la survivance, de l'oeuf au recrutement, dans les deux cas il faut juger quel stock minimum d'adultes est nécessaire pour maintenir le recrutement. La connaissance de la fécondité et du rapport des sexes du stock d'adultes sont nécessaires aussi pour calculer la dimension du stock d'après les estimations de la production annuelle d'oeufs qui sera décrite dans la section 7. Une troisième utilisation des données de fécondité est de discriminer entre les stocks dans les pêcheries exploitant un mélange de deux ou plusieurs stocks ayant différentes fécondités (Baxter 1963).
Les problèmes de l'évaluation de la fécondité dépendent de plusieurs facteurs: le nombre absolu d'oeufs produits, si l'espèce est un reproduoteur total ou partiel; du degré de différenciation qui existe entre la taille des oeufs qui seront pondus cette saison et les oeufs immatures présents qui seront reportés à la prochaine saison de ponte.
Comme dans le cas des évaluations du stade de maturité, le cas le plus simple est celui des reproducteurs totaux. On peut évaluer la fécondité en prélevant les ovaires de femelles des stades III à V de l'échelle donnée dans le tableau 5.1. Il faut mesurer les poissons sur lesquels ils sont prélevés et prélever les parties nécessaires pour déterminer l'âge. Les ovaires doivent etre conservés dans le liquide de Gilson modifié (100 ml d'alcool à 60 degrés, 800 ml d'eau, 15 ml d'acide nitrique à 80 %, 18 ml d'acide acétique glacial, 20 g de chlorure mercurique) avec une étiquette pour identifier le poisson dont ils proviennent. Les ovaires doivent être agités périodiquement dans le liquide de Gilson pour aider le relàchement du tissu ovarien et pour assurer la pénétration rapide du préservateur. Après 48 heures au moins dans le préservateur les oeufs peuvent être complètement libérés des tissus par un secouage vigoreux.
La manière la plus précise d'évaluer le nombre d'oeufs dans les ovaires est de les compter tous. Cela peut être effectué avec des machines à compter les oeufs parce que la fécondité de la plupart des poissons est si élevée qu'il est impossible de le faire à la main. A la place, il est nécessaire d'évaluer le nombre d'oeufs par sous-échantillonnage. Pour ce faire il y a deux méthodes, gravimétrique et volumétrique.
L'échantillonnage gravimétrique, comme son nom l'indique, est basé sur la pesée des oeufs. Après que les oeufs ont été libérés des tissus ovariens, ils sont lavés soigneusement et étalés sur du papier-buvard pour sécher à l'air. Le nombre total d'oeufs est alors pesé et des échantillons d'environ 500 oeufs sont pris au hasard, comptés et pesés. Le nombre total d'oeufs dans les ovaires est obtenu ensuite d'après l'équation F = n G/g dans laquelle F = fécondité, n = nombre d'oeufs dans le sous-échantillon, G = poids total des ovaires, g = poids du sous-échantillon, dans les mêmes unités.
Si on ne dispose pas de liquide de Gilson il est possible d'évaluer la fécondité en employant cette méthode en pesant les deux ovaires et en prélevant des sous-échantillons qui sont pesés. Les oeufs sont séparés avec deux aiguilles et comptés. Il faut prélever au moins trois sous-échantillons de chaque ovaire, un de la partie antérieure, un de la partie médiane et un de la partie postérieure. La méthode est fastidieuse et moins précise que s'il avait été possible d'employer le liquide de Gilson. Son grand avantage est qu'elle ne nécessite pas de grands volumes d'un liquide coùteux et qu'elle peut être utilisée sur le terrain. Elle est particulièrement utile pour les poissons ayant une faible fécondité et de grands oeufs.
La méthode volumétrique est très semblable. Après leur séparation dans le liquide de Gilson, les oeufs nettoyés sont mis dans un cylindre gradué et avec de l'eau on amène le tout à un volume connu. Pour prélever le sous-échantillons on secoue le récipient jusqu'à ce que les oeufs soient distribués uniformément dans l'eau. Un sous-échantillon de volume connu est prelevé avec une pipette de Stempel et on compte le nombre d'oeufs dans le souséchantillon. La fécondité est alors F = n V/v où n = nombre d'oeufs dans le sous-échantillon, V = volume auquel on a amené le nombre total d'oeufs, et v = volume du sous-échantillon.
En pratique, il est nécessaire normalement de compter plus d'un sous-échantillon de chaque poisson pour obtenir une estimation sùre de la fécondité. Des comptages de répliques de sous-échantillons du mème ovaire montrent que les distributions des comptes individuels sont du type de Poisson. Parce que la variance dans une distribution de Poisson est égale à la moyenne, le nombre de sous-échantillons nécessaire pour donner un degrée voulu de précision peut être déterminé d'après le nombre compté dans le premier sous-échantillon selon l'équation: % de précision = 100/mn dans laquelle la moyenne m est prise comme le compte dans le premier sous-échantillon et n est le nombre désiré de sous-échantillons.
Ces méthodes sont sujettes à une erreur systématique considérable parce qu'il est très difficile d'obtenir que les oeufs soient distribués uniformément dans le cylindre graduée. A moins que l'on fasse très attention la densité des oeufs est plus grande au fond du cylindre qu'à sa partie supérieure et au milieu du cylindre que sur les còtés. Le degré d'erreur est probablement le plus élevé si une personne doit secouer le cylindre et prélever le sous-échantillon.
Les comptes totaux du nombre d'oeufs dans un ovaire peuvent aussi être effectués en utilisant des compteurs automatiques soit du type décrit par Parrish, Baxter et Mowat (1960) (Fig. 5.2a) soit du type Decca-Master-count décrit par Boyar et Cliffor (1967) (Fig. 5.2b). L'avantage de l'emploi de ces machines est que l'erreur d'échantillonnage inhérente à toute technique d'échantillonnage est évitée, mais leur inconvénient est leur lenteur.
Des compteurs d'oeufs automatiques, basés sur le compteur Coulter, sont conçus maintenant, qui permettent de compter les nombres de particules de dimensions pré-établies. Cela éliminera un des principaux inconvénients des compteurs actuels, qui comptent toutes les particules grandes et petites. Dans les nouveaux compteurs seul le nombre de particules correspondant à la dimension des oeufs est relevé comme fécondité.
Jusqu'à ce jour, les analyses de fécondité ont été largement confinées aux reproducteurs totaux parce qu'il est tellement difficile d'évaluer la fécondité des reproducteurs partiels. Dans leurs stades précoces de maturité, tous les oocytes devant ètre pondus en un cycle de reproduction peuvent ne pas etre encore différenciés et, aux stades plus avancés, quelques-uns des premiers oeufs à se développer peuvent avoir déjà été pondus. Pour avoir une estimation convenable de la fécondité annuelle dans de telles espèces, il est nécessaire d'obtenir des informations sur le nombre de pontes par an, le nombre d'oeufs émis à chaque ponte et la relation entre ces facteurs et la taille et l'âge du poisson. Fischer et Balboutin (1970) ont décrit des techniques utiles pour trier les oocytes en groupes de taille et les sous-échantillonner dans ces espèces, pendant que Macer (sous presse) a décrit une méthode pour le chinchard (Trachurus trachurus) basée sur l'examen histologique des ovaires pendant un cycle complet de reproduction. La méthode nécessite beaucoup de temps et n'est pas applicable aux programmes d'échantillonnage courants mais elle permet une solution au problème.
Le sexe des élasmobranches peut toujours être déterminé d'après des caractères externes paroe que les mâles ont une paire de mixoptérygiums (organes copulateurs, organes d'accouplement) qui sont visibles dès les stades précoces de développement sur le bord interne des nageoires pelviennes (Fig. 5.3). Les femelles n'ont pas de mixoptérygiums.
La maturité des mâles peut facilement et très bien etre définie d'après l'état de développement des mixoptérygiums. Ceux des poissons immatures sont petits et flasques et n'atteignent pas le bord postérieur des nageoires pelviennes (Fig. 5.3a). Chez le poisson en cours de maturation les mixoptérygiums sont plus grands; ils s'étendent jusqu'au bord postérieur des nageoires pelviennes et la structure interne est visible mais molle et non-ossifiée (Fig. 5.3b); chez le poisson mûr les mixoptérygiums s'étendent bien au delà du bord postérieur de la nageoire pelvienne, la structure interne est visible et est dure et ossifiée (Fig. 5.3c).
La maturité des femelles doit être déterminée par examen interne. Le système reproducteur des femelles se compose d'ovaires (généralement deux, mais chez quelques espèces il n'y en a qu'un), des glandes nidamentaires et des oviductes (Fig. 5.4). Chez les poissons immatures l'ovaire est à peine discernable et il ne contient pas d'oeufs, la glande nidamentaire est aussi très petite et les oviductesont des parois épaises et sont blanos (Fig. 5.4a). Chez les poissons en cours de maturation des oeufs blancs sont visibles dans les ovaires mais le reste du système reproducteur est semblable à celui du poisson immature (Fig. 5.4b). Chez le poisson mûr les ovaires contiennent des oeufs jaunes, sauf immédiatement après l'ovulation chez les espèces vivipares et à la fin de la saison de reproduction chez les espèces ovipares. La glande nidamentaire est agrandie et les oviduotes distendus, et chez les espèces vivipares leurs parois sont minoes, flasques et souvent très vacularisées (Fig. 5.4d). Chez les espèces vivipares la maturité est aussi associée à des changements de dimension du cloaque (Fig. 5.4c).
Les élasmobranches sont soit ovipares (pondant des oeufs), soit ovovipares (les oeufs sont retenus dans la mère jusqu'à ce que les jeunes soient capables de mener une vie libre mais la mère ne fournit aucune nourriture aux jeunes), soit vivipares c'est-à-dire semblable aux ovovipares sauf qu'il y a une certaine liaison établie entre la mère et les jeunes par laquelle elle les nourrit.
La détermination de la fécondité des deux groupes portant leurs petits vivants dépend à la fois de la connaissance du nombre de jeunes et de la durée du cycle de gestation. Le premier peut être déterminé en comptant les oeufs jaunes se développant dans l'ovaire ou le nombre de jeunes dans “l'utérus” (le système combiné oviducte-cloaque). Dans ce dernier cas il faut faire attention de s'assurer qu'il n'y a pas eu d'avortement prématuré des jeunes pendant la capture et dans les deux cas il faut établir que le cannibalisme ne s'installe pas dans l'utérus (chez quelques espèces les premiers jeunes à éclore dévorent les oeufs restantes). La durée du cycle de gestation est moins facile à déterminer. La meilleure façon est d'obtenir des échantillons sur une année et de déterminer la longueur moyenne des jeunes et le volume de leur sac vitellin. Toutes les augmentations soudaines incompatibles, de la croissance des jeunes doivent être traitées avec suspicion. Les cycles de gestation des élasmobranches portant leurs petits vivants sont souvent très longs, deux ans pour l'aiguillat Squalus acanthias (Ford, 1922). Souvent les femelles à un stade du cycle ne sont pas faciles à capturer et cela peut conduire à de fausses conclusions sur la durée du cycle (voir Holden (1974) pour un examen complet de ces problèmes).
Les espèces ovipares sont des reproducteurs partiels et posent les mèmes problèmes que les téléostéens reproducteurs partiels. La seule étude à jour de ce problème est celle de la raie bouclée (Raja clavata) par Holden (sous presse). Il a déterminé la présence de capsules d'oeufs dans les exemplaires pris toute l'année et ensuite il a mis en équation le mois pendant lequel la présence de capsules d'oeufs était au maximum avec le taux maximum de ponte observée en aquarium (1 oeuf toutes les 24 h). Pour les autres mois le taux de ponte était supposé être proportionnel au pourcentage de présence de capsules d'oeufs. Cela, multiplié par le nombre de jours du mois a donné le nombre d'oeufs pondus chaque mois. Par exemple, que le pourcentage de présence en Avril (30 jours) soit 40 % au lieu de 80 % en Juin, le pourcentage le plus élevé de présence de capsules d'oeufs observé. On prend 80 % comme équivalent à un oeuf pondu en 24 h et ainsi 40 % est équivalent à 1 oeuf pondu par 48 h ce qui en 30 jours aurait pour résultat 15 oeufs pondus.
Chez toutes les espèces la fécondité parait être en relation avec la longueur du poisson selon une équation du type F = a Lb (Fig. 5.5). Une telle équation peut être amenée à une forme linéaire en la convertissant en logarithmes, p. ex. log F = a + b log L, dans laquelle F = fécondité, L = longueur du poisson, et a et b sont des constantes. La valeur de b est normalement voisine de 3 bien que pour quelques élasmobranches elle soit plus près de 2. Pitcher et Macdonald (1973) ont montré que si on utilise la longuer moyenne dans cette équation pour l'estimation d'un stock, le nombre d'oeufs est sousestimé parce que les petits poissons ont proportionnellement moins d'oeufs que les grands poissons.
Les constantes ne sont pas les mèmes pour toutes les espèces et pour une espèce a et b se modifient tous deux avec le temps. Des stocks de la mème espèce, peuvent aussi être séparés par des différences significatives en statistique entre les valeurs de a ou de b dans les relations fécondité-poids et fécondité-longueur. Comme le poids d'un poisson est normalement étroitement proportionnel au cube de la longueur la relation fécondité-poids est linéaire pour les espèces pour lesquelles b est voisin de 3 (Fig. 5.5) de la forme F = a W + b, où W est le poids du poisson. Une autre facon d'exprimer ces différences est d'utiliser un “indice de fécondité” exprimé soit comme fécondité/poids ou fécondité/ longueur³. Cette dernière forme est la meilleure expression parce qu'elle évite la variance en poids causée par la croissance des gonades dans un stock pendant une saison.
Baxter, I.G., 1963 A comparison of fecundities of early and late maturity stages of herring in the north-western North Sea. Rapp. P.-V. Reun. Cons. Perm. Int. Explor. Mer, 154:170–4
Boyar, H.C. et R.A. Clifford, 1967 Au automatic device for counting dry fish eggs. Trans Am. Fish. Soc., 96(3):361–3
Fischer, W. et F. Balboutin, 1970 On the investigation of ovarial cycle and fecundity of fish with special reference to partial spawners. Ber. Dtsch. Wiss. Kommo Meeresforsch., 21:56–77.
Ford, E., 1922 A contribution to our knowledge of the life histories of the dogfishes landed at Plymouth. J. Mar. Bio. U.K., 12:468–505
Holden, M.J., 1974 Problems in the rational exploitation of elasmobranchs and some suggested solutions. In Sea fisheries research, edited by F.R. Harden-Jones, London, Elek Science, pp. 117–37.
Holden, M.J., The fecundity of Raja clavata in British waters. J. Cons. Int. Explor. Mer, (in press)
Howard, G.B. et A. Landa, 1958 A study of the age, growth, sexual maturity, and spawning of the Anchoveta (Cetengraulis mysticetus) in the Gulf of Panama. Bull Inter-Am. Trop. Tuna Comm., 2:391–467
Macer, C.T., The fecundity and breeding biology of the horse mackerel (Trachurus trachurus in British waters. F. Fish. Biol., (in press)
Parrish, B.B., 1960 I.G. Baxter et M.J.D. Mowat, An automatic fish egg counter. Nature, Lond, 185(4715)777
Pitcher, T.J. et P.D.M. Macdonald, 1973 A numerical integration method for fish population fecundity. J. Fish. Biol., 5:549–53
Schaefer, M.B. et C.J. Orange, 1956 Studies on the sexual development and spawning of yellowfin tuna (Neothunnus macropterus) and skipjack (Katsuwonus pelamis) in three areas of the eastern Pacific Ocean by examination of gonads. Bull. Inter-Am. Tuna Comm., 1(6):281–349.
| Stade | Etat | Description |
|---|---|---|
I |
Vierge | Organes sexuels très petits, placés près de la colonne vertébrale. Testicules et ovaires transparents, incolores ou gris. Oeufs invisibles à l'oeil nu. |
II | Vierge en maturation et récupérant
après la ponte | Testicules et ovaires translucides, gris-rouge. Longueur des gonades ½, ou légèrement plus, de la longueur de la cavité abdominale. Oeufs individuels pouvant être vus avec une loupe. |
III | En développement | Testicules et ovaires opaques, rougeâtres avec des capillaires sanguines. Ocupent environ ½ de la cavité abdominale. Oeufs visibles à l'oeil nu comme matériel granuleux blanchâtre. |
IV | Développé | Testicules blanc-rougeâtre, pas de laitance quand on presse. Ovaires rouge-orange. Oeufs nettement discernables, opaques. Testicules et ovaires occupent environ ⅔ de la cavité abdominale. |
V | Gravide | Les organes sexuels remplissent la cavité abdominale. Testicules blancs. Gouttes de laitance produites quand on presse. Oeufs complètement ronds quelques uns déjà translucides et mûrs. |
VI | Reproduction | Oeufs et laitance s'écoulent quand on presse légèrement. La plupart des oeufs translucides avec peu d'oeufs opaques laissés dans l'ovaire. |
VII | Après ponte | Pas complètement vides, pas d'oeufs opaques laissés dans l'ovaire. |
VIII | Au repos | Testicules et ovaires rouges et vides. Quelques oeufs en état de résorption. |
| Stade | Etat | Description |
|---|---|---|
I | Immature | Ovaires et testicules environ ⅓ de la longueur de la cavité abdominale. Ovaires rosàtres, translucides; testicules blanchâtres. Oeufs invisibles à l'oeil nu. |
II | Vierge en maturation et récupération | Ovaires et testicules environ ½ de la longueur de la cavité abdominale. Ovaires rosâtres, translucides; testicules blanchâtres, plus ou moins symétriques. Oeufs invisibles à l'oeil nu. |
III | Mûrissant | Ovaires et testicules environ ⅔ de la longueur de la cavité abdominale. Ovaires de couleur jaune-rosâtre avec aspect granuleux, testicules blanchâtres à crême. Pas d'oeufs transparents ou translucides visibles. |
IV | Mûr | Ovaires et testicules de ⅔ à toute la longueur de la cavité abdominale. Ovaires de couleur rose-orange avec des vaisseaux sanguins superficiels visibles. Grands ceufs mûrs, transparents. Testicules blanc cremeux, mous. |
V | Après ponte | Ovaires et testicules rétractés à environ ½ de la longueur de la cavité abdominale. Parois lâches. Ovaires peuvent contenir des restes d'oeufs opaques et mûrs en désintégration, assombris ou translucides. Testicules injectés de sang et flasques. |
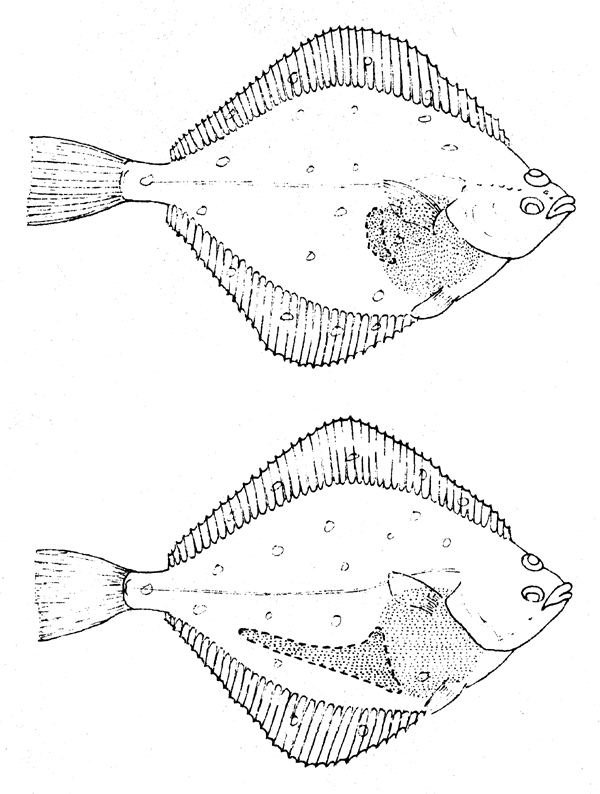
Fig 5.1 Différenciation sexuelle chez la pile - en haut: mâle; en bas: femelle
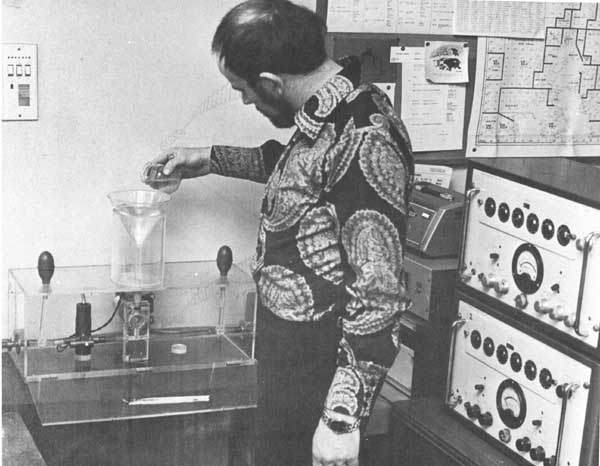
Fig. 5.2a Compteur automatique d'oeufas de poisson

Fig. 5.2b Comteur automatique d'oeufs de poisson
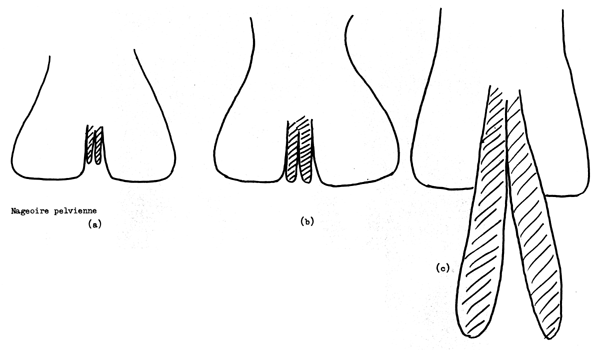
Fig. 5.3 Stades de maturité d'élasmobranche mâle; les mixipterygiums sont hachués en oblique. (a) inmature, (b) en maturation sexuelle, et (c) à maturité sexuelle
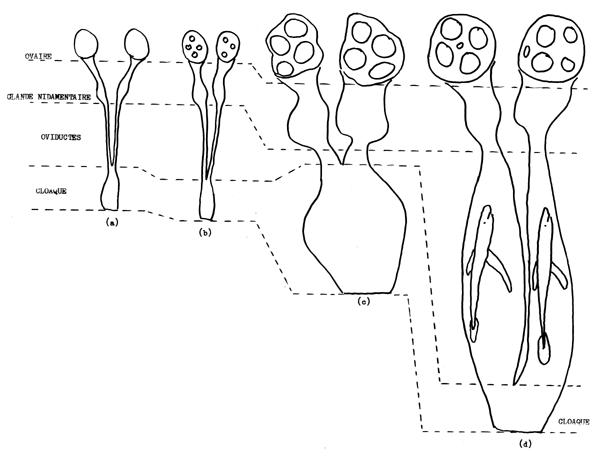
Fig. 5.4 Stades de maturité d'élasmobranche femelle; (a) inmature, (b) en maturation sexuelle, (c) â maturité sexuelle, escèce ovipare, (d) â maturité sexuelle, espèce vivipare (paroi de l'oviducte légérement vascularisée).
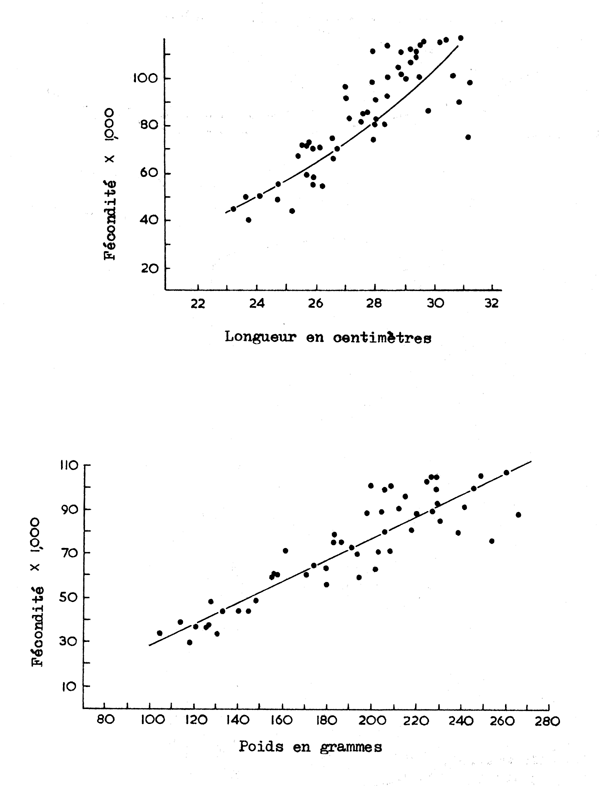
Fig. 5.5 Relations fécondité/longueur et fécondité/poids chez le hareng