J. Régnière
Jacques Régnière travaille auprès de Ressources naturelles Canada, Service canadien des forêts, Station de Sainte-Foy, Québec (Canada).
Le fait de connaître les effets des principaux facteurs climatiques sur le développement des espèces d’insectes, notamment la température, permet de prédire leur aire de répartition géographique potentielle et leur performance face aux changements climatiques.
| La spongieuse, Lymantria dispar: les modèles de saisonnalité de cet insecte nuisible introduit en Amérique du Nord prédisent qu’il avancera davantage vers le nord et l’ouest jusqu’au Canada où il pourrait menacer un nombre considérable d’essences feuillues |
 |
J.H. Ghent/US Forest Service/Bugwood.org |
Nombreuses sont les preuves indiquant que les aires de répartition des insectes évoluent à des rythmes sans précédent. Les altérations du climat de la planète offrent aux espèces d’insectes mobiles un nombre croissant d’habitats hospitaliers, et l’expansion du commerce mondial augmente les occasions pour les insectes mobiles de coloniser de nouveaux habitats.
Le présent article décrit les impacts potentiels de l’évolution du climat sur les insectes forestiers, ainsi qu’une méthode permettant de prédire leur répartition en fonction de leurs réactions physiologiques connues à des facteurs climatiques particuliers. La modélisation se fonde principalement sur les réactions au plan du développement, car ce sont elles qui établissent les climats sous lesquels un insecte peut mener à bien une saisonnalité stable et adaptative. Les modèles peuvent aussi tenir compte d’autres influences imputables au climat, comme la tolérance au froid. Trois exemples concernant l’Amérique du Nord sont présentés: la tordeuse des bourgeons de l’épinette indigène (Choristoneura fumiferana); la spongieuse envahissante introduite (Lymantria dispar); et le dendroctone du pin indigène (Dendroctonus ponderosae).
Ces études prédisent que l’aire de répartition de la plupart des espèces d’insectes se déplacera vers les pôles et vers des altitudes majeures sous l’effet des changements climatiques prévus, et que les régions tempérées souffriront le plus de ces déplacements. Les nouvelles aires de répartition pourront être favorables ou défavorables, suivant les espèces et le point de vue; mais les modèles laissent entendre qu’un monde au climat plus chaud n’est pas nécessairement un monde envahi par davantage d’insectes nuisibles.
Les insectes sont la forme de vie animale la plus diversifiée des écosystèmes terrestres. La plupart d’entre eux sont inoffensifs et font partie intégrante des écosystèmes naturels. Comme les insectes sont ectothermes, les rythmes des principaux processus physiologiques de leur cycle de vie sont déterminés par les conditions environnementales, notamment la température et les précipitations. D’une manière générale, ils ont des durées de génération brèves, une grande fécondité et une forte mobilité (tant par leurs propres moyens que grâce au vent, aux animaux et aux êtres humains). Les effets des changements climatiques sur les insectes forestiers (étudiés par Moore et Allard, 2008) doivent être mis en relation avec l’intensification du commerce international et les variations des modèles d’affectation des terres.
Les études des fossiles suggèrent que des épisodes antérieurs de réchauffement rapide du globe ont déterminé une augmentation du nombre d’insectes herbivores (Currano et al., 2008). De même, les niveaux d’insectes herbivores tendent actuellement à s’accroître (DeLucia et al., 2008), par exemple dans les forêts de bouleaux du nord de l’Europe (Wolf, Kozlov et Callaghan, 2008). Ces phénomènes s’expliquent, entre autres, par l’affaiblissement des défenses des végétaux et l’augmentation de leur valeur nutritionnelle en présence de volumes accrus de CO2 et de O3 (Kopper et Lindroth, 2003) et par la modification de la synchronie saisonnière entre les végétaux, les insectes herbivores et leurs ennemis naturels (van Asch et Visser, 2007; Stireman et al., 2005).
De nombreux insectes sont sensibles aux événements climatiques extrêmes (sécheresse, vagues de chaleur ou de froid). Du fait de l’altération du climat et de la déforestation, les environnements tropicaux, qui hébergent la majeure partie de la biodiversité de la planète, pourraient fort bien s’avérer trop chauds, secs ou fragmentés pour permettre à de nombreuses espèces d’insectes de subsister (Williams, Bolitho et Fox, 2003). Les espèces qui ont des interactions hôte plante très développées ou qui vivent dans des micro-habitats sont particulièrement en danger d’extinction, notamment dans les zones tropicales (Lewis, 2006).
Nouvelles aires de répartition
Les climats des zones tempérées et subarctiques offrent une hospitalité croissante aux plantes et aux insectes, suscitant des préoccupations liées au comportement des espèces indigènes et au risque d’invasion par des espèces exotiques, ce qui pourrait perturber les fonctions normales de l’écosystème. De nombreuses espèces propres aux zones tempérées ont altéré leur aire de répartition en réponse à l’évolution récente du climat. Telles sont la processionnaire du pin (Thaumetopoea pityocampa) en Europe (Battisti et al., 2006), l’arpenteuse tardive (Operophtera brumata) et l’arpenteuse verte veloutée (Epirrita autumnata) en Scandinavie (Jepsen et al., 2008), et le dendroctone méridional du pin (Dendroctonus frontalis) en Amérique du Nord (Tran et al., 2007). Certaines espèces, qui ont été enfermées dans le passé dans leur aire de répartition par des barrières géographiques, comme les montagnes et les grandes masses d’eau, sont susceptibles aujourd’hui de surmonter ces barrières et d’étendre soudain leur aire de répartition. Par exemple, le déplacement accru de masses d’air chaud vers des latitudes plus élevées a déterminé récemment des afflux de la fausse-teigne des crucifères (Plutella xylostella) dans les îles norvégiennes de Svalbard dans l’océan Arctique, à 800 km au nord du bord de son aire de répartition actuelle dans l’ouest de la Fédération de Russie (Coulson et al., 2002).
Le sort de certaines espèces d’insectes dépend de leur niveau de spécialisation (aire de répartition des hôtes et des habitats), de leur mobilité et de facteurs limitant leur distribution. Les espèces spécialistes de papillons se caractérisent par une ample décroissance au Royaume-Uni, alors que des espèces généralistes augmentent (Thomas, 2005; Franco et al., 2006). La richesse des espèces d’insectes s’accroît dans les habitats froids de la planète (Andrew et Hughes, 2005). Les espèces de papillons rencontrées dans l’ensemble du Royaume-Uni diminuent le plus rapidement au sud, alors que celles qui sont propres aux zones méridionales tendent à coloniser le nord (Conrad et al., 2004). Ainsi, le déplacement des aires de répartition géographique des insectes pourrait se traduire simultanément par une expansion à l’extrémité supérieure et une contraction à l’extrémité inférieure de leurs limites latitudinales et altitudinales (Parmesan et al., 1999).
La constitution génétique des espèces d’insectes subit aussi des changements sous l’effet des variations climatiques. Bien que l’évolution génétique soit un processus naturel normal, des altérations morphologiques exceptionnellement rapides ont été observées sur des périodes brèves (de l’ordre d’une décennie). Il s’agit d’altérations liées à la capacité de vol (Hill, Thomas et Blakeley, 1999; Thomas et al., 2001), aux stratégies de survie, à l’induction de la diapause (dormance) (Burke et al., 2005), au développement physiologique (Rank et Dahlhoff, 2002) et à la résistance au froid (Calosi et al., 2008) chez des espèces qui modifient leur aire de répartition.
Fréquence des infestations
Les signes probants de changements de fréquence des infestations chez les insectes forestiers nuisibles résultant de l’évolution du climat sont rares, car ils doivent être fondés sur des données historiques de longue durée et une bonne connaissance de la dynamique de la population de chaque insecte. Une multitude de données a relié le stress de sécheresse dû au changement climatique aux graves dommages causés par les insectes au pin (Pinus spp.) dans le sud-ouest des États-Unis (Trotter, Cobb et Whitham, 2008). Il a été observé que les cycles réguliers d’infestation (de 8 à 13 ans) de la tordeuse des bourgeons du mélèze (Zeiraphera diniana) en Suisse se sont interrompus depuis le début des années 1970 (Esper et al., 2007). La gravité et la fréquence des infestations de la tordeuse des bourgeons de l’épinette (Choristoneura spp.) dans l’est du Canada semblent avoir augmenté au cours des 200 dernières années (Simard, Morin et Lavoie, 2006). Les changements climatiques peuvent influencer le comportement de populations d’insectes dans leur aire de répartition actuelle en altérant les interactions écologiques qui les régissent. Ces effets sont difficiles à prévoir, notamment parce que la dynamique des populations de seules quelques espèces est suffisamment comprise (Harrington, Fleming et Woiwod, 2001). Même pour les espèces qui ont fait l’objet d’études plus approfondies, comme la tordeuse des bourgeons de l’épinette en Amérique du Nord, la complexité des interactions écologiques en jeu est réellement écrasante (Eveleigh et al., 2007).
La propagation mondiale d’espèces d’insectes forestiers nuisibles est une conséquence possible de l’évolution du climat. En raison de la diversité et de la complexité des réactions des insectes aux facteurs climatiques, il est difficile de formuler des prédictions générales. Les outils de modélisation génériques comme BioSIM (Régnière et St-Amant, 2008) utilisent les connaissances disponibles sur les réactions de certaines espèces (normalement des ravageurs) aux principaux facteurs climatiques pour prédire leur répartition géographique et leur comportement éventuels. Ces modèles tiennent compte principalement des facteurs qui déterminent la saisonnalité de l’insecte et de ceux qui influencent leur survie pendant la saison la plus âpre (normalement l’hiver). Ils se fondent sur le principe selon lequel le besoin le plus fondamental de l’insecte est de compléter son cycle de vie suivant un modèle saisonnier bien adapté, avec une synchronie adéquate entre les ressources essentielles, comme les plantes hôtes servant à leur alimentation et à leur abri, et les stades qui les exigent. Si une espèce est incapable de satisfaire cette viabilité de base d’une génération à l’autre sous un climat particulier, elle ne peut pas subsister dans cet environnement.
Une fois que le modèle de saisonnalité est disponible pour une espèce d’insecte, sa répartition peut être prédite en mappant les climats qui produisent la saisonnalité viable avec plus ou moins de certitude, et en superposant au mappage la répartition des ressources vitales (ou le plus à risque) pour cette espèce. On peut affiner ultérieurement les prédictions en tenant compte aussi de la probabilité de survie dans des conditions climatiques extrêmes (en se fondant, par exemple, sur sa tolérance au froid ou à la chaleur). Cette méthode a été appliquée à trois importantes espèces de forêts nord-américaines, en utilisant des normales climatiques (moyennes et modifications calculées sur des intervalles standards de 30 ans) pour les périodes 1971-2000 et 2041-2070, sur la base d’un scénario prudent de changement climatique déterminé par une augmentation de 1 pour cent par an du CO2 atmosphérique (Logan, Régnière et Powell, 2003).
Trois exemples nord-américains
La tordeuse des bourgeons de l’épinette (Choristoneura fumiferana) est un insecte défoliateur indigène des conifères, dont l’aire de répartition va de la côte ouest à la côte est du Canada et traverse le nord des États-Unis, du Minnesota dans le Midwest au Maine sur la côte est. La partie septentrionale de son aire actuelle est normalement limitée par celle des plantes hôtes. Toutefois, il existe des zones dans l’est du Canada où elle est limitée par le climat défavorable et où les changements climatiques sont susceptibles de lui permettre de prospérer. L’analyse a utilisé un modèle détaillé axé sur les processus pour déterminer les effets de la température sur le développement de l’insecte. Le froid hivernal n’est pas un facteur de mortalité particulièrement important pour la tordeuse des bourgeons de l’épinette; cette espèce, qui est strictement univoltine (elle n’a qu’une génération par an), passe l’hiver dans une diapause profonde au début du développement larvaire. Lorsque les plantes hôtes sont disponibles, sa limite septentrionale et altitudinale est déterminée par les étés trop froids pour permettre l’éclosion des œufs avant l’hiver, ce qui laisserait le temps aux larves de trouver un abri hivernal approprié. Ainsi, la probabilité d’une éclosion des œufs avant l’arrivée de l’hiver est un bon facteur d’estimation de la capacité de l’insecte à subsister dans un lieu donné. Les modèles décrivent avec précision la répartition actuelle de l’insecte dans l’est du Canada. Lorsque le climat change, cette aire de répartition devrait se déplacer lentement vers des latitudes plus septentrionales et des altitudes majeures, et n’être limitée que par la disponibilité d’arbres hôtes adaptés (figure 1). Il est prouvé que ce phénomène s’avère déjà, car une nouvelle infestation se manifeste actuellement à des latitudes anormalement élevées sur la rive septentrionale du fleuve Saint-Laurent au Québec. Des infestations plus graves et prolongées peuvent donc être escomptées dans des zones qui ont normalement échappé à ces dommages dans le passé grâce au climat inclément.
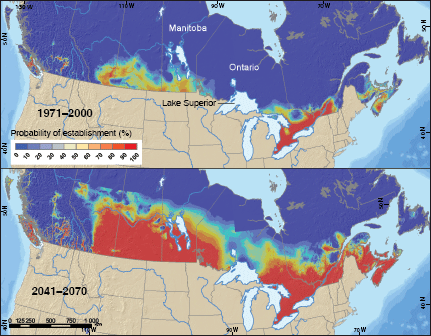
La spongieuse (Lymantria dispar) venue d’Europe s’est introduite dans le nord-est des États-Unis en 1869 et s’y est propagée à l’ouest et au sud, ainsi qu’au nord jusqu’au Canada où elle a atteint désormais sa limite septentrionale établie par les conditions climatiques défavorables. À l’heure actuelle, la spongieuse est confinée à l’est du lac Supérieur (figure 2). Un modèle de la saisonnalité de l’insecte a été utilisé pour prédire la probabilité de son établissement au Canada (Régnière, Nealis et Porter, 2009). Le modèle a prédit que cette espèce, qui est fortement polyphage (elle a beaucoup de plantes hôtes), menacera un nombre considérable de forêts feuillues à mesure que les changements climatiques lui permettront de s’étendre plus au nord et à l’ouest jusqu’au Canada. On a estimé que la proportion des forêts décidues du Canada qui risquent d’être endommagées par la spongieuse passera de 15 pour cent actuellement à plus de 75 pour cent d’ici à 2050. La stratégie de gestion visant à réduire ce risque comprend, dans une large mesure, le monitorage et la surveillance de l’ouest du lac Supérieur, qui a constitué une barrière géographique à l’extension vers le nord de l’itinéraire de l’insecte entre l’Ontario et le Manitoba, conjointement au programme «Slow the Spread»mis en œuvre dans le Midwest des États-Unis pour arrêter sa propagation à partir du sud.
Le dendroctone du pin (Dendroctonus ponderosae) est un scolyte originaire d’Amérique du Nord, qui a été confiné à l’ouest du continent par les barrières géographiques constituées par les montagnes Rocheuses et les Grandes Plaines. Un ample bagage d’informations est disponible sur les réactions physiologiques de l’insecte à la température, tant en termes de développement (Bentz, Logan et Amman, 1991) que de tolérance au froid (Régnière et Bentz, 2007). Des modèles ont été utilisés pour déterminer la zone du Canada la plus adaptée à cet insecte. Exactement une génération par an est idéale pour cette espèce sans diapause. Des cartes des risques ont été dressées pour le pays avec superposition des probabilités que l’insecte puisse mener à bien une saisonnalité adaptative et qu’il puisse survivre dans le froid extrême de l’hiver canadien, sous les climats actuels aussi bien que futurs. (figure 3). Ces cartes laissent entendre que le Canada à l’est des montagnes Rocheuses restera longuement inhospitalier pour cet insecte à l’avenir, à l’exception de certaines parties du nord-ouest de l’Alberta et de la côte atlantique. Toutefois, le risque d’infestations du dendroctone du pin dans l’ouest du pays augmentera sans doute de façon spectaculaire aux latitudes et altitudes plus élevées, mais diminuera aux latitudes et altitudes inférieures. Cette information, conjuguée aux connaissances sur la susceptibilité des différentes espèces de pin (Pinus) dans la forêt boréale du Canada, a permis à ce pays de concevoir une stratégie contre les risques pour la gestion d’une infestation sans précédent du dendroctone du pin en Colombie-Britannique et dans l’Alberta (Nealis et Peter, 2008). [NDLR: voir l’article de Konkin et Hopkins dans ce numéro.]
| 2 Probabilité de l’établissement de la spongieuse au Canada, dans les conditions climatiques actuelles et celles prédites pour l’avenir, sur la base d’une saisonnalité adaptée |
 |
La littérature met en évidence une perte de biodiversité chez les insectes des zones tropicales de la planète, à mesure que des espèces hautement spécifiques font face à la disparition des climats et des hôtes adaptés. Aux latitudes moyennes, les déplacements de la répartition vers les latitudes et altitudes supérieures semblent prévaloir, notamment chez les espèces polyphages et fortement mobiles.
Des modèles détaillés des réactions au climat de chaque espèce d’insecte sont nécessaires pour prédire les changements de répartition avec un minimum de précision. Cependant, il paraît difficile de formuler des prédictions générales quant aux réactions des principales espèces d’insectes forestiers nuisibles du point de vue de la sévérité et de la fréquence des infestations dans leur aire de répartition actuelle. On observe un risque croissant d’«invasion» des écosystèmes tempérés de plus en plus hospitaliers par les espèces particulièrement mobiles. Toutefois, les modèles donnent à penser que l’aire de répartition des insectes ne devrait pas s’étendre, mais plutôt se déplacer vers des latitudes et altitudes majeures. C’est pourquoi il n’est pas dit qu’un monde plus chaud soit nécessairement un monde plus peuplé de ravageurs.![]() Bibliographie
Bibliographie
Andrew, N.R. et Hughes, L. 2005. Diversity and assemblage structure of phytophagous Hemiptera along a latitudinal gradient: predicting the potential impacts of climate change. Global Ecology and Biogeography, 14: 249–262.
Battisti, A., Stastny, M., Buffo, E. et Larsson, S. 2006. A rapid altitudinal range expansion in the pine processionary moth produced by the 2003 climatic anomaly. Global Change Biology, 12: 662–671.
Bentz, B.J., Logan, J.A. et Amman, G.D. 1991. Temperature-dependent development of the mountain pine beetle (Coleoptera: Scolytidae) and simulation of its phenology. The Canadian Entomologist, 123: 1083–1094.
Burke, S., Pulin, A.S., Wilson, R.J. et Thomas, C.D. 2005. Selection of discontinuous life-history traits along a continuous thermal gradient in the butterfly Aricia agestis. Ecological Entomology, 30: 613–619.
Calosi, P., Bilton, D.T., Spicer, J.I. et Atfield, A. 2008. Thermal tolerance and geographical range size in the Agabus brunneus group of European diving beetles (Coleptera: Dytiscidae). Journal of Biogeography, 35: 295–305.
Conrad, K.F., Woiwod, I.P., Parsons, M., Fox, R. et Warren, M.S. 2004. Long-term population trends in widespread British moths. Journal of Insect Conservation, 8: 119–136.
Coulson, S.J., Hodkinson, I.D., Webb, N.R., Mikkola, K., Harrison, J.A. et Pedgley, D.E. 2002. Aerial colonization of high Arctic islands by invertebrates: the diamondback moth Plutella xylostella (Lepidoptera: Yponomeutidae) as a potential indicator species. Diversity and Distributions, 8: 327–334.
Currano, E.D., Wilf, P., Wing, S.L., Labandeira, C.C., Lovelock, E.C. et Royer, D.L. 2008. Sharply increased insect herbivory during the paleocene-eocene thermal maximum. Proceedings of the National Academy of Sciences, 105: 1960–1964.
DeLucia, E.H., Casteel, C.L., Nabity, P.D. et O’Neill, B.F. 2008. Insects take a bigger bite out of plants in a warmer, higher carbon dioxide world. Proceedings of the National Academy of Sciences, 105: 1781–1782.
Esper, J., Büntgen, U., Frank, D.C., Nievergelt, D. et Liebhold, A. 2007. 1200 years of regular outbreaks in alpine insects. Proceedings of the Royal Society Series B, 274: 671–679.
Eveleigh, E.S., McCann, K.S., McCarthy, P.C., Pollock, S.J., Lucarotti, C.J., Morin, B., McDougall, G.A., Strongman, D.B., Huber, J.T., Umbanhowar, J. et Faria, L.B.D. 2007. Fluctuations in density of an outbreak species drive diversity cascades in food webs. Proceedings of the NationalAcademy of Sciences, 104: 16976–16981.
Franco, A.M.A., Hill, J.K., Kitschke, C., Collingham, Y.C., Roy, D.B., Fox, R., Huntley, B. et Thomas, C.D. 2006. Impacts of climate warming and habitat loss on extinctions at species’ low-latitude range boundaries. Global Change Biology, 12(8): 1545–1553.
Harrington, R., Fleming, R.A. et Woiwod, I.P. 2001. Climate change impacts on insect management and conservation in temperate regions: can they be predicted? Agricultural and Forest Entomology, 3: 233–240.
Hill, J.K., Thomas, C.D. et Blakeley, D.S. 1999. Evolution of flight morphology in a butterfly that has recently expanded its geographic range. Oecologia, 121: 165–170.
Jepsen, J.U., Hagen, S.B., Ims, R.A. et Yoccoz, N.G. 2008. Climate change and outbreaks of the geometrids Operophtera brumata and Epirrita autumnata in subarctic birch forest: evidence of a recent outbreak range expansion. Journal of Animal Ecology, 77: 257–264.
Kopper, B.J. et Lindroth, R.L. 2003. Effects of elevated carbon dioxide and ozone on the phytochemistry of aspen and performance of an herbivore. Oecologia, 134: 95–103.
Lewis, S.L. 2006. Tropical forests and the changing earth system. Philosophical transactions of the Royal Society B, 361: 195–210.
Logan, J.A., Régnière, J. et Powell, J.A. 2003. Assessing the impact of global warming on forest pest dynamics. Frontiers of Ecology and the Environment, 1(3): 130–137.
Moore, B. et Allard, G. 2008. Climate change impacts on forest health. Document de travail sur la santé des forêts et la biosécurité FBS/34E. Rome, Italie, FAO.
Nealis, V. et Peter, B. 2008. Risk assessment of the threat of mountain pine beetle to Canada’s boreal and eastern pine forests. Information Report BC-X-417. Victoria, Colombie- Britannique, Canada, Ressources naturelles Canada, Service canadien des forêts, Centre de foresterie du Pacifique.
Parmesan, C., Ryrholm, N., Stefanescu, C., Hill, J.K., Thomas, C.D., Descimon, H., Huntley, B., Kaila, L., Kullberg, J., Tammaru, T., Tennent, W.J., Thomas, J.A. et Warren, M. 1999. Poleward shifts in geographical ranges of butterfly species associated with regional warming. Nature, 399: 579–583.
Rank, N.E. et Dahlhoff, E.P. 2002. Allele frequency shifts in response to climate change and physiological consequences of allozyme variation in a montane insect. Evolution, 56: 2278–2289.
Régnière, J. et Bentz, B. 2007. Modeling cold tolerance in the mountain pine beetle, Dendroctonus ponderosae. Journal of Insect Physiology, 53: 559–572.
Régnière, J., Nealis, V. et Porter, K. 2009. Climate suitability and management of the gypsy moth invasion into Canada. Biological Invasions, 11: 135–148.
Régnière, J. et St-Amant, R. 2008. BioSIM 9 – Manuel de l’utilisateur. Rapport d’information LAU-X-134. Québec, Canada, Ressources naturelles Canada, Service canadien des forêts, Centre de foresterie des Laurentides.
Simard, I., Morin, H. et Lavoie, C. 2006. A millenial-scale reconstruction of spruce budworm abundance in Saguenay, Québec, Canada. The Holocene, 16: 31–37.
Stireman, J.O. III, Dyer, L.A., Janzen, D.H., Singer, M.S., Lill, J.T., Marquis, J.R., Ricklefs, R.E., Gentry, G.L., Hallwachs, W., Coley, P.D., Barone, J.A., Greemey, H.F., Connahs, H., Barbosa, P., Morais, H.C. et Diniz, I.R. 2005. Climatic unpredictability and parasitism of caterpillars: implications of global warming. Proceedings of the NationalAcademy of Sciences, 102: 17384–17386.
Thomas, C.D., Bodsworth, E.J., Wilson, R.J., Simmons, A.D., Davies, Z.G., Musche, M. et Conradt, L. 2001. Ecological and evolutionary processes at expanding range margins. Nature, 411: 577–581.
Thomas, J.A. 2005. Monitoring change in the abundance and distribution of insects using butterflies and other indicator groups. Philosophical Transactions of the Royal Society B, 360: 339–357.
Tran, J.K., Ylioja, T., Billings, R.F., Régnière, J. et Ayres, M.P. 2007. Impact of minimum winter temperatures on the population dynamics of Dendroctonus frontalis. Ecological Applications, 17: 882–899.
Trotter, R.T. III, Cobb, N.S. et Whitham, T.G. 2008. Arthropod community diversity and trophic structure: a comparison between extremes of plants stress. Ecological Entomology, 33: 1–11.
van Asch, M. et Visser, M.E. 2007. Phenology of forest caterpillars and their host trees: the importance of synchrony. Annual Review of Entomology, 52: 37–55.
Williams, S.E., Bolitho, E.E. et Fox, S. 2003. Climate change in Australian tropical rainforests: an impending environmental catastrophe. Proceedings of the Royal Society of London B, 270: 1887–1892.
Wolf, A., Kozlov, M.V. et Callaghan, T.V. 2008. Impact of non-outbreak insect damage on vegetation in northern Europe will be greater than expected during a changing climate. Climatic Change, 87: 91–106.