Deux techniques peuvent être utilisées pour la collecte de la semence des mâles des petits ruminants. La première est la collecte à l'aide d'un vagin artificiel, la seconde est la collecte à l'aide d'un électroéjaculateur. Cette dernière technique a été employée dans le passé avec des succès inégaux; elle conduit à l'obtention de semence ayant des caractéristiques différentes de celle obtenue au vagin artificiel (le volume de plasma séminal est généralement plus élevé). De plus, cette technique paraît douloureuse pour les animaux. Pour ces raisons, seule la collecte de semence à l'aide du vagin artificiel sera décrite ici.
Mâles dont la semence n'a jamais été collectée. Cette opération nécessite un certain nombre d'heures de travail et beaucoup de patience. Il est préférable de la commencer pendant la saison où la motivation sexuelle est à son maximum (fin de l'été et automne chez les races saisonnées) ou, chez les jeunes animaux, dès qu'ils ont atteint la puberté. Il est très important que ce soit la personne chargée des futures collectes qui fasse ce travail. L'entraînement pour la collecte au vagin artificiel doit également être réalisé au même endroit où les animaux seront collectés ultérieurement. Dans l'espèce ovine, les mâles sont disposés dans une salle d'attente d'une surface d'environ 1 m par mâle. Ils sont ensuite introduits calmement, un par un ou deux par deux, dans la salle de collecte et mis en présence des brebis boute-en-train. Une des brebis est laissée libre et l'autre est immobilisée.
Dans l'espèce caprine, du fait que les mâles sont élevés dans des boxes individuels, ils sont mis un par un en présence de la femelle immobilisée. Il est très important d'avoir des femelles manifestant un comportement d'œstrus au moment de la collecte. Des femelles entières peuvent être utilisées, en œstrus naturel ou induit par traitement hormonal classique. Des femelles castrées peuvent également être utilisées. Un traitement hormonal artificiel doit donc être employé pour aboutir à l'obtention d'un comportement d'œstrus:
Plusieurs situations peuvent alors se présenter:
1. Si le mâle manifeste un des éléments caractéristiques de la séquence du comportement sexuel (voir Comportement sexuel du mâle, chapitre 1), tels que flairage, approches ritualisées ou monte, il est nécessaire que l'opérateur tente une approche. Celle-ci doit être faite calmement afin d'éviter un réflexe de crainte de l'animal. Si la motivation sexuelle du mâle est suffisante et que, en dépit de la présence humaine, celui-ci continue de chevaucher la femelle, le vagin artificiel peut être présenté dès que le mâle est dans une position adéquate pour l'accouplement. Deux situations peuvent alors survenir:
2. Chez quelques animaux peu motivés, le comportement sexuel se limite à une tentative d'accouplement. L'opérateur doit alors être prêt à effectuer la collecte à chaque tentative de l'animal. Il peut aussi recourir à d'autres moyens pour améliorer la situation: détacher la femelle et la faire passer devant le mâle, changer de femelle, encourager le mâle de la voix ou tourner la tête de la femelle vers l'arrière (voir Comportement sexuel de la femelle, chapitre 1). Dans ce cas, une telle sollicitation ne doit pas excéder cinq à 10 minutes. Il est préférable de répéter les contacts avec la femelle, puisque c'est en général dans les minutes qui suivent chaque contact que le comportement sexuel est déclenché.
Dans l'espèce caprine, les mâles présentent généralement un comportement sexuel plus rapide et plus spectaculaire que les béliers et sont souvent plus faciles à collecter.
3. Quelques animaux manifestent une inhibition dans leur comportement sexuel, soit à cause de la présence de l'homme, soit parce qu'ils sont homosexuels ou simplement «non actifs», soit enfin parce qu'ils ont un problème d'ordre sanitaire.
Inhibition due à la présence de l'homme. Le mouton est un animal craintif et grégaire qui, lorsqu'il est isolé de ses congénères, manifeste des réactions de crainte. Les mâles réagissant ainsi requièrent un entraînement spécial, en particulier pour les familiariser avec le son de la voix de l'opérateur et l'odeur de ses vêtements. Celui-ci doit éviter de porter des vêtements aux couleurs vives (blouse blanche de laboratoire, par exemple) et préférer des couleurs sombres (bleu ou noir). Un autre moyen intéressant, qui peut être employé avec succès dans le cas de mâles présentant un comportement sexuel déficient en dépit de conditions d'élevage optimales pendant la période prépubère, est de les utiliser en même temps que d'autres mâles pour détecter l'œstrus des femelles, pendant la saison sexuelle par exemple ou lors d'un œstrus induit. La manipulation fréquente des mâles ainsi que la présence répétée de femelles en œstrus sont susceptibles de déclencher l'activité sexuelle.
Chez les caprins, peu d'animaux manifestent une inhibition dans leur comportement sexuel en présence de l'homme. Lorsque cela arrive, les mêmes méthodes que chez les ovins peuvent être employées.
Inhibition due à l'homosexualité. Un faible pourcentage de mâles déclenchent leur comportement sexuel en présence d'autres mâles. Cela se produit plus particulièrement lorsque les mâles sont élevés en groupes sans femelles au cours des 2-3 mois qui précèdent la puberté (voir Effets de l'environnement social et des conditions d'élevage sur l'activité de reproduction, chapitre 2). Dans le cas de l'homosexualité, le meilleur moyen de collecter les mâles au vagin artificiel est d'utiliser un mâle boute-en-train, au lieu d'une femelle.
Béliers «non travailleurs». De tels animaux ne manifesteront aucune libido, même dans le cas de lutte naturelle dans un troupeau de femelles.
Inhibition due à des problèmes sanitaires. Une infection du prépuce et/ou du pénis est très douloureuse et peut empêcher la monte. Une inflammation des articulations peut également empêcher la saillie et toute infection générale est susceptible de diminuer la motivation sexuelle.
L'importance relative de ces différentes inhibitions varie en fonction de l'espèce et de la race, mais aussi en fonction de l'origine des mâles. Si des mâles adultes sont récupérés en ferme (à cause de leur valeur génétique, par exemple) pour être utilisés dans un centre d'IA, ils sont toujours plus difficiles à collecter que les mâles élevés dans de bonnes conditions au centre même. Par conséquent, il est préférable de choisir les jeunes mâles le plus tôt possible (au sevrage, par exemple), afin de leur procurer les conditions d'élevage adéquates (présence de femelles avant la puberté chez le bélier, isolement chez le bouc, bonnes conditions sanitaires et alimentaires et manipulation fréquente par l'homme).
Une autre technique susceptible d'être utilisée avec succès chez les jeunes mâles est de placer la femelle boute-en-train dans le box des mâles, tandis que l'opérateur se tient prêt avec le vagin artificiel. Cette technique de collecte dans l'environnement habituel des animaux est efficace si elle est répétée jusqu'à ce qu'un nombre maximum de mâles deviennent actifs.
Mâles dont la semence a déjà été collectée auparavant. En général, les mâles déjà habitués ne manifestent pas de problèmes comportementaux, même après un repos sexuel de plusieurs mois, si la période de collecte de semence redémarre pendant la période d'activité sexuelle maximale (saison sexuelle annuelle chez les animaux saisonnés). Toutefois, si ce redémarrage se situe hors saison, une inhibition sexuelle peut se produire sur un faible nombre de mâles. Celle-ci est due à la saison et non à la peur de l'homme. Dans cette situation, il est nécessaire et généralement suffisant de stimuler le comportement sexuel de ces mâles en les mettant en présence de femelles en œstrus. Le meilleur moyen d'éviter tout problème avec les collectes de semence pendant la contre-saison est d'entraîner régulièrement les mâles à la collecte à des jours et heures fixes.
Espèce ovine
Organisation de la salle de collecte. Les mâles sont conduits à la salle de collecte et attachés au mur à l'aide d'une chaîne et d'un collier. Il doit y avoir le même nombre de points d'attache que de mâles à utiliser. Une femelle boute-en-train est alors immobilisée dans l'appareil de contention et une autre femelle est gardée à proximité dans 'le cas où une stimulation nouvelle serait nécessaire pour une seconde collecte.
Une solution alternative est de collecter les mâles directement dans leurs boxes. Cette solution n'est toutefois pas idéale dans la mesure où le lieu de collecte est alors loin du laboratoire.
Préparation des mâles. Une fois attachés, il est nécessaire de nettoyer soigneusement la partie abdominale des béliers, devant et autour du fourreau. Le lavage de l'intérieur du fourreau avec une solution saline (0,9 pour cent de NaCl), pour éliminer le maximum de fragments et d'impuretés qui ont pu s'y accumuler, est recommandé.
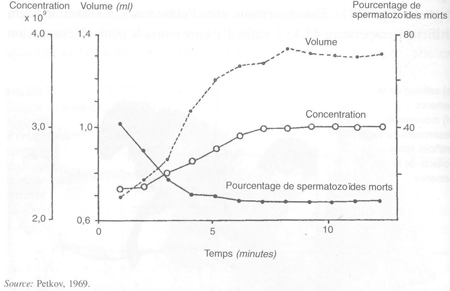
Chaque mâle est détaché et laissé en contact avec la femelle boute-en-train. Un temps d'attente de cinq à six minutes avant l'éjaculation accroît la quantité et la qualité de semence (figure 42) mais, en pratique, elle est difficile à mettre en œuvre. Il peut être préférable de forcer le mâle à effectuer des fausses montes en lui permettant de monter sur la femelle et en le forçant à descendre avant l'éjaculation.
FIGURE 41 Collecte de semence: séquence d'événements (a)matériel (b)femelle boute-en-train attachée (c)collecte de la semence (d)mouvement descendant du vagin artificiel après collecte de la semence

Collecte de la semence. L'opérateur, un genou à terre à côté du mâle, dévie légèrement avec la main le pénis du bélier en le manipulant au niveau du fourreau (figure 41). Simultanément, avec l'autre main, il avance le vagin artificiel (température 42-45°C) afin d'y faire entrer le pénis. L'éjaculation se produit alors immédiatement. Il est nécessaire de prendre garde à bien placer le vagin artificiel dans le prolongement du pénis afin que celui-ci pénètre complètement dans le vagin artificiel. Immédiatement après l'éjaculation, le mâle redescend et l'opérateur donne deux ou trois mouvements énergiques au vagin artificiel afin de faire descendre l'éjaculat à l'extrémité du tube de collecte gradué. Il est particulièrement important que la semence reste le moins longtemps possible en contact avec le caoutchouc du cône.
Afin de collecter immédiatement un deuxième éjaculat du même mâle dans le même tube de collecte, il est nécessaire de susciter un réflexe conditionné. Avec des mâles entraînés, pendant la saison sexuelle, deux éjaculats successifs peuvent être obtenus à un intervalle de une à deux minutes. Ce délai peut s'accroître chez des mâles non entraînés, en dehors de la saison sexuelle. Si le second éjaculat n'est pas obtenu au bout de deux à trois minutes, il est préférable de traiter le premier éjaculat. Le mâle sera alors rattaché et un second éjaculat pourra être collecté plus tard dans un autre vagin artificiel.
FIGURE 42 Effets de l'augmentation du temps de latence avant l'éjaculation sur les caractéristiques de l'éjaculat chez le bélier
Espèce caprine. L'organisation de la collecte de semence est assez différente pour les boucs, parce qu'ils sont conduits en cases individuelles, mais également parce que la semence non diluée apparaît plus fragile que dans l'espèce ovine.
Chaque bouc est conduit directement de son box jusqu'à la salle de collecte. L'opérateur s'agenouille à côté du mâle et effectue les mêmes manipulations que pour le bélier. Les fausses montes ne sont pas nécessaires et aucun effet positif du temps d'attente avant la collecte n'a été démontré. Les boucs peuvent, par conséquent, être collectés dès qu'ils entrent dans la salle de collecte. A cause de l'effet néfaste du plasma séminal, dans cette espèce, sur la survie in vitro des spermatozoïdes, il n'est pas recommandé d'attendre pour collecter un second éjaculat dans le même vagin artificiel. Immédiatement après la collecte, les mêmes procédures que pour le bélier doivent être appliquées afin de limiter le temps de contact de la semence avec le caoutchouc du cône. Une fois que la semence a été collectée, elle doit être traitée comme indiqué ci-après (échantillonnage pour motilité massale et concentration puis «lavage» immédiat pour séparation du plasma séminal).
La mesure du volume de l'éjaculat s'effectue par lecture directe à l'aide des graduations du tube de collecte. La lecture se fait sans tenir compte de la partie mousseuse de l'éjaculat. Le volume moyen de l'éjaculat est d'environ 1 à 1,5 ml dans les deux espèces mais varie d'un éjaculat à l'autre.
L'objectif de cette mesure est de pouvoir déterminer le nombre de spermatozoïdes par millilitre de semence pure en utilisant le minimum de semence possible. La concentration spermatique varie généralement de 2 à 10 x 109 spermatozoïdes par millilitre de semence éjaculée. Plusieurs possibilités existent pour mesurer cette concentration:
L'appréciation visuelle directe de la concentration spermatique est une technique utilisée par plusieurs centres d'IA. Cette pratique n'est toutefois pas recommandée en raison de son assez grande imprécision due à l'appréciation subjective et parce que d'autres techniques précises et d'emploi facile peuvent être utilisées.
Le comptage exact du nombre de spermatozoïdes dans un hématimètre est une technique précise si elle est effectuée soigneusement. Le principe de la mesure est le comptage du nombre exact de cellules spermatiques présentes dans un volume déterminé d'une solution de dilution connue.
La plupart des hématimètres (figure 43) sont composés de deux grilles (A et B). Chacune est divisée en 16 grands carreaux, eux-mêmes divisés en 16 petits carreaux d'une surface de 1/400 mm2 (1/20 x 1/20 mm). La distance entre la lame et la lamelle étant constante (1/10 mm), le volume est de 1/4 000 mm3 pour un petit carreau. En comptant 10 grands carreaux par grille, le volume exploré est de 4/100 mm3 (16x10 x 1/4 000). Si la dilution initiale est de 0,01 ml de semence pure pour 4 ml de sérum physiologique formolé, soit 1/400, la concentration réelle de l'éjaculat est la suivante:
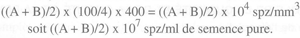
Les différentes étapes à suivre pour un comptage à l'hématimètre sont les suivantes:
1. Prélever (précisément) 0,01 ml de semence pure et la diluer dans 4 ml (précisément) de sérum physiologique formolé (0,9 pour cent de chlorure de sodium; 0,1 pour cent de formaldéhyde dans de l'eau distillée), puis homogénéiser la solution.
2. Préparer l'hématimètre en pressant fortement la lamelle sur les côtés de la grille, après avoir nettoyé et séché soigneusement les surfaces concernées. Cette manipulation permet de faire adhérer la lamelle à l'hématimètre (figure 43).
3. Avec une pipette Pasteur, rincée au préalable avec la solution contenant les spermatozoïdes, déposer une petite goutte de solution sans bulle d'air, en bordure de la lamelle. La gouttelette, par capillarité, se répartit alors entre lame et lamelle.
4. Laisser reposer quelques minutes afin que les spermatozoïdes se déposent sur le fond de la lame.
5. Placer avec soin l'hématimètre (veiller à le maintenir horizontal) sur la platine du microscope (équipée d'un mécanisme de précision permettant le déplacement dans deux directions), sous contraste de phase avec un grossissement de 200. Le champ du microscope couvre généralement la surface d'un grand carreau.
FIGURE 43 Hématimètre pour compter les spermatozoïdes: (a)matériel (b)mise en place de la lamelle (c)dépôt d'une goutte de semence diluée
FIGURE 44 Comptage des spermatozoïdes dans un hématimètre
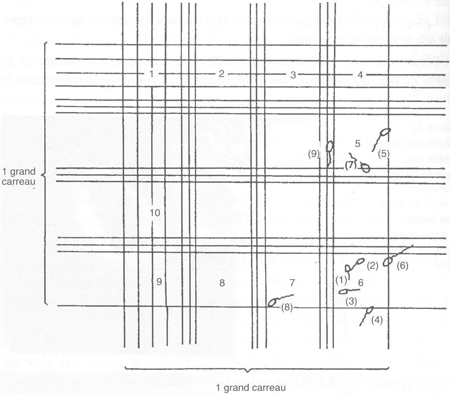
6. Compter au moins 10 grands carreaux par grille et trois à quatre grilles par éjaculat. Pour le comptage des spermatozoïdes, les règles suivantes peuvent être adoptées (figure 44): les spermatozoïdes nos 1,2, 3, 8, et 9 sont comptés dans le carreau; les spermatozoïdes nos 4 et 6 («entrants») sont comptés, leur tête touche ou croise une ligne extérieure du carreau; les spermatozoïdes nos 5 et 7 («sortants») ne sont pas comptés, parce que leur tête est en dehors des lignes extérieures du carreau. Si un comptage diffère de la moyenne par plus de 10 pour cent, il est nécessaire de recommencer le comptage. Ne pas omettre de faire varier la mise au point à chaque lecture pour repérer les spermatozoïdes éventuellement restés en suspension ou collés sous la lamelle.
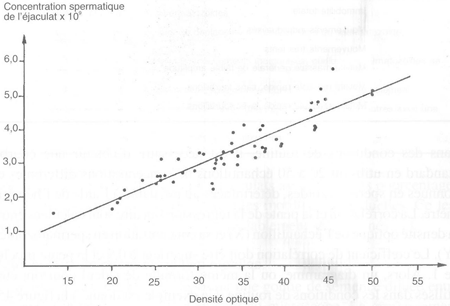
FIGURE 45 Exemple de la relation entre la densité optique et la concentration en spermatozoïdes de l'éjaculat
Cette technique est la plus précise pour la détermination de la concentration spermatique. Elle requiert toutefois du temps et de la patience et ne peut donc pas être mise en œuvre dans les conditions de routine d'un centre d'iA.
L'utilisation d'un spectrophotomètre est la technique la plus efficace car elle allie rapidité et précision. Le principe général est de mesurer la densité optique (à une longueur d'ondes de 550 manomètres) de la solution saline formolée précédente, contenant les spermatozoïdes, et de la comparer à un blanc (ne contenant pas de spermatozoïdes). Avant d'utiliser cette technique dans des conditions de routine, il est nécessaire d'obtenir une courbe standard en utilisant 20 à 50 échantillons de concentrations différentes et connues en spermatozoïdes, déterminées au préalable à l'aide de l'hématimètre. La corrélation et la pente de la régression linéaire sont calculées entre la densité optique de l'échantillon (X) et sa concentration en spermatozoïdes (Y). Le coefficient de corrélation doit être supérieur à 0,9 et la pente proche de 1. Alors, un diagramme, ou la même formule de calcul pourront être utilisés dans les conditions de routine. Un exemple est donné à la figure 45. Chaque année une vérification (comparant les comptages à l'hématimètre et la densité optique) doit être faite pour prévenir toute dérive de l'instrument de mesure.
TABLEAU 10
Détermination de
la note de motilité massale de la semence
|
Note |
Aspects du mouvement |
|
0 |
Immobilité totale |
|
1 |
Mouvements individualisés |
|
2 |
Mouvements très lents |
|
3 |
Motilité massale générale de faible amplitude |
|
4 |
Motilité massale rapide, sans tourbillons |
|
5 |
Motilité massale rapide, avec tourbillons |
C'est une mesure rapide et facile qui nécessite un examen microscopique de la semence, dès que celle-ci est collectée. Une goutte de sperme pur est déposée sur une lame et placée sur la platine chauffante du microscope (37-38°C) sous un grossissement de 80. L'observation doit être faite très rapidement car la motilité massale du sperme pur, à cette température, diminue rapidement au bout de 15 à 20 secondes.
La mesure est faite en utilisant une échelle qui va de 0 (aucun mouvement) à cinq (mouvements forts), ainsi que cela est défini au tableau 10. Un entraînement est nécessaire avant d'aboutir à une mesure fiable de routine.
Cette technique est suffisamment efficace pour détecter les éjaculats où les spermatozoïdes sont morts ou sont très peu mobiles; elle est toutefois trop imprécise pour différencier les éjaculats avec différents pourcentages de spermatozoïdes mobiles ou différentes motilités individuelles. Ce test peut être utilisé pour des mâles non préalablement sélectionnés.
TABLEAU 11 Détermination de la note de motilité individuelle des spermatozoïdes
|
Note |
Motilité individuelle |
|
0 |
Pas de déplacement des spermatozoïdes |
|
1 |
Déplacement très lent ou pas de déplacement, tremblements du spermatozoïde, oscillations de la queue |
|
2 |
Déplacement lent, tremblements, mouvements inorganisés, quelques spermatozoïdes se déplacent plus rapidement |
|
3 |
Les spermatozoïdes effectuent des déplacements curvilinéaires sans tremblement |
|
4 |
Déplacement rapide, quelques cellules avec une trajectoire rectiligne, d'autres avec une trajectoire courbe |
|
5 |
Déplacement rectiligne et rapide des spermatozoïdes |
Cette mesure est réalisée en déposant une goutte de semence diluée entre la lame et la lamelle et en l'examinant au microscope. Le grossissement est d'environ 200 et la platine chauffante est à 37-38°C. La dilution de la semence pour une observation correcte doit être comprise entre 60 et 200 x 106 spermatozoïdes/ml. L'observateur décide, après l'examen successif de cinq champs d'une même préparation, d'une estimation visuelle du pourcentage de spermatozoïdes mobiles. Pour un observateur entraîné, cette mesure est assez répétable. Pour l'apprentissage et l'entraînement régulier, il est nécessaire de comparer cette estimation visuelle du pourcentage de spermatozoïdes mobiles avec le pourcentage exact de spermatozoïdes vivants donné par le test de coloration différentielle éosine/ nigrosine. Pour un opérateur entraîné, la corrélation entre ces deux déterminations est généralement élevée (>0,90).
L'estimation visuelle de la motilité individuelle des spermatozoïdes est réalisée en même temps que l'estimation précédente du pourcentage de spermatozoïdes mobiles. Par conséquent, elle est effectuée dans les mêmes conditions de température et de grossissement.
La mesure est réalisée en utilisant une échelle allant de 0 (aucun mouvement des spermatozoïdes) à 5 (spermatozoïdes «fléchants» avec un mouvement rectiligne). Cette estimation doit tenir compte de la vitesse de déplacement des spermatozoïdes, de la rectitude de celui-ci et de ses mouvements latéraux, comme il est indiqué au tableau 11. Un entraînement est également nécessaire mais, pour le moment, aucune méthode objective ne permet d'apporter des corrections. L'entraînement peut se faire en observant, dans différents échantillons, la diminution de la motilité au cours de tests de thermorésistance.
Les deux tests précédents sont suffisamment précis pour juger ou non si les éjaculats doivent être écartés sur la base de faibles pourcentages de spermatozoïdes mobiles ou de faible motilité. Ils sont généralement utilisés pour apprécier la qualité de la semence après congélation et dégel. Toutefois, même s'ils sont liés à la fertilité de la semence, ils sont incapables de la prédire avec précision; d'autres tests sont donc nécessaires.
Ce test, qui utilise un colorant éosine/nigrosine, est efficace pour déterminer le pourcentage exact de spermatozoïdes morts et celui de spermatozoïdes anormaux. Ainsi que nous l'avons vu précédemment, le pourcentage de spermatozoïdes anormaux peut changer avec la saison (ou la photopériode) chez le bélier, et avec les températures ambiantes élevées chez le bélier et le bouc. Par conséquent, si aucun effet néfaste des températures élevées n'est soupçonné (dans les climats tempérés par exemple), cette mesure est d'un intérêt limité chez le bouc, puisque aucune apparition de spermatozoïdes anormaux due à la photopériode n'existe dans cette espèce.
Chez le bélier, cette période de collecte fréquente de semence peut coïncider avec la fréquence maximale d'anomalies spermatiques (printemps pour les races saisonnées). Pour une bonne connaissance de la qualité de la semence, il est utile de déterminer le pourcentage de spermatozoïdes anormaux dans des échantillons de semence à deux semaines d'intervalle. La semence des reproducteurs potentiels ne doit pas contenir plus de 20 à 30 pour cent de spermatozoïdes morts (colorés) et pas plus de 15 à 20 pour cent de spermatozoïdes anormaux, dans le premier éjaculat d'une série. Ces valeurs diminuent généralement avec le nombre de collectes:
| Eosine (soluble dans l'eau) | 1 | g |
| Nigrosine (soluble dans l'eau) | 2 | g |
|
Tri-Citrate de sodium, 5,5 H2O |
3,57 | g |
| Eau distillée | 100 | ml |
Préparation du colorant. Le colorant est composé de la manière suivante: après l'obtention d'une solution homogène, laisser reposer 24 heures, puis filtrer. Mesurer le pH de la solution et ajuster à environ 6,7-6,8, si nécessaire avec une solution d'acide citrique concentrée. La pression osmotique de la solution est d'environ 310 milliosmoles. La solution peut être conservée à+4°C, le. pH étant contrôlé mensuellement.
Coloration de la semence et préparation des lames
Méthode de comptage des différentes classes de spermatozoïdes. Placer la lame sur la platine chauffante du microscope (37-38°C pour éviter l'hydratation) et examiner, à la lumière directe, différents champs de la même préparation, jusqu'à un total d'au moins 150 spermatozoïdes. Cette procédure doit être répétée au moins une fois pour obtenir une mesure précise. Il est nécessaire de distinguer:
FIGURE 46 Préparation des frottis de semence colorés: (a)mélange des gouttes (b)étalement du mélange (début) (c)étalement du mélange (fin)
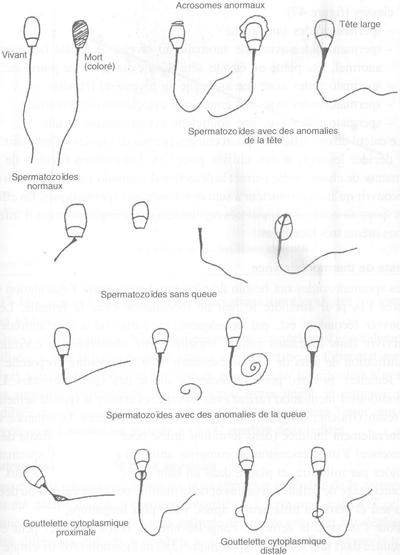
FIGURE 47 Classification des différentes anomalies spermatiques
-
spermatozoïdes sans queue
-
spermatozoïdes avec une anomalie au niveau de la tête (acrosome anormal, tête petite ou étroite, tête élargie en forme de poire, etc.)
-
spermatozoïdes avec une anomalie au niveau du flagelle
-
spermatozoïdes avec une gouttelette cytoplasmique proximale
-
spermatozoïdes avec une gouttelette cytoplasmique distale.
Le calcul de ces différents pourcentages permet de classer les animaux et de décider lesquels seront utilisés pour l'ia. Un examen régulier de la semence de chaque mâle permet la détection d'anomalies inattendues ou de découvrir qu'un reproducteur a subi des dommages spermatiques. En effet, les spermatozoïdes subissent très rapidement des altérations en cas d'infections même très localisées.
Les spermatozoïdes ont besoin de plusieurs heures après l'éjaculation ou après l'ia pour atteindre le lieu de fécondation chez la femelle. Leur pouvoir fécondant est, par conséquent, en partie lié à leur aptitude à survivre dans le tractus génital femelle. Cette observation a conduit à l'utilisation de tests de thermorésistance (à la température corporelle de la femelle), in vitro, pour apprécier la survie des spermatozoïdes. Les conditions d'incubation varient avec les espèces et avec le type de semence à tester (fraîche, congelée), mais dans les deux espèces, la semence est généralement rediluée (dans le milieu utilisé pour la dilution finale de la semence) à une concentration comprise entre 80 et 300 x 106 spermatozoïdes par millilitre, et placée dans un bain-marie à 37-38°C. Le taux de pourcentage de cellules vivantes et de la motilité peut être calculé au début du test et deux ou trois heures après, voire plus longtemps.
Pour l'ia avec la semence congelée chez la brebis, celle-ci peut être rediluée dans une solution hypotonique (250 milliosmoles) de tri-citrate de sodium à pH 8,5 (pH proche de celui du mucus utérin) et laissée à incuber à 37-38°C pendant trois heures. Les observations sont alors faites aux temps 0 et +3 heures.
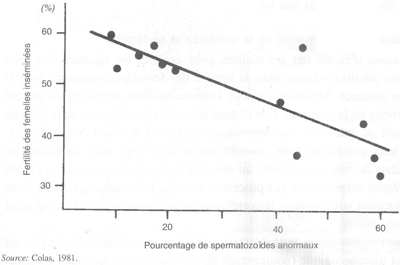
FIGURE 48 Relation entre le pourcentage de spermatozoïdes anormaux et la fertilité des brebis inséminées avec de la semence liquide
Dans l'espèce caprine, chez laquelle la semence congelée est généralement utilisée, le test d'incubation est réalisé sur une partie de l'éjaculat après dégel. Les résultats peuvent être utilisés pour détecter les éjaculats n'ayant pas supporté correctement la congélation. Après dégel, la semence est rediluée dans le milieu utilisé pour la congélation (contenant 7 pour cent de glycérol) et l'incubation réalisée à +37°C pendant deux heures.
Beaucoup d'autres tests différents pour apprécier la qualité de la semence ont été décrits dans la littérature; intégrité de l'acrosome, test GOT (glutamic oxaloacétic transaminase), aptitude des spermatozoïdes à se déplacer dans différents milieux y compris le mucus cervical. Des appareils très sophistiqués de mesure de la motilité de la semence ou du pourcentage de spermatozoïdes vivants, ou encore de paramètres composites de ces , caractéristiques, ont été décrits dans la littérature. Toutefois, aucun de ces tests n'est utilisé en routine dans une application commerciale et nous n'en ferons donc pas état ici.
Beaucoup d'essais ont été réalisés pour corréler les résultats des tests in vitro décrits ci-dessus avec la fertilité des femelles inséminées avec la même semence. Malheureusement, la fécondance ne dépend pas d'un seul paramètre de la semence. Elle dépend aussi du type d'œstrus de la femelle (naturel ou induit par voie hormonale) et du lieu de dépôt de la semence. Les tests précédents sont essentiellement utilisables pour identifier les éjaculats de mauvaise qualité au moment de la récolte ou ceux qui n'ont pas résisté correctement aux processus de congélation/décongélation. Avec les éjaculats «utilisables», la corrélation entre tests in vitro et fertilité n'est pas très élevée.
Dans l'espèce ovine, le seul test de prédiction actuellement disponible, est le test morphologique (pourcentage de spermatozoïdes normaux ou anormaux). Après lutte naturelle ou après ia, les corrélations obtenues entre le pourcentage de spermatozoïdes normaux et la fertilité des femelles sont proches ou supérieures à 0,50 (figure 48). Après la congélation, le choix est réalisé en appréciant le pourcentage de spermatozoïdes anormaux et celui de cellules vivantes après dégel et incubation à 38°C (test de thermorésistance).
Dans l'espèce caprine, seule la motilité individuelle des spermatozoïdes 120 minutes après dégel et incubation à +37°C, est reliée à la fertilité. L'intensité de la relation dépend du traitement progestagène utilisé et du lieu de dépôt de la semence (intra-utérine ou intracervicale; figure 49).
Un grand nombre d'IA pratiquées dans le monde, en particulier dans l'espèce ovine en Europe centrale et de l'Est, sont réalisées avec de la semence non diluée dans les minutes qui suivent la collecte, sans milieu de conservation. Cette méthode donne de bons résultats de fertilité, mais requiert la présence des mâles à proximité immédiate des femelles à inséminer. Dans un centre d'IA, la dilution de la semence est nécessaire.
FIGURE 49 Relation entre la fertilité des chèvres laitières, selon le type de traitement progestagène et le lieu d'IA, et la motilité des spermatozoïdes 120 minutes après dégel
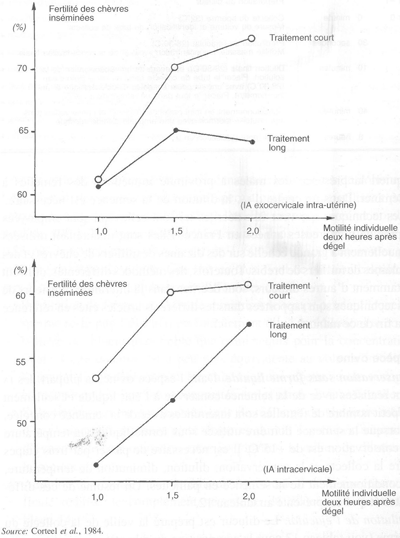
TABLEAU 12
Résumé des différentes étapes du traitement de la
semence de bélier pour utilisation sous forme liquide
|
Jour -1 |
Préparation du dilueur |
|
|
Jour 0 |
0 minute |
Collecte du sperme (32'C) Mesure du volume et identification du tube de collecte |
|
30 secondes |
Prédilution de l'éjaculat (28-30'C) Motilité massale + concentration + calcul de la concentration finale |
|
|
10 minutes |
Dilution finale (28-30°C), bouchage et homogénéisation de la solution. Placer le tube de collecte dans un verre plein d'eau (28-30°C) avec une ampoule congelée d'acide acétique et un thermomètre. Placer le tout dans un réfrigérateur (+6°C). |
|
|
40 minutes |
Conditionnement en mini paillettes (0,25 ml) et conservation dans une bouteille thermos avec une ampoule d'acide acétique |
|
|
8 heures |
Limite pour l'utilisation en ia |
Les techniques qui vont être décrites ici sont celles qui sont employées depuis de nombreuses années en France. Elles sont maintenant utilisées annuellement à grande échelle sur des dizaines de milliers de chèvres et des centaines de milliers de brebis. Toutefois, des méthodes différentes, utilisant notamment d'autres dilueurs, sont décrites dans la littérature. Plusieurs de ces techniques sont rapportées dans les différents articles cités en référence à la fin de ce manuel.
Conservation sous forme liquide. Dans l'espèce ovine, la plupart des ia sont réalisées avec de la semence conservée à l'état liquide et seulement un petit nombre de femelles sont inséminées avec de la semence congelée.
Lorsque la semence doit être utilisée sous forme liquide, la température de conservation est de +15°C. Il est nécessaire de passer par trois étapes entre la collecte et la conservation: dilution, diminution de température, et conditionnement de la semence en paillettes. Un résumé de ces différentes étapes est présenté au tableau 12.
Dilution de l'éjaculat. Le dilueur est préparé la veille de la collecte du sperme (voir tableau 13 pour la composition du dilueur).
TABLEAU 13 Préparation du dilueur pour la semence de bélier utilisée sous forme liquide (un jour avant la collecte de semence)
|
• |
100 ml d'eau bidistillée, stérilisée |
|
• |
chauffer à 60°C |
|
• |
dissoudre 0,33 g de sulfamides |
|
• |
refroidir à 20-25°C |
|
• |
dissoudre 11,1 g de poudre de lait de vache écrémé |
|
• |
faire bouillir au bain-marie durant 15 minutes |
|
• |
refroidir à température ambiante |
|
• |
ajouter 0,11 g de streptomycine et 100 000 Ul de pénicilline |
|
• |
conserver à +4°C 2 à 3 jours au maximum |
Après collecte et mesure de la motilité massale, les mesures du volume de l'éjaculat et de sa concentration en spermatozoïdes sont utilisées pour calculer le taux de dilution nécessaire à I'ia. Par exemple, avec un nombre total de 400 x 106 spermatozoïdes inséminés dans une mini-paillette de 0,25 ml, la concentration finale est de 1 600 x 106 spermatozoïdes par millilitre de semence diluée. Une fois ce taux final de dilution calculé, le processus de dilution fait intervenir différentes étapes:
TABLEAU 14 Exemple de calcul du volume final de dilueur à ajouter pour l'utilisation de semence de bélier sous forme liquide
| (1) | Volume de l'éjaculat | Vo=1,2ml |
| Concentration spermatique initiale |
Co = 4 600 x 106 spz/ml |
|
| Nombre de spermatozoïdes collectés |
No = Vo x Co = 5 520 x 106 spz |
|
| (2) | Concentration finale souhaitée | CF = 1 600 x 106 spz/ml |
| Volume final total à la concentration souhaitée | VF = No/FC = 3,45 ml | |
| (3) | Dilueur ajouté à la prédilution | Vi = V0=1,2ml |
| Volume final de dilueur à ajouter | V = VF - Vo - Vi = 1,05 ml |
Pendant toutes ces opérations d'addition de dilueur (prédilution et dilution finale), il est nécessaire de mélanger soigneusement la semence et le dilueur, de fermer le tube de collecte avec un bouchon et d'identifier ce tube (n° du mâle, n° d'éjaculat, date et heure de collecte).
Diminution de la température. Durant ces manipulations, il est nécessaire de refroidir progressivement l'éjaculat dilué depuis la température de collecte (+32°C) jusqu'à la température de conservation (+15°C). Celle-ci diminue le métabolisme basai du spermatozoïde. Les spermatozoïdes sont très sensibles aux chocs thermiques et une diminution régulière de la température est nécessaire. D'une manière générale, des fluctuations rapides de celle-ci doivent être évitées.
Immédiatement après la collecte, la prédilution doit se faire avec un dilueur à 28-30C. Le tube est alors placé dans un bain-marie ou une étuve à cette même température. Après addition du complément de dilueur (également à 28-30°C), le tube de collecte est placé dans un verre plein d'eau à 28-30°C, dans lequel une ampoule d'acide acétique congelé a été placée quelques secondes auparavant. Le tout est alors mis dans une étuve à +15°C. Après 30 minutes, lorsque la semence atteint 16-17°C, il peut être nécessaire de changer l'ampoule d'acide acétique, si la première est dégelée.
Il est recommandé de disposer un thermomètre dans l'eau, entre le tube de collecte et l'ampoule d'acide acétique, pour suivre la diminution de température et éviter le contact direct entre le tube et l'ampoule.
Dans ces conditions, il est recommandé d'utiliser la semence dans les huit heures qui suivent la collecte. Au-delà, la fécondance de celle-ci baisse rapidement (tableau 15).
TABLEAU 15 Diminution de fertilité au cours de la conservation à long terme de la semence sous forme liquide chez le bélier
|
Age de la semence |
Taux d'agnelage |
|
0 (fraîche) |
60 |
|
1 |
34 |
|
2 |
34 |
|
3 |
17 |
Conditionnement en paillettes. Après homogénéisation de la semence diluée, il est possible de remplir les paillettes soit par utilisation d'une machine, soit par aspiration buccale à travers le bouchon de l'extrémité de la paillette (figure 50). Après contact avec la semence, ce bouchon de polyvinyle forme une barrière étanche qui évite les pertes. Après quoi, en utilisant une seringue ou avec un bref mouvement de poignet, il est nécessaire de laisser 1 cm d'air à l'autre extrémité de la paillette afin de pouvoir obturer celle-ci avec de la poudre polyvinylique de couleur. Les paillettes, soigneusement séchées avec du papier, peuvent alors êtres employées.
Conservation à l'état congelé. La semence congelée de bélier demeure d'un emploi limité pour trois raisons essentielles. La fécondance de la semence congelée est d'environ 20 pour cent inférieure à celle de la semence fraîche, le nombre de spermatozoïdes nécessaires est plus élevé et la technique est plus coûteuse et plus compliquée à utiliser.
A l'avenir, et dans des situations particulières, la semence congelée de bélier sera probablement utilisée en ia intra-utérine qui permet le dépôt des spermatozoïdes directement dans l'utérus (voir plus loin ia par endoscopie).
Quand la semence est conservée à l'état congelé, il est indispensable d'effectuer différentes opérations successives entre la collecte et la conservation: dilution de la semence, diminution de température, conditionnement en paillettes ou en pastilles et congélation. Un résumé de ces différentes étapes est présenté au tableau 16.
Dilution de l'éjaculat. Après la collecte, la mesure de la motilité massale permet de sélectionner les éjaculats à congeler: la note de motilité massale ne doit pas être inférieure à 4,0. Les mesures de volume et de concentration permettent le calcul du taux final de dilution. Une fois celui-ci calculé, le processus de dilution comprend différentes étapes puisque deux dilueurs sont utilisés successivement (voir tableau 17 pour la composition des dilueurs).
FIGURE 50 Préparation de la semence en paillettes: (a) matériel (paillettes, portoirs et récipient (b) remplissage des paillettes pour l'azote liquide) (c) bouchage des paillettes avec l'alcool (d) mise en place des paillettes sur les polyvinylique coloré portoirs pour la congélation

Diminution de la température. Pendant toutes ces opérations, il est nécessaire de refroidir progressivement l'éjaculat dilué jusqu'à +4°C, température à laquelle la semence sera conditionnée en paillettes et où débuteront les opérations de congélation.
Immédiatement après la collecte, le dilueur 1 est ajouté comme indiqué précédemment pour la semence à l'état liquide. Le tube de collecte est alors placé dans un verre d'eau à 28-30°C, lui-même placé dans la partie basse d'un réfrigérateur (+6°C). Après 30 minutes, la température de la semence (suivie avec un thermomètre placé dans l'eau autour du tube), descend à 13-15°C, et après deux heures à +6°C. A ce stade, la semence est placée directement dans le réfrigérateur ou la chambre froide. Le dilueur 2 est ajouté à +4°C.
Congélation en paillettes. Le conditionnement en paillettes moyennes (0,50 ml) est réalisé comme indiqué précédemment pour la semence liquide. La congélation des paillettes peut être réalisée en utilisant une machine ou bien en maintenant les paillettes pendant huit minutes, 20 cm au-dessus du niveau d'azote liquide, dans les vapeurs de celui-ci (-75°C) puis en les plongeant directement dedans (figure 51). Dans ce dernier cas, l'utilisation d'un thermocouple au niveau des paillettes pour suivre la température, est recommandée.
TABLEAU 16 Résumé des différentes étapes du traitement de la semence de bélier pour utilisation sous forme congelée
|
Jour -1 |
Préparation des dilueurs |
|
|
Jour 0 |
0 min |
Collecte de sperme (32'C) Mesure du volume et identification du tube de collecte |
|
30 s |
Prédilution de l'éjaculat avec le dilueur 1(28-30°C) Motilité massale + concentration + calcul de la concentration finale |
|
|
10 min |
Dilution finale avec le dilueur 1 (28-30°C), bouchage et homogénéisation de la solution. Placer le tube de collecte dans un verre plein d'eau (28-30°C) avec un thermomètre. Placer le tout dans un réfrigérateur (+6'C) |
|
|
2 h 10 min |
Ajouter 1re partie du dilueur 2 (+4°C) |
|
|
2 h 30 min |
Ajouter 2e partie du dilueur 2 (+4°C) |
|
|
4 h |
Conditionnement de la semence en paillettes moyennes (0,50 ml) et congeler dans les vapeurs d'azote pendant 8 min |
|
|
ou Congeler en pastilles |
||
|
et Conserver dans l'azote liquide (-196°C) |
TABLEAU 17
Préparation des dilueurs 1 et 2 pour la
congélation de la semence de bélier
|
Dilueur 1. Lactose-jaune d'oeuf: |
|
|
• |
Dissoudre 10,3 g de lactose dans 100 ml d'eau bidistillée stérilisée (cette solution peut être conservée 5 jours à +4°C) |
|
• |
Chaque jour d'utilisation, dissoudre 20 ml de jaune d'oeuf dans 80 ml de la solution précédente |
|
Dilueur 2. Lait écrémé glycérolé: |
|
|
• |
Identique au dilueur utilisé pour la semence liquide (voir plus haut), auquel sont ajoutés 4,0 g de lait écrémé en poudre par 100 ml, afin d'accroître la pression osmotique jusqu'à 450 milliosmoles |
|
• |
Ajuster à un pH de 6,6-6,7 avec du citrate tri-sodique |
|
• |
Ajouter le glycérol dans le rapport de 9 parts de la solution précédente à 1 part de glycérol. |
|
• |
Ajouter le dilueur 2 afin d'aboutir à une concentration finale de glycérol de 4 pour cent dans la semence à congeler |
TABLEAU 18
Exemple de calcul des volumes des
dilueurs 1 et 2 à ajouter pour obtenir la concentration finale requise pour la semence de bélier à congeler
|
(1) |
Volume de l'éjaculat |
V0 = |
1,2 ml |
| Concentration spermatique initiale | Co = | 4 600 x 106 spz/ml | |
| Nombre de spermatozoïdes collectés |
No = |
Vo x Co = 552O x 106 spz |
|
|
(2) |
Concentration finale souhaitée |
CF = |
900 x 106spz/ml |
| Volume final à la concentration souhaitée |
VF= |
No/CF = 6,13 ml |
|
|
(3) |
Volume du dilueur 2 à ajouter pour avoir 4 pour cent de glycérol dans la semence à congeler |
V2 = |
VF x 0,04 x 10 (concentration du dilueur 2 en glycérol) = 2,4 ml |
|
(4) |
Dilueur ajouté à la prédilution |
V1 = |
Vo = 1,2 ml |
| Volume final du dilueur 1 à ajouter |
V = |
VF - V0 - V1 - V2= 1,33 ml |
Congélation en pastilles. La congélation en pastilles a été largement développée en Australie par Salamon et son équipe. Des gouttes de 0,1 ou 0,2 ml de semence à +4°C sont déposées directement sur de la glace carbonique (à -79°C), dans de petites cavités creusées au préalable avec un appareil chauffant. Après avoir séjourné trois à quatre minutes sur la glace, les pastilles sont plongées directement dans l'azote liquide, et conservées ensuite dans des tubes pour un stockage prolongé.
Le dégel doit se faire dans un récipient sec ou dans un dilueur de dégel, mais dans ce dernier cas il est nécessaire de centrifuger la semence (500-600 g pendant 10 minutes; voir figure 52 pour le calcul de la force centrifuge) après dégel pour obtenir le nombre correct de spermatozoïdes pour l'ia.
En termes de qualité de semence (pourcentage de spermatozoïdes vivants) après dégel, les deux méthodes (paillettes et pastilles) donnent les mêmes résultats. La méthode des pastilles est moins onéreuse et plus rapide; toutefois, la manipulation, l'identification et les conditions de dégel sont plus délicates.
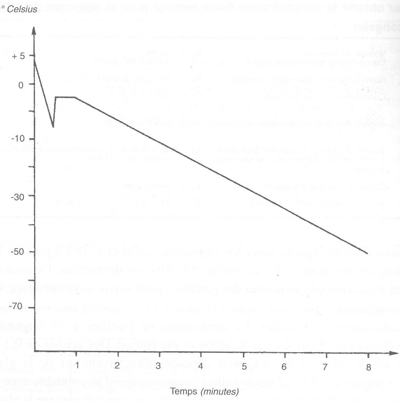
FIGURE 51 Diminution progressive de température pendant la congélation de la semence de bélier
Mesure de l'aptitude des spermatozoïdes à supporter la congélation. La paillette congelée (ou la pastille) est prélevée directement de l'azote liquide et placée dans un bain-marie (ou un tube en verre fin) à 37-38°C pendant 30 secondes (même opération que pour l'ia); son contenu est ensuite dilué pour incubation et observation microscopique.
Pour une ia exocervicale, il est recommandé d'utiliser seulement les éjaculats qui contiennent plus de 15 pour cent de cellules vivantes avec une motilité individuelle de 2,5, 180 minutes après dégel.
Afin d'assurer des conditions de stockage convenables, les paillettes doivent être conservées en permanence dans l'azote liquide et prélevées de celui-ci juste avant l'ia.
Dans cette espèce, l'existence d'enzymes dans le plasma séminal, qui agissent sur les phospholipides du dilueur pour libérer des composés toxiques pour le spermatozoïde, entraîne une manipulation de la semence différente de celle de l'espèce ovine. Chez le bouc, il est particulièrement recommandé de séparer le plasma séminal, dès que possible après la récolte, afin de limiter son contact avec lé dilueur.
Pour l'utilisation de semence fraîche, la dilution directe de l'éjaculat dans un dilueur au lait de vache écrémé est possible, mais la présence de jaune d'œuf dans le milieu de dilution est à proscrire. Si le dilueur en contient, il est alors absolument nécessaire d'effectuer un lavage de la semence avant dilution. Un résumé des différentes étapes est présenté au tableau 19.
«Lavage» de la semence de bouc. Le lavage de la semence dès la collecte est réalisé en suspendant le sperme dans une solution Krebs-Ringer-Phosphate (solution «de lavage») contenant du glucose, puis en centrifugeant le mélange pour éliminer le plasma séminal. Deux lavages successifs sont préférables à un seul lavage.
La procédure est décrite au tableau 19; les différentes étapes sont les suivantes:
TABLEAU 19 Résumé des différentes étapes de lavage et de traitement de la semence de bouc pour utilisation sous forme liquide ou congelée
| Jour-1 | Préparation de la solution de lavage et du dilueur | ||
| Jour 0 | 0 min | Collecte du sperme (32°C) Mesure du volume + identification du tube de collecte + motilité massale + concentration | |
| 30 s | 1re addition de solution de lavage (28-30°C) 1re centrifugation (500-600 g, voir figure 52, 15 min, 20°C) | ||
| 15 min | Elimination du surnageant, 2e addition de solution de lavage et centrifugation dans les mêmes conditions | ||
| Forme liquide | Forme congelée | ||
| 35 min | Dilution finale (20°C), homogénéiser. Placer le tube dans un verre plein d'eau (20°C) avec un thermomètre, dans le réfrigérateur (+6°C). | 35 min | Moitié de la dilution finale (20°C), homogénéiser. Placer le tube dans un verre plein d'eau (20°C) avec un thermomètre, dans le réfrigérateur (+6°C) |
| 65 min | Conditionnement en paillettes et conservation en bouteille thermos avec une ampoule d'acide acétique dégelée. (13-15'C) |
2h 2 h 10 min 2 h 20 min |
1re partie de dilueur glycérolé (+4°C) 2e partie de dilueur glycérolé (+4°C) 3e partie de dilueur glycérolé (+4°C) |
| 8h | Limite d'utilisation en IA | 3 h 10 min | Conditionner en paillettes de 0,25 ml Congeler dans les vapeurs d'azote; conserver dans l'azote liquide (-196°C) |
Utilisation sous forme liquide. Deux dilueurs différents peuvent être utilisés après lavage de la semence; le dilueur sans jaune d'œuf est recommandé. Les procédures (décrites au tableau 19) sont les suivantes:
FIGURE 52 Diagramme utilisable pour l'estimation de la force centrifuge selon la vitesse de centrifugation et le diamètre du rotor Tracer une ligne droite passant par deux valeurs connues de deux colonnes; lire la valeur cherchée dans la troisième colonne à l'intersection avec la ligne droite.
* RCF (Force centrifuge relative) = ω2r/ 9800 oú ω est la vitesse angulaire en rad/sec, soit 0,10472
x rpm, et r est en mm.

TABLEAU 20
Préparation de la solution de lavage
pour le sperme de bouc (solution Krebs-Ringer-phosphate-glucose à
préparer la veille de la collecte)
|
Solutions mères (concentrations finales dans de l'eau bidistillée) |
Volume de solution mère dans la solution finale |
|
0,9 pour cent NaCI |
100,0 |
|
1,15 pour cent KCI |
4,0 |
|
1,22 pour cent CaCl2 |
3,0 |
|
2,11 pour cent KH2 PO4 |
0,4 |
|
3,82 pour cent MgSO4, 7H2O |
1,0 |
|
Tampon phosphate pH 7,4a |
12,0 |
|
5,34 pour cent glucose anhydre Ces solutions doivent être mélangées dans cet ordre |
4,5 |
a Pour préparer le tampon phosphate, dissoudre 35,81 g de Na2HPO4, 12 H2O dans 20 ml de HCl/Nb. Compléter cette solution en ajoutant le volume nécessaire d'eau bidistillée pour obtenir 1 000 ml de tampon.
bPour préparer HC1/N (densité = 1,19): 50 ml d'eau bidistillée + 84,7 ml de HC1 + le volume d'eau nécessaire pour obtenir 1 000 ml de solution finale.
Cette solution doit être conservée à +4°C, 2 à 3 jours au maximum, après quoi des cristaux apparaissent qui peuvent endommager les spermatozoïdes lors de la centrifugation. Les solutions mères peuvent être conservées une semaine à +4°C. Source: Corteel, 1974.
Après avoir calculé le volume de dilueur à ajouter pour aboutir au nombre et à la concentration corrects de spermatozoïdes dans les paillettes qui peuvent être utilisées directement pour I'ia (voir l'espèce ovine pour un exemple de calcul), effectuer le traitement suivant:
Dans ces conditions, il est recommandé d'utiliser la semence dans les huit heures qui suivent la collecte.
TABLEAU 21 Préparation des dilueurs pour la semence de bouc (à préparer la veille de la collecte)
| Dilueur au lait de vache écrémé | |
|
• |
dissoudre 194 mg de glucose anhydre dans 100 ml d'eau bidistillée |
|
• |
dissoudre, dans cette solution, 10 g de poudre de lait de vache écrémé (contenant moins de 1 pour cent de matière grasse) |
|
• |
faire bouillir au bain-marie pendant au moins 15 minutes |
|
• |
refroidir à température ambiante |
|
• |
ajouter 50 mg de streptomycine et 50 000 Ul de pénicilline |
|
• |
conserver à +4'C 2 à 3 jours au maximum |
| Dilueur citrate-jaune d'œuf | |
|
• |
dissoudre 194 mg de glucose anhydre dans 100 ml d'eau bidistillée |
|
• |
dissoudre 3,52 g de citrate de sodium et compléter à 100 ml |
|
• |
ajouter 20 ml de jaune d'œuf à 80 ml de la solution précédente |
|
• |
ajouter 50 mg de streptomycine et 50 000 Ul de pénicilline |
| • |
conserver à +4oC 2 à 3 jours au maximum |
|
Dilueur glycérolé: ajouter 14 pour cent de glycérol (concentration finale) aux solutions précédentes, afin que la concentration finale de glycérol, dans la solution à congeler, soit de 7 pour cent |
|
Utilisation sous forme congelée. On peut utiliser les deux mêmes dilueurs que pour la semence fraîche (lait de vache écrémé et jaune d'œuf), avec les mêmes précautions concernant le plasma séminal. Toutefois, dans le cas de la semence congelée de bouc, il peut être bénéfique d'utiliser les caractéristiques cryoprotectrices du jaune d'œuf.
De la même façon que pour la semence de bélier, il est strictement recommandé d'éviter tout choc thermique des spermatozoïdes.
Une fois les opérations de lavage effectuées et après avoir calculé le volume total de dilueur à ajouter, on procède de la façon suivante:
|
- |
paillettes moyennes (0,50 ml), cinq minutes à 4 cm au-dessus du niveau d'azote liquide, dans les vapeurs, les plonger ensuite directement dans l'azote; |
|
- |
paillettes fines (0,25 ml), deux minutes à 16 cm au-dessus de l'azote liquide, puis trois minutes à 4 cm au-dessus du niveau d'azote liquide et, finalement, les plonger directement dans l'azote. |
L'appréciation de l'aptitude des spermatozoïdes à supporter la congélation/décongélation est réalisée comme pour la semence de bélier. Pour l'ia, il est recommandé d'utiliser seulement des éjaculats contenant au moins 30 pour cent de spermatozoïdes mobiles avec une motilité de 3,0 ou plus, l'observation étant réalisée cinq minutes après dégel. Comme pour la semence de bélier, les paillettes doivent être conservées en permanence dans l'azote liquide. Le dégel se fait de la même façon que dans l'espèce ovine.
Différents moyens peuvent être utilisés pour augmenter la quantité totale de spermatozoïdes produits par un nombre donné de mâles dans un temps défini. Le premier d'entre eux est de trier des mâles dans une population de jeunes ou d'adultes, susceptibles de fournir la production la plus élevée possible de spermatozoïdes de la meilleure qualité. Le deuxième moyen est de modifier le rythme de collecte. Le troisième est de manipuler quelques-uns des facteurs de l'environnement qui agissent sur les processus spermatogénétiques, comme la photopériode ou l'alimentation.
Deux types de mâles entrent généralement dans un centre d'IA:
Dans tous les cas, tous ces candidats n'ont pas été choisis sur leurs propres aptitudes reproductrices et c'est ce dernier critère de choix qui doit être fait à l'entrée dans le centre.
Critères externes de sélection des mâles. La première étape dans le choix des mâles qui seront employés pour l'ia, met en jeu des caractéristiques phénotypiques. Les mâles possédant des défauts évidents d'aplomb, d'anomalies du tractus génital, ou de symptômes d'anciennes maladies doivent être éliminés sans hésitation. Si des jeunes mâles sont à sélectionner, il est nécessaire de tenir compte des parents afin d'éviter toute transmission de défauts. Chez le bouc, à cause de l'existence d'une intersexualité liée au gène «absence de cornes» (motte) et qui apparaît chez les animaux mottes homozygotes, le choix d'animaux mottes phénotypiquement (sans cornes) doit être évité.
Par la suite, un examen détaillé du tractus génital pour la détection des épididymites, ou de tout défaut détectable par palpation, doit être effectué. Dans les races saisonnées, il peut être intéressant de choisir les animaux nés au début de la saison de mise bas, la semence étant alors plus facile à collecter au cours de la saison sexuelle suivante.
Choix sur leurs performances de reproduction. Une fois triés d'après leurs caractéristiques extérieures, les mâles doivent être sélectionnés sur leurs propres aptitudes à produire de la semence en grande quantité, de bonne qualité et qui, éventuellement, sera à même de survivre aux opérations de congélation/décongélation. L'appréciation de l'efficacité des processus spermatogénétiques peut être effectuée à différents niveaux et plus ou moins intensivement. Elle peut être faite sur de jeunes animaux (qui seront conservés comme producteurs de semence pendant leur future vie reproductive), ou sur des adultes (qui sont utilisés temporairement ou qui ont été sélectionnés après testage sur descendance en ferme).
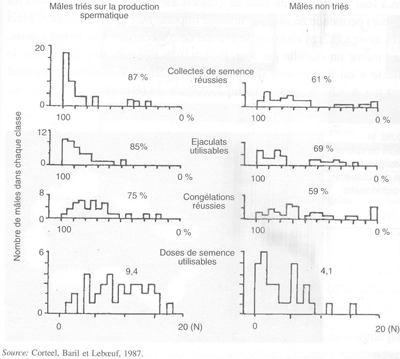
Sélection dé jeunes animaux. Quand les performances de boucs adultes, des races Alpine et Saanen, choisis au préalable pendant leur jeune âge ou leurs performances reproductrices, sont comparées à celles de mâles non triés, choisis d'après des caractéristiques génétiques et achetés en ferme, on observe que l'efficacité sexuelle pour être collectés au vagin artificiel est plus faible (-30 pour cent) chez les animaux non triés; le nombre d'éjaculats utilisables, l'aptitude des spermatozoïdes à supporter la congélation et le nombre de doses utilisables pour l'ia sont également plus faibles pour les animaux non triés (-20, -22 et -56 pour cent respectivement; figure 53). Dans ce cas particulier, 63 pour cent des 107 jeunes mâles avaient été sélectionnés en utilisant les critères suivants:
Sélection d'animaux adultes. Il n'est pas toujours possible de sélectionner des mâles dès leur plus jeune âge et, par conséquent, des animaux adultes au moment de leur entrée dans le centre d'IA doivent être utilisés. En plus des tests précédents, le tri des mâles adultes peut se faire à l'aide des mesures suivantes:
FIGURE 53 Caractéristiques comportementales et spermatiques d'animaux choisis selon deux procédures différentes, pour l'incorporation dans un programme d'IA
Une augmentation du nombre de collectes au vagin artificiel est capable de procurer un accroissement du nombre de spermatozoïdes produits, uniquement si le rythme de collecte précédent n'a pas été trop intensif. Le bénéfice d'une telle modification dépend aussi des réserves épididy-maires du mâle au moment du changement de rythme. Quand ces réserves sont à leur maximum, un taux de collecte élevé (plus de quatre collectes par jour) permet de récolter un nombre important de spermatozoïdes. Mais après avoir vidé ces réserves, le rythme de collecte doit être réduit à deux, voire même un éjaculat par jour. En fait, une augmentation du rythme de collecte n'est intéressante que lorsque le rythme préalablement appliqué n'est pas proche de la production maximale du testicule.
FIGURE 54 Mesure du volume testiculaire à l'aide d'un orchidomètre: (a)orchidomètre (b)palper comparatif
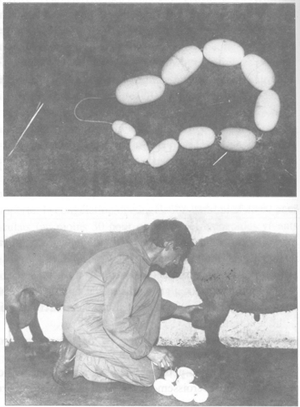
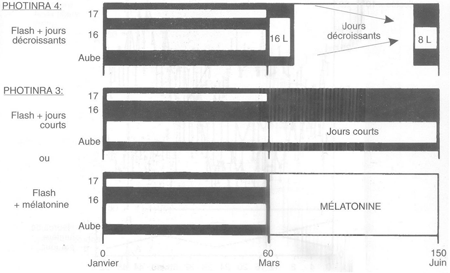
FIGURE 55 Traitements photopériodiques utilisables pour la maîtrise de la production spermatique dans les centres d'IA
Photopériode chez les races saisonnées. La manipulation du régime photopériodique chez des mâles des races saisonnées de petits ruminants est désormais possible. Différents traitements lumineux peuvent être employés; dans chacun d'eux, l'intensité lumineuse à employer doit être au moins égale à 200 lux, au niveau des yeux des animaux.
Succession précoce de jours longs, puis décroissants chez le jeune bélier afin d'avancer la puberté. Dans les races d'ovins saisonnés, il est difficile de collecter de la semence déjeunes mâles avant qu'ils n'aient atteint l'âge d'un an, voire plus, au cours de la saison sexuelle. Cependant, dans les systèmes utilisant largement I'ia pour le testage sur descendance, il est essentiel que les jeunes mâles puissent être collectés avant un an pour que leur semence soit mise en place sur les femelles adultes de la race, lors de la campagne annuelle d'insémination. Il est, par conséquent, intéressant de pouvoir avancer la période de collecte, et donc la puberté, en utilisant un traitement photopériodique.
FIGURE 56 Effets de l'inversion du régime photopériodique annuel sur la production spermatique et le pourcentage de spermatozoïdes anormaux chez le bélier Ile-de-France adulte
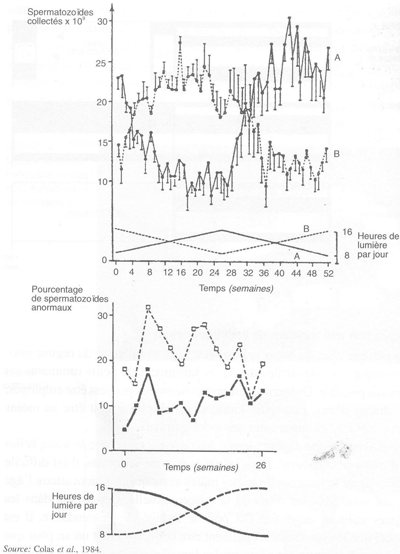
FIGURE 57 Effets d'un régime photopériodique accéléré (deux années photopériodiques en une) sur le diamètre testiculaire et la production spermatique chez le bélier Ile-de-France adulte
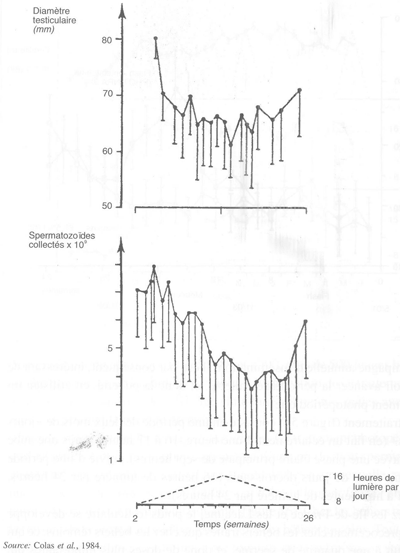
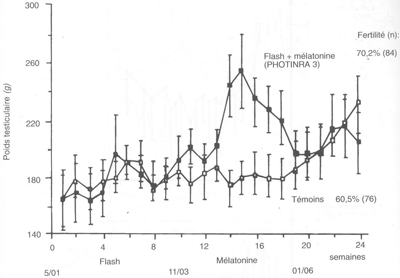
FIGURE 58 Augmentation du poids testiculaire et fertilité de la semence en ia après utilisation d'un traitement «jours longs» + mélatonine chez le bélier Ile-de-France adulte
Ce traitement (figure 55) consiste en une période de deux mois de «jours longs» (en fait un éclairement d'une heure, 16 à 17 heures après une aube fixe, avec une phase claire principale de sept heures), suivie d'une période de trois mois de jours décroissants (16 heures de lumière par 24 heures, jusqu'à huit heures de lumière par 24 heures).
Chez les Ile-de-France et les Lacaune, le poids testiculaire se développe plus précocement chez les béliers traités que chez les béliers témoins, ce qui conduit à une quantité de sperme, et donc de doses plus importantes qui peuvent être utilisées pour l'ia. En 1989 et 1990, plus de 500 jeunes béliers ont été traités en race Lacaune, en France. L'application de ce traitement ne dispense pas, toutefois, de l'élevage simultané des jeunes mâles avec des femelles pendant la période prépubère.
FIGURE 59 Effets de différents régimes photopériodiques accélérés sur le maintien d'un poids testiculaire élevé chez le bélier Ile-de-France
Inversion du régime photopériodique annuel. Ce traitement photopériodique est efficace pour provoquer l'apparition d'une production spermatique quantitative et qualitative équivalente à celle de la saison sexuelle, mais à une période où les animaux non traités sont habituellement faibles producteurs d'une semence de mauvaise qualité (figure 56). Chez les béliers traités, la fertilité de la semence est supérieure à celle des béliers témoins. Toutefois, même avec ce rythme, ces animaux ont toujours une contre-saison sexuelle au cours de l'année et ne peuvent donc pas être employés pour l'ia pendant celle-ci. Cela implique donc le maintien de deux groupes de béliers, un par saison.
Régime accéléré de six mois pour provoquer l'apparition de deux saisons sexuelles par an. Ce programme lumineux est efficace pour produire deux saisons sexuelles par an et les animaux sont capables de donner une semence de bonne qualité pendant deux périodes par an (figure 57). Il subsiste toutefois deux périodes de repos.
Succession de jours longs et de mélatonine. Le traitement précédent fonctionne également pour induire une activité sexuelle à contre-saison. Il nécessite toutefois l'emploi d'un bâtiment fermé pour effectuer des jours décroissants à une période où ceux-ci sont naturellement longs. L'emploi d'une succession d'un traitement de deux mois de «jours longs» puis de l'insertion d'un implant de mélatonine permet d'utiliser un bâtiment ouvert (figure 55).
Ce traitement provoque une augmentation rapide du poids testiculaire après l'insertion de l'implant de mélatonine, et donc une augmentation de la production spermatique, du nombre de doses d'IA produites, mais également de la fertilité des femelles inséminées (figure 58).
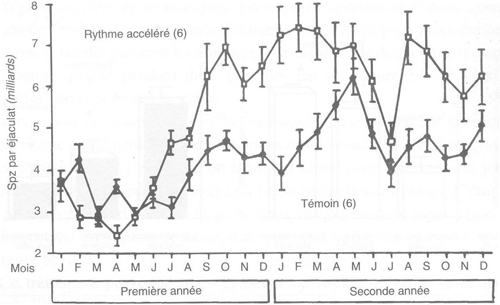
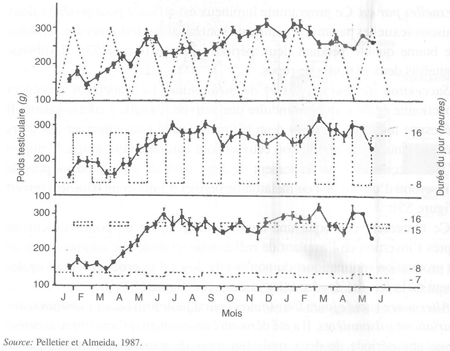
Alternance rapide jours longs/jours courts pour provoquer V abolition des variations saisonnières. Il a été démontré récemment qu'un rythme accéléré avec une période de deux mois (un mois de jours longs alternant avec un mois de jours courts), était capable d'éviter aux animaux l'habituelle période de faible activité spermatogénétique qui suit généralement la fin de la saison sexuelle. Les régimes photopériodiques à employer sont les suivants:
Dans de tels rythmes, le poids testiculaire de béliers Ile-de-France se maintient au niveau de celui enregistré habituellement au maximum de la saison sexuelle des béliers adultes (figure 59). La production spermatique quantitative et qualitative est au moins égale à celle de la saison sexuelle (figure 60).
FIGURE 60 Production spermatique quantitative et qualitative de béliers Ile-de-France traités avec un régime photopériodique accéléré
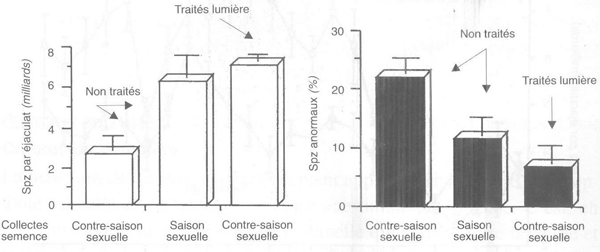
L'application chez le bouc alpin d'une alternance rapide d'un mois de jours longs et d'un mois de jours courts permet également l'abolition des fortes variations saisonnières observées naturellement. La production spermatique est également beaucoup plus élevée chez des mâles ainsi traités (figure 61), ce qui conduit à une augmentation de 70 pour cent du nombre de doses d'IA congelées disponibles sans modification de leur fertilité pour des mâles collectés à raison de deux éjaculats par semaine, par rapport à des mâles témoins soumis au même rythme de collecte.
Alimentation. La modification du régime alimentaire, en fournissant un régime contenant un haut niveau protéique, est capable de provoquer un accroissement de l'activité spermatogénétique (voir Effets des régimes alimentaires sur les performances de reproduction, chapitre 2). A cause du délai dans l'accomplissement des processus spermatogénétiques, la distribution du supplément alimentaire doit commencer au moins six semaines avant la période à laquelle l'augmentation de production spermatique est souhaitée. Les effets d'un supplément alimentaire sont plus marqués chez des mâles qui sont à un régime en dessous de l'entretien, que chez ceux qui sont à l'entretien. La suralimentation peut également être néfaste à la production spermatique.
FIGURE 61 Production spermatique de boucs alpins traités avec un régime photopériodique accéléré