por
Francçoise Corbineau & Daniel Côme
Université Pierre et Marie Curie
Physiologie Vegétale Appliquée
Tour 53, 1er étage, 4, Place Jussieu
75252 Paris Cedex 05, France
INTRODUCCION
La Terminalia superba y la Terminalia ivorensis están entre las especies más importantes de unas 200 que pertenecen al género Terminalia (Combretaceae). Gracias a las cualidades de estas dos especies madereras, naturales de Africa Occidental y Central, se han comenzado una serie de importantes programas de plantación dentro de su ámbito natural, en el Congo y en la Costa de Marfil, habiéndose establecido también en otros lugares ensayos de introducción, especialmente en países de América Latina. Mientras que las semillas de Terminalia superba no plantean ningún problema de germinación (Roederer, 1988), las de Terminalia ivorensis germinan con grandes dificultades. Por ello, se emprendió un estudio sobre la germinación de las semillas de esta última especie.
El trabajo a que se refiere este informe tuvo lugar en 1987 y en 1988, con los objetivos siguientes:
MATERIAL Y METODOS
Material de plantación
Se realizaron ensayos con cuatro lotes de semilla suministrados por CTFT (ahora CIRAD-Forêt), Nogent-sur-Marne
(Francia). Los lotes de semilla (No 86/5722N, 86/5723N, 86/5725N y 86/5729N) se
recogieron de 4 árboles distintos en enero de 1986 en la zona de Assuefri (Costa de Marfil). Cuando
se recibieron en el laboratorio el peso de las semillas desaladas variaba de 95 a 230 mg. y su
contenido medio de humedad, determinado después de secarlo a 105°C, era del orden del 9,5% del
peso seco.
Se recogieron otros lotes de semilla a partir de un solo árbol en la zona de Yapo (Costa de Marfil) los días 16, 20, 22 y 29 de diciembre de 1987, los días 2, 12, 21 y 28 de enero de 1988 y el 2 y 10 de febrero de 1988, a fin de determinar la influencia del estado de desarrollo de la semilla sobre su capacidad de germinación. Las semillas se desalaron y se enviaron tan pronto como se recogieron, poniéndose en un ensayo de germinación cuando se recibieron en el laboratorio.
Ensayos de germinación
Se realizaron ensayos de germinación a distintas temperaturas, de 5 a 40°C, en la oscuridad. Las
semillas enteras o los embriones extraídos se colocaron en placas Petri de 10 cm. de diámetro, sobre
algodón humidificado con agua desionizada o una solución de giberelina (GA3) 10-3 M. Cada ensayo
incluyó 50 semillas o 30 embriones distribuidos en dos placas Petri. Se observó regularmente la
germinación durante 30 a 60 días. Se consideraba que un embrión o una semilla habían germinado
cuando la radícula había alcanzado una longitud de unos pocos mm. (para un embrión) o había
atravesado los tegumentos de la semilla.
Tratamientos previos de la semilla
Las semillas enteras recibieron diferentes tratamientos previos con el fin de facilitar su germinación.
Todas las semillas se pusieron en remojo durante 3 horas en ácido sulfúrico concentrado y se
enjuagaron con abundancia en agua corriente durante 15 a 20 minutos. Parte de las semillas se
remojaron seguidamente durante 24 horas en una solución de celulasa (que es una enzima que degrada
la celulosa y en consecuencia las paredes de la célula), con una concentración de 1,25 g l-1 y a
25°C. Después de lavarlo en agua desionizada, las semillas, tratadas previamente con ácido sulfúrico
sólo o con ácido sulfúrico y celulasa, se mantuvieron a 30°C durante 5 días, en presencia de una
solución de GA3 10-3 M; y a continuación se pusieron a germinar, a igual temperatura, sobre algodón
humedecido con agua desionizada.
Secado de las semillas tratadas previamente
Parte de las semillas tratadas previamente con ácido sulfúrico, celulasa y GA3, se secaron a la
temperatura ambiente (20+-2°C) durante 2 días. Se encontró entonces que el contenido medio de
humedad estaba entre el 9 y el 10% del peso seco. Seguidamente se pusieron a germinar en algodón
humedecido con agua desionizada.
RESULTADOS
Germinación de las semillas recogidas en 1986
Ninguna de las semillas 86/5722N, 86/5723N y 86/5725N germinaron en agua a ninguna de las
temperaturas empleadas (5–40°C). Las semillas del lote 86/5729N germinaron lentamente a 30°C, pero
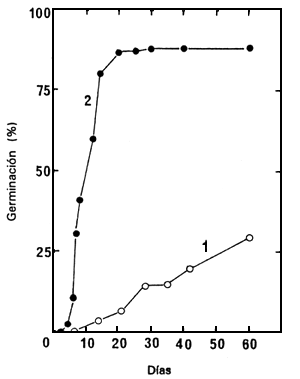
la germinación fue sólo del 30% después de 2 meses (Figura 1); germinaron aún con mayor dificultad
a 25 y 35°C, y no germinaron en absoluto por debajo de los 25°C (no se presentan los resultados).
La incapacidad de germinación de las semillas sin cortar se debe principalmente al grosor y dureza del tegumento externo, ya que los embriones extraídos germinaron con mucha mayor facilidad (Figura 1 y Cuadro 1).
Figura 1. Germinación de semillas sin cortar (1) y de embriones extraídos (2) del lote de semillas 86/5729N, en agua a 30°C.
Cuadro 1. Porcentajes de germinación obtenidos después de 60 días a 30°C, en agua, con semillas sin cortar y embriones extraídos de los lotes de semillas 86/5722N, 86/5723N, 86/5725N y 86/5729N
| LOTES DE SEMILLA | GERMINACION (%) semillas sin cortar | GERMINACION (%) embriones extraídos |
| 86/5722N | 0 | 60 |
| 86/5723N | 0 | 56 |
| 86/5725N | 0 | 70 |
| 86/5729N | 30 | 89 |
Influencia del estado de desarrollo de las semillas
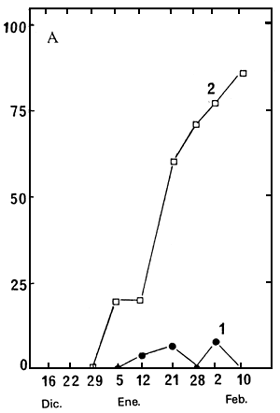
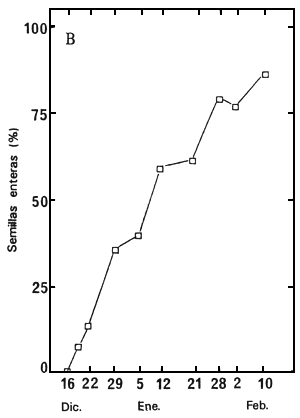
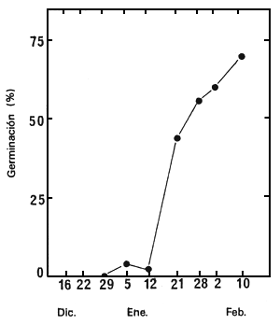
Los embriones extraídos de semillas recogidas entre el 16 de diciembre de 1987 y el 10 de febrero
de 1988, se pusieron a germinar en agua, a 30°C. La Figura 2 muestra los resultados después de
60 días; y la Figura 2B presenta el porcentaje de embriones bien desarrollados en el momento de la
recolección.
Figura 2. Variación, según la fecha de recolección, de la capacidad germinativa de semillas sin cortar y de embriones extraídos (A), y del porcentaje de semillas enteras (B).
 |  | ||
| Fecha de recolección | Fecha de recolección | ||
| A. | Porcentajes de germinación de semillas sin cortar (1) y embriones extraídos (2) después de 60 días a 30°C, en agua. | B: | Porcentajes de semillas que tienen un embrión bien desarrollado |
La germinación de las semillas sin cortar es extraordinariamente baja, cualquiera que sea la fecha de recolección; sin embargo, los embriones extraídos comenzaron a germinar en los lotes de semillas recogidos desde el 5 de enero y su germinación mejoró de forma constante hasta la última recolección (Figura 2A). Las Figuras 2A y 2B demuestran claramente que los embriones sólo germinan fácilmente cuando están bien desarrollados dentro de la semilla. Para obtener semillas con buena capacidad de germinativa, la recolección debe tener lugar cuando las semillas están plenamente maduras. Sin embargo, debe señalarse que incluso las semillas maduras germinan con gran dificultad si están sin cortar.
Efecto de la giberelina
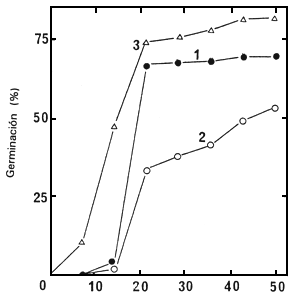
Este estudio se realizó con los lotes de semilla 86/5722N, 86/5725N y 86/5729N. Las semillas sin
cortar se pusieron a germinar a 30°C en contacto permanente con una solución de GA3 10-3 M. La
Figura 3 demuestra que el GA3 estimula fuertemente la germinación. Las semillas de los lotes
86/5722N y 86/5725N no germinaron en absoluto en agua, pero el 70% y el 54% respectivamente,
de las semillas de estos lotes pudieron germinar en 7 semanas en presencia de GA3. Las del lote
86/5729N germinaron también mucho mejor (86% después de 7 semanas) en presencia de GA3 que
en agua sola (Figura 1).
Un estudio similar realizado utilizando semillas recogidas entre el 16 de diciembre de 1987 y el 10 de febrero de 1988, demostró que el GA3 facilita también la germinación de las semillas inmaduras (Figura 4), pero sólo cuando los embriones están ya bastante bien desarrollados (Figura 2B).
 |  |
| Días | Fecha de Recolección |
| Figura 3. Germinación de semillas sin cortar de los lotes de semilla 86/5722N (1), 86/5725 N (2) y 86/5729 N (3) a 30°C, en presencia de GA3 10-3 M. | Figura 4. Variación, de acuerdo con la fecha de recolección, del porcentaje de germinación de semillas sin cortar obtenidas, después de 60 días a 30°C, en presencia de GA3 10-3 M. |
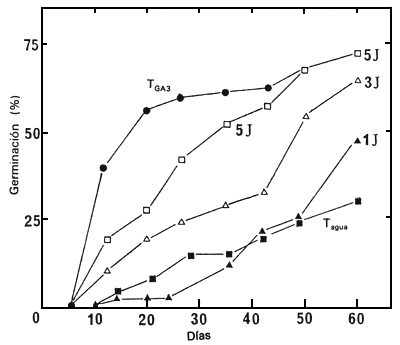
Para determinar los efectos de la duración del tratamiento con GA3, se pusieron en remojo las semillas del lote 86/5729N en una solución de GA3 10-3 M, durante 1, 3 y 5 días y a continuación se pusieron a germinar en agua. Las semillas puestas a germinar continuamente en agua o en presencia de GA3 10-3 M, sirvieron como control. Fue necesario un tratamiento de un mínimo de 5 días con GA3, para obtener, después de 50 ó 60 días, el mismo porcentaje de germinación que el de los lotes de semilla que estaban en contacto continuo con este regulador de crecimiento (Figura 5). Con los otros lotes de semilla (86/5722N y 86/5725N), el mismo tratamiento no fue suficiente para obtener un estímulo importante de la germinación (no se presentan los resultados).
Figura 5. Germinación de semillas sin cortar del lote 86/5729N, a 30°C, puestas en contacto con GA3 10-3 M durante 1,3 y 5 días, y trasladadas después a agua. En los controles, se pusieron las semillas a germinar continuamente en agua (Twat) o en una solución de GA3 10-3 M (TGA3)
Efecto del tratamiento con ácido sulfúrico y celulasa
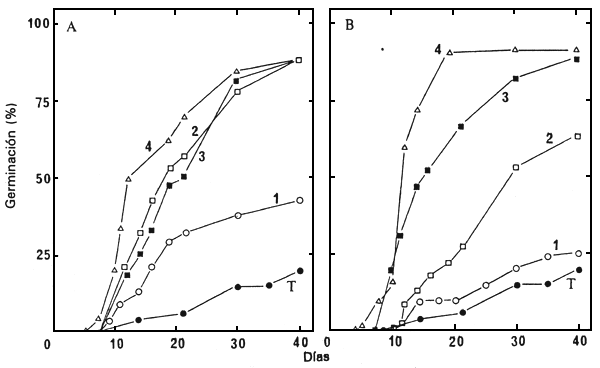
Considerando que la incapacidad de germinación parecía deberse en gran parte a la obstrucción ocasionada por el tegumento externo, se ensayó un tratamiento previo con ácido sulfúrico concentrado y con celulasa (1,25 gl-1). Las semillas tratadas previamente durante 3 horas en ácido sulfúrico, con o sin remojo durante 24 horas en una solución de celulasa, se pusieron a germinar a 30°C en agua o en una solución de GA3 10-3 M. Las semillas con tratamiento previo similar se pusieron en contacto con una solución GA3 10-3 M durante 5 días y a continuación se secaron durante 2 días antes de ponerlas a germinar en agua a 30°C. La Figura 6 y el Cuadro 2 resumen los resultados obtenidos con los lotes de semilla 86/5722N, 86/5725N y 86/5729N.
Figura 6. Germinación a 30°C de las semillas del lote 86/5729N, a las que se aplicaron
diferentes tratamientos previos y se pusieron a germinar en agua o en una solución de
GA3 10-3 M:
A =semillas tratadas previamente durante 3 horas con ácido sulfúrico concentrado;
B =semillas tratadas previamente durante 3 horas con ácido sulfúrico concentrado, y
a continuación durante 24 horas con celulasa (1,25 g l1). T = control sin tratamiento
y puestas a germinar en agua. 1 =semillas tratadas previamente y puestas a germinar
en agua; 2 =semillas tratadas previamente y puestas a germinar en presencia de GA3;
3 =semillas tratadas previamente y puestas en remojo durante 5 días en GA3, antes
de ponerlas a germinar en agua; 4 =semillas tratadas previamente y puestas en remojo
durante 5 días en GA3 y a continuación secadas antes de ponerlas a germinar en agua.
Cuadro 2. Efectos de los diferentes tratamientos previos sobre los porcentajes de germinación obtenidos después de 30 días a 30°C, en agua o en una solución de GA3 10-1 M, con semillas de los lotes 86/5722N, 86/5723N, 865725N y 86/5729N. Los resultados muestran la media de las dos observaciones. Los tratamientos previos fueron de 3 horas con ácido sulfúrico concentrado, 24 horas con celulasa (1,25 g l1) y 5 días en GA3 10-3 M, con o sin secado. Las semillas de control no recibieron tratamiento previo.
| TRATAMIENTO PREVIO | MEDIO | GERMINACION (%) LOTE DE SEMILLAS 86/5722N | GERMINACION (%) LOTE DE SEMILLAS 86/5725N | GERMINACION (%) LOTE DE SEMILLAS 86/5729N |
| Ninguno (semillas de control) | agua | 0 | 0 | 15 |
| H2SO4 | agua | 8 | 20 | 38 |
| H2SO4 | GA3 | 9 | 55 | 78 |
| H2SO4 + celulasa | agua | 6 | 5 | 20 |
| H2SO4 + celulasa | GA3 | 18 | 42 | 52 |
| H2SO4 + GA3 | agua | 12 | 56 | 82 |
| H2SO4 + GA3 + celulasa | agua | 40 | 36 | 82 |
| H2SO4 + GA3 + secado | agua | 22 | 49 | 84 |
| H2SO4 + GA3 + celulasa + secado | agua | 66 | 58 | 91 |
Cuando se pusieron las semillas a germinar en agua, el tratamiento previo con ácido sulfúrico sólo tuvo pequeños efectos positivos. Estos no mejoraron cuando el tratamiento previo con ácido sulfúrico fue seguido del remojo en celulasa. Por otra parte, las semillas tratadas previamente con ácido sulfúrico solamente, o con ácido sulfúrico y celulasa, germinaron mucho mejor cuando se pusieron en una solución de GA3 10-3 M, aunque la celulasa no pareció tener ningún efecto en particular. Este efecto estimulante de la giberelina fue muy significativo e incluso cuando este regulador de crecimiento se aplicó sólo durante 5 días después del tratamiento previo con ácido sulfúrico y celulasa. Los mejores resultados se obtuvieron con semillas que se secaron después de tratamientos previos sucesivos con ácido sulfúrico, celulasa y giberelina y a continuación se pusieron a germinar en agua.
DISCUSION Y CONCLUSIONES
Las semillas de Terminalia ivorensis germinan con gran dificultad. Esta incapacidad de germinación está ocasionada por el tegumento externo de la semilla, muy probablemente porque es grueso y lignificado. Los embriones extraídos germinan mucho mejor que las semillas sin cortar. En especies que prosperan en clima cálido (Côme y Corbineau, 1992), como la Cedrela odorata (Côme et al., 1985), Mangifera indica (Corbineau et al., 1986), Symphonia globulifera (Corbineau y Côme, 1986a), Shorea roxburghii (Corbineau y Côme, 1986b) o la Hopea odorata (Corbineau y Côme, 1986b, 1988), la temperatura óptima de germinación suele ser relativamente elevada (25–30°C). Este es el caso también de la Terminalia superba (Roederer, 1988).
No obstante, los embriones extraídos de Terminalia ivorensis sólo germinan bien si han alcanzado un estado conveniente de desarrollo antes de la recolección. Para obtener semillas con una buena capacidad germinativa es necesario por tanto asegurarse de que las semillas estén completamente maduras en el momento de la recolección. Esto se demostró claramente por el estudio de germinación de embriones extraídos de semillas en distintos estados de desarrollo. Los lotes de semilla cuyos embriones extraídos no germinaron por completo fueron sin duda recogidos demasiado pronto.
El GA3 con una concentración elevada (10-3 M) facilita significativamente la germinación de las semillas enteras pero este efecto estimulante sólo es posible si las semillas están suficientemente maduras, es decir, si el embrión ha alcanzado su desarrollo máximo. Un tratamiento con GA3 es difícil de utilizar en las condiciones de campo porque sólo es eficaz si se aplica durante tiempo suficiente.
La escarificación durante 3 horas en ácido sulfúrico no es suficiente para garantizar una germinación satisfactoria de las semillas, pero tiene efectos positivos si se complementa con un remojo durante 24 horas en una solución de celulasa (1,25 g l-1). Después de este tratamiento combinado, el uso del GA3 10-3M es muy eficaz, incluso si se aplica sólo durante 5 días.
Para obtener buenos resultados puede preverse el siguiente tratamiento: remojo durante 3 horas en ácido sulfúrico concentrado, enjuagado en agua, remojo durante 24 horas en una solución de celulasa, enjuagado en agua, remojo durante 5 días en una solución de GA3. Después de este tratamiento, la semilla puede incluso secarse a la temperatura ambiente, sin efectos negativos sobre la germinación. No obstante, será necesario comprobar si se mantienen los efectos positivos de tal tratamiento previo después del secado y también durante el almacenaje de la semilla.
El tratamiento descrito es molesto para una aplicación en gran escala. Puede ser conveniente, sin embargo, en la utilización de cantidades para investigación de material caro, por ejemplo las semillas recogidas durante la exploración del ámbito natural (siempre costosas y con frecuencia irrepetibles); o con semillas producidas mediante hibridación controlada.
Referencias
Côme D. & Corbineau F. (1992). Les semences et le froid. Dans Les végétaux et le froid, Hermann, Paris, 401–461.
Corbineau F. & Côme D. (1986a). Experiments on the storage of seeds and seedlings of Symphonia globulifera L. f. (Guttiferae). Seed Sci. & Technol., 14, 585–591.
Corbineau F. & Côme D. (1986b). Experiments on germination and storage of the seeds of two dipterocarps: Shorea roxburghii and Hopea odorata. The Malaysian Forester, 49, 4, 371–381.
Corbineau F. & Côme D. (1988). Storage of recalcitrant seeds of four tropical species. Seed Sci. & Technol., 16, 97–103.
Corbineau F., Defresne S. & Côme D. (1985). Quelques caractéristiques de la germination des graines et de la croissance des plantules de Cedrela odorata L. (Méliacées). Bois et Forêts des Tropiques, 207, 17–22.
Corbineau F., Kanté M. & Côme D. (1986). Seed germination and seedling development in the mango (Mangifera indica L.). Tree Physiology, 1, 151–160.
Roederer Y. (1988). Etude de la germination des semences de Terminalia superba Engler et Diels et de sa variabilité. Diplôme d'Etudes Doctorales, Université Pierre et Marie Curie, Paris, 100 p.
Recursos Genéticos Forestales Información No. 21. FAO, Roma (1994)