Indice
- ![]() Precedente - Siguiente
Precedente - Siguiente![]()
| Acido | Temperatura °C | Concentración de Acido (% en peso) | |||
| 20 | 40 | 60 | 80 | ||
| H2 SO4 (Sulfúrico) |
-17,8 | 87,3 | 55,7 | 15 | 3,14 |
| 10 | 87,4 | 56,6 | 15,8 | 3,88 | |
| 20 | 87,7 | 56,7 | 16,3 | 4,76 | |
| 30 | 87,5 | 56,6 | 17,0 | 5,75 | |
| 40 | 87,6 | 57,5 | 17,8 | 6,88 | |
| 44 | 88,8 | 58,2 | 18,8 | 8,2 | |
| Concentración de Acido (% en poso) | |||||
| H NO3 (Nítrico) |
20 | 30 | 40 | 50 | |
| -17,8 | 89,2 | 78,4 | 65,3 | 45,7 | |
| 10 | 86,7 | 77 | 63 | 45,6 | |
| 20 | 86,6 | 75,2 | 61,5 | - | |
| 30 | 86,6 | 74,9 | 61,3 | - | |
| 40 | 85,9 | 74,1 | 60,5 | - | |
| 44 | 86,5 | 74,6 | - | - | |
| 60 | 86,9 | 75,6 | - | - | |
| Concentración de Acido (% en peso) | |||||
| H Cl (Clorhídrico) |
10 | 20 | 30 | 40 | |
| -17,8 | 83,5 | 56 | 27,4 | 8,9 | |
| 10 | 83,5 | - | - | - | |
| 20 | 83,2 | - | - | - | |
| 30 | 84 2 | - | - | - | |
Fuente: HALL (1980)
Con la aparición de los modelos matemáticos de secado, la determinación de una ecuación para la entalpía de vaporización del agua de los granos creció en importancia, ya que se trata de una de las propiedades del producto que se usa en los modelos existentes.
Las isotermas de sorción del agua de los productos biológicos proporcionan los datos necesarios para calcular la entalpía de vaporización. La entalpía de vaporización del agua de un producto determinado depende, sobre todo, de la temperatura y del contenido de humedad que presenta dicho producto Cuanto mayor sea el contenido de humedad, menor será la cantidad de energía necesaria para evaporar una unidad de masa de agua contenida en un producto, y vice versa.
OTHMER (1940) elaboró una metoddogía general para obtener datos de entalpía de vaporización de una sustancia, basada en la ecuación de ClausiusClapeyron que aparece a continuación:
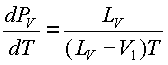
ec.31
Como el volumen especifico de la fase liquida V' es despreciable, comparado con el de la fase de vapor, se considera la ecuación 31 en la forma:
dPV / dT = LV
/ VVT
ec.32
Suponiendo que el vapor de agua se comporta como un gas perfecto, el volumen especifico de la fase de vapor, Vv, se puede obtener a partir de la ecuación de los gases perfectos. Así:
Vv=RVT / PV
ec.33
y la ecuación 34 será
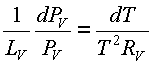
ec.34
La ecuación 34 se puede aplicar a cualquier sustancia cuyo comportamiento concuerde con las suposiciones que se hacen en las ecuaciones 31 y 33.
Así, si se escribe la ecuación 34 para agua libre y para agua contenida en un producto biológico, a la misma temperatura T, se tiene:
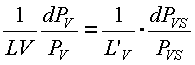
ec.35
puesto que el segundo miembro de la ecuación 34 es igual tanto para el agua libre como para el agua contenida en el producto biológico. En la ecuación 35. L'V, LV, PVS y PV representan la entalpía de vaporización del agua libre, la entalpía de vaporización del agua del producto biológico, la presión de vapor del agua libre y la presión de vapor del agua correspondiente a la humedad del producto biológico, respectivamente. Integrando la ecuación 35 se tiene:
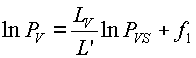
ec.36
Las isotermas de sorción de agua de granos están representadas por ecuaciones del tipo:
He = He(T, f). ec.37 o bien
f = f(T, He),
ec.38
como las ecuaciones 27, 28, 29 y 30.
Así, a punir de las isotermas de sorción, fijando un valor a la humedad del producto, se determina el valor de humedad relativa de equilibrio f a diferentes temperaturas T, y en seguida se calculan los valores de la presión de vapor PV por la relación:
PV = f PVS
ec.39
Los valores de presión de vapor de agua saturado PVS se obtienen en tablas de las temperaturas correspondientes. Reemplazando los valores de PV Y PVS en la ecuación 36 se obtiene el valor de LV/L'V, que es la inclinación de la recta de un gráfico bilogarítmico de PV en función de PVS. Aplicando el mismo procedimiento a otros contenidos de humedad, en la misma gama de temperaturas, se determinan los valores de LV/L'V para los contenidos de humedad correspondientes.
De este modo, si se desea determinar la entupía de vaporización de humedad del agua del arroz en cáscara, a temperaturas en la gama de 15 a 60 °C. y con contenidos de humedad en la gama de 0,15 a 0,25, base seca, se puede utilizar la ecuación de Chung-Pfost, ecuación 30, cuyos parámetros constan en el Cuadro 11:
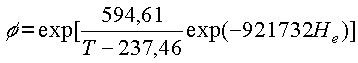
ec.40
El Cuadro 14 se preparó sobre la base de la metodología descrita, empleando la ecuación 40.
A punir del Cuadro 14, construyendo gráficos bilogaritmicos de Pv en función de PVS, se tienen las siguientes relaciones entre LV y L'V. según se ve en el Cuadro 15.
Rodrigues Arias presentó una ecuación para la entalpía de vaporización del agua de maíz, con la siguiente expresión: (Brooker et al, 1984):
Cuadro 15 Relaciones entre Lv y L'v
| Humedad (base seca) | Relación Lv/L'v |
| 15 | 1,08453 |
| 17 | 1,05431 |
| 19 | 1,03496 |
| 21 | 1,02275 |
| 23 | 1,01405 |
| 25 | 1,01006 |
Lv / L'v - 1 = a exp
(-bH),
ec.41
en que a = 4,35 y b = 28,25. Los valores de Lv/L'v se obtuvieron mediante el procedimiento ya descrito, y los coeficientes a y b se estimaron por análisis de regresión. La entalpía de vaporización del agua libre está representada por la expresión:
L'v = 3,11 x 106 -
2,38 x 103 T
ec.42
Aplicando la metodología presentada por OTHMER (1940) para obtener la entalpía de vaporización de otros productos, se obtienen los coeficientes a y b de la ecuación 41, que aparecen en el Cuadro 16.
Cuadro 16 Parámetros a y b de la ecuación 41 respecto de diversos productos
| Producto | a | b |
| Arroz en cáscara | 2,1274 | 21,6100 |
| Soja | 0,3240 | 13,9170 |
| Cebada | 0,8627 | 19,8890 |
| Sorgo | 1,0452 | 19,6440 |
| Trigo (hard) | 1,3069 | 17,6090 |
| Frejol | 0,4542 | 15,9750 |
Otro método para obtener la entalpía de vaporización del agua de productos biológicos es citado por FORTES (1978). Según este método, la entalpía de condensación o de adsorción de agua en alimentos y granos, Lc, se compone de dos partes: la entalpía que se libera cuando el agua se condensa del vapor saturado en estado de agua libre, Lo, y la entalpía diferencial de adsorción, LW. . En física, la entalpía diferencial de adsorción corresponde a la entalpía excesiva del valor de estado libre, que se libera cuando las moléculas de agua son atraídas por fuerzas físicas y químicas. Asf:
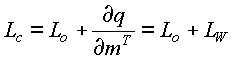
ec.43
o bien
LW= Lc-Lo
ec.44
La ecuación de Clausius-Clapeyron, ecuación 34, se puede escribir en la forma:
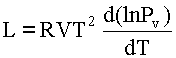
ec.45
Las Ecuaciones 43 y 45 conducen a:
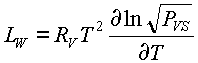
ec.46
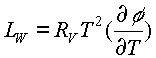
ec.47
Así, en el caso del secado, la entalpía de vaporización del agua al interior del cuerpo se puede expresar como sigue:
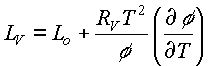
ec.48
La ecuación 48 ofrece una alternativa al método que propone OTHMER (1940) o las expresiones empíricas que aparecen en la literatura. Para aplicar las ecuaciones 47 y 48 hay que conocer la ecuación de las isotermas de sorción del producto, las ecuaciones 27 a 30, y el Lo se puede calcular por la ecuación 42.