


Lors du transport de pesticides:
|
Figure 19. Précautions pour le transport d’insecticides.
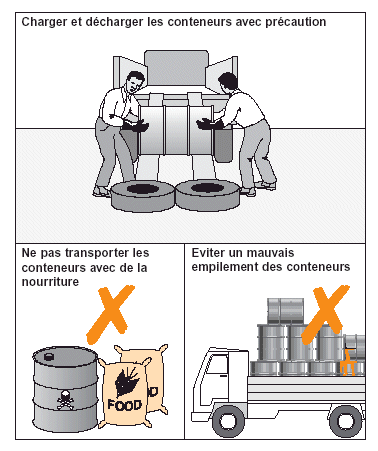
Les sections suivantes traitent des précautions pour l’environnement et la santé humaine à prendre pendant les opérations de traitement. Des détails sur les activités de suivi sont également fournis.
Avant d’atteindre sa destination finale (site d’utilisation en lutte antiacridienne), un fût d’insecticide a souvent parcouru des centaines de kilomètres à travers le pays.
Il peut être nécessaire de transporter des quantités importantes de pesticides entre les magasins de stockage dans le pays ou vers des bases d’opérations de terrain et des pistes d’atterrissage. Bien souvent, les routes sont en mauvais état ou il n’y a même pas de route.
Le bris de conteneurs pendant le transport sur des routes en mauvais état ou au moment du chargement constitue un risque majeur lors des opérations de lutte antiacridienne. Cela est surtout le cas pour des fûts volumineux. Chaque camion doit disposer d’outils adaptés au chargement et au déchargement de fûts (ex. planches, bandes/cordes et vieux pneus). Il ne faut jamais charger des fûts volumineux (200 litres) sur plus d’un niveau sur la plate-forme du camion; à cause de leur poids, ils pourraient facilement endommager les fûts du niveau inférieur. Des fûts moins volumineux (par ex. de 60 litres) peuvent être empilés sur deux niveaux mais pas plus. Il faut séparer les niveaux de fûts par des palettes et bien attacher tous les fûts, à la fois aux palettes et à la plate-forme du camion; si cela n’est pas possible, il faut éviter d’empiler les fûts.
Il peut être tentant d’utiliser les camions transportant les insecticides pour acheminer d’autres marchandises ou matériel vers les bases de terrain, surtout si la capacité de transport est limitée. Cependant, il faut éviter cela à tout prix car le risque de contamination est trop élevé. Tout camion transportant des insecticides doit être équipé de l’ensemble du matériel de protection nécessaire (voir page 28).
L’une des caractéristiques de la lutte contre le Criquet pèlerin est le transport de petites quantités d’insecticides par des équipes isolées mixtes lors de leurs missions de prospection/traitement. Le nombre de véhicules par équipe ayant tendance à être limité, un tel transport peut poser des problèmes. Il ne faut jamais transporter des insecticides dans un véhicule contenant des équipements de campement et de l’eau potable ou de la nourriture. Un autre véhicule est indispensable pour transporter les insecticides et les appareils de traitement. Si les traitements sont réalisés avec un pulvérisateur monté sur véhicule, il est souvent préférable de transporter l’insecticide dans ce véhicule. En pareil cas, il est crucial de bien attacher les fûts au véhicule parce que des fûts mal fixés peuvent endommager sérieusement le pulvérisateur (voir Fig. 19).
Figure 20. Entreposer les insecticides et le carburant loin des habitations et du campement.
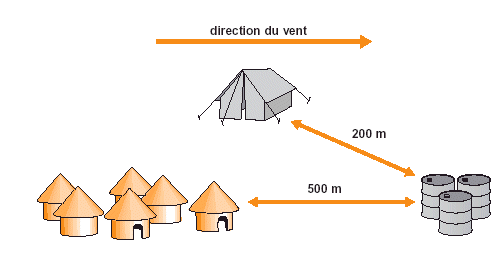
Figure 21. Entreposage temporaire des insecticides.
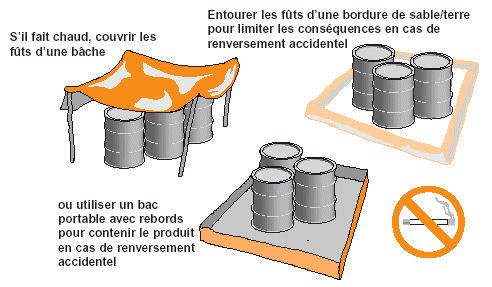
 |
Le carburant pour aéronef est très inflammable et quelques insecticides peuvent l’être aussi. Il est donc strictement interdit de fumer:
|
Lors d’une campagne de lutte importante, il peut être nécessaire d’entreposer temporairement des quantités importantes d’insecticides dans un nombre limité de bases à partir desquelles les insecticides seront distribués aux différents sites de traitement. Il faut construire des entrepôts à pesticides de grande capacité et conformes aux normes. Ils doivent respecter toutes les mesures de sécurité nécessaires pour contenir le produit en cas de renversement accidentel et être suffisamment aérés et bien protégés contre la pluie et le soleil. La FAO fournit des directives détaillées sur la conception des entrepôts de pesticides (voir page 87).
L’une des caractéristiques de la lutte antiacridienne est le stockage temporaire de quantités relativement faibles d’insecticides directement sur le site de traitement. Il peut s’agir d’une piste d’atterrissage ou d’une base de traitement temporaire. Les mesures de précaution sont particulièrement importantes en cas d’entreposage temporaire car des entrepôts de pesticides conformes aux normes sont rarement disponibles. L’entreposage de pesticides doit être fait suffisamment loin des habitations et des routes principales et de préférence sous le vent de la base de traitement (voir Fig. 20). Il faut mettre en place un gardiennage permanent des sites d’entreposage pour éviter tout contact de la population locale avec les insecticides.
Quand cela est possible, il faut veiller à entreposer les insecticides à l’ombre. Un excès de chaleur à l’intérieur des fûts peut provoquer, suite à l’augmentation de pression, un éclatement des fûts ou un giclement forcé du produit lors de l’ouverture. Si des traitements sont réalisés à partir du même site pendant plusieurs jours, les fûts peuvent être protégés du soleil par des bâches tendues entre des piquets (voir Fig. 21). Pour contenir du pesticide renversé accidentellement, il faut construire autour du site d’entreposage un rebord temporaire de sable/terre. Des bacs portables spéciaux existent aussi pour l’entreposage temporaire de fûts, évitant ainsi que les insecticides répandus s’infiltrent dans le sol (voir Fig. 21).
Le carburant pour les aéronefs de prospection et de traitement doit être entreposé près des pistes d’atterrissage (temporaires). Comme pour les insecticides, les entrepôts de carburant doivent être suffisamment éloignés des habitations et des campements. Dans certains cas, il peut être nécessaire de disposer de deux types de carburant (AvGas et Jet A1) sur la même piste d’atterrissage (par ex. lors de la présence simultanée d’hélicoptères et d’avions). En pareil cas, il faut absolument séparer les deux types de carburant et leurs pompes respectives pour éviter des mélanges aux conséquences potentiellement mortelles.
Pour éviter la surchauffe, il faut entreposer les fûts de carburant à l’ombre. Il est préférable de les coucher sur le côté pour réduire le risque de pénétration d’eau dans le carburant lors de pluies torrentielles.
Certaines formulations d’insecticides ainsi que le carburant pour aéronef sont inflammables. Il est donc interdit de fumer autour des sites d’entreposage d’insecticide et de carburant et pendant le ravitaillement des aéronefs; lors de cette intervention, tout moteur ou appareil susceptible de produire des étincelles (voiture, par ex.) doit être éteint ou déplacé.
Figure 22. Transvasement judicieux des insecticides.
 |
Les principaux risques associés au pompage sont l’éclatement des tuyaux et la perte des connexions entre tuyau et pompe. Il faut se rappeler de vérifier régulièrement ces connexions. |
La plupart des insecticides utilisés en lutte contre le Criquet pèlerin sont des formulations UBV prêtes à l’usage. Mélanger n’est donc pas un problème. Cependant, dans certains pays, des formulations UBV concentrées sont diluées sur le terrain. En pareil cas, il faut s’assurer que les agents chargés des dilutions ne soient pas en contact avec l’insecticide concentré. Des EPPs adaptés (surtout les gants, les écrans faciaux et les tabliers imperméables) et du matériel de pompage/mélange doivent être disponibles. Il faut former convenablement les agents à ces opérations de mélange/dilution.
Les réservoirs des aéronefs sont généralement remplis au moyen d’une pompe motorisée ou manuelle. C’est une opération potentiellement dangereuse car, en cas d’accident, l’opérateur peut être complètement inondé de produit. Les principaux risques associés au pompage sont l’éclatement des tuyaux et la perte des connexions entre tuyau et pompe. Il est probable que ces deux risques se produisent lors de l’utilisation de pompes motorisées.
Il est donc essentiel d’avoir du matériel de pompage de bonne qualité et de bien l’entretenir. Les insecticides UBV peuvent être très corrosifs et peuvent donc endommager relativement vite les tuyaux de la pompe. Il faut vérifier quotidiennement le niveau d’usure des tuyaux et la corrosion, et les remplacer dès que cela est nécessaire. De même, les connexions entre tuyau et pompe peuvent se desserrer lentement pendant l’opération, augmentant ainsi le risque d’exposition de l’opérateur. Il faut les contrôler et les serrer tous les jours (voir Fig. 22).
Verser directement les insecticides des fûts dans le réservoir de l’aéronef présente un risque élevé de contamination de l’opérateur et peut aussi endommager l’aéronef. Cette pratique n’est donc pas recommandée.
Le remplissage d’autres types de pulvérisateur peut aussi être dangereux puisque la formulation UBV concentrée peut éclabousser l’opérateur. Il est préférable de remplir les pulvérisateurs montés sur véhicule avec une pompe manuelle. Comme pour les pompes d’aéronef, le tuyau peut se corroder relativement vite et il faut le remplacer immédiatement si cela arrive. On peut remplir directement le pulvérisateur avec des conteneurs de petite capacité (20 litres). Le remplissage des pulvérisateurs à main s’effectue normalement en versant directement l’insecticide à partir du conteneur. Il faut utiliser un entonnoir de diamètre suffisamment large pour faciliter le remplissage et éviter de répandre du pesticide.
Pour toutes les opérations de transvasement d’insecticide, les agents doivent porter des EPPs adaptés; de l’eau ainsi que du savon pour le lavage doivent être disponibles. Il faut toujours remplir les pulvérisateurs loin des habitations, des personnes passivement présentes sur le site de traitement, des animaux et des sources d’eau. Il faut rincer les conteneurs vides avec un peu de kérosène ou de gazole puis mettre le mélange issu de ce rinçage dans le réservoir du pulvérisateur. Après utilisation, il faut bien reboucher les conteneurs, même s’ils sont vides, et les entreposer dans un endroit sûr (voir Fig. 22).
Minimiser l’exposition aux insecticides pendant le traitement:
|
Figure 23. Les agents de traitement doivent se plier à plusieurs pratiques élémentaires pour réduire au minimum leur exposition aux pesticides.
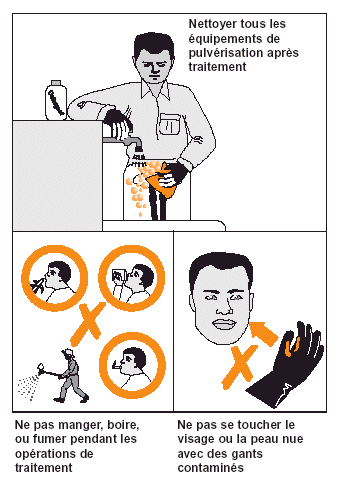
Il est important de réduire le risque d’exposition à l’insecticide pendant les opérations de lutte antiacridienne, aussi bien pour les agents de traitement que pour les personnes passivement présentes dans la zone traitée ou les organismes non-cibles.
Le facteur le plus important pour réduire le risque d’exposition aux insecticides lors des traitements est de bien former tous les agents aux bonnes pratiques d’épandage. Cela vaut aussi bien pour l’applicateur que pour le pilote et le personnel d’appui tel que les porte-fanion. Les fascicules de directives sur le Criquet pèlerin n° 4 «Lutte antiacridienne» et n° 7 «Annexes» 2.6 et 2.7 fournissent des conseils détaillés sur les bonnes pratiques d’épandage.
Un autre facteur important de diminution des risques est l’utilisation de matériel de traitement de bonne qualité et bien entretenu. Les pulvérisateurs ne doivent pas fuir et il faut régulièrement les nettoyer (voir Fig. 23). À noter que même un appareil de traitement bien entretenu constitue une source permanente d’exposition aux insecticides s’il n’est pas nettoyé correctement; cela est surtout valable pour les formulations UBV. Certains pulvérisateurs montés sur véhicule nécessitent la présence d’un opérateur pendant le traitement; cela est dangereux car de brusques changements de direction du vent peuvent contaminer l’opérateur. Les pulvérisateurs montés sur véhicule pouvant être manipulés à partir de la cabine du véhicule sont par conséquent recommandés.
Il est aussi important d’utiliser des équipements de protection personnelle –EPP– (voir page 27). Toutefois, cela constitue seulement l’ultime rempart face à l’exposition aux insecticides. Le niveau de protection fourni par les EPPs couramment utilisés en lutte antiacridienne est assez limité. Ils ne protégeront sûrement pas l’applicateur d’une mauvaise manipulation des insecticides ou de matériel de traitement défectueux.
En dernier lieu, l’observation d’exigences d’hygiène élémentaires de la part des agents antiacridiens réduit les risques d’exposition (voir Fig. 23).
 |
Exigences d’hygiène élémentaires à observer lors de la manipulation de pesticides:
|
Proposition de zones-tampons minimales pour la protection des habitats 1 aquatiques à respecter pendant les opérations de lutte contre le Criquet pèlerin | ||
Hauteur d’émission |
Type de pulvérisateur 2 |
Distance minimale de sécurité 3 |
1,0 - 1,5 m |
Micro-ULVA |
200 m |
2,5 - 3 m |
Ulvamast (X15) |
400 m |
10 m |
Aéronef (Micronair AU5000) |
1 500 m |
1 Les
zones-tampons ont été calculées pour des écosystèmes d’eau douce. En
attendant de vérifier les zones-tampons pour les écosystèmes terrestres,
les zones-tampons aquatiques peuvent servir de référence.
| ||
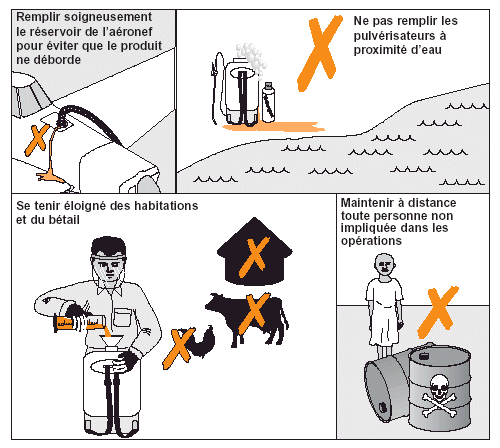
Figure 24. Avant de commencer les opérations de traitement, les agents antiacridiens doivent donner des instructions à la population locale.
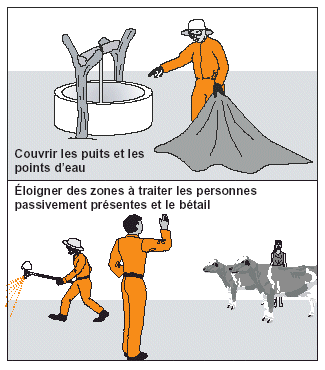
Il faut maintenir à une certaine distance de sécurité toutes les personnes n’ayant pas un rôle direct dans les opérations de traitement. Il faut préalablement informer les habitants de la zone dans laquelle des traitements auront lieu et les avertir de ne pas s’approcher des sites de traitement (voir Fig. 24). Comme les cibles acridiennes sont souvent identifiées en fin d’après-midi pour être traitées le lendemain matin, les habitants peuvent être prévenus la veille des opérations. Toutefois, même si ce n’est pas le cas, les équipes de traitement doivent toujours s’assurer qu’il n’y a personne dans la zone à traiter; cela vaut aussi pour le bétail. Lors des pulvérisations, les agents qui ne sont pas directement impliqués dans l’opération d’épandage doivent vérifier que les personnes passivement présentes dans la zone traitée restent à distance de sécurité. S’il est impossible d’éviter la présence de spectateurs, il faut alors veiller à ce qu’ils restent au vent de la zone traitée.
Certaines zones ou certains environnements sont interdits de tout traitement antiacridien. Il s’agit généralement des villages ou des habitations, des eaux de surface et des réserves naturelles. L’organisation de la campagne doit préparer une liste de zones ne pouvant pas être pulvérisées et/ou contaminées (voir page 25). Si de telles zones se situent sous le vent des zones à traiter, il faut garder une distance suffisante pour éviter que les insecticides ne dérivent vers elles. La taille de ces zones-tampons non traitées dépend du type de traitement (aérien ou terrestre), des conditions météorologiques (par ex. vitesse du vent), des conditions topographiques et de végétation (densité et hauteur) et de la vulnérabilité de la zone à protéger (voir tableau page opposée).
Cependant, même en respectant ces zones-tampons, il est impossible de garantir l’absence de risque. Il faut donc, dès que cela est possible, suivre leur efficacité. De plus, même lorsque ces zones-tampons sont observées, certaines mesures peuvent être adoptées pour réduire davantage les risques de contamination: couverture des puits ou des points d’eau situés dans la zone à traiter (voir Fig. 24); fermeture temporaire des ruches pour les protéger de toute dérive de pulvérisation inattendue (il est toutefois important d’éviter leur surchauffe).
Les pilotes et les opérateurs de lutte doivent toujours être attentifs aux situations imprévues. Il se peut que des personnes ou des animaux se soient promenés dans la zone traitée par inadvertance, que des mares ou des points d’eau n’aient pas été repérés lors des prospections des zones à traiter, qu’un porte-fanion ait oublié de se déplacer face au vent à temps... Dans tous ces cas, il faut arrêter temporairement l’épandage pour éviter l’exposition des personnes ou des organismes non-cibles.
 |
Élimination de l’eau utilisée pour le lavage et le nettoyage Il faut absolument veiller à ce que l’eau utilisée
pour le lavage des EPPs et le nettoyage des appareils de traitement ne
contamine ni les puits ni les eaux de surface. Par conséquent, les
opérations de lavage et nettoyage doivent être effectuées suffisamment
loin des points d’eau et des puits. Il ne faut jamais nettoyer des
équipements de pulvérisation près d’une rivière ou d’un point d’eau, même
si cela peut paraître pratique. |
Figure 25. La lutte contre le Criquet pèlerin peut représenter un risque accru d’exposition aux insecticides même lorsque des EPPs adaptés sont utilisés. Cela s’explique par le fait que: (a) le stress dû à la chaleur peut entraîner l’opérateur à commettre des erreurs; (b) la transpiration augmente l’absorption de l’insecticide par la peau; (c) les EPPs de remplacement peuvent être loin, obligeant les agents à continuer leur travail avec du matériel contaminé.
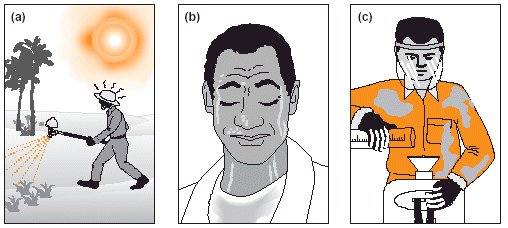
Comme mentionné dans le chapitre précédent, l’équipement de protection personnelle (EPP) constitue le dernier rempart face à l’exposition aux insecticides. Mais l’EPP n’est jamais une protection absolue en soi. En page 27 est proposée une liste d’EPPs de base recommandés en lutte contre le Criquet pèlerin. Elle se réfère aux types d’insecticides les plus nocifs utilisés en lutte antiacridienne (Classe II de la classification OMS). Néanmoins, il est recommandé de considérer cet EPP comme standard même en cas d’utilisation d’insecticides moins nocifs. Comme les membres d’un gouvernement, les agents antiacridiens doivent montrer l’exemple aux autres utilisateurs de pesticides dans le pays. Mettre en œuvre des bonnes pratiques d’épandage est donc important.
L’EPP doit être confortable à porter. Utiliser des combinaisons lourdes ou imperméables dans les conditions de forte chaleur souvent rencontrées en lutte contre le Criquet pèlerin provoquera très probablement une surchauffe (voir Fig. 25). Cela est dangereux car pouvant réduire la concentration des opérateurs et résulter en erreurs. Un tel EPP peut aussi provoquer des coups de chaleur. Des combinaisons plus légères et plus aérées ont tendance à être davantage perméables; il faut donc redoubler de prudence lors de la manipulation et des pulvérisations insecticides.
Les gants doivent être longs, couvrant la majeure partie de l’avant-bras. En cas de manipulation d’insecticides liquides, les gants doivent recouvrir les manches de la combinaison et avoir les bords tournés vers l’extérieur, constituant ainsi un puits pour contenir l’insecticide qui pourrait se répandre sur le bras. (voir Fig. 14). Si des poudres pour poudrage sont appliquées, il est préférable de porter les gants sous les manches de la combinaison.
À noter que les cartouches des masques respirateurs peuvent devenir inutilisables avant la fin de la période d’usage effectif inscrite sur l’étiquette. Cela peut résulter d’un encrassement dû à la poussière ou d’un excès d’humidité. Il faut donc contrôler régulièrement les cartouches et les jeter immédiatement si l’on peut sentir le pesticide en portant le masque respirateur.
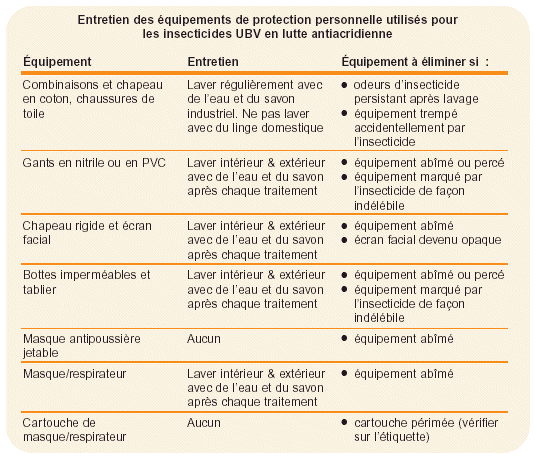
Il est fondamental de bien nettoyer et entretenir l’EPP. Un EPP contaminé porté directement sur le corps est une source permanente d’exposition aux insecticides. Cela peut être plus dangereux que de ne porter aucun EPP. La page opposée fournit des recommandations sur l’entretien des EPPs.
Il faut s’assurer que suffisamment d’EPPs de remplacement sont disponibles pour chaque équipe de traitement, remplacer tout équipement contaminé, déchiré ou abîmé. L’EPP est relativement bon marché comparé aux coûts des insecticides ou du traitement. Par conséquent, le remplacement régulier des EPPs ne devrait jamais être un problème.
 |
|
Figure 26. Soins de premier secours en cas d’exposition et d’empoisonnement aux insecticides.
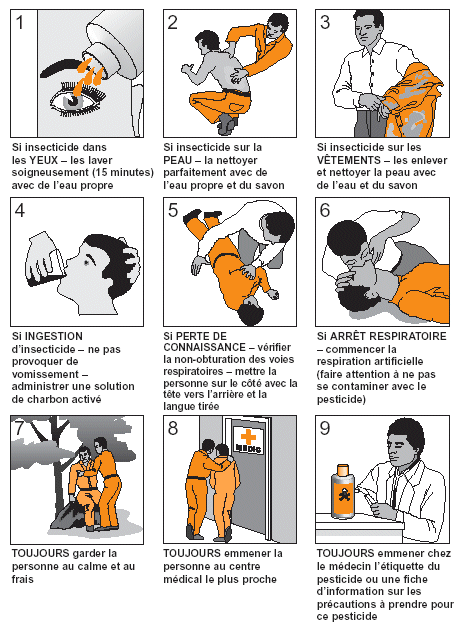
 |
Il ne faut jamais administrer les antidotes de manière prophylactique. Utiliser de l’atropine ou du pralidoxime en médication préventive peut cacher les premiers signes d’empoisonnement à l’organo-phosphoré. Cela permet aux agents antiacridiens de continuer à traiter alors qu’ils ne devraient pas et peut donc provoquer un empoisonnement encore plus grave. |
Même lorsque toutes les mesures ont été prises pour réduire l’exposition à l’insecticide et lorsqu’une tenue de protection adaptée est portée, un empoisonnement à l’insecticide n’est pas exclu. Malheureusement, les signes et symptômes d’un empoisonnement à l’insecticide sont rarement très spécifiques et peuvent aussi être dus à d’autres problèmes de santé. Les agents de terrain doivent donc être vigilants. En cas de doute sur l’origine de symptômes liés ou non à l’utilisation d’insecticide, la personne affectée doit cesser toute manipulation du produit. Les symptômes les plus caractéristiques d’un empoisonnement à l’insecticide utilisé en lutte antiacridienne figurent page 85.
Les premiers soins après une exposition à un insecticide sont d’une importance vitale. Cela est particulièrement vrai en lutte contre le Criquet pèlerin car l’assistance médicale peut être très éloignée des sites de traitement. Les objectifs les plus importants des premiers soins sont de réduire ou de stopper toute nouvelle exposition à l’insecticide et de rassurer le patient si nécessaire. La figure 26 fournit des conseils sur les premiers secours.
Le traitement d’un empoisonnement grave à l’insecticide est compliqué, même dans les hôpitaux spécialisés bien équipés. Dans la lutte contre le Criquet pèlerin, les longues distances entre les sites de pulvérisation et les hôpitaux rendent d’autant plus difficiles les traitements rapides. Éviter l’empoisonnement doit donc être la priorité absolue. Un empoisonnement à l’insecticide doit être traité par du personnel médical compétent. Cependant, dans la lutte contre le Criquet pèlerin, les médecins qualifiés ne travaillent pas toujours à proximité des sites de traitement. Il faut donc former les agents de terrain responsables non seulement aux soins de premier secours mais aussi au traitement de base tel que l’administration d’atropine en utilisant un injecteur automatique. Le tableau ci-dessous fournit davantage de détails sur les traitements spécifiques.
Traitement d’un empoisonnement aux insecticides | |
Famille insecticide |
Traitement |
Tous les insecticides |
|
Organo-phosporés |
|
Carbamates |
|
Pyréthrinoïdes |
|
Benzoyl-urées |
|
Phenyl-pyrazoles |
|
Figure 27. Délais de carence à respecter après des traitements antiacridiens.
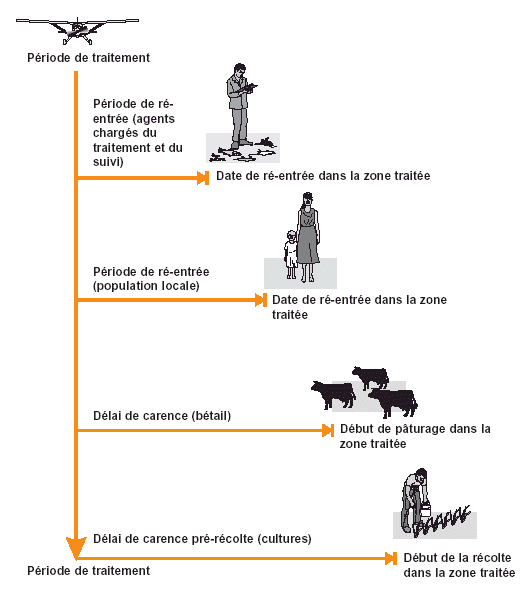
Conseil: les agents antiacridiens chargés du traitement et du suivi doivent expliquer l’importance du respect des délais de carence pour le bétail aux éleveurs et des délais de carence pré-récolte aux agriculteurs. |
Après des traitements antiacridiens, il faut respecter une période minimale avant la ré-entrée des hommes et du bétail dans la zone traitée ou avant la récolte de cultures traitées. Cela permet aux résidus d’insecticide de diminuer jusqu’à des niveaux acceptables et de réduire les risques d’exposition. De telles périodes minimales sont généralement appelées délais de carence. En principe, ils sont fixés par l’agence de réglementation responsable de l’homologation des pesticides et sont ensuite inscrits sur l’étiquette du pesticide. Les agents antiacridiens doivent informer la population locale de ces délais de carence et expliquer pourquoi il est important de les respecter. Il est évident que les agents antiacridiens doivent montrer l’exemple en observant eux-mêmes ces délais (voir Fig. 27).
Les agents chargés de la lutte ou suivi ont parfois besoin de pénétrer dans une zone juste après son traitement, par exemple pour vérifier la mortalité des criquets ou prélever des résidus. Si les agents portent une tenue de protection adaptée, ils ne courent en principe pas de risque trop élevé. Il faut toutefois respecter une période minimale de ré-entrée pour permettre au nuage de pulvérisation de se déposer et d’éviter l’inhalation de petites gouttelettes d’insecticide. Il faut laver dès que possible les combinaisons ou les bleus de travail des agents après cette activité.
La population locale ne dispose d’aucune tenue de protection. Par conséquent, avant que les personnes passivement présentes et les locaux ne puissent ré-entrer dans une zone traitée, le dépôt d’insecticide sur la végétation doit s’être complètement desséché et le résidu restant ne doit pas représenter de risque à travers une exposition de la peau (par ex. si les personnes frôlent la végétation traitée).
Le délai de carence pour le bétail dure en général plus longtemps que la période de ré-entrée pour l’ensemble du public. Cela s’explique par le fait que le bétail se nourrit de végétation traitée. Le risque d’empoisonnement du bétail après des traitements antiacridiens, aux doses recommandées des insecticides évalués par le Groupe consultatif sur les pesticides, est extrêmement faible. Néanmoins, il faut respecter des délais de carence pour éviter le risque de présence de résidus d’insecticide dans la viande ou le lait. Dans certains pays, le bétail est autorisé dans la zone traitée mais une longue période avant l’abattage est alors imposée.
Les délais de carence les plus longs sont généralement ceux appliqués à la récolte des cultures destinées à la consommation humaine. Au moment de la récolte, les résidus d’insecticide ne doivent pas dépasser les limites maximales tolérées pour les résidus (LMRs). Celles-ci sont établies par les autorités de réglementation nationales, parfois basées sur les LMRs internationales définies dans le Codex Alimentarius.
Figure 28. Méthodes à éviter pour se débarrasser des conteneurs d’insecticides vides.

Figure 29. Conduite à tenir en cas de renversement accidentel d’insecticide.
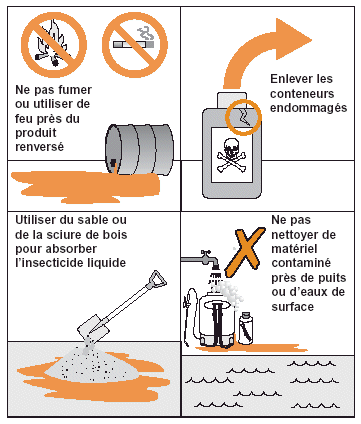
Les fûts, sacs ou autres conteneurs insecticides vides représentent un risque pour la santé humaine et l’environnement car il y reste toujours un peu de produit. Cela est surtout vrai pour les formulations UBV, très difficiles à nettoyer parfaitement.
Dans certaines zones de l’aire de distribution du Criquet pèlerin, les conteneurs vides sont très recherchés. Cependant, les conteneurs insecticide vides ne doivent jamais, quel que soit le contexte, être réutilisés pour stocker de l’eau potable ou de la nourriture même après nettoyage (voir Fig. 28). Les agents antiacridiens ne doivent pas satisfaire les demandes des populations réclamant des conteneurs insecticides vides.
Les emballages en papier vides utilisés pour les formulations d’insecticides en poudre peuvent être brûlés à condition de le faire loin des habitations. En pareil cas, les agents doivent se trouver au vent du site d’incinération. Les fûts ou les conteneurs en plastique vides sont d’abord rincés avec un peu de gazole ou de kérosène et le liquide de rinçage est remis dans le réservoir d’un pulvérisateur. Tous les conteneurs vides doivent ensuite être rapportés à la base de lutte antiacridienne. Il ne faut jamais les brûler ou les enterrer sur le site de traitement car cela est dangereux pour les êtres humains et l’environnement. Après la campagne de lutte, les conteneurs vides rassemblés au niveau de la/des base(s) antiacridienne(s) peuvent être gérés de manière appropriée (voir page 77).
Un équipement de protection personnelle (EPP) contaminé ou abîmé doit être traité comme un déchet chimique. Il faut l’emballer dans des sacs plastiques solides et le rapporter à la base antiacridienne pour une élimination appropriée. Il ne faut jamais l’abandonner sur le site de traitement car des locaux (surtout les enfants) peuvent le ramasser et se contaminer.
Le sol ou n’importe quel autre substrat ou objet souillé par un insecticide accidentellement renversé doit être immédiatement nettoyé pour éviter toute contamination ultérieure (voir Fig. 29). En cas de pesticide accidentellement renversé, il faut:
Si le pesticide se renverse sur une grande zone, il faut le contenir avec un rebord de terre pour réduire la superficie concernée et prévenir la contamination des eaux de surface. Il faut veiller à ce que la population et le bétail ne puissent pas accéder au site contaminé. Ces mesures élémentaires prises, contacter le siège de l’unité de lutte antiacridienne pour que soit mise en place une vaste opération de nettoyage.

 |
En cas d’observation répétée de taux de mortalité insuffisants ne pouvant pas être expliqués par des épandages mal effectués, il faut contacter le responsable de la base de terrain ou le principal responsable de terrain. Tout incident d’empoisonnement des agents antiacridiens doit être immédiatement signalé par radio au principal responsable de campagne ou à son responsable médical. Tout incident relatif à du pesticide accidentellement renversé ou à une fuite importante et les mesures prises pour y remédier doivent être signalés par radio au principal responsable de campagne. |
Un suivi minimum doit être effectué directement par les équipes de traitement. Ces activités sont appelés «évaluations rapides» et sont partiellement décrites dans le fascicule de directives n° 4 «Lutte antiacridienne». Une évaluation rapide comprend les activités ci-dessous.
Il faut collecter les paramètres de base de l’épandage insecticide pour chaque opération de traitement. Ils comprennent: la localisation exacte de la zone traitée, des données sur l’insecticide, les conditions météorologiques pendant la pulvérisation et le réglage des appareils. Le Formulaire FAO de suivi de la pulvérisation couvre tous ces aspects (voir Annexe 4.2) et les équipes de lutte doivent le remplir pour chaque cible traitée. Comme l’épandage d’insecticides représente la part la plus onéreuse d’une campagne de lutte antiacridienne, un traitement mal effectué peut être très coûteux. Le suivi de l’épandage est donc essentiel, d’un point de vue économique et environnemental.
Les évaluations d’efficacité servent à vérifier si l’insecticide et la technique de lutte sont effectifs. Elles ne doivent pas être réalisées après chaque traitement mais il est recommandé de vérifier régulièrement l’efficacité, même avec des insecticides pour lesquels on a de l’expérience. Davantage d’information sur les évaluations de mortalité acridienne est fournie dans le fascicule de directives n° 4 «Lutte antiacridienne».
Tous les cas d’empoisonnement aux insecticides (même suspectés) des agents antiacridiens doivent être signalés avec le maximum de détails possible. Le Formulaire FAO de suivi de la pulvérisation (Annexe 4.2) prévoit une rubrique à cet effet mais un formulaire plus détaillé figure page 84.
La mortalité des organismes non-cibles (poissons, abeilles, oiseaux, crevettes) doit être mentionnée dans le Formulaire FAO de suivi de la pulvérisation. Cela aidera l’(es) équipe(s) de suivi spécialisée(s) à examiner plus en détail les effets secondaires indésirables ou excessifs des traitements.
Les agents antiacridiens peuvent recevoir des informations sur des cas présumés d’empoisonnement aux insecticides observés dans la population ou des plaintes à propos des opérations de lutte antiacridienne. Il faut noter de telles informations avec le maximum de détails possible dans le carnet de terrain. Cependant, les équipes de traitement ne sont généralement pas équipées, ou n’ont pas le temps, pour enquêter sur de tels cas. Elles doivent en informer le siège de la campagne, qui peut ensuite prendre action (ex. en envoyant une équipe de suivi spécialisée).
Les équipes de traitement n’ont pas à effectuer de prélèvement en vue de l’analyse des résidus insecticides. Les opérateurs manipulant en permanence des insecticides très concentrés, le risque de contaminer de tels prélèvements est trop élevé. Le prélèvement de résidus doit être effectué par l’(es) équipe(s) de suivi spécialisée(s).
Figure 30. Le suivi opérationnel spécialisé peut comprendre tout ou partie des activités ci-dessous. Il dépend du type de personnel impliqué, des fonds disponibles et des priorités établies par l’organisation de la campagne.
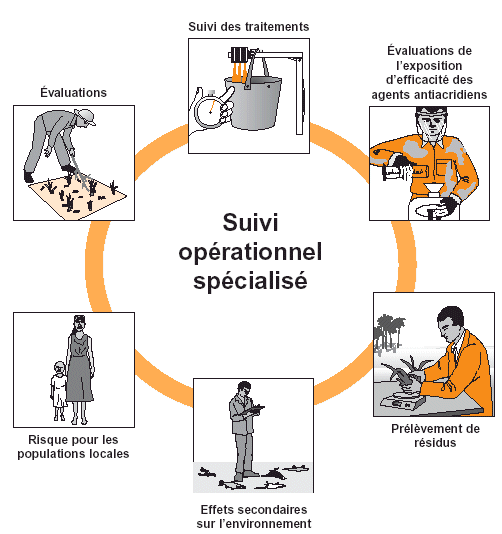
Conseil: si une équipe de suivi spécialisée est sur place, elle peut libérer l’(es) équipe(s) de traitement des responsabilités de suivi des traitements et des évaluations d’efficacité. Cela permet aux équipes de lutte de se concentrer sur les activités de prospection et de traitement et peut accélérer les opérations. |
Dans de nombreuses campagnes de lutte, une ou plusieurs équipes de suivi opérationnel spécialisé ont un rôle actif. Dans les sections ci-dessous, différents aspects de ce type de suivi sont abordés. Toutefois, il est impossible, dans ce fascicule de directives, de fournir des protocoles détaillés pour chaque aspect du suivi de l’environnement et de la santé humaine. Des références d’informations plus détaillées sur des sujets spécifiques concernant le suivi figurent page 86.
Il n’est jamais possible de suivre de près tous les traitements ou d’évaluer tous les effets potentiels d’un insecticide. Il faut donc choisir ce qu’il convient exactement de surveiller (voir Fig. 30). Cela dépend généralement des compétences et des fonds disponibles pour l’activité. Des suggestions pour fixer les priorités ont déjà été données dans la section de ce fascicule relative à la préparation de la campagne. En principe, le suivi doit au moins concerner les activités que les agents antiacridiens ou l’ensemble du public considèrent comme potentiellement dangereuses. Il est préférable de limiter le suivi à quelques problèmes et de le faire sérieusement plutôt que d’essayer d’en couvrir beaucoup et ne pas pouvoir fournir de réponse satisfaisante.
Le suivi de la pulvérisation est d’abord du ressort des équipes de traitement (voir page 59). Toutefois, si une équipe de suivi spécialisé est sur place, elle peut assumer cette tâche. Elle réduit ainsi la charge de travail de l’équipe de traitement, ce qui peut accélérer l’opération de lutte. Elle fournit également une vérification indépendante de l’étalonnage des appareils et de l’exécution des traitements. Le Formulaire FAO de suivi de la pulvérisation est disponible en Annexe 4.2.
Pour les mêmes raisons, l’équipe de suivi spécialisé peut aussi réaliser des évaluations d’efficacité. Cela est surtout utile pour des insecticides ayant une vitesse d’action modérée ou faible. L’équipe de traitement peut se déplacer vers d’autres cibles pendant que l’équipe de suivi reste sur place pour vérifier l’efficacité du traitement précédent. Le fascicule de directives n° 4 «Lutte antiacridienne» donne des conseils supplémentaires sur l’évaluation des mortalités acridiennes.
 |
Question fréquemment posée no 4 (voir réponse page 88) De l’expérience dans le domaine du suivi opérationnel de l’environnement et de la santé humaine des campagnes de lutte antiacridienne, tel que décrit dans ce fascicule de directives, est-elle disponible? |
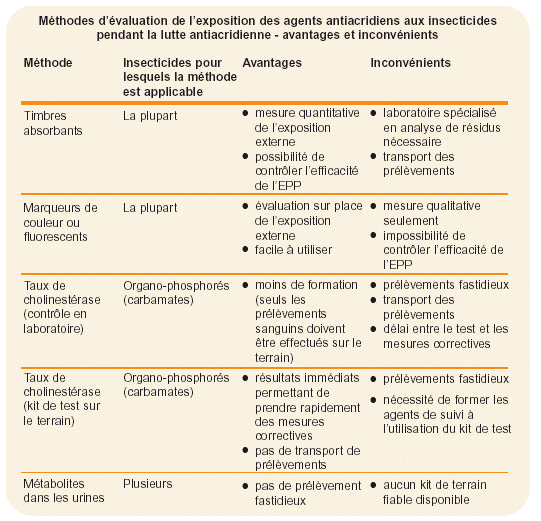
Figure 31. Ajouter un colorant (fluorescent) à l’insecticide peut aider à évaluer l’exposition des agents de traitement.
Exposition des agents antiacridiens. Ce sont les opérateurs de terrain qui courent le plus haut risque d’être exposés aux, voire empoisonnés par des, insecticides. Il est donc important de contrôler régulièrement l’exposition aux insecticides.
Exposition externe. L’exposition externe aux insecticides peut être contrôlée en utilisant des timbres absorbants fixés, avant l’épandage ou la manipulation d’insecticide, sur certaines parties du corps. Après le traitement, les timbres sont conservés dans un réfrigérateur, transportés au laboratoire et analysés pour détecter les éventuels résidus d’insecticide. Si les timbres sont aussi fixés à l’intérieur de la tenue de protection, le niveau de protection fourni par celle-ci peut également être évalué.
Une deuxième méthode pour évaluer l’exposition externe consiste à mélanger un marqueur (fluorescent) à l’insecticide (voir Fig. 31). Les opérateurs effectuent ensuite les manipulations et pulvérisations comme d’habitude. Le traceur peut être visualisé après traitement (pour les traceurs fluorescents, cela peut être fait de nuit, au retour au camp, en utilisant une lampe UV à piles). Cette méthode est seulement qualitative mais est efficace pour démontrer que des pratiques de lutte sont potentiellement dangereuses.
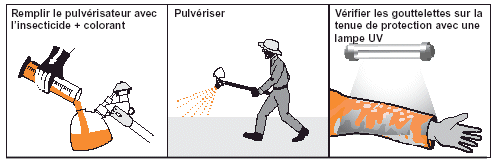
Exposition interne. Un indicateur communément utilisé pour l’absorption d’organo-phosphoré est la chute du taux d’acétylcholinestérase (dans les globules rouges) et de pseudocholinestérase (dans le plasma). Le taux peut être contrôlé après analyse d’un prélèvement sanguin en utilisant un kit de test de terrain ou dans un laboratoire spécialisé.
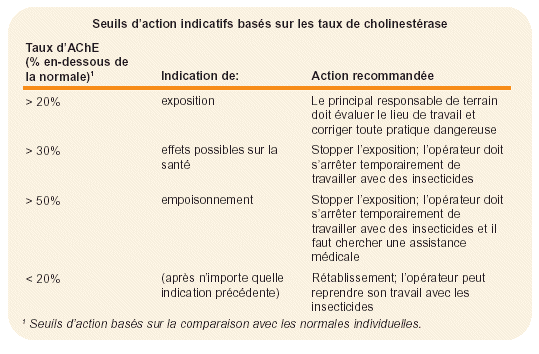
Figure 32. Composition d’un kit de terrain pour tester le taux de cholinestérase.
Figure 33. Des prélèvements sanguins peuvent être effectués sur le terrain pour évaluer l’exposition aux insecticides organo-phosphorés.

En lutte contre le Criquet pèlerin, les kits de terrain pour tester le taux de cholinestérase sont recommandés parce qu’ils évitent de transporter les prélèvements jusqu’à un laboratoire (pouvant être très éloigné du site de traitement) et permettent de prendre immédiatement des mesures correctives, si nécessaire. Des kits de terrain de bonne qualité, solides, et faciles d’usage sont maintenant disponibles (voir Fig. 32). Il est préférable que les prélèvements sanguins soient effectués par du personnel médical ou paramédical (voir Fig. 33). Si le taux de cholinestérase s’effondre au-delà du seuil considéré comme acceptable, il faut (temporairement) soustraire l’agent aux opérations de traitement jusqu’à son rétablissement.
L’exposition aux carbamates peut aussi être contrôlée en utilisant un test de cholinestérase. Cependant, comme la chute du taux de cholinestérase induit par le carbamate ne dure pas très longtemps, il faut effectuer le test sanguin dans l’heure qui suit le contact sinon aucun effet ne sera perceptible. Il n’existe pour le moment aucun kit de terrain pratique pour contrôler l’empoisonnement aux pyréthrinoïdes, aux benzoyl-urées ou aux phenyl-pyrazoles.
Empoisonnement des agents antiacridiens. Tous les cas d’empoisonnement des opérateurs doivent être consignés avec un maximum de détails pour éviter qu’ils ne se reproduisent dans le futur. Le Formulaire FAO d’incident d’empoisonnement pour les opérations de lutte antiacridienne peut être utilisé à cet effet (voir page 84).
Exposition de la population locale. Le risque d’exposition aux insecticides utilisés en lutte antiacridienne de la population locale est généralement évalué à travers des contrôles indirects. Ceux-ci incluent l’analyse des résidus d’insecticide dans la nourriture et l’eau, la vérification des zones-tampons et des délais de carence, le respect des pratiques d’épandage par les équipes de traitement et le comportement des personnes passivement présentes dans la zone traitée. La prochaine section donne des conseils sur les prélèvements à effectuer pour analyser les résidus d’insecticides. Une liste des éléments à prendre en compte pour évaluer le risque d’exposition des populations locales aux insecticides utilisés en lutte antiacridienne est proposée page 82. Il est recommandé de compléter cette liste régulièrement, surtout si les traitements ont lieu près d’habitations.
Des contrôles directs (prélèvement sanguins, examens médicaux, études épidémiologiques) sont très rarement utiles en situation de lutte antiacridienne car l’exposition, si elle alieu, est généralement très brève, ne se produit qu’une fois et concerne des insecticides relativement peu rémanents.
Taille minimale de l’échantillon à prélever pour le suivi des résidus en situation d’urgence | |
Substrat |
Taille minimale du substrat 1,2 |
Eau (en cas de dérive d’insecticide ou de produit accidentellement renversé) |
1 litre |
Sol (en cas de produit accidentellement renversé) |
500 g |
Herbage, fourrage vert |
1 000 g |
Cultures (grains de céréales, cultures au stade feuillaison) |
1 000 g |
Lait |
500 ml |
Arthropodes (ex. abeilles et crevettes) |
100 - 200 g |
Poisson |
500 g |
|
1 Chiffres
uniquement indicatifs; la taille exacte minimale de substrat à prélever
dépend de la limite de détection pour l’insecticide et le
substrat | |
Figure 34. Toujours mesurer la taille exacte de l’échantillon immédiatement après prélèvement (poids frais pour les solides et volume pour les liquides).

Il est parfois utile de contrôler les résidus d’insecticides après les traitements antiacridiens et ce avec deux objectifs: évaluer si les délais de carence recommandés par les producteurs d’insecticides sont valides dans les conditions locales ou confirmer qu’il n’y a aucune contamination des zones protégées quand les zones-tampons recommandées sont respectées. De plus, en cas d’observation de mortalité chez les poissons ou dans la faune sauvage, l’analyse des résidus peut aider à contrôler si ces incidents résultent de la lutte antiacridienne. Toutefois, l’analyse de résidus d’insecticide coûte cher et, si le prélèvement n’est pas effectué correctement, l’exercice entier peut se révéler inutile. Par conséquent, tout échantillonnage effectué en vue de l’analyse de résidus d’insecticide doit être très bien préparé.
Études de suivi de résidus. Il n’existe pas de protocole général d’échantillonnage pour l’analyse des résidus d’insecticide. Cela dépend du substrat prélevé (eau, végétation...) et du type d’insecticide concerné (voir Fig. 34). Aussi, la question exacte à laquelle il faut répondre détermine dans une certaine mesure la nature et la durée de l’étude. La liste des éléments à prendre en compte de la page suivante fournit des conseils d’ordre général sur le processus de mise en place d’un exercice de suivi des résidus. Des références supplémentaires sur les méthodes de prélèvement pour l’analyse des résidus d’insecticide sont données page 86.
Échantillonnage d’urgence. Il est parfois impossible de développer un plan d’échantillonnage approprié. Cela peut arriver en situation d’urgence, par ex. lors d’observation de mortalité dans la faune sauvage, d’insecticide accidentellement renversé, de plaintes d’apiculteurs relatives à des dégâts causés par la lutte antiacridienne... En pareils cas, l’équipe de suivi peut avoir à effectuer immédiatement un échantillonnage pour ensuite analyser les résidus d’insecticide. Il est important d’effectuer l’échantillonnage le plus tôt possible, sinon les résidus peuvent s’être déjà dégradés. La page opposée donne des tailles indicatives d’échantillons à respecter dans ces cas-là.
 |
Question fréquemment posée no 5 (voir réponse page 88) Peut-on manger des criquets traités? |
Étapes à
suivre lors de la mise en place | |
Étapes à suivre |
|
1 |
Identifier clairement la question principale à laquelle il faut répondre |
2 |
Définir le substrat à prélever (culture, végétation naturelle, eau, lait) |
3 |
Identifier quel(s) est(sont) l’(es) insecticide(s) et éventuellement leurs métabolites à analyser; obtenir leurs caractéristiques physicochimiques |
4 |
Identifier le laboratoire capable d’analyser cet insecticide (dans le pays comme à l’étranger) |
5 |
Obtenir du laboratoire, du producteur de l’insecticide ou à partir d’un manuel analytique, la méthode d’analyse de l’insecticide dans le substrat sélectionné |
6 |
Définir un programme d’échantillonnage: taille et fréquence des prélèvements (fonction de la question à résoudre [étape 1], du type de substrat [étape 2], de la rémanence de l’insecticide [étape 3] et de la limite du détection [étape 4] ) |
7 |
Décider du lieu d’extraction de l’insecticide, sur place ou au laboratoire (fonction du type d’insecticide [étape 3] et du matériel disponible) |
8 |
Définir la(les) méthode(s) et la durée de transport des prélèvements, du terrain au laboratoire (fonction de la stabilité de l’insecticide [étape 3], du type de substrat [étape 2], du type de prélèvement –complet ou partiel– [étape 7] et de la distance à laquelle se trouve le laboratoire [étape 4]) |
9 |
Choisir le type de contenant du prélèvement (fonction du type de substrat [étape 2], du |
10 |
Définir des mesures de garantie de qualité (ex. préparation d’échantillons chargés d’une quantité connue d’insecticide, utilisation d’un système d’étiquetage en double aveugle, utilisation de prélèvement répartis en deux lots pour un éventuel deuxième résultat d’analyse, prévention de contamination croisée...) |
Note: Des informations complémentaires sur la conception et l’exécution d’un suivi des résidus sont disponibles en section «Références» page 86. |
|
Conception des études de suivi des résidus. Le suivi des résidus d’insecticide dans les cultures, le sol, l’eau ou le bétail peut parfois être nécessaire dans le cadre d’un exercice de suivi environnemental. Il faut répondre à un certain nombre de questions avant de mettre en place une telle étude. Les points à prendre en compte pour s’assurer que l’étude de suivi est correctement conçue sont énumérés en page opposée.
Bonnes pratiques d’échantillonnage. De bonnes pratiques d’échantillonnage sont essentielles à la réussite du suivi des résidus d’insecticide. Les quantités d’insecticides à détecter sont très faibles. Une contamination ou un mauvais entreposage peut invalider la totalité de l’exercice.
Le suivi des résidus d’insecticide doit suivre les bonnes pratiques de laboratoire et de terrain toutes les fois que cela est possible. Des protocoles détaillés d’échantillonnage et de manipulation des échantillons sont ensuite appliqués. Toutefois, même en cas d’échantillonnage d’urgence, il faut respecter certaines règles de base:
Figure 35. L’observation de cas de mortalité ou de comportement anormal chez des organismes non-cibles peut fournir une information précieuse sur le risque pour l’environnement induit par l’insecticide.

Les agents responsables du suivi doivent noter:
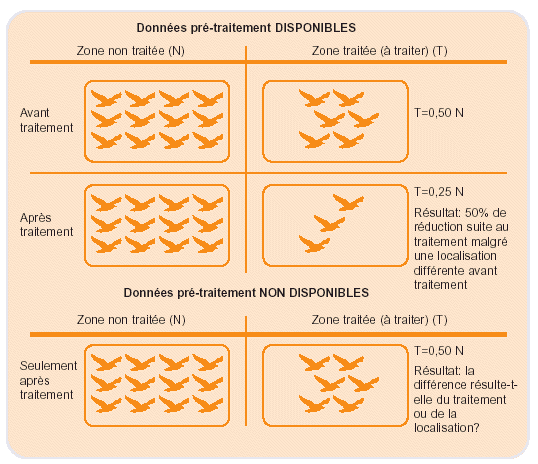
Figure 36. Dilemme à résoudre lors du suivi de l’abondance en l’absence de données pré-traitement: la différence de densité aviaire entre les zones traitée et non traitée est-elle due à l’insecticide ou seulement à la localisation de la zone?
L’une des principales contraintes du suivi écologique de la lutte contre le Criquet pèlerin est que la localisation exacte des zones à traiter n’est souvent connue que peu de temps avant le début des pulvérisations. La plupart des cibles à traiter sont identifiées le soir précédant le traitement et parfois seulement le jour même. Cela signifie que les observations ou les prélèvements pré-traitement sont généralement impossibles. Par conséquent, la portée du suivi écologique réalisable est relativement limitée.
Trois approches de suivi écologique opérationnel peuvent généralement être utilisées en lutte contre le Criquet pèlerin: observations, mesures et expériences.
Observations. Les observations sont (pour la plupart) des évaluations qualitatives de l’impact direct d’un traitement, par ex. poissons morts, changements de comportement chez les oiseaux, mortalité importante chez les abeilles... (voir Fig. 35). Même si les effets secondaires écologiques ne sont pas quantifiés, de telles observations sont très importantes. Des organismes sensibles peuvent être identifiés pour une étude complémentaire et des effets secondaires imprévus peuvent indiquer des problèmes induits pas les traitements insecticides.
Il est donc toujours utile de prendre un peu de temps pour parcourir la zone traitée et observer ce qu’il s’y passe. La plupart des changements de comportement se manifestent assez rapidement après la pulvérisation (c.-à-d. de 1 à 48 heures après traitement). Toutefois, la mortalité peut intervenir plus tard selon le type d’organisme et d’insecticide utilisé. L’observateur doit essayer de noter le niveau d’effort d’échantillonnage pour réaliser ce type d’évaluation (par ex. «Trois des cinq points d’eau contrôlés abritaient des poissons morts» ou «15 reptiles morts ont été trouvés en une demi-heure de recherche»).
Mesures. Les mesures correspondent à toutes les évaluations quantitatives de l’impact d’une pulvérisation insecticide. Normalement, il s’agit de la différence de valeur d’un paramètre biologique entre les zones traitées et non traitées.
La chute du taux de cholinestérase (ChE) dans le sang est un indicateur d’exposition aux organo-phosphorés et aux carbamates. Il s’agit d’une technique non-destructive et utile pour le bétail. Le taux de ChE dans le cerveau peut seulement être mesuré chez les animaux morts et peut servir à confirmer si la mort résulte d’un traitement. Il faut faire des comparaisons avec les taux de ChE chez les organismes non exposés. Le prélèvement sanguin sur du bétail ne pose pas de problème, ce qui n’est pas le cas chez des organismes appartenant à des espèces rares ou protégées; il ne faut en aucun cas les capturer et les tuer pour extraire leur cerveau.
Idéalement, il faut évaluer l’impact d’un insecticide sur l’abondance des organismes non-cibles. Cependant, cela ne peut être réalisé sérieusement que lorsque des données ont été recueillies avant traitement. L’abondance de nombreux organismes dans des environnements arides et semi-arides varie énormément dans le temps et l’espace. Par conséquent, si aucune donnée n’a été recueillie avant traitement, il est quasiment impossible de prouver que la différence d’abondance observée entre les zones traitées et non traitées est due à l’insecticide, à moins d’observer des cas de mortalité (voir Fig. 36).
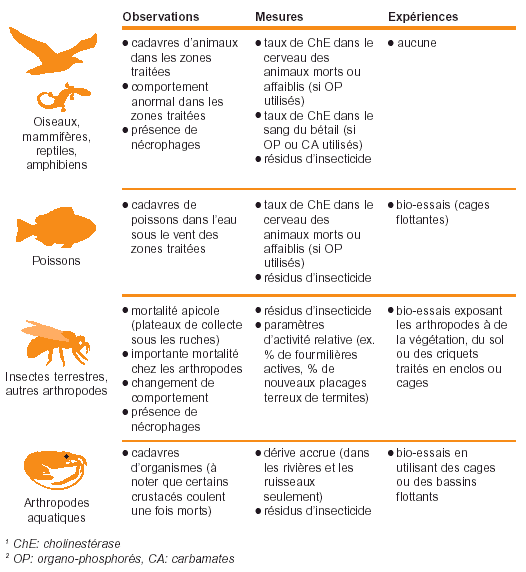
Figure 37. Que suivre après des traitements antiacridiens?
 |
Question fréquemment posée no 6 (voir réponse page 88) Les insecticides utilisés en lutte antiacridienne provoquent-ils des avortements chez les chamelles? |
Des données pré-traitement peuvent uniquement être recueillies si l’équipe de suivi sait exactement où les traitements auront lieu. Cela est réalisable en période de rémission mais est quasiment impossible pendant une résurgence ou une invasion. Les évaluations d’abondance après traitement ne sont par conséquent pas recommandées comme technique standard de suivi en situation d’urgence. Les traitements en barrières sont une exception: s’il existe des différences significatives d’abondances des organismes non-cibles entre les barrières traitées et interpasses non traitées, il est peu probable qu’elles résultent de facteurs autres que le traitement.
Des paramètres écologiques autres que l’abondance peuvent souvent être utilisés à meilleur escient en l’absence de données pré-traitement; c’est le cas du pourcentage d’activité aux entrées des fourmilières ou dans des galeries des termitières, des taux de réparation des placages (de termites). Ces paramètres sont souvent relativement indépendants de l’abondance absolue de l’organisme.
Expériences. Les seules expériences pouvant être menées de façon réaliste en situation de lutte contre le Criquet pèlerin sont les bio-essais (voir Fig. 37). Des organismes tests sont exposés à la pulvérisation insecticide sur le terrain en utilisant des cages ou des enclos; du substrat pulvérisé (végétation, sol) peut aussi être prélevé sur le site de traitement et mis ensuite en contact avec les organismes (sur le terrain ou en laboratoire). Cela donne de bons résultats pour certains arthropodes terrestres et pour plusieurs types d’organismes aquatiques. De tels bio-essais révèlent la toxicité d’un substrat pour l’organisme directement après traitement mais peuvent aussi être utilisés pour évaluer la rémanence de l’insecticide dans les conditions environnementales locales. L’un des principaux défis que représentent les bio-essais est d’éviter une mortalité importante due aux traitements; la maîtrise des techniques de manipulation et d’élevage en cage est donc une condition préalable pour la réussite de ces bio-essais.
Synchronisation. La synchronisation des observations et des mesures est très importante car certains paramètres biologiques se manifestent rapidement après traitement alors que d’autres sont plus longs à se matérialiser. Les changements de comportement chez les animaux se manifestent souvent très vite après traitement (de quelques heures à un jour); la mortalité peut intervenir plus tard (jusqu’à plusieurs jours). Si l’analyse des résidus ou du taux de ChE doit être effectuée sur des cadavres, il faut les ramasser le plus tôt possible après leur mort. Sinon, les résidus peuvent se dégrader ou les cadavres commencer à se putréfier.
Analyse de force de l’évidence. Il peut souvent ne pas être simple d’établir un lien causal entre une application insecticide et un effet. Certains points méritent une attention particulière. L’évidence d’un lien causal est plus forte si des preuves chimiques et biologiques peuvent être combinées (par ex. trouver des niveaux mortels de résidus d’insecticide sur des cadavres d’animaux observés dans une zone traitée). Des effets observés de manière répétée après des traitements avec le même insecticide et à différents endroits sont aussi une indication forte d’un lien causal. La chronologie des événements est un autre facteur important: une cause doit toujours précéder ses effets. Par exemple, si des pertes en bétail ont déjà été observées avant traitement, il est peu probable que les insecticides utilisés en lutte antiacridienne en soient la cause.
Figure 38. Les équipes de suivi doivent garantir un échange d’information effectif avec toutes les parties concernées par la campagne de lutte.
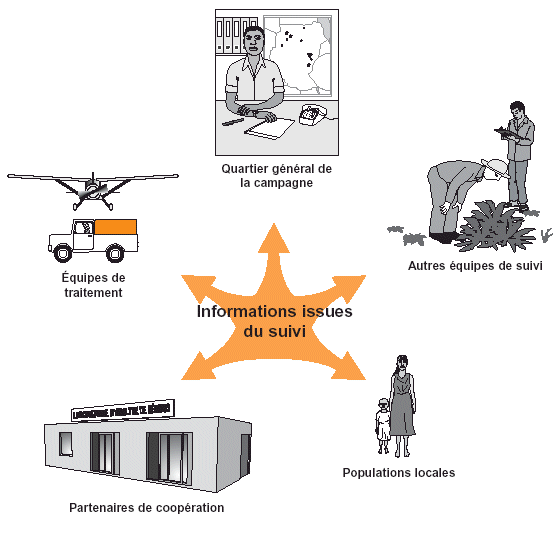
Un élément important du suivi environnemental et de la santé humaine est l’échange d’information, aussi bien entre les acteurs de la campagne qu’avec les populations locales (voir Fig. 38).
Les équipes de suivi recueillent des informations devant être transmises à d’autres acteurs de la campagne. Il faut en premier lieu s’assurer de la qualité des communications avec les équipes de traitement. La coopération avec les équipes de traitement étant essentielle à un suivi effectif, il faut les informer des évaluations en cours de planification. Il faut aussi communiquer les résultats du suivi directement aux équipes de traitement pour qu’elles puissent prendre des mesures correctives si nécessaire. Il est important que l’équipe de suivi ne soit pas perçue comme le «gendarme» de la campagne mais comme un moyen d’améliorer la lutte et de fournir une assistance technique si cela est nécessaire.
Les équipes de suivi doivent communiquer efficacement avec leurs partenaires techniques de coopération (laboratoire d’analyse de résidus, autorités médicales...) qui doivent être informés rapidement de l’assistance qu’ils peuvent avoir à fournir aux équipes de suivi ou à n’importe quel patient, ou des échantillons qu’ils peuvent recevoir. De même, en étant informés des activités et des problèmes sur le terrain, les partenaires de coopération peuvent proposer des solutions de façon proactive.
Enfin, il faut toujours informer le quartier général de campagne de la localisation et du programme à venir des équipes de suivi. Cela garantit le meilleur usage possible de compétences souvent limitées. Le quartier général de campagne peut aussi recevoir des requêtes d’information relatives à la santé et à l’environnement de la part de la presse, d’autres institutions gouvernementales ou de politiciens.
Les populations locales sont souvent très intéressées par les effets possibles sur l’environnement et la santé humaine des insecticides utilisés en lutte antiacridienne. Les équipes de suivi sont en contact direct avec ces personnes et constituent la source évidente d’information. Les équipes doivent donc être bien préparées à répondre aux questions (voir
page 39).
Il est important de prévoir de courtes sessions d’information dans les villages ou les campements proches des sites de traitement pour expliquer à la population locale le but de l’opération et les risques induits par les pesticides. Il faut aussi l’informer des mesures de précaution à prendre. Ces sessions peuvent servir à obtenir de l’information de la part des locaux sur les difficultés rencontrées. De plus, en cas de suivi opérationnel spécialisé, les équipes doivent expliquer quelles sont les techniques de suivi utilisées et obtenir leur coopération pour éviter des pertes de matériel tels que les pièges...