INTRODUCCIÓN
La resistencia a los herbicidas es la capacidad que han desarrollado las poblaciones de malezas previamente susceptibles a un cierto herbicida para resistir a ese compuesto y completar su ciclo biológico cuando el herbicida es aplicado en sus dosis normales; esta capacidad se ha incrementado seriamente en los últimos años (Heap y LeBaron, 2001). Si bien la gran mayoría de los casos de resistencia a los herbicidas han ocurrido en los países desarrollados, también en los países en desarrollo varias malezas importantes han evolucionado a ciertas formas de resistencia con un considerable impacto económico negativo sobre algunos cultivos específicos. Esta breve revisión está enfocada al manejo de las malezas resistentes a los herbicidas en los países en desarrollo, dando preferencia a los casos que se encuentran en dichos países y a las prácticas adecuadas para enfrentar esos problemas.
Los herbicidas representaron en todo el mundo el 47 por ciento de los casi $EE.UU. 28 000 millones de ventas de productos agroquímicos en el año 2001 (Agrow, 2002a). Los países de las economías desarrolladas (América del Norte, Europa, Japón) abarcaron aproximadamente el 70 por ciento del mercado global de productos agroquímicos (Bryant, 1999). Las ventas en América Latina, que presentaron el mayor incremento en 1996 (Agrow, 1996, 1997a), descendieron casi en ocho por ciento (a $EE.UU. 3 500 millones), debido especialmente al colapso de la economía en Argentina y a las fluctuaciones de la tasa de cambio en Brasil. A pesar de un incremento de tres por ciento en el año 2000, el mercado de pesticidas de Japón retomó su tendencia descendente en el 2001 como resultado de una menor área sembrada con arroz, a la presión de los precios y a menos ataques de insectos (Agrow, 2002a). En el año 2001, las siete principales compañías de productos agroquímicos (Syngenta, Monsanto, Aventis, BASF, Dow AgroSciences, DuPont y Bayer) informaron de ventas por valor de $EE.UU. 22 000 millones (Agrow, 2002a). El herbicida más usado en el mundo es el glifosato (Woodburn, 2000), cuyas ventas constituyen el 11 por ciento del total del valor del mercado de los productos agroquímicos (Agrow, 2002b). El glifosato representa 67 por ciento de los $EE.UU. 3 900 millones comercializados por Monsanto (Agrow, 2001). Existen también varias compañías en el mundo que producen glifosato genérico, muchas de ellas establecidas en países en desarrollo (Woodburn, 2000). Otros compuestos sumamente difundidos son el paraquat, que es considerado el segundo producto agroquímico más vendido, las triazinas y el metolachor. En los países en desarrollo, el paraquat continúa siendo uno de los herbicidas preferidos.
CASOS DE RESISTENCIA EN LOS PAÍSES EN DESARROLLO
El primer caso de resistencia a los herbicidas (al 2,4-D) fue constatado por Hilton (1957), pero la resistencia de las malezas a los herbicidas comenzó a ser reconocida solamente después que Ryan (1970) informó sobre el primer caso de resistencia a la triazina en Senecio vulgaris. Durante varios años la resistencia a las triazinas fue el caso más notorio. Hay 64 especies que han desarrollado resistencia a las triazinas y a otros inhibidores del Fotosistema II (Heap, 2002). Por otro lado, en sólo cuatro especies se ha confirmado la resistencia al glifosato, incluso después de 25 años de uso de este herbicida. En la actualidad, en todo el mundo, existe la confirmación de 261 biotipos resistentes que pertenecen a 157 especies: 95 dicotiledóneas y 62 monocotiledóneas (Heap, 2002). Dos grupos de modo de acción de reciente comercialización han contribuido a la agravación del problema de la resistencia a los herbicidas: i) aquellos herbicidas que inhiben la enzima «acetolactate synthase» (ALS) que incluye sulfonylureas (SFU), imidazolinonas, triazopirimidinas y sulfonilamino-carbon-triazolinonas y, ii) los inhibidores de la enzima «acetyl CoA carboxylase» (ACCase) que comprenden los aryloxyfenoxy-propanoatos y las cyclohexanedionas. Hay 73 especies (104 biotipos) resistentes a los herbicidas ALS y 28 especies (59 biotipos) resistentes a los herbicidas ACCase (Heap, 2002).
Según la base de datos de Heap (2002), los países en desarrollo contribuyen con 22 por ciento de los casos de resistencia a los herbicidas (hasta septiembre 2002 se ha informado de un total de 465 casos). Hay diferencias en la distribución relativa de los casos de resistencia basados en el modo de acción de los herbicidas entre los países desarrollados y los países en desarrollo (Figura 1). Los tres grupos más importantes (triazina, ALS y ACCase) comprenden 74 y 65 por ciento de los casos de resistencia en los países desarrollados y en los países en desarrollo, respectivamente. En ambos grupos de países la resistencia a las triazinas continúa siendo la más frecuente, según el número de biotipos, pero en los países desarrollados la resistencia al grupo ALS tiene una frecuencia proporcionalemente doble de la resistencia a ACCase. En los países en desarrollo la frecuencia a la resistencia de ambos modos de acción es prácticamente la misma. Los herbicidas bipyridilium, auxinic y urea/amide, proporcionalmente, contribuyen con más casos de resistencia en los países en desarrollo que en los países industrializados. Una posible explicación pudiera encontrarse en el relativamente difuso uso de paraquat, 2,4-D y propanil en los países en desarrollo.
EVOLUCIÓN DE LAS MALEZAS RESISTENTES
Las poblaciones de malezas adquieren resistencia por la interacción de algunos elementos clave. Las plantas en general, y las malezas en particular, son variables. Los genes que confieren resistencia están presentes naturalmente en las poblaciones salvajes, pero se piensa, sin embargo, que las mutaciones para resistencia no son inducidas por los herbicidas (Jasienuk et al., 1996). Esos genes ocurren en las poblaciones salvajes con una baja frecuencia ya que, en ausencia de los herbicidas, no confieren ninguna ventaja adaptativa a esas plantas. La frecuencia de los genes para resistencia es un elemento importante para determinar cuanto tiempo será necesario para advertir la resistencia una vez que se comienza a usar un determinado herbicida. Por ejemplo, el rápido incremento de la resistencia a los herbicidas ALS es atribuída en parte a la alta frecuencia de mutación sobre el centro de acción de la enzima y a la existencia de varias mutaciones que le confieren resistencia (Chaleff y Day, 1984; Devine y Preston, 2000). Preston y Powles (2002) determinaron la frecuencia de los individuos resistentes a los herbicidas inhibidores ALS sobre poblaciones de Lolium rigidum que anteriormente nunca habían sido expuestas a esos herbicidas. La frecuencia de los individuos resistentes a sulfometuron-methyl e imazapyr varió de 2,2 x 10-5 a 1,2 x 10-4 y de 1 x 10-5 a 5,8 x 10-5, respectivamente, dependiendo de la población. Estos valores de alta frecuencia ayudan a explicar la rápida evolución de la resistencia una vez que las poblaciones son sujetas a la selección impuesta por los herbicidas ALS. Lamentablemente, la frecuencia de los individuos resistentes en una población de malezas no es conocida antes de la introducción de un nuevo herbicida con un nuevo modo de acción ya que estos datos no son necesarios para registrar los productos y raramente son generados con el propósito de hacer una futura supervisión (Moss, 2001).
Otras dos características importantes de una maleza, en lo que se refiere a la evolución de la resistencia a los herbicidas, son la magnitud y la viabilidad del banco de semillas y la adecuación de las malezas. El banco de semillas puede actuar como un amortiguador demorando la evolución de la resistencia ya que con el pasar del tiempo el banco de semillas del suelo se ha enriquecido con semillas de los individuos predominantes susceptibles. En algunos casos los individuos que presentan una mutación -tales como aquellas que confieren resistencia a los herbicidas- son penalizados en razón de estar menos adaptados o ser menos adecuados en ausencia de los herbicidas. Es difícil medir la falta de adecuación, pero puede ser relacionada a una menor eficiencia de los procesos fisiológicos clave tales como la fotosíntesis o características generales de la planta como una menor producción de semillas o una menor capacidad competitiva. Sin embargo, a menudo los biotipos resistentes no son más adecuados que los biotipos normales y susceptibles.
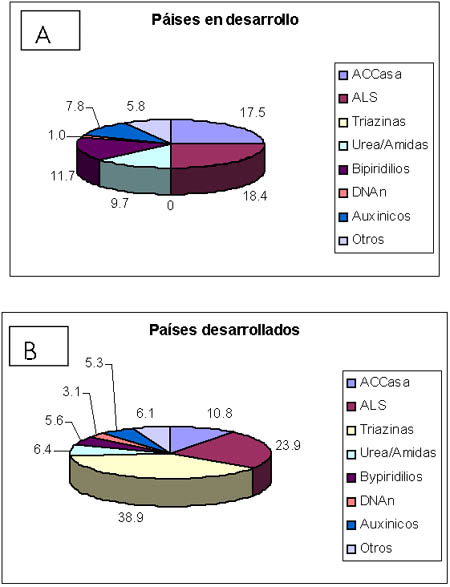
Figura 1. Distribución de los casos de resistencia a herbicidas de acuerdo al modo de acción, en países en desarrollo y en países desarrollados. (En base a datos compilados por Heap, 2002)
El factor más importante que gobierna la evolución de la resistencia a un herbicida es la presión de selección que impone el herbicida (Jasienuk et al., 1996). La mayor presión de selección se impone cuando se usan altas dosis de herbicidas de compuestos altamente efectivos y/o persistentes y cuando su aplicación es frecuente. A medida que se incrementa la tasa de mortalidad también aumenta la tasa de la presión de selección que se impone con el herbicida. Por lo tanto, las poblaciones de malezas resistentes pueden ser consideradas como un caso de rápida evolución (Reznick y Cameron, 2001). La evolución independiente de la resistencia a un herbicida particular dentro de una especie en distintos sitios y épocas ha sido propuesta como un ejemplo de evolución recurrente en respuesta a la misma fuerza selectiva -el herbicida- en todas las poblaciones (Levin, 2001). Las poblaciones de malezas también responden a las prácticas agrícolas, incluyendo los herbicidas, por medio de cambios en su composición y abundancia. Los cambios de las malezas a menudo están asociados con el uso continuo de un herbicida particular. Las especies que no son naturalmente afectadas por el herbicida serán las prevalentes (Hyvonen y Salonen, 2002), incluyendo aquellas pocas que escapan a los herbicidas no selectivos tales como el glifosato usado en los cultivos resistentes al glifosato, como ha sido documentado en Argentina y en los sistemas de labranza cero en Brasil (Merotto et al., 1999; Moreno, 2001; Valverde, 2002; Vita et al., 2001). Estos cambios en la flora en un lugar específico no deberían ser confundidos con la evolución de la resistencia a los herbicidas.
MECANISMOS DE RESISTENCIA
Varios mecanismos confieren resistencia a los herbicidas. Los más comunes e importantes son aquellos relacionados con la insensitividad del lugar-objetivo y del fortalecimiento del metabolismo del herbicida o la descomposición de los productos inactivos. Además, la resistencia puede ser atribuída al secuestro de los herbicidas (o su falta de acción debido a la separación física o temporal del herbicida de los tejidos sensibles o lugares-objetivo) o a una absorción reducida (Devine y Preston, 2000).
El mecanismo de secuestro ha sido propuesto para muchos casos de resistencia al paraquat. Por ejemplo, un biotipo resistente al paraquat de la maleza Asteracea anual Crassocephalum crepidioides fue encontrado en 1990 en un cultivo de tomates cerca de Tanah Rata, Malasia, donde el paraquat había sido aplicado dos veces por año durante los últimos 10 años (Ismail et al., 2001a). Los estudios fisiológicos determinaron que el paraquat no fue metabolizado en los tejidos de las hojas de las plantas susceptibles pero tampoco en el biotipo resistente. Las plantas de ambos biotipos absorbieron el paraquat en forma similar y la resistencia pareció radicar en un mecanismo de secuestro que inactiva el paraquat (Ismail et al., 2001a). Recientemente, un mecanismo adicional previamente identificado en selecciones de cultivos de tejidos, la sobreproducción de lugares-objetivo, fue propuesta como el mecanismo de resistencia a los graminicidas (inhibidores de ACCase) en un biotipo de sorgo de Alepo (Sorghum halepense) (Bradley et al., 2001).
Existen casos en los que hay más de un mecanismo involucrado que confiere resistencia a los herbicidas en un individuo o en una población de plantas (resistencia múltiple). También es común que una maleza que ha desarrollado resistencia a un herbicida específico exhiba también resistencia a otros herbicidas del mismo grupo de modo de acción porque comparten el mismo sitio de unión. Por lo tanto, una modificación de este sitio da lugar a una resistencia cruzada sobre el lugar-objetivo. Por ejemplo, en Costa Rica poblaciones de Ixophorus unisetus seleccionadas por su resistencia a imazapyr (un inhibidor de ALS) también tuvieron resistencia cruzada a un grupo de imidazolinone y herbicidas SFU (Chaves et al., 1997). Cuando la resistencia es promovida por otro mecanismo tal como el favorecimiento de la degradación del herbicida, puede ocurrir la resistencia cruzada a los herbicidas de modos de acción o procesos químicos no relacionados. Por ejemplo, una población de Digitaria sanguinalis proveniente de Australia seleccionada por su resistencia al herbicida ACCase fluazifop-p-butyl, tenía resistencia cruzada al imazethapyr con inhibidor ALS, a pesar de no haber sido nunca tratada con ningún herbicida ALS. La resistencia al herbicida ALS no estaba basada en el lugar-objetivo sino que ocurrió probablemente en razón del incremento del metabolismo del herbicida. Sin embargo, la enzima responsable por la detoxificación del ácido fluazifop en D. sanguinalis es diferente de la enzima que detoxifica imazethapyr (Hidayat y Preston, 2001). Sin embargo, más comúnmente, la resistencia múltiple es conferida por la acumulación de dos o más mecanismos de resistencia tal como ocurre en las poblaciones de Lolium rigidum, Alopecurus myosuroides y Phalaris minor (Preston y Mallory-Smith, 2001). También ocurren casos extremos. Un biotipo de L. rigidum procedente de Australia seleccionado después de haber sido expuesto a varios herbicidas (diuron, chlorsulfuron y atrazina) y dos exposiciones a diclofop, presentaba resistencia (cruzada) a nueve clases de herbicidas que representaban a cinco grupos de modo de acción (Burnet el al., 1994). El conocimiento del modo de acción y del mecanismo de resistencia son importantes para diseñar e implementar la prevención de los herbicidas y las prácticas de manejo. El agrupamiento de los herbicidas de acuerdo a su modo de acción ha sido desarrollado como guía en el manejo de la resistencia. Los mejor conocidos son aquellos preparados por el Comité de Acción de Resistencia a los Herbicidas (Herbicide Resistance Action Committee - HRAC) y la Sociedad de Malezas de Estados Unidos de América (Weed Science Society of America - WSSA), (Retzinger y Mallory-Smith, 1997; Schmidt, 1997).
En Australia, donde los problemas de resistencia son de mayor magnitud, actualmente es obligatorio que los rótulos de los herbicidas indiquen claramente el modo de acción (Powles, 1997). La selección de los productos herbicidas para las mezclas, la aplicación en secuencias o en rotaciones es así facilitada, identificando fácilmente la clase de modo de acción a la cual pertenecen.
PREVENCIÓN Y MANEJO DE LA RESISTENCIA A LOS HERBICIDAS
La aparición de casos de resistencia a los herbicidas es una indicación de un exceso de dependencia de los herbicidas dentro de un sistema particular de producción. Los países en desarrollo no están excluídos de la tendencia actual de esa dependencia de los herbicidas; estos compuestos son ampliamente usados en los sistemas de producción más avanzados así como también por los agricultores de escasos recursos. Sin duda, algunos de los casos más complejos de resistencia a los herbicidas en los países en desarrollo han ocurrido en zonas y en cultivos donde hay explotaciones comerciales y pequeños agricultores que han utilizado un solo herbicida o modo de acción como la principal herramienta para eliminar una maleza específica. Este es el caso de la resistencia de Echinochloa colona al propanil en América Central, México y parte de América del Sur (Valverde et al., 2000) y de la resistencia a isoproturon de Phalaris minor en la India (Malik y Singh, 1995). También es el caso de uno de los pocos informes conocidos sobre resistencia al glifosato, cuando Eleusine indica desarrolló resistencia en varias regiones de la Península Malaya en huertos frutales y de hortalizas, criaderos y plantaciones de palma aceitera (Ismail et al., 2001b). En una finca productora de guayaba, en Teluk Intan, después que el glifosato fracasó en el control de Eleusine indica a la dosis recomendada de 540 g ia/ha (Lee y Ngim, 2000), la aplicación experimental del herbicida a 4,32 kg ia/ha controló solo el 25 por ciento del biotipo resistente. La resistencia se desarrolló en un corto período -cerca de tres años- de uso intensivo de glifosato (6-7 aspersiones por año en dosis crecientes). Otras áreas en las que se confirmó la resistencia fueron expuestas a tratamientos más intensos (hasta 10 veces por año durante cinco años). La caracterización de algunos biotipos indicó, que a la temperatura óptima, las semillas de los biotipos resistentes y de los biotipos susceptibles germinaron de la misma forma pero los biotipos resistentes parecieron ser más vigorosos y productivos que los susceptibles (Ismail et al., 2001b). El mecanismo de resistencia al glifosato en Eleusine indica ha sido aclarado recientemente por el trabajo de Baerson y sus asociados (2002). Niveles de actividad basal o inducida por el glifosato de la enzima objetivo del glifosato 5-enolpyruvylshikimate-3-phosphate synthase (EPSPS), sobre un biotipo resistente y uno susceptible fueron similares, indicando que la resistencia no estaba relacionada con la sobreexpresión de la enzima objetivo en el biotipo resistente. Los dos biotipos también contienen un idéntico número de copias de genes EPSPS. Se confirmó que la resistencia era el resultado de una alteración de la enzima del EPSPS que presenta una sensibilidad reducida al glifosato. En el EPSPS alterado el aminoácido prolina es sustituído por la serina en la posición 106. Este mecanismo difiere del que se ha detectado recientemente en Australia en una población de Lolium rigidum que también desarrolló resistencia al glifosato y en la cual la sobreproducción de la enzima EPSPS estuvo asociada con la resistencia observada (Gruys et al., 1999).
La mayor parte de las prácticas de manejo de la resistencia a los herbicidas hacen referencia a los sistemas de cultivos arables y se ha dado preferencia a ejemplos de los países en desarrollo para ilustrar su desarrollo e implementación. Hay sin embargo, casos de resistencia en plantaciones y pasturas que podrían justificar la adaptación de prácticas específicas para enfrentar el problema de la resistencia a los herbicidas. Una compilación completa del manejo de las prácticas de manejo de la resistencia a los herbicidas en los cultivos de grano de todo el mundo fue presentada recientemente (Powles y Shaner, 2001).
Prevención de la resistencia a los herbicidas
En áreas geográficas o en fincas específicas donde la resistencia a los herbicidas aún no ha aparecido, deberían ser hechos todos los esfuerzos posibles para integrar las tácticas de control de malezas que puedan evitar o demorar la selección de poblaciones resistentes. Dado que la presión de selección es el elemento fundamental para el desarrollo de la resistencia, las tácticas que disminuyen esa presión de selección impuesta sobre la población son las que deberían ser favorecidas. La dosis de los herbicidas, la eficacia y la frecuencia de sus aplicaciones determinan en gran medida la presión de selección. La monocultura, el uso intensivo de herbicidas con el mismo modo de acción y una limitación de los trabajos culturales, por lo general caracterizan los sistemas en los que ha evolucionado la resistencia (Mortensen et al., 2000). Los herbicidas altamente efectivos usados en forma persistente imponen una alta presión de selección que puede conducir al desarrollo de poblaciones resistentes a los herbicidas en pocas generaciones. Esto ha sido bien documentado en los países en desarrollo con los herbicidas ALS y ACCase que son considerados especialmente propicios para el desarrollo de resistencia. La aplicación reiterada de un herbicida en la misma estación de cultivo aumenta la presión de selección, especialmente si la maleza germina y emerge en varios flujos y completa más de una generación en cada estación. Esos regímenes de aplicación de herbicidas son responsables por la resistencia al propanil de Echinochloa colona en América Central (Valverde et al., 2000) y por casos de resistencia al paraquat en Malasia (Itoh et al., 1992), dos herbicidas de contacto sin persistencia en el suelo.
Si los agricultores deben confiar en los herbicidas para controlar las malezas, un enfoque útil para demorar o prevenir la resistencia a los herbicidas es el uso de sus mezclas o la rotación de los herbicidas. Convencionalmente, los herbicidas se combinan con el objetivo de ampliar el espectro de control de malezas, disminuyendo a menudo las dosis de los productos en la mezcla. Sin embargo, para el manejo de la resistencia existen otros requerimientos: ambos herbicidas en la mezcla deben estar con su dosis completa y efectiva para las especies de malezas a tratar y deben poseer una persistencia similar pero diferentes mecanismos de acción y/o procesos de degradación en la planta (Wrubbel y Gressel, 1994). Muchos productores de arroz en América Central combinan propanil con pendimethalin para el control de Echinochloa colona; pendimethalin es un excelente asociado del propanil en la prevención de la resistencia dado que reúne la mayoría de aquellos requerimientos. De esta manera, la resistencia al propanil ha sido demorada o no ha ocurrido en los arrozales donde el propanil se mezcla regularmente con pendimethalin, un herbicida que también es útil como un producto alternativo cuando se ha desarrollado resistencia al propanil (Garita et al., 1995; Garro et al., 1991; Riches et al., 1996, 1997).
Con el mismo razonamiento, la rotación de herbicidas ayuda a demorar la selección de poblaciones resistentes a los herbicidas. De acuerdo a predicciones hechas con modelos de dos herbicidas que tienen diferente modo de acción pero que son igualmente efectivos contra una determinada maleza, las mezclas son superiores a las rotaciones anuales para demorar la aparición de resistencia a los herbicidas (Powles et al., 1997). En los países en desarrollo, y especialmente cuando se usan herbicidas genéricos, es común encontrar una variedad de productos comerciales que contienen el mismo ingrediente activo. Los agricultores que no han sido adecuadamente informados, algunas veces rotan, o incluso mezclan en el tanque, productos conteniendo el mismo ingrediente activo pero vendidos con un diferente nombre comercial. Los agricultores a menudo también son confundidos por la introducción de nuevos productos que son miembros del mismo grupo químico o con el mismo modo de acción.
El uso de semillas certificadas, de semillas libres de malezas y evitar el uso de equipo de trabajo contaminado debería ayudar a prevenir la introducción de materiales resistentes en nuevas áreas o fincas. Por otro lado, la conservación de semillas de las cosechas anteriores es común en muchos países en desarrollo. Por ejemplo, en Viet Nam, menos del cinco por ciento del total de la semilla de arroz utilizada por los agricultores es certificada y la semilla conservada por el agricultor es de baja calidad y contaminada con semillas de malezas (Chin, 2001). La dispersión de malezas resistentes a los herbicidas por medio de semillas contaminadas no está bien documentada si bien hay casos que sugieren tal operación (Thill y Mallory-Smith, 1997). La importancia de una cuidadosa limpieza de la maquinaria para prevenir la difusión de las malezas resistentes fue ilustrado por Itoh et al. (1997a,b). Un agricultor en Japón seleccionó una población resistente de Lindernia rubia var. major después de cinco años de uso de bensulfuron y mefenacet en un campo de arroz; el movimiento de la maquinaria de campo (máquinas para trasplante y una cosechadora) infestaron completamente con individuos resistentes un campo situado más alejado según un trazado que seguía el movimiento de los equipos desde la entrada al predio.
Las semillas de las malezas se caracterizan por tener adaptaciones que facilitan su dispersión y generalmente no tienen diferencias en el tamaño de las semillas o su peso específico entre aquellas producidas por las plantas susceptibles y las resistentes. De esta manera las semillas de malezas de biotipos resistentes pueden viajar naturalmente cortas o largas distancias ayudadas por esas adaptaciones y los correspondientes agentes de diseminación. Por ejemplo, se ha sugerido que en Europa las aves migratorias pueden haber jugado un papel importante en la difusión de las semillas de Solanum nigrum resistente a las triazinas (Stankiewicz et al., 2001). El cardo ruso (Salsola iberica) es una especie sumamente prolífica adaptada para la dispersión anemófila. Las plantas maduras se despegan del suelo y ruedan empujadas por el viento dispersando sus semillas a medida que viajan. De esta manera, las plantas de cardo ruso resistentes a SFU infestan nuevas áreas en grandes regiones (Stallins et al., 1994).
Mientras que las malezas en general, y las malezas resistentes en particular, pueden ser dispersadas, es importante enfatizar que la presión de selección es el principal elemento que rige la aparición de poblaciones resistentes en una finca o en un área determinada. Sin duda, los estudios que usan marcadores moleculares en Lindernia micrantha establecieron que la resistencia a los herbicidas ALS evolucionó como un evento múltiple y que no fue el resultado de un población fundadora difundida en varios lugares, ya sea por el polen o por introducción de plantas en equipos contaminados (Shibaike et al., 1999).
Manejo de poblaciones de malezas naturalmente resistentes a los herbicidas
La situación más común a la que se enfrentan los agricultores es controlar las malezas que han desarrollado resistencia a los herbicidas. Si bien la respuesta inmediata es cambiar a un herbicida diferente pero aún activo sobre esa población de malezas, el manejo a largo plazo de la resistencia puede solamente ser obtenido por medio de la integración de tácticas apropiadas basadas en el conocimiento de la biología y la ecología de las malezas y el modo de acción del herbicida y los mecanismos de resistencia. Muy raramente existe información que cubra todos estos aspectos, especialmente en el caso de los sistemas de producción agrícola de los países en desarrollo. Sin embargo, comprendiendo las bases de la evolución de la resistencia a los herbicidas, aprovechando las experiencias recogidas en otros lugares con casos similares y volviendo a buenas prácticas de manejo de la tierra, es posible diseñar e implementar programas adecuados de manejo.
Varias tácticas agronómicas pueden contribuir a limitar la difusión local, el aumento de la densidad y el impacto de las poblaciones resistentes. Es necesario enfatizar que las prácticas de manejo deberían estar dirigidas a disminuir la proporción de semillas de individuos resistentes en el banco de semillas del suelo, especialmente de aquellas especies cuyas semillas tienen una limitada longevidad y persistencia en el suelo. Estas prácticas que previenen la formación de semillas y su dispersión por las plantas que han sobrevivido a todas las prácticas de control durante el ciclo de cultivo deberían contribuir a la declinación de las infestaciones con individuos resistentes. Por ejemplo, en Australia, algunos agricultores usan piezas especiales o modifican sus cosechadoras para retener las semillas de Lolium rigidum, una práctica que ha demostrado ser valiosa para manejar las poblaciones que presentan resistencia múltiple (Powles, 1997; Gill y Holmes, 1997). La quema de los residuos de las cosechas o su incorporación al suelo también pueden destruir las semillas de las malezas o prevenir la producción de las plantas que están madurando en el momento de la cosecha del cultivo. En Taiwán y China continental los agricultores queman la paja del arroz después de su cosecha para controlar las malezas restantes y para prevenir el aumento del banco de semillas del suelo (De Datta y Baltazar, 1996). Sin embargo, la incorporación de los restos de la cosecha no tuvieron efecto sobre la densidad de Echinochloa colona en el siguiente cultivo o en una serie de ensayos de campo llevados a cabo durante tres años en Costa Rica (Valverde et al., 2001a). Para disminuir la formación de semillas de Lolium rigidum algunos agricultores en Australia asperjan paraquat a bajas dosis al final de la estación de crecimiento (Powles, 1997).
Preparación del suelo
La preparación del suelo afecta la dinámica de las semillas de malezas y la densidad de las plántulas en el momento de la siembra, contribuyendo así al manejo de las poblaciones de malezas resistentes a los herbicidas (Buhler et al., 1997). El éxito de una maleza anual depende en gran parte del momento de la emergencia el cual determina si una planta compite exitosamente con sus vecinas, si es consumida por los herbívoros, si es infectada por enfermedades y si florece, se reproduce y madura normalmente al final de la estación de crecimiento (Forcella et al., 2000). Los sistemas de labranza afectan la emergencia de las malezas modificando la composición, la distribución vertical y la densidad de los bancos de semillas en el suelo. Las especies de malezas cuyas semillas pueden germinar sobre o cerca la superficie del suelo y que finalmente se establecen, tienen el mayor potencial para proliferar bajo los sistemas de labranza de conservación (Buhler et al., 1997).
En la labranza convencional, las aradas o disqueadas a intervalos antes de la siembra controlan las poblaciones iniciales de malezas que de otro modo emergerían con el cultivo sembrado. Una demora de tres semanas en la siembra del trigo permite el control del Lolium rigidum con resistencia múltiple por medio de herbicidas no selectivos efectivos para su control o por medio de trabajos culturales antes de la siembra. Sin embargo, esta práctica es limitada ya que acorta el tiempo disponible para el crecimiento del cultivo lo que reduce su potencial de rendimiento (Gill y Holmes, 1997). La siembra retrasada que permite que las malezas emerjan y sean eliminadas con los herbicidas es una práctica muy usada en algunos países de América Latina para el control del arroz maleza (Oryza spp.) y el manejo de Echinochloa colona, especialmente en el arroz de secano (Fischer, 1996); ha demostrado ser útil para el control de E. colona resistente al propanil (Valverde et al., 2001a). En Italia, en los arrozales no se observó resistencia a los herbicidas ALS cuando la contaminación con arroz rojo obligó a los agricultores a preparar falsas camas de semillas y a aplicar oxidiazon antes de la siembra (Sattin et al., 1999).
Si las malezas susceptibles y resistentes tienen diferentes modelos de emergencia a causa de diferencias en la latencia de las semillas, las tácticas de control pueden ser adaptadas para eliminar la mayor parte de los individuos resistentes antes de la siembra del cultivo (Dyer et al., 1993; Alcocer-Ruthking et al., 1992). Las semillas resistentes de Kochia scoparia germinan antes que las semillas de las plantas susceptibles haciendo posible su control mecánico o con un herbicida con un modo de acción diferente, previa a la siembra de un cultivo como el trigo (Thompson et al., 1994). Del mismo modo las plántulas de Solanum nigrum resistentes a herbicidas en base a triazina, emergieron más rápido y en mayor proporción que las plántulas susceptibles a la triazina en razón de la interacción entre la temperatura del suelo y los requerimientos de la diferencial mínima de germinación de las semillas entre los distintos biotipos (Kremer y Lotz, 1998).
Rotación de cultivos
Los cultivos por lo general tienen una flora típica de malezas asociadas a los mismos. Por lo tanto, la rotación de cultivos modifica la composición de las especies de las comunidades de malezas (Hyvonen y Salonen, 2002). La producción intensiva en sistemas de monocultura selecciona la flora de las malezas altamente compatibles con el sistema de producción específico; estas malezas por lo general son también muy competitivas y difíciles de eliminar. La rotación de cultivos implica cambios en los modelos de siembra, en los ciclos de vida, en las características de competitividad y en el manejo de las malezas que alteran los nichos de regeneración de esas especies y previenen el aumento de aquellas altamente adaptadas (Buhler, 2002). En India, donde la secuencia arroz-trigo fue interrumpida por la rotación con otros cultivos, la incidencia del Phalaris minor resistente a isoproturon fue sin duda menor (Malik y Singh, 1995). Alopecurus myosuroides es una gramínea anual que ha desarrollado resistencia a varios herbicidas en Europa (Heap, 2002). Un estudio reciente llevado a cabo en Francia (Chauvel et al., 2001) evaluó el efecto de varias prácticas seleccionadas de manejo, incluyendo la rotación de cultivos, sobre una población de Alopecurus myosuroides resistente a fenoxaprop y clodinafop. La población exhibió resistencia cruzada al herbicida SFU flupysulfuron que nunca había sido usado en ese campo. El porcentaje de las plantas resistentes al ACCase no cambió durante los tres años de la rotación, si bien no se usaron herbicidas con este modo de acción, probablemente porque las plantas resistentes no deben sufrir procesos de adaptación, en comparación con las plantas suceptibles. Sin embargo, la rotación de cultivos redujo la densidad del pasto negro, especialmente cuando los cultivos de primavera fueron introducidos en el esquema de la rotación.
Ventajas competitivas de los cultivos
Hay prácticas agronómicas tradicionales que pueden proporcionar ventajas competitivas para los cultivos reduciendo el impacto de las malezas asociadas con el mismo y disminuyendo la necesidad del control químico. Cada vez recibe mayor atención la obtención e identificación de variedades con capacidad de suprimir malezas, especialmente en los cereales como el trigo y el arroz (Coleman et al., 2001; Fasoula y Fasoula, 1997). Estas variedades deberían ser evaluadas de acuerdo con los sistemas locales de producción y sus problemas de malezas. Lemerle et al. (2001) encontraron una ventaja competitiva mínima en el rendimiento de grano de variedades de trigo que crecían con Lolium rigidum en Australia, por lo cual fue necesario desarrollar otras tácticas para aumentar la competitividad del cultivo. Garriti et al. (1992) evaluaron la capacidad competitiva de 25 cultivares de arroz contra bajas y altas poblaciones de malezas. Los cultivares altos suprimieron mejor las malezas que los cultivares intermedios y semienanos y los cultivares más competitivos suprimieron hasta 75 por ciento del peso seco de las malezas. Sin embargo, los cultivares altos son más susceptibles al vuelco, tienen una menor capacidad de macollaje y un índice de área foliar relativamente mayor que da lugar a un mayor sombreado mutuo de las hojas. En Colombia, Fischer et al. (1997) encontraron un cultivar de arroz que bajo severa presión de las malezas produjo suficiente grano y fue capaz de suprimir Echinochloa colona. La competitividad de los cultivares de arroz ensayados estuvo correlacionada con un incremento del índice del área foliar, del número de tallos y de la intercepción de la luz por el dosel foliar. Importantes referencias bibliográficas y experiencias prácticas se han obtenido identificando caracteres y ensayando cultivares alelopáticos de arroz, las que se describen en Olofsdotter et al. (2002).
Las ventajas competitivas de los cultivos también pueden ser incrementadas aumentando su densidad. En Australia, como resultado de severas infestaciones de Lolium rigidum resistente a herbicidas, los agricultores han adoptado la práctica de aumentar las densidades de siembra del trigo en un 20-40 por ciento para suprimir las malezas (Powles, 1997). Las densidades de siembra deberían ser ajustadas de acuerdo a la maleza competidora prevalente a ser suprimida. Fueron necesarias mayores densidades de siembra de trigo suplementadas con herbicidas selectivos para controlar Avena ludoviciana que para controlar Phalaris paradoxa (Walker et al., 2002).
El arroz, con sus exclusivos sistemas de cultivo, ofrece alternativas adicionales para que el cultivo sea más competitivo. Estas alternativas incluyen el trasplante, el embarrado del suelo y el manejo del nivel del agua en el arroz regado (Valverde e Itoh, 2001). Otras prácticas que tienen influencia sobre la composición de la flora de malezas y la carga de herbicidas son los cultivos intercalados y el uso de cultivos de cobertura.
Control químico alternativo
Cuando el agricultor encuentra evidencia de la resistencia a un herbicida, por lo general cuando la repetición del mismo producto a una dosis máxima fracasa nuevamente en el control de la maleza, la solución típica es cambiar a otro herbicida. La selección de los herbicidas alternativos debe ser cuidadosa dado que ha sido probado que las modalidades de uso de los herbicidas han generado el desarrollo de resistencia. Para sorpresa de agricultores y asesores, algunas veces las poblaciones resistentes también resultan ser resistentes a otro herbicida que no ha sido aplicado anteriormente o que ha sido escasamente usado. Además de los ejemplos anteriores hay otros casos que también son ilustrativos. Algunas poblaciones de Alopecurus myosuroides son resistentes al herbicida PS II chlortoluron porque la actividad de la oxidasa ha sido fortalecida lo que da lugar a un rápido metabolismo del chlortoluron y el pendimethalin (James et al., 1995). En este caso, pendimethalin no es un herbicida alternativo viable. En unos pocos casos, para sorpresa de los investigadores, los agricultores continuan usando el mismo herbicida al cual la maleza principal dentro del sistema de producción se ha vuelto resistente. Esto ocurre cuando el herbicida todavía controla otras malezas importantes y es bastante económico. Tal es el caso del uso continuo de bensulfuron en el arroz, en California y Australia, donde malezas importantes desarrollaron resistencia a este herbicida ALS (Valverde e Itoh, 2001). Del mismo modo, en Costa Rica algunos agricultores continúan usando propanil a pesar de haber causado la selección de Echinochloa colona resistente, ya que el propanil además controla selectivamente varias malezas dicotiledóneas (Valverde et al., 2000).
Un ejemplo del uso de herbicidas con modos de acción alternativos para enfrentar la el problema de la resistencia en los países en desarrollo está ilustrado por el manejo de las malezas de hoja ancha resistentes en el cultivo de la soja en Brasil y Argentina que son, respectivamente, el segundo y el tercer productores mundiales. De acuerdo a datos de la FAO, en el 2001 Brasil sembró 13,9 millones de hectáreas y Argentina 10,3 millones. En el 2002 el área sembrada en Brasil se incrementó en 16 por ciento para llegar a 16,3 millones de hectáreas (CONAB, 2002). En Brasil, los estados productores más importantes son Paraná y Río Grande do Sul en el sur y Mato Grosso en el centro-oeste con más de 3 millones de hectáreas cada uno; los otros dos productores importantes están en el centro-oeste y son Goiás y Mato Grosso do Sul. En Brasil no es legal sembrar soja transgénica resistente a herbicidas. Por otro lado, en Argentina se siembran casi solamente variedades resistentes al glifosato (James, 2001). Las principales provincias productoras de soja son Córdoba, Santa Fé y Buenos Aires. En Argentina, en el año 2001, de los $EE.UU. 600 millones del mercado de productos agroquímicos, dos terceras partes correspondieron a herbicidas. Como era de esperar, el glifosato fue el herbicida más vendido pero hasta el momento no se ha informado de casos de resistencia al mismo.
En Brasil, tres malezas de hoja ancha (Bidens pilosa, B. subalternans, Euphorbia heterophylla) han desarrollado resistencia a herbicidas ALS. También Amaranthus quitensis ha desarrollado resistencia a este grupo de herbicidas en Argentina, en las provincias de Córdoba y Tucumán. Además, en Brasil se ha confirmado la resistencia de Brachiaria plantaginea a herbicidas ACCase (Christoffoleti et al., 2001; Gazziero et al., 2000; Vidal y Fleck, 1997), la que al parecer sería debido a una mutación del lugar-objetivo (Cortez et al., 2000). Se han llevado a cabo varios estudios para comprender la naturaleza de esta resistencia, los modelos de resistencia cruzada y para aclarar el mecanismo de resistencia. Estos estudios comparan los biotipos sospechosos o que se conocen como resistentes a herbicidas ALS de diferentes lugares, todos seleccionados por imazethapyr y chlorimuron o ambos, incluyendo los susceptibles. Los modelos de resistencia cruzada parecen ser bastante similares entre los distintos biotipos.
Los informes iniciales indican que Bidens pilosa había desarrollado resistencia a inhibidores ALS (Ponchio et al., 1997) pero posteriormente se confirmó que esta especie crece en estrecha relación con B. subalternans. De esta manera, ambas especies son ahora confirmadas como resistentes a los herbicidas ALS (Gelmini et al., 2001; Christoffoleti, 2002). Un tipo de B. pilosa de Mato Grosso do Sul, tratado en el campo con herbicidas ALS por al menos ocho años, presentó índices de resistencia RI 40 (basados en bioensayos completos de plantas) para chlorimuron-ethyl, 60 para metsulfuron-methly e imazethapyr y 175 para nicosulfuron (Christoffoleti, 2002). El RI se calcula como la relación entre las dosis de herbicida que inhiben el crecimiento en un 50 por ciento (GR50) en la población interesada dividida entre el valor GR50 de la población de referencia susceptible. Este modelo de resistencia cruzada está ampliamente documentado para ambos Bidens spp. (Gelmini et al., 2002; Monqueiro et al., 2000; Monqueiro y Christoffoleti, 2001b). En las condiciones de Brasil, la semilla de B. pilosa sobrevive en el suelo por tres o cuatro años (Voll et al., 2001). En un experimento enterrando semillas de B. pilosa también se demostró que la germinación y la decadencia de las semillas fue más intensa en la superficie del suelo. Cerca del 80 por ciento de las semillas en la superficie del suelo se perdieron como resultado de la germinación y la decadencia en los dos primeros meses (estación lluviosa); el 20 por ciento restante mantuvo su viabilidad hasta la terminación del experimento (un año). Cuando las semillas fueron enterradas a 10 cm las pérdidas de semillas fueron de cerca de 50 por ciento (Carmona y Villas-Boas, 2001). Por ello, el uso de herbicidas de preemergencia y postemergencia temprana en un sistema de producción de soja sin labranza podrían rápidamente reducir el banco de semillas del suelo y ayudar a controlar la formación de poblaciones resistentes a herbicidas ALS. Los biotipos resistentes de esas especies pueden ser controlados con lactofen, fomasafen, bentazon, glufosinato y glifosato (Christoffoleti, 2002; Gelmini et al., 2002). Un biotipo de B. pilosa resistente a ALS mostró un comportamiento similar al de los individuos cultivados en macetas de estudio (Christtofoleti, 2001).
Tuesca y Nisensohn (2001) evaluaron la respuesta a los herbicidas de tres poblaciones de Amaranthus quitensis procedentes de tres sistemas de no labranza en Argentina que supuestamente eran resistentes a herbicidas ALS. Dos de esas poblaciones procedían de campos en los que se había usado imazethapyr en cultivos de soja en los últimos 4-5 años; la tercera población era de un campo en el que imazethapyr se había rotado con nicosulfuron en cultivo de maíz y chlorimuron-ethyl durante el mismo período. La población susceptible de referencia fue recolectada en un campo en la cual se aplicaba la labranza convencional, la soja se rotaba con maíz y había sido expuesta a un herbicida ALS (imazetapyr) solo una vez, cinco años antes de la recolección de las semillas. Las dos poblaciones seleccionadas por imazethapyr fueron resistentes a este herbicida pero no al chlorimuron-ethyl. La población expuesta a ambos herbicidas, imidazolinone y SFU fue resistente a ambos, imazethapyr y chlorimuron-ethyl. La mortalidad del biotipo susceptible fue de 95 por ciento a la mitad de la dosis recomendada de cualquier herbicida y total en la dosis comercial completa. Lactofen, fomazafen y bentazon controlaron el A. quitensis resistente a ALS (Monqueiro y Christoffoleti, 2001b). La resistencia a los herbicidas ALS en Bidens spp. y A. quitensis es conferida por una enzima insensible al objetivo (Monteiro y Christoffoleti, 2001a).
También se ha reconfirmado la resistencia a los herbicidas ALS de E. heterophylla en campos de soja en los estados de Paraná, Río Grande do Sul, Sao Paulo e, indirectamente, en un estudio de campo sobre su eficacia, en Mato Grosso do Sul (Gazziero et al., 1998; Vidal y Merotto Jr., 1999; Oliveira et al., 2002; Gelmini et al., 2001; Melhorança y Pereira, 2000). Las poblaciones resistentes ensayadas hasta el momento son susceptibles a otros herbicidas para la soja con diferente modo de acción (Gazziero et al., 1998; Vidal y Merotto Jr., 1999). La población de esta especie recolectada en un área regada del estado de Sao Paulo que fue resistente a chlorimuron-ethly e imazethapyr (RI>20 para ambos herbicidas) fue efectivamente controlada por los herbicidas de preemergencia Protox-herbicides, fomesafen, lactofen y flumiclorac-pentyl y por glufosinato y glifosato (Gelmini et al., 2001). Otros herbicidas que controlan Euphorbia heterophylla ALS-resistentes son sulfentrazone, herbicidas auxínicos y paraquat (Gazziero et al., 1998; Vidal y Merotto Jr., 1999). No se observó un crecimiento diferente de las plantas individuales susceptibles y resistentes, incluso en su producción de semillas (Vidal y Trezzi, 2000; Brighenti et al., 2001; Santos et al., 2002). La resistencia es conferida por una enzima ALS alterada (Oliveira et al., 2002) heredada como un gen simple dominante (Vargas et al., 2001).
Por lo tanto, existen varias opciones químicas para tratar las malezas con resistencia a herbicidas ALS. De acuerdo a las recomendaciones locales (EMBRAPA, 2000) las labores culturales se llevan a cabo hasta tres veces durante el ciclo del cultivo, siempre antes de la floración y la aplicación de herbicidas es el método de control de malezas más difundido. En la producción de soja sin labranza, los herbicidas recomendados antes de la siembra son paraquat, 2,4-D, una mezcla de paraquat y diuron y glifosato o sulfosato. Chlorimorun-ethyl también se recomienda para controlar Raphanus sativum, Senecio brasiliensis y Bidens pilosa cuando no han ocurrido formas de resistencia. Varios herbicidas están disponibles para el tratamiento presiembra (PRE) o postemergencia (POST), muchos de los cuales son efectivos sobre especies resistentes a herbicidas ALS. Estos incluyen Protox POST herbicidas, acifluorfen-sodio, fomesafen, lactofen y el PRE sulfentrazone; los PRE, inhibidores de la síntesis de muchos ácidos grasos de cadena larga, alachlor y metolachlor; los herbicidas PS-II bentazon (POST), cyanazine (PRE), linuron (PRE), metribuzin (presiembra incorporado [PPI] o PRE); los inhibidores tubulin-polimerización, pendimethalin (PRE), trifluralin (PPI) y el inhibidor de la síntesis de los pigmentos clomazone (PRE, al menos 150 días antes de la siembra). A pesar del creciente problema de la resistencia, los dos grupos de acción más ampliamente usados son todavía aquellos del grupo de inhibidores ALS, incluyendo el POST chlorimuron-ethyl, cloransulam-methyl, oxasulfuron e imazethapyr, el PPI diclosulam y flumetsulam e imazaquin (aplicado PPI o PRE) y los inhibidores ACCase, clethodym, fenoxaprop-p-ethyl, fluazifop-p-butyl, propaquizafop, quizalofop-p-ethyl, sethoxydim y tepraloxydim.
Otra opción química para manejar malezas resistentes a los herbicidas es el uso de sinérgicos específicos. Estos compuestos, cuando se mezclan con los herbicidas dan lugar a un nivel de actividad biológica substancialmente más alto que el nivel de la eficacia de cada compuesto aplicado por separado. Los compuestos sinérgicos son útiles cuando la resistencia es originada por un metabolismo fortalecido pero son inefectivos contra la resistencia en el lugar-objetivo. Pueden ser usados como componentes de una mezcla en el tanque o como parte de una formulación. El autor conoce una sola solución práctica en la cual un sinérgico ha sido usado en forma comercial para controlar una maleza resistente a los herbicidas; se trata de la mezcla de piperophos o anilofos con propanil para controlar E. colona resistente a propanil.
Durante algunos años se ha sabido que algunos insecticidas órgano-fosfatados y carbamatos bloquean la acción de aryl-acylamidasa (AAA) la cual es responsable por la hidrólisis del propanil en el arroz (Frear y Still, 1968; Matsunaka, 1968; Leah et al., 1994). Cuando estos insecticidas se aplican inmediatamente antes o después del propanil, el arroz puede ser dañado por el herbicida porque el insecticida previene el metabolismo del propanil. Los mecanismos de resistencia de E. colona al propanil involucran un incremento de la actividad de AAA (Leah et al., 1994, 1995). En base al conocimiento de los mecanismos de resistencia los herbicidas órgano-fosfatados piperophos y anilofos, que son selectivos del arroz, fueron desarrollados como sinérgicos (Caseley et al., 1996; Valverde et al., 1997, 1999). Las mezclas de estos herbicidas a muy bajas dosis, con propanil también a baja dosis (en general 1,76 kg/ha comparado con la dosis corriente de 3,84 kg/ha) no son más fitotóxicos para el cultivo que el propanil solo, pero son exitosos para vencer la resistencia de E. colona (Valverde et al., 2000). Una formulación conteniendo piperophos y propanil fue usada por primera vez en Costa Rica y en otras áreas de América Latina; anilofos ha sido usado en mezclas en el tanque (Valverde, 1996) y ambas mezclas son bien aceptadas por los productores de arroz (Valverde e Itoh, 2001).
Se han hecho otros intentos para desarrollar compuestos sinérgicos para combatir las malezas resistentes a los herbicidas. Sin embargo, más frecuentemente los compuestos sinérgicos han sido utilizados para analizar los mecanismos de resistencia. Los agentes de quelatos cúpricos han sido usados como posibles elementos sinérgicos del paraquat y otros herbicidas generadores de oxidantes (Rogachev et al., 1998). Los quelatos capaces de remover el cobre y/o el zinc de la superóxido-dismutasa y el cobre de la ascorbate-peroxidasa podrían ser de uso práctico para controlar los biotipos de Conyza bonariensis resistentes al paraquat, cuya resistencia está relacionada con altos niveles constitutivos y/o herbicidas de enzimas antioxidantes (Ye y Gressel, 2000; Ye et al., 2000). Se encontró que el herbicida aminotriazole, amitrole inhibió el metabolismo de diclofop-ácido en un biotipo resistente (SLR 31) de Lolium rigidum, cuya resistencia a dichlofop fue conferida por una insensitividad al lugar-objetivo y a un fortalecimiento del metabolismo. El amitrole tuvo un efecto sinérgico con diclofop-methyl sobre ambos biotipos, resistente y susceptible (Preston y Powles, 1998).
Cultivares resistentes a los herbicidas
Están disponibles en el comercio cultivares resistentes a los herbicidas producidos por la ingeniería genética o por mutaciones genéticas. La introducción de estos cultivares ha permitido que los agricultores utilicen nuevas alternativas químicas para controlar especies difíciles de exterminar y malezas resistentes a los herbicidas. Se estima que 52,6 millones de hectáreas de cultivos transgénicos fueron sembradas en todo el mundo en el año 2001, lo cual representa un incremento de 19 por ciento (u 8,4 millones de hectáreas) sobre el año anterior. Un 25 por ciento de esta área (equivalente a 13,5 millones de hectáreas) fue sembrada en los países en desarrollo, la mayoría en Argentina donde se sembraron 11,8 millones de hectáreas de soja y maíz transgénicos en el año 2001. Los cultivos genéticamente modificados también se sembraron en África del Sur, Bulgaria, China (sobre todo algodón Bt), Indonesia, México, Rumania y Uruguay. Globalmente, los principales cultivos son soja, maíz, algodón y canola. Casi el 80 por ciento de los cultivos genéticamente modificados que se sembraron son aquellos que llevan genes que confieren tolerancia a los herbicidas (James, 2001).
En relación con la resistencia a los herbicidas en las malezas, existen preocupaciones acerca del amplio uso de los cultivares resistentes a los herbicidas (ver Duke, 1996, para una revisión completa), incluyendo aquellos en los países en desarrollo, por su impacto sobre la agricultura y la biodiversidad (Madsen et al., 2002; Olofsdotter et al., 2000; Riches y Valverde, 2002). Muchos países en desarrollo no tienen una legislación adecuada respecto a los cultivares resistentes a los herbicidas y la FAO ha hecho un esfuerzo para desarrollar directrices simples para ayudar a tomar decisiones acerca la introducción y liberación de esos cultivos (Valverde et al., 2001b; FAO, 2001). Además de la nueva presión de selección impuesta por los nuevos compuestos químicos usados en los cultivares resistentes a los herbicidas, uno de los riesgos más discutidos de estos cultivos, en lo que se refiere a la resistencia a herbicidas en las malezas, es la posibilidad de que los genes de resistencia se trasladen del cultivo a especies de malezas o biotipos compatibles y que el cultivar resistente a herbicidas se convierta en una maleza difícil de combatir cuando crece en forma espontánea en una rotación.
Integración de las prácticas de control
Como han señalado Mortensen et al. (2000) se debería ir más allá de la noción de considerar las malezas como un problema que puede ser solucionado solamente con herbicidas y comprender que pueden ser manejadas por medio de un mejor diseño de los sistemas de producción. Incluso los problemas más complicados de resistencia a los herbicidas podrían haber sido prevenidos por medio de una estrategia adecuada de manejo integrado de malezas; ahora es necesario volver a buenas prácticas agronómicas y de manejo integrado de malezas para enfrentarlas con éxito. Es importante que los agricultores tomen conocimiento del impacto negativo de la resistencia a los herbicidas y comprendan los razonamientos lógicos para integrar las tácticas de control como base para su aceptación. También se debe demostrar que las alternativas propuestas son provechosas y realistas. Las oportunidades para un manejo integrado se ilustran tal vez con los casos más importantes de resistencia a los herbicidas en los países en desarrollo: Phalaris minor en India y Echinochloa colona en varios países de América Latina.
Phalaris minor es considerada en India como la gramínea maleza más difícil de combatir en los cultivos de trigo en invierno seguidos por arroz en el verano (Malik y Singh, 1995). Esta maleza es muy competitiva con el trigo y altos niveles de infestación pueden dar lugar al fracaso total del cultivo (Singh et al., 1999). Desde 1982 los agricultores hindúes han confiado en isoproturon, un herbicida de amplio espectro de urea sustituída, para el control de P. minor, ya que es rentable, tiene un amplio período de uso, existe flexibilidad en los métodos de aplicación y combate varias malezas (Walia et al., 1997; Chhokar y Malik, 2002). Sin embargo, la presión de selección impuesta por exceso de dependencia de isoproturon resultó en la selección de poblaciones resistentes que fueron confirmadas a inicios de la década de 1990 (Malik y Singh, 1995; Walia et al., 1997). Los niveles de resistencia varían entre los biotipos, algunos con RI hasta 13-18. Después que las primeras poblaciones fueron confirmadas en el estado de Haryana, el problema aumentó en esa área y en los estados vecinos, especialmente en Punjab (Singh et al., 1998b). Se estima que cerca de un millón de hectáreas están infestadas con biotipos resistentes en esos dos estados (Singh et al., 1998c). Los estudios de Singh et al. (1997a) indicaron que una mutación en el lugar-objetivo no está implicada en el mecanismo de resistencia a isoproturon en el caso de esta maleza. La absorción de isoproturon y su traslocación no difieren entre los biotipos susceptibles y resistentes (Singh et al., 1996) pero la resistencia parede ser conferida por una capacidad fortalecida de las plantas resistentes para metabolizar el herbicida como resultado de un incremento de la actividad de las enzimas de monooxygenasa (Singh et al., 1998b). Sin duda la función combinada de los inhibidores de la oxidasa, 1-amino-bensotriazole (ABT) y piperonylbutoxide (PBO) inhibieron la degradación del herbicida en el biotipo R (Singh et al., 1998b,c).
Herbicidas con modo de acción alternativo controlan P. minor resistente a isoproturon, incluyendo los herbicidas inhibidores ACCase tralkoxydim y diclofop-methyl (Walia et al., 1997). Sin embargo, recientemente se ha informado que algunos biotipos resistentes a isoproturon exhibieron resistencia cruzada a dichlofop-methyl (Kirkwood et al., 1997) y probablemente a clodinafop-propargyl (Singh et al., 1997b; Singh et al., 1998a) sin haber sido usados anteriormente en ese campo, pero permaneciendo susceptibles al chlorotoluron, herbicida relacionado estructural y fisiológicamente, el que puede ser usado selectivamente en el trigo. Otros herbicidas también son efectivos en el control de P. minor resistente a isoproturon: fenoxaprop-p-ethyl, sethoxydim, tralkoxydim, sulfosulfuron y las dinitroanilinas trifluralin y pendimethalyn (Kirkwood et al., 1997; Malik y Yadav, 1997; Chhokar y Malik, 2002).
La integración de varias prácticas agronómicas combinadas con herbicidas correctamente seleccionados ha sido propuesta para manejar las poblaciones resistentes; estas incluyen: siembra de cultivares de trigo competitivos, con un crecimiento agresivo de su dosel foliar, modificación de la fecha de siembra para asegurar un rápido establecimiento del cultivo, fertilización adecuada en tiempo y calidad y humedad para favorecer el crecimiento del cultivo, mayor densidad de siembra y menor espaciamiento entre los surcos o siembra cruzada para proporcionar una ventaja competitiva al cultivo sobre la maleza (Singh et al., 1999). La rotación de cultivos, tal como se ha mencionado anteriormente, ha sido un factor importante para demorar la aparición de las poblaciones resistentes a isoproturon, y también puede ser utilizada como parte de la estrategia de manejo integrado. La caña de azúcar puede romper la dominancia de P. minor; el maíz en invierno y los cultivos forrajeros, el trébol de Alejandría (Trifolium alexandrinum) y la alfalfa (Medicago sativa) también han sido útiles en la rotación de cultivos (Singh et al., 1999). Finalmente, en las áreas afectadas por la resistencia a isoproturon ha habido una tendencia hacia los sistemas de labranza cero. En este sistema, el trigo puede ser sembrado más temprano cuando las temperaturas son menos favorables para la germinación de P. minor, dando así ventaja al desarrollo del cultivo sobre la maleza. Además, hay economía de combustible y mano de obra que permite que los agricultores que aplican la labranza cero cambien a herbicidas con modos de acción alternativos y que son más económicos que el isopruron (Gill, 2001).
Echinochloa colona ha desarrollado resistencia a propanil en América Central, Colombia, México y Venezuela (Valverde et al., 2000) y se han presentado varias opciones para controlar las poblaciones resistentes. Además de herbicidas con modo de acción alternativo y el ya discutido uso de sinérgicos, varias prácticas agronómicas han sido probadas y usadas para el manejo de la resistencia, incluyendo regímenes modificados de herbicidas (Valverde et al., 2001a).
La eliminación de las primeras poblaciones de E. colona que emergen antes o con el cultivo, reduce substancialmente la infestación del arrozal y la necesidad de un control químico adicional. Un herbicida de amplio espectro como el glifosato o una operación ligera de labranza pueden eliminar estas poblaciones antes de la siembra. Mayores beneficios fueron obtenidos sustituyendo pendimethalin por propanil u otros herbicidas que efectivamente controlaron E. colona (Valverde et al., 2001a). Estos incluyen inhibidores de ACCase tales como fenoxaprop, cyhalofop, sethoxydim y clefoxydim, herbicidas ALS (bispyribac-sodium y pyribenzoxim), pendimethalin, clomazone, pretilachlor y el herbicida auxínico quinclorac (Valverde et al., 2000, 2001a). Lamentablemente, la resistencia al herbicida ACCase fenoxaprop se desarrolló en una escala limitada, después de su uso para controlar E. colona resistente a propanil (Riches et al., 1996).
CONCLUSIONES
Ningún herbicida simple ni ninguna táctica de manejo pueden resolver un problema particular de resistencia a los herbicidas. Para prevenir y manejar la resistencia, una vez que esta ha aparecido, es necesario contar con un conocimiento básico de la biología de las malezas y la dinámica de su población. Es fundamental comprender cuales son los elementos que fuerzan la selección de individuos resistentes y los procesos por los que la resistencia es acelerada o demorada, además de la experiencia ganada en una gran variedad de condiciones de cultivo y países que deberían dar elementos para combatir la resistencia a los herbicidas. El autor espera que la información presentada en este trabajo pueda estimular a los investigadores y a los técnicos de campo de los países en desarrollo a documentar, estudiar e innovar mejores soluciones a los problemas locales de control de malezas.
BIBLIOGRAFÍA
Agrow. 1996. World Crop Protection News. December 13.
Agrow. 1997a. World Crop Protection News. February 14 and 28.
Agrow. 1997b. World Crop Protection News, July 11.
Alcocer-Ruthling, M., Thill, D.C. y Shafii, B. 1992. Seed biology of sulfonylurea-resistant and -susceptible biotypes of prickly lettuce (Lactuca serriola). Weed Tech. 6: 858-864.
Baerson, S. R., Rodríguez, D. J., Tran, M., Feng, Y., Biest, N.A. y Dill, G.M. 2002. Glyphosate resistant goosegrass. Identification of a mutation in the target enzyme 5-enolpyruvylshikimate-3-phosphate synthase. Plant Physiology 129: 265-1275.
Bradley, K. W., Wu, J., Hatzios, K.K. y Hagood, E.S., Jr. 2001. The mechanism of resistance to aryloxyphenoxypropionate and cyclohexanedione herbicides in a Johnsongrass biotype. Weed Sci. 49: 477-484.
Brighenti, A. M., Gazziero, D. L. P., Voll, E., Adegas, F.S. y Val, W.M.C. 2001. Análise de crescimento de biótipos de amendoim-bravo (Euphorbia heterophylla) resistente e suscetível aos herbicidas inibidores da ALS. Planta Daninha 19: 51-59.
Bryant, R. 1999. Agrochemicals in perspective: Analysis of the worldwide demand of agrochemical active ingredients. The Fine Chemicals Conference, Kensington, London, 29-30 November, 1999.
Buhler, D. D. 2002. Challenges and opportunities for integrated weed management. Weed Sci. 50: 273-280.
Buhler, D. D., Hartzler, R.G. y Forcella, F. 1997. Implications of weed seedbank dynamics to weed management. Weed Sci. 45: 329-336.
Burnet, M. W. M., Hart, Q., Holtum, J.A.M. y Powles, S.B. 1994. Resistance to nine herbicide classes in a population of rigid ryegrass (Lolium rigidum). Weed Sci. 42: 369-377.
Carmona, R. y da C. Villas-Bôas, H.D. 2001. Dinâmica de sementes de Bidens pilosa no solo. Pesquisa Agropecuaria Brasileira 36: 457-463.
Caseley, J. C., Leah, J.M., Riches, C.R. y Valverde, B.E. 1996. Combating propanil resistance in Echinochloa colona with synergists that inhibit acylamidase and oxygenases. Proc. of the Second Int. Weed Control Congress, Copenhagen, Dinamarca. 2: 455-460.
Chaves, L., Valverde, B.E. y Garita, I. 1994. Resistencia del pasto Honduras (Ixophorus unisetus) a herbicidas inhibidores de la sintetasa del acetolactato. Resúmenes V Congreso Internacional de Manejo Integrado de Plagas. San José, Costa Rica, p. 197.
Chin, D. V. 2001. Biology and management of barnyardgrass, red sprangletop and weedy rice. Weed Biology and Management 1: 37-41.
Chhokar, R. S. y Malik, R.K. 2002. Isoproturon-resistant littleseed canarygrass (Phalaris minor) and its response to alternate herbicides. Weed Tech. 16: 116-123.
Christoffoleti, P. J. 2002. Curvas de dose-resposta de biótipos resistente e suscetível de Bidens pilosa L. aos herbicidas inibidores da ALS. Scientia Agricola 59: 513-519.
Christoffoleti, P. J. 2001. Análise comparativa do crescimento de biótipos de picão-preto (Bidens pilosa) resistente e suscetível aos herbicidas inibidores da ALS. Planta Daninha 19: 75-83.
Christoffoleti, P. J., Kehdi, C. A. y Cortez, M.G. 2001. Manejo da planta daninha Brachiaria plantaginea resistente aos herbicidas inibidores da ACCase. Planta Daninha 19: 61-66.
Coleman, R. K., Gill, G. S. y Rebetzke, G.J. 2001. Identification of quantitative trait loci for traits conferring weed competitiveness in wheat (Triticum aestivum L.). Australian J. of Agricultural Res. 52: 1235-1246.
CONAB. Companhia Nacional de Abastecimento,2002. Acompanhamento da safra 2001/02. Sexto levantamento. Julho/2002. (también disponible en http://www.conab.gov.br/politica_agricola/Safra/avalia.html)
Cortez, M. G., Christoffoleti, P.J., Victoria Filho, R. y de Prado, R. 2000. Resistência cruzada e mecanismo de resisência em biotipos de Brachiaria plantaginea resistentes a herbicidas inibidores da ACCase. Resumos. XXII Congreso Brasileiro da Ciência das Plantas. Daninhas. Foz do Iguaçu, Brasil, p. 498.
De Datta, S. K. y Baltazar, A.M. 1996. Integrated weed management in rice in Asia. pp.145-165. En: Naylor, R., ed. Herbicides in Asian rice: Transitions in weed management. Institute for Int. Studies, Stanford University, Palo Alto, California, & the Int. Rice Research Institute, Manila, Filipinas.
Devine, M. D. y Preston, C. 2000. The molecular basis of herbicide resistance. pp. 72-104. En: Cobb, A.H. & Kirkwood, R.C., eds. Herbicides and their mechanisms of action. Sheffield Academic Press Ltd, Inglaterra.
Duke, S. O., ed. 1996. Herbicide resistant crops. Agricultural, environmental, regulatory, and technical aspects. CRC Press, Boca Raton, Florida, Estados Unidos de América. 420 pp.
Dyer, W. E., Chee, P.W. y Fay, P.K. 1993. Rapid germination of sulfonylurea-resistant Kochia scoparia L. accessions is associated with elevated seed levels of branched chain amino acids. Weed Sci. 41: 18-22.
EMBRAPA. Empresa Brasileira de Pesquisa Agropecuaria. 2000. Recomendações técnicas para a cultura da soja no Paraná - safra 2000/2001. EMBRAPA, Brasil, 225 pp.
Fasoula, D. A. y Fasoula, V.A. 1997. Competitive ability and plant breeding. Plant Breeding Reviews 14: 89-138.
Fischer A. J. 1996. Integrated red rice management in Latin American rice fields. Proc.of the Second Int. Weed Control Congress. Copenhagen, Dinamarca, 2: 53-664.
Fischer, A., Ramírez, J., H. V. y Lozano, J. 1997. Suppression of junglerice (Echinochloa colona) (L.) Link by irrigated rice cultivars in Latin America. Agronomy J. 89: 516-521.
Forcella, F., Benech Arnold, R. L., Sánchez, R. y Ghersa, C.M. 2000. Modeling seedling emergence. Field Crops Res. 67: 23-139.
Garita, I., Valverde, B. E., Chacón, L.A., de la Cruz, R., Riches, C.R. y Caseley, J.C. 1995. Occurrence of propanil resistance in Echinochloa colona in Central America. Proc.Brighton Crop Protection Conference - Weeds 1: 193-196.
Garriti, D. P., Movillon, M. y Moody, K. 1992. Differential weed suppression ability in upland rice cultivars. Agronomy J. 84: 586-591.
Garro, J. E., de la Cruz, R. y Shannon, P.J. 1991. Propanil resistance in Echinochloa colona populations with different herbicide use histories. Proc. Brighton Crop Protection Conference - Weeds 3: 1079-1083.
Gazziero, D. L. P., Brighenti, A. M., Maciel, C.D.G., Christofolleti, P.J., Adegas, F.S. y Voll, E. 1998. Resistência de amendoim - bravo aos herbicidas inibidores da enzima ALS. Planta Daninha 16: 117-125.
Gazziero, D. L. P., Christoffoleti, P. J., Brighenti, A. M., Prete, C.E.C. y Voll, E. 2000. Resistência da planta daninha capim-marmelada (Brachiaria plantaginea) aos herbicidas inibidores da enzima accase na cultura da soja. Planta Daninha 18: 169-184.
Gelmini, G. A., Victória-Filho, R., Soares-Novo, M. C. S. y Adoryan, M.L. 2001. Resistência de biótipos de Euphorbia heterophylla L. aos herbicidas inibidores da enzima ALS utilizados na cultura de soja. Bragantia 60: 93-99.
Gelmini, G.A., Victória Filho, R., Novo, M.C.S.S. y Adoryan, M.L. 2002. Resistência de Bidens subalternans aos herbicidas inibidores da enzima acetolactato sintase utilizados na cultura da soja. Planta Daninha 20: 319-325.
Gill, G. S. 2001. Resistance management in Australian wheat and Indian rice/wheat cropping systems. Japan-Australia Seminar,Utsunomiya University, 5-7 November 2001, pp. 33- 37.
Gruys, K. J., Biest-Taylor, N. A., Feng, P. C. C., Baerson, S. R., Rodríguez, D. J., You, J., Tran, M., Feng, Y., Kreuger, R.W., Pratley, J.E., Urwin, N.A. y Stanton, R.A. 1999. Resistance of glyphosate in annual ryegrass (Lolium rigidum). II Biochemical and molecular analyses. Weed Sci. Society of America Abstracts 39: 163.
Heap, I. y LeBaron, H. 2001. Introduction and overview of resistance. pp. 1-22, En: S. B. Powles &. Shaner, D.L., eds. Herbicide resistance in world grains. CRC Press, Boca Ratón, Florida, Estados Unidos de América.
Hidayat, I. y Preston, C. 2001. Cross-resistance to imazethapyr in a fluazifop-P-butyl- resistant population of Digitaria sanguinalis. Pesticide Biochemistry and Physiology 71: 190-195.
Hyvönen, T. y Salonen, J. 2002. Weed species diversity and community composition in cropping practices at two intensity levels - a six-year experiment. Plant Ecology 154:73-81.
Itoh, K., Uchino, A., Wang, G.X. y Yamakawa, S. 1997a. Distribution of Lindernia spp. resistant biotypes to sulfonylurea herbicides in Yuza Town, Yamagata Prefecture. J. of Weed Sci. and Tech. 42 (supplement): 22-23.
Itoh, K., Wang, G. X. y Uchino, A. 1997b. Non-effective problems of Lindernia weeds to one shot application herbicides including sulfonylureas in Tohoku area. J.of Weed Science and Technology 42 (supplement): 12-13.
Itoh, K., Azmi, M. y Ahmad, A. 1992. Paraquat resistance in Solanum nigrum, Crassocephalum crepidioides, Amaranthus lividus and Conyza sumatrensis in Malaysia. Proc. 1st Int. Weed Control Congress, Melbourne, Australia, 17-21 February, 1992. 2: 224-228.
Ismail, B. S., Chuah, T. S. y Khatijah, H.H. 2001. Metabolism, uptake and translocation of 14 C-paraquat in resistant and susceptible biotypes of Crassocephalum crepidioides (Benth.) S. Moore. Weed Biology and Management 1: 176-181.
Ismail, B. S., Chuah, T.S. y Salmijah, S. 2001. Germination, emergence and growth of glyphosate resistant and susceptible biotypes of goosegrass (Eleusine indica). Proc.II,18th Asian-Pacific Weed Sci. Society Conference, The Asian-Pacific Weed Science Society, Beijing, pp. 471-481.
James, C. 2001. Global review of commercialized transgenic crops: 2001. ISAAA Briefs, 24. Ithaca, NY: Int. Service for the Acquisition of Agri-Biotech Applications. 20 p.
James, E. H., Kemp, M.S. y Moss, S.R. 1995. Phytotoxicity of trifluoromethyl- and methyl-substituted dinitroaniline herbicides on resistant and susceptible populations of black-grass (Alopecurus myosuroides). Pesticide Science 43: 273-277.
Jasieniuk, M., Brûlé-Babel, A.L. y Morrison, I.N. 1996. The evolution and genetics of herbicide resistance in weeds. Weed Sci. 44: 176-193.
Kirkwood, R., Singh, S. y Marshall, G. 1997. Resistance of Phalaris minor to isoproturon: Mechanism and management implications. Proc. 16th Asian-Pacific Weed Sci. Society Conf., Kuala Lumpur, Malaysia, 8-12 September 1997. pp. 204-207.
Kremer, E. y Lotz, L.A.P. 1998. Germination and emergence characteristics of triazine-susceptible and triazine-resistant biotypes of Solanum nigrum. J. of Applied Ecology 35: 302-310.
Lee L. J. y Ngim, J. 2000. A first report of glyphosate-resistant goosegrass (Eleusine indica (L.) Gaertn) in Malaysia. Pest Management Science 56: 336-339.
Lemerle, D., B. Verbeek y Orchard, B. 2001. Ranking the ability of wheat varieties to compete with Lolium rigidum. Weed Res. 41: 197-209.
Levin, D. D. 2001. The recurrent origin of plant races and species. Systematic Botany 26: 197-204.
Madsen, K. H., Valverde, B. E., y Jensen, J.E. 2002. Risks assessment of herbicide resistant crops: A Latin American perspective using Oryza sativa as a model. Weed Tech.16:215-223.
Malik, R. K. y Singh, S. 1995. Littleseed canarygrass (Phalaris minor) resistance to isoproturon in India. Weed Tech. 9: 419-425.
Malik, R. K. y Yadav, A. 1997. Potency of alternative herbicides against isoprotyron-resistance littleseed canary grass. Proc. 16th Asian-Pacific Weed Sci. Society Conf., Kuala Lumpur, Malaysia, 8-12 September 1997, pp. 208-210.
Melhorança, A. L. y Pereira, F. A. R. 2000. Eficiência do herbicida lactofen no controle de Euphorbia heterophylla resistente aos herbicidas inibidores da enzima acetolactato sintasa (ALS). Revista Brasileira de Herbicidas 1: 53-56.
Merotto, A., Jr., Vidal, R.A. y Fleck, N.G. 1999. Soybean tolerance to synthetic auxin and potential of mixtures with protox-inhibiting herbicides. Proc. British Crop Protection Conference - Weeds 1: 319-324.
Monqueiro, P. A. y Christoffoleti, P.J. 2001a. Bioensaio rápido de determinação da sensibilidade da acetolactato sintase (ALS) a herbicidas inibidores. Scientia Agricola 58: 193-196.
Monqueiro, P. A. y Christoffoleti, P.J. 2001b. Manejo de populações de plantas daninhas resistentes aos herbicidas inibidores da acetolactato sintase. Planta Daninha 19: 67-74.
Monqueiro, P.A., Christoffoleti, P. J. y Dias, C.T.S. 2000. Resistência de plantas daninhas aos herbicidas inibidores da ALS na cultura da soja (Glycine max). Planta Daninha 18:419-425.
Moreno, R. E. 2001. Soybean weed management in Argentina [abstract]. En: Abstracts of the Third Int. Weed Sci. Congress, 2000 June 6-11; Foz do Iguassu, Brazil, pp. 520. CD-ROM. Disponible en Int. Weed Science Society, Oxford, MS, Estados Unidos de América.
Mortensen, D. A., Bastiaans, L. y Sattin, M. 2000. The role of ecology in the development of weed management systems: an outlook. Weed Res. 40: 49-62.
Oliveira, M. F., Prates, H.T., Brighenti, A.M., Gazziero, D.L.P., Vidal, R.A.,Vargas, L., Oliveira, R.S., Jr. y Purcino, A. A. C. 2002. Atividade da acetolactato sintase de plantas de milho e de amendoim-bravo (Euphorbia heterophylla) resistentes e suscetíveis ao imazaquin. Planta Daninha 20: 77-82.
Olofsdotter, M., Jensen, L.B. y Courtois, B. 2002. Improving crop competitive ability using allelopathy-an example from rice. Plant Breeding 121: 1-9.
Olofsdotter, M., Valverde, B. E. y Madsen, K.H. 2000. Herbicide resistant rice (Oryza sativa L.): Global implications for weedy rice and weed management. Annals of Applied Biology 137: 279-295.
Ponchio, J. A., Victoria-Filho, R. y Christoffoleti, P.J. 1997. Resistencia de biotipos de Bidens pilosa aos herbicidas inibidores da ALS/AHAS. Resumos. XXI Congresso brasileiro da sciencia das plantas daninhas. Caxambu, MG, pp.126.
Powles, S. B. 1997. Success from adversity: herbicide resistance can drive changes to sustainable weed management systems. Proc. Brighton Crop Protection Conference - Weeds.3: 119-1126.
Powles, S. B. y Shaner, D.L. eds. 2001. Herbicide resistance in world grains. CRC Press, Boca Ratón, Florida, Estados Unidos de América. 308 pp.
Preston, C. y Mallory-Smith, C.A. 2001. Biochemical mechanisms, inheritance, and molecular genetics of herbicide resistance in weeds. pp. 23-60 En: S. B. Powles & Shaner, D.L. eds. Herbicide resistance in world grains. CRC Press, Boca Ratón, Florida, Estados Unidos de América.
Preston, C. y Powles, S.B. 1998. Amitrole inhibits diclofop metabolism and synergises diclofop-methyl in a diclofop-methyl-resistant biotype of Lolium rigidum. Pesticide Biochemistry and Physiology 62: 179-189.
Preston, C. y Powles, S.B. 2002. Evolution of herbicide resistance in weeds: initial frequency of target site-based resistance to acetolactate synthase-inhibiting herbicides in Lolium rigidum. Heredity 88: 8-13.
Retzinger, E. J. y Mallory-Smith, C. 1997. Classification of herbicides by site of action for weed resistance management strategies. Weed Tech.11: 384-393.
Reznick, D. N. y Cameron, K.G. 2001. The population ecology of contemporary adaptations: what empirical studies reveal about the conditions that promote adaptive evolution. Genetica 112-113: 183-198.
Riches, C. R. y Valverde, B.E. 2002. Agricultural and biological diversity in Latin America: Implications for development, testing and commercialization of herbicide resistant crops. Weed Tech.16: 200-214.
Riches, C. R., Caseley, J.C., Valverde, B.E. y Down, V.M. 1996. Resistance of Echinochloa colona to ACCase inhibiting herbicides. pp. 14-16, En: de Prado, R., Jorrín, J., García-Torres, L. & Marshall, G. eds. Proc. of the Int. Symposium on Weed and Crop Resistance to Herbicides, 3-6 April 1995. University of Cordoba, España.
Riches, C. R., Knights, J.S., Chaves, L., Caseley, J.C. y Valverde, B.E. 1997. The role of pendimethalin in the integrated management of propanil-resistant Echinochloa colona in Central America. Pesticide Science 51: 341-346.
Rogachev, I., Kampel, V., Gusis, V., Cohen, N., Gressel, J. y Warshawsky, A. 1998. Synthesis, properties, and use of copper-chelating amphiphilic dithiocarbamates as synergists of oxidant-generating herbicides. Pesticide Biochemistry and Physiology 60:133-145.
Santos, J. B., Procópio, S.O., Silva, A.A. y Costa, L.C. 2002. Produção e características qualitativas de sementes de plantas daninhas. Planta Daninha 20: 237-241.
Sattin, M., Berto, D., Zanin, G. y Tabacchi, M. 1999. Resistance to ALS inhibitors in weeds of rice in north-western Italy. Proc. Brighton Crop Protection Conference Weeds, Brighton, UK, 3: 783-790.
Shibaike, H., Uchino, A. e Itoh, K. 1999. Genetic variation and relationships of herbicide-resistant and -susceptible biotypes of Lindernia micrantha. Proc. Brighton Crop Protection Conference - Weeds 1: 197-202.
Singh, S., Kirkwood, R.C. y Marshall, G. 1999. Biology and control of Phalaris minor Retz. (littleseed canarygrass) in wheat. Crop Protection 18: 1-16.
Singh, S., Kirkwood, R. C. y Marshall, G. 1997a. Effects of isoproturon on photosynthesis in susceptible and resistant biotypes of Phalaris minor and wheat. W ed Res. 37: 315-324.
Singh, S., Kirkwood, R. C. y Marshall, G. 1997b. New management approaches for isoproturon-resistant Phalaris minor in India. Proc. Brighton Crop Protection. Conference - Weeds. 1: 357-362.
Singh, S., Kirkwood, R.C. y Marshall, G. 1998b. Effect of ABT on the activity and rate of degradation of isoproturon in susceptible and resistant biotypes of Phalaris minor and wheat. Pesticide Sci. 53: 123-132.
Singh, S., Kirkwood, R. C. y Marshall, G. 1998c. Effect of the monooxygenase inhibitor piperonyl butoxide on the herbicidal activity and metabolism of isoproturon in herbicide resistant and susceptible biotypes of Phalaris minor and wheat. Pesticide Biochemistry and Physiology 59: 143-153.
Singh, S., Kirkwood, R. C. y Marshall, G. 1998a. Control of isoproturon resistant biotypes of Phalaris minor by chorotoluron and clodinafop-propargyl. Resistance Pest Management 10: 5-18.
Singh, S., Kirkwood, R. C. y Marshall, G. 1998a. Control of isoproturon resistant biotypes of Phalaris minor by chorotoluron and clodinafop-propargyl. Resistance Pest Management 10: 5-18.
Singh, S., Kirkwood, R. C. y Marshall, G. 1996. Uptake, translocation and metabolism of isoproturon in wheat, susceptible and resistant biotypes of Phalaris minor. Proc. Second Int. Weed Control Congress, Copenhagen, Denmark, 25-28 June 1996, 2: 529-534.
Stankiewicz, M., Gadamski, G. y Gawronski, S.W. 2001. Genetic variation and phylogenetic relationships of triazine-resistant and triazine-susceptible biotypes of Solanum nigrum-analysis using RAPD markers. Weed Res. 41: 287-300.
Stallings,G. P., Thill, D, y Mallory-Smith, C.A. 1994. Sulfonylurea-resistant Russian thistle (Salsola iberica) survey in Washington state. Weed Tech. 8: 258-264.
Thill, D. C. y Mallory-Smith, C.A. 1997. The nature and consequence of weed spread in cropping systems. Weed Sci. 45: 337-342.
Thompson, C. R., Thill, D. C. y Shafii, B. 1994. Germination characteristics of sulfonylurea resistant and -susceptible Kochia (Kochia scoparia). Weed Sci. 42: 50-56.
Tuesca, D. Nisensohn, L. 2001. Resistencia de Amaranthus quitensis a imazetapir y clorimurón-etil. Pesquisa Agropecuaria Brasileira 36: 601-606.
Valverde, B. E. 2002. Weed Management in Latin America. Pesticide Outlook 13: 79-81.
Valverde, B. E. 1996. Management of herbicide resistant weeds in Latin America: The case of propanil-resistant Echinochloa colona in rice. Proc.Second Int. Weed Control Congress, Copenhagen, pp. 415-420.
Valverde, B. E. e Itoh, K. 2001. World rice and herbicide resistance. pp. 195-249. En: Powles, S. R. & Shaner, D. eds. Herbicide Resistance in World Grains. CRC Press, Boca Ratón, Florida, Estados Unidos de América.
Valverde, B., Garita, I., Vargas, E., Chaves, L., Ramírez, F., Fischer, A.J. y Pabón, H. 1999. Anilofos as a synergist to propanil for controlling propanil-resistant junglerice, Echinochloa colona. WSSA Abstracts 39: 318.
Valverde, B. E., Chaves, L., Garita, I., Ramírez, F., Vargas, E., Carmiol, J., Riches, C.R. y Caseley, J.C. 2001a. Modified herbicide regimes for propanil-resistant junglerice control in rain-fed rice. Weed Sci. 49: 395-405.
Valverde, B. E., Madsen, K. H., Streibig, J. E. y Labrada, R. 2001b. Assessment of environmental hazards of herbicide and insect-resistant crops. Preparation of Guidelines. VALDOR - Values in Decisions On Risk. Proc. Stockholm. Suecia. pp.132-141.
Valverde, B. E., Chaves, P., Garita, I., Vargas, E., Riches, C.R. y Caseley, J.C. 1997. From theory to practice: Development of piperophos as a synergist to propanil to combat herbicide propanil resistance in Junglerice, Echinochloa colona. WSSA Abstracts 37: 33.
Valverde, B. E., Riches, C.R. y Caseley, J.C. 2000. Prevention and management of herbicide-resistant weeds in rice: Experiences from Central America with Echinochloa colona. Cámara de Insumos Agropecuarios, Costa Rica, pp. 123.
Vargas, L., Borém, A. y Silva, A.A. 2001. Herança da resistência aos herbicidas inibidores da ALS em biótipos da planta daninha Euphorbia heterophylla. Planta Daninha.
Vidal, R. A. y Fleck, N.G. 1997. Three weed species with confirmed resistance to herbicides in Brazil. WSSA Abstracts 37: 251.
Vidal, R. A. y Merotto, A., Jr. 1999. Resistência de amendoim-bravo aos herbicidas inibidores da enzima acetolactato sintase. Planta Daninha 17: 367-373.
Vidal, R. A. y Trezzi, M.M. 2000. Análise de crescimento de biótipos de leiteira (Euphorbia heterophylla) resistentes e suscetível aos herbicidas inibidores da ALS. Planta Daninha 18: 427-433.
Vitta, J., Tuesca, D., Puricelli, E., Nisensohn, L., Faccini, D. y Leguizamón, E. 2001. Glyphosate-tolerant soybean and weed management in Argentina: present and prospects [abstract]. En: Abstracts of the Third Int. Weed Sci. Congress, 2000, June 6-11; Foz do Iguassu, Brazil, pp. 343. CD-ROM. Disponible en Int. Weed Science Society, Oxford, MS, Estados Unidos de América.
Voll, E., Torres, E., Brighenti, A.M. y Gazziero, D.L.P. 2001. Dinâmica do banco de sementes de plantas daninhas sob diferentes sistemas de manejo de solo. Planta Daninha19: 171-178.
Walia, U. S., Bar, L. S. y Dhaliwal, B.K. 1997. Resistance to isoproturon in Phalaris minor Retz. En: Punjab. Plant Protection Quarterly 12: 138-140.
Walker, S. R., Medd, R. W., Robinson, G.R. y Cullis, B.R. 2002. Improved management of Avena ludoviciana and Phalaris paradoxa with more densely-sown wheat and less herbicide. Weed Res. 42: 257-270.
Wrubel, R. P. y Gressel, J. 1994. Are herbicide mixtures useful for delaying the rapid evolution of resistance? A case study. Weed Tech. 8: 635-648.
Ye, B. y Gressel, J. 2000. Transient, oxidant-induced antioxidant transcript and enzyme levels correlate with greater oxidant-resistance in paraquat-resistant Conyza bonariensis. Planta 211: 50-61.
Ye, B., Faltin, Z., Ben-Hayyim, F., Eshdat, Y. y Gressel, J. 2000. Correlation of glutathione peroxidase to paraquat/oxidative stress resistance in Conyza determined by direct fluorometric assay. Pesticide Biochemistry and Physiology 66: 182-194.