Les effets du régime et de la ration alimentaire ont été spécialement traités dans la section antérieure. Cette présente section apporte des informations de base utiles en discutant d'autres aspects des conditions de culture et comment ils influencent aussi bien la performance embryonnaire que larvaire. Il s'agit de la température, la salinité, la qualité de l'eau de mer, la qualité des œufs et des larves, et les maladies.
La plupart de l'information incluse dans cette section n a pas été publiée auparavant et contrairement aux autres sections de ce manuel, les références sont citées dans le texte pour permettre au lecteur de poursuivre et chercher les sujets qui l'intéressent plus profondément.
De tous les facteurs qui affectent la croissance, le développement, la survie des larves en culture, la température est un des facteurs les plus importants puisque le taux des métabolites est dicté par la température de l'eau dans laquelle nagent les larves. Les larves de plusieurs espèces de bivalves communément cultivées montrent une grande tolérance aussi bien à la température qu'à la salinité, souvent bien au delà des conditions où elles sont normalement exposées dans leur environnent naturel. Dans le cas des espèces, qui vivent dans des endroits froids en pleine mer, il ne doit pas être présupposé que les larves montreront une performance optimale dans la gamme de températures rencontrées où est exposé normalement le stock sauvage. Souvent, les larves croient mieux à des températures élevées que dans le milieu naturel. De la même manière, les limites de tolérance à la salinité sont souvent plus grandes qu'il n'est prévu. A titre d'exemple, les larves du pétoncle calico, Argopecten gibbus, d'un stock adapté à une salinité presque invariable de 36 PSU aux Bermudes sont capables de croître et de se développer jusqu'à la fixation à 20 PSU. La croissance et le développement sont plus lents, mais le taux de survie est légèrement différent comparé à des élevages cultivés à des salinités élevées.
La croissance des larves de coquille Saint-Jacques japonaise, Patinopecten yessoensis, à des salinités et des températures variées est montrée dans la figure 71. La tolérance à la température de cette espèce, est typique et les taux de croissance sont semblables à ceux d'autres espèces de pectinidés d'eau froide incluant Placopecten magellanicus et Pecten maximus, normalement cultivées à une température de 14 à 16 ºC. La croissance, le développement et la survie sont fortement affectés à des températures élevées. Les pectinidés du large tels que Placopecten magellanicus et Pecten maximus ont des exigences en salinité élevée (>30 PSU). Par contre, les larves des espèces d'Argopecten, par exemple le pétoncle calico (Argopecten gibbus) et le pétoncle de baie (Argopecten irradians concentricus) peuvent être cultivées avec succès à des températures aussi élevées que 26 à 28 ºC.
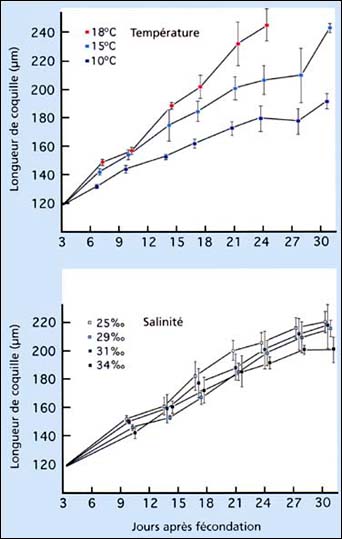
Figure 71: Effets de la température et de la salinité sur la croissance larvaire de la coquille Saint-Jacques japonaise, Patinopecten yessoensis. Les larves ont été cultivées à des salinités de 29 PSU pour différentes températures et à 15 ºC pour différentes salinités. D'après Bourne et al. (1989).
Les huîtres du genre Crassostrea sont extrêmement tolérantes tant à la température qu'à la salinité en conditions contrôlées. Les interactions de ces deux facteurs sur la croissance sont illustrées dans la figure 72. Dans l'huître de mangrove, Crassostrea rhizophorae, et l'huître du Pacifique, Crassostrea gigas - et c'est également vrai pour l'huître américaine, Crassostrea virginica - la croissance, le développement, et la survie sont optimaux à 28 ºC et à la salinité de 25 PSU. Les larves peuvent tolérer des salinités aussi basses que 10 PSU mais les survivants souffrent à une salinité de 5 PSU. Les survivants excédent 80 pour cent dans tous les traitements après la durée des essais avec les deux espèces.
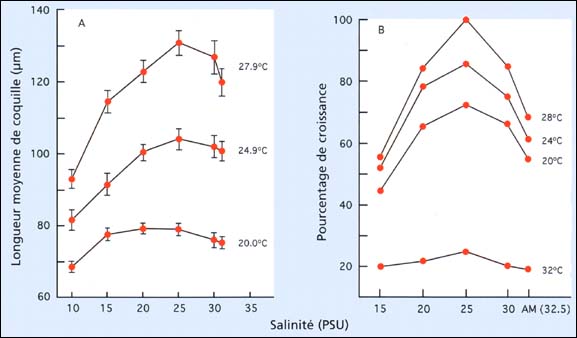
Figure 72: Croissance de A, l'huître de mangrove, Crassostrea rhizophorae, durant une période de 7-jours à partir du stade larve D (longueur moyenne initiale de 65 mm) et B, des larves de l'huître du Pacifique, Crassostrea gigas, exposées à des températures et des salinités différentes durant 10 jours. Les résultats de l'huître du Pacifique sont exprimés en pourcentage de croissance des larves du meilleur traitement (28 ºC à 25 PSU). AM indique la salinité ambiante qui était de 32,5 PSU dans B.
Les larves de l'huître plate européenne, Ostrea edulis, sont aussi tolérantes à la température que les espèces de Crassostrea, mais ne sont pas très tolérantes à des faibles salinités. Tandis qu'elles survivront à des expositions brèves de salinité de 20 PSU, le taux de croissance et de développement des cultures est proche de l'optimum quand les salinités varient entre 28 et 32 PSU.
La croissance des larves des espèces commercialement cultivées, les palourdes japonaises côtières ou d'estuaire incluant, Tapes philippinarum, la palourde américaine à coquille dure, Mercenaria mercenaria, et la palourde à coquille lisse, Mya arenaria, montrent aussi une tolérance à une large gamme de température et de salinité. A l'exception de Mya arenaria, qui est normalement cultivée à une température de 18 à 20 ºC, les larves sont généralement cultivées à 25±2 ºC et à des salinités entre 25 et 34 PSU. L'effet de la température sur la croissance des larves de la palourde japonaise est montré dans la figure 73.
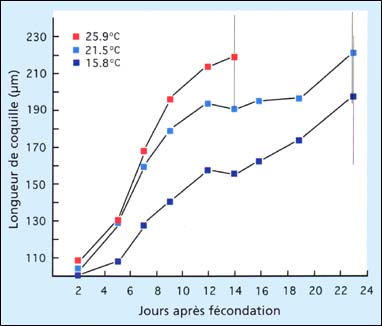
Figure 73: Croissance des larves de la palourde japonaise, Tapes philippinarum, de la larve D jusqu'à la métamorphose à trois températures. Les barres verticales indiquent la gamme des longueurs de coquilles des larves (mm) quand les pedivéligères ont été remarquées pour la première fois dans les cultures (A. Lovatelli, MSc thesis).
Il est généralement exceptionnel pour une écloserie de fonctionner à un taux de production constant durant toute l'année. Les facteurs de nature saisonnière qui ne peuvent pas être facilement contrôlés peuvent entraîner pendant certaines périodes de l'année de moindres performances larvaires en terme de taux de croissance et de survie. En l'absence d'explications techniques, telles que des problèmes de filtres ou de corrosion du matériel - parmi d'autres possibilités - ou l'utilisation de cultures d'algues de mauvaise qualité qui peuvent devenir contaminées, ou des défaillances en élevage (erreur humaine), la qualité de l'eau de mer peut être responsable.
Il a été établi depuis longtemps que l'eau de mer varie saisonnièrement dans sa capacité à assurer la croissance et la survie des embryons et des larves. Ceci peut ne pas se reproduire de manière globale, mais des conditions défavorables se reproduisent des deux côtés de l'Océan Atlantique, particulièrement quand la mer commence à se réchauffer en printemps et coïncident avec des périodes de floraisons phytoplanctoniques intenses aussi bien au printemps qu'à l'automne. Les raisons précises de la détérioration de la qualité de l'eau de mer durant ces périodes ne sont pas complètement comprises et peuvent ne pas se reproduire chaque année. A cet égard, certaines années sont meilleures que d'autres.
En comparant le développement des embryons ou la croissance des larves dans une écloserie dont l'eau de mer est traitée normalement et dans un milieu contenant de l'eau de mer artificielle en utilisant les techniques standard de bioessais, il est possible de détecter et de quantifier les variations dans la qualité de l'eau de mer. La méthode pour les bioessais d'embryons de bivalves est détaillée dans Utting et Helm (1985). Une adaptation peut être réalisée à l'échelle du bécher ou seau pour déterminer la variabilité qui affecte la croissance et la survie des larves. L'eau de mer artificielle peut être préparée selon plusieurs recettes à partir de produits chimiques analytiques de qualité variée ou achetés sous forme de produits réputés chez les fournisseurs de laboratoires et des magasins de d'aquariophilie. Ils doivent toujours être préparés de la même manière et être de qualité constante comme un milieu de contrôle.
Un exemple de la variabilité de la qualité de l'eau de mer affectant le développement des embryons des huîtres du Pacifique en écloserie est illustré dans la figure 74. Le développement des œufs fécondés jusqu'au stade larve D est exprimé comme mortalité nette de traitement (MNT), où:
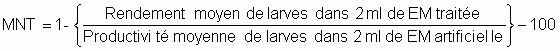
Une valeur 0 de mortalité nette de traitement indique qu'un nombre élevé d'œufs fécondés ont survécu jusqu'au stade larve D dans les deux milieux et une valeur de MNT de 100 dénote un échec total du développement dans l'eau de mer normalement traitée. Les valeurs négatives indiquent que la qualité d'eau de mer en écloserie était supérieure à celle de l'eau de mer artificielle.
Au début de l'année dans les latitudes nord tempérées de l'Océan Atlantique, quand les températures sont froides et les jours sont courts, la qualité de l'eau de mer est relativement stable. Quand les eaux côtières se réchauffent et les journées deviennent plus longues durant le printemps et l'été, la qualité de l'eau de mer devient progressivement variable. Les valeurs de MNT commencent à grimper de façon non prédictible et dans quelques années il y aura des périodes pendant lesquelles il sera difficile de produire des larves D même à partir d'œufs de bonne qualité - les œufs vont se développer normalement dans un milieu artificiel contrôlé mais pas dans l'eau de mer de l'écloserie. Le phénomène s'applique également à une grande variété d'espèces de bivalves, pas seulement à l'huître du Pacifique.
L'instabilité de la qualité de l'eau de mer coïncide généralement avec une production intense dans les eaux côtières durant les conditions de floraison phytoplanctonique printanière. Il n'y a pas d'évidences directes que ce sont les métabolites ou des produits de dégradation phytoplanctonique qui causent la détérioration de la qualité de l'eau. Il s'agirait plutôt, de bactéries associées aux floraisons ou aux métabolites, incluant les exotoxines, qu'ils produisent.
Une situation similaire est illustrée dans la figure 74 dans un site d'écloserie où les espèces algales dominantes en fin de floraison printanière dans les eaux côtières étaient les colonies de flagellés, Phaeocystis pouchetti. La comparaison des valeurs de MNT pour les différentes années montre que la qualité de l'eau de mer d'écloserie était médiocre quand un nombre de bactéries formant des colonies sur TCBS agar était à leur maximum. Les bactéries qui forment des colonies sur cet agar incluent les espèces du genre Vibrios. Elles comprennent des pathogènes opportunistiques connues, tel que V. anguillarum, qui a fréquemment été rapportée comme étant la bactérie la plus dominante en écloserie en cette période de l'année. Elles sont souvent impliquées dans des maladies. V. anguillarum est connue pour ses potentialités de production de toxines incluant des toxines de faibles poids moléculaires comme les ciliostatiques qui inhibent les battements des cils du velum pour les larves et des branchies pour les juvéniles.
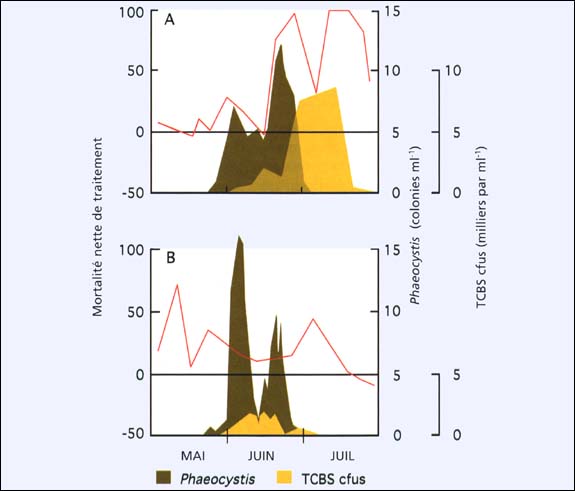
Figure 74: Survie relative (mortalité nette de traitement - ligne rouge) dans des bioessais consistant à comparer le taux de formation de larves D (nombre de larves D formées par rapport au nombre d'œufs fécondés) de l'huître du Pacifique dans de l'eau de mer artificielle et dans de l'eau de mer normalement traitée durant la période de mai à juin, 1977 (A) et 1978 (B). La ligne horizontale noire, équivalente à la valeur zéro de mortalité nette de traitement, indique une égalité de survie dans l'eau de mer testée et le milieu de contrôle. La floraison des flagellés coloniales, Phaeocystis pouchetti, (exprimée en colonies par ml) et le nombre de colonies de bactéries (cfus - colonies formant des unités - comme milliers par ml) cultivées sur un agar TCBS dans des échantillons prélevés des eaux côtières adjacentes sont superposés. Adaptées de Utting et Helm (1985), incluant des données antérieures non publiées.
La qualité de l'eau pour le développement des embryons peut être améliorée par des prétraitements avec des produits chimiques pendant une période de 24 heures avant utilisation. Ceci en plus de la filtration habituelle et des mesures de désinfection aux rayons UV. Le plus souvent, pour des traitements efficaces 1 mg par litre d'EDTA (acide ethylenediamine-tetraacetique) et 20 mg par litre de sodium metasilicate (Na2SiO3.9H2O) sont ajoutés aux bacs contenant de l'eau de mer qui sont ensuite vigoureusement aérés jusqu'à leur utilisation dans les 24 heures qui viennent. Le pourcentage d'œufs qui se développent en larve D peut souvent être significativement amélioré par un tel traitement. A titre d'exemple, dans 26 essais avec des embryons de l'huître du Pacifique, les biomasses des larves D à partir d'une ponte par semaine durant la saison en écloserie (mars à septembre) ont été améliorées en moyenne de 36,6 pour cent à 52,9 pour cent. L'amélioration apportée par l'utilisation des prétraitements à base de produits chimiques est comparable avec la biomasse moyenne de 54,6 pour cent dans le milieu artificiel de contrôle.
Le taux de croissance des larves à partir du stade D est également influencé par la variabilité de la qualité de l'eau de mer de la même façon et pour les mêmes raisons que les embryons. Encore une fois, les effets sur la croissance étaient évidents chez toutes les espèces de bivalves testées. La croissance comparée de larves d'huîtres du Pacifique pendant une période de 6 jours à partir du stade D, cultivées en bécher à 25 ºC dans une eau normale d'écloserie et en eau de mer artificielle (formule de Lyman et Fleming, à partir de Sverdrup et al. (1942), est representée dans la figure 75. Les différences entre taux de croissance sont exprimées en Indice de Croissance (IC), où:
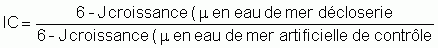
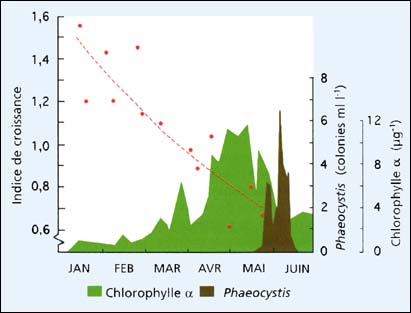
Figure 75: Comparaison de la croissance des larves d'huîtres du Pacifique, après une période de 6 jours à 25 ºC dans de l'eau de mer normale d'écloserie et de l'eau de mer artificielle, exprimée en indice de croissance (voir texte). La teneur en chlorophylle á et le nombre de colonies de Phaeocystis pouchetti en écloserie sont illustrés comme indicateurs de production phytoplanctonique dans les eaux côtières adjacentes de l'écloserie (M.M. Helm, données non publiées).
Un indice de croissance >1,0 indique des périodes où la croissance est supérieure en eau d'écloserie; un IC de 1,0 montre une égalité de performance entre les deux milieux et ICs <1,0 indique la période durant laquelle le taux de croissance était inférieur dans l'eau de mer d'écloserie comparé à l'eau artificielle.
Les résultats illustrés dans la figure 75 suggèrent une détérioration progressive de la qualité de l'eau de mer à partir du début de la saison de l'écloserie en janvier jusqu'à ce que les essais s'achèvent à la fin mai quand - pour une période de 6 semaines approximativement - les larves n'ont pas pu survivre au cours de la période expérimentale de 6 jours dans les deux milieux. Jusqu'à la fin d'avril, des groupes de larves élevées pour produire du naissain se développent normalement jusqu'à la fixation dans l'eau de mer avec un bon rendement en naissain. La culture en grand volume était problématique au delà de cette période avec un faible taux de survie et échec éventuel pour atteindre la fixation. La même tendance existe chez les larves de l'huître plate européenne, Ostrea edulis, où une détérioration des performances de croissance et de survie conduit souvent à des maladies et à une mortalité totale des lots larvaires dans les cultures en mai et juin. La qualité de l'eau de mer était plus variable certaines années que d'autres.
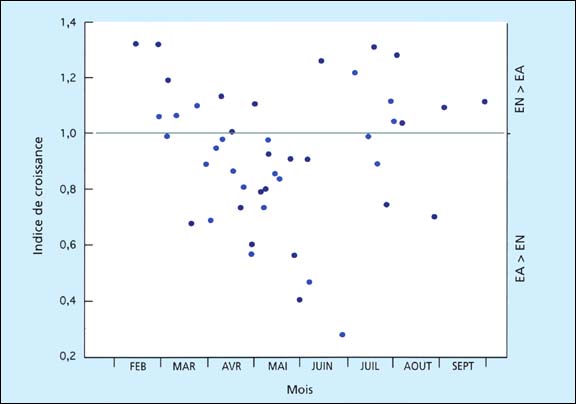
Figure 76: Indices de croissance de différents lots de larves d'huître plate européenne, Ostrea edulis, cultivées en bécher en écloserie et en eau de mer artificielle pendant 4 jours suivant l'émission à 24±1 ºC pendant la période de production de l'écloserie. Les résultats couvrent une période de 2-années différenciées par l'ombrage des points d'enregistrement. Extrait de M.M. Helm (1971) et autres données antérieures non publiées.
La qualité des œufs en terme de quantité et qualité de leur composition biochimique ont aussi un effet sur les performances ultérieures des larves. Des études concernant ce sujet se sont principalement focalisées sur les teneurs en lipides et, en particulier, sur l'importance et le rôle des acides gras hautement insaturés (AGHI) apportés par la femelle adulte durant l'oogenèse ou mobilisés directement à partir du régime alimentaire durant la période de la maturation des œufs qui précède la ponte.
Les conditions auxquelles les femelles sont exposées durant l'oogenèse et la maturation des œufs peuvent avoir un effet considérable sur la fécondité et la qualité des œufs pondus ultérieurement. La composition des régimes et l'abondance de la nourriture ont une grande importance et s'appliquent également aux stocks dans leur habitat naturel et aux géniteurs maintenus en écloserie. La composition en AGHI des œufs fraîchement pondus peut être significativement altérée par le régime fourni durant le conditionnement (figure 77) mais il n'y a pas d'évidence que de tel changement exerce un effet facilement discernable sur la viabilité et la vigueur des larves se développant à partir des œufs. Il n'y a aucune évidence qui suggère que les larves émises à partir du stock sauvage d'huître plate européenne soient plus ou moins viables que celles issues des stocks maintenus en écloserie même si les profils des AGHI sont très différents (figure 78). Les différences peuvent être trop subtiles pour être discerné aisément dans le contexte des cultures en écloserie où des efforts sont faits pour que les conditions soient quasi optimales pour les larves.
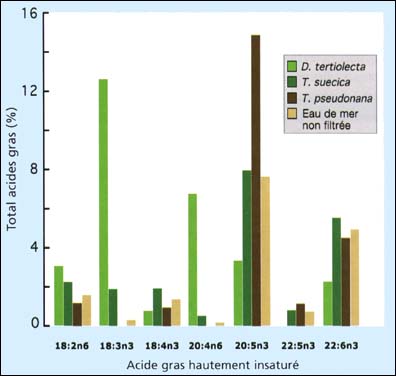
Figure 77: Composition des œufs en acides gras hautement insaturés de la palourde japonaise, Tapes philippinarum, émis par des géniteurs conditionnés en écloserie et nourris sur différents régimes. Les palourdes témoins ont été maintenues en eau de mer non filtrée alors que les autres étaient alimentées sur la base d'une ration de 3 pour cent de Dunaliella tertiolecta, Tetraselmis suecica ou Thalassiosira pseudonana dans de l'eau de mer filtrée à 2 mm. (I. Laing, A. R Child et M. M. Helm - données antérieures non publiées).
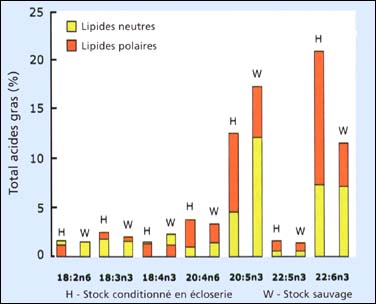
Figure 78: Comparaison de la composition en acides gras hautement insaturés des larves conditionnées en écloserie et issues d'un stock sauvage de l'huître plate européenne, Ostrea edulis. Les acides gras sont différenciés en constituants neutres (triacylglycerols) et polaires (structurel). Modifié à partir de M.M. Helm et al. (1991).
La tendance la plus lourde semble être la teneur en lipides totaux des œufs récemment émis, ou des larves récemment libérées dans le cas de l'huître plate européenne, Ostrea edulis. Les lipides totaux en tant que pourcentage du poids sec sans cendres (matière organique) de l'huître du Pacifique sont positivement corrélés avec le pourcentage de développement au stade larve D (figure 79). Même quand on utilise le protocole standard de conditionnement des géniteurs, les teneurs en lipides peuvent varier largement selon la période de l'année et d'une année à l'autre (figure 80A). Ceci peut être expliqué par la quantité, la diversité et la valeur nutritionnelle de la nourriture présente dans l'eau de mer non filtrée utilisée pour les bacs de conditionnement avant que les cultures d'algues ne soient rajoutées (figure 80B). Ceci peut aussi aider à expliquer pourquoi certaines années en écloserie sont plus productives et souffrent de moins de perturbations que d'autres.
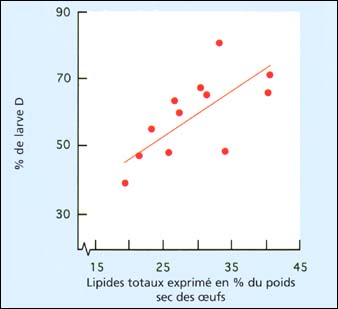
Figure 79: Relation entre lipides totaux des œufs exprimés en pourcentage du poids sec et taux de formation de larve D de l'huître du Pacifique, Crassostrea gigas. Extrait de S.D. Utting et M.M. Helm (1985) et données antérieures non publiées.
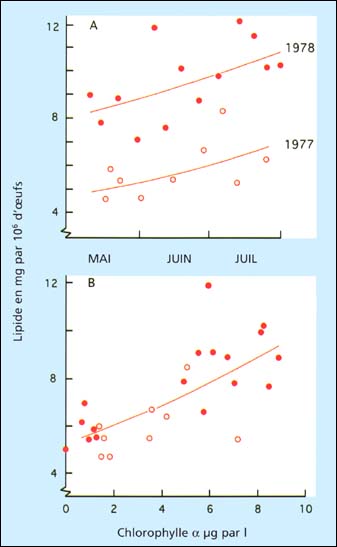
Figure 80: Relation entre teneur en lipides d'œufs fraîchement émis de l'huître du Pacifique (exprimés en lipides par millions d'œufs) et, (A) mois de l'année au cours de deux différentes années et (B), chlorophylle á contenue dans l'eau de mer non filtrée utilisée pour le conditionnement de géniteurs en écloserie selon un protocole standard. Extrait de Utting et Helm (1985) et données antérieures non publiées.
Chez les huîtres larvipares, par exemple Ostrea edulis, l'augmentation de la croissance larvaire dans une période de 4 jours suivant la libération par les adultes est significativement corrélée avec les teneurs en lipides au moment de l'émission, suggérant l'importance des réserves maternelles apportées durant les premiers stades larvaires (figure 81). D'autre part, il y a des indications d'un facteur saison et des différences entre les années. Cependant, de tels effets deviennent moins prononcés lorsque les larves poursuivent leur développement et le régime ainsi que la ration alimentaire fournie jour après jour ont une influence primordiale.
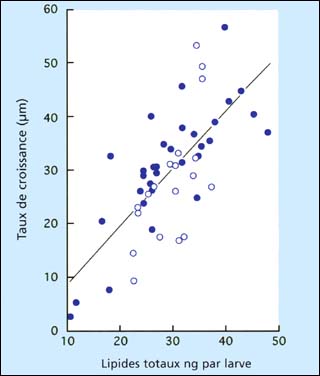
Figure 81: Relation entre croissance larvaire d'Ostrea edulis pendant 4 jours depuis la libération et teneur lipidique à l'émission à partir de géniteurs conditionnés en écloserie. Chaque point de données représente un lot larvaire spécifique au cours d'une période de 2 années - chaque année se différenciant selon l'ombrage des points d'enregistrement. Les larves étaient cultivées dans des béchers contenant de l'eau de mer artificielle et alimentées par le même régime et ration selon des conditions standardisées pendant toute la période des essais. Extrait de M.M. Helm (1971) et données antérieures non publiées.
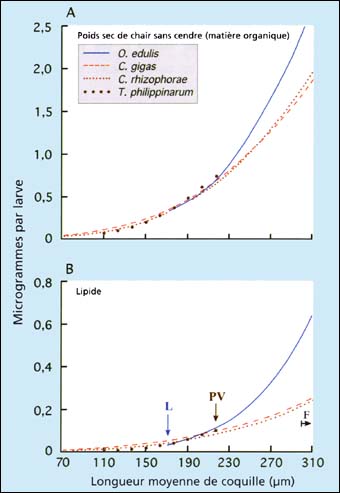
Figure 82: Comparaison de l'augmentation (A) du poids sec sans cendre (organique) et (B) de la teneur en lipide larvaire en fonction de la longueur moyenne des larves chez quatre espèces de bivalves. L - Dénote la taille moyenne à la libération des larves d'Ostrea edulis; PV - Le commencement du stade pedivéligère chez Tapes philippinarum et F - le début de la fixation chez trois huîtres. Source: M.M. Helm - données antérieures non publiées.
Il y a une relation similaire entre la longueur de coquille et le poids de matière organique des larves chez la plupart des espèces de bivalves communément cultivées quand elles sont chacune élevées dans des conditions quasi optimales (figure 82A). L'exception parmi les espèces étudiées est l'huître larvipare, Ostrea edulis, où il y a divergence croissante entre la longueur de coquille et la matière organique dans les stades larvaires âgés comparativement aux larves de Crassostrea sp. Ceci est expliqué par une différence d'accumulation de lipides d'un facteur 3 lorsque les larves approchent la métamorphose (figure 82B). Des études ont suggéré que les lipides sont beaucoup plus importants en tant que source d'énergie durant la métamorphose chez Ostrea edulis qu'ils ne le sont pour les huîtres ovipares.
L'implication des bactéries du genre Vibrio dans les mortalités larvaires de masse a été mentionnée dans la section 5.3.3. Cela se reproduit de temps à autre dans les écloseries les mieux gérées. Le Vibrio sp. peut ne pas toujours être une cause directe des taux anormaux des mortalités, ni constituer le seul groupe des pathogènes opportunistes ou inévitables qui peut contaminer les cultures. Les pathogènes potentiels sont présents à l'intérieur de l'environnement de l'écloserie durant toute l'année, mais sont dans la plupart du temps en veille en étant minoritaire dans la flore bactérienne. Durant d'autres périodes de l'année, comme indiqué dans la section 5.3.3, ils peuvent proliférer et dominer la flore microbienne, en exposant la production à une sérieuse menace.
Avant d'attribuer les mortalités larvaires de masse à une apparition soudaine de maladie, d'autres causes potentielles doivent être examinées. Par exemple, la propreté des tuyaux et des filtres doit être vérifiée. De même l'équipement tel que les pompes et les soufflantes d'air qui peuvent être corrodées ou présenter une fuite d'huile ont besoin d'être minutieusement examinées. Les cultures algales peuvent devenir sérieusement contaminées ou un technicien peut avoir fait une erreur de jugement ou un mauvais calcul et suralimenter la culture, ou a oublié d'ouvrir le débit de l'air dans le ou les bacs, ou ne pas rincer un bac après un traitement à l'eau de javel. C'est seulement après cet examen minitieux qui en exclu l'implication que l'occurrence d'une maladie peut être considérée.
A l'encontre des maladies larvaires chez les poissons, l'installation d'une maladie chez les bivalves est rapide et catastrophique. Les larves montrent rarement des symptômes prolongés conduisant à une mortalité de masse. Elles peuvent apparaître tout à fait normales sur le plan de leur coloration et du comportement la nuit précédente, et le matin suivant se retrouver au fond du bac, mortes ou moribondes avec leurs coquilles presque dépourvues de tissus et remplies par des protozoaires ciliées agissant comme des ravageurs opportunistes. Il y a souvent des signes précurseurs comme la prise de nourriture par les larves à un moindre niveau le jour précédent la mortalité en masse. Ceci souligne l'importance de consigner et d'enregistrer minutieusement les observations.
Une fois que les larves tombent au fond du bac il n'y a pas autre chose à faire que d'ajouter un agent stérilisateur puissant tel que l'eau de javel. Même quand un petit pourcentage de larves paraît encore actif et normal, elles sont vouées à mourir avant d'atteindre la métamorphose si un pathogène est impliqué. L'objectif est donc d'essayer de maîtriser la maladie et d'éliminer la source d'infection. Ceci peut se traduire par la fermeture de l'écloserie pour une désinfection complète, en s'assurant de bien nettoyer et stériliser tout le matériel. L'écloserie est donc arrêtée pendant une semaine ou deux avant le redémarrage de la production. L'utilisation des antibiotiques n'est pas recommandée durant l'émergence de ces maladies. Ils améliorent rarement la situation et il y a toujours le risque que des pathogènes deviennent résistants.
Plusieurs écloseries concentrent leurs productions durant des périodes de l'année où les mortalités en masse sont peu probables. Dans les régions tempérées la période la plus sure est l'hiver et le début du printemps, c'est-à-dire avant le commencement des floraisons phytoplanctoniques. La période entre fin juin jusqu'à la fin septembre est souvent convenable pour une production non ininterrompue.
Plus d'informations sur les maladies des larves de bivalves figurent à la fin du chapitre 5.
Les larves nagent librement dans la colonne d'eau pendant une bonne partie de leur vie larvaire (figure 83A). Typiquement, elles nagent en se dirigeant vers la surface et rétractent l'organe de nage/alimentation (le velum), ferment les valves de leur coquille et se laissent couler au fond avant de reprendre à nouveau leur activité natatoire. En fin de vie larvaire, les activités alimentaires ralentissent, et moins de nourriture est consommée, les larves passant plus de temps au fond du bac. Ceci marque le début de la métamorphose, une étape critique du développement durant laquelle une mortalité massive peut se produire. Des changements anatomiques considérables se produisent au cours de cette métamorphose. Des transformations réussies et une survie jusqu'au stade juvénile dépendent de plusieurs facteurs comme la disponibilité des réserves énergétiques accumulées durant la phase larvaire. L'importance de produire des larves en bonne santé avec d'importantes réserves énergétiques est à souligner.
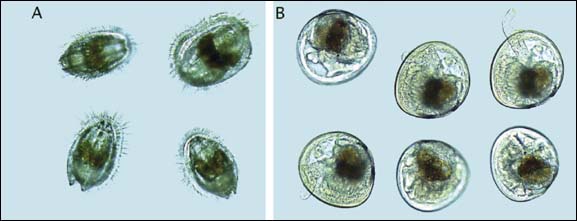
Figure 83: Microphotographies de (A) nage de larves d'Argopecten gibbus, montrant l'organe cilié de nage/alimentation, le velum, et (B) de larves oeillées pedivéligères de la même espèce. Le pied peut être aperçu s'étendant entre les valves de la coquille dans trois larves et l'oeil sous forme de petit point noir est visible en dessous de la glande digestive, particulièrement transparent dans la larve d'en haut à gauche dans (B).
La métamorphose peut être divisée en deux stades, la fixation qui est réversible (à l'exception des huîtres) et la métamorphose qui est irréversible.
La fixation est le stade initial de la métamorphose. Les larves commencent à quitter la colonne d'eau pour tomber sur le substrat, rampent autour d'elles même sur le substrat en utilisant leur pied avec la coquille en position verticale et cherchent une surface appropriée pour se fixer (figure 83). Si la surface n'est pas adéquate elles vont arrêter de se déplacer ou nager plus loin pour chercher des endroits plus adaptés à leur fixation. Ce processus peut être répété plusieurs fois et la métamorphose peut être retardée quelque temps si une surface adéquate n'est pas trouvée.
La métamorphose est la seconde phase et elle est irréversible. Les facteurs déclenchant ce phénomène restent inconnus mais le type de substrat associé à des activateurs physique, chimique et biologique sont sans aucun doute importants. Des changements morphologiques et physiologiques considérables se produisent chez l'animal dès le moment où il passe d'une larve nageuse au stade naissain. La métamorphose peut se produire rapidement mais peut être retardée si les conditions de fixation ne sont pas rencontrées. Dans les écloseries elle peut être parfois différée si la température de l'eau est abaissée.
Parmi les indications caractérisant la recherche de substrat, la préparation à la fixation (parfois appelé captage) et métamorphose ont commencé, ou sont sur le point de le faire, il y a l'apparition - dans plusieurs espèces - d'une paire de taches ocellaires sombres pigmentées, chacune d'un côté entre la surface de la glande digestive et les valves de la coquille (figure 83). Le rôle joué par cet oeil, reste sujet à hypothèse. L'apparition de la tache ocellaire est liée à la taille (voir ci-après) et coïncide avec le comportement d'agrégation ou «regroupement en cheminée» des larves en grand nombre du à des secrétions muqueuses quand elles sont transférées des tamis dans les seaux au cours du changement d'eau (figure 84). Ces signes clairs indiquent que les larves sont prêtes à se fixer.
Dès ce moment, un ou deux jours après, les larves vont être aussi vues en train de tester un pied nouvellement formé entre les deux valves (figure 83B). Ce pied a une pointe ciliée et de nombreux récepteurs sensoriels utilisés pour la recherche d'un substrat de fixation et secrète un byssus ou ciment à l'endroit choisi. Le pied permet aux larves de ramper sur des surfaces et peut aussi avoir une fonction alimentaire («nutrition pédieuse») chez certaines espèces. Il est aussi porteur du byssus ou la glande adhésive selon les espèces. Les huîtres fabriquent un ciment d'attachement aux surfaces alors que d'autres bivalves se fixent au moyen de fils de byssus. A ce stade, les larves sont appelées pédivéligères.
La fixation des larves a donné lieu à une vive polémique en se demandant si les bivalves - et autres larves d'invertébrés - se fixent et se métamorphosent selon un calendrier précis ou si elles sélectionnent un substrat particulier et nécessitent une activation spécifique pour déclencher le processus. Actuellement, le consensus admet que les signaux environnementaux influencent la fixation et la métamorphose et que les larves ont besoin de stimuli chimiques avant que les processus de fixation et de métamorphose ne soient initiés. Des études ont montré que ces signaux de nature chimique appelés neurotransmetteurs doivent être présents pour initier la fixation et la métamorphose.
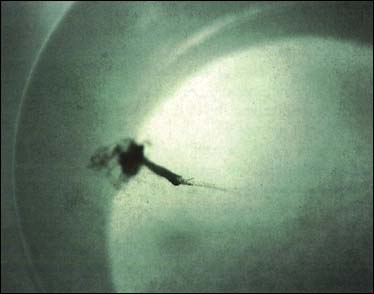
Figure 84: Comportement d'agrégation ou «regroupement en cheminée» de larves matures avant fixation. La masse noire représente de nombreuses larves rassemblées juste en dessous de la surface d'eau dans le seau.
Les stratégies pour faciliter et augmenter la fixation des pedivéligères varient beaucoup selon les écloseries, les espèces et les méthodes employées pour élever les jeunes juvéniles. Les gérants des écloseries veulent que les larves puissent se fixer sur un substrat adéquat (collecteur - voir 5.4.3.2) pour initier la métamorphose le plus rapidement possible. Des études ont montré que plusieurs méthodes, incluant aussi bien des stimuli physiques que chimiques aident à déclencher ces processus. La méthode physique la plus classiquement utilisée est le choc thermique, consistant à refroidir les larves matures (parfois dans un réfrigérateur) et en les plaçant dans de l'eau tiède dans les bacs de fixation. Les résultats rapportés sont variables mais la métamorphose est globalement améliorée quand cette méthode est utilisée.
Une autre méthode courante pour stimuler et augmenter la métamorphose est l'utilisation de produits chimiques. Plusieurs ont été testés incluant l'ammonium et un groupe de produits chimiques communs comme les neurotransmetteurs à savoir la L-DOPA (L-3-4-dihydroxyphenylalanine), l'adrénaline, la noradrénaline et la yohimbine.
Plusieurs responsables d'écloseries sont septiques sur l'utilisation des produits chimiques pour stimuler et augmenter le succès à la métamorphose. Les gérants considèrent qu'une métamorphose réussie avec des taux élevés dans une écloserie produisant des larves de bivalves peut être atteint en écloserie ou dans un site de télécaptage si les larves sont de bonne qualité avec des réserves nutritionnelles abondantes et manipulées correctement. Ils pensent que l'addition de neurotransmetteurs peut induire des taux de métamorphose plus élevés que chez les larves non traitées, mais que cette différence s'estompe au stade juvénile à une taille de 5 à 10 mm. Les neurotransmetteurs permettent à certaines larves de se métamorphoser alors qu'elles seraient normalement incapables de le faire, mais elles ne contiennent pas suffisamment de réserves pour se développer jusqu'au stade juvénile.
Le matériel utilisé pour la fixation des larves en écloserie ou dans les installations de télécaptage est appelé collecteur et il peut être très varié. Les deux critères importants pour un collecteur concernent sa surface qui doit être adaptée à la fixation des larves et sa maniabilité.
Des écloseries d'huîtres de la côte ouest de l'Amérique du Nord ne fixent pas elles même les pédivéligères mais fournissent aux conchyliculteurs des larves oeillées à fixer dans des sites adjacents aux fermes d'huîtres (figure 85). Cette méthodologie est traitée dans le chapitre 6.2.
La suite est un résumé des méthodes les plus couramment employées pour la fixation des larves oeillées de différents groupes de bivalves.

Figure 85: Système de télécaptage d'huîtres situé dans l'île de Vancouver, Colombie britannique, Canada. Les larves oeillées de l'huître du Pacifique, Crassostrea gigas, sont reçues des écloseries de la côte ouest et sont mises à fixer dans des bacs en béton contenant des poches remplies de vieilles coquilles d'huîtres propres du Pacifique. Une fois que les coquilles sont suffisamment recouvertes de jeune naissain - quelques jours après - elles sont transférées en nourricerie pour le prégrossissement.
(i) Les huîtres
Les surfaces de fixation peuvent correspondre aux parois des bacs larvaires - voire directement aux bacs de géniteurs dans le cas particulier des larves de Tiostrea - ou à des bacs spéciaux dédiés à cette tâche. Ceci quand 50 pour cent ou plus des larves d'Ostrea et/ou de Crassostrea sont au stade oeillée. Les écloseries procèdent souvent à la sélection des larves de plus grande taille dans chaque lot pour la fixation, en tamisant les pédivéligères sur un tamis de 240 mm (retenant les larves dont la longueur de coquille varie entre 300 et 340 mm) en laissant le restant croître et se développer d'avantage. A la fixation, les densités appropriées de larves d'huîtres par unité de volume varient entre 2 000 et 5 000 par litre bien que la surface de fixation soit le critère le plus important. Le matériel couramment utilisé pour fournir de grandes surfaces de fixation comporte:
a) des feuilles en PVC légèrement rugueuses, pouvant être empilées verticalement dans la colonne d'eau en séparant chaque feuille des autres par un espace, ou une seule feuille placée à la base du bac. (Une feuille, en PVC en forme de tuile de toit semi cylindrique, est aussi parfois utilisée.)
b) Des couches de brisure, préparées à partir de vieilles coquilles d'huîtres propres étalées à la base des plateaux de fixation. Ce matériel particulier est trié de façon à ce que seuls les fragments passant à travers un tamis de 500 mm mais retenues sur un tamis de 250 mm soient utilisés.
c) Des tas, des poches, ou des cordes de vieilles coquilles d'huîtres propres sont disposés dans la colonne d'eau, le plus souvent dans les bacs de fixation.
d) Divers matériels en plastique ou en céramique enrobés de ciment (mélange chaux/mortier). A titre d'exemple, des piles de collecteurs de type «chapeau chinois» en plastique enduits de ciment sont utilisées pour fixer le naissain d'huîtres dans des grands bacs. Une fois atteint une taille convenable, le naissain peut être transféré en tournant et fléchissant les collecteurs pour casser le revêtement en ciment.
Les larves ont tendance à se fixer et s'attacher plus rapidement sur des surfaces ombragées au verso du matériel utilisé comme substrat dans des bacs peu profonds. Une faible intensité lumineuse provenant d'une lampe à tungstène (60W), placée en dessus de bacs profonds, encouragera les larves à se fixer au fond des aires les plus ombragées (figure 86A et B). L'attraction des larves vers des aires de collectage étendue peut être améliorée en induisant les surfaces de fixation par des extraits de chair d'huîtres homogénéisées. Ultérieurement les collecteurs sont séchés à l'air libre avant de les placer dans les bacs de fixation. En effet, les larves ont un comportement grégaire et vont avoir tendance à se fixer là où les autres se sont déjà attachées. Les collecteurs en PVC deviennent plus performants pour le captage au fil du temps. Quand ils sont suffisamment âgés ils n'ont plus besoin d'être enduits d'extrait.

Figure 86: A et B - Dans cet exemple, des feuilles en PVC à surface matte utilisées comme substrat de fixation de naissain d'huître sont placées dans le fond des bacs d'élevage larvaire (A). Les bacs sont éclairés par des lampes de tungstène placées au dessus pour accélérer la fixation. Les collecteurs sont examinés plusieurs fois par jour (B) et quand la fixation est suffisante, le naissain récemment fixé est précautionneusement détaché au rasoir. C et D - Le personnel d'une écloserie d'huîtres à Cuba mettant sur corde des coquilles d'huîtres de mangrove sur des sections de nylon tressé (C). Ces cordes sont placées dans des bassins en béton contenant un nombre suffisant de larves oeillées pour permettre l'obtention de la quantité exigée de naissain (D). Des bacs de culture larvaire en grands volumes peuvent être aperçus derrière les bacs de fixation dans la photo D.
Les méthodes (a) et (b) mentionnées ci-dessus sont utilisées pour produire ce qu'on appelle du «naissain un à un». Celui-ci (naissain qui n'est plus attaché à un substrat ou collé à un fragment de coquille) peut donc être cultivé comme des individus disjoints jusqu'à la taille commerciale pour alimenter le marché des huîtres à demi décoquillée. Par contre, les postlarves survivantes captées sur coquille vont se développer ensemble et leurs coquilles vont fusionner et former ainsi un paquet et ne servent alors que pour l'extraction de la chair après récolte.
Pour fournir du naissain un à un quand des feuilles collectrices en PVC sont utilisées, le naissain nouvellement fixé a besoin d'être décollé des parois par une lame dans les 24 heures de son attachement. Ceci est fait en immergeant la feuille dans un plateau peu profond contenant de l'eau de mer et en grattant doucement la surface avec une lame de rasoir, montée sur un support adapté, en aspergeant la lame avec un jet d'eau de mer. Le nombre de naissain enlevé peut être estimé en utilisant la même méthode que celle utilisée pour estimer les larves (section 5.1.2.3). Ils sont donc transférés en écloserie pour être placés dans un système de micronourricerie.
Comme mentionné antérieurement, les larves oeillées d'huîtres peuvent être stimulées pour déclencher la métamorphose sans fixation en utilisant des neurotransmetteurs, l'adrénaline. Cela implique la dissolution de 0,1832 g d'adrénaline dans un peu d'acide hydrochlorique à 10 pour cent dilué dans 10 litres d'eau de mer, volume suffisant pour traiter 2 millions de larves oeillées. Les larves ayant la taille de fixation sont exposées à ce traitement pendant 60-90 minutes et sont replacées en bacs d'élevage. Au renouvellement d'eau suivant, les larves métamorphosées qui ont démarré leur croissance postlarvaire sont séparées de celles qui sont encore au stade larvaire en les retenant dans des tamis de maille de 270 mm. Seules les larves qui sont prêtes à se fixer de façon imminente répondront à ce traitement et achèveront leur métamorphose sans fixation. Les larves qui ne répondent pas à ce traitement sont saines et peuvent être traitées une deuxième fois un ou deux jours plus tard. Cette méthode de traitement peut être utilisée en présence ou absence de collecteurs (normalement avec).
Les taux de survie après fixation chez les huîtres sont généralement élevés avec 50-70 pour cent de celles qui se fixent en atteignant 2 mm de longueur de la coquille.
(ii) Les pectinidés
A l'encontre des larves d'huître, les pédivéligères oeillées de pectinidés sécrètent un byssus d'attachement aux surfaces sur lesquelles elles se posent. Dans la nature elles s'attachent sur des algues rouges filamenteuses, des hydrozoaires, des bryozoaires et des tubes de polychètes, et sur d'autres substrats vivants ou inertes. Des filets en polyéthylène, ou en nylon et autres matériaux filamenteux du même type constituent des substituts satisfaisants en écloserie. Les pedivéligères oeillées peuvent être mises en métamorphose dans des bacs larvaires ou dans des bacs de fixation dédiés à cette tâche, soit en eau stagnante soit en flux ouvert. Dans ce dernier système, un tamis doit être placé en sortie pour maintenir les larves dans le bac. Les larves, pedivéligères et jeunes postlarves de pectinidés, sont particulièrement fragiles le transfert des bacs larvaires au stade oeillé vers des bacs de fixation est communément pratiqué. Ceci à une taille bien plus petite que les larves d'huître - 220 à 240 mm vs 300 à 340 mm. Des exemples de type de bacs adaptés à la fixation et de collecteurs sont présentés en figures 87 et 88.
Les pedivéligères de pectinidés peuvent être mises en métamorphose à des densités variant entre 1 000 et 2 000 par litre dans des bacs remplis de collecteurs en eau stagnante, renouvelée ou en flux ouvert. L'exemple illustré de la figure 87 présente des bacs circulaires de poissons de 450 litres en fibre de verre (A) équipés d'une vanne de vidange à leur base et de tuyaux verticaux. Des ballots de filets en plastique (B) sont placés de façon désordonnée dans le(s) bac(s) (C) ou enfermés dans des sacs «d'oignon» à maille fine et suspendus dans la colonne d'eau (D). Le naissain se fixe principalement sur le filet noir (E). Le tuyau en plastique visible au dessus de la surface d'eau, clairement illustré en D, constitue une des parties d'un système d'air lift. Chaque tuyau vertical est équipé d'une sortie d'air placée à sa base. Lorsque le débit d'air est activé, l'eau est soulevée à partir de la base du bac et retourne dans ce dernier par l'intermédiaire de petits orifices percés au niveau de tuyaux de distribution placés au dessus du bac. En fonctionnement, le niveau d'eau dans le bac couvre à moitié les tuyaux de distribution.
Les bacs de fixation sont traités comme les bacs d'élevage larvaire au cours des 6 à 8 premiers jours après adjonction des pédivéligères. L'eau est changée 3 fois durant cette période par vidange à travers un tamis retenant les larves nageuses restantes (noter les vannes de vidange visibles dans la figure 87A). En même temps, l'eau de mer filtrée est ajoutée à un débit qui compense l'eau sortante et maintient l'eau à un niveau constant, en empêchant les larves fixées d'être en contact avec l'air. Cet échange d'eau est continu pendant 30 à 45 minutes. Le nombre de larves retenues sur le tamis, leur taux de survie et le nombre de naissain métamorphosé mais non attaché est estimé avant d'être retourné au bac. Les bacs sont faiblement aérés durant cette période et sont alimentés de la même façon qu'au cours de l'élevage larvaire.

Figure 87: Les pedivéligères de pectinidés peuvent être mises en métamorphose à une densité optimale de 2 000 par litre dans des bacs remplis de collecteurs et fonctionnant en eau stagnante ou en flux ouvert. Le système illustré est développé à la Station de Recherche Biologique des Bermudes, Inc. et est appliqué à Argopecten gibbus et Pecten ziczac. Voir texte pour le détail des étapes impliquées.
A l'issue de cette première semaine, l'air lift est activé et la température de l'eau dans le bac est graduellement diminuée pendant quelques jours pour atteindre la température ambiante. Les bacs fonctionnent alors selon un système en flux ouvert avec apport continu d'eau de mer maintenue à la température ambiante et avec un débit autorisant le renouvellement du volume du bac 3 à 4 fois par jour. L'air lift est maintenu et la nourriture est donc apportée de manière continue. Trois semaines après l'introduction des pédivéligères les plus grandes postlarves attachées mesurent 2 mm de hauteur de coquille (figure 87E).
Le processus décrit ci-dessus est essentiellement une adaptation par l'écloserie de la technique de captage dite «sac d'oignon» utilisée pour le collectage de naissain en mer. Une autre approche consiste à fixer les pédivéligères dans des tamis carrés ou cylindriques équipés d'une maille adaptée (120 à 150 mm). Les tamis sont installés dans des bacs peu profonds dans lesquels de l'eau de mer enrichie en microalgues est apportée en flux ouvert ou recirculé (figure 88).

Figure 88: A - Tamis cylindriques à maille nylon pour la fixation des pédivéligères des pectinidés à la Station de recherche biologique des Bermudes, Inc. Les tamis sont partiellement immergés dans des bacs type raceway peu profonds à travers lesquels l'eau peut être soit recyclée ou rejetée directement. Chaque tamis reçoit un flux descendant d'eau de mer enrichie en microalgues. B - L'apparence du naissain âgé de 3 semaines d'Argopecten gibbus attachés à la maille du tamis. Une grille graduée en cm2 a été placée en dessous de la maille pour indiquer l'intensité de la fixation et l'estimation du nombre de naissain.
Les pedivéligères sont distribuées dans des tamis à une densité optimale de 100 par cm2 de la superficie de la maille du tamis. A titre d'exemple, un diamètre interne de 25 cm avec une superficie de tamis d'approximativement 500 cm2 peut contenir jusqu'à 50 000 pedivéligères. La disponibilité en place pour la fixation, la métamorphose et la croissance des postlarves est critique dans la détermination de la densité initiale en pedivéligères. Le naissain est mobile et répondra à la surdensité en brisant son byssus et en nageant à la recherche d'une zone de fixation moins dense pour se rattacher. Des altérations tissulaires conduisant à des mortalités peuvent se produire si les postlarves s'entrechoquent et entrecroisent leurs valves.
Différentes adaptations de la technique de fixation de pedivéligères de pectinidés dans des tamis peu profonds sont utilisés en Europe pour Pecten maximus.
Chez les pectinidés les taux de survie à la fixation ne sont pas normalement très élevés; 15 à 30 pour cent de postlarves de 2 mm de hauteur de coquille par rapport au nombre initial de pedivéligères sont considéré comme normal. La méthode de fixation en tamis conduit à une meilleure survie (figure 88) mais le taux de croissance est supérieur avec des collecteurs suspendus de type poche ou sac d'oignon (figure 87). Ceci est probablement lié à la plus grande disponibilité spatiale d'une surface de fixation conséquente répartie dans tout le volume du bac.
(iii) Palourdes et moules
Les larves de palourde ont un comportement de recherche de substrat à une taille (longueur de coquille) similaire à celle des larves de pectinidés (220 à 240 mm). Elles s'attachent également aux parois et fond des bacs et entre elles, par leurs filaments de byssus. A ce stade leur transfert en bac de fixation jusqu'à métamorphose complète, comme dans l'exemple de la figure 88 est recommandé. Sinon, elles peuvent rester dans les bacs larvaires jusqu'à ce que la fixation soit achevée. Cependant, comme elles ont une taille et un comportement similaire aux pedivéligères de pectinidés, des densités similaires peuvent être utilisées par unité de surface de tamis. Bien que dans la nature les palourdes adultes vivent enfouies dans le sédiment il n'est pas nécessaire de leur fournir un substrat tant que le naissain n'excède pas 7 mm de longueur. Le naissain fixé peut être décollé des parois et fond par un jet d'eau.
Les moules s'attachent aussi grâce à des filaments du byssus, mais plus fortement que les pectinidés. Comme les palourdes, elles conservent cette capacité d'attachement durant toute leur vie. De part leur plus faible valeur marchande, par rapport aux huîtres, pectinidés et la plupart des palourdes commerciales, sa production en écloserie est plus rare. Le naissain de moules est normalement collecté dans la nature même si sa production en écloserie commence à présenter un intérêt sur la côte ouest des Etats-Unis d'Amérique et en Nouvelle-Zélande. Le même type de matériel que celui utilisé pour la collecte du naissain sauvage peut être utilisé en écloserie, cordes, filets, poches en plastique. Le type de système illustré dans la figure 87 correspondant à des bacs profonds est tout aussi approprié pour la fixation des moules qu'il l'est pour les pectinidés.
Dans le chapitre suivant on verra comment le naissain une fois fixé est cultivé.
Bayne, B.L. 1969. The gregarious behaviour of the larvae of Ostrea edulis L. at settlement. J. Mar. Biol. Assoc. UK, 49: 327-356
Bourne, N., Hodgson, C.A. et Whyte, J.N.C. 1989. A Manual for Scallop Culture in British Columbia. Canadian Tech. Rep. Fish and Aquatic Sciences, No. 1694: 215 pp.
Breese, W.P. et Malouf, R.E. 1975. Hatchery manual for the Pacific oyster. Sea Grant Program Publ., No. ORESU-H-75-002. Oregon State Univ., Corvallis, Oregon, USA: 22 pp.
Brown, C. et Roland, A. 1984. Characterization of exotoxin produced by a shellfish pathogenic Vibrio sp. J. Fish Diseases, 7: 1-10
Brown, C. et Russo, D.J. 1979. Ultraviolet light disinfection of shellfish hatchery sea water: (1) elimination of five pathogenic bacteria. Aquaculture, 17: 17-23
Calabrese, A. et Davis, H.C. 1970. Tolerances and requirements of embryos and larvae of bivalve molluscs. Helgol. Wiss. Meeresunters., 20: 553-564
Castagna, M. et Manzi, J.J. 1989. Clam culture in North America: hatchery production of nursery stock clams. p 111-125. In: Manzi, J.J. & Castagna, M. (eds) Clam Mariculture in North America. Developments in Aquaculture and Fisheries Science, 19. Elsevier, Amsterdam, Oxford and New York.
Chu, F.-L.E., Webb, K.L., Hepworth, D., Barrett, D.B. et Roberts, M. 1983. Growth and fatty acid composition of oyster larvae. In: (eds: Pruder, G.D., Langdon, C. & Conklin, D.) Proceedings of the 2nd International Conference on Aquaculture Nutrition: Biochemical and Physiological Approaches to Shellfish Nutrition, October 1981, Rehoboth Beach, Delaware. Louisiana State University Press, Baton Rouge: 426 (abstract)
Coon, S.L., Fitt, W.K. et Bonar, D.B. 1990. Competency and delay of metamorphosis in the Pacific oyster, Crassostrea gigas (Thunberg). Mar Biol., 106: 379-387
Coon, S.L. et Weiner, R.M. 1985. Induction of settlement and metamorphosis of the Pacific oyster, Crassostrea gigas (Thunberg) by L-DOPA and catecholamines. J. Exp. Mar. Biol. Ecol., 94: 211-221
Couturier, C., Dabinett, P. et Lanteigne, M. 1995. Scallop culture in Atlantic Canada. p 297-340. In: Boghen, A.D. (ed) Cold-Water Aquaculture in Atlantic Canada. The Canadian Institute for Research on Regional Development, Moncton, Canada: 672 pp.
Crisp, D.J., Yule, A.B. et White, K.N. 1985. Feeding of oyster larvae: The functional response, energy budget and a comparison with mussel larvae. J. Mar. Biol. Assoc. UK, 65: 759-783
DiSalvo, L.H., Bleoka, J. et Zebal, R. 1978. Vibrio anguillarum and larval mortality in a California coastal shellfish hatchery. Appl. Environ. Microbiol., 35: 219-221
Elston, R. et Leibovitz, L. 1980. Pathogenesis of experimental vibriosis in larval American oysters, Crassostrea virginica. Can. J. Fish. Aquat. Sci, 37: 964-978
Elston, R., Leibovitz, L., Relyea, D. et Zatila, J. 1981. Diagnosis of vibriosis in a commercial oyster hatchery epizootic: diagnostic tools and management features. Aquaculture, 24: 53-62
Gabbott, P.A. et Holland, D.L. 1973. Growth and metabolism of Ostrea edulis larvae. Nature, London, 241: 475-476
Gallager, S.M., Mann, R. et Sasaki, G.C. 1986. Lipid as an index of growth and viability in three species of bivalve larvae. Aquaculture, 56: 81-103
Helm, M.M. 1971. The effect of sea water quality on the laboratory culture of Ostrea edulis L. larvae. International Council for the Exploration of the Sea. ICES. CM 1971/K:28: 11 pp.
Helm, M.M. 1977. Mixed algal feeding of Ostrea edulis larvae with Isochrysis galbana and Tetraselmis suecica. J. Mar. Biol. Assoc. UK, 57: 1019-1029
Helm, M.M. 1986. Effects of nutrition on larval production in the European oyster, Ostrea edulis. Proceedings 14th Meeting on Environment and Resources: Applications and Perspectives in Aquaculture, Albarella (RO), Italy, 20-28 September 1986: 12 pp.
Helm, M.M. 1990a. Moderna progettazione e gestione di schiuditoi per molluschi bivalvi e nuovi sviluppi (Hatchery design and general principles of operation and development). pp. 65-87. In: Alessandra, G. (ed) Tapes philippinarum: Biologia e Sperimentazione. Ente Svillupo Agricolo Veneto, Venice, Italy: 299 pp. (Italian and English text)
Helm, M.M. 1990b. Managing Production Costs - Molluscan Shellfish Culture. pp. 143-149. Congress Proceedings, Aquaculture International, September 4-7, 1990, Vancouver, BC, Canada: 480 pp.
Helm, M.M. 1991. Development of industrial scale hatchery production of seed of the mangrove oyster, Crassostrea rhizophorae, in Cuba. Food and Agriculture Organization of the United Nations. FAO: TCP/CUB/8958: 46 pp.
Helm, M.M. 1994. Towards reliable bivalve seed supply in Nova Scotia. Bull. Aquacul. Assoc. Canada 94 (4): 9-14
Helm, M.M., Holland, D.L. et Stephenson, R.R. 1973. The effect of supplementary algal feeding of a hatchery breeding stock of Ostrea edulis L. on larval vigour. J. Mar. Biol. Assoc. UK, 53: 673-684
Helm, M.M., Holland, D.L., Utting, S.D. et East, J. 1991. Fatty acid composition of early non-feeding larvae of the European flat oyster, Ostrea edulis L. J. Mar. Biol. Assoc. UK, 71: 691-705
Helm, M.M. et Laing, I. 1987. Preliminary observations on the nutritional value of Tahiti Isochrysis to bivalve larvae. Aquaculture 62: 281-288
Helm, M.M. et Millican, P.F. 1977. Experiments in the hatchery rearing of Pacific oyster larvae (Crassostrea gigas Thunberg). Aquaculture, 11: 1-12
Holland, D.L. et Spencer, B.E. 1973. Biochemical changes in fed and starved oysters, Ostrea edulis L., during larval development, metamorphosis and early spat growth. J. Mar. Biol. Assoc. UK, 53: 287-298
Huggins, W.L., Helm, M.M. et Williams, D.R. 1987. Automatic control of food supply in the culture of filter feeding organisms. Aquacultural Engineering, 6: 259-275.
Inamura, H., Nakai, T. et Muroga, K. 1985. An extracellular protease produced by Vibrio anguillarum. Bull. Jap. Soc. Sci. Fish., 51: 1915-1920
Jeffries, V.E. 1983. Three Vibrio strains pathogenic to larvae of Crassostrea gigas and Ostrea edulis. Aquaculture, 29: 201-226
Jespersen, H. et Olsen, K. 1982. Bioenergetics in veliger larvae of Mytilus edulis L. Ophelia, 21: 101-113
Jia, J. et Chen, J. 2001. Sea farming and sea ranching in China. FAO Fisheries Tech. Paper, No 418, Food and Agriculture Organization, UN, Rome: 71 pp.
Knottage, A.S. et Birkbeck, T.H. 1986. Toxicity to marine bivalves of culture supernatant fluids of the bivalve-pathogenic Vibrio strain NCMB 1338 and other marine vibrios. J. Fish Diseases, 9
Lewis, T.E., Garland, C.D. et McMeekin, T.A. 1986. Manual of hygiene for shellfish hatcheries. Department of Agricultural Science, University of Tasmania. University of Tasmania Printing Dept., Hobart, Tasmania: 45 pp.
Loosanoff, V.L. et Davis, H.C. 1963. Rearing of bivalve mollusks. Advances in Marine Biology, 1, Academic Press Ltd, London: 1-136
Lovatelli, A. 1985. Conditions for the culture of clam larvae with particular reference to Tapes semidecussatus (Reeve). M.Sc. Thesis. Plymouth Polytechnic, UK: 179 pp.
Malouf, R.E. et Breese, W.P. 1977. Food consumption and growth of larvae of the Pacific oyster, Crassostrea gigas (Thunberg), in a constant flow rearing system. Proc. Nat. Shellfish Assoc., 67: 7-16
Manahan, D.T. et Crisp, D.J. 1982. The role of dissolved organic material in the nutrition of pelagic larvae: amino acid uptake in bivalve veligers. Amer. Zool., 22: 635-646
Moreno, J.E.A., Moreno, V.J. et Brenner, R.R. 1976. Lipid metabolism of the yellow clam, Mesoderma mactroides: 2 - polyunsaturated fatty acid metabolism. Lipids, 11, 561-566
Munn, C.B. 1978. Haemolysin production by Vibrio anguillarum. FEMS Microbiol. Letters, 3: 265-268
Roland, W.G. et Broadley, T.A. 1990. A manual for producing oyster seed by remote setting. Province of British Columbia, Ministry of Agriculture and Fisheries, Victoria, BC, Canada: 58 pp.
Strickland, J.D.H. et Parsons, T.R. 1968. A practical handbook of seawater analysis. Bull. Fish. Res. Board of Canada. 167: 1-311
Sverdrup, H.U., Johnson, M.W. et Fleming, R.H. 1942. The Oceans: their Physics, Chemistry and General Biology. Prentice-Hall, New York: 1087 pp.
Tubiash, H.S., Chanley, P.E. et Leifson, E. 1965. Bacillary Necrosis: A Disease of Larval and Juvenile Bivalve Mollusks: 1. Etiology and Epizootiology. J. Bacteriol., 90: 1036-1044
Utting, S.D. et Helm, M.M. 1985. Improvement of seawater quality by physical and chemical pre-treatment in a bivalve hatchery. Aquaculture. 44: 133-144
Utting, S.D. et Spencer, B.E. 1991. The hatchery culture of bivalve mollusc larvae and juveniles. Lab. Leafl., MAFF Fish. Res., Lowestoft, No. 68: 31 pp.
Waldock, M.J. et Holland, D.L. 1984. Fatty acid metabolism in young oysters, Crassostrea gigas: polyunsaturated fatty acids. Lipids, 19: 332-336
Waldock, M.J. et Nascimento, I.A. 1979. The triacylglycerol composition of Crassostrea gigas larvae fed on different diets. Marine Biology Letters, 1: 77-86
Walne, P.R. 1974. Culture of Bivalve Molluscs. Fishing News (Books) Ltd, Surrey, England: 189 pp.
Webb, K.L. et Chu, F.-L.E. 1983. Phytoplankton as a source of food for bivalve larvae. In: (eds: Pruder, G.D., Langdon, C. & Conklin, D.) Proceedings of the 2nd International Conference on Aquaculture Nutrition: Biochemical and Physiological Approaches to Shellfish Nutrition, October 1981, Rehoboth Beach, Delaware. Louisiana State University Press, Baton Rouge: 272-291
Wilson, J.H. 1979. Observations on the grazing rates and growth of Ostrea edulis L. larvae when fed algal cultures of different ages. J. Exp. Mar. Biol. Ecol., 38: 187-199
Whyte, J.N.C. 1987. Biochemical composition and energy content of six species of phytoplankton used in mariculture of bivalves. Aquaculture, 60: 231-241
Whyte, J.N.C., Bourne, N. et Hodgson, C.A. 1987. Assessment of biochemical composition and energy reserves in larvae of the scallop Patinopecten yessoensis. J. Exp. Mar. Biol. Ecol., 113: 113-124
Zaroogian, G.E., Pesche, G. et Morrison, G. 1969. Formulation of an artificial sea water media suitable for oyster larvae development. Amer. Zool., 9: 1144
Zimmer-Faust, R.K. et Tamburri, M.N. 1994. Chemical identity and ecological implications of a waterborne larval settlement cue. Limnol. Oceanogr., 39: 1075-1087