por
E.E. Boschi y M.A. Scelzo2
Instituto de Biología Marina
Mar del Plata, Argentina
Extracto
El trabajo trata sobre el desarrollo larval y cultivo del camarón comercial de Argentina Artemesia longinaris, en condiciones de laboratorio. Se dan detalles de las técnicas utilizadas, tanto del filtrado de agua, de los métodos para llevar a cabo los cultivos de fitoplancton, de la alimentación de los distintos estadios larvales, postlarvales y juveniles y se dan datos sobre los resultados del crecimiento de dos lotes de camarones criados en cautividad hasta cerca de 70 mm de longitud. Otra parte del trabajo se refiere al desarrollo embrionario y larval del camarón. Se exponen caracteres morfológicos de 13 estadios y subestadios larvales y también de la mysis-postlarva, postlarvas y juveniles. Finalmente se discute la posibilidad de cultivar en mayor escala tanto el camarón, Artemesia longinaris, como el langostino, Hymenopenaeus muelleri, en la Argentina y se dan detalles del proyecto elaborado para llevarlo a cabo.
Abstract
This paper deals with the larval development and the laboratory culture of the Argentine commercial shrimp, Artemesia longinaris. Detailed information is given on the utilized techniques, e.g., water filtration, culture of phytoplankton, and feeding of the larvae in different stages of postlarval and juvenile development. Results of the growth of two lots of shrimps reared in the laboratory to 70 mm in length are also analysed. The embrionic and larval development of the shrimp is described; the morphological characteristics of 13 stages and substages of larvae, mysis-postlarvae, postlarvae and juveniles are reported. The possibility of the cultivation of two penaeid species, Artemesia longinaris and Hymenopenaeus muelleri, on greater scale in Argentina, and details for the carrying out of this programme are given.
1 Contribución del Instituto de Biología Marina No. 264
2 Investigadores del Consejo Nacional de Investigaciones Científicas y Técnicas de Argentina
1. INTRODUCCION
Las investigaciones sobre el desarrollo larval y descripción morfológica de los diferentes estadios y subestadios de la principales especies de crustáceos decápodos del litoral bonaerense han sido encaradas por los autores desde 1965 (Boschi y Scelzo, 1967). Las primeras etapas se cumplieron con la finalidad de conocer el ciclo vital de las especies en estudio, reconocer su presencia en las muestras de plancton y poder estimar la abundancia. Las características de las larvas, a su vez, hicieron posible apoyar interpretaciones filogenéticas y vinculaciones entre las distintas estirpes de Decapoda en estudio.
Sobre la base de estas líneas de investigación se continuó la labor en forma ininterrumpida en el Laboratorio de Carcinología del Instituto de Biología Marina. En los últimos años se concentraron los trabajos sobre las principales especies de interés comercial de la región, particularmente sobre el langostino (Hymenopenaeus muelleri) y el camarón (Artemesia longinaris) (Fig. 1). La gran demanda de estos peneidos en el mercado de consumo, así como las continuas fluctuaciones en las capturas comerciales en las regiones tradicionales de pesca, han exigido que los trabajos se intensifiquen en distintos aspectos, razón por la que que se llevaron a cabo campañas de pesca exploratoria en distintas regiones del litoral argentino (Boschi y Scelzo, 1967; 1969; 1971) y se dio especial énfasis a las investigaciones de los estadios larvales en muestras de plancton (Cienchomski y Boschi, 1968; Scelzo, 1971) y al desarrollo larval en el laboratorio.
La idea básica de estas investigaciones, referente al cultivo de los peneidos comerciales mencionados, ha sido desarrollar técnicas convenientes para la crianza de estas especies en aguas templadas, establecer los requerimientos en distintas fases de su vida larval, postlarval y juvenil, tanto de alimentación como ambientales, con el fin de poseer la mayor información posible que permita conocer los factores que rigen el crecimiento y supervivencia de los mismos en cultivos artificiales.
El estado actual de las investigaciones ha permitido lograr el desarrollo larval de ambas especies en el laboratorio y particularmente con el camarón se han podido llevar a cabo el mayornúmero de experiencias hasta el momento, relativas al cultivo en piletas y estanques de 100 a 200 l, criando en forma masiva un número relativamente elevado de larvas y postlarvas, las cuales han alcanzado más de 70 mm de longitud total en pocos meses.
En el presente trabajo se exponen, por lo tanto, los resultados relativos al desarrollo del camarón Artemesia longinaris Bate, 1888, Penaeidae; incluyendo algunos estadios embrionarios, todos los estadios y subestadios larvales, postlarvales y juveniles, así como la descripción de las técnicas usadas en el laboratorio, en el transcurso de los años 1972, 1973 y 1974.
Los resultados obtenidos, muy alentadores por cierto, en cuanto al cultivo de estas especies, han permitido prever la posibilidad de desarrollar su crianza en ambientes semi-naturales y a escala mayor. Para tal fin se ha planeado la instalación de una Estación de Maricultura en las proximidades de la Albufera Mar Chiquita, a 40 km del Instituto de Biología Marina, cuyo proyecto ha sido elevado, por intermedio de la Comisión de Investigaciones Científicas de la Provincia de Buenos Aires, al Ministerio de Economía de la misma provincia.
2. ANTECEDENTES
Los estudios sobre las larvas de los crustáceos decápodos comenzaron hace muchos años, cuando Thompson en 1830 descubrió que la zoea y la megalopa eran estadios larvales de un crustáceo. Los primeros antecedentes están reunidos en los libros de Gurney (1939, 1942), obras básicas de consulta para todos los estudiosos del desarrollo de los Decapoda.
Otro trabajo de gran importancia ha sido el de Pearson (1939), que trató varias especies de peneidos comerciales (gran parte de estos estudios han sido realizados con muestras de plancton, pero significó un gran adelanto en las investigaciones sobre los estadios larvales de estas especies). También la obra de Heldt (1938) y otras contribuciones de la autora, han sido los primeros aportes en esta línea de relevante valor.
Es indudable que las investigaciones de Hudinaga (1935 y 1942) y colaboradores han abierto un nuevo camino en los estudios sobre el desarrollo larval de los crustáceos. Este investigador japonés fue uno de los primeros que logró el cultivo de camarones peneidos. Sus trabajos comenzaron en 1933 y en 1967 obtuvo producción a escala comercial de Penaeus japonicus. Es evidente que todos los que han seguido estas líneas de trabajo, han utilizado básicamente los mismos procedimientos. En nuestros trabajos además nos ha sido muy útil la obra de Dobkin (1971) que trata sobre el desarrollo de Penaeus duorarum duorarum, obtenido en muestras de plancton y el trabajo de Cook y Murphy (1961) sobre técnicas de cultivo de laboratorio.
3. MATERIAL Y METODOS
3.1 Acuarios y tanques
Las experiencias y trabajos de laboratorio sobre el cultivo del camarón y del fitoplancton destinado a la alimentación de las larvas y postlarvas, se han llevado a cabo en acuarios de vidrio y tanques de polietileno (Fig. 2)1. Los acuarios de paredes de vidrio y armazón de acero o hierro en ángulo utilizados en los trabajos han sido de dimensiones variables, entre 60 y 100 cm de lado, por una altura variable entre 30 y 40 cm. En el ángulo interno de los acuarios se aplicó cemento flexible a base de siliconas para evitar pérdidas das de agua, asegurar la duración del mismo y evitar todo contacto del agua de mar con la masilla o metal (Boschi, 1972).
Los recipientes de polietileno de 70 × 40 × 45 cm de lado y los de 100 × 60 × 50 cm de lado, resultaron muy útiles para el cultivo externo e interno de fitoplancton y el mantenimiento de larvas y postlarvas. Estos recipientes son fáciles de lavar y de transportar y se han adaptado perfectamente a estos trabajos.
3.2 Filtros para el agua de mar
Uno de los aspectos más importantes en los trabajos de cultivo y desarrollo larval de los camarones peneidos, es la calidad del agua y ello depende en gran medida, de la eficiencia del sistema de filtrado de la misma. Partiendo de este criterio se han ensayado y empleado varios tipos de filtros, inspirados en modelos utilizados en otras instituciones (Mock y Murphy, 1971; Cook y Murphy, 1966), pero con algunas modificaciones o adaptaciones condicionadas por nuestros propósitos de trabajo y por las posibilidades de empleo de material disponible localmente (Boschi, 1972).
Todos los acuarios o tanques destinados a recibir los huevos de camarón fueron equipados con el sistema de filtro de circuito cerrado y de funcionamiento continuo. Ello aseguró una permanente limpieza y pureza del agua. Los filtros que dieron mejor resultado en estas experiencias han sido el sistema de tubos de PVC perforados, formando una trama que cruza el fondo del acuario. Los tubos PVC son cubiertos con conchilla de ostra machacada y sobre ésa se agregan 5 ó 6 cm de arena fina. Previamente este substrato se lava concienzudamente con agua para eliminar impurezas y organismos indeseables.
El filtro funciona mediante la acción de una simple bomba de agua construida con dos tubos verticales unidos en su base. El de mayor sección recibe del más fino una corriente de aire, cuyas burbujas al ascender arrastran el agua, produciendo una circulación constante de ambos flúidos. Este sistema es muy eficiente y práctico, lográndose mantener una permanente transparencia del agua y circulación. La circulación del agua originada por la bomba hace que el líquido fluya permanentemente a través del substrato y sea absorbido por las perforaciones de los tubos de PVC, de donde es arrastrada hacia la bomba (Fig. 2).
También se ha empleado un sistema de filtro mixto, externo e interno, en el cual el elemento filtrante, con conchillas de ostra está fuera del tanque y la boca de absorción de aguas se ubica en el interior del mismo (Fig. 2). La ventaja de este procedimiento es que se evita mantener el acuario con substrato de arena, obviando con ello la proliferación de protozoarios, bacterias, etc., que pueden impurificar y contaminar el agua. El recipiente externo lleva en su interior un tamiz de malla de 50 μ y un cilindro con tapa de base perforada lleno de conchilla de ostra, que tiene la función de filtrar el agua. Este recipiente se puede desarmar fácilmente para su limpieza. La circulación del agua se realiza mediante el mismo sistema de bombas descrito anteriormente.
3.3 Agua de mar
Las aguas marinas que bañan las costas de Mar del Plata no son totalmente aptas, dado el grado de contaminación, para el desarrollo y cultivo de camarones peneidos en las fases de huevo y larva. Por otra parte no es nuevo el hecho de que las aguas marinas costeras resultan poco aptas para el cultivo de animales marinos oceánicos, como lo ha comprobado Ewald (1965) para Penaeus duorarum en Florida, EE.UU.
Esta dificultad exige dedicar especial atención al mejoramiento del agua que se emplea en los cultivos y los medios o sistemas de filtración y purificación. Como primera medida, se utilizó, en nuestros trabajos, agua obtenida por lo menos a unas 5 ó 6 millas de la costa y cuando fue posible en alta mar. El agua fue recogida en recipientes de polietileno de 50 l y transportada al laboratorio, para luego ser filtrada a través de membranas de 8,0 μ con el uso simultáneo de un prefiltro de fibra de vidrio que retuvo las partículas mayores. El agua de mar lograda por este procedimiento fue colocada en los acuarios previamente preparados.
El agua costera ha demostrado ser apta si previamente se la deja envejecer aproximadamente unos 10 a 15 días, en los mismos recipientes de polietileno. Al agua de mar siempre se le agrega 1 g por cada 100 l, de EDTA (ácido etilendiaminotetracético sal disódica). Este compuesto es un quelante que tiene la finalidad de incorporar a su molécula algunos metales y liberar otros. La salinidad del agua empleada osciló entre 33,4 y 33,9 por mil, donde fueron obtenidas las hembras maduras; el oxígeno se mantuvo siempre a nivel de saturación.
3.4 Temperatura
La temperatura del agua durante el curso de los experimentos osciló considerablemente. Los trabajos se iniciaron con temperatura de 16–19°C, en el momento de producirse algunos desoves, elevándose luego hasta 24°C en el transcurso del desarrollo larval. Los juveniles vivieron perfectamente a temperaturas entre 25 y 26°C. La temperatura del mar en la región nunca excede los 23°C.
3.5 Obtención de reproductores
Las hembras maduras y próximas al desove han sido obtenidas en la zona de pesca de arrastre frente a la Ciudad de Mar del Plata, 28°S, particularmente en el sector de Playa Grande y Cabo Corrientes. Las hembras impregnadas se presentan en esta zona en los meses de primavera y principios de verano, esto es entre septiembre y mediados de diciembre de cada año. La talla comercial de esta especie oscila entre 60 y 145 mm de longitud total.
Para la captura de las hembras se ha empleado una lancha de pesca comercial de la región, arrastrando entre 10 y 20 minutos con un ranío o red de barra (beam trawl), con el objeto de obtener animales en buenas condiciones vitales. Las hembras que mostraron el ovario oscuro, fácilmente visible a través del caparazón, fueron seleccionadas y apartadas en recipientes de 50–100 l, renovando permanentemente el agua para evitar que se eleva la temperatura. En todos los casos las hembras están fecundadas en alto porcentaje (Cristiansen y Scelzo, 1971). Los animales capturados y mantenidos en las mejores condiciones posibles, son desembarcados en el puerto y transportados hasta el Instituto, a sólo 1 km. Las hembras son luego alojadas en acuarios c recipientes de polietileno de 70–100 l, tres o cuatro en cada uno. También algunas hembras son mantenidas en acuarios individuales o en trampas para mantenerlas separadas del desove.
3.6 Cultivo de algas para alimentación de las larvas
La diatomea usada para la alimentación de las larvas del camarón, en los estadios de protozoea y mysis ha sido principalmente Skeletonema costatum. Esta alga es muy común en la primavera - septiembre-noviembre - en el sector del puerto de Mar del Plata y adyacentes. De muestras obtenidas en ese lugar ha sido aislada y cultivada en el laboratorio, mediante varias réplicas, hasta lograr un cultivo casi puro. Luego se pasa a tanques de 100 l de capacidad para obtener una producción en suficiente cantidad. Para disponer de abundantes cultivos de Skeletonema se han seguido dos procedimientos. Uno externo, empleando luz solar, menos controlado, y otro interno, utilizando luz de tubos fluorescentes. En el caso de los cultivos exteriores llevados a cabo al comienzo de la temporada de reproducción, se emplearon recipientes de polietileno de 65 × 48 × 42 cm ubicados sobre una estantería externa que recibe sol en las primeras horas de la mañana. Los recipientes son tapados con planchas de acrílico transparente. El agua utilizada para el cultivo fue costera, filtrada y a veces envejecida.
Por cada 100 l de agua se añadió el siguiente medio de cultivo: 1,0 g de NO3K; 0,5 g de PO4HNa2; 0,5 g de SiO3Na2; 0,98 g de EDTA; 0,054 g de Cl3Fe; 100 μg B 12.
En todos los casos el agua fue aireada. Al medio así preparado se le agrega 1 l de cultivo del alga y al cabo de tres días se obtiene un nuevo cultivo denso de color verde amarillento. Este procedimiento fue repitiéndose alternativamente con tres tanques de las características mencionadas, para disponer de suficiente alimento para las protozoeas.
También se llevaron a cabo cultivos interiores, en los mismos recipientes de polietileno, iluminados con una serie de seis tubos fluorescentes de 40 watts. Ello permitió lograr buenos cultivos, aunque algo más lentamente. Este procedimiento fue utilizado durante el verano, cuando no era posible realizarlos al aire libre por el excesivo calor ambiental. Cuando el cultivo no fue consumido en su totalidad, se llevó a nivel original, reponiendo el agua y los nutrientes y al siguiente día se logró un cultivo con densidad óptima. Los cultivos en buenas condiciones llegaron a una densidad de 360 000 células/ml. En otros casos los cultivos de Skeletonema empleados tenían una concentración de cerca de 100 000 células/ml y algunos con concentración de 50 000 células/ml.
Los cultivos de algas fueron introducidos en los recipientes que contenían las larvas, en forma de goteo, llegándose a concentraciones que oscilaron entre 10 000 y 27 500 células/ml y en algunos casos hasta 60 000 células/ml, con cadenas de Skeletonema de 3–12 células en su mayoría. Estas concentraciones especialmente las mayores, mostraron ser aptas para el desarrollo de las larvas.
Hudinaga y Miyamura (1962) establecieron que cultivos de Skeletonema de 5 000 a 10 000 células/ml eran la mejor concentración para protozoeae de P. japonicus. Cook y Murphy (1969) suministraron diariamente 1 l de cultivo de alga con una densidad de 200 000 células/ml por cada 15 l de agua de mar del tanque. Según Neal (1970) 60 000 células/ml de Thalassiosira fue suficiente para alimentar larvas, pero se necesitaron 200 000 células/ml de Skeletonema en el cultivo, por ser esta alga de menor tamaño. San Feliu, Muñoz y Alcaraz (1973) emplearon concentraciones de Skeletonema y Thalassiosira para alimentar a las protozoeae de Penaeus kerathurus que oscilaron entre 350 000 y 480 000 células/ml y en algunos casos parecen haber sido más elevadas.
3.7 Desove en cautividad
En los acuarios mayores de 80 a 100 l se colocan unas tres-cuatro hembras y en pequeños de 30 l se coloca una sola hembra madura. Algunos de estos acuarios han sido preparados de manera de colocar a la hembra en una trampa para mantener al animal separado del desove.
Como acontece en otros peneidos las hembras son impregnadas por los machos en el momento de la muda. Para el camarón se ha hallado que la mayoría de las hembras han recibido el espermatóforo del macho, que queda alojado en la espermateca del télico de la hembra. Christiansen y Scelzo (1971), han comprobado altos porcentajes de fecundación durante todo el año, llegando a valores promedios de 86,8 por ciento en ejemplares entre 49 y 88 mm de longitud total. Los valores decrecen en los meses fríos a un 40 por ciento aumentando en los meses cálidos hasta un 95–100 por ciento.
Normalmente las hembras con el ovario maduro desovan al siguiente día de la captura; en general en horas del amanecer. En algunos casos se obtuvo el desove de hembras en cautividad luego de tres-cuatro días de su captura, pero en general las hembras que no desovan reabsorben el ovario. En esos casos se reemplazó al animal.
Las hembras del camarón argentino en cautividad ponen un número variable de huevos, una parte del total de huevos que contiene el ovario. Normalmente se obtuvieron desoves de 10 000 a 50 000 huevos (Fig. 3). La hembra queda aún con el ovario oscuro, pudiéndose ver perfectamente este color por transparencia del caparazón. Los huevos tienden a depositarse en el fondo del acuario agrupándose por sectores y son visibles a simple vista por su tamaño que oscila en unas 340 μ de diámetro externo, aunque como son transparentes pueden pasar desapercibidos entre los granitos de arena. Si el agua del acuario está en movimiento y hay aireación fuerte, los huevos flotan y se les ve a simple vista Tras obtener el desove la hembra es retirada del acuerio o los huevos son transferidos a otro recipiente destinado al desarrollo larval.
4. CULTIVO DE LARVAS Y POSTLARVAS EN TANQUES DE LABORATORIO
Una vez obtenidos los huevos de una o varias hembras en un recipiente o acuario en el laboratorio, se mantiene constantemente la filtración y aireación, con observación permanente de la temperatura. Con el camarón argentino se trató de mantener el agua entre 17° y 20°C, que es una temperatura adecuada para el desarrollo de los huevos y todas las fases larvales hasta la primera postlarva. En las experiencias la temperatura de 20°C ha sido aumentada para lograr una aceleración del desarrollo larval, con todo éxito.
Nauplius. La eclosión de los huevos se produce dentro de las 12–48 horas, dependiendo de la temperatura. A 20–21°C nacen a las 12–24 horas, mientras que a la temperatura de 17–18°C los nauplii aparecen después de 48 horas de puestos los huevos (Figs. 3 y 4). Los nauplii nacen en forma masiva y muestran un claro fototactismo positivo, aglomerándose en los sectores más iluminados del estanque o acuario. Seis mudas se verifican en este estadio, en un tiempo de tres a cuatro días, nutriéndose de sus propias reservas. La mortalidad en el estadio de nauplius es prácticamente nula o muy baja, si las condiciones del agua y temperatura son adecuaoas y no sobreviene ningún tipo de enfermedad o ataque por otros organismos. Tras la muda del nauplius VI aparece la primera protozoea.
Protozoea. La fase más crítica en los cultivos artificiales coincide con la aparición de la protozoea. En este estadio larval el camarón realiza tres mudas que corresponden a tres subestadios. El tiempo que requiere esta fase del desarrollo larval varió durante los experimentos de laboratorio entre 9 y 14 días, con temperaturas entre 16° y 22°C. La calidad y cantidad de alimento es muy importante y de ello depende la supervivencia de las larvas, de acuerdo con las experiencias llevadas a cabo. Se emplearon cultivos concentrados de dos especies de diatomea, Phaeodactylum tricornutum y S. costatum. La primera de éstas no dio resultados positivos en la alimentación de las protozoeae, mientras que se ha logrado éxito con el empleo de la última mencionada.
En el último día del estadio de nauplius, se comienza a suministrar mediante un goteo continuo el cultivo de Skeletonema y a su vez se interrumpe el sistema de filtración del agua del acuario para evitar que queden retenidas en el filtro las algas introducidas. Se airea el agua del tanque con varios picos de aire a presión. Los cultivos puros de S. costatum utilizados han tenido concentraciones que variaron entre 100 000 y 360 000 células/ml. Estos se hacen gotear en el acuario hasta que el agua toma una ligera coloración verde claro, lo que significa una concentración de Skeletonema de unas 10 000 a 60 000 células/ml. En algunos casos las concentraciones fueron de sólo 5 000–10 000 células/ml. Los valores mencionados en primer término son los más adecuados para la alimentación de esta especie.
Esta etapa del cultivo es el estadio donde se produce mayor mortalidad en las larvas, hecho observado también por otros autores (Cook y Murphy, 1965). Estos resultados contrastan con los logrados por San Feliu, Muñoz y Alcaraz (1973) cultivando Penaeus kerathurus en laboratorio; en un cultivo inicial de 110 000 nauplii lograron 90 000 mysis y 85 000 postlarvas.
En nuestros cultivos, no obstante, se ha podido comprobar que aproximadamente un 10 por ciento alcanza la primera postlarva. En nuestro programa actual se han intensificado los estudios tendientes a lograr una mayor supervivencia en este estadio.
Los diversos autores que trabajaron en cultivos de peneidos, tales como Hudinaga (1942), Cook y Murphy (1969), Mock y Murphy (1971) entre otros, han utilizado preferentemente Skeletonema para alimentar protozoeae. Estas algas parecen ser adecuadas para nutrir a las larvas, debido al tamaño que forman las cadenas siendo eficazmente barridas por los apéndices filtradores de la protozoea. Otros autores han obtenido también buenos resultados con Thalassiosira, Exuviela, Phaeodactylum, Tetraselmis, etc. Las protozoeae se nutren activamente en cultivos concentrados de Skeletonema, pudiéndose observar en el microscopio el conducto intestinal completamente verde por la concentración de algas. Las larvas en este estadio muestran también fototactismo positivo, manteniendo la posición característica con la región cefálica hacia arriba y hacia adelante, nadando mediante impulsos continuados de las anténulas y antenas. Cuando las larvas están en la tercera protozoea se comienza a suministrar nauplii recién nacidos de Artemia salina para permitir la inmediata nutrición de la primera mysis.
Mysis. El estadio de mysis representa un cambio fundamental en la forma de la larva, que comienza a ser zooplanctófaga. Las primeras mysis pueden comer fitoplancton pero deben también ingerir zooplancton. En el caso de cultivos en tanques se les suministra tres raciones diarias de nauplii de A. salina nacidos en el día. La nutrición se hace más intensa a medida que las larvas mudan a subestadios más avanzados y en los últimos comienzan a observarse muchos casos de canibalismo, que se manifiesta acentuadamente cuando las condiciones de confinamiento se tornan extremas debido a que el número de larvas por recipiente es muy elevado. Las mysis alimentadas sólo con fitoplancton mueren antes de llegar a postlarvas.
Las mysis manifiestan fototactismo positivo y nadan con la región cefálica orientada hacia abajo. La duración de los cuatro subestadios de mysis es más breve que el anterior, necesitándose entre ocho y nueve días una temperatura entre 18° y 21°C, pudiendo llegar a 11 días con temperaturas entre 16° y 18°C. La muda de cada subestadio es fácilmente detectable por el aumento de tamaño y la aparición de mayor número de apéndices.
Mysis-postlarva y postlarva. Tras la muda de la IV mysis aparece la mysis postlarva, con características intermedias entre la mysis y la postlarva, con rostro y exopoditos largos, y hábitos nadadores. Luego muda a la verdadera postlarva, con hábitos menos nadadores y quedando frecuentemente sobre el fondo, mostrando deseos de enterrarse en el substrato. La primera postlarva es un pequeño camaroncito de unos 5,0 a 5,7 mm de largo total.
Las postlarvas, en los primeros estadios han sido alimentadas básicamente con nauplii de Artemia, en raciones diarias. Cada postlarva llegó a comer entre 60 y 90 nauplii por día. Las postlarvas avanzadas y los juveniles han sido alimentados con carne fresca de camarón, peces y moluscos (mejillón). Se les suministró también raciones de alimento preparado para peces. La ración se suministró cuatro o cinco veces por día en las primeras semanas y luego dos o tres veces diariamente por la mañana y al atardecer.
El desarrollo larval de A. longinaris se completa entre 24 y 32 días, dependiendo de la temperatura. Esta osciló entre 16 y 23°C.
5. CRECIMIENTO DE POSTLARVAS Y JUVENILES DE A. longinaris Y DE OTRAS ESPECIES DE PENEIDOS
5.1 Datos de crecimiento de algunas especies del género Penaeus
Es útil considerar con fines comparativos algunos resultados de otros investigadores. La mayor parte de los resultados disponibles se refieren a especies tropicales y subtropicales de mayor tamaño y cultivadas en épocas del año con temperatura mayor que la de nuestra región. Por ejemplo, Johnson y Fielding (1956) estudiaron la reproducción en cautividad del camarón blanco, Penaeus setiferus en Florida, EE.UU., estableciendo para las postlarvas un crecimiento promedio diario de 2,1 mm en 1954 y de 1,7 mm en 1955.
Pearson (1939) en su importante trabajo, realizó experimentos aislados de crecimiento de postlarvas de P. setiferus obtenidas del plancton. Con estos trabajos comprobó que durante 43 días un grupo de postlarvas creció un máximo de 29 mm lo que da un incremento diario de 0,7 mm. Asimismo 18 postlarvas de la misma especie obtenidas del plancton, de unos 6 mm de largo, crecieron en acuario, tras 50 días en cautividad, un promedio de 0,5 mm por día.
Loesch (1965) estableció que el crecimiento, determinado mediante frecuencias de longitud de juveniles de P. aztecus en ambientes naturales de Alabama, EE.UU., osciló entre 13 y 18 mm por mes en invierno, y entre 30 y 35 mm en verano. En el camarón P. setiferus el mismo autor comprobó un creimiento entre 14 y 27 mm mensuales en invierno y de 18 a 30 mm en verano.
Williams (1955) estableció que las postlarvas de P. setiferus crecen a razón de 36 mm por mes, las de P. duorarum 52 mm por mes y las de P. aztecus crecen 46 mm por mes, en aguas salobres y durante los meses cálidos y durante los meses cálidos en Carolina del Norte, EE.UU.
Wheeler (1968) realizó cultivos de P. setiferus y P. aztecus en tanques semi-naturales de aguas salobres fertilizadas. Los resultados logrados luego de cuatro meses de observación fueron los siguientes para P. setiferus.
| Fecha | Talla promedio (mm) | Incremento diario | No. ejemplares |
| 14 julio 1966 | 12,3 | - | 37 800 |
| 18 agosto 1966 | 93,0 | 2,3 | 79 |
| 15 setiembre 1966 | 108,2 | 0,6 | 53 |
| 10 noviembre 1966 | 113,5 | 0,1 | 47 |
El crecimiento observado en las experiencias con P. astecus aztecus ha sido algo menor, tanto en tanques con agua fertilizada o sin ese tratamiento. En un período de cinco meses llegaron a un promedio de 104 mm en el primer caso y en los ambientes sin fertilizar a una talla promedio de 89 mm en el mismo período. Las experiencias con más de medio millón de ejemplares dieron en la última observación un resultado de 49 y 86 ejemplares respectivamente.
San Feliu, Muñoz y Alcaras (1973) han realizado estudios de cultivo de P. kerathurus en tanques de laboratorio. Tras cuatro meses y medio lograron una talla media para macho de 62 mm y para hembras de 64 mm, con una supervivencia del 77 por ciento.
5.2 Crecimiento de A. longinaris en cautividad
Pasada la cuarta mysis, el camarón nuda a mysis-postlarva e inmediatamente a postlarva, que tiene características semejantes a un camarón juvenil y una longitud total inicial que oscila entre 5,0 y 5,7 mm. La condición de postlarva se define en esta especie hasta los 12 mm de longitud total. A partir de este tamaño aparecen los caracteres sexuales secundarios en el primer pleópodo del macho, considerándolo juvenil.
En los experimentos realizados en nuestro laboratorio de Mar del Plata en las primaveras y veranos de 1972–73 y 1973–74, se observaron y controlaron especialmente cuatro lotes del camarón, A. longinaris. Cada lote observado estuvo integrado por un número aproximado de 300 a 1 000 postlarvas, de las cuales se midieron al azar periódicamente un número variable.
El crecimiento observado en el laboratorio, en los lotes de primavera y verano de 1972–73 ha mostrado ser distinto al del período 1973–74. En la primera temporada de trabajo se obtuvo un mayor aumento de la talla en función del tiempo. Parecería que la diferencia más evidente hallada entre las condiciones de trabajo de las dos temporadas ha sido la temperatura, que se mantuvo algo más baja en 1973–74. Asimismo la diferencia de crecimiento de los camarones de un mismo lote es evidente (Figs. 4, 5 y 6).
Un lote observado en 1972–73, noviembre-febrero (Cuadro I) al cabo de 90 días de vida, a partir de la primera postlarva, alcanzó una talla total media de 54,7 mm, con ejemplares que llegaron hasta 60 mm de longitud total. Si se agregan los 24 días que duró el desarrollo larvario, la edad total de estos camarones fue de 114 días de vida. El crecimiento medio diario en el transcurso de los tres meses de observación osciló entre 0,3 y 1,0 mm, correspondiendo los mayores valores al primer mes. En general se observa una curva de crecimiento con una pendiente relativamente suave en todo el lapso de observaciones (Figs. 5 y 7).
En 1973–74 se observaron varios lotes de camarones con el fin de verificar el crecimiento en longitud y también se tomaron algunos datos de peso, tanto de postlarvas como de juveniles. Los resultados obtenidos sobre un lote de 25 ejemplares mostró un crecimiento algo menor que la experiencia anterior. Después de 143 días de observación de los camarones a partir de la primera postlarva, llegaron a una talla media de 60,6 mm con un máximo de 64,6 mm (Figs. 6 y 8). El crecimiento medio diario osciló entre 0,9 y 0,6 mm durante el primer mes, mientras que en el tercero sólo se observaron incrementos de 0,1–0,3 mm (Cuadro II).
Cuadro I
Crecimiento de postlarvas y juveniles de ambos sexos de un lote de camarones observados en cautividad durante los meses de noviembre de 1972 a febrero de 1973, con temperaturas entre 19° y 24°C. Nauplii nacidos el 24 de octubre de 1972
| Fecha de observación | No. camarones medidos | No. de días desde 1o postlarva | Longitud total media (mm) | Crecimiento medio diario (mm) | Crecimiento medio mensual (mm) |
| 16/11/72 | 10 | 1–2 | 5,4 | - | 1o mes 16,9 |
| 27/11/72 | 10 | 11 | 10,1 | 0,4 | |
| 30/11/72 | 11 | 14 | 13,1 | 1,0 | |
| 5/12/72 | 14 | 19 | 17,1 | 0,9 | |
| 9/12/72 | 10 | 23 | 20,5 | 0,6 | |
| 14/12/72 | 21 | 28 | 22,3 | 0,4 | 2o mes 19,4 |
| 19/12/72 | 18 | 33 | 26,7 | 0,9 | |
| 22/12/72 | 23 | 36 | 27,8 | 0,4 | |
| 27/12/72 | 25 | 41 | 30,1 | 0,5 | |
| 29/12/72 | 26 | 43 | 31,3 | 0,5 | |
| 3/1/73 | 27 | 48 | 33,7 | 0,5 | |
| 6/1/73 | 23 | 51 | 35,7 | 0,6 | |
| 10/1/73 | 24 | 55 | 38,6 | 0,7 | |
| 15/1/73 | 22 | 60 | 41,7 | 0,6 | 3o mes 13,0 |
| 18/1/73 | 22 | 63 | 43,5 | 0,6 | |
| 23/1/73 | 22 | 68 | 45,7 | 0,4 | |
| 27/1/73 | 20 | 72 | 47,1 | 0,3 | |
| 5/2/73 | 20 | 81 | 51,4 | 0,3 | |
| 14/2/73 | 20 | 90 | 54,7 | 0,4 |
Cuadro II
Crecimiento de postlarvas y juveniles de ambos sexos de un lote de camarones observados en cautividad durante los meses noviembre de 1973 a abril de 1974, con temperatura entre 17° y 23°C. Nauplii nacidos el 8/10/73
| Fecha de observación | No. camarones medidos | No. de días desde 1o postlarva | Longitud total media (mm) | Crecimiento medio diario (mm) | Crecimiento medio mensual (mm) |
| 10/11/73 | 6 | 1–2 | 5,1 | - | - |
| 15/11/73 | 21 | 7 | 6,1 | 0,9 | 1o mes 13,7 |
| 19/11/73 | 21 | 11 | 7,9 | 0,5 | |
| 26/11/73 | 19 | 18 | 11,9 | 0,6 | |
| 6/12/73 | 25 | 28 | 18,8 | 0,7 | 2o mes 20,8 |
| 17/12/73 | 25 | 39 | 25,8 | 0,6 | |
| 28/12/73 | 20 | 50 | 32,3 | 0,6 | |
| 9/1/74 | 12 | 62 | 39,6 | 0,3 | |
| 22/1/74 | 21 | 75 | 43,9 | 0,2 | 3o mes 8,6 |
| 30/1/74 | 17 | 83 | 45,7 | 0,3 | |
| 9/2/74 | 17 | 93 | 48,2 | 0,3 | |
| 1/3/74 | 17 | 113 | 54,0 | 0,3 | 4o mes 12,4 |
| 14/3/74 | 15 | 126 | 56,0 | 0,1 | |
| 1/4/74 | 16 | 143 | 60,6 | 0,3 |
Algunos registros de peso mostraron que animales de 42,8 mm pesan 0,5 g y los de 68,3 mm 2,0 g.
5.3 Comparación entre el crecimiento de postlarvas y juveniles de tanques-laboratorio y de muestras obtenidas en el mar
Es interesante comparar el crecimiento de las postlarvas y juveniles en acuario y los resultados del muestreo del material proveniente de la captura de una lancha de pesca comercial. Desde 1965 se lleva a cabo en el Instituto de Biología Marina, un muestreo permanente de las capturas de camarón en el área de Mar de Plata. De estas observaciones han surgido interesantes resultados referentes al crecimiento del camarón juvenil y adulto en su medio natural (Boschi, 1969a; 1969b y datos inéditos).
De acuerdo con los resultados obtenidos en el muestreo mencionado, el grueso de los camarones entran en reclutamiento al área de pesca en la región de Mar del Plata en enero y febrero (verano), con una longitud que oscila entre 35 y 70 mm, tallas estas variables cada año. La edad estimada para esas tallas ha sido de 5 a 6 meses aproximadamente. No obstante se observa la incorporación de nuevos reclutas en los meses siguientes, pero en menor cantidad, debido a la extensión del período de reproducción.
Las observaciones realizadas en laboratorio han permitido verificar que un lote de postlarvas, a los 90 días de vida, llegó a tallas entre 47,5 y 60,5 mm y otro a los 143 días alcanzó una longitud total comprendida entre 50,8 y 68,3 mm (Figs. 5 y 6). Estos datos permiten asegurar que todos los camarones provenían de un mismo desove y tenían una misma edad, situación que no es la misma con los animales de muestreo de la pesca comercial, donde además la selección y competencia se deben manifestar de algún modo.
La relacion de crecimiento entre los animales del muestreo de la pesca y del laboratorio es algo diferente. De acuerdo con estos resultados, los animales criados en cautividad parecen tener una tasa de crecimiento algo mayor en la etapa postlarval y primeras semanas de la juvenil, aunque es probable que la edad de los camarones del mar haya sido sobrestimada en uno o dos meses. Este crecimiento es comparable al de otras especies de peneidos de mares templados, o al período de crecimiento invernal de especies tropicales del género Penaeus. Un ejemplo del primer caso lo constituye Metapenaeus benettae de Australia que, de acuerdo con Dall (1958) después de tres a cinco meses de vida llega a medir entre 39 y 48 mm de largo en su ambiente natural. San Feliu et al. (1973) para P. kerathurus establecieron un crecimiento en la primera fase de la vida de 19,2 mm por mes en experiencias de laboratorio.
6. DESCRIPCION DEL HUEVO, LARVAS, POSTLARVAS Y JUVENILES
6.1 Desarrollo embrionario
Los desoves ocurren generalmente durante las horas de la noche o en horas muy tempranas del día, lo cual deja suponer que la luminosidad juega un papel muy importante como factor de liberación de los huevos. Tras el desove, los huevos fecundados se depositan en el fondo del acuario, o se mantienen flotando cuando se airea el agua fuertemente. Al tenar contacto con el agua la membrana externa o coriónica adopta una forma bien esférica Esta membrana es translúcida, con un diámetro variable entre 270 y 450 μ. En un mismo desove pueden aparecer huevos de tamaño externo variable (Figs. 9b, c, d). A través de la membrana coriónica puede observarse la masa vitelina, esférica, opaca y de color amarillento que ocupa la porción central, presentando un diámetro relativamente constante que oscila entre 215 y 250 μ.
Después del desove comienza la división celular. Las características de la segmentación del huevo de un peneido, han sido descritas por Hudinaga (1935; 1942), para P. japonicus y el A. longinaris que muestran ser similares. Inicialmente el huevo se divide en dos blastómeros. Aproximadamente a los 30 minutos después de la primera segmentación y a temperatura entre 18° C y 20°C, el huevo efectúa la segunda división, a cuatro blastómeros. Tal cual ya lo indicó Hudinaga (op.cit.) para P. japonicus, en ese etapa se produce la división característica de los crustáceos peneidos ya que la segunda hendidura ocurre en ángulo recto a la primera y posteriormente se realiza una rotación equivalente a 45–60° en relación al eje del primer clivaje.
En A. longinaris se observó el desarrollo embrionario a partir de la segunda división. Las siguientes divisiones en 8, 16, 32, 64, etc. blastómeros se producen a intervalos de aproximadamente 30 minutos. A medida que las divisiones se suceden, las células van reduciendo su tamaño. En la fase de gástrula, en vista lateral el polo vegetativo se presenta como una superficie más achatada que el resto. Esta etapa ocurre alrededor de las seis horas después del momento del desove; posteriormente a la gastrulación comienzan a evidenciarse los esbozos de los futuros apéndices de la larva.
El embrión aparece rodeado por una membrana embrionaria muy delgada, pudiéndose distinguir un eje antero-posterior, una superficie dorsal convexa y una superficie ventral relativamente plana, en la que se puede observar la aparición de los tres primeros pares de apéndices de la larva: anténula, antena y mandíbula. A medida que transcurren las horas los apéndices se alargan y el extremo de las mandíbulas y antenas de hiende para formar un apéndice birramado (Fig. 9). En el extremo anterior del cuerpo se puede notar el ocelo u ojo naupliar, rojizo.
El embrión está compuesto de cuatro somitos, tres de los cuales están indicados por los apéndices anteriormente mencionados. Estos apéndices en su extremo distal tienen pequeñas sedas. Veinticuatro horas después del desove, el embrión está totalmente formado, presenta la forma ovoide característica de la primera larva y realiza bruscos movimientos dentro del huevo. En la parte posterior del cuerpo han aparecido un par de fuertes y largas furcas caudales. El nauplius se mueve dentro del huevo y apoya el primer par de apéndices, las anténulas, sobre la superficie interna de la membrana coriónica, hasta conseguir romperla con las espinas de la furca caudal. Finalmente emerge, primeramente con su extremo caudal, hasta quedar totalmente libre del huevo.
6.2 Desarrollo larval
6.2.1 Generalidades sobre los estadios larvales y postlarvales. El desarrollo larval de A. longinaris es como el de otros peneidos. El primer estadio larval libre, o nauplius, presenta un cuerpo piriforme con sólo tres pares de apéndices que cumplen función natatoria. La larva no se alimenta del medio externo y consta de 6 subestadios. El segundo estadio, o protozoea, se caracteriza por tener el cuerpo dividido en céfalopereion o céfalotorax, y abdomen o pleon. El caparasón en esta fase larval sólo cubre la porción cefálica. Las anténulas y antenas son los principales órganos locomotores; se desarrollan otros apéndices, especialmente los bucales, y aún son rudimentarios los maxilípedos 3o y los 5 pares de pereiópodos. Los ojos compuestos son pedunculados ya en el segundo subestadio. El telson es espatulado, con dos lóbulos que poseen de 7 a 8 procesos cada uno. Los urópodos aparecen en la tercera muda. El estadio protozoea se compone de tres subestadios.
Después de la protozoea la larva se transforma en mysis, que se caracteriza fundamentalmente por el desarrollo de los pereiópodos. Este apéndice posee dos ramas bien características, un endopodito segmentado y un exopodito provisto de sedas muy largas, cuya agitación permanente permite el desplazamiento del animal. La larva además presenta los pleópodos, aunque aún rudimentarios. Este estadic se compone de cuatro subestadios.
En los cultivos de laboratorio, y en algunas muestras de plancton, se observaron ejemplares con características particulares e intermedias entre las de mysis y la primera postlarva, designándola como mysis-postlarva o postmysis. Entre los rangos más sobresalientes puede mencionarse la presencia de largos exopoditos funcionales en los maxilipedos y pereiópodos, rostro largo y de extremo agudo que sobrepara los ojos, además de pleópodos segmentados y con sedas. Esta larva nada permanentemente, pero con la cabeza hacia adelante. Tras este estadio la larva se transforma en primera postlarva (Cuadro III).
Cuadro III
Estadios y subestadios de huevo, larvas y postlarvas, indicando el tamaño, duración de cada uno y alimentación del camarón de Argentina A. longinaris
| Estadio | Subestadio | Tamaño medio en mm | Duración promedio en horas o días | Alimento principal |
| Huevo | - | 0,35(0,23)a | 12–36 horas | - |
| Nauplius | I | 0,28 | 9 horas | propias res. |
| Nauplius | II | 0,29 | 13 horas | propias res. |
| Nauplius | III | 0,30 | 12 horas | propias res. |
| Nauplius | IV | 0,32 | 12 horas | propias res. |
| Nauplius | V | 0,35 | 16 horas | propias res. |
| Nauplius | VI | 0,50 | 24 horas | propias res. |
| Protozoea | I | 1,0 | 4–5 días | fitoplancton |
| Protozoea | II | 1,7 | 3–4 días | fitoplancton |
| Protozoea | III | 2,2 | 3–4 días | fitoplancton |
| Mysis | I | 2,8 | 2–3 días | zooplancton |
| Mysis | II | 3,4 | 2–3 días | zooplancton |
| Mysis | III | 4,0 | 2–2 días | zooplancton |
| Mysis | IV | 5,0 | 2–3 días | zooplancton |
| Mysis postlarva | I | 5,0 | 1–2 días | zooplancton |
| Postlarva | varios | 5,0–12,0 | variables | zooplanton y otros |
Nota: El desarrollo larval completo de esta especie, desde el primer nauplius hasta la cuarta mysis se cumple entre 24 y 32 días para una temperatura que osciló entre 16 y 24°C
a El primer valor indica el diámetro de la membrana externa del huevo, el segundo del huevo sin ésta
Las características básicas de la postlarva son la presencia de pleópodos setosos, rostro romo y muy corto que no alcanza el nivel de la córnea cuando los ojos están extendidos. Los pereiópodos y maxilípodos poseen exopoditos más cortos y aún con sedas. En general las larvas muestran una tendencia a descansar sobre el fondo y esconderse en el substrato cuando se las molesta.
6.2.2 Caracterización del nauplius. La primer larva se denomina nauplius. Dorsalmente puede verse a través de la cutícula un ojo mediano impar que está ubicado en la línea media del cuerpo sobre la base del primer par de apéndices. Posee tres pares de apéndices que se insertan ventralmente: anténulas, antenas y mandíbulas. Todos estos apéndices poseen sedas o procesos de diferente naturaleza y estructura y para su mejor descripción han sido numerados siguiendo un orden, como puede observarse en las figuras respectivas. Este ordenamiento se mantiene a través de todo el ostudio. Para su mejor visualizazión los apéndices del costado derecho en las figuras (izquierda en el animal) se han girado de manera conveniente, cerca de 45° en las anténulas y 90° en las antenas y mandíbulas.
Las anténulas (A1) son unirramadas y presentan siete procesos constantes en todo el estadio, salvo en el nauplius VI. Este par de apéndices se proyecta desde la parte anterior lateral del cuerpo, curvándose ligeramente hacia adentro.
Las antenas (A2) emergen immediatamente detrás de las anténulas, son birramadas y constituidas por exo y endopodito. El número y forma de los procesos del endo y exepodito ayudan a caracterizar cada subestadio.
Las mandíbulas (M) ubicadas posteriormente y en la porción media del cuerpo, son birramadas con exo y endopodito, ambos con tres sedas largas cuyo número permanece invariable en todo el estadio.
La furoa caudal del nauplius está formada por un par de espinas largas, acompañadas de otras menores en los subestadios avansados, ubicadas en el extremo postero-ventral del cuerpe. Estas espinas son rectas o ligeramente curvalas, lisas o con espínulas. La variación del número de espinas en los distintos subestadios contribuye a caracterizarlos, variando desde 1+1 hasta 7+7.
En vista lateral la larva presenta la superficie dorsal convexa y en ciertos ejemplares se evidenoia muy claramente la presencia de una protuberancia (¿órgano dorsal?) que emerge en la mitad anterior del cuerpo, perpendicularmente a la base de las mandíbulas o entre la antena y la mandíbula. El perfil ventral presenta el labrum o labio superior y el labium o labio inferior, que aparecen entre la base de las antenas y mandíbulas; estas estructuras se hacen más visibles en los últimos subestadios.
Los nauplii miden entre 276 y 470 μ. El tamaño de los ejemplares se ha tomado desde el extreme anterior o cefálico al extremo condal, entre medio de la furca, sin incluir las espinas. La anchura tomada entro la base de las antenas y mandíbulas es de 180 μ aproximadamente, permanenciendo invariable a lo largo de todo el estadio, mientras que la longitud aumenta considerablemente. La altura, tomala en vista lateral y en el extremo anterior del cuerpo, es de unos 210 μ, sin variaciones considerables en los distintos subestadios.
Paralelamente al aumento progresivo del tamaño aparece la segmentación de los apéndices, y nuevos somitos representados por los esbozos de los apéndices cefálicos y torácicos como maxílula, maxila, maxilípedos primero y segundo. Estos apéndices se hacen libres en el último subestadio, aunque permanecen rudimentarios y no funcionales.
6.2.3 Descripción de los nauplii (Figs. 10 y 11)
Nauplius I
Nauplius II
Nauplius III
Nauplius IV
Nauplius V
Nauplius VI
6.2.3 Caracterización de la protozoea. La protozoea del camarón A. longinaris tiene tres subestadios, que se individualizan por los cambios morfológicos y sus respectivas mudas. El cuerpo se presenta dividido en dos partes principales: el céfalon o cabeza y el resto del cuerpo compuesto por el tórax y abdomen (pereion + pleon).
La cabeza está cubierta por un caparazón que presenta una forma ligeramente hexagonal, siendo más largo que ancho, con una anchura máxima ubicada en la mitad del mismo. La presencia del caparazón es un carácter distintivo entre protozoea y nauplius. A partir de la protozoea II aparece el rostro y un par de espinas supraorbitales. La parte posterior del caparazón presenta una escotadura en la parte media y carece de espinas. Otro rasgo característico del estadio es poseer ojos compuestos, que se hacen pedunculados a partir de la protozoea II. El ocelo u ojo naupliar se mantiene, ubicándose en la línea media, entre los ojos compuestos.
El tórax es segmentado, presentando entre 5–6 segmentos. El abdomen es entero en la protozoea I y con 5 y 6 segmentos en los restantes subestadios, además en la protozoea III se segmenta el 6° somito, dejando libre el telson, conjuntamente con la aparición de los urópodos rudimentarios. En este estadio están bien desarrolladas las anténulas y antenas que cumplen función de natación, conjuntamente con los maxilípedos 1° y 2°. Las mandíbulas se incorporan a la región bucal como apeńdices masticadores, habiéndo perdido el exo y endopodito y con una superficie masticatoria, que utiliza en su nutrición. También son funcionales las maxílulas y maxilas, además de los maxilípedos 1° y 2°. El maxilípedo 3° y los 5 pares de pereiópodos aparecen rudimentarios, a partir de la protozoea II.
El telson se separa del 6° somito abdominal en la protozoea III, mostrando una escotadura mediana y dos lóbulos laterales que poseen 7 procesos o espinas en cada lóbulo en las protozoeas I y II y 8 en la protozoea III. Dorsalmente, el abdomen o pleon lleva una espina en el borde posterior del 1° al 5° somito y un par de espinas en el borde lateroposterior del 5° y 6° somito abdominal.
6.2.4 Descripción de la protozoeae (Fig. 12)
Protozoea I
Protozoea II
Protozoea III
6.2.5 Caracterización de la mysis. El cuerpo se ha alargado haciéndose más parecido a un pequeño camarón y con rasgos específicos más definidos. Este estadio tiene 4 subestadios determinados por respectivas mudas. La longitud total varía entre 2,6 y 5,0 mm. Los rasgos más notorios y característicos que definen al estadio son la presencia de exopoditos setosos, nadadores y bien desarrollados en los maxilípedos y pereiópodos, y el desarrollo en forma paulatina, de los pleópodos rudimentarios en el abdomen, pero sin sedas.
El cefalopereion presenta un rostro puntiagudo que se proyecto entre los ojos y los sobrepasa, y un par de espinas supraorbitales de menor tamaño. Los bordes anterolaterales del caparazón presentan una serie de 5 a 7 espinitas. El resto del caparazón es liso y en vista lateral puede distinguirse el “órgano dorsal” en forma de una elevación, ubicado en el tercio posterior. A partir del segundo estadio de mysis aparecen un par de espinas hepáticas, mientras que las espinas rostrales superiores se presentan a partir de la tercera mysis.
La anténula presenta tres segmentos basales y dos ramas terminales, una externa y una interna, y cuya estructura no varía a lo largo del desarrollo del estadio. La antena, contrastando con el estadio anterior, posee el exopodito transformado en escama, y en forma espatular, bordeado de sedas o setas y a partir del 2° subestadio el proceso más externo se diferencia en una fuerte espina. El endopodito siempre alargado, en el último subestadio, mide casi el doble de la escama, siendo además segmentado. La estructura de los apéndices bucales, como mandíbula, maxílula y maxila y los maxilípedos 1° y 2° no varían mayormente. Son funcionales el 3° par de maxilípedos y los 5 pares de pereiópodos a partir de la segunda mysis, y de estos los tres primeros son quelados. Tanto los maxilípedos como los pereiópodos tienen muy desarrollados los exopoditos.
El pleon o abdomen se caracteriza por presentar los cinco primeros segmentos de tamaño y estructura similares. El 6° segmento es más desarrollado. Los segmentos 3, 4, 5 y 6 presentan en la línea media dorsal y posterior, una espina muy desarrollada que en algunos ejemplares es poco evidente o falta en algunos segmentos, especialmente en los primeros, aunque esto puede atribuirse a variaciones intraespecíficas. El borde posterolateral (placa tergo lateral) de los somitos 5° y 6° presenta además una prominente espina. En la región ventral de los somitos 1° – 5° del abdomen y a partir de la segunda mysis hacen aparición los pleópodos, siempre en forma rudimentaria y sin setas o sedas. El diferente grado de desarrollo caracteriza cada subestadio, aunque se observa cierto grado de variación en el tamaño de los mismos.
La nadaders caudal está formada por el telson y los urópodos. El telson sufre variaciones de forma en los distintos subestadios, es espatular, bordeado por ocho procesos pares y con una escotadura central en los primeros subestadios, desapareciendo esta totalmente en la última mysis. Tanto las formas de la placa como la de la escotadura central y su relación con los procesos externos, caracterisan cada subestadio. Uno de los rasgos más particulares de los estadios de mysis es la forma de natación. La agitación de los últimos maxilípedos y principalmente los exopoditos de los pereiópodos, permiten una eficaz y veloz natación a la larva en este estadio. La natación se produce, en su mayor parte, con la cabeza hacia abajo y avanzado hacia atrás con el abdomen hacia adelanta.
6.2.6 Descripción de las mysis (Figs. 13 y 14)
Mysis I
Duración: término medio 3 días
Tamaño: Lt. 2,6–3,1 mm, promedio 2,8 mm
Caracterización. Escama antenal sin espina externa, flagelo pequeño menor
que la escama, casi la mitad de su longitud. Pereiópodos de 1° a 3° par con quela rudimentaria.
Pleon sin esbozos de pleópodos. Telson ensanchado, espatular, borde posterior
convexo, el número par de espinas o procesos del 4° somito mayores que los demás. El 8° par
de procesos o espinas están separadas entre sí por una profunda escotadura central, redondeada,
alcanzando cerca del nivel de la base de las espinas del primer par. Sin espina hepática en
el caparazón.
Mysis II
Duración: 3 días
Tamaño: Lt. 3,1–3,6 mm, promedio 3,4 mm
Caracterización. Escama antenal con una fuerte espina externa, el flagelo
sobrepasa la mitad de la escama, alcanzando el tercio superior. Pereiópodos 1, 2 y 3 quelados.
Pleópodos rudimentarios. Telson casi rectangular, escotadura mediana más pequeña y redondeada
que sobrepasa el nivel de la base del proceso 2. Caparazón con espina hepática muy pequeña,
a veces ausente.
Mysis III
Duración: 2 días
Tamaño: Lt. 2,6–4,4 mm, promedio 4,0 mm
Caracterización. Flagelo de la antena alcanza o sobrepasa la escama.
Rostro con 1–2 espinas dorsales. Pleópodos desarrollados y articulados, a veces bisegmentados.
Telson con escotadura central pequeña, alcanzando el nivel de la base entre los
procesos 2° y 3° del telson.
Mysis IV
Duración: 2 días
Tamaño: Lt. 4,6–5,4 mm, promedio 5,0 mm
Caracterización. Flagelo antenal casi el doble que la escama siendo segmentado.
Dos espinas rostrales bien desarrolladas. Pleópodos bisegmentados muy desarrollados.
Telson rectangular sin escotadura central, procesos espinosos de tamaño similar, siendo el
4° mayor y los tres primeros pares se colocan lateralmente.
6.2.7 Descripción de la mysis-postlarva (Fig. 15)
Duración: 2–3 días
Tamaño: 4,0–5,0 mm
Caracterización. Posee una longitud intermedia entre la última mysis y las
primeras postlarvas, además tiene un par de espinas supraorbitales bien desarrolladas como en
las mysis. Dentro de las características sobresalientes se puede mencionar la existencia de
una largo rostro que iguala o sobrepasa a los ojos, la presencia de pereiópodos con largos
exopoditos setosos y nadadores como en la mysis y la presencia de pleópodos setosos. Este
último carácter permite que el animal nade en posición típica de postlarva.
El rostro largo y puntiagudo posee una espina basal o diente epigástrico y dos dientes rostrales superiores. La anténula está provista de tres segmentos basales y dos ramas o flagelos segmentados. El flagelo interno es el mayor con cuatro-seis segmentos y el externo con cuatro. El flagelo antenal mide de dos a tres veces el largo de la escama. Los maxilípedos tienen exopoditos bien desarrollados y están provistos de varias setas o sedas. El endopodito está segmentado. El lóbulo basal o pedúnculo se desarrolla notablemente presentando su borde interno provisto de numerosas sedas. Los pereiópodos presentan exopoditos bien desarrollados y setosos, alcanzando el borde distal del meropodito. Los pleópodos son bisegmentados y setosos, el teslon es cuadrangular.
Este estadio aparece frecuentemente en cultivos de laboratorio y se hallaron algunos ejemplares en muestras de plancton, con características muy similares a las mysis-postlarvas.
6.2.8 Descripción de la postlarva (Figs. 16 y 17)
Tamaño: entre 5,0 y 12,0 mm
Caracterización. El final del proceso del desarrollo larval en el camarón
está marcado por la aparición de la postlarva, de aspecto muy semejante al juvenil y adulto.
El rasgo morfológico más notorio es la presencia de un rostro romo y de pleópodos setosos,
además de diferencias menores en cuanto a la forma de la anténula, antena, maxilípedos, pereiópodos,
pleópodos y forma del telson. Contrariamente a lo que se podía esperar, los exopoditos
de los periópodos no se reducen bruscamente en la primera postlarva, como ocurre en otras
especies de peneidos, sino que la reducción es gradual a lo largo de las distintas mudas de
las postlarvas.
Para esta especie se ha fijado como carácter diagnóstico para reconocer el límite de la vida postlarval y el comienzo de la etapa juvenil la presencia de endopoditos en el primer pleópodo del macho, que se ha verificado a los 12,0 mm de longitud total.
Rostro: La primera postlarva presenta un rostro romo, muy corto. Dorsalmente tiene tres espinas, siendo una de ellas el diente epigástrico, generalmente aislado de los dos restantes dientes rostrales propiamente dichos que son más distales y se ubican sobre el rostro. El número de dientes rostrales aumenta en cada muda, generalmente de uno a dos cada vez, aunque hay mudas que no incorporan nuevos dientes. En las últimas postlarvas con tallas entre 12 y 13 mm el número de dientes rostrales es de 7 u 8 y aún el rostro no sobrepasa los ojos.
Anténulas: Presentan una estructura similar a la mysis, con tres segmentos basales y dos ramas distales segmentadas, cuyos tamaños y número de segmentos van aumentando a través de las mudas. En la primera postlarva, los ejemplares de 5,0 mm tienen la rama interna con cinco-seis segmentos y la externa con cuatro. Las últimas postlarvas presentan alrededor de 28 segmentos en la interna y 22 en la externa. En la región basal de la anténula se halla situado el estatocisto.
Antena: Compuesta por una rama interna o flagelo, segmentado y una rama externa que es la escama o escafognatito, con el borde externo liso, culminando en una espina y el borde interno redondeado y bordeado de largas sedas plumosas. El tamaño del flagelo es de aproximadamente 1,5 mm en las primeras postlarvas y alcanza alrededor de 9 mm en los ejempplares de 12–13 mm de longitud, aumentando de tamaño y número de segmentos en las sucesivas mudas.
Maxilípedos: Han sufrido profundos cambios en comparación con los estadios de mysis, principalemente con el modo de alimentarse.
Primer maxilípedo: Se ensancha notablemente. El exopodito aún persiste pero reduce su tamaño, tiene pocas sedas y es de tamaño ligeramente menor al endopodito. Este es aún segmentado y con algunas sedas. La porción basal interna se manifiesta en un lóbulo o pedúnculo que presenta sedas o setas en su borde. La porción basal y externa ha desarrollado una estructura lobular plana, que representa la futura branquia.
Segundo maxilípedo: Con la forma típica del adulto. El endopodito con el extremo distal curvado internamente en forma de gancho. El pedúnculo o región basal consiste en dos segmentos. El exopodito alcanza el extremo distal del meropodito y las setas plumosas se han reducido en número y tamaño.
Tercer maxilípedo: De forma típica, alargado y recto, con el endopodito compuesto por cinco segmentos y el pedúnculo por dos. El exopodito, reducido, alcanza el borde distal del meropodito.
Pereiópodos: Con rasgos normales de los peneidos. Los exopoditos de los pereiópodos están moderamamente reducidos en la primera postlarva con un número menor de sedas plumosas, típicas del estadio de mysis, la reducción del tamaño de los exopoditos hasta su total desaparición es gradual a medida que se suceden las mudas. En ejemplares de una longitud total entre 8 y 9 mm los exepoditos se hallan muy reducidos y contribuyen a la natación.
Pleópodos: Como se ha indicado los caracteres de los pleópodos son fundamentales para definir el estadio. Los cinco pares de pleópodos son setosos, segmentados y bien desarrollados. En las primeras postlarvas son unirramados hallándose presente sólo el exopodito, apareciendo el endopodito rudimentario en ejemplares mayores de 6,0 mm de longitud total. El desarrollo de este endopodito o rama interna del apéndice se realiza desde los pleópodos posteriores hacia los más anteriores. El endopodito del primer par de pleópodos se hace visible a partir de 12 mm de longitud, y su posterior desarrollo dará como resultado el petasma de los machos. Por lo tanto los camarones superiores a los 13 mm y que no presenten endopodito en el primer pleópodo, deben ser considerados hembras.
Urópodos y telson: La forma y estructura de los urópodos permanece invariable y acompaña al telson formando la aleta caudal. El telson es de forma rectangular; está provisto de cuatro pares de fuertes espinas laterales, siendo la más externa la mayor, dispuestas en el tercio distal y una serie de cuatro pares de procesos menores. El extremo distal del telson es recto en la primera postlarva y se va modificando con las sucesivas mudas, hasta hacerse puntiagudo por el desarrollo de un proceso central impar, hasta tomar la forma característica del telson del adulto.
6.2.9 Natación y reacciones de la postlarva. Una de las características de las postlarvas es la natación, realizada en la misma forma que los juveniles y adultos, empleando los pleópodos para avanzar. A medida que aumentan de talla, se reduce el comportamiento planctónico y frecuentemente se esconde en el substrato blando del fondo, especialmente en horas de elevada intensidad luminosa.
Desde las primeras postlarvas la coloración es parda, debido a las diferentes gamas de cromatoforos que cubren todo el cuerpo y los apéndices. Cuando los animales son alojados en recipientes de fondo blanco, la coloración general se hace más clara.
6.2.10 Caracterización del juvenil. Se determina como juvenil el camaroncito comprendido entre 12 mm de longitud total y 60–70 mm de largo total. Los endopoditos del primer par de pleópodos, crecen a partir de la mitad del borde interno del protopodito del apéndice; cuando hacen su aparición miden aproximadamente ⅓ de la longitud del basipodito. En ejemplares que miden entre 18 y 20 mm el endopodito alcanza el extremo distal del protepodito. A partir de los 25 mm de longitud pueden hallares ejemplares con los endopoditos unidos formando un verdadero petasma, aunque existen ejemplares de mayor talla que no los tienen unidos. La aparición del petamma unido ocurre en ejemplares con más de 11 espinas rostrales y telson bien desarrollado.
En los juveniles las características de la especie son bien evidentes, prepercienes del cuerpo, color pardo variable, etc. Sólo el número de dientes rostrales no es el definitivo del adulto que llega a tener 14 y 17. A partir de los 30–35 mm se observa un crecimiento desigual entre ambos sexos, siendo mayor el de la hembra.
7. CONCLUSIONES
De estas investigaciones se concluye que el camarón puede ser cultivado en el laboratorio, a partir de hembras grávidas, obtenidas en el área de pesca comercial, en las aguas costeras de Mar del Plata, durante la época de madurez sexual, entre septiembre y diciembre de cada año. El método de cultivo es igual al que se emplea en la etapa de laboratorio, en Japón, Estados Unidos de América y otros países que se dedican a la crianza de peneidos comerciales.
El desarrollo larval es más prolongado que en las especies del género Penaeus, pero de acuerdo con las experiencias realizadas, los días que dura el desarrollo larval, pueden acortarse con temperaturas algo más elevadas, lo cual es mucho más conveniente, al reducirse el período más crítico de la vida del camarón. Por otra parte la mortalidad en el estadio de protozoea puede ser controlada y disminuida, con adecuado alimento y mejores condiciones ambientales. El crecimiento de la especie es bueno, teniendo en cuenta la talla más bien pequeña y la región templada donde habita. El cuerpo delgado y el rostro largo, especialmente en las hembras, presenta una relación entre la talla y el peso relativamente baja.
Si se tiene en cuenta, no obstante lo señalado anteriormente, el alto valor del camarón en el mercado de consumo, donde se le encuentra en tallas que oscilan entre 60 y 135 mm de largo, así como la importancia que reviste, cada día más, como carnada para la pesca deportiva aún en tamaños inferiores a los señalados, pudiendo llegar a la venta entre 30 y 50 pesos argentinos por kg con cabeza (dólares EE.UU. 1, equivale a 10 pesos nuevos argentinos), se justifica todo intento de producción en mayor escala. Además existe la posibilidad de preparar pasta de camarón con los animales de tallas no comerciales que son capturados con la red convencional sin valor para el consumo directo.
La etapa inmediata que se debe encarar actualmente, dado la experiencia acumulada y habiéndose resuelto satisfactoriamante los aspectos de crianza a nivel de laboratorio, es la instalación de una base o estación para iniciar la cría de este peneido y el langostino a mayor escala.
El proyecto de la referida Estación de Maricultura fue presentado ante las autoridades del Ministerio de Economía de la Provincia de Buenos Aires en febrero de 1972, mencionándose las distintas etapas necesarias para llevarlo a cabo, consignando la superficie requerida de terreno en una primera etapa que tendrá la finalidad de planta piloto. Su ubicación podría estar en inmediaciones de la Albufera Mar Chiquita a sólo 40 km de la sede del Instituto de Mar del Plata. En este proyecto se dan detalles de las construcciones principales y el orden cronológico de realización de las mismas, incluyendo los laboratorios, salas y piletas de cultivos internos, estanques externos, bomba y filtros para el agua salada, vivienda para el cuidado y personal, etc. (Fig. 18). Por otra parte se indican los pasos a seguir para llevar a cabo el cultivo en forma masiva y en estanques internos y externos de las especies de peneidos comerciales hasta tallas de preadulto (Fig. 18).
La realización y puesta en marcha del cultivo y crianza de camarones comerciales marinos, requerirá, naturalmente, una planificación en tiempo y espacio, con la integración de un grupo de investigadores y técnicos a nivel interdisciplinario que permita asegurar el éxito de la empresa.
Los aspectos básicos que deberán encararse simultáneamente con los cultivos propiamente dichos, serán los siguientes:
desarrollo gonadal y fecundidad de las especies a cultivar
lograr la madurez gonadal de hembras en los mismos estanques de cultivo, sin depender totalmente de los animales silvestres
obtener desove total de hembras en cautividad
investigaciones sobre cultivos de fitoplancton con el fin de lograr la composición más adecuada para la alimentación de las protosoeae
estudio de la nutrición más conveniente, tanto para las fases larvales, postlarvales, juveniles y de adultos (alimento vivo y alimento preparado-balanceado)
estudio de las condiciones ambientales, relativo a la tolerancia a los cambios de temperatura, salinidad, oxígeno y otras variables
control microbiano de los cultivos y de las enfermedades en las distintas etapas del desarrollo
estudio de la variación de la composición química de juveniles y adultos en relación con distintos tipos de alimentación y la talla y peso logrado con la edad.
Hasta el presente se han encontrado dificultades para concretar el mencionado proyecto, en razón de que no se ha dispuesto de los recursos financieros mínimos para iniciar las construcciones citadas, si bien se ha hallado eco favorable en las distintas instituciones y funcionarios con quienes se habló sobre el particular.
La importancia de seguir con este proyecto está fundamentada, básicamente, en que se han superado con éxito las etapas de laboratorio, que son el paso imprescindible para iniciar los trabajos a un nivel mayor. Por otra parte los trabajos y esfuerzos dedicados en otros países del mundo a este tipo de cultivos, dan respaldo a la línea de trabajo sugerida, por el éxito logrado en los últimos años en la crianza artificial de peneidos comerciales marinos. Asimismo en el proyecto presentado por el Instituto de Biología Marina se contempla la posibilidad de extender estos cultivos a otros organismos de interés comercial como moluscos y peces.
8. AGRADECIMIENTOS
Cumplimos en agradecer a todo el personal del Instituto de Biología Marina que colaboró de alguna forma en estas investigaciones. Especialmente al Dr. J.I. Carreto y sus colaboradores del Laboratorio de Agua de Mar y Bioproducción del Instituto por el asesoramiento y análisis; al equipo del Laboratorio de Carcinología Lic. J.L. Fenucci, Srta. A. Valentini. Sr. S. Daloi y Srta. Lydia A. Gómez, especialmente a esta última por su interés y eficiencia en el cuidado de los cultivos. Al fotógrafo Sr. Miguel A. Scelzo y al dibujante Sr. S. Pereyra. También al Intendente del Instituto Sr. H. Bezzi y al pescador que colaboró en la obtención del material de estudio Sr. Pugliesi.
9. REFERENCIAS BIBLIOGRAFICAS
Allen, D.M., 1963 Shrimp farming. Fish. Leaflet 551; Bureau of Comm. Fish., 8 p.
Anderson, W.W., J.E. King y M.J. Lindner, 1949 Early stages in the common marine shrimp, Penaeus setiferus (Linnaeus). Biol. Bull., 96(2): 168–72
Boschi, E.E., 1969 Crecimiento, migración y ecología del camarón comercial Artemesia longinaris (Bate). FAO Fish. Rep., 57(3):833–46
Boschi, E.E., 1969a Estudio biológico pesquero del camarón Artemesia longinaris (Bate) de Mar del Plata. Bol.Inst.Biol. Marina, 18:1–47
Boschi, E.E., 1972 El acuario de agua salada para experiencias de laboratorio. Contrib.Inst.Biol. Mar., No. 220, 23 p.
Boschi, E.E., (en prensa), Cultivo de Camarones Comerciales Marinos. Com.Invest.Cient.Prov. Bs.Aires
Boschi, E.E. y M.A. Scelzo, 1967 Campaña de pesca exploratoria camaronera en el litoral de la Provincia de Buenos Aires. Proy.Des.Pesq. Mar del Plata, Publ. No. 2, 15 p.
Boschi, E.E., 1969 Nuevas campañas exploratorias camaroneras en el litoral argentino, 1967–68, con referencias al plancton de la región. Proy.Des.Pesq. Arg.Publ., 16:1–31
Boschi, E.E., M.A. Scelzo y B. Goldstein, 1967 Desarrollo larval de dos especies de crustáceos decápodos en el laboratorio. Pachycheles haigae (Rodrigues Da Costa) (Porcellanidae) y Chasmagnathus granulata (Dana) (Grapsidae). Bol.Inst.Biol.Mar., 12:1–46
Christiansen, E.H. y M.A. Scelzo, 1971 Ciclo de maduración sexual y observaciones sobre la morfología del aparato genital del camarón Artemesia longinaris (Bate) (Resultados preliminares). CARPAS/5/D.Técn., 16:1–22
Ciechomski, J.D.C. de y E.E. Boschi, 1968 Resultados de salidas costeras frente a Mar del Plata, para estudios de huevos y larvas de peces y crustáceos comerciales. Año 1967. Proy.Des.Pesq.Publ., 6:1–8
Cook, H.L. y M.A. Murphy, 1965 Early developmental stages of the rock shrimp, Sicyonia brevirostris (Stimpson), reared in the laboratory. Tulane Studies in Zool., 12(4):109–27
Cook, H.L., 1966 Rearing penaeid shrimp from eggs to postlarvae. Proc.Conf.Southern Ass.Game Comms., 19:283–8
Cook, H.L., 1969 The culture of larval penaeid shrimp. Trans.Amer.Fish.Soc., 98(4):751–4
Costlow, J.D., 1969 Cultivation of marine invertebrates. Marine Biology, 5:1–606. Gordon and Breach, Sc.Publ.
Dall, W., 1958 Observations on the biology of the green tail prawn, Metapenaeus mastersii (Haswell) (Crustacea, Decapoda, Penaeidae). Austr.Jour.Mar.Fresw.Res., 9(1):111–34
Dobkin, S., 1961 Early development stages of pin shrimp, Penaeus duorarum from Florida waters. Fish.Bull., 190(91):321–49
Ewald, J.J., 1965 The laboratory rearing of pink shrimp Penaeus duorarum. Bull.Mar.Sc., 15(2): 436–49
Fujinaga (Hudinaga), M., 1967 Kuruma shrimp (Penaeus japonicus) cultivation in Japan. FAO Fish. Rep., 57(3):811–32
Gurney, R., 1924 Crustacea. IX. Decapod Larvae. Nat.Hist.Rep.British Antarctic (Terra Nova) Exp. 1910 (Zool), 8(2):37–202
Gurney, R., 1939 Bibliography of the larvae of Decapod Crustacea. The Soc.London, 123 p. (reimpreso 1960)
Gurney, R., 1942 Larvae of Decapod Crustacea. The Ray Soc., London, 306 p. (1960, reimpreso)
Heldt, J., 1938 La reproduction chez les crustacés décapodes de la famille des peneids. Ann.Inst. Océanogr.Paris, H.G., 18(2):1–206 (sin consultar)
Hudinaga, M., 1935 Studies on the development of Penaeus japonicus (Bate). Rep.Hayatomo Fish. Inst., 1(1) (sin consultar)
Hudinaga, M., 1942 Reproduction, development and rearing of Penaeus japonicus (Bate). Japanese Jour.Zool., 19(2):305–93
Hudinaga, M. y J. Kittaka, 1966 Studies on food and growth of larval stage of a prawn Penaeus japonicus, with reference to the application to practical mass culture. Inform. Bull.Plankt.Japan, 13:83–9
Hudinaga, M. y M. Miyumura, 1962 Breeding of the “kuruma” prawn, Penaeus japonicus (Bate). J. Oceanog.Soc.Japan, 20th Ann. Vol., 694–5
Hudinaga, M.C. y J. Kitara, 1967 The large scale production for the young “kuruma” prawn, Penaeus japonicus (Bate). Inf.Bull.Plankt.Japan, 35–46
Johnson, M.C. y F.H. Fielding, 1956 Propagation of the white shrimp Penaeus setiferus (Linnaeus) in captivity, Tulane Studies in Zool., 4(6):175–90
Loesch, H., 1963 Distribution and growth of penaeid shrimp in Mobile Bay, Alabama. Inst.Mar.Sc., 10:41–58
Mock, C.R. y M.A. Murphy, 1971 Techniques for raising penaeid shrimp from the egg to postlarva. Contribution No. 307. Bur.Comm.Fish.Biol.Lab.Galveston, Texas, Proc.First Ann. Workshop World Mar.Soc., 143–56
Neal, R.A., 1970 Experimentación en cultivo del camarón. Centro Latin.Cap.Met.Invest.Biol.Pesq. del camarón y evaluación de los recursos camaroneros, 70/Loc.9/Tema 3(f):1–4 México
Pearson, J.C., 1939 The early life histories of some American Penaeidae chiefly the commercial shrimp Penaeus setiferus (Linnaeus), Bull.Bur.Fish., 49(30)1–73
San Feliu, J.M., F. Muñoz y M. Alcaraz, 1973 Técnicas de la cría artificial de crustáceos. Invest.Pesquera, 37(3):557 p.
Scelso, M.A., 1971 Identificación, distribución y abundancia de larvas, postlarvas y juveniles del camarón Artemesia longinaris (Bate) (Crustacea; Decapoda; Penaeidae) en las aguas costeras de la Provincia de Buenos Aires, Rca.Argentina, CARPAS/5/D. Técn., 17:1–18
Wheeler, R.S., 1968 Culture penaeid shrimp in brackish ponds, 1966–67. Proc.22nd Annual Conf. Southeast Assoc. Game Fish.Comm., 387–91
Anexo I
Abreviaturas empleadas en el texto y en las ilustraciones
A1: anténula
A2: antena
br: branquia
Bs: basipodito
ca: carpopodito
cx: coxopodito
da: dactilopodito
endo: endopodito
exo: exopodito
isq: isquiopodito
lm: lóbulo masticatorio
Lt: longitud total
m: mandíbula
max: maxilípedo
me: meropodito
p: pereiópodo
pb: pedúnculo o lóbulo basal
pl: pleópodo
pr: protopodito
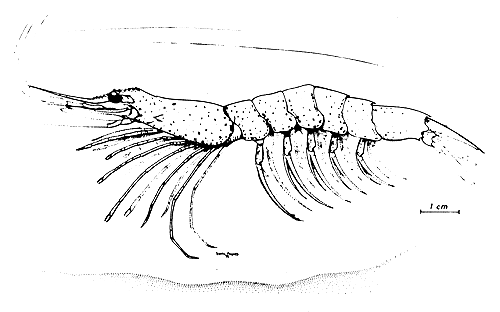
Fig. 1 El camarón de Argentina Artemesia longinaris Bate 1888 (Dibujo S. Pereyra)
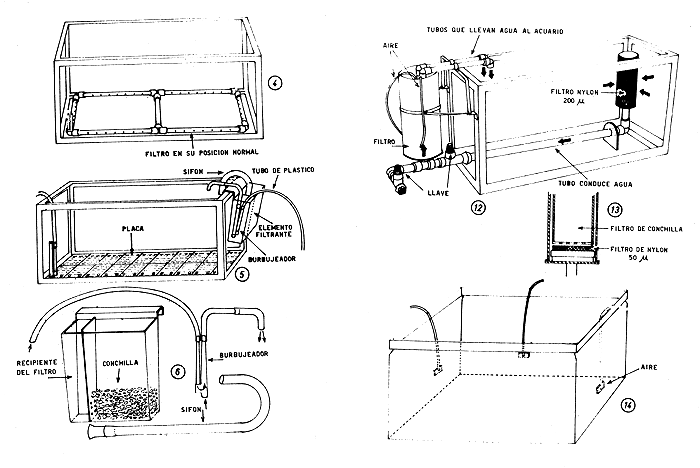
Fig. 2 (Isquierda) distintos tipos de filtros utilizados en las experiencias. (Derecha) Filtro externo e interno en un tipo de acuario utilizado en los trabajos y recipiente de polietilene empleado en los cultivos. Según Boschi, 1972.
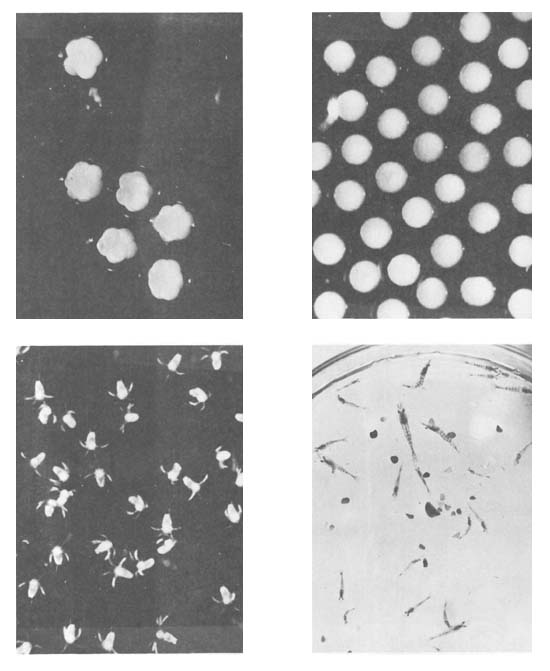
Fig. 3 Artemesia longinaris. Superior, izquierda: huevos en 8 y 16 blastómeros; derecha, huevos en estadios de mórula y gástrula. Inferior, izquierda: nauplii; derecha postlarvas y juveniles
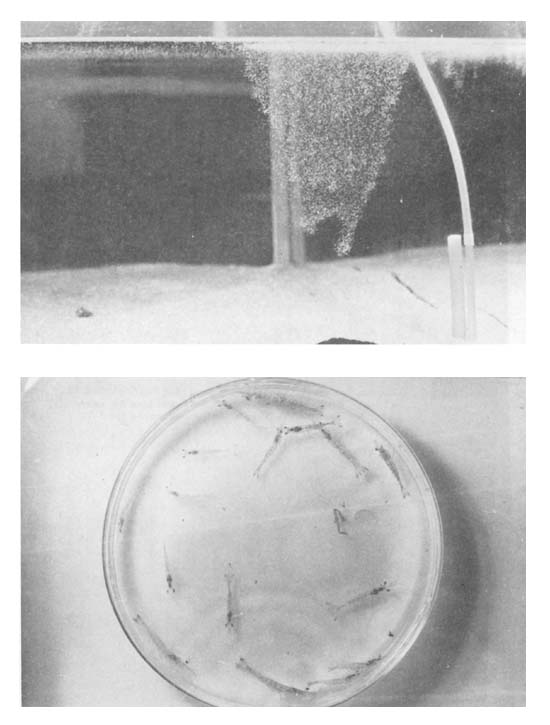
Fig. 4 Superior. Conjunto de Nauplii de Artemesia longinaris en un acuario de cultivo Inferior. Postlarvas y juveniles criados en cautividad. A pesar de ser del mismo desove las talles son muy distintas
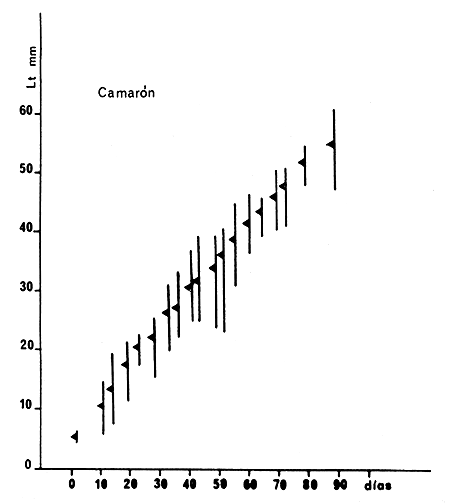
Fig. 5 Valores medios (triángulos) y amplitud de distribución (líneas verticales) de un lote de camarones de ambos sexos criados en cautividad entre noviembre de 1972 y febrero de 1973 (Cuadro I)
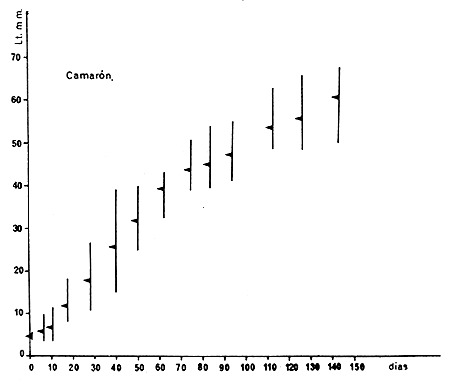
Fig. 6 Valores medies (triángulos) y amplitud de distribución (líneas verticales) de un lote de camarones de ambos sexos criados en cautividad entre noviembre de 1973 y abril de 1974 (Cuadro II)
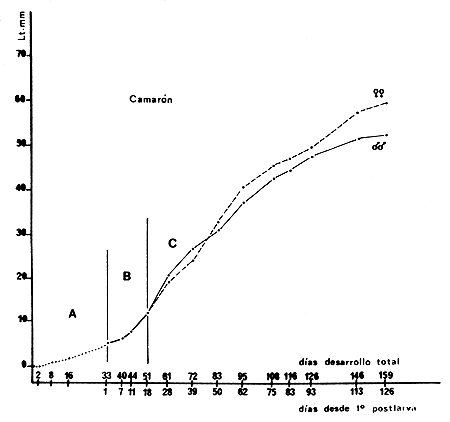 | 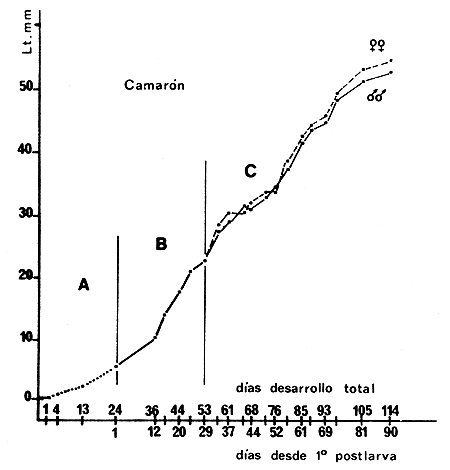 |
Fig. 7 Curva de crecimiente de un lote de camarones criados en cautividad (Cuadro I) entre noviembre de 1972 y febrere de 1973. La primera parte de la curva A indica el desarrollo larval que duró 24 días con temperaturas entre 17 y 20°C. La parte B indica el crecimiento de las postlarvas con temperaturas entre 19 y 22°C. En la parte C se comsigna el crecimiento de juveniles, machos y hembras, con temperaturas entre 20 y 24°C | Fig. 8 Curva de crecimiento de un lote de camarones criados en cautividad (Cuadro II) entre noviembre de 1973 y abril de 1974. La primera parte de la curva A indica el desarrollo larval que duró 33 días con temperaturas entre 16 y 18°C. La parte B indica el crecimiento de las postlarvas con temperaturas entre 17 y 21°C. En la parte C de la curva se consigna el crecimiento de juveniles, machos y hembras, con temperaturas entre 18,5 y 23,5°C |
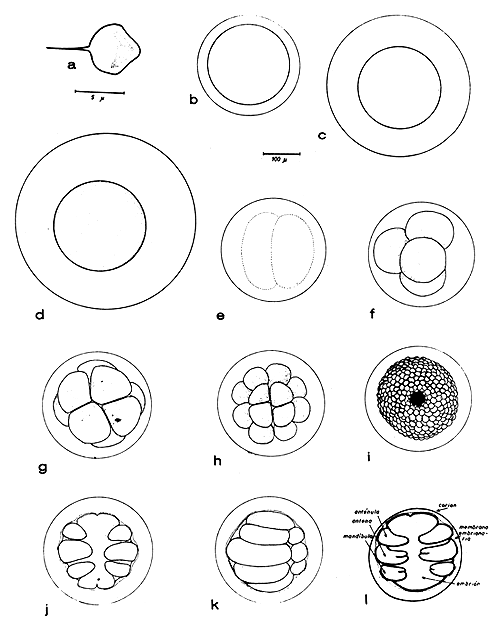
Fig. 9 Desarrollo embrionario del camarón Artemesia longinaris. a: espermatozooide (escala 5 μ): b, c y d: huevos fecundados, con membrana coriónica de distinto tamaño: e: huevos en etapa de 2 blastómeros; f: etapa de 4 blastómeros; g: etapa de 8 blastómeros; h: etapa de 16 blastómeros; i: etapa de mórula con blastoporo visible; j: embrión con apéndices en formación, vista ventral; k: ídem vista lateral; l: embrión con antena y mandíbula bifurcadas en su extremo (escala 100 μ)
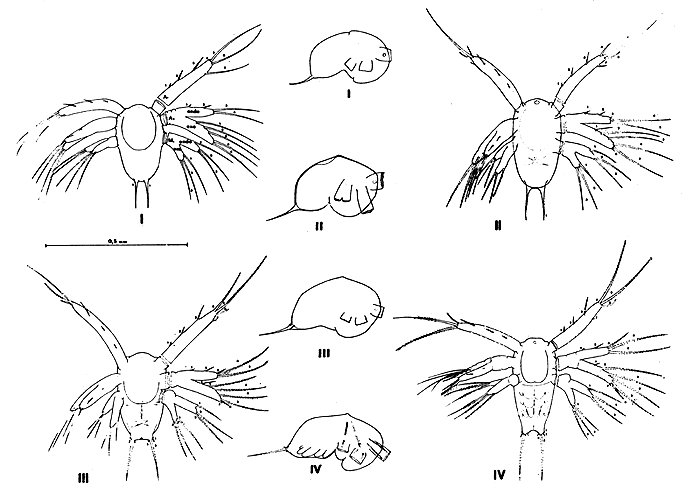
Fig. 10 Nauplius 1, 2, 3 y 4 del camarón Artemesia longinaris. I: Nauplius 1, vista ventral y lateral; II: Nauplius 2, vista ventral y lateral; III: Nauplius 3, vista ventral y lateral; IV: Nauplius 4, vista ventral y lateral. A1 : anténula; A2 : antena; M : mandíbula; endo: endopodito; exo: exopodito (escala 0,5 mm)
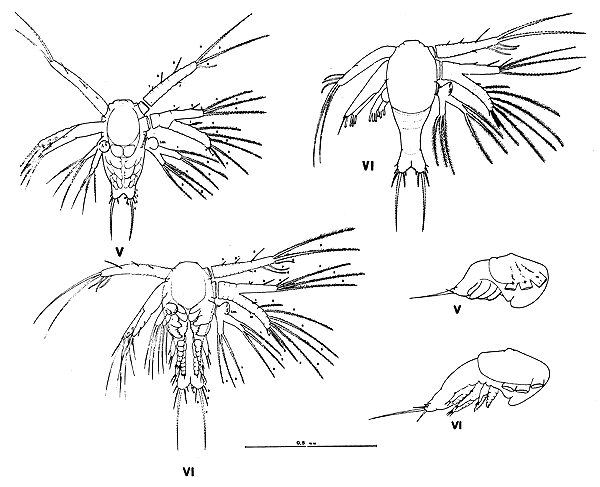
Fig. 11 Nauplius 5 y 6 del camarón Artemesia longinaris. V: Nauplius 5, vista ventral y lateral. VI: Nauplius 6, vista ventral, lateral y dorsal (escala 0,5 mm)
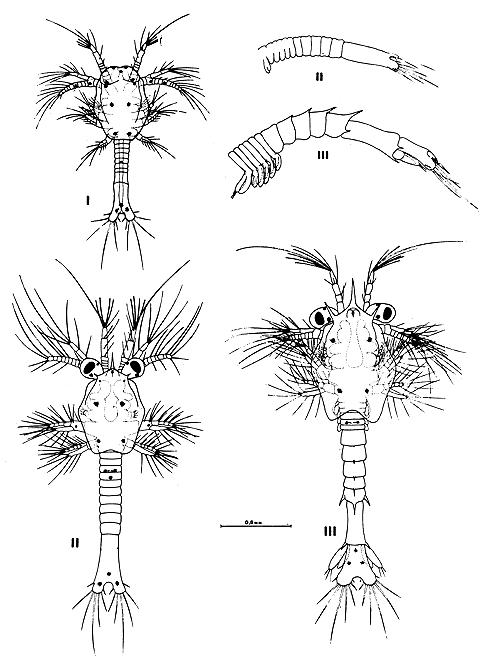
Fig. 12 Protozoea 1, 2 y 3 del camarón Artemesia longinaris. I: Protozoea 1°, vista dorsal; II: Protozoea 2°, vista dorsal y vista lateral del tórax y del abdomen; III: Protozoea 3°, vista dorsal y vista lateral del tórax y del abdomen (escala 0,5 mm)
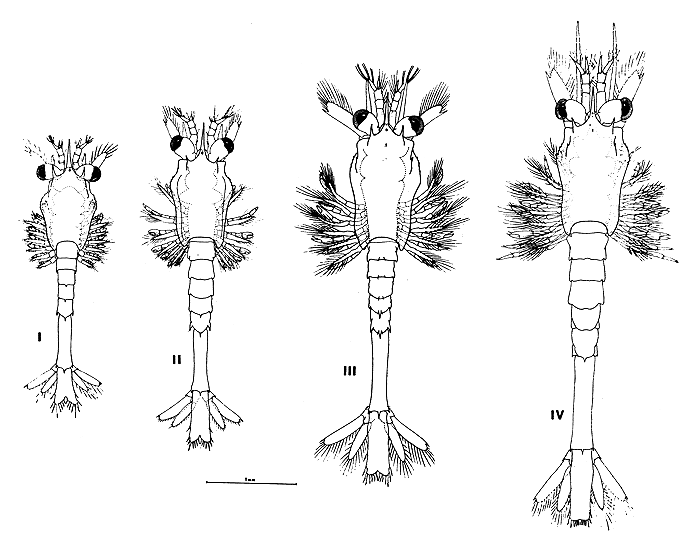
Fig. 13 Mysis 1, 2, 3 y 4 del camarón Artemesia longinaris. Vista dorsal (escala 1 mm)
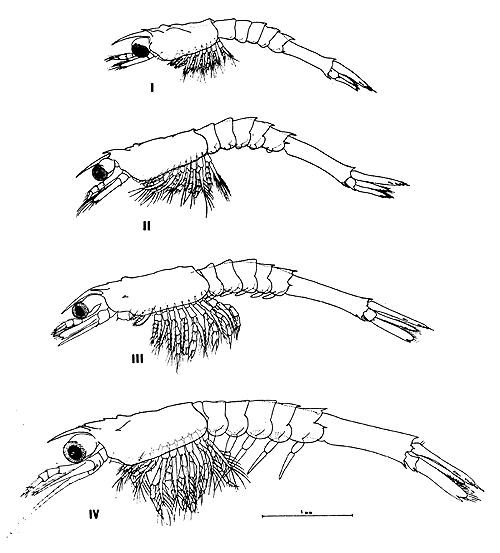
Fig. 14 Mysis 1, 2, 3 y 4 del camarón Artemesia longinaris. Vista lateral (escala 1 mm)
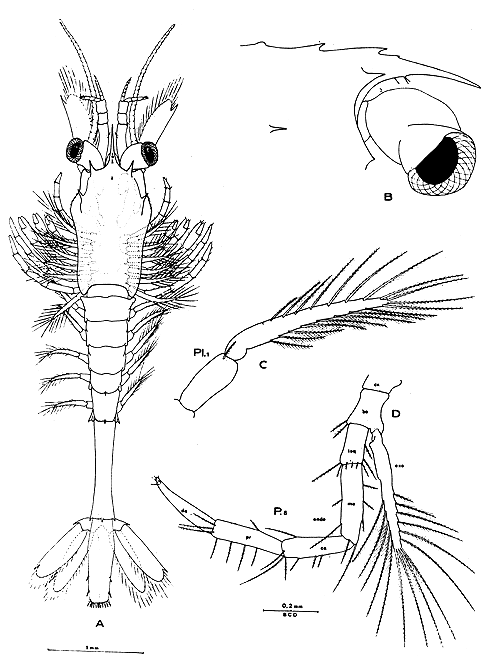
Fig. 15 Mysis postlarva del camarón Artemesia longinaris. A: vista dorsal (escala 1 mm); B: rostro; C: pleópodo 1°; D: pereiópodo 5°; bs: basipodito; ca: carpopodito; cx: coxopodito; da: dactilopodito; endo: endopodito; exo: exopodito; isq: isquiopodito; me: meropodito; pr: protopodito (escala 0,2 mm)
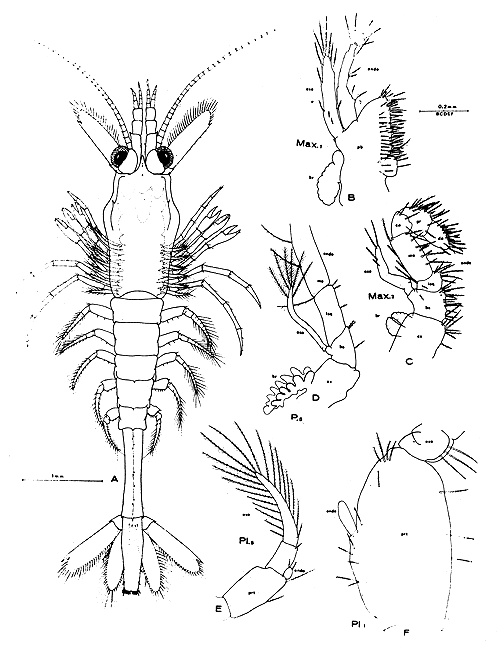
Fig. 16 Postlarva del camarón Artemesia longinaris. A: postlarva 1°, LT: 5,03 mm vista dorsal (escala 1 mm); B: primer maxilípedo; C: segundo maxilípedo; D: pereiópodo 5°, postlarva LT: 6,5 mm; E: pleópodo 5°, postlarva LT: 6,5 mm; F: pleópodo 1°, postlarva LT: 12,6 mm. br: branquia; bs: basipodito; ca: carpopodito; cx: coxopodito; da: dactilopodito; endo: endopodito; exo: exopodito; isqu: isquiopodito; me: eropodito; pb: pedúnculo basal; pr: propodito; prt: protopodito (escala 0,2 mm)

Fig. 17 Rostro y extremidad del telson de postlarvas y juveniles del camarón Artemesia longinaris. A y A' rostro y telson de postlarva de LT: 5,4 mm; B y B' ídem de postlarva de LT: 6,6 mm; C y C' ídem de postlarva de LT: 7,5 mm; D y D' ídem de postlarva LT: 8,6 mm; E y E' ídem de postlarva LT: 9,2 mm; F y F' ídem de juvenil LT: 12,0 mm
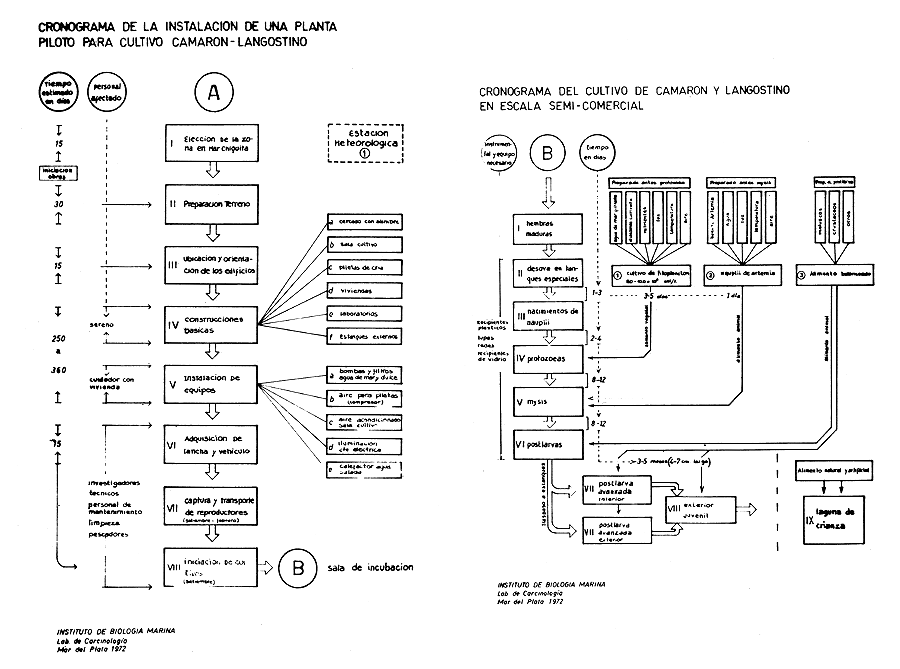
Fig. 18 Izquierda, cronograma de instalación de la Estación de Maricultura, según el proyecto elaborado y, derecha, los distintos pasos para llevar a cabo el cultivo de los peneidos comerciales