Daniel Novoa, Joseph Koonce, Freddy Ramos y Ana Locci
7.1 RESUMEN
El represamiento de las aguas del río Coroní creó un lago artificial de 4.000 m2, cuya finalidad principal es la producción de energía eléctrica. Considerando su tamaño, se pensó en la importancia de su aprovechamiento pesquero y con este objeto se realizó estimaciones del potencial pesquero, entre los años 1984 y 1987.
El material íctico recolectado correspondió a aproximadamente 30 especies; entre éstas se encuentran 15 especies de tamaño mayor, con importancia pesquera, siendo el “pocoro”, Prochilodus rubrotaeniatus, la más abundante. Algunas de estas especies ícticas completan su ciclo reproductivo en el lago, por ejemplo, "curvinata, “pavón”, “aimará” y “caribe”; el “pocoro” y otros desovan fuera del lago, donde permanecen hasta los tres años.
Para las especies más comunes se obtuvieron las relaciones edad y talla, además de longitud, peso y fecundidad. Asimismo, se estudió la alimentación y el período de reproducción. Las estimaciones de biomasa íctica oscilaron entre los 12.000 y 20.000 kg/ha/año.
ABSTRACT
The damming of the water of the Caroní river created an artificial lake of 4,300 km, which is mainly utilized for generation of electricity. In view of its size, it was considered than it could be utilized for fishery production and potential estimates were carried out between 1984 and 1987 for this purpose.
The technical material collected corresponded to approximately 30 fish species, among them 15 larger species which have the greatest relative importance: “coporo” (Prochilodus rubrotaeniatus) is the most abundant. Some of these species complete their reproductive cycle in the lake (“curvinata”, “pavón”, “aimará”, “caribe”). “Coporo” and others spawn out of the lake, where they remain up to their third year of age.
Data obtained for the more common species were: relation between age and size; length, weight and fertility; feeding and reproduction period were also studied. Estimates of the biomass fluctuated between 12,000 and 20,000 kg/ha/year.
7.2 ANTECEDENTES HISTORICOS
El río Caroní es el río de aguas negras más importante y de mayor potencial hidroeléctrico del país. Posee gran velocidad debido a un pronunciado desnivel, que en los últimos 215 kilómetros es de 240 m., lo cual define una pendiente de 1,12 m. por kilómetro recorrido. Posee un gasto máximo promedio de unos 9.000 m3/segundo y un mínimo de 1.700 m3/segundo durante el período de aguas bajas (Vásquez, 1984). Este mismo autor presenta los valores de algunos parámetros físico-químicos de las aguas del bajo Caroní, así como del embalse Macagua I.
El gran potencial hidroeléctrico del río Caroní comenzó a ser aprovechardo a finales de la década del 50, al inaugurarse la represa Macagua I, embalse de pequeño tamaño y destinado a suplir parte de las necesidades energéticas de la población humana a asentarse en lo que constituiría el núcleo urbano mas importante del sur de Venezuela.
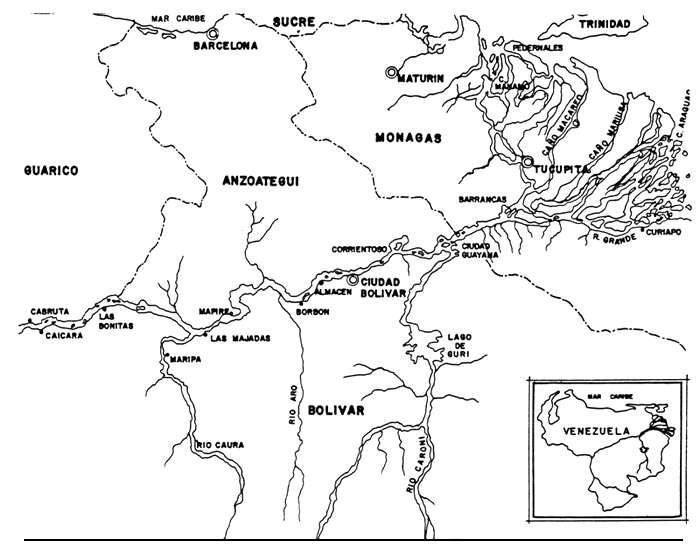
Años después, en 1968, cuando el Gobierno pone en servicio la primera unidad de 175.000 KW de capacidad, embalsando al río Caroní en el caño Nekuima, se da un paso trascendental para el futuro de la región sur del país. Durante la primera etapa de desarrollo eléctrico del Guri se había creado lo que sería el lago artificial más grande del país, a ser empleado en la generación de energía hidroeléctrica. Parte de la capacidad eléctrica instalada serviría para alimentar a las principales industrias medianas y pesadas que se establecerían en ciudad Guayana, dando así origen a un nuevo polo de desarrollo y centro industrial de Venezuela (Figura 1).
En la etapa final del proyecto, a concluirse en 1986, se elevaría el nivel del embalse hasta la cota de 270 m., para completar una capacidad instalada de energía hidroeléctrica de cerca de 9 millones de KW, lo cual, además de atender las necesidades regionales de electricidad, significaría además una fuente energética para gran parte del territorio nacional.
De esta forma se creó un lago artificial de magnitud gigantesca, alcanzando una superficie cercana a los 4.300 kilómetros cuadrados, orientado básicamente hacia la generación de energía hidroeléctrica. No obstante, es inevitable que este inmenso espejo de agua dé lugar a otras actividades que no necesariamente entorpezcan el fin básico para el cual fue creado el lago, pero que demandarán de los administradores del embalse una visión distinta, dando cabida a planes que conviertan al lago de Guri en un recurso de usos múltiples.
7.3 EL APROVECHAMIENTO PESQUERO DEL LAGO DE GURI
Es lógico pensar que cualquier otro interés o uso posible del lago de Guri, diferente de la producción de hidroelectricidad, tenga un valor secundario. No obstante, el hecho de que el país disponga de un nuevo espejo de agua, de gran superficie, ofrece la posibilidad de aprovechar el potencial pesquero que dicho lago pueda tener. Experiencias obtenidas en otras partes del mundo demuestran que es posible la explotación pesquera en los embalses, constituyéndose en reservorios de variada importancia para la producción de pescado. Hay un rango amplio de rendimientos posibles, lo cual depende de las características físicas del lago artificial, de la fertilidad de las aguas, tamaño del embalse, profundidad media del mismo, así como de la magnitud de su superficie inundable. Welcomme (1979) presenta una lista de lagos de Africa y Asia, en los cuales los rendimientos pesqueros oscilan entre 7 y 300 kg/ha/año.
El lago de Guri es alimentado por el río Caroní, que es de aguas oscuras, pobre en nutrientes y ácidas. La profundidad promedio del lago es más bien elevada, por lo cual cabría esperar que su potencialidad pesquera teórica sea baja. Sobre esta base teórica se han hecho estimaciones del potencial pesquero sostenible de sólo 19 kg/ha/año (Alvarez, et al. 1986), el cual es alto para los valores típicos registrados en climas templados, pero más bien bajos en comparación con otros lagos tropicales (Hecky, 1984) y ríos (Novoa, 1988).
Los ríos caudalosos, poco fértiles y de estrecho plano inundable, suelen tener baja potencialidad pesquera, lo cual no necesariamente es el caso cuando se represan, ya que el establecimiento de un ambiente léntico conlleva el atrape de sedimentos y la inundación de terrenos de vegetación variada, que representan aportes orgánicos que mejoran las condiciones para la vida acuática, tanto animal como vegetal. En el caso del lago de Guri, la magnitud del plano inundable es mayor a las 100.000 hectáreas de vegetación variada, especialmente de sabanas. Esto significa masas gigantescas de material alóctono que anualmente se incorporan al lago y elevan sustancialmente la potencialidad pesquera del embalse.
En este informe se reportan los resultados obtenidos en un programa de pesca exploratoria desarrollado entre diciembre de 1984 y diciembre de 1987, en distintas localidades del lago de Guri, empleando artes de pesca similares a las de uso común en el río Orinoco, especialmente redes de ahorque de tamaños de malla variables.
7.4 RESULTADOS OBTENIDOS
a) Capturas totales: Durante los tres años de muestreo se capturaron cerca de 40.000 kilos de pescado con redes de ahorque. También se emplearon palambres y pesca al cordel, lográndose capturas de poca importancia. En la Tabla 1 y Figura 2 se presentan las capturas anuales distribuidas por especie, así como la composición porcentual. Se deduce la presencia de 15 especies de peces grandes, de las cuales el coporo (Prochilodus rubrotaeniatus) es la de mayor importancia relativa. Luego prosiguen una variada gama de especies carnívoras, predadores típicos, entre los que destacan la payara (Hydrolicus scomberoides), el pavón (Cichla ocellaris; C. temensis), la curvinata (Plagioscion squamosissimus) la aimara (Hoplias macrophtalmus), y el caribe blanco (Serrasalmus rhombeus). Otras especies que aparecen con cierta regularidad, pero de poca importancia relativa, son el bagre yaque (Leiarius sp.) y la guitarrilla (Opsodoras sp.), bagre omnívoro el primero y consumidora de zoobentos la segunda
b) Captura por unidad de esfuerzo de pesca: Durante el período considerado se distribuyeron mes a mes las capturas y esfuerzos de pesca correspondientes, obteniéndose a partir de éstos un estimador del tamaño poblacional de cada especie e ictiomasa total. El índice empleado en este trabajo fue el kg/hora/100 m de red.
En pesquerías desarrolladas, las variaciones de este índice en el tiempo permiten llegar a conclusiones sobre el estado de los recursos y las posibles condiciones de manejo óptimo. Los modelos matemáticos utilizados para este propósito, llamados de rendimiento excedente, pronostican que entre el tamaño poblacional (captura por unidad de esfuerzo) y el esfuerzo de pesca, se establece una relación lineal negativa (modelo de Schaefer) o exponencial negativa (modelo de Fox), expresando en cualquier caso que intensidades de pesca crecientes reducen el tamaño de la población virgen. A cada tamaño poblacional corresponde una tasa de crecimiento o reemplazo que es máxima a un tamaño poblacional medio.
En la Figura 3 se presentan los valores de captura por esfuerzo contra el esfuerzo de pesca, verificándose una relación muy débil entre estas variables. Estos resultados sugieren que la magnitud o tamaño del recurso pesquero del lago de Guri es proporcionalmente muy grande, comparado con las mortalidades de pesca aplicadas durante el muestreo, por lo cual no se evidencia disminución alguna en el tamaño del recurso pesquero.
En la Figura 4 se muestran los cambios mensuales de la captura por unidad de esfuerzo durante el período muestreado, evidenciándose bruscas oscilaciones a corto plazo pero tendiendo a un valor promedio próximo a 1 kg/hora/100 m de red. Este valor es elevado, comparable a los sistemas fluviales tropicales más productivos, tal como se muestra en la Tabla 2 extraída de Welcomme (1979).
c) Comparación de rendimientos pesqueros entre el “día y la noche”: Las pescas experimentales fueron efectuadas durante todo el día, haciéndose dos revisiones diarias. De esta forma, las capturas obtenidas y los esfuerzos de pesca fueron distribuidos entre el día (07:00–16:30) y la noche (16:30–07:00), a fin de establecer las posibles diferencias en la capturabilidad de las distintas especies en relación al período del día.
Los rendimientos (kg/hora) para la noche fueron de tres a seis veces más altos que los rendimientos para el día, revelando una mayor eficiencia de las artes durante este período o una mayor actividad de las especies más importantes. La aimara, curvinata, bagre yaque y guitarrilla fueron capturados casi exclusivamente durante la noche o período de oscuridad. El boquimi (Leporinus freidereci) fue capturado casi exclusivamente de día. El pavón fue capturado en ambos períodos, pero los rendimientos diurnos fueron superiores. Dado que esta especie tiene gran demanda por parte de los pescadores deportivos, la diferencia encontrada puede servir para orientar un programa de ordenación pesquera entre los pescadores deportivos y la pesca artesanal con redes de ahorque, bien de subsistencia o de carácter comercial (Tabla 3).
d) Inventario ictiofaunístico: Durante el período de muestreo se han efectuado colecciones de las especies ícticas empleando las redes de ahorque; desde finales de 1986 se comenzó a utilizar el chinchorro de malla fina arrastrado a la playa, aumentando así la capacidad de muestreo, accediendo a las especies de pequeño tamaño, distribuidas en la zona litoral y constituyendo el llamado ictioforraje. El material biológico obtenido se ha identificado, registrándose poco más de treinta especies de peces. En la Tabla 4 se presenta la lista, indicando los nombres comunes y científicos de los integrantes de la comunidad íctica.
e) Ciclo reproductivo; madurez sexual y desove: Durante la presente investigación se ha podido verificar que algunas especies -las de mayor tamaño-completan su ciclo reproductivo en el lago, tales como curvinata, pavón, aimara, caribe, guitarrilla, etc. La curvinata presenta una importante fracción de hembras maduras a partir del mes de octubre, alcanzando el máximo porcentaje entre febrero y marzo, es decir, cuando el lago se aproxima a su mínimo nivel durante su fase descendente, que se inicia en septiembre. Una de las especies de pavón (Cichla ocellaris) presenta un ciclo reproductivo distinto, con la máxima frecuencia de hembras ovígeras entre mayo y septiembre, es decir, cuando el lago se encuentra en la fase ascendente y en la cota máxima. Esta especie, sin embargo, parece desovar durante todo el año, aunque con la mayor intensidad durante el período señalado. En las figuras 5a y 5b se presentan los ciclos reproductivos encontrados para la curvinata y el pavón.
El coporo (Prochilodus rubrotaeniatus, que es la especie más importante en términos de abundancia, no desova en el lago, reabsorbiendo los productos sexuales. El desarrollo gonádico es normal hasta la fase final de la madurez cuando ocurre la reabsorción. En los ríos Caroní y Paragua han sido capturados ejemplares pequeños de esta especie, así como en las lagunas situadas en los alrededores del lago, donde se ha capturado numerosos ejemplares juveniles. Este es uno de los rasgos más interesantes y únicos de la fauna ictícola del lago de Guri, en donde la especie más importante, en peso, desarrolla parte de su ciclo vital fuera del lago.
Los estudios demográficos realizados sobre la especie permiten afirmar que en el lago no se distribuyen ejemplares menores de tres años, ingresando al lago a esa edad después de permanecer en las áreas de crecimiento durante los primeros años de su ciclo de vida. El desove ocurre durante el movimiento desde las áreas de crecimiento hacia el lago, durante el período de lluvias. Una vez producido el desove, los ejemplares ingresan al lago, alcanzando edades muy avanzadas, sin que se tengan evidencias de que regresen a las áreas de desove. Una curiosa similitud en este ciclo vital ha sido informado para la zapoara (Semaprochilodus laticeps), especie endémica de la cuenca del río Orinoco y perteneciente a la misma familia del coporo del lago de Guri (Novoa y Ramos, 1982).
El muestreo del ictioforraje también ha permitido la recolección de ejemplares juveniles de otras especies, confirmándose el éxito reproductivo de las mismas, tales como la vieja o care-caballo (Geophagus surinamensis). De las especies pequeñas, base fundamental en la alimentación de las especies carnívoras, se ha verificado que las especies más comunes completan la reproducción en el embalse. También se ha determinado los valores de fecundidad total para las especies comerciales o industrializables más importantes. En la Tabla 5 se presentan los resultados obtenidos.
f) Distribución por tallas: Para las especies más comunes de peces grandes se obtuvieron las frecuencias de distribución por tallas, agrupando mes a mes y luego anualmente el número de individuos por cada rango de tallas. De esta forma, se construyeron los histogramas frecuencia de tallas, escogiéndose visualmente las tallas modales de la distribución correspondiente a cada especie; en las Figuras 6a y 6e se muestran los resultados obtenidos
g) Crecimiento: Basados en las relaciones talla-edad derivadas de las modas determinadas para cada distribución, se calcularon los parámetros de crecimiento utilizando el método de Bertalanffy. Este método se basa en un modelo de crecimiento de tres parámetros (Ricker, 1975):
Li = Linf (l - e -k(i-1))
donde: Li = es la longitud a la edad i
Linf = es la longitud máxima
k y to = son constantes
En las Figuras 7a - 7e se presentan las curvas de tallas teóricas por edad y los valores de los parámetros se presentan en la Tabla 6.
h) Relación talla-peso: Durante los muestreos biológicos se obtuvieron datos de largo y peso para cada una de las especies grandes recolectadas en las pescas exploratorias, haciéndose un análisis de regresión final de estas variables, previa transformación a logaritmos.
LOG (W) = b1 LOG (L) + bo
donde: W = es el peso total (gr)
L = es la longitud total (mm)
b1 = es la pendiente
bo = es la intercepción
En la Tabla 7 se presentan los parámetros de regresión obtenidos para las especies de peces grandes.
i) Relación fecundidad-peso: Para las especies anteriormente señaladas se estableció la relación fecundidad-peso total, linearizando la relación mediante la transformación previa de los valores de las variables a la escala logarítmica. La ecuación que describe la relación entre la fecundidad y el peso es la siguiente:
LOG (F) = b1 LOG (W) + bo
donde: F = es la fecundidad total (número de huevos/hembra)
W = es el peso total (gr)
b1 = es la pendiente bo= es la intercepción
j) Variaciones del Indice Gonadosomático (IG): Entre septiembre de 1986 y diciembre de 1987 se hicieron determinaciones del IG de las especies más comunes en las capturas:
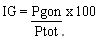
donde: Pgon = peso de las gónadas (gr)
Ptot = peso total del pez (gr)
En la Tabla 8 se presentan los resultados obtenidos para las especies con mayor número de ejemplares muestreados. Los máximos valores de este índice obtenidos para la payara, caribe y coporo se registraron entre marzo y junio, mientras que para la curvinata se encontraron entre octubre y marzo. Para el pavón (C. ocellaris), los máximos valores del índice se obtuvieron entre julio y septiembre.
Estos resultados sugieren que la elevación del nivel de las aguas en el lago de Guri actúa como factor determinante para el proceso de desove en la mayoría de las especies de peces grandes que existen en dicho lago; sin embargo, en el caso del coporo este proceso no se produce.
k) Alimentación: Durante el período de 1985–1987, el equipo de investigadores de la CVG recolectó estómagos de la mayoría de las especies de peces grandes, así como de algunas de las especies del ictioforraje. Para el análisis del contenido estomacal se utilizó el método gravimétrico, identificando hasta donde era posible cada item alimentario. En el caso de los pequeños peces, del ictioforraje sólo se identificaron a nivel de orden o clase, los principales grupos que forman el alimento de ellos. En la Tabla 9 se da un resumen, incluyendo el tipo de alimentación de los peces del ictioforraje.
A base de estos resultados hemos construido una versión simplificada de la estructura trófica del lago de Guri; en la Figura 8 se presenta el esquema sugerido. En nuestra opinión, la entrada principal de energía al ecosistema procede del área de inundación, en forma de materia orgánica de origen alóctono, desde donde comienza a ser utilizada por los invertebrados del zoobenthos, los cuales a su vez constituyen el alimento principal de los pequeños peces del ictiforraje. Estos peces, que se distribuyen principalmente en la franja litoral del lago, constituyen el alimento fundamental de los peces carnívoros, eslabón tope de la cadena trófica.
Otro flujo de energía importante se produce a través del detritus orgánico, fuente fundamental en la alimentación del coporo, que es la especie de mayor importancia entre los peces grandes. Bonetto et al. (1969) reconocen el papel de “transformadores” del detritus que ejercen las especies de Prochilodus presentes en el sistema Paraná, donde este grupo es dominante. La ausencia de peces zooplanctófagos en el lago de Guri sugiere que la transformación de energía vía fito y zooplancton debe tener poca importancia en este ecosistema.
7.5 ESTIMACION DE LA BIOMASA ICTICA DEL LAGO DE GURI
Cualquier estimación basada en el uso de las redes de ahorque en un lago inmenso y donde no hay pesca, tiene necesariamente un carácter de primera aproximación y está sujeta a un refinamiento posterior. Idealmente, la estimación de la ictiomasa debería estar basada en un método que sea diseñado para ese propósito (métodos acústicos, captura y recaptura, etc.). Con los únicos datos disponibles provenientes de campañas de pesca exploratoria empleando redes de ahorque se tienen que hacer, necesariamente, algunas suposiciones para estimar la magnitud de la biomasa que produciría las capturas observadas.
Una red de ahorque patrón empleada durante la investigación realizada tiene una longitud de unos 100 m, 2 m de alto y 15 cm de diámetro de malla, estirada. Un primer método utilizado para estimar la biomasa íctica de peces grandes fue abarcar un área conocida y calcular a lo largo del año los kilos por unidad de un área (kg/ha), de tal forma que pudiera extrapolarse ese índice a la superficie total de distribución conocida que tienen los peces en el lago de Guri. Se obtuvieron estimaciones de entre 80 y 220 kg/ha a lo largo de los años 1985 y 1986 para la ictiomasa total.
Asimismo, hasta donde se ha podido verificar, la distribución de los peces en el lago de Guri es fundamentalmente litoral, hasta los 10 m de profundidad, existiendo unas 200.000 hectáreas de superficie bajo agua total o parcialmente hasta esa profundidad. Conociendo la composición porcentual por especie de la captura, los kilogramos promedios por hectáreas y el número total de hectáreas ocupadas por los peces, se pudo obtener un valor aproximado de la magnitud de la biomasa de los peces grandes. En la Tabla 10 se presentan estos resultados, empleando dos niveles de kg/ha/año, obteniendo entre 12.000 y 20.000 toneladas como estimación del tamaño del recurso pesquero en el lago de Guri.
Otro método algo más elaborado, que podríamos llamar volumétrico, se fundamenta en el volumen de zona litoral “muestreado” o “barrido” por la red, y el número de peces capturados cuyo movimiento se asume perpendicular, unidireccional, en relación a la red. Estimando una velocidad promedio del pez (1 cm/seg), y asumiendo que las redes son igualmente eficientes, se puede estimar el volumen de agua “barrido” por la red patrón por día (86.400 m3). Conociendo la captura promedio por red por día y el volumen total de agua en la zona litoral hasta los diez metros, se puede estimar la biomasa total de peces grandes, mediante la fórmula:
Biomasa total = (V1/Vs) x captura
donde: V1 = volumen (m3) de la zona litoral (20 km3)
Vs = volumen “barrido” por una red tipo
En la Tabla 11 se presentan las capturas promedio diarias por especie y el correspondiente estimado de biomasa. De ambos estimados se deduce que el lago de Guri posee un potencial pesquero apreciable, superior a las 20.000 toneladas anuales. De esta biomasa total, el coporo ocupa un lugar preponderante, por lo cual conviene tratar separadamente a este recurso y ofrecer algunos detalles con mayor profundidad respecto a esta especie.
7.6 EL MODELO DEL COPORO (Prochilodus rubrotaeniatus)
Como ya se indicó, esta es la especie más importante en términos de abundancia entre los peces grandes. Curiosamente, en el propio lago de Guri no se ha capturado individuos menores de tres años, en un estado juvenil o subadulto. Esto sugiere que esta especie no desova en el lago y su incorporación ocurre a través de un proceso migratorio desde las áreas de desove y crecimiento ubicadas fuera del lago. Muestreos realizados en lagunas próximas al lago, así como en el río Paragua, un tributario del río Caroní, han permitido constatar la distribución de los individuos menores de tres años, juveniles y subadultos, en esos habitats externos al lago, de tal manera que la presencia del coporo es consecuencia de una “siembra” natural, cuya magnitud estará en función de factores ajenos al propio lago.
En general, las especies del género Prochilodus son altamente variables, dependiendo su abundancia de factores ambientales, especialmente la magnitud del plano inundable, definido a su vez por el ciclo anual de precipitación. Suponiendo que el número de individuos reclutas (< 3 años) que migran al lago, así como el éxito del proceso migratorio, sea función de la intensidad de la época de lluvias, se puede establecer un modelo que defina el tamaño del reclutamiento en función de la precipitación anual promedio o de algún índice relacionado con éste.
El modelo básico consiste en una serie de grupos de edad con un reclutamiento anual de individuos de tres años procedentes de las áreas de crecimiento situados fuera del lago, con un crecimiento por largo promedio especificado por el modelo de crecimiento de Bertalanffy.
En una aproximación inicial, el modelo asume que el reclutamiento es una función sigmoidal de la media de precipitación anual:
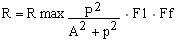
donde: R max es el producto de la máxima densidad de individuos de edad 2+ y el área inundable promedio; P es la precipitación relativa anual, la cual tiene una distribución normal N (P, P2std) con media y varianza estimada de datos del río Orinoco; y las constantes A, Fd y Ff, las cuales son la precipitación a la mitad del reclutamiento máximo, un coeficiente relacionado con el ancho de la zona inundable y un coeficiente relacionado con los efectos de las prácticas forestales sobre el reclutamiento.
Debido a que no se tenían datos sobre patrones de precipitación en cuenca del Guri, utilizamos una medida relativa como son los índices hidrológicos para el Orinoco entre 1979 y 1985 (Novoa, en prensa, Tabla 2). Los parámetros resultantes del modelo fueron los siguientes:
| PARAMETRO | VALOR | UNIDADES |
|---|---|---|
| Linf | 67.8 | cm |
| l | 0.451 | sin unidad |
| to | -0.054 | años |
| R max | 1 millón | individuos |
| P | 1.0 | sin unidad |
| Pstd | 0.25 | sin unidad |
| A | 0.5 | sin unidad |
| Fd | 1.0 | sin unidad |
| Ff | 1.0 | sin unidad |
La abundancia de cada grupo de edad (3 hasta +) está explícitamente representada en el modelo. Estimaciones iniciales de abundancia se derivaron de los datos de muestreos y las cosechas fueron calculadas de los valores de capturabilidad observados (qi), crecimiento futuro del esfuerzo de pesca (E) y la mortalidad natural estimada (M = 0.2 años -1).
Ni + 1, t + 1 = Ni, t .eqi.E-M
Asimismo, la cosecha anual sería una función del esfuerzo de pesca:
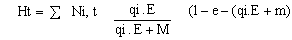
7.7 SIMULACIONES
a) Patrones de abundancia: Las simulaciones se iniciaron en 1983 con un horizonte temporal de 20 años, de tal manera que se representaron las estructuras poblacionales esperadas de los pasados cinco años así como también las esperadas para los próximos 15 años. En tales análisis se exploraron las posibles consecuencias de una pesca comercial a bajos niveles de esfuerzo de pesca (50 pescadores por año) y a un nivel intenso (500 pescadores por año). En la Figura 8 se presenta la abundancia del Coporo en el lago de Guri.
Basados en los muestreos de las tasas de captura se dedujo que en 1983 había unos 500.000 individuos de tres o más años. En 1987, el modelo indica que esta población se ha incrementado hasta unos 2.500.000 individuos y que podría estabilizarse, a bajos niveles de explotación, en unos 3.5 a 4 millones de individuos a principios de 1990. Como se observa en la citada Figura 9, una explotación más intensa reduciría ese nivel de biomasa del Coporo.
b) Explotación: En la Figura 10 se presentan los resultados predichos por el modelo en relación con las posibles capturas o cosechas a los dos niveles de explotación antes señalados. Si ocurre un drástico aumento del esfuerzo pesquero, las capturas aumentarán en la misma proporción, mientras que a un bajo nivel de esfuerzo las capturas se estabilizarán rapidamente al nivel de los 100.000 kg por año. A un nivel de intensa pesca, los cambios en las capturas anuales hacen recordar el fenómeno del pulso postllenado que se ha reportado en otros embalses y sus pesquerías (Marshall et al. 1982).
No está claro si el nivel de esfuerzo pesquero intenso (500 pescadores por año) corresponde al nivel de explotación sostenible, pero no hay duda de que la declinación en las capturas (“Pulso de Producción”) sería el resultado de una reducción de la biomasa del coporo por efecto de la pesca misma, tal como se muestra en la Figura 10.
En consecuencia, de ocurrir un desarrollo pesquero incontrolado, con un rápido crecimiento de la explotación de los recursos pesqueros del lago, podríamos presenciar una declinación como la descrita, que no es más que la respuesta normal de un recurso virgen sometido a una pesquería intensa, de rápido desarrollo.
c) Discusión: Unos de los principales retos en el desarrollo de pesquerías en los lagos nuevos es evitar una sobre-explotación temprana de sus recursos pesqueros. Los problemas surgen para administrar un lago que tiene una comunidad íctica aún no estabilizada y sin registros previos como respuestas a la explotación. Esta carencia obliga a buscar alternativas mediante la comparación con ecosistemas similares y su respuesta a la explotación pesquera. De este enfoque comparativo han surgido dos generalizaciones:
El pulso de productividad pesquera que se produce después del llenado de los embalses.
La deducción de los niveles esperados de rendimientos pesqueros basados en el empleo del índice morfo-edáfico.
Sin otro tipo de información, estas generalizaciones son guías útiles para la administración y manejo de los recursos pesqueros de un lago nuevo. Sin embargo, en algunas situaciones específicas es preciso hacer un manejo diferente, que responda a rasgos únicos que se presentan ante esas situaciones específicas. Basados en los análisis y examen a fondo de la información disponible, creemos que los recursos pesqueros del lago de Guri representan estas excepciones, por las características únicas que están detrás de los mecanismos de producción, de tal forma que exigen un esquema de manejo pesquero que responda a la dinámica y magnitud de los recursos descritos a lo largo de este informe.
d) Niveles de cosecha sostenible del coporo: Si nos basamos en las predicciones del índice morfo-edáfico, el lago de Guri parecería tener un potencial pesquero de solo 10/kg/ha/año (Alvarez et al. 1986). Asumiendo que pudiera sostener una cosecha anual de 400.000 kg de coporo (Figura 11), la cosecha sostenible del coporo sería unicamente de alrededor de 10/kg/ha/año.
Como vimos antes, algunos cálculos hechos sobre la base de los resultados de tres años de pesca exploratoria, indican un posible rango de producción sostenible entre 80 y 200/kg/ha/año. Sin asumir que estos últimos valores sean la cifra definitiva como valor estimado de producción pesquera sostenible, sí creemos que existen suficientes evidencias para considerar que 10 kg/ha/año es una cifra tentativa, en extremo conservadora, del nivel de cosecha sostenible del Lago de Guri.
e) Propuestas de acciones futuras: Las investigaciones hasta ahora realizadas sobre los ciclos de vida y dimensión del recurso pesquero del Lago de Guri, ha generado una copiosa información, mucha de la cual se ha resumido en este informe. Sin embargo, persisten una serie de interrogantes en relación con los mecanismos de productividad biológica en el lago; ciclos de vida de algunas especies ícticas; patrón exacto de distribución de las poblaciones pesqueras, especialmente su distribución batimétrica; biología y ecología del zoobentos; composición y densidad de éstos organismos; metabolismo de la materia orgánica del área inundable, etc., que, si bien deben irse abordando, su resolución no puede ser requisito previo para iniciar un uso controlado y supervisado del potencial pesquero del Lago de Guri.
De hecho, el enfoque sistémico hecho en este estudio mediante la utilización de modelos predictivos, permite diseñar unas políticas de manejo del recursos apropiadas y hacer el seguimiento y vigilancia de los resultados o respuestas del recurso a la aplicación de estas políticas. Muchas de las dudas respecto a la productividad pesquera potencial del lago pueden ser resueltas mediante la ejecución de un plan de desarrollo de una pesquería deportiva y otra comercial, de carácter limitado y temporal, que signifiquen el aporte de datos e información valiosa que complemente los conocimientos adquiridos hasta ahora.
El empleo de las técnicas de modelaje en el caso de este lago, nos han permitido establecer ciertas hipótesis sobre su potencial piscícola y sus posibles respuestas en el tiempo, ante diversas estrategias de manejo. En este contexto, una apertura consciente a la explotación piscícola del Lago de Guri permitirá probar las hipótesis y pronósticos que efectuados en este trabajo. Esta iniciativa, de carácter experimental, permitirá predecir y observar los cambios en la comunidad de peces y será una prueba dura de ecología teórica y teoría emergente de manejo de los recursos naturales renovables (Walters, 1986).
f) Propuestas de manejo pesquero: En el Lago de Guri actualmente se realizan pesquerías tanto de carácter comercial como deportivo y de subsistencia, aunque aún a una escala pequeña; en relación con la magnitud del recurso, presentan una tendencia creciente. Hay evidencias de que en los últimos dos años se han llevado a Ciudad Bolívar y San Félix un total cercano a los 100.000 kilogramos de pescado procedentes de diversos sectores del Lago de Guri, obtenidos ilegalmente mediante el uso de redes de ahorque principalmente.
Asimismo, hay una pesquería deportiva practicada desde hace algunos años cuyo principal objetivo es el pavón, pez altamente estimado por la lucha que ofrece durante su captura y por el exquisito sabor de su carne. No se tiene certeza de las capturas totales de ésta y otras especies de interés deportivo, pero se supone que se trata de una cantidad considerable. Existe, además, una población campesina dispersa que vive en los alrededores del inmenso lago, la cual obtiene diariamente su sustento alimenticio pescando en el Lago de Guri.
Creemos que es el momento oportuno de establecer ciertos controles mediante la definición de algunas normas de manejo pesquero que permitan evaluar la respuesta de estos recursos. Es por eso que se ha considerado conveniente sugerir algunos esquemas de ordenamiento de la explotación pesquera en este lago.
g) Pesca comercial artesanal: A fin de suplir el déficit de pescado que se presenta en la región Guayana durante los meses de lluvias o aguas altas en los principales ríos, se propone establecer una pesquería artesanal de carácter estacional, mediante el empleo de redes de ahorque de un diámetro de mallas (estiradas) de 14 cm o mayores, orientando a la captura del coporo y otras especies grandes, minimizándose la posibilidad de captura del pavón de pequeño y medianas tallas.
De las Figuras 10 y 11 se deduce que una cuota máxima de 100.000 kilogramos de coporo, con una flota de 50 pescadores, durante el período junio–agosto, no afectaría el tamaño poblacional de esa especie. Las capturas correspondientes al resto de las especies también lucen proporcionalmente pequeñas en relación con el tamaño poblacional de cada una de ellas.
h) Pesca deportiva o recreacional: En nuestra opinión, es ésta la pesquería que pudiera causar un impacto a corto plazo en la población del pavón, de no tomarse algunas medidas inmediatas que la regulen, dada la gran demanda por parte de los pescadores deportivos, tanto de la región como fuera de ella.
Basándose en la estimación del número de individuos superiores a un kilo (750.000) se estableció un número máximo de pavones a capturarse de 375.000, correspondiente a la mitad del tamaño poblacional estimado. Este número, repartido entre los pescadores deportivos y los de subsistencia, determinan unos regímenes de pesca (№ de licencias; № de individuos por pescador-día; № de días de pesca por pescador-año, etc.) que necesariamente deben establecerse para garantizar la conservación del recurso y un nivel apropiado de tamaño poblacional.
Una tasa de mortalidad de pesca excesiva puede provocar un colapso más o menos violento del recurso pavón, lo cual podría ser interpretado como una confirmación de la hipótesis del pulso de postllenado del embalse, en circunstancia de que se trataría de un típico fenómeno de sobre-pesca o sobre-uso de un recurso. En la Tabla 12 se presentan algunas de las alternativas de manejo de las pesquerías recreacional y de subsistencia del pavón en el Lago de Guri.
BIBLIOGRAFIA
ALVAREZ, E., BALBAS, L., MASSA, I.y PACHECO, J. 1986. Aspectos ecológicos del embalse de Guri. Interciencia. 11:325–333.
BONETTO, A.A., DIONI, W. y PIGNALBERI, C. 1969. Limnological investigations of biotic communities in the Middle Paraná river valley. IN: Verh. Int. Ver. Limnol. 17:1035–1050.
MARSHALL, B.E., F. JUNOR and L. LANGERMAN. 1982. Fisheries and fish production on the Zambabwean side of Lake Kariba. IN: Kariba Studies. National Museum and Monuments of Zimbabwe. 10:175–231.
NOVOA, D. 1988. The multispecies fisheries of the Orinoco river; development, present status and management strategies. IN: Can. J. Fish. Aquat. Sci.
NOVOA, D. y Ramos, F. 1982. Aspectos generales sobre la biología y pesquería de la Zapoara. EN: Los Recursos Pesqueros del río Orinoco y su explotación. Corporación Venezolana de Guayana. 386 p.
RICKER, W.E. 1975. Computation and interpretation of biological statistics of fish populations. IN: Bull. Fish. Res. Board Canada 191. 382 p.
VASQUEZ, E. 1984. El zooplancton de la sección baja de un río de aguas negras (Río Caroní) y de un embalse hidroeléctrico (Macagua I). Venezuela. Mem. Soc. Cienc. Nat. La Salle № 121. Tomo XLIV.
WALTERS, C.J. 1986. Adaptative management of renovable resources. New York, U.S.A., Mac Millan. 374 p.
WELCOMME, R.L. 1979. Fisheries Ecology of flood plain rivers. London, England, Longman.
TABLA № 1.
CAPTURAS TOTALES EN EL LAGO DE GURI
COMPOSICION PORCENTUAL POR ESPECIE, ANO Y TOTAL PERIODO 1985 – 1987.-
| ESPECIE | 1985 | 1986 | 1987 | TOTAL | %1985 | %1986 | %1987 | TOTAL |
| COPORO | 12247.4 | 7530.7 | 4821.38 | 24799.41 | 64.28710 | 59.61511 | 64.48626 | 63.32893 |
| CURVINATA | 1951.6 | 1650.9 | 615.35 | 4217.85 | 10.24402 | 13.06898 | 8.230345 | 10.77090 |
| GUITARRIL | 162.9 | 408.2 | 498.31 | 1069.41 | 0.855068 | 3.231424 | 6.664927 | 2.730895 |
| PAYARA | 1682 | 1543.9 | 796.25 | 4022.15 | 8.828886 | 12.22194 | 10.64989 | 10.27115 |
| AIMARA | 634.5 | 448.5 | 230.37 | 1313.37 | 3.330516 | 3.550450 | 3.081213 | 3.353883 |
| B.ZAPATO | 47.3 | 72.5 | 10.6 | 130.4 | 0.248279 | 0.573930 | 0.141775 | 0.332995 |
| CARIBE | 704.4 | 209 | 25.51 | 938.91 | 3.697424 | 1.654501 | 0.341197 | 2.397644 |
| B.YAQUE | 171.9 | 61.7 | 98.25 | 331.85 | 0.902310 | 0.488434 | 1.314099 | 0.847427 |
| ALAMBRA | 25.1 | 14.2 | 13.68 | 52.98 | 0.131750 | 0.112411 | 0.182970 | 0.135292 |
| C.CABALLO | 27.6 | 45.5 | 7.14 | 80.24 | 0.144873 | 0.360190 | 0.095497 | 0.204904 |
| MIJE | 124 | 20.1 | 7 | 151.1 | 0.650881 | 0.159117 | 0.093625 | 0.385856 |
| BOQUIMI | 13.3 | 6.3 | 0.79 | 20.79 | 0.069812 | 0.049872 | 0.010566 | 0.053090 |
| POYITA | 2.6 | 2.6 | 0.013647 | 0 | 0 | 0.006639 | ||
| MOCOROTO | 11.7 | 11.7 | 0 | 0 | 0.156488 | 0.029877 | ||
| PAVON | 1256.5 | 620.7 | 340.11 | 2217.31 | 6.595419 | 4.913633 | 4.548992 | 5.662227 |
| TOTAL | 19051.1 | 12632.2 | 7476.6 | 39159.68 | 100 | 100 | 100 | 100 |
TABLA № 2.
VALORES TIPICOS DE CAPTURA USANDO REDES DE AHORQUE EN ALGUNOS RIOS TROPICALES
UNIDAD: KG/100m/día.
| RIO | KG/100m/DIA | FUENTE |
| Barotse | 6,2 | FAO/UN (1969) |
| Kafue | 10,2 | Everets(1974) |
| Magdalena | 13,2 | Granados (1975) |
| Mekong | 24,0 | Fily y D'Aubenson (1966) |
| Niger | 9,3 | FAO/UN (1971) |
| Ovemé | 10,4 | " " |
| Pendjari | 4,5 | " " |
| Shire | 12,2 | Willoughby y Walber(1977) |
| Tomado de Welcomme, R. (1979) |
TABLA № 3.
COMPARACION ENTRE LOS RENDIMIENTOS PESQUEROS PARA EL“DIA” (0700-16:30)
Y LA NOCHE (16:30-0700) EMPLEANDO REDES DE AHORQUE EN EL LAGO DE GURI.
* Los lapsos son aproximados.
| FECHA | 16 al 20/7/85 | 7 al 10/8/85 | 20 al 24/8/85 | |||||||||
| № DE HORAS | DIA 28,3 | NOCHE 56,9 | DIA 28,19 | NOCHE 57,37 | DIA 27,41 | NOCHE 57,96 | ||||||
| ESPECIES | KG. | KG/H. | KG. | KG/H. | KG. | KG/H. | KG. | KG/H. | KG. | KG/H. | KG. | KG/H. |
| Aimara | - | - | 66,500 | 1,168 | - | - | 85,100 | 1,483 | - | 0,000 | 62,804 | 1,084 |
| Boquimí | 0,850 | 0,003 | - | - | 0,850 | 0,030 | - | - | 1,526 | 0,056 | - | 0,000 |
| Caribe blanco | 8,025 | 0,283 | 28,425 | 0,48 | 27,601 | 0,979 | 20,090 | 0,350 | 20,801 | 0,741 | 38,503 | 0,578 |
| Coporo | 75,300 | 2,660 | 1219,623 | 21,434 | 117,690 | 4,175 | 1458,315 | 75,336 | 104,277 | 8,804 | 1618,181 | 27,922 |
| Curvinata | - | - | 94,246 | 1,656 | - | - | 79,750 | 1,390 | - | 0,090 | 52,514 | 0,906 |
| Guitarrilla | - | - | 14,410 | 0,253 | - | - | 3,825 | 0,066 | - | 0,000 | 6,199 | 0,107 |
| Mije | 1,100 | 0,038 | 5,850 | 0,102 | 11,601 | 0,412 | 4,200 | 0,078 | 19,727 | 0,720 | 21,788 | 0,376 |
| Payara | 2,900 | 0,102 | 11,725 | 1,963 | 0,600 | 0,021 | 153,850 | 2,682 | 45,100 | 1,642 | 163,32 | 2,813 |
| Pavón | 39,425 | 1,393 | 33,725 | 0,592 | 40,156 | 1,424 | 72,006 | 1,255 | 94,409 | 3,444 | 71,383 | 1,292 |
| Palambra | - | - | 6,175 | 0,108 | - | - | - | - | - | 0,000 | 9,412 | 0,162 |
| Saltón | - | - | - | - | - | - | 0,425 | 0,007 | - | 0,000 | - | 0,000 |
| Vieja | 0,700 | 0,024 | 1,050 | 0,018 | 3,505 | 0,124 | 1,450 | 0,025 | 0,320 | 0,012 | 1,649 | 0,028 |
| Yaque | 3,300 | 0,116 | 46,800 | 0,822 | - | - | 29,075 | 0,307 | - | 0,000 | 35,344 | 0,610 |
| Zapato | - | - | 1,575 | 0,027 | - | - | 5,700 | 0,099 | 0,000 | 0,021 | ||
| 131,600 | 4,650 | 1625,104 | 28,560 | 202,003 | 7,166 | 1908,786 | 33,272 | 285,560 | 10,419 | 2076,513 | 35,839 | |
Nota: Los datos no son comparables entre las distintas fechas por corresponder a esfuerzos pesqueros diferentes (mts.de redes).
TABLA № 4
ESPECIES CAPTURADAS CON REDES Y PALANGRES EN LOS MUESTREOS EFECTUADOS EN EL LAGO DE GURI DURANTE EL PERIODO DICIEMBRE 1984–DICIEMBRE 1987
| REDES DE AHORQUE DIAMETRO MALLA 10 a 20 CM. | REDES DE MALLA FINA DIAMETRO DE MALLA 1 CM. | PALANGRES |
| Prochilodus rubrotaeniatus | Charax gibbosus | Hoplias macrophthalmus |
| Plagioscion squamosissimus | Tetragonopteridae | Ageneiosus sp |
| Guitarrilla (Doradidae) | Mesonauta sp | Hydrolicus scomberoides |
| Hydrolicus scomberoides | Crenicichla wallaci | |
| Hoplias macropthalmus | Serrasalmus rhombeus | |
| Cichla temensis | Bryconops caudomaculatus | |
| Ageneiosus sp | Brycon pesu | |
| Serrasalmus rhombeus | Hemiodopsis gracilis | |
| Leiarius marmoratus | Cichla sp | |
| Brycon sp | Geophagus surinamensis | |
| Cichla ocellaris | Curimatella inmaculata | |
| Geophagus surinamensis | Acestrorhynchus microlepis | |
| Leponinus friderici | Bryconops sp | |
| Leporinus sp | Characidae sp1 | |
| Piaractus brachypomum | Eingenmania sp | |
| Characidae sp2 | ||
| Hypostomus brevirostris | ||
| Moenkhausia sp | ||
| Hemiodus unimaculatus | ||
| Coridoras sp | ||
| Plagioscion squamosissimus | ||
| Pimelodus ornatus | ||
| Hoplias malabaricus | ||
| Leporinus friderici | ||
| Leporinus fasciatus | ||
| Loricariidae | ||
| Moenkhausia quadriscuamis | ||
| Hemigranmus sp |
TABLA № 5.
VALORES DE FECUNDIDAD DE PESCA DEL LAGO DE GURI.—
| ESPECIE | LT cm | PT gr | № HUEVOS |
| AIMARA (HOPLIAS MACROPHTHALMUS) | 81.0 | 9.000 | 439.838 |
| 58.0 | 2.600 | 59.779 | |
| 62.5 | 3.600 | 123.234 | |
| 65.0 | 4.300 | 133.972 | |
| CURVINATA (PLAGIOSCION SQUAMOSISSIMUS) | 55.2 | 2.500 | 134.249 |
| 53.5 | 2.150 | 95.895 | |
| PAVON (CICHLA OCELLARIS) | 36.2 | 815 | 4.087 |
| 43.5 | 1.199 | 12.544 | |
| 38.2 | 817 | 8.020 | |
| 43.6 | 1.118 | 9.024 | |
| 37.0 | 851 | 9.241 | |
| 42.5 | 1.150 | 5.900 | |
| 40.0 | 885 | 4.430 | |
| CARIBE BLANCO (SERRASALMUS RHOMBEUS) | 22.3 | 200 | 4.52 |
| 32.4 | 700 | 12.322 | |
| 33.6 | 811 | 13.975 | |
| COPORO (PROCHILODUS RUBROTAENIATUS) | 60.0 | 5.400 | 177.226 |
| 56.8 | 3.775 | 783.685 | |
| CARE CABALLO (GEOPHAGUS SURINAMENSIS) | 16.5 | 250 | 1.292 |
| 27.3 | 325 | 1.657 | |
| PAVON (CICHLA TEMENSIS) | 63.0 | 3.500 | 15.255 |
| 53.3 | 2.290 | 9.210 | |
| PAYARA PERRA (HYDROLICUS SP) | 50.0 | 1.170 | 251.338 |
| GUITARRILLA (DORADIDAE) | 42.2 | 1.675 | 73.739 |
| 56.4 | 2.250 | 75.045 |
TABLA № 6.
PARAMETROS DE CRECIMIENTO DE ALGUNAS ESPECIES DE PECES DEL LAGO DE GURI
| ESPECIES | Linf | k | To |
| Pavón (Cichla sp.) | 85.15 | 0.254 | -1.324 |
| Curvinata (Plagioscion squamosissimus) | 72.86 | 0.188 | -1.395 |
| Coporo (Prochilodus rubrotaeniatus) | 67.83 | 0.451 | -0.125 |
| Payara (Hydrolicus scomberoides) | 107.51 | 0.251 | -0.305 |
| Caribe blanco (Serrasalmus rhombeus) | 37.35 | 0.374 | 0.215 |
| Aymara (Hoplias macrophthalmus) | 106.99 | 0.276 | -0.726 |
TABLA № 7.
PARAMETROS DE LAS ECUACIONES DE REGRESION LIÑEAL PARA LAS RELACIONES LONGITUD TOTAL - PESO TOTAL Y FECUNDIDAD-PESO PARA ALGUNAS ESPECIES DE PECES DEL LAGO DE GURI.
| LONGITUD - PESO | FECUNDIDAD - PESO | |||
| ESPECIES | bl | bo | bl | bo |
| Pavón (Cichla sp.) | 2.77 | -4.27 | 0.47 | 2.47 |
| Curvinata (Plagioscion squamosissimus) | 2.52 | -3.18 | 2.21 | -2.41 |
| Coporo (Prochilodus rubrotaeniatus) | 2.71 | -4.24 | -4.13 | 8.28 |
| Payara (Hydrolicus scomberoides) | 2.52 | -3.68 | 1.18 | 1.58 |
| Caribe blanco (Serrasalmus rhombeus) | 2.68 | -3.92 | 0.79 | 1.84 |
| Aymara (Hoplias macrophthalmus) | 3.18 | -5.39 | 1.56 | -0.52s |
TABLA № 8.
INDICE GONOSOMATICO MENSUAL (PROMEDIO) DE PECES DEL LAGO DE GURI
PERIODO: SEPTIEMBRE 86 – DICIEMBRE 87
ESPECIE
| Curvinata | Coporo | Payara | Guitarrilla | Pavón (c.t.) | Pavón (c.o) | |||||||
| MES | IG | N | IG | N | IG | N | IG | N | IG | N | IG | N |
| Septiembre | 0,253 | 9 | - | - | 0,416 | 4 | 1,183 | 2 | - | - | - | - |
| Octubre | 1,005 | 33 | - | - | 0,563 | 7 | 0,617 | 16 | 0,119 | 13 | 0,190 | 6 |
| Noviembre | 0,912 | 59 | - | - | - | - | 2,279 | 6 | 0,101 | 7 | 0,409 | 4 |
| Diciembre | 1,168 | 33 | - | - | - | - | 2,409 | 4 | - | - | 0,962 | 1 |
| Enero | 0,844 | 25 | - | - | 0,353 | 14 | 0,588 | 6 | 0,071 | 1 | - | - |
| Febrero | 0,835 | 17 | - | - | 0,266 | 4 | 0,449 | 5 | - | - | 0,331 | 1 |
| Marzo | 0,882 | 24 | 4,315 | 64 | 0,353 | 10 | 0,503 | 22 | 0,083 | 1 | 0,090 | 1 |
| Abril | 0,602 | 8 | 5,974 | 31 | 0,472 | 1 | 1,575 | 21 | - | - | 0,132 | 1 |
| Mayo | 0,686 | 19 | 6,375 | 40 | 0,795 | 8 | 4,062 | 32 | 0,241 | 10 | - | - |
| Junio | 0,913 | 5 | 0,690 | 4 | 0,385 | 1 | 4,811 | 16 | - | - | - | - |
| Julio | 0,321 | 7 | 0,784 | 7 | 0,354 | 1 | 3,595 | 4 | 0,249 | 10 | 1,461 | 4 |
| Agosto | 0,283 | 11 | 0,371 | 6 | 0,302 | 3 | 3,739 | 9 | - | - | 0,632 | 9 |
| Septiembre | 0,464 | 5 | 0,184 | 1 | 0,361 | 2 | 1,969 | 4 | 0,134 | 12 | 0,777 | 5 |
| Octubre | 0,823 | 2 | - | - | - | - | 2,041 | 4 | 1,185 | 1 | - | - |
| Noviembre | 1,304 | 2 | - | - | - | - | - | 0,583 | 3 | - | - | |
| Diciembre | 0,686 | 9 | 0,372 | 16 | 0,418 | 4 | 0,553 | 13 | 0,104 | 4 | 0,200 | 1 |
TABLA № 9.
ANALISIS DEL CONTENIDO ESTOMACAL DE ALGUNAS ESPECIES DEL LAGO DE GURI
| A) ESPECIES PREDADORAS | B) ESPECIES OMNIVORAS | |||||||||
| AIMARA | CURVINATA | PAVON(C.O) | PAVON(C.T.) | PAYARA | CARIBE | B.ZAPATO | B.YAQUE | GUTTARRILLA | B.COGOTUO | |
| n= 16 | n= 263 | n= 29 | n= 49 | n= 92 | n= 68 | n= 10 | n= 14 | n= 78 | n= 4 | |
| Peces no identificados | 30,34 | 14,56 | 47,08 | 27,96 | 33,73 | 67,95 | 9,04 | - | - | 50,00 |
| Hemigranmus sp | - | 27,36 | 1,29 | 2,71 | 2,00 | 11,59 | 49,95 | - | - | |
| Cichla sp | 40,96 | 5,27 | 11,77 | 12,74 | 16,03 | - | - | - | - | - |
| Geophagus sp | 18,12 | 7,44 | 35,87 | 25,69 | 9,85 | - | 35,51 | - | - | - |
| Eritrinidae | - | 13,61 | 2,21 | 18,42 | 23,09 | - | - | 8,84 | - | - |
| Simbranchus sp | - | 5,36 | - | - | - | 0,62 | - | - | - | - |
| Gimnotiformes | - | 9,81 | - | - | 2,27 | - | - | - | - | - |
| Salton | - | - | 0,81 | - | - | - | - | - | - | - |
| Anostomidos y otros Caracidos | - | 3,46 | - | 12,47 | 0,52 | - | - | - | - | - |
| Pimelodidae | - | - | - | - | 0,56 | - | 3,35 | - | - | - |
| Auchenipteridae | - | 3,36 | - | - | 0,65 | - | - | - | - | - |
| Prochilodus sp | 8,60 | - | - | - | - | - | - | - | - | - |
| Corydoras sp | - | 0,05 | - | - | 0,08 | - | - | - | - | - |
| Serrasalmus sp | - | 0,05 | - | - | 5,00 | - | - | - | - | - |
| Plagioscion sp | - | 3,46 | - | - | 4,92 | 15,72 | - | - | - | - |
| Ctenolucidae | - | 0,11 | - | - | 0,56 | - | - | - | - | - |
| Doradidae | - | - | - | - | 0,04 | - | - | - | - | - |
| Otros Siluriformes | - | 1,45 | - | - | - | - | - | - | - | - |
| Hydrolicus sp | 1,03 | - | - | - | - | - | - | - | - | - |
| Curimatidae | 0,41 | - | - | - | - | - | - | - | - | - |
| Total peces | 99,46 | 95,35 | 99,03 | 100,00 | 99,30 | 95,88 | 97,85 | 8,84 | - | 50,00 |
| Otros Vertebrados | - | - | - | - | 0,11 | 3,26 | - | 0,37 | - | - |
| Macrobrachium sp | - | 2,92 | 0,97 | - | 0,47 | - | 1,91 | 0,08 | - | - |
| Otros Malacostracos | 0,31 | 1,34 | - | - | - | 0,12 | - | 24,06 | - | - |
| Odonata (Ninfas) | - | 0,16 | - | - | - | 0,45 | - | 6,02 | X | X |
| Otros insectos | - | 0,01 | - | - | 0,03 | - | - | 0,87 | X | X |
| Total Invertebrados | 0,31 | 4,43 | 0,97 | - | 0,50 | 0,57 | 1,91 | 31,40 | 100,00 | 50,00 |
| Vegetales | 0,17 | 0,22 | - | - | 0,08 | 0,30 | 0,24 | 59,76 | - | - |
| Materia Inorgánica | - | 0,01 | - | - | - | - | - | - | - | - |
TABLA № 10.
CALCULO OF THE STANDIND STOCK EN EL LAGO DE GURI
| METODO 1. | 2000 Km2. ZONA OCUPADA POR PECES(TONS.) | |||
| ESPECIE | % EN LA CAPTURA | 60 KG/HA/AÑO | 100 KG/HA/AÑO | |
| Aimara | 3.7 | 2.22 | 3.7 | 444 – 740 |
| Caribe blan. | 1.9 | 1.14 | 1.9 | 228 – 380 |
| Coporo | 64.3 | 38.60 | 64.3 | 7220 – 12900 |
| Curvinata | 9.6 | 5.76 | 9.6 | 1150 – 1920 |
| Guitarrilla | 2.1 | 1.26 | 2.1 | 250 – 420 |
| Payara | 10.2 | 6.12 | 10.2 | 1220 – 2040 |
| Pavón | 5.8 | 3.48 | 5.8 | 696 – 1160 |
| B. yaque | 0.9 | 0.54 | 0.9 | 108 – 180 |
| B. zapato | 0.3 | 0.18 | 0.3 | 36 – 60 |
| Varios | 1.2 | 0.72 | 1.2 | 144 – 240 |
| TOTAL | 12000 20000 |
| METODO 2. | TABLA № 11. | ||
| ESPECIE | NUMERO | PESO PROMEDIO | BIOMASA (KG) |
| Coporo | 3 × 106 | 4 | 12 × 106 |
| Payara | 1 × 106 | 3 | 3 × 106 |
| Aimara | 1 × 105 | 5 | 0.5 × 106 |
| Curvinata | 8 × 105 | 2.5 | 2 × 106 |
| Caribe | 6 × 105 | 0.5 | 0.3 × 106 |
| Pavón | 7 × 105 | 2 | 1.4 × 106 |
TABLA № 12
PLAN DE ORDENAMIENTO DE LA PESQUERIA DEPORTIVA DEL PAVON EN EL LAGO DE GURI.
| № LICENCIAS | RESTRICCIONES DE CAPTURA | DIA DE PESCA AL AÑO | RESULTADO ESPERADO (№ PAVONES) | IMPACTO SOBRE LA POBLACION |
| 500 | 5 Ejemp/lic/dia | 72 días máx. | 195.000 | No hay riesgo de sobre explotación con la pesca deportiva y la de subsistencia, actuando conjuntamente. |
| 750 | 5 Ejemp/lic/día | 52 días máx. | 195.000 | |
| Pesca subsist. | 1 ejemp/pers/día | 365 días | 180.000 | ------- |
AMAZONAS
FIGURA 1
UBICACION GEOGRAFICA DEL
RIO CARONI Y EL LAGO DE GURI
FIGURA 2
CAPTURAS LAGO DE GURI
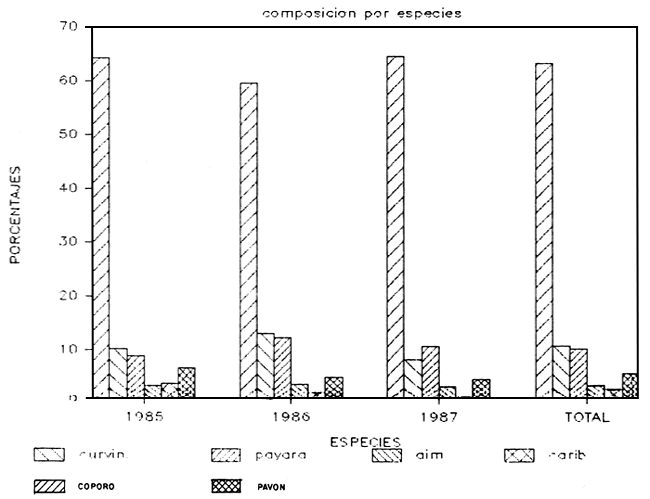
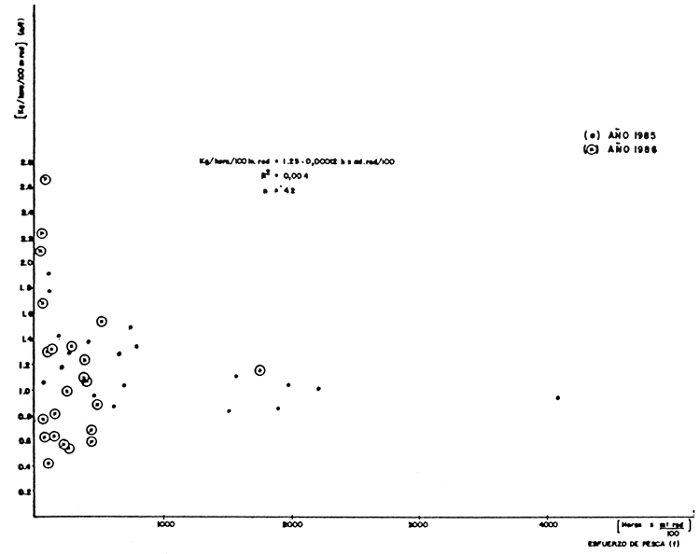
FIGURA 3: Análisis de la regresión lineal entre la C.P.U.C./esfuerzo de pesca para el lago de Guri durante 1985–1986.
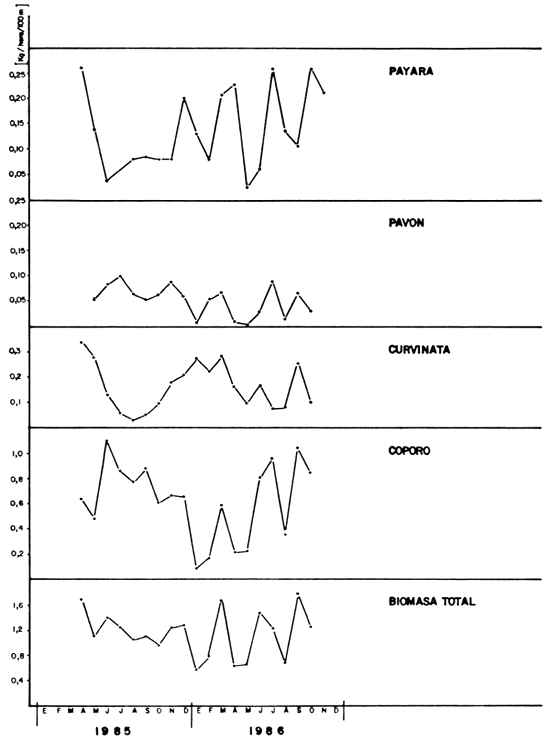
FIGURA 4. Cambios mensuales de la captura por unidad de esfuerzo (C.P.U.E.) para las principales especies de peces y total en el Lago de Guri.
FIGURA 5a: Ciclo reproductivo de la curvinata en el lago de Guri, 1985–1986.
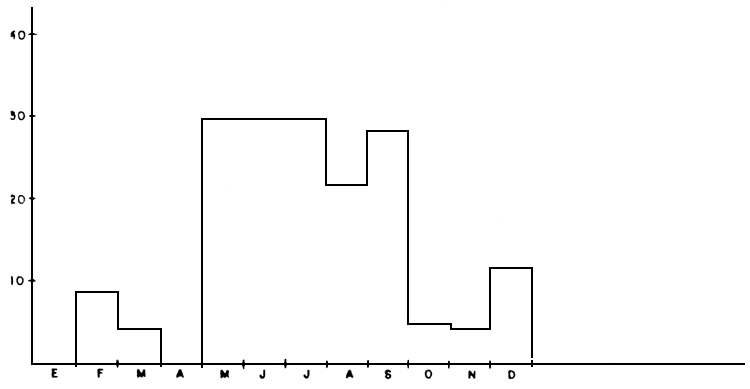
FIGURA 5b: Ciclo reproductivo del pavón (Cichla ocellaris) en el lago de Guri, 1985–1986.
FIGURA 6
DISTRIBUTION DE TALLAS DE CURVINATA
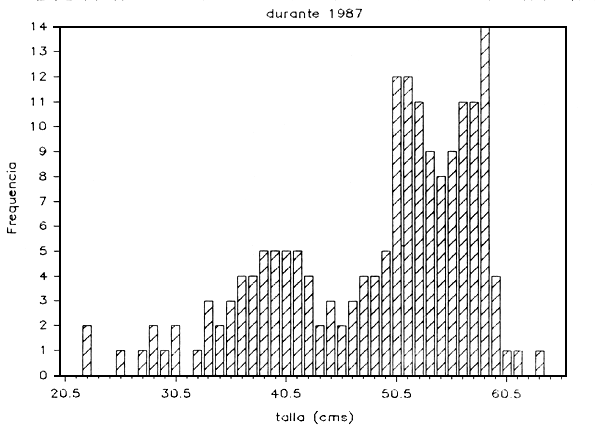
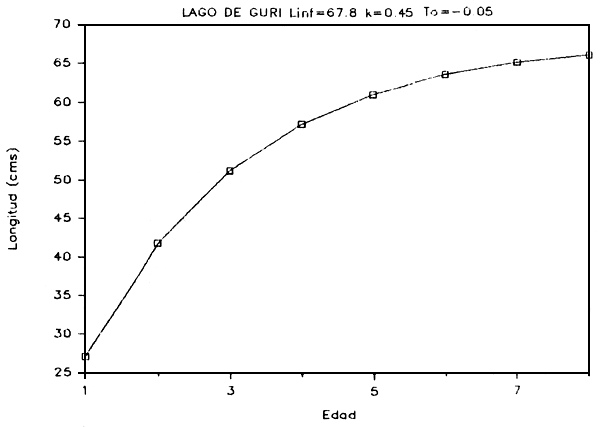
FIGURA 7a: Curva de crecimiento del coporo.
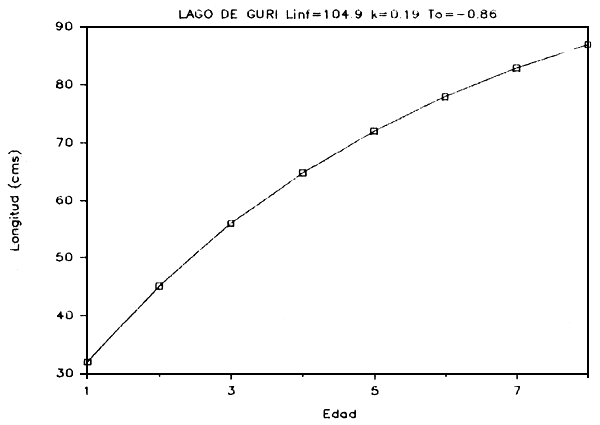
FIGURA 7b: Curva de crecimiento de payara.
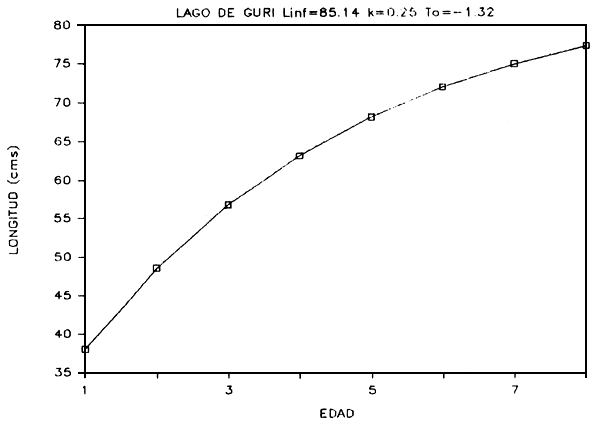
FIGURA 7c: Curva de crecimiento de pavón.
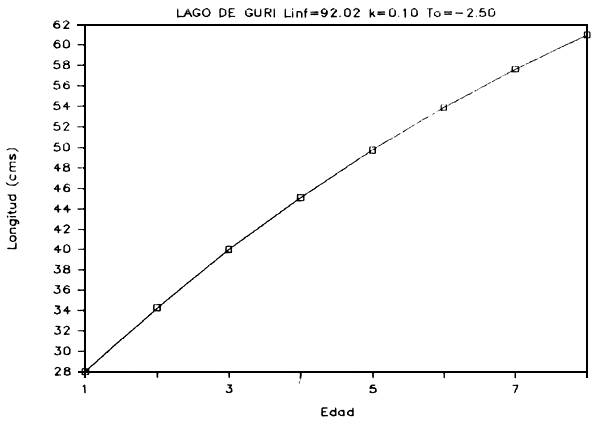
FIGURA 7d: Curva de crecimiento de curvinata.
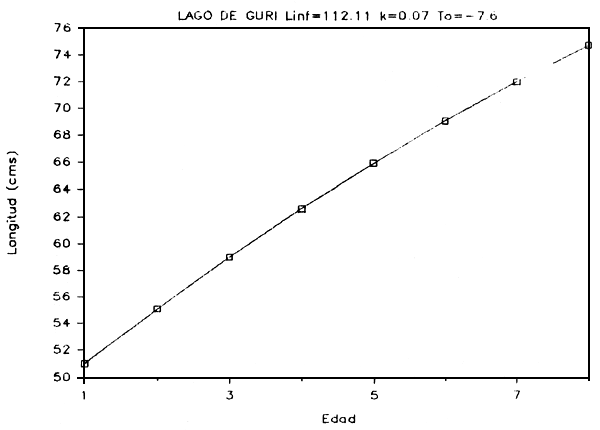
FIGURA 7e: Curva de crecimiento de aimará.
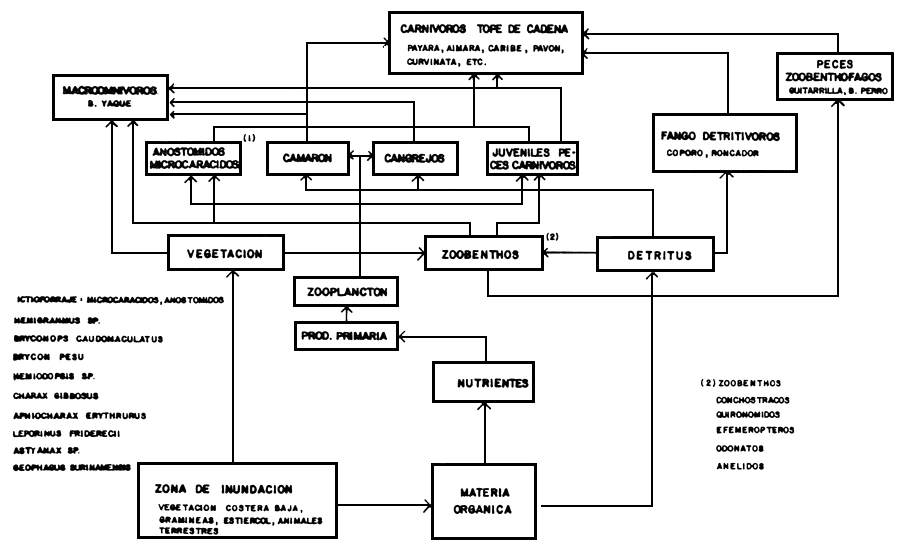
Figura 8. Estructura trófica simplificada del Lago de Guri.
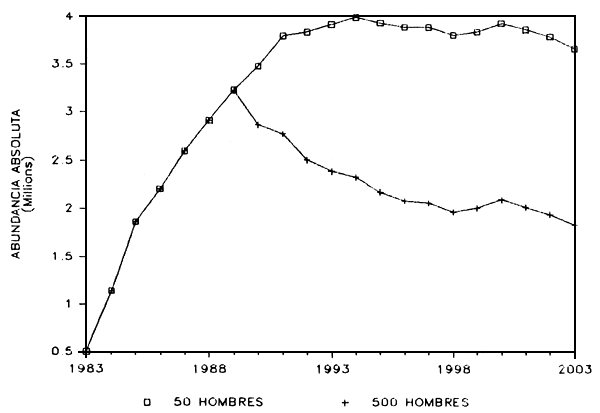
FIGURA 9: Lago de Guri. Explotación, abundancia del coporo.
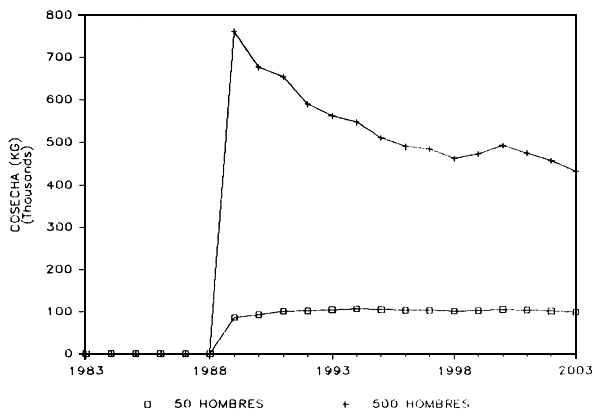
FIGURA 10: Lago de Guri. Modelo predictivo de cosecha.