
IDENTIDAD
Rasgos biológicos
Cuerpo alargado y algo comprimido. Labios gruesos. Dos pares de barbillas en el ángulo de la boca, las más cortas sobre el labio superior. Base de la aleta dorsal larga con 17-22 rayos ramificados y una espina dorsal fuerte y dentada en el frente; contorno de la aleta dorsal cóncavo anteriormente. Aleta anal con 6-7 rayos blandos; borde posterior de la 3ª espina de las aletas dorsal y anal con espínulas filudas. Línea lateral con 32 a 38 escamas. Dientes faríngeos 5:5, dientes con coronas aplanadas. Color variable, las carpas silvestres son de color parduzco verdoso sobre el dorso y parte superior de los costados, con tonalidad amarillo dorada ventralmente. Las aletas son oscuras, ventralmente con un matiz rojizo. Las carpas doradas son criadas con propósitos ornamentales.
PERFIL

Antecedentes históricos
La carpa común era un alimento de lujo en el período romano medio y tardío y fue consumida durante el ayuno en la Edad Media. Los peces eran mantenidos por los romanos en estanques de almacenamiento ('piscinae') y más tarde en lagunas de peces construidas por los monasterios cristianos. En esta práctica europea las carpas se mantenían en monocultivo. Los individuos más grandes eran seleccionados como reproductores. Desde, el siglo XII hasta mitad del siglo XIV DC había tenido lugar una selección artificial no intencional, los primeros pasos hacia la domesticación. La reproducción controlada semi natural en estanques y la crianza de alevines de carpa común comenzó en el siglo XIX en Europa. Los ciprínidos han sido criados en China por más de 2 000 años, donde fueron mantenidas en estanques sin drenaje. Los estanques eran sembrados regularmente con alevines de los ríos. Se aplicaba tecnología de policultivo basado en alimentos naturales. Se han desarrollado razas de carpas semi domesticadas en este sistema. Carpas domesticadas han sido producidas recientemente en la mayoría de las áreas de crianza de carpas. Hay alrededor de 30-35 linajes o cepas domesticadas de carpa común en Europa. Muchas cepas son mantenidas en China. Hay algunas cepas de carpas indonesias, las cuales aún no han sido científicamente examinadas e identificadas.
Principales países productores

Principales países productores de Cyprinus carpio (FAO Estadísticas pesqueras, 2006)
Hábitat y biología
La carpa común silvestre (generalmente referida simplemente como 'carpa' en esta hoja de información) vive en las corrientes medias y bajas de los ríos, en áreas inundadas y en aguas confinadas poco profundas, tales como lagos, meandros lacunares y embalses de agua. Las carpas son principalmente habitantes del fondo, pero buscan alimento en las capas media y superior del cuerpo de agua. Los típicos 'estanques de carpas' en Europa son pozas poco profundas, eutróficas con un fondo fangoso y vegetación acuática densa en los diques. El espectro ecológico de la carpa es amplio. El mejor crecimiento se obtiene cuando la temperatura del agua está en el intervalo 23 °C y 30 °C. Los peces pueden sobrevivir períodos de inviernos fríos. Salinidades hasta alrededor de 5‰ son toleradas. La gama de pH óptimo es 6,5-9,0. La especie puede sobrevivir bajas concentraciones de oxígeno (0,3-0,5 mg/litro) así como súper saturación. Las carpas son omnívoras, con una gran tendencia hacia el consumo de alimento animal, tal como insectos acuáticos, larvas de insectos, gusanos, moluscos y zooplancton. El consumo de zooplancton es dominante en estanques de peces donde la densidad de siembra es alta. Adicionalmente, la carpa consume los tallos, hojas y semillas de plantas acuáticas y terrestres, plantas acuáticas en descomposición, etc. El cultivo de la carpa en estanques se basa en la habilidad de la especie para aceptar y utilizar cereales proporcionados por los granjeros. El crecimiento diario de la carpa puede llegar a ser 2 a 4 por ciento del peso corporal. Las carpas pueden alcanzar 0,6 a 1,0 kg de peso corporal dentro de una estación en los estanques de cría de peces en policultivo de áreas subtropicales/tropicales. El crecimiento es mucho más lento en la zona temperada: ahí los peces alcanzan pesos corporales de 1 a 2 kg después de dos a cuatro estaciones de crianza. En Europa, las carpas hembras necesitan alrededor de 11 000 a 12 000 grados-días para alcanzar la madurez en las zonas climáticas temperadas y subtropicales. Las carpas macho están maduras dentro de un período que es 25-35 por ciento más corto. El período de madurez de las cepas asiáticas de carpa es levemente más corto. El desove de la carpa europea comienza cuando la temperatura del agua es 17-18 °C. Las cepas asiáticas comienzan a desovar cuando la concentración de iones del agua disminuye abruptamente al comienzo de la estación lluviosa. Las carpas silvestres son desovantes parciales. Las carpas domesticadas liberan todos sus huevos maduros dentro de unas pocas horas. Después del tratamiento hormonal las carpas liberan sus huevos maduros dentro de un período mucho más corto, lo que hace posible "ordeñar" a los reproductores para obtener sus gametos (huevos y espermios). La cantidad de huevos liberados es 100 a 230 g/kg de peso corporal. La cáscara del huevo se hace pegajosa después del contacto con el agua.
El desarrollo embrionario de la carpa común demora alrededor de tres días a 20-23 °C (60-70 grados-días). Bajo condiciones naturales, los peces eclosionados se pegan al substrato. Alrededor de tres días después de la eclosión se desarrolla la parte posterior de la vejiga natatoria, las larvas nadan horizontalmente y comienzan a consumir alimento externo con un tamaño máximo de 150-180 µm (principalmente rotíferos).
El desarrollo embrionario de la carpa común demora alrededor de tres días a 20-23 °C (60-70 grados-días). Bajo condiciones naturales, los peces eclosionados se pegan al substrato. Alrededor de tres días después de la eclosión se desarrolla la parte posterior de la vejiga natatoria, las larvas nadan horizontalmente y comienzan a consumir alimento externo con un tamaño máximo de 150-180 µm (principalmente rotíferos).
PRODUCCIÓN

Desove en nidos, plantas acuáticas y pastos inundados en tanques, lagunas o estanques
Las carpas pueden desovar a través del año en las áreas tropicales de India, con máximos en enero-marzo y julio-agosto. La reproducción se realiza en 'hapas', tanques de cemento o pequeños lagunas o estanques. Se usan plantas acuáticas sumergidas como sustratos para la puesta de huevos. Cuando los pececillos tienen cuatro o cinco días de edad, se los siembra en estanques de crianza.
El 'método Sundanese' es usado para desovar carpas en Indonesia. Los reproductores son mantenidos en estanques para reproductores, separados por sexo. Los reproductores maduros son transferidos a estanques de desove de 25-30 m². En los estanques se instalan 'kakabans' (nidos hechos de las fibras de una especie de Arenga). Los peces ponen sus huevos sobre ambos lados de los kakabans. Cuando el desove se termina, los nidos son transferidos a estanques de eclosión/incubación.
En China se usan pequeños estanques para desovar las carpas. Se usan plantas acuáticas (Ceratophyllum, Myriophyllum) u hojas flotantes de palma como substratos para el desove.
En el pasado, en Europa se usaron pequeños 'estanques Dubits' (área 120-300 m² de superficie de agua) para desove y para criar alevines de carpa por un lapso corto. Más recientemente, se usan aquí estanques con un área desde unos pocos cientos de m² hasta 10-30 ha. Dos a cuatro semanas después del desove, los pececillos pueden ser o cosechados desde estos grandes estanques o pueden permanecer allí para su crianza hasta tamaño alevín.
Producción de semilla en base a incubadora
Este es el método de producción de semilla más efectivo y confiable. Los reproductores son mantenidos en agua saturada con oxígeno, dentro del intervalo de temperatura de 20-24 °C. Se les dan dos dosis de inyección de glándula pituitaria, o una mezcla de GnRH/dopamina antagonista, para inducir la ovulación y la espermatogénesis. Los huevos son fertilizados (aplicando el 'método seco') y la adhesividad se elimina de los huevos usando un tratamiento de sal/urea, seguido por un baño ácido de tanino (el 'método Woynarovich'). La incubación se lleva acabo en jarros Zoug. Los pececillos eclosionados son mantenidos en grandes tanques cónicos por uno a tres días y usualmente son sembrados al estado de 'alevín que nada hacia arriba' o 'alevín que se alimenta' en estanques correctamente preparados. Aproximadamente unos 300 000 a 800 000 pececillos recién eclosionados pueden esperarse de una sola hembra.
Crianza de carpa común en lagunas o estanques y tanques
Estanques poco profundos, libres de malezas acuáticas, drenables de 0,5 a 1,0 ha son los más apropiados para la crianza de carpa. Los estanques de crianza deben ser preparados antes de ser sembrados para fomentar el desarrollo de una población de rotíferos, ya que ellos constituyen el primer alimento de los alevines que comienzan a alimentarse. La densidad de siembra es 100-400 alevines/m². Los estanques deben ser inoculados con microcrustáceos, Moina o Daphnia después de la siembra. Alimentos suplementarios, tales como harina de soya, harinas de cereales, harina de carne o mezclas de estos materiales, deben ser aplicados. También se puede usar salvado de arroz o cascarilla de arroz para alimentar a los alevines. La longitud del período de crianza es tres a cuatro semanas. El peso final de los peces es 0,2-0,5 g. La tasa de sobrevivencia es 40-70 por ciento.
Si hay muchos depredadores en el área donde se situarían los estanques (insectos, serpientes, ranas, aves, peces silvestres), se puede emplear tanques de cría de carpas. Se puede usar tanques de 5-100 m² de área superficial, hechos de concreto, ladrillos o plástico, para criar los alevines hasta 1-2 cm de tamaño. Aplicando heno y estiércol, se puede establecer poblaciones densas de Paramecium y rotíferos en estos tanques. Se puede sembrar unos pocos cientos de alevines por m². Se puede usar zooplancton recolectado y harinas de tamaño de partícula fino, o alimento inicial completo. Los sistemas industriales, tales como canales o sistemas con agua recirculada también son apropiados para la crianza.
Producción de alevines
La producción de alevines de carpa normalmente tiene lugar en estanques semi-intensivos y se basa en alimento natural generado con estiércol/fertilizante y alimentación suplementaria. La producción de alevines se puede realizar en un sistema de una sola etapa (sembrando pececillos recién nacidos y cosechando alevines), un sistema de etapa dual (sembrando pececillos ya criados y cosechando alevines) o un sistema de ciclo múltiple (donde los pececillos recién nacidos son sembrados y los peces son raleados varias veces a medida que crecen).
La siembra de pececillos ya criados es la manera más efectiva para producir alevines de tamaño mediano y grande. Dependiendo del tamaño final requerido de los alevines, 50 000-200 000 pececillos/ha pueden ser sembrados en zonas temperadas, preferentemente en sistemas de policultivo donde la proporción de carpa común es 20-50 por ciento. El peso final de la carpa es 30-100 g. En climas cálidos, si la producción deseada es de alevines de tamaño grande, la densidad de siembra de pececillos ya criados es 50 000-70 000/ha, de la cual la proporción de carpa común es 20 por ciento. Se alcanzan tasas de sobrevivencia de 40-50 por ciento. Alevines de pequeño tamaño pueden ser producidos en estanques sembrados con 400 000 pequeños (15 mm) pececillos ya criados. En este caso la tasa de sobrevivencia es 25-30 por ciento.
Se necesita la aplicación frecuente de estiércol para mantener la población de plancton. La alimentación se basa principalmente en subproductos agrícolas en áreas subtropicales y en cereales y/o pellets en zonas temperadas.
Producción de carpas de dos veranos de edad
En zonas temperadas, los peces de un verano de edad (20-100 g) deben ser criados hasta 250-400 g en el segundo año. La tasa de siembra es 4 000-6 000/ha, más alrededor de 3 000 carpas chinas/ha, si sólo se les alimenta con cereales. La tasa de siembra puede ser mucho más alta (hasta 20 000/ha) si se usan cereales y también pellets. La ración diaria es aproximadamente 3-5 por ciento del peso corporal.
Producción de peces de tamaño comercial
La carpa común puede ser producida en sistemas basados en monocultivo de producción extensiva, con alimento natural y dietas suplementarias, en lagunas o estanques de agua estancada. La producción basada en monocultivo intensivo con alimentos artificiales puede llevarse a cabo en jaulas, embalses de irrigación y estanques/lagunas/tanques con agua corriente, o en sistemas con recirculación.
Las carpas comunes son sembradas con carpas chinas, y/o las principales carpas de India, tilapia, lisas, etc., en sistemas de policultivo. Este constituye un método de producción basado en alimento natural y dietas suplementarias, en el cual peces que tienen diferentes hábitos de alimentación y que ocupan diferentes nichos tróficos son sembrados en los mismos estanques. La cantidad de peces debe estar de acuerdo con la productividad de los organismos que sirven como alimento natural. La aplicación frecuente de estiércol o fertilizantes y la proporción apropiada de especies, hace posible el mantenimiento de la productividad de las poblaciones de organismos que sirven como alimento natural y maximiza la utilización de la productividad del ecosistema del estanque. Efectos sinérgicos entre las especies de peces soportan la producción de policultivo en estanques.
El cultivo de carpa puede ser integrado con la ganadería y/o la producción vegetal. La integración puede ser directa (animales sobre los estanques de peces), indirecta (desechos de animales son usados en los estanques como abono), paralela (arroz-con-peces) o secuencial (producción de peces entre cosechas). El ciclado secuencial de peces/animales/legumbres/arroz (en ciclos de siete a nueve años) es apropiado para disminuir significativamente la carga ambiental de la acuicultura/agricultura intensiva. Dado que las carpas comunes excavan en el fondo del estanque, tienen una amplia tolerancia ambiental y hábitos de alimentación omnívoros, ellas son una especie clave en sistemas integrados.
Las carpas comunes también pueden ser sembradas en aguas naturales, embalses y áreas temporalmente inundadas, para utilizar la producción de alimento natural de estas aguas y mejorar las capturas de la pesquería. En este caso los peces sembrados debieran ser alevines de 13-15 cm producidos en granjas piscícolas ('pesquerías basadas en acuicultura'), para evitar las pérdidas que ocurrirían con peces más pequeños. Las carpas comunes son usualmente sembradas con otras especies de ciprínidos, de acuerdo con la productividad del cuerpo de agua y la intensidad de explotación.
El uso de alimentos naturales ha sido mencionado en otras secciones de esta hoja de información. Estos son suplementados a veces con alimentos compuestos hechos en la granja o con dietas comerciales.
Para la crianza de carpa se usan estanques no drenables, o estanques drenables con una larga zanja para cosecha, o estanques con fosos internos o externos para cosecha. Los peces son usualmente cosechados con una red de tiro. La longitud de las redes debiera ser 1,5 veces el ancho de los estanques, pero no más larga que 120-150 m.
En estanques no drenables, se puede hacer cosecha selectiva. Los pesos máximos de las carpas que pueden pasar a través de redes de varios tamaños de malla son: tamaño de malla de 20 mm = peces de 20 g; 25 mm = 40 g; 30 mm =100 g; 35 mm =170 g; 40 mm = 270 g; 50 mm = 400 g.
Dado que las carpas mantienen áreas libres de fango allí donde ellas buscan su alimento, la alimentación a través del período de crecimiento debiera hacerse en el área de cosecha. Al momento de la cosecha el agua debiera ser drenada lentamente (1-3 días desde un estanque de 1 ha, 8-14 días desde estanques de 30-60 ha). Los peces se reúnen en el área más profunda del estanque, a menos que ellos se alejen asustados por una disminución abrupta del nivel de agua o por ruidos. Dado que las carpas tienden a nadar hacia el agua entrante, una pequeña cantidad de agua se hace fluir en el estanque cerca del sitio de drenaje para concentrar los peces, especialmente si la temperatura del agua es alta. Se debiera proporcionar aireación cuando se ha concentrado una gran cantidad de peces en los fosos de cosecha. La aspersión o rociado de agua sobre la superficie generalmente no es suficiente.
La cosecha parcial (independiente si los estanques son drenables o no drenables) aumenta la producción total de los estanques al mejorar las condiciones para la población restante.
Si la cosecha se realiza en agua caliente, los peces son preacondicionados sometiéndolos a estrés repetidamente antes de enmallarlos. Los peces cosechados pueden ser transferidos vivos en tanques aireados por 3-5 horas, si la proporción peces/agua no es más que 1:2. La densidad de los peces en los tanques de transporte y la duración del transporte dependen del tamaño de los peces, la temperatura y la cantidad de aireación.
Si, durante la cosecha, los peces han sido atraídos al área de cosecha con alimento, sólo es factible un tiempo de transporte muy corto, dado que la demanda de oxígeno de los peces saciados es alta.
La mayoría de las carpas es transferida viva a los mercados y es vendida ya sea viva o en fresco. Pruebas exitosas se han llevado a cabo en Francia en relación con el fileteo de carpa a gran escala. Aparte de productos con valor agregado, se puede preparar alrededor de 15 productos diferentes de carpa, representando diferentes niveles de procesamiento.
La utilidad promedio de la producción de carpa en algunas granjas piscícolas de Hungría fue EUR 326/ha (en ventas de EUR 1652/ha) entre 1999-2001, de acuerdo con un a estudio del Instituto de Investigación de Pesquerías, Acuicultura e Irrigación (datos no publicados). En India el beneficio neto del policultivo, en el cual la carpa común representaba 25 por ciento del total de peces sembrados, fue reportado como 710 USD/ha (en ventas de 1 929 USD) en 1990 (Sinha, 1990). El beneficio de cultivadores de pequeña escala en Bangladesh fue reportado como 510-1 580 USD/ha (en ventas de 1 540-2 610 USD/ha) en estanques de policultivo no drenables, en los cuales la proporción de siembra de carpa fue de 20 por ciento (Gupta et al., 1999).
Ciclo de producción

Ciclo de producción de Cyprinus carpio
Sistemas de producción
Suministro de semilla
Desove en nidos, plantas acuáticas y pastos inundados en tanques, lagunas o estanques
Las carpas pueden desovar a través del año en las áreas tropicales de India, con máximos en enero-marzo y julio-agosto. La reproducción se realiza en 'hapas', tanques de cemento o pequeños lagunas o estanques. Se usan plantas acuáticas sumergidas como sustratos para la puesta de huevos. Cuando los pececillos tienen cuatro o cinco días de edad, se los siembra en estanques de crianza.
El 'método Sundanese' es usado para desovar carpas en Indonesia. Los reproductores son mantenidos en estanques para reproductores, separados por sexo. Los reproductores maduros son transferidos a estanques de desove de 25-30 m². En los estanques se instalan 'kakabans' (nidos hechos de las fibras de una especie de Arenga). Los peces ponen sus huevos sobre ambos lados de los kakabans. Cuando el desove se termina, los nidos son transferidos a estanques de eclosión/incubación.
En China se usan pequeños estanques para desovar las carpas. Se usan plantas acuáticas (Ceratophyllum, Myriophyllum) u hojas flotantes de palma como substratos para el desove.
En el pasado, en Europa se usaron pequeños 'estanques Dubits' (área 120-300 m² de superficie de agua) para desove y para criar alevines de carpa por un lapso corto. Más recientemente, se usan aquí estanques con un área desde unos pocos cientos de m² hasta 10-30 ha. Dos a cuatro semanas después del desove, los pececillos pueden ser o cosechados desde estos grandes estanques o pueden permanecer allí para su crianza hasta tamaño alevín.
Producción de semilla en base a incubadora
Este es el método de producción de semilla más efectivo y confiable. Los reproductores son mantenidos en agua saturada con oxígeno, dentro del intervalo de temperatura de 20-24 °C. Se les dan dos dosis de inyección de glándula pituitaria, o una mezcla de GnRH/dopamina antagonista, para inducir la ovulación y la espermatogénesis. Los huevos son fertilizados (aplicando el 'método seco') y la adhesividad se elimina de los huevos usando un tratamiento de sal/urea, seguido por un baño ácido de tanino (el 'método Woynarovich'). La incubación se lleva acabo en jarros Zoug. Los pececillos eclosionados son mantenidos en grandes tanques cónicos por uno a tres días y usualmente son sembrados al estado de 'alevín que nada hacia arriba' o 'alevín que se alimenta' en estanques correctamente preparados. Aproximadamente unos 300 000 a 800 000 pececillos recién eclosionados pueden esperarse de una sola hembra.
Criadero
Crianza de carpa común en lagunas o estanques y tanques
Estanques poco profundos, libres de malezas acuáticas, drenables de 0,5 a 1,0 ha son los más apropiados para la crianza de carpa. Los estanques de crianza deben ser preparados antes de ser sembrados para fomentar el desarrollo de una población de rotíferos, ya que ellos constituyen el primer alimento de los alevines que comienzan a alimentarse. La densidad de siembra es 100-400 alevines/m². Los estanques deben ser inoculados con microcrustáceos, Moina o Daphnia después de la siembra. Alimentos suplementarios, tales como harina de soya, harinas de cereales, harina de carne o mezclas de estos materiales, deben ser aplicados. También se puede usar salvado de arroz o cascarilla de arroz para alimentar a los alevines. La longitud del período de crianza es tres a cuatro semanas. El peso final de los peces es 0,2-0,5 g. La tasa de sobrevivencia es 40-70 por ciento.
Si hay muchos depredadores en el área donde se situarían los estanques (insectos, serpientes, ranas, aves, peces silvestres), se puede emplear tanques de cría de carpas. Se puede usar tanques de 5-100 m² de área superficial, hechos de concreto, ladrillos o plástico, para criar los alevines hasta 1-2 cm de tamaño. Aplicando heno y estiércol, se puede establecer poblaciones densas de Paramecium y rotíferos en estos tanques. Se puede sembrar unos pocos cientos de alevines por m². Se puede usar zooplancton recolectado y harinas de tamaño de partícula fino, o alimento inicial completo. Los sistemas industriales, tales como canales o sistemas con agua recirculada también son apropiados para la crianza.
Producción de alevines
La producción de alevines de carpa normalmente tiene lugar en estanques semi-intensivos y se basa en alimento natural generado con estiércol/fertilizante y alimentación suplementaria. La producción de alevines se puede realizar en un sistema de una sola etapa (sembrando pececillos recién nacidos y cosechando alevines), un sistema de etapa dual (sembrando pececillos ya criados y cosechando alevines) o un sistema de ciclo múltiple (donde los pececillos recién nacidos son sembrados y los peces son raleados varias veces a medida que crecen).
La siembra de pececillos ya criados es la manera más efectiva para producir alevines de tamaño mediano y grande. Dependiendo del tamaño final requerido de los alevines, 50 000-200 000 pececillos/ha pueden ser sembrados en zonas temperadas, preferentemente en sistemas de policultivo donde la proporción de carpa común es 20-50 por ciento. El peso final de la carpa es 30-100 g. En climas cálidos, si la producción deseada es de alevines de tamaño grande, la densidad de siembra de pececillos ya criados es 50 000-70 000/ha, de la cual la proporción de carpa común es 20 por ciento. Se alcanzan tasas de sobrevivencia de 40-50 por ciento. Alevines de pequeño tamaño pueden ser producidos en estanques sembrados con 400 000 pequeños (15 mm) pececillos ya criados. En este caso la tasa de sobrevivencia es 25-30 por ciento.
Se necesita la aplicación frecuente de estiércol para mantener la población de plancton. La alimentación se basa principalmente en subproductos agrícolas en áreas subtropicales y en cereales y/o pellets en zonas temperadas.
Técnicas de engorda
Producción de carpas de dos veranos de edad
En zonas temperadas, los peces de un verano de edad (20-100 g) deben ser criados hasta 250-400 g en el segundo año. La tasa de siembra es 4 000-6 000/ha, más alrededor de 3 000 carpas chinas/ha, si sólo se les alimenta con cereales. La tasa de siembra puede ser mucho más alta (hasta 20 000/ha) si se usan cereales y también pellets. La ración diaria es aproximadamente 3-5 por ciento del peso corporal.
Producción de peces de tamaño comercial
La carpa común puede ser producida en sistemas basados en monocultivo de producción extensiva, con alimento natural y dietas suplementarias, en lagunas o estanques de agua estancada. La producción basada en monocultivo intensivo con alimentos artificiales puede llevarse a cabo en jaulas, embalses de irrigación y estanques/lagunas/tanques con agua corriente, o en sistemas con recirculación.
Las carpas comunes son sembradas con carpas chinas, y/o las principales carpas de India, tilapia, lisas, etc., en sistemas de policultivo. Este constituye un método de producción basado en alimento natural y dietas suplementarias, en el cual peces que tienen diferentes hábitos de alimentación y que ocupan diferentes nichos tróficos son sembrados en los mismos estanques. La cantidad de peces debe estar de acuerdo con la productividad de los organismos que sirven como alimento natural. La aplicación frecuente de estiércol o fertilizantes y la proporción apropiada de especies, hace posible el mantenimiento de la productividad de las poblaciones de organismos que sirven como alimento natural y maximiza la utilización de la productividad del ecosistema del estanque. Efectos sinérgicos entre las especies de peces soportan la producción de policultivo en estanques.
El cultivo de carpa puede ser integrado con la ganadería y/o la producción vegetal. La integración puede ser directa (animales sobre los estanques de peces), indirecta (desechos de animales son usados en los estanques como abono), paralela (arroz-con-peces) o secuencial (producción de peces entre cosechas). El ciclado secuencial de peces/animales/legumbres/arroz (en ciclos de siete a nueve años) es apropiado para disminuir significativamente la carga ambiental de la acuicultura/agricultura intensiva. Dado que las carpas comunes excavan en el fondo del estanque, tienen una amplia tolerancia ambiental y hábitos de alimentación omnívoros, ellas son una especie clave en sistemas integrados.
Las carpas comunes también pueden ser sembradas en aguas naturales, embalses y áreas temporalmente inundadas, para utilizar la producción de alimento natural de estas aguas y mejorar las capturas de la pesquería. En este caso los peces sembrados debieran ser alevines de 13-15 cm producidos en granjas piscícolas ('pesquerías basadas en acuicultura'), para evitar las pérdidas que ocurrirían con peces más pequeños. Las carpas comunes son usualmente sembradas con otras especies de ciprínidos, de acuerdo con la productividad del cuerpo de agua y la intensidad de explotación.
Suministro de alimento
El uso de alimentos naturales ha sido mencionado en otras secciones de esta hoja de información. Estos son suplementados a veces con alimentos compuestos hechos en la granja o con dietas comerciales.
Técnicas de cosecha
Para la crianza de carpa se usan estanques no drenables, o estanques drenables con una larga zanja para cosecha, o estanques con fosos internos o externos para cosecha. Los peces son usualmente cosechados con una red de tiro. La longitud de las redes debiera ser 1,5 veces el ancho de los estanques, pero no más larga que 120-150 m.
En estanques no drenables, se puede hacer cosecha selectiva. Los pesos máximos de las carpas que pueden pasar a través de redes de varios tamaños de malla son: tamaño de malla de 20 mm = peces de 20 g; 25 mm = 40 g; 30 mm =100 g; 35 mm =170 g; 40 mm = 270 g; 50 mm = 400 g.
Dado que las carpas mantienen áreas libres de fango allí donde ellas buscan su alimento, la alimentación a través del período de crecimiento debiera hacerse en el área de cosecha. Al momento de la cosecha el agua debiera ser drenada lentamente (1-3 días desde un estanque de 1 ha, 8-14 días desde estanques de 30-60 ha). Los peces se reúnen en el área más profunda del estanque, a menos que ellos se alejen asustados por una disminución abrupta del nivel de agua o por ruidos. Dado que las carpas tienden a nadar hacia el agua entrante, una pequeña cantidad de agua se hace fluir en el estanque cerca del sitio de drenaje para concentrar los peces, especialmente si la temperatura del agua es alta. Se debiera proporcionar aireación cuando se ha concentrado una gran cantidad de peces en los fosos de cosecha. La aspersión o rociado de agua sobre la superficie generalmente no es suficiente.
La cosecha parcial (independiente si los estanques son drenables o no drenables) aumenta la producción total de los estanques al mejorar las condiciones para la población restante.
Manipulación y procesamiento
Si la cosecha se realiza en agua caliente, los peces son preacondicionados sometiéndolos a estrés repetidamente antes de enmallarlos. Los peces cosechados pueden ser transferidos vivos en tanques aireados por 3-5 horas, si la proporción peces/agua no es más que 1:2. La densidad de los peces en los tanques de transporte y la duración del transporte dependen del tamaño de los peces, la temperatura y la cantidad de aireación.
Si, durante la cosecha, los peces han sido atraídos al área de cosecha con alimento, sólo es factible un tiempo de transporte muy corto, dado que la demanda de oxígeno de los peces saciados es alta.
La mayoría de las carpas es transferida viva a los mercados y es vendida ya sea viva o en fresco. Pruebas exitosas se han llevado a cabo en Francia en relación con el fileteo de carpa a gran escala. Aparte de productos con valor agregado, se puede preparar alrededor de 15 productos diferentes de carpa, representando diferentes niveles de procesamiento.
Costos de producción
La utilidad promedio de la producción de carpa en algunas granjas piscícolas de Hungría fue EUR 326/ha (en ventas de EUR 1652/ha) entre 1999-2001, de acuerdo con un a estudio del Instituto de Investigación de Pesquerías, Acuicultura e Irrigación (datos no publicados). En India el beneficio neto del policultivo, en el cual la carpa común representaba 25 por ciento del total de peces sembrados, fue reportado como 710 USD/ha (en ventas de 1 929 USD) en 1990 (Sinha, 1990). El beneficio de cultivadores de pequeña escala en Bangladesh fue reportado como 510-1 580 USD/ha (en ventas de 1 540-2 610 USD/ha) en estanques de policultivo no drenables, en los cuales la proporción de siembra de carpa fue de 20 por ciento (Gupta et al., 1999).
Enfermedades y medidas de control
En algunos casos se han utilizado antibióticos y otros productos farmacéuticos en el tratamiento, pero su inclusión en esta tabla no implica una recomendación de la FAO.
Proveedores con experiencia en patología
Se puede obtener asesoría experta de las siguientes fuentes:
| ENFERMEDAD | AGENTE | TIPO | SINDROME | MEDIDAS |
| Saprolegniasis | Saprolegnia spp. | Hongos | Colonias fúngicas blancas sobre la superficie del cuerpo, áreas heridas o úlceras, y sobre la superficie de los huevos | Dosis única o repetidas de verde de malaquita |
| Branquiomicosis; podredumbre de las agallas | Branchiomyces sanguinis | Hongo | Coloración de las agallas tipo mosaico; hemorragias y áreas anémicas; mortalidad masiva; infección secundaria por Saprolegnia | Tratamiento del estanque con cal viva; tratamiento repetido con sulfato de cobre |
| Eritrodermatitis de la carpa; enfermedad ulcerosa | Aeromonas salmonicida achromogenes | Bacteria | Nódulos esféricos pequeños sobre las aletas; hemorragias; úlceras con bordes irregulares; escamas salientes; exoftalmia; abdomen hinchado; hemorragias sobre las agallas; fluido rosado en la cavidad del cuerpo; infección secundaria de las úlceras por Saprolegnia | Aplicar tecnologías extensivas; evitar el estrés; aplicar antibióticos en la dieta o como inyecciones; vacunación |
| Enfermedad Columnaris | Flexibacter columnaris | Bacteria | Aparece por sobre los 15 °C; puntos gris blancuzcos rodeados por zona con tinte rojizo sobre la cabeza, agallas, piel y aletas; membranas destruidas entre los rayos de las aletas | Tratamiento con cloruro de benzalkonium, sulfato de cobre o antibióticos (furazolidone, neomicina, oxitetraciclina, terramicina); alimentos conteniendo sulfamerazina y oxitetraciclina |
| Enfermedad bacterial de las agallas | Flavobacterium branciophyla | Bacteria | Áreas blancas sobre la superficie del cuerpo y/o sobre las agallas; necrosis de las áreas infectadas | Tratamiento con sal o antibióticos; mejoramiento del ambiente del estanque |
| Micobacteriosis | Mycobacterium spp. | Bacterias | Peces enflaquecidos, enanos; cesa la alimentación; decoloración gris claro sobre la superficie del cuerpo; a veces úlceras abiertas | No hay tratamiento disponible; destruir las poblaciones infectadas |
| Viremia primaveral de la carpa | Rhabdovirus carpio | Virus | Brota por sobre 12 °C; natación errática; más tarde ocurre letargo; enteritis; edema; exoftalmia; agallas pálidas; hemorragias en la piel | Eliminación de vectores, tales como parásitos chupadores de sangre; no transferir peces infectados |
| Varicela de la carpa | Virus tipo Herpes | Virus | Manchas lisas, opacas, blanco grisáceas de diámetro 1-2 mm sobre la superficie del cuerpo; más tarde, el cuerpo es cubierto con ellas; pérdida de calcio; cuerpo blando; la cola puede estar vuelta hacia la cabeza; se manifiesta por sobre los 14 °C | Evitar la introducción de peces infectados |
| Enfermedad del Virus Herpes del Koi (KHV) | Virus tipo Herpes | Virus | La enfermedad ocurre entre 17-25 °C en carpa común y koi; letargo; natación descontrolada, errática; necrosis focal de las agallas; aumento de la secreción de mucus; hemorragias en las agallas e hígado; inflamación del riñón; mortalidad masiva | Mantener las áreas infectadas libres de carpas por tres meses; vacunación |
| Costiosis | Ichthyobodo spp. | Protozoos ectoparásitos | Boqueando a la entrada del agua; letargo; destello; natación errática; peces delgados; película azul-gris sobre la piel y agallas | Baños de sal, formalina o verde de malaquita; oxicloruro de cobre en los estanques |
| Coccidiosis | Eimeria spp. | Protozoos endoparásitos | Los peces yacen sobre el fondo del estanque; ojos hundidos; debilitamiento; cuerpo delgado; cabeza grande; edema de las membranas abdominales y de la pared intestinal; la pared intestinal es oscura; mucosa intestinal hinchada; exudado de mucus amarillento | Desinfección y secado de los estanques; furazolidone en el alimento |
| Enfermedad del punto blanco Ictioftiriasis | Ichthyophthirius multifiliis | Protozoo ectoparásito | Comportamiento de rascarse; destello; boqueo; batir acelerado de las agallas; daño en las agallas; puntos blancos sobre aletas, piel, agallas y ojos | Baños de verde de malaquita |
| Quilodonelosis | Chilodonella spp. | Protozoos ectoparásitos | Peces en la superficie; natación errática, oscilante; agallas pálidas; película de mucus gris sobre la piel; necrosis de células epiteliales; úlceras | Baños de sal, formalina o verde de malaquita; oxicloruro de cobre en los estanques |
| Tricodinosis | Trichodina spp. | Protozoos ectoparásitos | Peces salen a la superficie; manchas blancas sobre la superficie de la piel; exceso de exudado de mucus sobre las agallas; aletas deshilachadas; agallas pálidas cubiertas con mucus y restos celulares | Baños de sal, formalina o verde de malaquita; oxicloruro de cobre en los estanques |
| Mixobolosis | Myxobolus spp. | Mixosporidios endoparásitos | Edema; escamas sueltas; exoftalmia; quistes blancos o amarillos y hemorragias en las agallas; nódulos blancos en las agallas (koi); necrosis muscular | Fumagilina en el alimento |
| Dactilogirosis Enfermedad por gusanos planos en las agallas | Dactylogyrus spp. | Helmintos Trematodos Monogeneos ectoparásitos | Los peces nadan hacia la entrada del agua; proliferación de la epidermis de las agallas; gusanos visibles sobre las agallas con baja (40-60) multiplicación | Baños de sal, amoníaco, organofosfato, neguvon o praziquantel; secado de los estanques |
| Girodactilosis | Gyrodactylus spp. | Helmintos Trematodos Monogeneos ectoparásitos | Los peces nadan sin descanso; piel grisácea; agallas pálidas; aletas blancas y destrozadas | Baños de sal, amoníaco, organofosfato, neguvon o praziquantel; secado de los estanques |
| Diplostomosis | Diplostomum spp. | Trematodos endoparásitos | Natación descontrolada; piel oscura; pequeñas hemorragias sobre el abdomen; pérdida de peso; desarrollo de cataratas en los ojos; hemorragias en los ojos; inflamación de los ojos; exoftalmia | Baño de praziquantel; erradicación de huéspedes, tales como caracoles y aves |
| Fostodiplostomosis | Phosthodiplostomum spp. | Trematodos endoparásitos | Las larvas encapsuladas evocan acumulación de melanina; se desarrollan quistes negros de 0,6-1,0 mm; puede ocurrir deformación de la columna vertebral en los alevines | Baños de organofosfato (masoten, dipterex, sumithion) o praziquantel; erradicación de caracoles y garzas |
| Sanguinicoliasis | Sanguinicola spp. | Trematodos endoparásitos | Letargo; natación con movimiento en espiral; peces en la superficie del agua; cesan de alimentarse; a veces exoftalmia; inflamación de las agallas | Baño de praziquantel; erradicación de caracoles con sulfato de cobre cuando no hay peces presentes; secado de los estanques al sol |
| Ligulosis | Ligula intestinalis | Cestodo endoparásito | Cuerpo distendido; nadan con dificultad; cesan de alimentarse; pérdida de peso; primera parte del abdomen abultada; exudado en la cavidad del cuerpo; las lombrices son visibles en los peces | Expulsar las aves; baño de praziquantel |
| Botriocefalosis | Bothriocephalus acheilognathi | Cestodo endoparásito | Movimientos lentos; natación en la superficie; enflaquecimiento; abdomen abultado; inflamación del tracto digestivo; hemorragias y úlceras en el intestino | Suministrar salicilanalid clorinado en el alimento; baño de praziquantel; mantener los estanques secos en invierno; desinfectar los fondos de los estanques con cal; erradicar los copépodos |
| Khawiosis; infestación por tenia | Khawia sinensis | Cestodo endoparásito | Movimientos lentos; pérdida de apetito; crecimiento lento; anemia de la piel y agallas; hemorragias y úlceras en el intestino; los gusanos pueden sobresalir desde el ano | Baños de devermin; erradicar tubifex (anfitrión) desinfectando los estanques |
| Infestación por nematodos | Contracaecum spp. | Nematodos endoparásitos | Enflaquecimiento; exoftalmia; pérdida de sangre en la cavidad del cuerpo; ascárides (gusanos redondos) en el corazón y cavidad del cuerpo | No tratamiento |
| Filometrosis; infestación por nematodos | Phylometra spp. | Nematodos endoparásitos | Pérdida del balance; los peces flotan cabeza abajo; cesan de alimentarse; nódulos rojos sobre la piel y bajo las escamas | Erradicar copépodos; inyecciones de nilverm o ditrazin en la cavidad del cuerpo |
| Infestación por Sanguijuela de pez | Piscicolidae | Anélido endoparásito | Natación hiperactiva a la entrada del agua; pérdida de peso; úlceras | Baños de sal o dipterex (con o sin permanganato de potasio) |
| Ergasilosis | Ergasilus spp. | Artrópodo ectoparásito | Pérdida de peso; desarrollo lento; mortalidad; manchas blancas pequeñas sobre las agallas; hiperplasia de las agallas; necrosis del tejido de las agallas; pérdida de lamelas; circulación reducida; infecciones secundarias | Baños de clorfos u organofosfato; secado de los estanques al sol |
| Lernaeosisinfestación por gusanos ancla | Lernaea spp. | Artrópodo Copépodo ectoparásito | Letargo; los peces cesan de alimentarse; los gusanos ancla se pueden ver sobre la superficie del cuerpo y agallas | Baños de sal, permanganato de potasio u organofosfato |
| Argulosis | Argulus spp. | Artrópodo ectoparásito | Los parásitos son visibles sobre la superficie del cuerpo; natación anormal; letargo; los peces cesan de alimentarse; producción excesiva de mucus; pequeñas hemorragias; erosión de las aletas; anemia; úlceras; infecciones secundarias | Baños de sal, permanganato de potasio u organofosfato |
Proveedores con experiencia en patología
Se puede obtener asesoría experta de las siguientes fuentes:
- Asia
- Asia Diagnostic Guide to Aquatic Animal Diseases (http://library.enaca.org/NACA-Publications/ADG-complete.pdf).
- Prof. Jiang Yulin, China. E-mail to: [email protected].
- Aqua-Vet Technologies Ltd. Israel (Dr. Ra'anan Ariav). E-mail to: [email protected] or [email protected].
- Europe
- CEFAS Weymouth Laboratory, UK
- Dr. Peter Dixon. E-mail to: [email protected].
- Dr. Keith Way. E-mail to: k.way@[email protected].
- Central Veterinarian Institute, Fish and Bee Disease Department, Hungary
- Dr. Gyorgy Csaba. E-mail to: [email protected].
- Dr. Maria Lang. E-mail to: [email protected].
- Fish & Shellfish Diseases Laboratory, The Netherlands
- Dr. Olga L.M. Haenen. E-mail to: [email protected].
- National Reference Laboratory for Fish Diseases, Germany
- Dr. Sven Bergmann. E-mail to: [email protected].
- CEFAS Weymouth Laboratory, UK
- Australia
- Commonwealth Scientific and Industrial Research Organisation-CSIRO (http://csiro.au).
- USA
- UC Davis, California
- Prof. Ronald Hedrick. E-mail to: [email protected].
- UC Davis, California
ESTADÍSTICAS
Estadísticas de producción
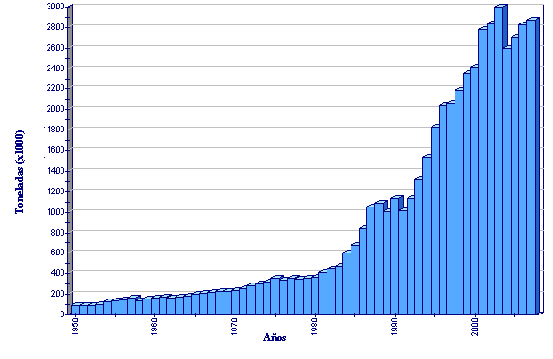
Producción de acuicultura global de Cyprinus carpio
(FAO Estadísticas pesqueras)
(FAO Estadísticas pesqueras)
Mercado y comercio
Los datos estadísticos indican que la producción de carpa común puede haber llegado cerca de su límite. Sin embargo, la carpa común permanecerá como una especie importante en aquellas áreas donde ha sido producida tradicionalmente. La mayoría de las carpas son consumidas domésticamente. En base a varias experiencias de procesamiento de carpa común realizadas en Europa, se reveló que el mercado tiene demanda por pescado vivo o preparado en fresco. El procesamiento aumentó el precio de la carpa a niveles menos competitivos, de manera que un aumento significativo en la demanda por productos procesados de carpa no puede ser pronosticado.
Típicamente, alrededor de 24 000 toneladas de productos de carpa (todas las especies) viva, fresca/filete enfriado o congelado se transan anualmente (importados o exportados) dentro de Europa. Los principales exportadores son Austria, la República Checa, Croacia y Lituania. Los principales importadores en 2002 fueron Austria, Alemania, Hungría y Polonia. En el conjunto del resto del mundo, incluyendo la principal región productora (Asia), el comercio internacional de todas las especies de carpa es muy limitado (39 000 toneladas/año en 2002).
La producción de 'bio carpa' ha sido iniciada en algunas áreas. El etiquetado de calidad y un énfasis sobre el hecho que las carpas son producidas en sistemas extensivos o semi intensivos que son tecnologías amigables con el ambiente, puede aumentar la aceptación de la carpa común por parte de ciertos grupos de consumidores.
Un cambio en el objetivo principal de la producción de carpa común puede ser observado en Europa. Inicialmente, el mercado demandaba pescado principalmente para consumo. Recientemente, una cantidad significativa de la carpa producida en acuicultura es sembrada en aguas naturales y embalses para propósitos de pesca deportiva. Dado que los pescadores deportivos prefieren peces que son más activos en el anzuelo que las carpas domesticadas, ellos necesitan carpas silvestres o linajes híbridos de carpas domesticadas y silvestres. Las carpas silvestres son requeridas también para repoblar aguas naturales, donde se lleva a cabo la rehabilitación de la fauna natural.
Típicamente, alrededor de 24 000 toneladas de productos de carpa (todas las especies) viva, fresca/filete enfriado o congelado se transan anualmente (importados o exportados) dentro de Europa. Los principales exportadores son Austria, la República Checa, Croacia y Lituania. Los principales importadores en 2002 fueron Austria, Alemania, Hungría y Polonia. En el conjunto del resto del mundo, incluyendo la principal región productora (Asia), el comercio internacional de todas las especies de carpa es muy limitado (39 000 toneladas/año en 2002).
La producción de 'bio carpa' ha sido iniciada en algunas áreas. El etiquetado de calidad y un énfasis sobre el hecho que las carpas son producidas en sistemas extensivos o semi intensivos que son tecnologías amigables con el ambiente, puede aumentar la aceptación de la carpa común por parte de ciertos grupos de consumidores.
Un cambio en el objetivo principal de la producción de carpa común puede ser observado en Europa. Inicialmente, el mercado demandaba pescado principalmente para consumo. Recientemente, una cantidad significativa de la carpa producida en acuicultura es sembrada en aguas naturales y embalses para propósitos de pesca deportiva. Dado que los pescadores deportivos prefieren peces que son más activos en el anzuelo que las carpas domesticadas, ellos necesitan carpas silvestres o linajes híbridos de carpas domesticadas y silvestres. Las carpas silvestres son requeridas también para repoblar aguas naturales, donde se lleva a cabo la rehabilitación de la fauna natural.
ESTATUS Y TENDENCIAS
Dado que esta especie tiene importancia destacada en la acuicultura de agua dulce, muchos aspectos de su fisiología, nutrición, genética y enfermedades han sido estudiados durante las décadas pasadas. El papel de la carpa común en los ecosistemas acuáticos ha sido examinado y se han desarrollado las tecnologías de reproducción y crianza que se ajustan a diversas condiciones climáticas y niveles de intensidad.
Las tareas para el futuro incluyen:
Las tareas para el futuro incluyen:
- Tecnología de Crianza: introducción/adaptación de tecnologías que sean óptimas para diversas condiciones climáticas, ambientales y socio-económicas y la aplicación más amplia de sistemas de bicultivo y policultivo amigables con el ambiente en las áreas tradicionales de producción de carpa.
- Acuicultura y agricultura rotacional: la introducción de sistemas rotacionales de uso de la tierra para agricultura/acuicultura basada en carpa puede ayudar a eliminar el impacto ambiental adverso de la agricultura intensiva en muchos lugares. Este sistema también puede ser usado para desalinización del suelo.
- Genética: las necesidades de investigación orientada a la genética práctica deben ser continuadas para el desarrollo de sistemas de crianza confiables. Basado en la investigación genética, debiera establecerse asociaciones de criadores para mantener el genoma estable 'razas locales' (cepas) en diversas áreas geográficas y zonas climáticas, para evitar así la endogamia. El INGA (Red Internacional de Genética en Acuicultura, organizada por el Centro Mundial de Peces, antiguamente ICLARM) ayuda a realizar las tareas indicadas arriba en las áreas de Asia sur oriental y Europa del este. Hay algunas oportunidades en genética de peces para aumentar la resistencia de las carpas a las enfermedades desarrollando cepas e híbridos resistentes.
- Enfermedades y control: cambios adversos en el ambiente natural, la creciente intensidad de la producción de carpas en muchas áreas, el extensivo transporte interregional de la carpa común y otros ciprínidos y la prohibición del uso de varios medicamentes tradicionales (fungicidas, antibióticos e insecticidas) claman por la intensificación de la investigación sobre las enfermedades de las carpas. Un campo de investigación relativamente nuevo y promisorio es el desarrollo de inmunoestimulantes, para aumentar la resistencia natural de los peces. El desarrollo de vacunas parece ser la solución más promisoria para evitar la aplicación de antibióticos. El desarrollo y aplicación a gran escala de vacunas contra enfermedades virales tiene importancia primaria para controlar enfermedades virales 'tradicionales', tales como la viremia de primavera, la varicela de la carpa y la necrosis viral de las agallas. La introducción a gran escala de la vacunación contra 'KHV' (la cual realmente es un virus llamado Virus de la Nefritis y Necrosis de las Agallas de la Carpa, CNGNV) también es muy importante en las áreas infectadas o en peligro. También es necesario el desarrollo de herramientas de diagnóstico rápido para determinar las infecciones bacteriales y virales. La vigilancia sobre las enfermedades parasitarias debiera ser mantenida. También debiera continuarse la investigación para entender mejor los factores ambientales y tecnológicos precondicionantes, que hacen a los peces menos resistentes y a los patógenos más virulentos.
PRINCIPALES ASUNTOS
El efecto del cultivo extensivo de carpa sobre el ambiente es insignificante o incluso positivo, dado que la carpa ayuda a mantener condiciones aeróbicas del fondo. El efecto ambiental del policultivo semi intensivo de carpa depende de la intensidad de producción y de la calidad del agua de los recipientes. La acumulación de lodo y material orgánico puede ser muy alta en los sistemas integrados. Sin embargo, el uso rotacional de la tierra para la producción de peces-con-patos y alfalfa y arroz es el medio ambientalmente más amigable para realizar acuicultura y agricultura integradas. El efecto de los sistemas de acuicultura intensiva (industrial) sobre el ambiente depende de la eficiencia del manejo de los desechos.
La sobre población de las aguas abiertas con carpas y la introducción de carpas no indígenas puede causar impactos negativos. La población de plantas acuáticas puede ser destruida por el aumento de la turbiedad y el desarraigo de las plantas. Al reducir los sitios de desove disponibles para especies fitofílicas, la carpa común puede disminuir la biodiversidad en aguas naturales.
La sobre población de las aguas abiertas con carpas y la introducción de carpas no indígenas puede causar impactos negativos. La población de plantas acuáticas puede ser destruida por el aumento de la turbiedad y el desarraigo de las plantas. Al reducir los sitios de desove disponibles para especies fitofílicas, la carpa común puede disminuir la biodiversidad en aguas naturales.
Prácticas de acuicultura responsable
Hay muchos tipos de producción de carpa bien elaborados, por lo tanto es relativamente fácil seleccionar métodos de producción que estén de acuerdo con el Artículo 9 del Código de Conducta para Pesquerías Responsables. La técnica más ampliamente aplicada, a saber la producción extensiva o semi-intensiva de carpa basada en alimento suplementario, es considerada como una manera ambientalmente amigable de producción de proteína animal. La acuicultura responsable en el nivel de producción (Artículo 9.4., Código de Conducta) se puede asegurar aplicando un estricto proceso de licencias, en el cual se consideren los principales principios de protección ambiental y ecológica.
El establecimiento de asociaciones de criadores de carpa que mantienen y reproducen linajes o cepas puras de carpa común por criadores certificados en hatcheries con licencia; controles de calidad frecuentes basados en exámenes estandardizados de progenie; y apoyo a las granjas en la siembra de linajes puros, ayuda a mantener la población de carpa de diversas áreas, incluyendo las poblaciones de carpa del tipo silvestre de las aguas naturales; este sistema fue elaborado y aplicado por la Asociación Húngara de Productores de Peces.
El control de la salud de los peces basado en veterinarios locales e instituciones gubernamentales ayuda a aumentar la seguridad de la producción al disminuir los efectos de las enfermedades de los peces cultivados sobre las poblaciones naturales de peces y ayuda a minimizar el uso de químicos, drogas y antibióticos.
La introducción de controles de calidad, basados en el etiquetado/trazabilidad de los productos y la provisión de apoyo para el desarrollo de productos 'orgánicos' puede incrementar la aplicación de tecnologías ambientalmente amigables, así como también mejorar el suministro de pescado de buena calidad.
El establecimiento de asociaciones de criadores de carpa que mantienen y reproducen linajes o cepas puras de carpa común por criadores certificados en hatcheries con licencia; controles de calidad frecuentes basados en exámenes estandardizados de progenie; y apoyo a las granjas en la siembra de linajes puros, ayuda a mantener la población de carpa de diversas áreas, incluyendo las poblaciones de carpa del tipo silvestre de las aguas naturales; este sistema fue elaborado y aplicado por la Asociación Húngara de Productores de Peces.
El control de la salud de los peces basado en veterinarios locales e instituciones gubernamentales ayuda a aumentar la seguridad de la producción al disminuir los efectos de las enfermedades de los peces cultivados sobre las poblaciones naturales de peces y ayuda a minimizar el uso de químicos, drogas y antibióticos.
La introducción de controles de calidad, basados en el etiquetado/trazabilidad de los productos y la provisión de apoyo para el desarrollo de productos 'orgánicos' puede incrementar la aplicación de tecnologías ambientalmente amigables, así como también mejorar el suministro de pescado de buena calidad.
REFERENCIAS
Bibliograf�a
| ADB/NACA. 1998. Aquaculture Sustainability and the Environment. Report on a Regional Study and Workshop on Aquaculture Sustainability and the Environment. Asian Development Bank and Network of Aquaculture Centres in Asia-Pacific, Bangkok, Thailand. 491 pp. |
| Alabaster, J.S. & Lloyd, R. 1982. Water Quality Criteria for Freshwater Fish. Second edition. Butterworth Scientific, London, England. 359 pp. |
| Alikhuni, K.H. 1966. Synopsis of biological data of common carp Cyprinus carpio (Linnaeus), 1758 (Asia and Far East). FAO Fisheries Synopsis No.31.1. FAO, Rome, Italy. 77 pp. |
| Bakos, J. & Gorda, S. 2001. Genetic resources of common carp at the Fish Culture Research Institute Szarvas, Hungary. FAO Fisheries Technical Paper No. 417. FAO, Rome, Italy. 106 pp. |
| Balon, E.K. 1995. Origin and domestication of the wild carp, Cyprinus carpio: from Roman gourmets to the swimming flowers. Aquaculture, 129:3-48. |
| Balon, E.K. 2004. About the oldest domesticates among fishes, and an epigenetic dichotomy in fish ontogenies and culture. In Proceedings of Nature and Culture: Comparative Biology and Interactions of Wild and Farmed Fish, 19-23 July 2004, London, England. The Fisheries Society of the British Isles, in association with the European Aquaculture Society. [in preparation] |
| Berinkey, L. 1966. Halak-Pisces. Fauna Hungariae 79. Akademiai Kiado, Budapest, Hungary. 136 pp. |
| Biro, P. 1995. Management of pond ecosystems and trophic webs. Aquaculture, 129:373-386. |
| Boyd, C.E. 1990. Water Quality in Ponds for Aquaculture. Birmingham Publishing Co. Birmingham, Alabama, USA. 482 pp. |
| Chen, L. 1990. Aquaculture in Taiwan. Fishing News Books, Blackwell Scientific Publications Ltd, UK. 273 pp. |
| De Silva, S. 2003. Carps. In: J.S. Lucas & P.C. Southgate (eds.), Aquaculture: farming aquatic animals and plants, pp. 276-294. Blackwell Publishing, Oxford, England. |
| EIFAC. 2001. Report of the Ad Hoc EIFAC/EC Working Party on Market Perspectives for European Freshwater Aquaculture, Brussels, Belgium, 14-16 May 2001. EIFAC Occasional Paper. No. 35. FAO, Rome, Italy. 136 pp. |
| FAO, 1995. Code of Conduct for Responsible Fisheries. FAO/UN, Rome, Italy. 41 pp. |
| Gupta, M.V., Mazid, M.A., Islam, M.S., Rahman, M. & Hussain, M.G. 1999. Integration of Aquaculture into the farming Systems of the Floodprone Ecosystems of Bangladesh: An Evaluation of Adoption and Impact. ICLARM Technical Report 56. 32 pp. |
| Hepher, B. 1978. Ecological aspects of warm water fishpond management. In: S.D. Gerging (ed.), Ecology of freshwater fish production. Blackwell Science Publishers, Oxford, England. pp. 447-468. |
| Hepher, B. & Pruginin, Y. 1981. Commercial Fish Farming. A Wiley-Interscience Publication, John Wiley & Sons, New York, USA. 261 pp. |
| Hoole, D., Bucke, D., Burgess, P. & Wellby, I. 2001. Diseases of Carp and other Cyprinid Fishes. Fishing News Books, Blackwell Science Ltd, UK. 264 pp. |
| Horvath, L. 1985. Egg development (oogenesis) in the common carp (Cyprinus carpio L.). In: J. Muir & R.J. Roberts (eds.), Recent advances in aquaculture. Volume 2. Croom Helm, London & Sidney, Westview Press, Boulder, Colorado. pp. 31-77. |
| Horvath, L. 1986. Carp oogenesis and the environment. In: R. Billard & J. Marcel (eds.), Aquaculture of Cyprinids, 2-6 September 1985, Evry, France. INRA, Paris, France. pp. 109-117. |
| Horvath, L., Tamas, G. & Seagrave, C. 1992. Carp and Pond Fish Culture. Fishing News Books, Blackwell Scientific Publications Ltd., UK, 154 pp. |
| Hulata, G. 1995. A review of genetic improvement of the common carp (Cyprinus carpio L.) and other cyprinids by crossbreeding, hybridization and selection. Aquaculture, 129:143-155. |
| Jeney, Zs. & Jeney, G. 1995. Recent achievements in studies on diseases of common carp (Cyprinus carpio L.). Aquaculture, 129:397-420. |
| Jhingran, V.G. 1982. Fish and Fisheries of India. Hindustan Publishing Corporation, Delhi, India. 665 pp. |
| Jhingran, V.G. & Pullin, R.S.V. 1985. A Hatchery Manual for the Common, Chinese and Indian Major Carps. ICLARM Studies and Reviews 11, ADB/ICLARM, Manila, Philippines. 191 pp. |
| Kestemont, P. 1995. Different systems of carp production and their impacts on the environment. Aquaculture, 129:347-372. |
| Kirpichnikov, V.S. 1999. Genetics and Breeding of Common Carp. Institute National De La Recherche Agronomique, CEDEX, Paris, France. 98 pp. |
| Komen, J.1990. Clones of common carp, Cyprinus carpio. Agriculturasl Univeristy of Wageningen, Netherlands. 169 pp. |
| Koblickaja, A.F. 1966. Opredelitel molodi rub delti Volgi. Izd. Nauka, Moscow, Russia. 167 pp. (in Russian) |
| Linhart, O., Shigeharu, K., Billard, R., Slechta, V. & Mikodina, E. 1995. Morphology, composition and fertilization of carp eggs: a review. Aquaculture, 129:75-93. |
| Little, D. & Muir, J. 1987. A Guide to Integrated Warm Water Aquaculture. Institute of Aquaculture, University of Stirling, Scotland. 230 pp. |
| Molnar, K. & Szakolczai, J. 1980. Halbetegsegek. Mezogazdasagi Kiado, Budapest, Hungary. 254 pp. (in Hungarian) [Fish diseases] |
| Pillay, T.V.R. 1990. Aquaculture Principles and Practices. Fishing News Books, Blackwell Scientific Publications Ltd, UK. 575 pp. |
| Peteri, A., Nandi, S. & Chowdury, N.S. 1992. Manual on seed production of carps. BGD/87/045/92/24 FAO Field Document. 59 pp. FAO, Rome, Italy. |
| Peteri, A. & Ruttkay, A. 1983. A takarmany mennyisegenek hatasa a ponty petefeszek-testsuly aranyanak es ikraproduciojanak alakulasara. Halaszat, 29:167-169. (in Hungarian) [Effect of feeding on the GSI and egg production of common carp] |
| Peterfy, M. 2001. Vakasztekbovites irdalassal, pacolassal, panirozassal keszitett pontytermekekkel. Halaszat, 94(4):143-146. (in Hungarian) [Different processing methods for increasing the variety of carp products] |
| Pinter, K. 1989. Magyarorszag halai. Akademia Kiado, Budapest, Hungary. 202 pp. (in Hungarian) [Fish species in Hungary] |
| Ruttkay, A. 1972. A pontyfelek zsirtartalmarol. Halaszat, 18:116-117. (in Hungarian) [The fat content of some Cyprinids] |
| Ruttkay, A. 1977. Nepesites, takarmanyozas, hozam. Halaszat, 23:16-24. (in Hungarian) [Stocking, feeding, production] |
| Ruttkay, A. 1978. Ivadek-utoneveles polikulturaban. Halaszat, 24:16-17. (in Hungarian) [Rearing of two summer old fish in polycultural systems] |
| Ruttkay, A. & Moravcsik, K. 1979. A polikultura es a zooplancton. Halaszat, 25:18-21. (in Hungarian) [The zooplankton in the polycultural ponds] |
| Ruttkay, A. 1987. Eros Pal togazdasagi koncepciojanak kritikai elemzese. Halaszat, 33:77-82. (in Hungarian) [Critics of the conception of Eros Pal on pond fish farming] |
| Ruttkay, A. 1988. Hogyan takarmanyozzuk a pontyot Magyarorszagon. Halaszat, 34:50-56. (in Hungarian) [The method of fish feeding in Hungary] |
| Ruttkay, A. 1990. A halak novekedese es taplalek-hasznositasa (I-III.). Halaszat, 36:46-49. 121-123. 149-152. (in Hungarian) [The growth and feed utilization of fish] |
| Ruttkay, A. 2000. Fish feeding research in Hungary-1895-1995. In I. Csengeri, A. Szito, Zs. Gy. Papp, & A. Tacon (eds.), Fish and Crustacean Nutrition Methodology and Research for Semi-intensive Pond-based Farming Systems. Fisheries Development Vol.23. Fish Culture Research Institute, Szarvas, Hungary. pp. 21-41. |
| Sarig, S. 1966. Synopsis of biological data of common carp Cyprinus carpio (Linnaeus), 1758 (Near East and Europe). FAO Fisheries Synopsis No.31.2. FAO, Rome, Italy. |
| Shirgur, G.A., Shingare, P.E. & Vipradas, K.C. 1988. On Optimum Rearing of Common carp (Cyprinus carpio) Fry into Fingerlings. In: V.R.P. Sinha & H.C. Srivastava (eds.), Proceedings of the Symposium on Aquaculture Productivity, 16-17 December 1988, New Delhi, India. Oxford & IBH Publishing Co. PVT.LTD, New Delhi, Bombay, Calcutta. pp. 413-428. |
| Sifa, L. 1986. Reservoir fish culture in China. In: R. Billard, & J. Marcel (eds.) Aquaculture of Cyprinids, 2-6 September 1985, Evry, France. INRA, Paris, France. pp. 347-356. |
| Sinha, M. 1990. Polyculture of Indian and Exotic Carps-A Techno-economic Appraisal. In: V.V. Sugunan, and U. Bhaumik (eds.), Technologies for Inland Fisheries Development. Central Inland Capture Fisheries Research Institute, Barrackpore, India. pp. 47-59. |
| Sinha, V.R.P. 1986. Integrated carp farming in Asian countries. In: R. Billard & J. Marcel (eds.), Aquaculture of Cyprinids, 2-6 September 1985, Evry, France. INRA, Paris, France. pp. 377-390. |
| Suzuki, R. 1979. The Culture of Common Carp in Japan. In: T.V.R. Pillay & Wm. A. Dill (eds.), Advances in Aquaculture, FAO Technical Conference on Aquaculture, 26 May-2 June 1976, Kyoto, Japan. Fishing News Books Ltd, UK. pp. 161-166. |
| Suzuki, R.1986. Intensive carp rearing in Japan. In: R. Billard & J. Marcel (eds.) Aquaculture of Cyprinids, 2-6 September 1985, Evry, France. INRA, Paris, France. pp. 327-333. |
| Vallod, D. 1995. Carp processing and market analysis: a case study in France. In: R. Billard & G.A.E. Gall (eds.), The Proceedings of the Second Aquaculture-sponsored Symposium held in Budapest, Hungary, 6-9 September 1993. Aquaculture, 129:476-477. |
| Varadi, L. 1995. Equipment for the production and processing of carp. In: R. Billard & G.A.E. Gall (eds.), The Proceedings of the Second Aquaculture-sponsored Symposium held in Budapest, Hungary, 6-9 September 1993. Aquaculture, 129: 443-466. |
| Varadi, L., Gorda, S., Bakos, J. & Jeney, Z. 2002. Management of Broodstock and Quality Control of Fish Seed in Hungary. Naga, World Fish Center Quarterly 25(3&4):45-47. |
| Wohlfarth, G.W., Moav, R. & Hulata, G. 1983. A genotype-environment interaction for growth rate in the common carp, growing in intensively manured ponds. Aquaculture 33:187-195. |
| Wohlfarth, G.W. 1984. Common carp. In: I.L. Mason (ed), Evolution of domesticated animals, Longman, London and N.Y, USA. pp. 375-380. |
| Woynarovich, E. 1979. The Feasibility of Combining Animal Husbandry with Fish Farming, with special reference to Duck and Pig Production. In: T.V.R. Pillay & Wm.A. Dill (eds.), Advances in Aquaculture, FAO technical Conference on Aquaculture, 26 May-2 June 1976, Kyoto, Japan. Fishing News Books Ltd, UK. pp. 203-208. |
| Woynarovich, E. & Horvath, L. 1980. The artificial propagation of warm-water finfishes - a manual for extension. FAO Fisheries Technical Paper No. 201. FAO, Rome, Italy. 183 pp. |

