特性
生物学特征
食用牡蛎是一种双壳软体动物,壳椭圆形或梨形,表面粗糙,有鳞片。不规则壳有钩状缘,有微细状脉纹。壳的两片为不同形状,半圆形到圆形,不对称。左壳凹陷并固着在附着基上,右壳扁平,边缘更粗糙,位于左壳内,成盖。两壳片内表面光滑,通常珍珠色、白或蓝灰色,常有暗蓝区域。壳端由一个弹性韧带连接。无饺齿。大型中央肌依靠韧带拉动关闭壳片。壳灰白色,右壳片黄色或乳白色并具浅褐色或蓝色的放射条纹。壳包括一系列白层,成层状和凹陷。粗糙坚硬灰色壳中包含的肉色从乳白色到暗灰色,味道从咸味到无味,肉质从嫩到坚硬。食用牡蛎分布在从挪威沿岸到邻近摩洛哥的水域,经由地中海进入黑海。食用牡蛎可长到很大(大于20厘米)和很老(大于20年)。
图片库
 |
 |
食用牡蛎解剖图 |
有贻贝壳的管状网用于收集卵 |
 |
 |
用于悬浮牡蛎卵收集器的架子 |
使用铁架的牡蛎驳船用于收集卵和袋养 |
 |
 |
用于清洁租赁场所和清除敌害(海星)的拖把 |
牡蛎水压耙船 |
主要情况
历史背景
食用牡蛎是欧洲本地种类,成为人类食物已有多个世纪。罗马人建池塘储备和挑选牡蛎。17世纪在法国大西洋沿岸从岩石上收集牡蛎卵,分开并放在盐沼中的池塘里。盐沼活动衰退使养殖面积扩大促进了牡蛎养殖的发展。在18和19世纪,捕捞努力导致过度开发、无法补充以及破坏了欧洲的自然海底,还受到了极度寒冷冬天的影响。苗种供应的短缺促使管理者开发持续补充供应苗种的养殖办法。最后,“租赁场所”系统和人工卵收集器的开发以及系统地应用促进了该产业的发展。开始在潮间带利用木质卵收集器,随后通过在绳上排列的牡蛎壳和石板收集卵。然后在1865年,在法国西南部开发了石灰瓦技术(瓦用石灰和细砂涂层)和木盒养殖稚贝。涂层瓦在法国和荷兰成为收集卵的主要方式:6-10个月后用手移开卵,在盘中养殖或在潮下带杆上重新摆放。在地中海沿岸,从1900年开始利用粘在钢柱的牡蛎。开发了浅水(3-4米)养成设施,然后通过从传统牡蛎苗附着区(布列塔尼)转移卵来扩大牡蛎养殖。卵被单独粘在杆上,杆悬挂在建在贻贝租赁场所的架子上。1950年这一类型的养殖被葡萄牙巨牡蛎生产替代。
20世纪在2个领域发生了最明显的养殖变化:卵的收集和牡蛎种群发生的病害。卵收集技术在荷兰普遍从播撒鸟蛤壳(1904年)变为向水下播撒贻贝壳(1939年)。这个技术要求更少的劳力,使成本效率大大提高。从上世纪80年代起,在法国布列塔尼使用充塞贻贝壳的管状网并吊养也证明更成本有效。最近,孵化场开始生产无贝壳屑的食用牡蛎卵。
在病害方面,1920年大规模的死亡冲击了食用牡蛎种群。该种群后来恢复,但几个传统养殖区被巨牡蛎替代。随后,在70年代早期和80年代蔓延了两种疾病(折光马尔太病和包那米虫病),食用牡蛎产量在几乎所有欧洲传统养殖区急剧减少。尽管有新的管理办法和精养补充计划,但此后食用牡蛎产量不高。
20世纪在2个领域发生了最明显的养殖变化:卵的收集和牡蛎种群发生的病害。卵收集技术在荷兰普遍从播撒鸟蛤壳(1904年)变为向水下播撒贻贝壳(1939年)。这个技术要求更少的劳力,使成本效率大大提高。从上世纪80年代起,在法国布列塔尼使用充塞贻贝壳的管状网并吊养也证明更成本有效。最近,孵化场开始生产无贝壳屑的食用牡蛎卵。
在病害方面,1920年大规模的死亡冲击了食用牡蛎种群。该种群后来恢复,但几个传统养殖区被巨牡蛎替代。随后,在70年代早期和80年代蔓延了两种疾病(折光马尔太病和包那米虫病),食用牡蛎产量在几乎所有欧洲传统养殖区急剧减少。尽管有新的管理办法和精养补充计划,但此后食用牡蛎产量不高。
主要生产国

主要生产国(粮农组织渔业统计数据,2006年)
生境和生物学
食用牡蛎见于大西洋东北部的从挪威的西欧沿海到摩洛哥以及整个地中海盆地。在上世纪40和50年代的有意引入后,自然种群也见于从缅因到罗得岛的北美东部。
食用牡蛎是雄性先熟的雌雄同体,在一个季节一般变性两次。产卵早期的雄性牡蛎,到后期变为雌性,反之亦然。通常食用牡蛎在秋天附着后为雄性。食用牡蛎有一系列生理学种群,在欧洲沿岸显示遗传差异。最低温度种群之一的分布在西班牙,要求产卵温度为12-13°C,而挪威海湾的产卵温度为25°C。在法国,10°C时配子形成,在14和16°C之间产卵。从外套腔(在此与体外排出的精液受精)排出雌配偶子。与大型的长巨牡蛎繁殖努力相反,食用牡蛎每次产卵为50万和100万个。取决于温度,在8-10天的孵化期后,最后投放到外界环境中。然后幼虫(规格为160 µm) 在附着前有8到10天的浮游期。在低于20‰的盐度可得到合适的幼虫生长率和成活率,尽管其可在低于15‰的盐度中存活。
食用牡蛎是雄性先熟的雌雄同体,在一个季节一般变性两次。产卵早期的雄性牡蛎,到后期变为雌性,反之亦然。通常食用牡蛎在秋天附着后为雄性。食用牡蛎有一系列生理学种群,在欧洲沿岸显示遗传差异。最低温度种群之一的分布在西班牙,要求产卵温度为12-13°C,而挪威海湾的产卵温度为25°C。在法国,10°C时配子形成,在14和16°C之间产卵。从外套腔(在此与体外排出的精液受精)排出雌配偶子。与大型的长巨牡蛎繁殖努力相反,食用牡蛎每次产卵为50万和100万个。取决于温度,在8-10天的孵化期后,最后投放到外界环境中。然后幼虫(规格为160 µm) 在附着前有8到10天的浮游期。在低于20‰的盐度可得到合适的幼虫生长率和成活率,尽管其可在低于15‰的盐度中存活。
生产
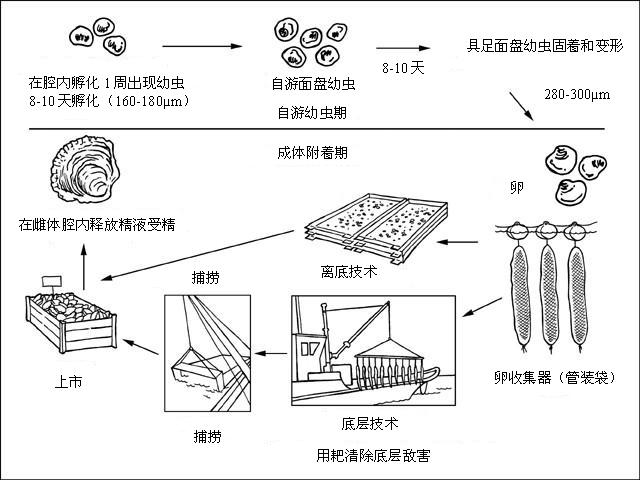
通过野生卵或孵化生产(无贝壳屑苗)得到幼体。目前,多数野生卵来自自然繁殖区域,而孵化生产大多以没有自然苗供应的区域为重点。但海底资源衰竭和病害(包那米虫)的影响促使孵化行业努力开发抗病品系。
亲体
通过提高海水温度和提供额外(随意)饵料(浮游植物)使食用牡蛎性成熟和繁殖。调节基于模仿自然繁殖周期和环境条件。与传统的孵化场培育的种类(例如长巨牡蛎或菲律宾蛤仔)相比,该种类体外受精依然困难,导致极低的成活率。因而到目前为止,依然要求孵化阶段。同步成熟和刺激产卵也在技术上是困难的。热压刺激产卵不能达到完全的性同步发育。尽管使用化学品(血清素)促进了繁殖调节,但该技术不能常规使用。因此开发了两项技术。一是基于整批牡蛎成熟的大规模产卵。这既不要求评价单个亲体对世代的贡献,也不控制杂交繁育。二是要求通过每个水池2个牡蛎然后收集产出苗的控制繁育(完全同种)技术。所有限制显示在孵化场一级尚没有完全控制整个繁殖过程。
孵化场生产
孵化场培育要求生产合适的微藻作为食物。通常,浮游植物种类为鞭毛藻和硅藻,提供很平衡的食物,因此促进配子和幼虫发育。食物的量取决于幼虫密度。由于尚未开发出抗病品系,孵化场生产的量不大。
自然卵采集
多数食用牡蛎养殖依然基于利用卵收集器获得野生幼苗。卵收集器可以是6-7月撒播(18°C)的贻贝壳,密度大多为30-60立方米/公顷(荷兰)或充塞贻贝壳的管状网(每个含约600个贻贝壳)并离开海底吊放(法国)。后一种情况,在浅水水域(3-6米深)将网吊在钢架上。由于养殖者使用煮过的贻贝壳作为卵收集器,这些壳将自然分解,不需要更多的工作。通常,一个钢架可以支撑约120个管状网,单产为70到75公斤的卵/年。最近,为此目的在潮间带使用了石灰覆盖的PVC器具。使用这个技术的主要好处是能够用自动设备从收集器上取下卵,因此降低了运行成本。
尽管贝有保护壳,但如果在筛选和分级处理时不小心将损害壳。因此需要通过过滤从调节水池流出的海水收集在柱上附着的牡蛎。然后按传统技术进行微藻培育和育苗阶段养殖。包括使用尼龙筛制成的微藻培育盘和频繁进行水交换的流水循环系统(例如底下水,向下和向上流动)。无论何时将卵从水中移出,都要小心保证不干或不过热。在达到5-6毫米规格时(用4毫米筛眼的筛),用篮将卵转移到开阔水域养成。
生产食用牡蛎有两类主要生产技术:吊养和底养。
吊养技术
包括浮盘或筏、延绳垂下、悬浮绳、吊在筏子上的灯笼网或塑料蓝、潮间带的脚手架和牡蛎袋。在西班牙,贻贝养殖使用的浮筏也用来养牡蛎。该项技术包括手工将中等规格的牡蛎(5厘米)用粘合剂附着在绳上。工人将绳吊在筏子上并定期清除海藻和贻贝苗。最近,在筏子上悬挂塑料篮。 随着牡蛎的生长将其分散养殖。
底养技术
由船直接将牡蛎卵重新放置在潮下底层场所,密度为50-100公斤/公顷,在法国比长巨牡蛎的密度低5-10倍。5月-6月投苗的普通规格为1厘米,约1年龄。用手工铲放置牡蛎目前由传送带或用海水卵冲洗器来完成。传统管理方式包括用棉网收集海星敌害以及带齿钢架在租赁场所拖拉。深水养殖最大生长率由于发生包那米虫病,使3-4年龄的牡蛎成活率急剧下降。因此,在发生病害导致的死亡前用耙网捕捞2年龄的牡蛎(60-80克)。尽管早捕,成活率依然低,在3年的养殖期后约为5%。
在缅因州(美国),在浮盘上养殖牡蛎直到在秋末达到35-50毫米。用吃海草的玉黍螺生物控制污垢。然后将牡蛎转移到租赁场所养到上市规格。开发有效控制敌害的办法来对付海星和蟹是底养的主要问题。
由于多数食用牡蛎是养殖在潮下带并为避免病害进行粗养,通常用约3.5-4米宽和2米深的有 3-5厘米齿片的两个钢质耙网捕捞牡蛎,用水压或气绞盘操作。 在潮间带使用脚手架,养殖者将袋子运往包装室进行分类、分级和再投放。
在牡蛎达到上市规格时,销售前养殖者将牡蛎分级并暂存在清洁水中。在法国,根据牡蛎规格(0到5级)销售。根据欧盟规定,运输牡蛎普遍使用冷藏卡车。在西班牙,与其他贝类鲜销一样,牡蛎也必须净化。将牡蛎放入容器,再放入水已经氯消毒的净化池中。最大允许净化量为30公斤/平方米,净化时间至少42小时。将牡蛎放在冰上冷藏上市。销售期间,在 3-10 °C保存。
尽管高度变化,根据养殖场所特征和成活率,生产成本高。主要是由于该种类的病害和非常低的成活率促使养殖者减少生产,还由于养殖周期的长度。养殖食用牡蛎为粗放类型,有时与长巨牡蛎混养以减少病害影响;这增加了分类的工作量。在深海养殖使用专门网具需要投资。筏养是劳力密集性的,要求考虑生产过程中准备和清洁生产单元的时间。与使用水压网具和耙网的深水养殖相比,筏养一般要求手工操作。
预防措施
在贝类规则方面,根据 OIE国际水生动物健康守则规定的须申报的病原体清单(须申报病原体),预防措施的目标是只进口没有疾病爆发的国家的产品。上表所列的3种寄生虫是须申报的病原体,因此要限制将食用牡蛎从有病的区域转移到无病区。软体动物应当只从这类国家进口:至少前2年没有被这些病原体引起疾病爆发;按照OIE的程序进行官员监视计划期间测试的软体动物上至少两年没有发现寄生虫。此外,欧洲动物卫生指示强制实施分区系统,来限制这些疾病的扩散。因此,监测食用牡蛎种群和寄生虫对预防和限制相关的危害至关重要。在没有治疗的情况下,采取预防措施来限制病害影响,大多是有关管理操作的,包括场所选择和降低密度。
供病理学专业知识的单位
以下是几个可以提供专业技术知识的单位:
生产周期

生产周期
生产系统
苗种供应
通过野生卵或孵化生产(无贝壳屑苗)得到幼体。目前,多数野生卵来自自然繁殖区域,而孵化生产大多以没有自然苗供应的区域为重点。但海底资源衰竭和病害(包那米虫)的影响促使孵化行业努力开发抗病品系。
亲体
通过提高海水温度和提供额外(随意)饵料(浮游植物)使食用牡蛎性成熟和繁殖。调节基于模仿自然繁殖周期和环境条件。与传统的孵化场培育的种类(例如长巨牡蛎或菲律宾蛤仔)相比,该种类体外受精依然困难,导致极低的成活率。因而到目前为止,依然要求孵化阶段。同步成熟和刺激产卵也在技术上是困难的。热压刺激产卵不能达到完全的性同步发育。尽管使用化学品(血清素)促进了繁殖调节,但该技术不能常规使用。因此开发了两项技术。一是基于整批牡蛎成熟的大规模产卵。这既不要求评价单个亲体对世代的贡献,也不控制杂交繁育。二是要求通过每个水池2个牡蛎然后收集产出苗的控制繁育(完全同种)技术。所有限制显示在孵化场一级尚没有完全控制整个繁殖过程。
孵化场生产
孵化场培育要求生产合适的微藻作为食物。通常,浮游植物种类为鞭毛藻和硅藻,提供很平衡的食物,因此促进配子和幼虫发育。食物的量取决于幼虫密度。由于尚未开发出抗病品系,孵化场生产的量不大。
自然卵采集
多数食用牡蛎养殖依然基于利用卵收集器获得野生幼苗。卵收集器可以是6-7月撒播(18°C)的贻贝壳,密度大多为30-60立方米/公顷(荷兰)或充塞贻贝壳的管状网(每个含约600个贻贝壳)并离开海底吊放(法国)。后一种情况,在浅水水域(3-6米深)将网吊在钢架上。由于养殖者使用煮过的贻贝壳作为卵收集器,这些壳将自然分解,不需要更多的工作。通常,一个钢架可以支撑约120个管状网,单产为70到75公斤的卵/年。最近,为此目的在潮间带使用了石灰覆盖的PVC器具。使用这个技术的主要好处是能够用自动设备从收集器上取下卵,因此降低了运行成本。
育苗
尽管贝有保护壳,但如果在筛选和分级处理时不小心将损害壳。因此需要通过过滤从调节水池流出的海水收集在柱上附着的牡蛎。然后按传统技术进行微藻培育和育苗阶段养殖。包括使用尼龙筛制成的微藻培育盘和频繁进行水交换的流水循环系统(例如底下水,向下和向上流动)。无论何时将卵从水中移出,都要小心保证不干或不过热。在达到5-6毫米规格时(用4毫米筛眼的筛),用篮将卵转移到开阔水域养成。
养成技术
生产食用牡蛎有两类主要生产技术:吊养和底养。
吊养技术
包括浮盘或筏、延绳垂下、悬浮绳、吊在筏子上的灯笼网或塑料蓝、潮间带的脚手架和牡蛎袋。在西班牙,贻贝养殖使用的浮筏也用来养牡蛎。该项技术包括手工将中等规格的牡蛎(5厘米)用粘合剂附着在绳上。工人将绳吊在筏子上并定期清除海藻和贻贝苗。最近,在筏子上悬挂塑料篮。 随着牡蛎的生长将其分散养殖。
底养技术
由船直接将牡蛎卵重新放置在潮下底层场所,密度为50-100公斤/公顷,在法国比长巨牡蛎的密度低5-10倍。5月-6月投苗的普通规格为1厘米,约1年龄。用手工铲放置牡蛎目前由传送带或用海水卵冲洗器来完成。传统管理方式包括用棉网收集海星敌害以及带齿钢架在租赁场所拖拉。深水养殖最大生长率由于发生包那米虫病,使3-4年龄的牡蛎成活率急剧下降。因此,在发生病害导致的死亡前用耙网捕捞2年龄的牡蛎(60-80克)。尽管早捕,成活率依然低,在3年的养殖期后约为5%。
在缅因州(美国),在浮盘上养殖牡蛎直到在秋末达到35-50毫米。用吃海草的玉黍螺生物控制污垢。然后将牡蛎转移到租赁场所养到上市规格。开发有效控制敌害的办法来对付海星和蟹是底养的主要问题。
捕捞技术
由于多数食用牡蛎是养殖在潮下带并为避免病害进行粗养,通常用约3.5-4米宽和2米深的有 3-5厘米齿片的两个钢质耙网捕捞牡蛎,用水压或气绞盘操作。 在潮间带使用脚手架,养殖者将袋子运往包装室进行分类、分级和再投放。
处理和加工
在牡蛎达到上市规格时,销售前养殖者将牡蛎分级并暂存在清洁水中。在法国,根据牡蛎规格(0到5级)销售。根据欧盟规定,运输牡蛎普遍使用冷藏卡车。在西班牙,与其他贝类鲜销一样,牡蛎也必须净化。将牡蛎放入容器,再放入水已经氯消毒的净化池中。最大允许净化量为30公斤/平方米,净化时间至少42小时。将牡蛎放在冰上冷藏上市。销售期间,在 3-10 °C保存。
生产成本
尽管高度变化,根据养殖场所特征和成活率,生产成本高。主要是由于该种类的病害和非常低的成活率促使养殖者减少生产,还由于养殖周期的长度。养殖食用牡蛎为粗放类型,有时与长巨牡蛎混养以减少病害影响;这增加了分类的工作量。在深海养殖使用专门网具需要投资。筏养是劳力密集性的,要求考虑生产过程中准备和清洁生产单元的时间。与使用水压网具和耙网的深水养殖相比,筏养一般要求手工操作。
病害和控制措施
| 疾病 | 致病因子 | 类型 | 综合病症 | 措施 |
| 疱疹状感染 | 类疱疹病毒 (OHSV-1) | 病毒 | 未观察到对群体有直接影响 | 无治疗措施;保证良好选择场地和管理操作来限制影响和牡蛎运送的强制监测;分区系统 |
| 贝壳病 | 绞扭伤壳菌 | 真菌 | 有限影响但壳内侧黑色畸形可能阻止发育并最终致命 | |
| 包那米虫病 | 包那米虫 | 原生动物 | 多数感染的牡蛎不显示明显症状;但有时感染伴随黄色污点和大范围鳃和外套膜损坏;在牡蛎2-3龄时成为系统和通常致命疾病 | |
| 马尔太病 | 折光马尔太虫 | 原生动物 | 消化腺上皮变色;停止生长;失去组织条件;肝糖储量减少;可能复发致命 | |
| 登曼岛病 | 闭合孢子虫 | 原生动物 | 绿色到黄色脓包或脓肿状损坏(小于5毫米),由血细胞渗透和坏疽产生,出现在体内壁、唇瓣或外套膜或内收肌表面;常在邻近外套膜表面导致褐色疤痕;寄生虫可导致再次发病,年长的牡蛎死亡率异常 |
预防措施
在贝类规则方面,根据 OIE国际水生动物健康守则规定的须申报的病原体清单(须申报病原体),预防措施的目标是只进口没有疾病爆发的国家的产品。上表所列的3种寄生虫是须申报的病原体,因此要限制将食用牡蛎从有病的区域转移到无病区。软体动物应当只从这类国家进口:至少前2年没有被这些病原体引起疾病爆发;按照OIE的程序进行官员监视计划期间测试的软体动物上至少两年没有发现寄生虫。此外,欧洲动物卫生指示强制实施分区系统,来限制这些疾病的扩散。因此,监测食用牡蛎种群和寄生虫对预防和限制相关的危害至关重要。在没有治疗的情况下,采取预防措施来限制病害影响,大多是有关管理操作的,包括场所选择和降低密度。
供病理学专业知识的单位
以下是几个可以提供专业技术知识的单位:
- 欧洲贝类动物卫生参考实验室(OIE 马尔太和包那米虫病参考实验室), IFREMER La Tremblade, BP 133, 17390 La Tremblade, 法国。
- 渔业和海洋部太平洋生物站,加拿大BC纳奈莫V9R 5K6。
- 西班牙Instituto de Investigaciones Marinas Consejo Sup. de Invest. Cie., Eduardo Capelo 6, 36208 Vigo。
- 英国CEFAS, Weymouth实验室,Barrack Road, The Nothe, Weymouth Dorset, DT4 8UB。
- 荷兰CIDC Lelystad, 动物病害控制所, PO Box 2004, 8203 AA Lelystad。
统计
生产
全球养殖产量
粮农组织渔业统计
粮农组织渔业统计
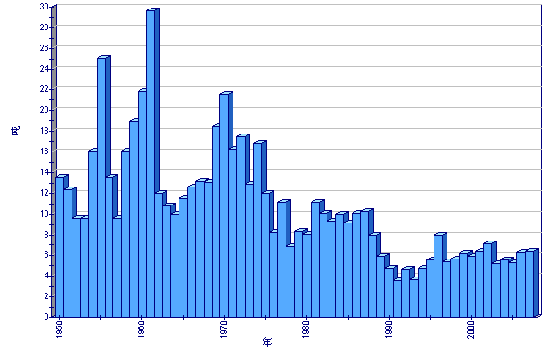
市场和贸易
食用牡蛎在传统上被新鲜和放在半壳上消费。牡蛎被运往当地市场或销售到超市和餐馆。由于供应量下降,平均价格急剧上涨。尽管有很大波动,取决于规格和当地可得性,在法国的传统市场价格已经达到创记录的高价位(13美元/公斤)。食用牡蛎平均批发价格通常高出便宜的长巨牡蛎3-5倍。因此, 产品现在占据经济上的小环境,被认为是奢侈的海产品-专门消费者的昂贵美味。