特性
生物学特征
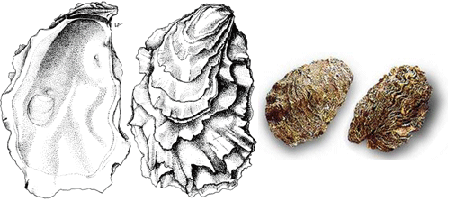
牡蛎壳坚硬,两片壳不等瓣,壳表面极为粗糙,普遍有凹槽,层状;左(下)壳深陷,有时两边几乎为垂直面,右(上)壳扁平或略凸起,置于左壳内;两侧不等 边,喙和壳嘴往往生得太大;外形趋于长圆形并通常是扭曲的,而且非常不规则。环境造成外壳形状的差异。颜色一般呈白色,还有许多紫色条纹和斑纹从壳嘴部向 外放射。壳内呈白色,只有一个有时为深色,但不会是紫色或黑色的肌痕。
主要情况
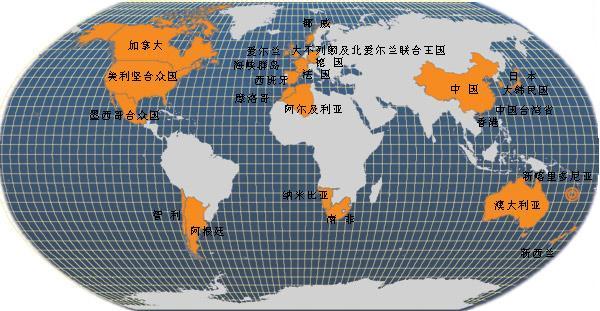
除了地图中所显示的国家之外,以下国家亦有引种记录:
历史背景
鉴于长巨牡蛎有快速生长的潜力,而且对环境条件具有广泛的耐受能力,因此该品种已经成为世界许多地区首选的牡蛎养殖品种。尽管其原产地是日本,在那里已经 养殖了几百年,但是它已被世界其他地方广泛引进,最明显的是自1920年代起进入美国西部沿海地区,并于1966年开始进入法国。[为进行养殖评估,本情 况介绍的参考书目一节提供了已知引进活动清单。] 引进长巨牡蛎的目的是替代因过度捕捞或疾病而严重耗竭的本地牡蛎种群,或者是为了创建一个过去不存在的产业。引进清单有可能不完整,或许未包括通过全球运 输活动而意外引进的情况,即船舶压舱水中所含幼体或附着在船体上的成年牡蛎。还存在着各国之间广泛、小规模、无记载的二次引进活动。依靠野生捕获的苗种和 在生产区进行转播的传统粗放养殖方式已经发展为包括悬浮(吊漂养殖)和离底养殖在内的一系列方法,利用野生和育苗场培育的苗种。最新发展情况包括育苗场三 倍体苗种的生产和选择计划。这类选择计划的重点是生产适应特殊条件的生长快、质量高的苗种种群。
主要生产国

主要生产国(粮农组织渔业统计数据,2006年)
除了地图中所显示的国家之外,以下国家亦有引种记录:
- 厄瓜多尔、伯利兹、哥斯达黎加、波多黎各、美属维尔京群岛和巴西。
- 以色列、菲律宾和马来西亚。
- 罗马尼亚和乌克兰。
- 塞舌尔。
- 斐济、法属玻利尼西亚、关岛、帕劳、萨摩亚和瓦努阿图。
生境和生物学
长巨牡蛎属于河口种类,喜好坚实的底部基质,附着在岩石、残片和贝壳上,从下游的潮间带到40米深的水域都有分布。然而,在泥质和泥沙质的水底也会发现这 类牡蛎。虽然该种类能够在盐度低于10‰或高于35‰的条件下生存(但不会繁殖),但是最佳盐度范围应在20-25‰。它还对温度具有广泛的耐受性,即 –1.8到35 °C。长巨牡蛎是雄性先熟的雌雄同体。在饲料供应良好的地区,较成熟牡蛎中的雌雄比例显示雌性占主导地位,而在食物供应量较低的地区,情况则相反。当食物 供应有限时(例如它们在过分拥挤的情况下),雌性便会转变为雄性。当温度达到约10 °C,盐度在15-32‰之间时,配子开始形成,而在更高盐度条件下,配子发育则很少能够完成。产卵通常需要温度在20 °C以上,很少在15–18 °C。该品种非常多产,8–15 cm的雌性一次可产卵5 000万至2亿枚。幼虫以浮游生物为食物,分布在整个水体中。在胚壳的第I阶段,它们的壳长70 µm – 继早期胚胎发育后 – 利用后足到水体外爬行,寻找适宜的定居地,以便在达到300–340 µm时附着。这一过程可能需要2-3周时间,取决于水温、盐度和食物供应。在此期间它们会随水流分散到广泛的区域。如其他牡蛎品种那样,成熟的长巨牡蛎幼 虫利用其足腺分泌的粘液,永久性地附着在选定的基质上。一旦固着,它们就会变态成为幼贝。在良好的条件下,其生长速度非常快;在18-30个月内便可达到 上市规格。
生产
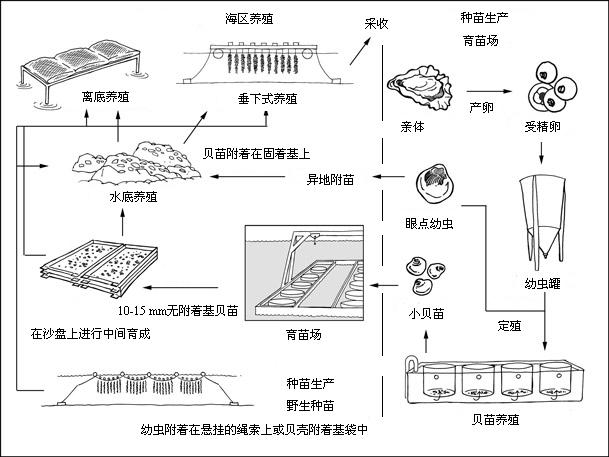
生产周期

生产周期
生产系统
生产长巨牡蛎所采用的方法很多,取决于种苗供应来源、不同地区的环境条件和销售产品的类型(即用于半壳牡蛎贸易或提取牡蛎肉)。下面强调说明各种方法的差别,重点是来自育苗场的苗种供应。
在天然贝苗供应充足且可靠的地方,牡蛎养殖者在野生环境安装采集器,确保各自的苗种供应,而不依赖育苗场。全球贝苗供应的大部分为野生采集的苗种,采集方法包括在长线和浮筏上吊挂的各种固着材料。然而,其它商业化养殖单位则经营育苗场,现介绍如下:
亲体
育苗场采用的亲体通常来自商业养殖单位私营的海水养成设施,而且取自最佳条件下养殖的精选种群。鉴于成贝的性别无法确定,因此需要从冬季一直到自然产卵季 节定期采集成贝群。将它们单独放入流水式水槽中暂养,在所使用的海水补充了养殖海藻,水温在20–22 °C,盐度保持在25–32‰范围内。在冬季月份中,如果成贝性发育低下,配子的初步形成和成熟需要大约六周的孵化培育。随着产卵季节临近和自然海水温度 上升,所需的时间逐渐缩短。含有成熟配子的成贝可以采用热冲击方法产卵,但是最常见的是将它们打开,采用巴氏吸管使配子从性腺“脱离”,这是一个能确保取 得良好结果的程序。活重为70–100 g的成熟雌贝将能生产超过5 000–8 000万枚卵。出于生产目的,通过从相同数量雄贝采集的少量精液样本使六个或更多雌贝所产的卵受精。从受精卵发育成带壳的前双壳Ⅰ期(D形幼虫)阶段都是 在大容量水槽中进行,水槽中灌注的海水经过严格过滤,而且往往经过紫外线处理,水温为25–28 °C,盐度在25–32‰之间。在早期发育阶段,水槽不充气,不添加食物,持续时间大约24小时。全球大部分育苗场目前均将三倍体的生产作为重点。倍性操 作(通常采用温度冲击)通常在受精后不久进行,尽管最新的趋势是将四倍体与二倍体杂交,这样可确保获得100%的三倍体后代。
幼虫和后期幼虫养殖
幼虫可在静水或流水水槽系 统中生长至浮游面盘幼虫期,在25–28 °C水温条件下这一阶段可持续14-18天。最佳盐度在20-25‰之间。最初的养殖密度大约为20 000个D形幼虫/升,而随着发育而出现自然死亡和换水时进行筛选分级,这一密度降至5 000个/升。在静水水槽系统中,选择性分级每周进行3次或4次。其目的是随着附着和变态阶段的临近,只保留生长较快、更健康的幼虫。幼虫的饲料是养殖藻 类。早期面盘幼虫(壳长<120 µm)每日采用定量的等鞭金藻(Isochrysis galbana )或巴夫藻( Pavlova lutherii ),加上诸如钙质角毛藻(Chaetoceros calcitrans )或海链藻(Thalassiosira pseudonana )的小矽藻进行投喂。后期幼虫的饲料包括相同种类并辅以一种或多种较大型绿色鞭毛藻(Tetraselmis )。 当幼虫准备附着时便开始出现有色“眼点”,可以通过透明壳瓣清楚地看到。在此阶段还生出一只足。此时将附着基质放入水槽,供幼虫寻找并附着。可以使用略微 粗糙的黑色PVC薄膜、有凹槽的PVC管子、贝壳或壳屑等作为附着基的表面材料。另一种方法是将成熟幼虫装好并运到牡蛎养殖者那里自行附着并养至上市规 格。这些地点往往远离育苗场。这后一种做法是北美太平洋沿岸选用的方法,该过程被称为远距离附着。
在世界许多其他地方,在育苗场附着和生长的幼贝(稚贝)在育苗设施严格管理的条件下长到几毫米(3–5 mm之间)。该生产阶段通常是在大型水槽系统中完成的,每天进行部分换水,在这一系统中幼贝作为流动层被暂养于培养容器中,该过程被称为上升流养殖。不断 投喂来自育苗场养殖的,或来自附近室外水槽或池塘中繁殖的高营养价值藻类促进了稚贝的迅速生长。一旦达到所需的规格,稚贝便被运往育苗场自己的室外育苗系 统或包装并出售给牡蛎养殖者。
育苗场频繁开展海上或陆上中间培育场养殖作业,在那里贝苗从1 mm长至15 mm。在高产地区,密度可以达到100 kg/m³ 水流。采用这种方法来降低小贝苗的死亡率,因为如果直接将贝苗转入海水养成,小贝苗就有可能死亡。海上中间培育场一般采用上升流系统,安装在驳船或筏子 上,处于较温暖和生产力更强的河口环境。这种防护设施最大限度地减少了因捕食行为造成的损失。上升流方法还被广泛用于陆基中间培育场,可以将设备安装在咸 水塘中的驳船上,或安装在陆上水槽系统中并使用从池塘中抽取的含有丰富藻类的水。池塘或许具有自身生产力或采用人工或天然肥料进行强化。就异地附着而言, 稚贝附着在袋装的贝壳附着基、成串贝壳或塑料材料上,供幼虫附着的水槽也被用来进行数天或更长时间的稚贝暂养。在某种保护性养殖中(或潮间采用网眼或帆布 罩,或潮线下采用筏子或吊养),上述工作是在放置附着基之前进行的,其目的是尽可能减少捕食损失。野生环境采集的稚贝采用类似处理方法。
在使用施肥池塘供水的上升流中间培育场中,用于养成的10–15 mm苗种的产量可以达到3吨/公顷。
养成阶段几乎全部在海水中完成。根据不同的环境(如潮汐带、掩蔽处、租赁水域的水深、海湾和河口的水交换率、基质的种类等)和传统,所使用的方法很多,包括水底、离底和垂下式养殖。
水温在15–25 °C以及盐度在25和32之间时生长率较快。天然浮游植物饲料供应的补充率是关键。长巨牡蛎需要18-30个月达到70–100 g活重(带壳)的上市规格。面积覆盖数千公顷广泛水域被用来开展包括种苗采集在内的养成阶段的所有活动,育苗和生长阶段,以及收获前牡蛎的硬化,该水域的 产量可以达到25吨/公顷/年。如果是宽阔、独立的小面积租赁水域,产量可以大大提高(>70吨/公顷/年)。
水底养殖
可将苗种播撒在事先用贝壳或石子铺垫 的较为坚实的潮间或潮下地面上,贝苗(1-2 g活重)密度为200–400个/m²,采用防掠食者的保护设备(围栏或网罩)。还可以在无防护装置的情况下采用~200/m²的密度播撒贝苗(10 g活重)。其目的是将播苗密度控制在适当水平,使牡蛎在达到上市规格之前无需进一步的管理。
离底养殖
选择较低的潮间带适宜的地面,将贝苗 装在网袋或不同类型的多孔塑料盘中,用绳索或橡皮圈固定在木框或钢筋支架上。这种系统有时位于潮下带,但是这会增加操作费用。离底养殖可被用于育苗的中间 阶段或作为将产品养至上市规格的一个方法。10–15 mm贝苗的播苗密度可为基地的每0.25 或 0.5 m²的托盘为1000–2000个,需要定期维护和维修,将牡蛎以较低的密度转移到干净的袋子/托盘,其网孔大小随牡蛎的成长而增加。在生产力比较高的地 区,一旦牡蛎生物量超过5 kg/m²托盘区时,生长速度明显减慢。
垂下式养殖
吊漂养殖采用长线(最常见的)或浮 筏悬吊的立体装置。这些装置可以是贝壳绳索或网线,供贝苗附着;它们也可以是一系列网子、网袋或塑料托盘,每袋或每盘的养殖密度与离底养殖方式相同。在沉 放养殖装置时,应注意选择污损生物较少的地点,而且在浅水区应避免接触水底。定期维护和维修是必要的,目的是将处于生长期的牡蛎以较低的密度转移到干净的 袋子/托盘,其网孔大小随牡蛎成长而增加。
漂浮式养殖
某些地区在贝苗生长的早期阶段使用带有网孔基座的木框托盘或带有漂浮环圈的多孔(聚苯乙烯泡沫)塑料托盘。上述装置的顶部需要使用帆布或密实的网状物覆盖以避光。
硬化
在垂下式养殖系统中生长的长巨牡蛎在收获前通常需要3-4个月的“硬化”期。硬化过程允许每天几次接触空气,通常发生在潮间带或潮夕带的浅水区。接触空气的牡蛎有着更高的含肉量,而且收获后的保质效果更好。
牡蛎通常在壳长达到>75 mm,活重在70–100+ g时便可收获。水底养殖的收获方式用手耙或手捡或在潮间带河床处于水下时用挖掘器挖捕。离底或盘式养殖或延绳垂下式养殖的牡蛎使用小型渔船或机动驳船进行 采收,如果产品是供应半壳产品贸易的,这些船只通常配备机械清洗和分级器。每年某些时间可能会出现有害藻类水花,所产生的麻痹性贝毒(PSP)、致泻性贝 毒(DSP)和其它神经毒素将会使收获中断。在牡蛎产卵后的2-3个月中通常不会进行采收,因为此时肉质不佳。
小规格牡蛎可以被作为特色“开胃食品”出售。它们的销售形式可以是带壳的鲜活产品,也可以是去壳的和冷冻加工产品、熏制和浸油的罐头、干牡蛎、提取的耗油或其它预制增值产品。
在没有粪大肠菌群的水体中生长的牡蛎仅需要进行最基本的加工。将它们洗净并按规格和形状分类,如果是底播养殖的牡蛎,可以将它们放入海水的流水式水箱中, 冲去外套腔中的泥沙。如果牡蛎受到粪大肠菌的侵染,将需要经它们放入装有紫外光或臭氧灭菌设备的循环系统,进行一段时间的净化。对于供应半壳产品市场的单 个牡蛎而言,包装时应将杯形壳至于下方以便保存外套膜的水分。如果包装得当而且置于冷藏条件下,产品的货架寿命可以达到7-10天。真空包装的增值半壳产 品在欧洲的销售取得了一定的成功,尽管大部分贸易量是鲜活产品。在其他许多国家,收获后的牡蛎被运到加工厂去壳以提取牡蛎肉、装瓶、装罐或冷冻,或被用来 制作耗油等预制产品。大部分国家对加工过程进行严格管理。
有关生产成本的信息很难获得,不仅仅是因为信息有所有权问题,而且还因为地点因素而导致使用的方法不同和所采用的技术水平差异很大。种苗供应通常占总成本 的大约20–25。在发展中国家,育苗场生产的3–4 mm 贝苗售价在10–15美元/1 000个,用于远距离附着的成熟幼虫的成本需要约2美元/百万个(不包括运输费用)。与供应半壳市场的产品生产相比,为牡蛎肉贸易养殖的产品劳动和设备的 集约化程度较低,而底层养殖比垂下式养殖(吊养)的成本要少。饲料并未被计算在成本里,因为一旦贝苗被转移到海水养殖地点,饲料便是一种免费资源。劳动力 是主要的重复性开支,而且一般是季节性的。
苗种供应
在天然贝苗供应充足且可靠的地方,牡蛎养殖者在野生环境安装采集器,确保各自的苗种供应,而不依赖育苗场。全球贝苗供应的大部分为野生采集的苗种,采集方法包括在长线和浮筏上吊挂的各种固着材料。然而,其它商业化养殖单位则经营育苗场,现介绍如下:
亲体
育苗场采用的亲体通常来自商业养殖单位私营的海水养成设施,而且取自最佳条件下养殖的精选种群。鉴于成贝的性别无法确定,因此需要从冬季一直到自然产卵季 节定期采集成贝群。将它们单独放入流水式水槽中暂养,在所使用的海水补充了养殖海藻,水温在20–22 °C,盐度保持在25–32‰范围内。在冬季月份中,如果成贝性发育低下,配子的初步形成和成熟需要大约六周的孵化培育。随着产卵季节临近和自然海水温度 上升,所需的时间逐渐缩短。含有成熟配子的成贝可以采用热冲击方法产卵,但是最常见的是将它们打开,采用巴氏吸管使配子从性腺“脱离”,这是一个能确保取 得良好结果的程序。活重为70–100 g的成熟雌贝将能生产超过5 000–8 000万枚卵。出于生产目的,通过从相同数量雄贝采集的少量精液样本使六个或更多雌贝所产的卵受精。从受精卵发育成带壳的前双壳Ⅰ期(D形幼虫)阶段都是 在大容量水槽中进行,水槽中灌注的海水经过严格过滤,而且往往经过紫外线处理,水温为25–28 °C,盐度在25–32‰之间。在早期发育阶段,水槽不充气,不添加食物,持续时间大约24小时。全球大部分育苗场目前均将三倍体的生产作为重点。倍性操 作(通常采用温度冲击)通常在受精后不久进行,尽管最新的趋势是将四倍体与二倍体杂交,这样可确保获得100%的三倍体后代。
幼虫和后期幼虫养殖
幼虫可在静水或流水水槽系 统中生长至浮游面盘幼虫期,在25–28 °C水温条件下这一阶段可持续14-18天。最佳盐度在20-25‰之间。最初的养殖密度大约为20 000个D形幼虫/升,而随着发育而出现自然死亡和换水时进行筛选分级,这一密度降至5 000个/升。在静水水槽系统中,选择性分级每周进行3次或4次。其目的是随着附着和变态阶段的临近,只保留生长较快、更健康的幼虫。幼虫的饲料是养殖藻 类。早期面盘幼虫(壳长<120 µm)每日采用定量的等鞭金藻(Isochrysis galbana )或巴夫藻( Pavlova lutherii ),加上诸如钙质角毛藻(Chaetoceros calcitrans )或海链藻(Thalassiosira pseudonana )的小矽藻进行投喂。后期幼虫的饲料包括相同种类并辅以一种或多种较大型绿色鞭毛藻(Tetraselmis )。 当幼虫准备附着时便开始出现有色“眼点”,可以通过透明壳瓣清楚地看到。在此阶段还生出一只足。此时将附着基质放入水槽,供幼虫寻找并附着。可以使用略微 粗糙的黑色PVC薄膜、有凹槽的PVC管子、贝壳或壳屑等作为附着基的表面材料。另一种方法是将成熟幼虫装好并运到牡蛎养殖者那里自行附着并养至上市规 格。这些地点往往远离育苗场。这后一种做法是北美太平洋沿岸选用的方法,该过程被称为远距离附着。
在世界许多其他地方,在育苗场附着和生长的幼贝(稚贝)在育苗设施严格管理的条件下长到几毫米(3–5 mm之间)。该生产阶段通常是在大型水槽系统中完成的,每天进行部分换水,在这一系统中幼贝作为流动层被暂养于培养容器中,该过程被称为上升流养殖。不断 投喂来自育苗场养殖的,或来自附近室外水槽或池塘中繁殖的高营养价值藻类促进了稚贝的迅速生长。一旦达到所需的规格,稚贝便被运往育苗场自己的室外育苗系 统或包装并出售给牡蛎养殖者。
育苗
育苗场频繁开展海上或陆上中间培育场养殖作业,在那里贝苗从1 mm长至15 mm。在高产地区,密度可以达到100 kg/m³ 水流。采用这种方法来降低小贝苗的死亡率,因为如果直接将贝苗转入海水养成,小贝苗就有可能死亡。海上中间培育场一般采用上升流系统,安装在驳船或筏子 上,处于较温暖和生产力更强的河口环境。这种防护设施最大限度地减少了因捕食行为造成的损失。上升流方法还被广泛用于陆基中间培育场,可以将设备安装在咸 水塘中的驳船上,或安装在陆上水槽系统中并使用从池塘中抽取的含有丰富藻类的水。池塘或许具有自身生产力或采用人工或天然肥料进行强化。就异地附着而言, 稚贝附着在袋装的贝壳附着基、成串贝壳或塑料材料上,供幼虫附着的水槽也被用来进行数天或更长时间的稚贝暂养。在某种保护性养殖中(或潮间采用网眼或帆布 罩,或潮线下采用筏子或吊养),上述工作是在放置附着基之前进行的,其目的是尽可能减少捕食损失。野生环境采集的稚贝采用类似处理方法。
在使用施肥池塘供水的上升流中间培育场中,用于养成的10–15 mm苗种的产量可以达到3吨/公顷。
养成技术
养成阶段几乎全部在海水中完成。根据不同的环境(如潮汐带、掩蔽处、租赁水域的水深、海湾和河口的水交换率、基质的种类等)和传统,所使用的方法很多,包括水底、离底和垂下式养殖。
水温在15–25 °C以及盐度在25和32之间时生长率较快。天然浮游植物饲料供应的补充率是关键。长巨牡蛎需要18-30个月达到70–100 g活重(带壳)的上市规格。面积覆盖数千公顷广泛水域被用来开展包括种苗采集在内的养成阶段的所有活动,育苗和生长阶段,以及收获前牡蛎的硬化,该水域的 产量可以达到25吨/公顷/年。如果是宽阔、独立的小面积租赁水域,产量可以大大提高(>70吨/公顷/年)。
水底养殖
可将苗种播撒在事先用贝壳或石子铺垫 的较为坚实的潮间或潮下地面上,贝苗(1-2 g活重)密度为200–400个/m²,采用防掠食者的保护设备(围栏或网罩)。还可以在无防护装置的情况下采用~200/m²的密度播撒贝苗(10 g活重)。其目的是将播苗密度控制在适当水平,使牡蛎在达到上市规格之前无需进一步的管理。
离底养殖
选择较低的潮间带适宜的地面,将贝苗 装在网袋或不同类型的多孔塑料盘中,用绳索或橡皮圈固定在木框或钢筋支架上。这种系统有时位于潮下带,但是这会增加操作费用。离底养殖可被用于育苗的中间 阶段或作为将产品养至上市规格的一个方法。10–15 mm贝苗的播苗密度可为基地的每0.25 或 0.5 m²的托盘为1000–2000个,需要定期维护和维修,将牡蛎以较低的密度转移到干净的袋子/托盘,其网孔大小随牡蛎的成长而增加。在生产力比较高的地 区,一旦牡蛎生物量超过5 kg/m²托盘区时,生长速度明显减慢。
垂下式养殖
吊漂养殖采用长线(最常见的)或浮 筏悬吊的立体装置。这些装置可以是贝壳绳索或网线,供贝苗附着;它们也可以是一系列网子、网袋或塑料托盘,每袋或每盘的养殖密度与离底养殖方式相同。在沉 放养殖装置时,应注意选择污损生物较少的地点,而且在浅水区应避免接触水底。定期维护和维修是必要的,目的是将处于生长期的牡蛎以较低的密度转移到干净的 袋子/托盘,其网孔大小随牡蛎成长而增加。
漂浮式养殖
某些地区在贝苗生长的早期阶段使用带有网孔基座的木框托盘或带有漂浮环圈的多孔(聚苯乙烯泡沫)塑料托盘。上述装置的顶部需要使用帆布或密实的网状物覆盖以避光。
硬化
在垂下式养殖系统中生长的长巨牡蛎在收获前通常需要3-4个月的“硬化”期。硬化过程允许每天几次接触空气,通常发生在潮间带或潮夕带的浅水区。接触空气的牡蛎有着更高的含肉量,而且收获后的保质效果更好。
处理和加工
牡蛎通常在壳长达到>75 mm,活重在70–100+ g时便可收获。水底养殖的收获方式用手耙或手捡或在潮间带河床处于水下时用挖掘器挖捕。离底或盘式养殖或延绳垂下式养殖的牡蛎使用小型渔船或机动驳船进行 采收,如果产品是供应半壳产品贸易的,这些船只通常配备机械清洗和分级器。每年某些时间可能会出现有害藻类水花,所产生的麻痹性贝毒(PSP)、致泻性贝 毒(DSP)和其它神经毒素将会使收获中断。在牡蛎产卵后的2-3个月中通常不会进行采收,因为此时肉质不佳。
生产成本
小规格牡蛎可以被作为特色“开胃食品”出售。它们的销售形式可以是带壳的鲜活产品,也可以是去壳的和冷冻加工产品、熏制和浸油的罐头、干牡蛎、提取的耗油或其它预制增值产品。
在没有粪大肠菌群的水体中生长的牡蛎仅需要进行最基本的加工。将它们洗净并按规格和形状分类,如果是底播养殖的牡蛎,可以将它们放入海水的流水式水箱中, 冲去外套腔中的泥沙。如果牡蛎受到粪大肠菌的侵染,将需要经它们放入装有紫外光或臭氧灭菌设备的循环系统,进行一段时间的净化。对于供应半壳产品市场的单 个牡蛎而言,包装时应将杯形壳至于下方以便保存外套膜的水分。如果包装得当而且置于冷藏条件下,产品的货架寿命可以达到7-10天。真空包装的增值半壳产 品在欧洲的销售取得了一定的成功,尽管大部分贸易量是鲜活产品。在其他许多国家,收获后的牡蛎被运到加工厂去壳以提取牡蛎肉、装瓶、装罐或冷冻,或被用来 制作耗油等预制产品。大部分国家对加工过程进行严格管理。
生产成本
有关生产成本的信息很难获得,不仅仅是因为信息有所有权问题,而且还因为地点因素而导致使用的方法不同和所采用的技术水平差异很大。种苗供应通常占总成本 的大约20–25。在发展中国家,育苗场生产的3–4 mm 贝苗售价在10–15美元/1 000个,用于远距离附着的成熟幼虫的成本需要约2美元/百万个(不包括运输费用)。与供应半壳市场的产品生产相比,为牡蛎肉贸易养殖的产品劳动和设备的 集约化程度较低,而底层养殖比垂下式养殖(吊养)的成本要少。饲料并未被计算在成本里,因为一旦贝苗被转移到海水养殖地点,饲料便是一种免费资源。劳动力 是主要的重复性开支,而且一般是季节性的。
病害和控制措施
与其它具有商业重要性的牡蛎品种相比,而且除了其在世界范围的广泛分布,长巨牡蛎方面很少有重大疾病问题的报告。令人比较关注的是发生在美国太平洋沿岸和 法国的“夏季死亡”事件,此病似乎与在暖水产卵后生理应激反应有关,此时牡蛎密度很高。据信,本地双壳贝类中发生的灾难性疫病的病原体并不是长巨牡蛎带入 的。然而,当它们被运往一些国家进行直接海水转播时,无意间伴随而入的是若干有害生物和寄生虫,其中包括日本荔枝螺(Ceratostoma inornatum )、牡蛎扁虫(Pseudostylochus ostreophagus )和东方贻贝蚤(Mytilicola orientalis )。在育苗场中,幼虫和早期稚贝的细菌疾病并不少见,而且大多都由弧菌(Vibrio spp.)引起。在这方面,长巨牡蛎(C. gigas )的幼虫同样容易遭受与其它双壳贝类幼虫同样大量死亡的厄运。
下表概述了所观测到的疾病和寄生虫。
在某些情况下,抗生素和其它药物被用于治疗,但将它们列入本表并不意味着是粮农组织的建议。
下表概述了所观测到的疾病和寄生虫。
在某些情况下,抗生素和其它药物被用于治疗,但将它们列入本表并不意味着是粮农组织的建议。
| 疾病 | 致病因子 | 类型 | 综合病症 | 措施 |
| 登曼岛病 | 闭合孢子虫病或小囊虫病 | 原生动物寄生虫 | – | 有限改进养殖方式 |
| 诺卡氏菌病 | 诺卡氏菌 | 细菌 | – | 改进养殖方式 |
| 长巨牡蛎(C. gigas)幼虫疱疹病毒病 | – | 病毒 | – | 无 |
| 牡蛎面盘病毒病(OVVD) | – | 病毒 | – | 未知 |
统计
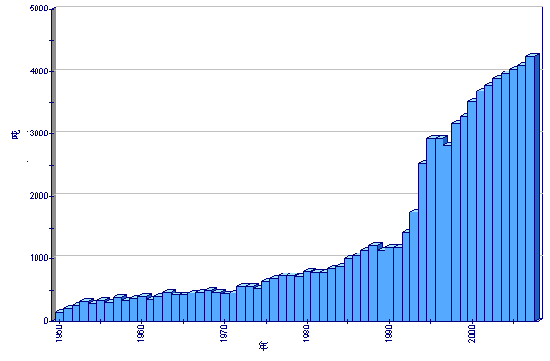
生产
全球养殖产量
粮农组织渔业统计
粮农组织渔业统计

市场和贸易
主要生产国的大部分产品由国内市场吸收并由来自邻国和贸易伙伴的进口量予以补充(例如在欧盟的内部贸易中,法国从联合王国和爱尔兰等其他欧盟国家进口剩余 产品)。这类品种相对较短的货架寿命是全球进行大规模鲜活产品贸易的一个限制因素,而且消费者往往选择活体、半壳牡蛎或者新鲜牡蛎肉。现在经常出现在市场 上并具有全球销售潜力的还有增值和便利产品,包括罐头牡蛎以及加入各种调味料的冷冻或抽真空包装的牡蛎。然而,它们在总产量中仅占很小一部分。育苗场培育 的苗种(特别是三倍体)仍具备国际销售的潜力。
状况和趋势
世界范围的长巨牡蛎的养殖生产持续稳步扩大,从1950年的156000吨扩大到1970年的437000吨和1990年的120万吨。1990年代期间 产量增长非常快,到2000年已经达到390万吨。产量继续提高并在2003年达到近440万吨。产量的增长趋势将会继续,尽管其速度会因沿海的城市化和 不得不与其他用户共享沿海资源而有所减缓。
主要问题
与许多其它养殖品种不同,种苗的可靠供应不会成为限制进一步发展的制约因素。种苗可以随时从自然水域采集,也可以在育苗场以相对较低成本进行大批量生产。 一个令人关注的问题是环境恶化的可能性,该问题已经出现在某些主要产区,而且长巨牡蛎在引进国可能具有主导或占据原本属于本地双壳类的栖息地。长巨牡蛎具 有很强的海水过滤能力,因此在集约化养殖条件下它们会排放大量生物废料。它们在自然繁育地区构成密集的暗礁,而这些暗礁使底层水流减慢并同时改变生物多样 性,从而成为沉积物陷阱。吊养方法能够减轻这种环境影响。
长巨牡蛎有意或无意地被引入新西兰和澳大利亚的新南威尔士强调说明了其取代本地种的可能性。从积极的角度看,长巨牡蛎1971年首次在新西兰北岛奥克兰地区被发现。到1977年,通过争夺定殖空间并得益于其极快的生长速度,长巨牡蛎(Crassostrea gigas )已经取代了本地的岩石牡蛎(Saccostrea glomerata ),成为主要养殖牡蛎。同样,鉴于新南威尔士的海湾及河口地区是本地悉尼岩牡蛎(Saccostrea commercialis )的栖息地,因此长巨牡蛎(C. gigas )被偶然引入或转移至该地区引起生产者、政府和环保人士的严重关注。
长巨牡蛎有意或无意地被引入新西兰和澳大利亚的新南威尔士强调说明了其取代本地种的可能性。从积极的角度看,长巨牡蛎1971年首次在新西兰北岛奥克兰地区被发现。到1977年,通过争夺定殖空间并得益于其极快的生长速度,长巨牡蛎(Crassostrea gigas )已经取代了本地的岩石牡蛎(Saccostrea glomerata ),成为主要养殖牡蛎。同样,鉴于新南威尔士的海湾及河口地区是本地悉尼岩牡蛎(Saccostrea commercialis )的栖息地,因此长巨牡蛎(C. gigas )被偶然引入或转移至该地区引起生产者、政府和环保人士的严重关注。
负责任水产养殖实践
以上提及的许多重要问题正在通过为该品种制定更加负责任和可持续的生产规范予以解决。这一做法非常符合粮农组织的《负责任渔业行为守则》(CCRF),而 且包括对海湾及河口的租赁水面实行限制以便将生产控制在水域的承载能力之内。鉴于三倍体的生产得到100%的保证,对鱼类健康和管理的认识不断加深,而且 拥有将眼点幼虫运送到世界任何地点供异地附苗的能力,在过去从未养殖过此类牡蛎的地区和国家发展生产是具有潜力的。如果能够本着环境可接受的准则开展养殖 生产,三倍体的繁殖和竞争应不会给本地品种带来威胁。
长巨牡蛎的养殖很适于小型家庭企业、合作社或区域性产业,而且养成生产阶段可以由技能相对较低的劳动力来完成,同鱼虾的养殖相比,设备和基础设施的投资也比较少。
长巨牡蛎的养殖很适于小型家庭企业、合作社或区域性产业,而且养成生产阶段可以由技能相对较低的劳动力来完成,同鱼虾的养殖相比,设备和基础设施的投资也比较少。
参考文献
书目
| Byung, H.P., Mi, S.P., Bong, Y.K., Sung, B.H. & Seong, J.K. 1988. Culture of the Pacific oyster (Crassostrea gigas) in the Republic of Korea. |
| Helm, M.M., Bourne, N. 2004. Hatchery culture of bivalves. A practical manual. A. Lovatelli (ed.), FAO Fisheries Technical Paper No. 471. FAO, Rome, Italy. |
| FAO. 1995. Code of Conduct for Responsible Fisheries. FAO, Rome, Italy. 41 pp. |
| FAO. 1997. Aquaculture development. FAO Technical Guidelines for Responsible Fisheries No. 5. FAO, Rome, Italy. 40 pp. |
| Kan-no, H. & Hayashi, T. 1971. The present status of shellfish culture in Japan. Proceedings of the First U.S.-Japan Meeting on Aquaculture at Tokyo, Japan, October 18-l9, 1971. |
| Leffler, M.& Greer, J.R. 1991. The Ecology of Crassostrea gigas in Australia, New Zealand, France and Washington. Maryland Sea Grant, College Park, Maryland. UM-SG-TS-92-07. |
| Mann, R. 1979. Exotic Species in Mariculture. Proceedings of Symposium on Exotic Species in Mariculture: Case histories of the Japanese oyster, Crassostrea gigas (Thunberg), with implications for other fisheries, Woods Hole Oceanographic Institution, Woods Hole, September 18-20, 1978. MIT Press, Cambridge Press, 363 pp. |
| Sarkis, S. 2007. Installation and operation of a modular bivalve hatchery. A. Lovatelli (ed.), FAO Fisheries Technical Paper No. 492. FAO, Rome, Italy. |
| Spencer, B.E. 1990. Cultivation of Pacific oysters. Laboratory Leaflet No. 63. MAFF Directorate of Fisheries Research, Lowestoft, UK. 47 pp. |