
 |
MANUEL D'ECLOSERIE |
| FAO/MAG/88/006 | |
| MANUEL D'ECLOSERIE | FERME PILOTE D'AQUACULTURE DE CREVETTES NOSY - BE |
par
Olivier AVALLE
CTP FAO/MAG/88/006
et
Rolland RANDRIANTOMPONIONY
Responsable Ecloserie
AVRIL 1994
ORGANISATION DES NATIONS UNIES POUR L'ALIMENTATION ET L'AGRICULTURE
Les liens hypertextes vers d'autres sites de l'Internet ne signifient nullement que l'Organisation approuve officiellement les opinions, idées, données ou produits qui y sont présentés, qu'elle en assume la responsabilité ou qu'elle garantit la validité des informations qui s'y trouvent. Leur seul objectif est d'indiquer où trouver un complément d'informations sur des thèmes apparentés.
Cette version numérique du document a été scannérisé en utilisant des logiciels de reconnaissance optique de texte (OCR). La FAO décline toute responsabilité pour les éventuelles différences pouvant apparaître dans ce document par rapport à la version imprimée originale.
1.1. Généralités
1.2. L'eau douce
1.3. L'eau de mer
1.4. Entretien
1.5. L'air
2.1. Objectif
2.2. Les géniteurs
2.3. Les bacs de maturation
2.4. Paramètres d'élevage
2.5. Conduite de l'élevage
3.1. Généralités
3.2. Le pondoir
3.3. Paramètres d'élevage
3.4. Mode opératoire
4.1. Généralités
4.2. L'éclosoir
4.3. Paramètres d'élevage
4.4 Mode opératoire
5.1. Généralités
5.2. Elevage larvaire
5.3. Paramètres d'élevage
5.4. Conduite d'élevage
5.5. Transfert de Nauplii
5.6. Elevage larvaire avec changement d'eau
5.7. Elevage larvaire sans changement d'eau
5.8. Recolte et transfert des post-larves
5.9. Prophylaxie
6.1. Généralités
6.2. Les équipements
6.3. Paramètres d'élevage
6.4. Conduite de l'élevage
6.5. Acclimatation des post-larves
6.6. Transfert et expédition des Post-larves
6.7. Survie d'élevage et test de salinité
VII. L'UNITE DE PRODUCTION D'ARTEMIA
7.1. Généralités
7.2. Matériels
7.3. Paramètres d'élevage
7.4. Conduite de l'élevage
7.5. Prophylaxie
VIII. PRODUCTION D'ALGUES UNICELLULAIRES
8.1. Généralités
8.2. Paramètres de culture
8.3. Les milieux de culture
8.4. Technique de culture
8.5. Comptage
Ce document technique décrit les activités nécessaire au fonctionnement de l'écloserie de la Ferme Pilote de Nosy-Be. A ce titre, il sera utilisé plutôt par les ingénieurs et les techniciens en charge de cette écloserie qui y trouveront toutes les informations nécesaires.
Mais il pourra également servir à d'autres équipes qui travaillent dans des installations différentes car les méthodes décrites dans ce manuel peuvent s'appliquer à d'autres écloseries.
La méthode d'élevage retenue sur l'écloserie de la Ferme Pilote est celle dite intensive en eau claire par opposition à celle en eau verte et à basse densité. Le principe d'élevages repose sur la séparation de toutes les phases d'élevages afin d'en contrôler toutes les étapes.
Dand l'ordre chronologique nous trouvons:
Cette description des installations ne fait pas mention de la salle d'algues bien que les technique de culture d'algues soient décrites dans ce manuel. La raison en est que la Ferme Pilote a, dès le début de ses activités de production en 1989, mis au point la méthode d'élevage avec microparticules et sans algues.
Cette méthode expérimentale à l'époque, est devenue de routine car les résultats ont été satisfaisants. Elle a permis de produire 30 millions de post-larves depuis Juin 1989. De récentes expérimentations ont testées avec succès la méthode d'élevage larvaire sans changement d'eau. Au lieu de pratiquer des renouvellement d'eau à partir du cinquième jour, cette technique limite les changements d'eau qui ne seront faits qu'au stade post-larves. Il en résulte une plus grande simplicité de travail, une économie d'énergie importante et une fiabilité accrue.
L'écloserie utilise de l'eau douce, de l'eau de mer et de l'air. Ceux-ci doivent toujours être en parfait état de fonctionnement car une panne de l'un ou de l'autre peut entraîner l'arrêt provisoire de l'écloserie et la perte des élevages en cours. Les différents réseaux sont en général regroupés dans le local technique afin de simplifier l'installation, la maintenance et l'utilisation.
Elle est surtout utilisée pour le nettoyage des équipements, elle doit donc être propre et si possible de qualité potable. Il importe qu'elle soit claire sans particules en suspension, sinon il faut la filtrer. Dans cette hypothèse un passage dans un filtre à sable à faible granulométrie est suffisant et plus pratique qu'un filtre à cartouche qui a tendance à se colmater trop rapidement.
L'eau douce sert au nettoyage des équipements et au rinçage de tout le petit matériel. Dans chaque salle de l'écloserie sera placé un fût ou un 1/2 fût de 200 litres qui sera rempli tous les jours et chloré à 40 g/m3. Cette eau va servir à tuer tous les germes sur les équipements qui ont été en contact avec les élevages. En fin de journée le fût sera vidé sur le sol pour servir au nettoyage général de la pièce.
Dans le cas de la nurserie, l'eau douce va servir non seulement au nettoyage des bacs, mais aussi à baisser la salinité de l'eau de mer. La baisse de salinité est indispensable dans le cas où les post-larves doivent être ensemencés dans des bassins à faible salinité. Pour cette utilisation l'eau douce sera utilisée telle quelle sans filtration.
1.3.1. Approvisionnement et stockage
L'eau de mer arrive dans l'écloserie par pompage. Deux pompes d'un débit de 25 m3/ heure assurent l'alimentation. Elles peuvent être utilisées soit individuellement, soit simultanément selon les besoins.
Le pompage suit le rythme des marées. Il se fait généralement au début de la marée montante et sert à remplir une cuve de stockage de 30 m3 afin d'assurer les besoins en eau pendant 12 heures (durée entre deux marées).
1.3.2 Filtration et distribution
Le degré de filtration varie selon l'unité à alimenter. Après le premier pompage, l'eau passe dans un filtre à sable de 50 microns et arrive directement soit à la nursery, soit dans la cuve de stockage. Après la cuve et sous l'action de deux pompes de 10 m3/heure, l'eau passe dans un deuxième filtre à sable de 50 microns et suit trois embranchements :
1.3.3. Traitements
Les traitements de l'eau de mer varient selon l'unité de production :
1.4.1. Lavage et traitement des filtres
Ces différents types de filtre retiennent une grande partie des particules contenues dans l'eau de mer. Après une utilisation assez longue, ils se colmatent et perdent leur pouvoir de filtration. Suivant le type de filtre, un nettoyage devra être fait quotidiennement ou après chaque cycle larvaire.
(i) Filtre à sable1
Après chaque cycle d'élevage, on traite le sable avec de l'eau chlorée pendant au moins 4 heures. Pour le rinçage, placer la manette en position “égout”. A l'aide d'un tuyau PVC rigide placé au bout d'un tuyau souple alimenté avec de l'eau douce, remuer le sable pour éliminer le chlore retenu entre les grains. Pour terminer, faire un “backwash” assez long :
Lors d'une utilisation prolongée comme pour le remplissage des bacs neurseries, il peut être indispensable de pratiquer un cours “backwash” si la turbidité de l'eau de pompage est importante. Dans ce cas là un nettoyage de 2 ou 3 minutes est suffisant et permet d'augmenter le débit et la qualité de l'eau.
(ii) Filtre à cartouches CUNO2
Il faut disposer d'au moins deux lots de cartouches filtrantes pour une utilisation alternative. A chaque fin de journée, les cartouches seront enlevées et trempées dans de l'eau chaude (80°C au minimum) pendant deux heures. Puis elles seront lavés par un jet sous pression jusqu'à l'élimination de toutes les particules. Ensuite les filtres seront mis à sécher sur une étagère au soleil ou avec l'air chaud des surpresseurs d'air.
L'alimentation en air se fait par une batterie de 3 supresseurs3 mis en marche en fonction de la demande. Chaque appareil a un débit qui lui permet d'alimenter l'élevage larvaire. Mais lorsque la nursery est une production, il faut brancher deux appareils.
L'aspiration d'air doit être dégagée. La fragilité de ces appareils exige un entretien minutieux. Tout bruit de fonctionnement suspect doit être signalé au responsable logistique qui diagnostiquera le problème et son démontage éventuel.
3 Surpresseurs de marque SIEMENS Type ELMO.G de 110 m3/h à 2,25 m. Moteur 3 KW.
Le stockage des géniteurs en bac de maturation a pour but de leur fournir les conditions propices pour le développement des gonades en vue d'obtenir une meilleure reproduction et des oeufs bien fécondés.
La mise en bac de maturation permet d'obtenir la maturation simultanée des femelles, donc des pontes groupées, et également d'assurer la gestion des stocks et le suivi biologique des géniteurs.
La planification et l'organisation du travail de cette unité nécéssitent une bonne coordination avec les autres unités.
En principe, les géniteurs sont issus du milieu naturel, mais parfois complétés par des individus provenant des élevages.
Les espèces élevées sont P. monodon et P. indicus : le choix des géniteurs est décisif pour la réussite de la maturation et par conséquence des pontes.
| P. monodon | ||
| Femelles | : de 120 à 150g | |
| Mâles | : de 80 à 90g ou plus | |
| P. indicus | ||
| Femelles | : de 25 à 40g | |
| Mâles | : au moins 20g | |
| Ces chiffres correspondent au poids individuel. | ||
Nota : Les femelles de grande taille (> 150 g) sont trop âgées, pondent beaucoup d'oeufs, mais le taux de fécondation diminue d'une façon importante.
Ce sont des bacs rectangulaires en béton armé ayant chacun une capacité de 18 m3. Ils sont alimentés en eau de mer filtrée à 50 microns. L'aération se fait de façon continue par un système “air-lift” avec circulation d'eau en profondeur et par un diffuseur de microbulles en surface.
La reconstitution de l'habitat naturel des crevettes se fait par la pose de graviers recouverts de bidim4, et de sable sur la moitié de la surface du bassin.
| - Biomasse par bac | : | 250 à 300g/m2 |
| - Sex ratio | : | 50/50 (0,7 mâle pour une femelle au minimum) |
| - Température de l'eau | : | 28 à 30° C |
| - Salinité | : | 27 á 38 ‰ |
| - Filtration | : | 50 microns |
| - Renouvellement d'eau | : | 200 à 300% par jour et en continu |
| - Aération | : | forte par “air-lift” en profondeur et par diffuseur en surface |
| - Lumière | : | Très réduite |
| - Alimentation | : | Aliments frais : crabes (achetés sur place) huître (récoltées par les ouvriers) - têtes de crevettes |
| granulés : NIPPAÎ et ARGENT5 utilisés surtout à la fin de la maturation. |
Le poids moyen des géniteurs et leur appétit déterminent la ration journalière. En principe, elle est de 5 à 10% de la biomasse.
2.4.1. Aliments
Les granulés favorisent la maturation des femelles. Mais leurs effets peuvent provoquer une incidence négative sur la qualité des gonades, plus précisement sur les gamétes. A cet effet, il est impératif de compléter la ration par des aliments frais et variés. Le meilleur résultat est obtenu avec la combinaison : calmars - crabes - granulés.
2.4.2. Paramétres physico-chimiques
La stabilité de la salinité et de la température sont particulièrement importantes. Un brusque changement peut arrêter les maturations. Il faut éviter les basses salinités inférieures à 30 ‰.
Le changement d'eau en continu contribue à la mue des femelles et permet ainsi leur fertilisation. Celles-ci ont leurs thélicums fermés et ne sont fécondables qu'au moment de la mue. Par conséquent, un contrôle rigoureux est nécessaire pour maintenir la stabilité de tous les facteurs physico-chimiques : pH, température, ….
Pour éviter des variations brusques de la température ambiante, surtout la nuit, le local est chauffé par des lampes á incandescence.
2.4.3. Lumière
La lumière doit être très réduite, voire supprimée, car une forte luminosité entraîne un changement de comportement des crevettes qui diminue les chances de maturation. Une photopériode constante de 12 heures peut être obtenue en utilisant une lumière artificielle en remplacement de la lumière du jour.
Pendant toute la durée d'élevage en bac maturation, les facteurs biotechniques sont à surveiller et à mesurer, puis sont affichés journalièrement sur un tableau de contrôle.
2.5.1. Planning de travail
Toutes ces informations doivent être enregistrées dans une fiche de suivi quotidienne de maturation.
2.5.2. Maturation des femelles
a) Epédonculation
Principe
L'acclimatation en bac maturation dure environ une semaine. En absence d'état de maturation, chaque femelle doit être épédonculée pour assurer une maturation de ses gonades et pour avoir des pontes groupées. L'épédonculation se fait 4 à 7 jours avant la date prévue de la ponte. Elle crée un stress qui stimule la sécrétion d'hormones en entrainant par la suite la maturation des gonades.
Méthode
Baisser le niveau de l'eau dans le bac. Séparer les individus mâles des femelles dans deux nasses différentes. Peser individuellement chaque femelle. Noter le poids.
Faire une ligature assez ferme à la base du pédoncule de l'oeil à inciser, avec un fil en coton pour éviter une hémorragie. Inciser l'oeil oculaire à l'aide d'une lame de rasoir ou d'un bistouri et pousser son contenu à l'extérieur. Mettre la femelle dans le bac.
Pendant l'opération, il faut tenir fermement la femelle sans l'écraser afin d'éviter un stress musculaire. Deux techniciens sont nécessaires pour réaliser l'opération le plus rapidement possible.
Pour les mâles, les peser seulement et noter leur poids individuel.
b) Observation de la maturation
La maturation est contrôlée par l'observation journalière de l'évolution de la “trâce” noire sur le dos de l'animal. Elle est jugée atteinte lorsque la “trâce” est épaisse, traduisant des gonades bien gonflées.
Nota:- Il faut réduire au maximum les activités dans le local de maturation 1 à 2 jours après l'épédonculation et surtout vers la fin de maturation afin d'éviter de stresser les animaux par une brusque illumination des lampes ou par des bruits.
- Les femelles matures doivent être manipulées avec précaution.
2.5.3. Prophylaxie
Chaque matin, les restes de mues et les individus morts doivent être enlevés :
- déterminer et noter leur sexe et leur nombre. Le fond du bac est nettoyé à l'aide d'un balai. Les restes d'aliments et les fecès sont concentrés près de la vidange centrale puis évacués en enlevant le tuyau de trop plein. A la fin d'un cycle de maturation, les femelles sont sacrifiées et les mâles retournent en stockage dans le bassin extérieur de maturation.
Le nettoyage des bacs est réalisé complètement, c'est-à-dire, en enlevant le système de filtration du fond: sable, bidim, graviers. Ceux-ci seront lavés et chlorés puis séchés. Le bac lui-même sera rempli, après le nettoyage, avec de l'eau douce chlorée et laissé ainsi pendant 48 heures.
Avant de rédémarrer un nouveau cycle de maturation, les bacs seront rincés abondament avec de l'eau de mer filtrée à 10 microns.
C'est l'unité de production d'oeufs. Elle est sous la responsabilité du biologiste qui dirige l'unité maturation. Les femelles dont les gonades sont jugées matures doivent y être transférées.
Ce sont des bacs cylindro-coniques de 200 à 250 litres, d'eau de mer filtrée à 5 microns. L'aération est assurée par des diffuseurs d'air.
La densité est de 1 à 2 femelles/bac pour P. monodon et de 2 à 4 femelles/bac pour P. indicus. Le séjour dure une nuit (12 heures environ).
| Densité par bac | :1 à 2 femelles (P. monodon); 2 à 4 femelles P.indicus) |
| Température de l'eau | :28 à 30 ° C (Chauffage par thérmoplongeur si nécessaire |
| Salinité | :27 à 36 ‰ |
| Filtration | :5 microns |
| Renouvellement d'eau | :aucun |
| Aération | :faible pour assurer la suspension des oeufs |
| Lumière | :obscurité totale (bac avec couvercle) |
| Manipulation | :transfert des femelles vers 20 heures |
| Alimentation | :aucune |
3.4.1. Préparation du pondoir
Elle se fait 2 heures au moins avant le transfert des femelles:
3.4.2. Transfert des femelles
Entre 18 et 20 heures un biologiste, assisté d'un technicien, sort les femelles matures:
3.4.3. Récolte des oeufs
(i) Matériel
Casque avec filtre de 100 microns, épuisette, seaux de 10 litres, gobelet, pipette de 1 ml, pipette Pasteur, 3 boîtes de Pétri ou équivalent, compteur manuel et une fiche de ponteéclosion.
(ii) Récolte
Elle commence vers 7 heures du matin. A l'aide d'une épuisette, chaque femelle est capturée et l'état de ponte est vérifié: PT = ponte total, PP = ponte partiel. Les femelles ayant pondu (FAP) sont pesées (PF) et transférées dans leur bac de maturation.
Un filtre appelé “casque” avec une maille de 100 μ est placé sous la vanne d'évacuation. Il est préalablement rempli d'eau pour éviter d'abîmer les oeufs. La vanne est ouverte doucement jusqu'à complète vidange du bac. De temps en temps, il faut décolorater le filtre pour empêcher le débordement du casque. Lorsque le bac est vide, un rinçage au jet évacuera tous les oeufs collés sur la paroi du cône.
Les oeufs sont séparés des déchets en les passant à travers un tamis de 100 μ, puis ils sont mis dans un seau de 10 litres pour le comptage. Une aération est nécessaire si les oeufs ne sont pas comptés rapidement.
(iii) Comptage
Le volume du seau contenant les oeufs est ajusté à 10 l, il est ensuite brassé vigoureusement pour homogénéiser la répartition des oeufs. A l'aide d'une pipette de 1 ml, trois prélèvements sont effectués et répartis dans 3 boîtes de Pétri. Le comptage est fait avec une pipette pasteur et un compteur manuel.
La moyenne des 3 échantillons multipliée par 10.000 (1 litre = 10.000 ml) donne le nombre d'oeufs total (NT).
Les rapports NT/FAP et NT/PF donnent respectivement le nombre des oeufs pondus par femelle et le nombre des oeufs pondus par unité de poids de femelles.
Répeter la même manipulation pour tous les bacs.
(iv) Qualité des oeufs
Avant leur mise en écloserie les oeufs doivent être observés pour évaluer leur état, et le taux de fécondition.
Une centaine d'oeufs sont prélevés et placés dans un creuset pour une observation sous un microscope ou une loupe binoculaire. Les oeufs sont comptés en notant ceux qui sont fécondés (WF) et ceux qui sont non fécondés ou détruits (WNF).
Le taux de fécondation (TF) est obtenu par le rapport WF/XNF et le nombre total d'oeufs fécondés par NT/TF.
Le taux de fécondation est un indicateur pour décider de garder ou de jeter la ponte. Avec un taux inférieur à 20 %, elle est jetée car le nombre de nauplii récupérables risque d'être trop faible pour démarrer un élevage larvaire.
C'est l'unité où se déroule l'éclosion des oeufs pour donner des larves Nauplii. Elle se trouve généralement dans le même local que les pondoirs.
Le but est d'établir des bonnes conditions pour l'éclosion des oeufs afin de séparer définitivement les bons et les mauvais oeufs.
Cette unité est sous la responsabilité du biologiste de maturation.
Il est composé d'un filtre généralement un tuyau en PVC (diamètre 300 mm) équipé d'une maille de 100 microns. Ce filtre est placé dans un bac qui peut acceuillir plusieurs éclosoirs en série. La circulation de l'eau s'effectue du fond du filtre vers le haut à travers la maille où reposent les oeufs. L'évacuation de l'eau se fait par la partie supérieure en direction d'un casque récepteur.
L'éclosoir est recouvert d'un couvercle qui est percé par un petit orifice que l'on place à la verticale de l'évacuation.
| Densité des oeufs | : 600 oeufs par cm3 |
| Température de l'eau | : 28 à 29°C |
| Salinité | : 28 à 36 ‰ |
| Filtration | : 1 micron |
| Renouvellement d'eau | : continu avec 1 à 2 litres par minute |
| Aération | : nulle ou trés faible |
| Lumière | : obscurité dans le bac, local éclairé assez fortement |
| Alimentation | : aucune |
La densité des oeufs ne doit pas être trop élevée pour éviter l'entassement sur le filtre. La circulation de l'eau par le fond vers le haut permet une bonne oxygénation.
Après éclosion, les Nauplii vigoureux nagent vers le haut attirés par la lumière (phototropisme positif), et où un courant d'eau permanent de faible vitesse les entraîne vers le casque collecteur de 100 microns. Par ce système, les Nauplii faibles ne peuvent pas nager vers le haut et ne seront pas collectés.
En général, l'éclosion commence 6 heures après la ponte, en saison chaude lorsque la température de l'eau est de 30° C. En saison froide l'éclosion a lieu 10 heures après car la température peut descendre à 27° C.
4.4.1. Préparation de l'éclosoir
Elle se fait simultanément avec la préparation des bacs d'élevage larvaire, c'est à dire, le matin lorsque les pontes ont été récoltées et observées.
Tout le matériel devra être parfaitement nettoyé et séché avant la mise en eau.
4.4.2. Transfert des oeufs
Il faut installer le filtre de 1 micron sur la pompe d'alimentation d'eau dans le local technique et mettre en place le système d'aération du bac éclosoir. Le bac sera rempli en veillant à ne laisser aucune bulle d'air au-dessous de la maille de l'éclosoir car elles constituent des “zones mortes” (mauvaise circulation d'eau et d'oxygènation). S'il y en a, elles seront siphonnées à l'aide d'un tuyau cristal d'aération.
Les oeufs seront transferés avant que le niveau de l'eau n'atteigne la conduite d'évacuation d'eau. A l'aide d'une baguette appropriée, placer les oeufs au bord de l'éclosoir car cette opération semble augmenter le taux d'éclosion. Les éclosoirs sont recouverts avec les couvercles et le local est éclairé:
4.4.3. Récolte des Nauplii
A la fin de l'éclosion des oeufs, tous les Nauplii en bonne santé sont récoltés dans le casque installé à la sortie de l'éclosoir. Ils sont transférés dans un seau avec 10 1 d'eau pour être comptés (voir § comptage des oeufs). Afin de faciliter le comptage des Nauplii, ils sont tués en ajoutant un peu d'eau douce dans les bôtes de Petri. Le nombre total est déterminé, ainsi que le taux d'éclosion.
En fonction du nombre total de Nauplii, un ou plusieurs bacs d'élevage larvaire seront préparés.
Cette unité assure le bon déroulement du développement des différents stades larvaires allant du Nauplii au Post-larve. Elle constitue l'étape la plus importante et la plus délicate dans le cycle d'élevage en écloserie.
Elle est sous la direction d'un biologiste assisté d'un technicien et de quelques ouvriers.
Cette phase d'élevage va se dérouler pendant 12 à 15 jours dans les bacs d'élevage. Ceux-ci sont en polyester d'un volume de 2,5 m3, mais dans certaines écloseries industrielles des bacs en forme de μ d'un volume de 15 m3 sont utilisés. Au cours des 15 jours d'élevage, les larves vont muer et se transformer de Nauplii à Zoé 1, 2, et 3 puis MYSIS 1, 2, et 3. A ce stade la mue de post-larve leur donnera leur configuration définitive. Pour plus de facilité, à partir de post-larve leur âge est compté en jours et non plus en stade de mue. Ex. P2 = une post-larve de 2 jours.
Pendant cette phase d'élevage, les larves seront nourries avec différents aliments, algues unicellulaire, microparticules et artémia. Des changements d'eau permettront de maintenir de bonnes conditions d'élevages et des traitements seront appliqués pour éviter des proliférations bactériennes.
Deux méthodes d'élevages seront décrites : celle utilisant les changements d'eau quotidiens à partir du 5ème jour et celle plus récente consistant à ne changer l'eau qu'en stade post-larve.
| Densité | : | 250.000 à 350.000 Nauplii par bac |
| Température | : | 27 à 31 ° C (optimale 30 ° C) |
| Salinité | : | 25 à 38 ‰ |
| Filtration | : | 5 microns |
| Changement d'eau | : | 0 à 100 % suivant le stade larvaire |
| Aération | : | continue |
| Lumière | : | naturelle |
| Alimentation | : | microparticules et Nauplii d'Artémia |
| Traitements | : | antifongique:Tréflan6 antibiotique : Furazolidone ou chloramphénicole chélation des métaux lourds:EDTA7 |
7EDTA : Acide Ethylène Diamoino Tétracétique
La préparation des bacs d'élevage larvaire se fait pendant la période d'incubation des oeufs et elle nécessite au moins deux ouvriers. Le nettoyage des bacs consiste à les rincer abondament pour enlever toutes traces du chlore puis à les remplir à l'eau de mer filtrée. Avant d'utiliser l'eau de mer, il faut purger les tuyauteries de l'eau résiduelle en laissant couler la vanne de purge durant plusieurs minutes.
Les systèmes d'aération seront nettoyés en les plongeant dans de l'eau douce bouillante.
Ensuite les bacs sont remplis à 1500 1 et le tréflan et l'EDTA sont ajoutés.
Les résistances électriques avec thérmo-plongeur sont mises en place mais pas branchées car les températures doivent être équivalentes entre les éclosoirs et les bacs d'élevages larvaires. Elles seront branchées plus tard si la température de l'eau est inférieure à 30° C.
Les diffuseurs d'air sont cristalisés et le débit est réglé au minimum.
Les lampes à incandescence sont allumées pour éviter les variations thérmiques diurnes dans la salle d'élevage.
Avant le transfert, il faut vérifier la conformité de températures des éclosoirs et des bacs d'élevages. Les Nauplii sont transportés dans des seaux jusqu'à la salle d'élevage larvaire où ils sont transvasés dans les bacs avec un pot d'un litre après avoir bien homogénéisé la répartition dans le seau. Il est important de bien connaître le nombre total de Nauplii dans le seau pour effectuer correctement la répartition. Les bacs de 2,5 m3 reçoivent chacun jusqu'à 300.000 Nauplii.
Lorsque le transfert est terminé, il faut brancher la résistance et régler le thérmostat à 30° C.
5.6.1. Les observations de routine
Elles doivent être faites de manière très rigoureuse car c'est à partir de là que le biologiste établit par ordre de priorité, le programme de travail de la journée.
Pendant les stades Nauplii (30 à 48 heures), aucune intervention n'est à faire, sauf effectuer de fréquentes observations à l'oeil nu et au microscope pour déterminer et suivre l'évolution des stades de développement. Il faut aussi contrôler l'aération, la température et faire le comptage.
A partir du Zoé l, le biologiste détermine sur quelques échantillons, le stade larvaire, l'état de replétion (vide, très peu, plein…), les anomalies morphologiques (tordues,…) et les maladies.
Au niveau du bac, on note:
Le biologiste doit aussi relever les informations de la nuit notées dans le cahier de rapport par le personnel de permanence.
5.6.2. Changement d'eau
Au début, le volume d'eau est de 80 % du volume d'eau total d'élevage. En principe, le changement d'eau se fait à partir du stade Zoé 2. Avant ce stade, on ajuste progressivement le volume d'eau à 1,7 m3 puis à 2 m3. Toutefois, le changement d'eau reste nécessaire même aux stades antérieurs lorsque la turbidité est trop élevée et en cas de problèmes d'élevages tels que maladies ou retards de mues.
| STADE | Volume d'eau (1) | Changement d'eau (%) | Filtre (μ) | Durée (mn) |
| W - N | 1500 | |||
| N | 1500 | |||
| N - Z1 | 1700 | |||
| Z1 | 2000 | |||
| Z2 | 2000 | 50 | 250 | - |
| Z3 | 2000 | 100 | 250 | 30 |
| Z3 - M1 | 2000 | - | - | - |
| M1 | 2000 | 100 | 250 | 30 |
| M2 | 2000 | 100 | 500 | 30 |
| M3 | 2000 | 100 | 500 | 30 |
| M3 - PL | 2000 | - | - | - |
| P1 | 2000 | 100 | 500 | 30 |
| P2 | 2000 | 50 – 100 | 500 | 0 – 30 |
| P3 | 2000 | 50 – 100 | 500 | 0 – 30 |
| P4 | 2000 | 50 – 100 | 500 | 0 – 30 |
| P5 | Transfert à la Nurserie | |||
Tableau 1: Principe général de changement d'eau
Le changement d'eau comprend deux étapes :
- la vidange
- le renouvellement
(i) Vidange
Avant toute intervention sur les bacs d'élevages, il faut débrancher les résistances chauffantes. Elles seront ensuite rinçées à l'eau chaude, et séchées.
La préparation du matériel consiste à sortir des étagères : 1 seau de 10 litres, des gobelets de 1litre, des éponges (1/bac), 1 casque de 250 μ et le filtre de 250 μ avec son tuyau de trop plein. Tout ce matériel sera rinçé à l'eau de mer filtrée avant d'être utilisé.
Pour installer le filtre dans le bac d'élevage, il faut :
Avant d'ouvrir la vanne d'évacuation, il faut placer un casque avec tamis de 250 ou 500 μ dans celle-ci, puis il faut vérifier au début de la vidange, qu'il n'y a pas de fuite de larves en prélevant un peu d'eau dans le casque.
Les parois du bac seront nettoyées avec un chiffon afin d'enlever tous les dépôts. Ce matériel utilisé sur un bac ne doit pas passer à un autre bac. Le technicien en charge de ce travail devra passer ses mains dans de l'eau chlorée lorsqu'il intervient sur un autre bac.
La vidange est terminée lorsque le niveau de l'eau atteint la partie supérieure du filtre.
(ii) Le renouvellement
Pendant la vidange des bacs d'élevage, le circuit d'eau de mer sera bien purgé en laissant couler l'eau en dehors des bacs.
Le remplissage peut être fait en 2 étapes suivant qu'il y a ou non un changement d'eau supérieur à 50 %.
Si le changement d'eau est de 50 % : lorsque le niveau d'eau atteint le filtre, la vanne d'évacuation sera fermée et le filtre remplacé par le tuyau de Trop-plein. La vanne de remplissage sera ouverte modérément et le bac rempli jusqu'au niveau déterminé par le tableau.
Si le changement d'eau est supérieur á 50 % : le filtre restera dans le bac et la vanne de remplissage sera ouverte. Cette circulation d'eau peut durer de 10 à 30 minutes ou plus en cas de problèmes d'élevages. Lorsque l'eau du bac est parfaitement propre, le renouvellement d'eau est arrêté et le filtre remplacé par le Trop-plein. Puis le bac est remonté au niveau déterminé par le biologiste.
Les casques placés sur les vannes de vidanges seront inspectés pour vérifier les fuites éventuelles de larves.
Tout le matériel utilisé sera chloré et séché puis rangé à sa place.
Le reste d'eau chlorée servira à rincer le sol de la salle d'élevage larvaire.
5.6.3. Les traitements
Au cours de l'élevage, trois types de traitements sont utilisés :
Pour un volume de 1,5 m3 d'élevage, 7,5 ml de la solution seront versés dans une bouteille placée au-dessus du bac, elle sera remplie 2 fois/jour.
chélater : l'EDTA (ou acide éthylène diamino tétracétique). Il est utilisé pour chélateur les métaux lourds contenus dans l'eau de mer.
La dose est de 5 g/m3 qui est versée directement dans le bac après dissolution dans un peu d'eau de mer.
antibiotique : la furazolidone, elle est distribuée en dose préventive tous les deux jours. Il faut la diluer dans un peu d'alcool pour la rendre liquide.
Le tableau suivant indique les quantités à utiliser pendant la durée d'élevage.
| STADE | TRAITEMENT | ||
| Tréflan (ml/m3) | Furazolidone (g/m3) | EDTA (g/m3) | |
| W - N | 5 | 5 | |
| N | 5 | - | |
| N - Z1 | 8,8 | 0,6 | |
| Z1 | 12,5 | 0,2 | 0,75 |
| Z2 | 12,5 | 2,5 | |
| Z3 | 20 | 0,2 | 5 |
| Z3 - M1 | 30 | - | |
| M1 | 30 | 0,3 | 5 |
| M2 | 40 | 5 | |
| M3 | 40 | 0,3 | 5 |
| M3 - PL | 50 | - | |
| P1 | 50 | 0,4 | 5 |
| P2 | 50 | 2,5 - 5 | |
| P3 | 50 | 0,4 | 2,5 - 5 |
| P4 | 50 | 2,5 - 5 | |
| P5 | Transfert à la Nurserie | - | |
Tableau 2 : Les traitements en élevage larvaire.
5.6.4. Alimentation
Elle est un facteur essentiel dans la réussite des élevages. A ce titre, sa distribution devra faire l'objet de beaucoup d'attentions pour adapter au niveau les quantités d'aliments par rapport au nombre de larves en élevage et en fonction de leur stade.
Il y a trois types d'aliments qui sont utilisés :
(i) Le phytoplancton
Il est le premier aliment qui est distribué aux larves à partir du stade Zoé l et cela jusqu'au stade post-larves si nécessaire. Le phytoplancton est un aliment naturel pour les larves de crevettes et il a donc été utilisé dès la mise au point des méthodes d'élevages larvaires. Les espèces de phytoplancton les plus utilisées sont :
Leurs cultures nécessitent des équipements appropriés et une méthodologie assez lourde qui doit être suivie méticuleusement.
Les difficultés de production ainsi que le coût engendré par les équipements et le personnel ont incité les éleveurs à travailler de plus en plus avec des microparticules. Bien que la méthode de production soit décrite en fin du manuel, l'utilisation du phytoplancton ne sera pas retenue comme aliment larvaires car il est remplacé à 100 % par les microparticules.
(ii) Les microparticules
Depuis plusieurs années, les microparticules ont été utilisées en complément des algues unicellulaires. Mais peu à peu, leurs qualités s'étant améliorées, elles ont remplacé totalement les algues.
Les microparticules se présentent sous plusieurs granulomètries qui correspondent aux différents stades larvaires, leurs tailles varient de 50 à 350 microns.
(iii) Les artémia
Ils sont obtenus après l'incubation des cystes d'artémia salina. L'éclosion de ces cystes se passe dans les éclosoirs de la salle d'artémia ; il faut compter entre 12 et 24 heures pour obtenir entre 80 et 100 % d'éclosion. Les artémia constituent l'aliment frais pour les larves à partir du stade Zoé 3 jusqu'à la fin de l'élevage larvaire. La suppression des artémia et leur remplacement à 100 % par des microparticules sont fortement déconseillés. La taille des post-larves ainsi obtenue est pratiquement inférieure de 50 % par rapport à celle produite avec la méthode microparticules plus artémia.
5.6.5. La distribution des aliments
Pour l'alimentation des larves de P. monodon et de P. indicus, les méthodes de nutrition utilisant les microparticules et les artémia sont fiables et permettent d'obtenir de très bons résultats. Pour parvenir à une bonne survie finale, les distributions doivent bien suivre le tableau suivant où sont indiquées les rations journalières.
La première distribution de microparticules se fait avant ou pendant le passage de Nauplii à Zoé 1.
Les microparticules sont distribuées 6 fois par jour, toutes les 4 heures. Un distributeur par tapis roulant peut être utilisé pour faciliter les distributions nocturnes. Les rations sont calculées en mg par larve et par jour.
Les artémia sont récoltés deux fois par jour afin de ne prendre que les Nauplii nouvellement éclos. Il faut donc gérer la production des artémia pour avoir toujours un à deux bacs à récolter par jour.
| STADE | MICROPARTICULES* OU GRANULES BROYES ET TAMISES ** | ARTEMIA*** Nauplii / larve | |
| Quantités (mg/larve/jours) | Dimensions (microns) | ||
| W - N | 30 – 90 | ||
| N | |||
| N - Z1 | 0,015 | ||
| Z1 | 0,020 | ||
| Z2 | 0,025 | 30 – 90 et 80 – 150 | |
| Z3 | 0,030 | 10 | |
| Z3-M1 | 0,040 | 80 – 150 | 15 |
| M1 | 0,045 | 15 | |
| M2 | 0,050 | 20 | |
| M3 | 0,055 | 20 | |
| M3-PL | 0,060 | 80 – 150 et 150 – 250 | 20 |
| P1 | 0,060 | 25 | |
| P2 | 0,075 | 150 – 250 | 25 |
| P3 | 0,075 | 30 | |
| P4 | 0,075 | 150 – 250 et 225 – 335 | 30 |
| P5 | Transfert à la nurserie | - | |
* Microparticules : FRIPPAK (2CD, 3CD et PL + 300)
: ARGENT (Grade I, Grade II, Grade III)
** Granulés : ARGENT (Brine Shrimps Flakes)
: PRESIDENT (Grower)
Tableau 3 : Ration théorique de base pendant l'élevage larvaire
De Nauplii - Zoé1 à P 1 : microparticules
De P 2 à P4 : microparticules et / ou granulés broyés et tamisés
5.6.6. Comptage
(i) De nauplii à Zoé 3
Entre ces deux stades, les larves sont particulièrement petites et leur comptage à l'oeil nu exige un dispositif particulier composé d'une ampoule éléctrique supportée par un trépied stable et mobile. La tige portant l'ampoule peut coulisser de haut en bas. Le dispositif permet à la fois de :
La méthode consiste à :
(ii) De mysis à P4
Le comptage se fait directement au niveau du bac :
A partir de P2, les larves sont très rapides et capables de s'échapper à la prise d'échantillon. Le nombre total est alors souvent sous-estimé.
Cette méthode assez récente a été expérimentée avec succès à la Ferme Pilote. Elle consiste à ne pas pratiquer de renouvellement d'eau à partir de Zoé 2 comme dans la méthode précédemment décrite. Les changements d'eau interviennent seulement aux stades post-larves. Tous les autres paramètres restent identiques comme l'alimentation, les traitements antifongiques et antibiotiques.
Cette technique amène une grande simplification dans le travail de routine et une économie d'énergie très importante surtout lorsqu'il s'agit de chauffer l'eau d'élevage.
Le volume d'eau d'élevage est augmenté progressivement suivant le stade larvaire :
| - Nauplii | :1 500 l |
| - Zoé 1 | :1 700 l |
| - Zoé 2 à Zoé 3 | :2 000 l |
| - Mysis à Post-larve | :2 500 l |
La température doit être strictement supérieure à 29° C. L'optimale est 30° C. L'utilisation des résistances chauffantes thérmostatées facilite la stabilisation de la température.
Le pH doit être supérieur à 7,9. L'optimal est 8.
L'aération est assez forte et doit être maximale à chaque passage de stade sans provoquer la dislocation des larves.
A partir de P1, il est difficile de maintenir la qualité de l'eau tant physique (température, turbidité, …) que chimique (pH, …) et, il faudra faire des changements d'eau total ou partiel.
Au terme de l'élevage, les post-larves âgées de cinq jours (P5) doivent être transferées à la nurserie. Le transfert se fait généralement au début de la matinée lorsque les températures de l'élevage larvaire et de la nurserie sont relativement identiques.
5.8.1. Matériel
Filtre de 500 microns, casque de 500 microns, gobelet, seaux de 10 1, bassines de 40 1, thermomètre, salimomètre, calculatrice et compteur manuel.
5.8.2. Vidange
Elle sera exécutée de la même manière qu'un renouvellement quotidien, avec un filtre de 50 microns.
5.8.3. Récolte
Quand la vidange est terminée :
5.8.4. Comptage
Dans la bassine de 40 litres et après une bonne homogénéisation à la main prendre 4 échantillons de 250 ml et les mettre dans 4 seaux où le volume sera ajusté à 10 l. De nouveau, il faut homogénéiser à la main et prendre un échantillon de 1 litre pour le comptage. L'opération sera repètée deux fois pour chaque seau. Le calcul du nombre moyen dans 250 ml et multiplié par 1600, donne le nombre total. Le rapport de ce dernier sur le nombre des Nauplii au début de l'élevage permet de calculer la survie.
5.8.5. Test de salinité
L'objectif est de déterminer la qualité des post-larves en les plongeant brutalement dans un milieu où la salinité est différente de celle du bac d'élevage. Le choc de salinité permet d'apprécier la résistance des animaux.
Dans des béchers de 1 litre, cinq salinités seront préparées : 10, 15, 20 et 35 ‰. Trente post-larves seront mises dans chaque bécher et le comptage des individus morts sera fait au bout de 2 heures.
Les post-larves seront considérées comme résistantes et donc en parfait état si les survies sont supérieures à 50 ‰ à 10‰ aux autres salinités. Des survies inférieures mettent en évidence la faiblesse des post-larves et donc des problèmes d'élevages seront à attendre lors de la phase nursery.
La préparation de cette gamme de salinité se fait comme l'indique le tableau suivant:
| SALINITE (‰) | 35 | 25 | 20 | 15 | 10 |
| EAU DE MER (ml) | 1000 | 750 | 600 | 480 | 300 |
| EAU DOUCE (ml) | - | 250 | 400 | 520 | 700 |
Tableau : Test de salinité
Seul le biologiste et le personnel nécessaire peuvent entrer dans l'écloserie. Avant toutes manipulations, ils devront laver leurs mains puis les passer à l'alcool. Le matériel doit être propre et sec avant utilisation :
pour les bacs, nettoyage avec du savon liquide et rinçage avec de l'eau chaude puis séchage.
pour les autres matériels, lavage à l'eau douce et trempage à l'eau chlorée puis séchage.
pour la salle d'élevage, lavage avec de l'eau douce puis arrosage avec de l'eau chlorée.
l'eau du pédiluve doit être changée chaque fois qu'elle est sale.
Immédiatement après un cycle de production de post-larves, il faut laver les bacs d'élevage larvaire en brossant énergiquement leurs parois, les rincer puis les remplir jusqu'à ras-bord avec de l'eau douce additionnée de chlore (40 g / m3). Laisser tremper pendant 48 heures puis vider.
Cette unité termine les différentes étapes d'élevage en écloserie. Elle assure la croissance des post-larves P5 jusqu'à P12 ou elles seront ensemencées dans les bassins de prégrossissements ou directement dans les bassin de grossissements. Quelque fois, les post-larves peuvent y restent jusqu'à P20 - P30 lorsque c'est nécessaire notamment en saison froide.
C'est une installation à part du bâtiment de l'écloserie. Elle est constituée par des bassins cylindriques en tôle galvanisée tapissés à l'intérieur par une bache en PVC traitée anti-UV. Chaque bassin a un volume utile de 100 m3. L'eau de mer passe par un filtre à sable de 50 microns et ne subit pas d'autres traitements. Des sacs de sable maintiennent au fond le système d'aération qui est composé de tuyau PVC de diamètre 30 mm et qui est percé de trous tous les 20 cm. La vidange est centrale.
| - Densité | : | 10 à 15 post-larves/litre |
| - Température | : | 25 à 30° C, (couverture en toile d'ombrage pour éviter les variations nycthémerales) |
| - Salinité : 5 à 35 ‰ | : | (acclimatation progressive à la salinité du bassin de prégrossissement) |
| - Filtration | : | 50 microns |
| - Changement d'eau | : | 80 % à partir du troisième jours d'élevage |
| - Nettoyage | : | quotidien par siphonnage |
| - Alimentation | : | microparticules et granulés broyés / tamisés Nauplii d'Artémia |
| - Traitement | : | aucun |
6.4.1. Les observations de routine (cf. élevage larvaire)
6.4.2. Les changements d'eau et le nettoyage
Avant l'ensemencement des post-larves, le bassin est rempli à 80 % de son volume. Les deux jours suivants, il est rempli à 90 puis 100 %. Au quatrième pour le renouvellement commence. Le bassin est vide à 50 % pour ne laisser que 50 cm d'eau. La maille du filtre central est de 500 microns. A ce moment intervient le personnel en charge de nettoyage. Muni d'un masque et d'un tuba, il rentre dans le bassin et à l'aide d'un tuyau souple, il siphonne les zones où se sont accumulés les déchets. Il veillera à ne pas aspirer de post-larves, par sécurité un filtre sera placé à l'autre extremité afin de récupérer les post-larves qui auraient pu être siphonnées.
Pendant le siphonnage le technicien observe :
Il complète ainsi les informations receuillies par le biologiste au cours des observations à l'oeil nu et sous le binoculaire. Ces observations permettront au biologiste d'estimer la biomasse et de calculer l'alimentation.
6.4.3. Alimentation
(i) Microparticules et granulés broyés et tamisés
Après le transfert de l'élevage larvaire en nursery, l'alimentation change peu; ce sera encore des microparticules et des artémia. Un autre type d'aliment peut être utilisé, il s'agit des “Flakes”, mais leur coût est assez prohibitif et on leur préférera les granulés broyés et tamisés. Le changement qualitatif s'effectue progressivement. En général, le régime change à partir de P8 où on utilise des granulés broyés et tamisés entre 250 et 335 microns.
Pour la quantité, la ration est surtout mesurée en fonction du volume d'eau (g/m3/jour) et ne tient pas vraiment compte du nombre des post-larves. Les résultats des observations tant sur l'état des replétions que sur les restes d'aliments pourront modifier la ration journalière.
Le tableau suivant donne la ration théorique pour un bac nursery de 100 m3 contenant 1.200.000 post-larves.
| STADE | MICROPARTICULES OU GRANULES BROYES ET TAMISES | ARTEMIA Nauplii / larve | ||
| Quantités | Dimensions (microns) | |||
| mg/larve/jours | mg/m3/jour | |||
| P5 | 0,18 | 3600 | 225 – 335 | 30 |
| P6 | 0,20 | 3600 | 30 | |
| P7 | 0,24 | 3700 | 30 | |
| P8 | 0,26 | 3750 | 35 | |
| P9 | 0,28 | 3900 | 35 | |
| P10 | 0,30 | 4000 | 225 – 335 / 400 – 600 | 35 |
| P11 | 0,32 | 4200 | 40 | |
| P12 | 0,34 | 4250 | 40 | |
| P13 | 0,36 | 4400 | 40 | |
| P14 | 0,40 | 4500 | 40 | |
Tableau 4 : Ration théorique de base en nurserie
(ii) Les Artémia
Les artémia sont distribués soit, sous forme de nauplii (Ao) nouvellement éclos soit en artémia de deux jours (A2). Ceux-ci sont prégrossis dans un bac extérieur et nourris avec de la “fine” de granulé. Le changement qualitatif s'opère vers le milieu de l'élevage mais pas avant P8. La ration varie de 30 à 40 artémia/larves/jour.
6.4.4. Echantillonnage
L'augmentation du poids moyen au cours de l'élevage traduit la croissance des post-larves. La connaissance du poids moyen est particulièrement importante car elle détermine les conditions et les paramètres de transfert ou d'expédition des post-larves vers le lieu de prégrossissement.
Les post-larves sont pêchées avec une épuisette à maille fine et égouttées avant d'être menées sur une balance de précision. Tout de suite après, elle seront comptées soit à sec individuellement soit replongées dans une bassine avec de l'eau. La méthode de comptage par dilatation sera utilisée pour connaître le nombre exact de post-larves dans la bassine. Si l'échantillon contient des déchets (feuilles, sables…) ils devront être pesés séparément et déduits du poids total. La méthode de comptage individuel est plus précise mais elle n'est possible que si l'échantillon est inférieur à 300 post-larves. La perte de ces post-larves est insignifiante par rapport au nombre total en élevage dans le bac.
Les paramètres physico-chimiques de la nurserie ne sont pas nécessairement identiques à ceux du bassin de prégrossissement. Cela concerne la température et la salinité. Pour la température, l'acclimatation ne s'effectue qu'au moment du transfert ou de l'expédition des post-larves. Mais pour la salinité, elle se fait progressivement au cours de l'élevage. En effet, connaissant la salinité à atteindre, on la baisse en ajoutant après une vidange de l'eau de mer diluée, en fonction du résultat qu'on veut obtenir.
La dilution pour obtenir une salinité préalablement fixée se fait dans un bac voisin ou l'on prépare un mélange d'eau de mer et d'eau douce. Le transport de cette eau vers le bac d'élevage est assuré par une pompe éléctrique. En principe, on diminue la salinité de 2 à 3 unités par jour. Il faut éviter toutes variations brusques de la salinité au cours de l'acclimatation.
6.6.1. Transfert
Si le bassin de prégrossissement est proche de l'écloserie, on met les post-larves dans des bassines de 40 1 qu'on transporte rapidement vers le bassin. Si on observe une différence des paramètres (température, salinité), on réalise une réacclimatation sur place. Dans le cas contraire, on déverse le contenu directement dans le bassin.
6.6.2. Expédition
Lorsque l'écloserie est éloignée du site d'ensemencement des post-larves, il faut les transporter en suivant une méthodologie qui permettra d'obtenir des survies proches ou égales à 100 %. Le temps de transport est un facteur déterminant dans la programmation de l'opération. Dans le cas de la Ferme Pilote de nombreuses expéditions ont permis de fiabiliser cette technique.
(i) Le matériel nécessaire pour une expédition consiste en :
(ii) La méthode consiste à remplir les sacs plastiques avec 10 à 20 litres d'eau de mer filtrée et à salinité identique à celle de la nursery. Ensuite l'eau est saturée en oxygène pur en la faisant buller pendant 2 mn. Les post-larves sont ajoutées à une charge prédéfinie de 2, 4, 6 ou 8 g/litre.
La charge par litre correspond au poids des post-larves. Elles devront être préalablement échantillonnées pour déterminer leur poids moyen.
Le temps de transport va définir la charge / litre qui sera retenue pour des durées égales à 24 h, il est recommandé de ne pas dépasser 6 g / l. Mais pour des durées plus courtes cette charge peut être augmentée jusqu'à 10 g / l pour 10 heures et 20 g / l pour 4 heures de transport.
Une fois les post-larves tranférées dans le sac, celui-ci est gonflé à l'oxygène pur pour chasser tout l'air résiduel. Ensuite il est fermé hermétiquement avec un double élastique et entreposé dans un carton.
Le transport doit s'effecteur à l'abri de la lumière et si possible dans un milieu tempéré à 20–24° C.
La vidange totale des bassins de nurserie permet de compter les post-larves survivantes à l'élevage. Le rapport du nombre total des post-larves P12 récoltées sur le nombre total des post-larves P5 transférées par multiplié par 100 exprime le taux de survie de l'élevage.
Pour le test de salinité, se conférer au paragraphe 5.5 / Elevage larvaire
Cette unité assure l'éclosion des cystes d'Artémia salina pour donner des Nauplii qui constituent l'aliment frais pour les larves à partir du stade Zoé. En principe, la production n'exige pas de technologie sophistiquée, mais la qualité et des la quantité des Nauplii obtenus sont déterminantes pour la réussite de l'élevage larvaire. Il est donc nécessaire d'appliquer une méthodologie rigoureuse et un suivi des paramètres biotechniques.
Cette unité est sous la responsabilité du biologiste de l'élevage larvaire assisté du technicien et des ouvriers correspondants.
L'éclosion passe dans des bacs cylindroconiques en polyester de 150 l au moins. Au niveau du cône, une partie transparente est aménagée pour l'infiltration de la lumière qui permet d'attirer les nauplii vers l'évacuation. Le petit matériel consiste en filtre de 100 μ, seaux, bassines.
| - Densité | : | 1 g de cystes par litre |
| - Température | : | 28 – 30 ° C (utilisation des résistances chauffantes si nécessaire) |
| - Salinité | : | 20 – 35 ‰ |
| - Filtration | : | 5 microns |
| - Aération | : | forte, pour mettre les cystes en suspension |
| - Renouvellement d'eau | : | aucun |
| - Alimentation | : | aucune |
| - Traitement | : | antifongique (Tréflan 1 ‰ à 1 ml / 100 l) |
| - Récolte | : | 18 à 30 heures après incubation |
7.4.1. Test d'éclosion
Le taux d'éclosion des cystes après 24 heures d'incubation détermine la quantité à mettre en éclosion. Aussi, il est nécessaire de connaître au préalable ce taux :
Si le nombre de cystes/g n'est pas indiqué sur la boîte, il faut faire un comptage. Le nombre d'oeufs peut varier de 250 à 400.000/g.
Peser 5 g de cystes et les tremper dans l'eau chlorée à 2 % (2 g pour 100 ml) pendant 10 mn pour faciliter l'éclosion.
7.4.2. Ensemencement
La quantité à ensemencer est fonction :
Nettoyer et rincer les bacs avec de l'eau de mer à filtrée à 5 microns où la salinité est préalablement mesurée. Mettre en place la “tige-bouchon” et le système d'aération puis fermer la vanne d'évacuation. Remplir et ajouter du Tréflon à 1 ‰.
Peser les cystes. Tremper dans de l'eau chlorée pendant 10 mn puis rincer et versér dans le bac. Si la température est trop basse, brancher la résistance chauffante et régler le thermostat.
Remplir le tableau de contrôle (fig. 13) et enregistrer toutes les informations dans le cahier de rapport d'élevage.
| Date | Température | Salinité | Numero du bac et quantité ensemencée | Période d'ensemencement | Nombre Nauplii | Taux d'éclosion | Observation | |||
| 1 | 2 | 3 | 4 | Matin Après-midi Soir | ||||||
Fig. 13 : Fiche de production de Nauplii d'Artémia
7.4.3. Récolte et distribution
Trente minutes avant l'heure de distribution, débrancher la résistance chauffante. Arrêter l'aération et mettre le couvercle. Eclairer par une lampe éléctrique la partie transparente du cône pour attirer les Nauplii vers le bas. Cette méthode permet de séparer les Nauplii des cystes non éclos et des coques vides qui flottent en surface.
Après trente minutes, enlever la “tige-bouchon”. Ouvrir doucement la vanne d'évacuation au bas de laquelle on a mis un casque de 100 microns. Eviter le colmatage du filtre du casque en l'arrosant de temps en temps par l'eau de mer.
Si la récolte est totale, éviter de collecter les casques et les cystes non éclos. Si nécessaire, siphonner les Nauplii pour séparer.
Si la récolte est partielle, sitôt l'opération finie, fermer la vanne d'évacuation. Eteindre la lampe éléctrique. Enlever le couvercle. Remonter l'eau si nécessaire. Aérer et brancher la résistance chauffante.
Avant la distribution, faire un comptage pour pouvoir déterminer la quantité pour chaque bac d'élevage larvaire. S'il y a des restes, congeler ou reensemencer dans d'autres bacs pour les post-larves en nurserie.
Avant de réensemencer ou à chaque fin de cycle, nettoyer et laver à l'eau douce tous les matériels. Chlorer et sécher.
Bien que les élevages larvaires n'utilisent plus d'algues pour l'alimentation des larves, une description sera tout de même donnée pour connaître la technique de produire des algues.
Cette unité assure l'entretien et la multiplication des souches de phytoplancton. Les trois espèces cultivées constituent l'aliment : des premiers stades larvaires de Zoé l à Mysis. Les espèces les plus cultivées sont :
Un mois avant la date de ponte, l'unité doit démarrer la production pour arriver au moins aux volumes de 150 à 200 litres dès l'apparition des premières Zoé l en élevage larvaire.
Un biologiste assure la conduite de cette unité avec l'assistance d'un technicien pour les travaux de routine.
| - Température ambiante | : | 22° C (local climatisé) |
| - Salinité | : | 35 ‰ |
| - Filtration | : | 1 u puis stérilisation à l'U.V |
| - Renouvellement d'eau | : | culture en volume successif sans changement d'eau |
| - Aération | : | air + CO2 (0,3%) à partir de volume de 3 1 |
| - Lumière | : | artificielle fournie par 19 tubes flurorescents de 40 watts |
| - Milieu de culture | : | varié suivant l'espèce |
8.2.1. Régulation thérmique
La régulation thermique est assurée par une climatisation suffisamment puissante pour pallier le dégagement thermique des rampes d'éclairage afin de maintenir une température constante de 22° C.
8.2.2. Eclairage
Les cultures sont maintenues sous un éclairage de 19 tubes fluorescents de 40 W du type “blanc industrie”. Pour assurer une bonne répartition de la lumière, les 3 tubes sont disposés horizontalement pour les cultures de faibles volumes et verticalement pour les cultures de grands volumes.
Pour obtenir une production maximale, l'énergie lumineuse est fournie 24 heures sur 24.
8.2.3. Aération
L'air surpressé est insuflé à une pression de 0, 3 bar reglée de la salle. On y adjoint 3 % de gaz carbonique. Le débit d'air enrichi de CO2 est reglé au niveau des entrées des erlenmeyers et des gaines. Il est introduit dans les cultures à l'aide de cannes de verre fixées au bout des tuyaux cristals.
L'air apporte aux algues l'oxygène et le gaz carbonique et permet l'agitation du milieu pour maintenir les algues en suspension.
8.2.4. Réseaux eau douce - eau de mer
La méthode de culture nécessite l'utilisation de l'eau douce et de l'eau de mer.
L'eau douce est principalement utilisée pour le lavage des verreries et après distillation, elle sert à la préparation des solutions.
L'eau de mer est utilisée pour les milieux de culture. Elle est traitée de deux façons selon les volumes de cultures :
8.3.1. Milieu liquide
Il sert à entretenir et à multiplier les algues. Pour préparer un litre de milieu de culture, il faut 1 ml de solution no 1, 4, 5 et 0,1 ml de solution no 3. La solution no 4 est utilisée seulement pour les Diatomées.
| Solution no 1 | Solution no 2 | ||
| Na EDTA | 45 g | ZnCl2 | 2,1 g |
| H3 BO3 | 33,6 g | Ca Cl2, 6 H2O | 2 g |
| Na NO3 | 20 g | ||
| NaH2 PO4 2 (H2O) | 100 g | (NH4)6 MO7 O24, 4(H2O) | 0,9 g |
| MnCl2, 4 (H2O) | 0, 36 g | CuSO4, 5(H2O) | 2 g |
| FeCl3, 6(H2O) | 1, 3 g | HCl N/10 | 10 ml |
| Solution No 2 | 1 ml | ||
| Ajuster le volume à IL avec de l'eau distillée | Ajuster le volume à 100 ml avec de l'eau distillée | ||
| Solution no3 | Solution n o 4 | ||
| Chlohydrate de Thiamine | 200 mg | Na2 Si O3, 5 (H2O) | 20 g |
| Cyanocobalamine avec | 10 mg | Ajuster le volume à de l'eau distillée | 100 ml |
| Ajuster le volume à 100 ml avec de l'eau distillée | |||
| Solution no 5 | |||
| KNO3 | 10 g | ||
| Ajuster le volume à 100 ml avec de l'eau distillée | |||
A part la solution no 3, il faut les passer à l'autoclave sous une pression de 1, 5 à 1, 8 bar pendant 30 minutes. Toutes ces solutions restent stables au frais.
NOTA : Pour les Diatomées, la salinité du milieu de culture est de 28 ‰.
8.3.2. Milieu gelosé
Il sert à conserver les souches pendant une durée assez longue. On l'obtient en mélageant 9 g d'Agar - Agar dans un litre d'eau de mer enrichie de l ml de solution no l. Le mélange est ensuite passé à l'autoclave.
8.4.1. Entretien des souches
(i) Principe
Les souches doivent être repiquées tous les 7 jours afin de les maintenir en bon état. Cette durée, entre chaque repiquage, permet de conserver les cellules jeunes avec une bonne capacité de multiplication.
Le repiquage consiste à dédoubler une souche-mère pour obtenir deux souches filles. Une souche fera, au bout de 7 jours, office de souche-mère. L'autre souche fille permettra une éventuelle mise en route d'une culture.
(ii) Méthode
Une journée avant le repiquage, le biologiste prépare et stérilise tous les matériels et les solutions à l'étuve (180° C pendant 1 heure) ou l'autoclave (30mn à 1, 5–1,8 bar). Au moment du repiquage, il effectuera dans la zone stérile autour du bec Bunsen et de façon la plus aseptique possible, le remplissage des tubes de 15 ml avec le milieu no 1. Sitôt, la répartition du milieu terminé, il ajoutera 2 ml des souches mères dans chaque tube qui sera fermé avec du coton cardé et une feuille d'aluminium.
8.4.2. Phase de production
(i) Principe
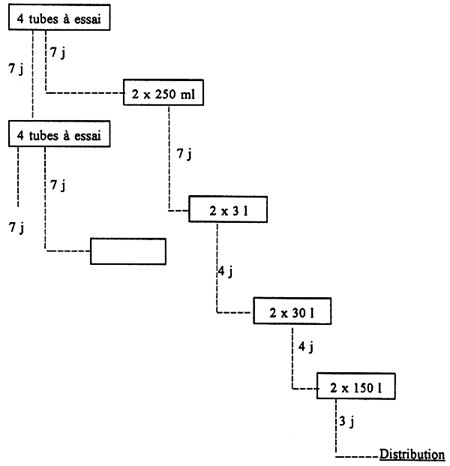
Il consiste à passer progressivement du tube à essai à un volume de 150 à 200. Cela nécessite 25 jours pour obtenir une culture utilisable en élevage larvaire.
| RECIPIENT | VOLUME DE LA CULTURE | DUREE (j) |
| Tube à essai de 20 ml | 16 ml | 7 |
| Erlenmeyer de 500 ml | 250 ml | 7 |
| Erlenmeyer de 5 1 | 3 1 | 4 |
| Gaîne plastique 20/100 l et 40 cm à plat | 30 l | 4 |
| Gaîne plastique 20/100 l et 40 cm à plat | 150 l | 3 |
Tableau 5 : Volume et durée de culture des souches d'algues
Chaque souche est cultivée suivant ce diagramme :
(ii) Méthode
Le repiquage en tube à essai et en erlenmeyer de 500 ml se fait comme la méthode décrite en 8.4.1 (i).
A partir du volume de 3 1, la stérilisation de l'eau de mer se fait par U.V après la filtration à 1 micron.
• Volume de 3 litres
• Volume de 30 litres
• Volume de 150 litres
Agir de la même façon que pour les volumes de 30 litres, mais en utilisant 3 m de gaîne plastique.
Ce volume d'eau de mer stérile sera de 120 litres et la souche mère de 30 litres.
(iii) Culture sur milieu gelosé
Dans la zone stérile autour de la flamme d'un bec Bunsen et de façon aseptique, le biologiste va piquer dans la souche-mère le bout d'une anse de Hansen ou d'une trompe de mouche. Ce repiquage se fait en balayant en zig-zag la surface gélosée. Ensuite le tube est soigneusement rebouché avec du coton cardé passé à la flamme puis recouvert d'un morceau d'aluminium. Pour finir, ce tube est rangé dans un disposoir de la salle des souches.
Le comptage s'effectue à l'aide d'une cellule de Malassez
façon suivante :
- toute la cuve (10-3 mm 3) = n × 103 cellules par ml
- une ligne (10-4 mm3) = n × 104 cellules par ml
- une case (10-5 mm3) = n × 105 cellules par ml
NOTA: On ne compte que la moitié des cellules à cheval sur les lignes.
