Rutina de limpieza de los filtros y de los tanques de almacenamiento del agua.
Sedimentadores
3 trabajan al mismo tiempo, 1 en cloración-limpieza por día.
Filtros de arena
Se hace un retrovalado después de cada utilización Se cloran cuando hay un vacío sanitario.
Tanques de reserva de agua filtrada por filtros de arena
Cloración y limpieza de cada tanque una vez/semana.
Filtros de cartuchos
Cambio y limpieza de los cartuchos 1 vez/semana por cada uno de los filtros.
Se trabaja con 2 filtros, el tercer cartucho estando en limpieza.
Tanque de reserva de agua filtrada por cartuchos
Cloración y limpieza de cada tanque 1 vez/semana.
Tanque de bombeo de agua para larvas y maduración
Se cloran y limpian una vez a la semana, en coordinación con la cloración de su red respectiva.
- RUTINA Y METODO DE CRIA
I.1. Observaciones tanques y larvas in situ
I.2. Conteo larvas
I.3. Conteo algas
I.4. Observaciones larvas al microscopio
- Recambios de agua
Finalidad, tabla según estadio, proceso EDTA
- Alimentación
III.1. Generalidades
III.2. Phytoplancton
control
III.3. Naupliis de Artemias
III.4. Alimentos inertos
sustituto Artemias
- Pesca y despacho
IV.1. Preaclimatación
IV.2. Hora
IV.3. Pesca
IV.4. Empaque
- Producción naupliis Artemias
V.1. Generalidades
V.2. Procedimiento
almacenamiento y previsión necesidades
V.3. Otras técnicas
Decapsulación
V.4. Precauciones
- ENFERMEDADES Y PATOLOGIAS, PREVENCIONES
- Bacterias e infecciones
I.1. Descripción enfermedades
I.2. Bacterias involucradas
I.3. Profilaxia
I.4. Tratamientos
I.5. Método bacteriología
- Hongos
II.1. Infección
II.2. Tratamiento
- Virus
III.1. Virus conocidos
III.2. Baculo virus
III.3. IHHN
III.4. Profilaxia
- Otras enfermedades
IV.1. Ciliados y bacterias filamentosas
IV.2. Estómago negro
La producción de un departamento de fitoplancton debe ser un flujo diario de algas. Para asegurar este flujo, el trabajo debe ser una rutina diaria y constante, constituida por muchos detalles pues hay muchas etapas y volúmenes. La falla de uno de estos detalles puede cortar el flujo, con consecuencias graves en larvicultura.
Por eso hay que establecer la rutina en sus aspectos cualitativos y cuantitativos de la manera más precisa posible, para que el departamento gire diariamente, asegurando cada etapa de producción. Los esquemas de producción y el cronograma diario de trabajo constituyen los puntos de referencia básicos indispensables para esta rutina.
Un departamento de producción es un sistema que evoluciona por cambios o mejoras en los equipos, la producción necesaria, y las técnicas de trabajo. Los puntos de referencia precitados deben modificarse de acuerdo con estos cambios, pero siempre deben estar presentes y ser actualizados.
Este documento presenta el protocolo de producción de acuerdo con el estado actual del departamento, dando un modelo en el cual puede incluirse cualquier cambio. Presenta también recomendaciones de trabajo.
Nota: Los datos cuantitativos están diseñados para la producción diaria de 5 m3 de Diatomeas (1 de Th, 4 de CH) y 1,5 de flagelados Tt, lo que corresponde a las necesidades máximas de 1 nave de larvicultura.
Las modificaciones de estos datos para las necesidades de las 2 naves conciernen solamente los tanques exteriores y se les presenta en el párrafo III.2.
Th - Thalassiosira
Ch - Chaetoceros
Tt - Tetraselmis
I.1. PRINCIPIO DEL METODO DE CULTIVO SECUENCIAL
Un mismo cultivo, desde la cepa hasta la etapa exterior final es transferido sucesivamente en volúmenes crecientes, eso, cada vez que lleva un tiempo de cultivo determinado correspondiente a su concentración y calidad óptima.
A cada volumen, y para cada especie, se le atribuye un número de días de crecimiento correspondiente a su concentración óptima, pero con el criterio fundamental que los cultivos deben ser siempre mantenidos en fase de crecimiento exponencial, lo que significa un buen estado fisiológico de las células.
Una vez establecido este número de dias, es imperativo respetarlo y nunca un cultivo debe envejecer.
Se cultivan para la alimentación de larvas.
Diatomeas. Chaetoceros Sp. (Calcitrans, Gracilis, Ceratosporum, etc.) Eventualmente Thalassiosira, Sp.
Flagelado. Tetraselmis Sp. (Chui, Suesica, Tetratehele, etc.)
Que sea para Ch y Tt, generalmente se pone en producción una especie de cada género, y se guarda otra reserva de cepas.
Las secuencias de volúmenes utilizados para cada especie son las siguientes :
a) Tetraselmis
| Volumen recipiente | = 100 ml | 250 ml | 1 lt | 5 lt | 70 lt | 0,5 m3 | 12 m3 |
| Volumen cultivo | = 75 ml | 175 ml | 0,8 lt | 4 lt | 40 lt | 0,5 m3 | 4 m3 |
| Cepas | Volúmenes menores | Int. | Exterior | ||||
b) Chaetoceros
| Volumen recipiente | = 30 ml | 250 ml | 1 lt | 5 lt | 70 lt | 1 m3 | 1 m3 | 12 m3 |
| Volumen cultivo | = 15 ml | 175 ml | 0,8 lt | 4 lt | 40 lt | 0,5 m3 | 1 m3 | 4 m3 |
| Cepas | Volúmenes menores | Int. | Exterior | |||||
I.4. DIVISION DE LOS VOLUMENES EN AREAS DISTINTAS
Véase esquema precedente.
Area “estéril”
Sala de cepas :
En esta sala se trabajan y cultivan las cepas.
Tubos de 15 y 30 ml. Erlens de 100 ml sin aeración.
Se siembran Erlens de 250 ml.
Condiciones asépticas : agua, nutrientes, recipientes,
material, estériles.
Sala de cultivos menores :
Erlens 250 ml, l lt, 5 lt, se siembran y cultivan en
esta sala a excepción de los Erlens de 250 ml que se
siembran en sala de cepas.
Todos los cultivos tienen aeración.
Condiciones asépticas : agua, nutrientes, recipientes,
material, estériles.
Area “limpia”
Sala de cultivos interiores :
Tanquetas de 70 lt. Agua filtrada 8 micras y pasada
por lámpara ultravioleta.
Condiciones no asépticas.
Area exterior :
Tanques de fibra de vidrio de 0,5 m3, 1 m3 y 12 m3.
Agua filtrada 8 micras y pasada por lámpara
ultravioleta
Con el fin de informar sobre el alimento disponible, controlar la producción y prever cualquier problema, cada día se revisan y cuentan bajo microscopio muestras de los cultivos siguientes :
Cultivos exteriores destinados a la alimentación (mañana y tarde).
Todos los cultivos destinados a ser transferidos este día.
Cepas destinadas a iniciar la producción y a repicar.
Se utilizan diferentes fertilizaciones según la etapa de los cultivos.
Se utilizan productos puros (calidad analítica) para las etapas estériles, y productos técnicos para las etapas siguientes.
II.1. CEPAS Y CULTIVOS MENORES
Se recomienda utilizar el medio Guillard F/2 de la fómula más completa que el medio A.M.
Fórmula de preparación del medio Guillard F/2
| - | Solución 1 | ||
| Na NO3 | 75 g | } 1 lt de agua destilada | |
| Na H2PO4 | 5 g | ||
| - | Solución 2 | ||
| Na2 Si O3 | 30 g | } 1 lt de agua destilada | |
| - | Solución 3. Metales trazas | ||
| CuSO4 | 0,98 g | | | |
| ZnCl2 | 1,05 g | | | |
| CoCl2 | 1 g | } 100 lt de agua destilada | |
| MnCl2 | 18 g | | | |
| Na2MoO4 | 0,63 g | | | |
| - | Solución 4 | ||
| Na2EDTA | 4,36 g | ||
| FeCl3 | 3,15 g | } 1 lt de agua destilada | |
| 1ml solución 3 | | | ||
| - | Solución de vitaminas | ||
| B1 - Tiamina 200 mg | | | ||
| B12 - Cianocobalamina | 10 mg | } 100 lt de agua destilada | |
| H - Biotina 10 mg | | | ||
- La solución 3 es una solución stock de metales trazas. Cuando se prepara, hay que añadir HCl para favorecer la dilución.
La solución madre de metales es la solución 4, constituida de EDTA FeCl3 y de 1 ml de la solución stock de metales (solución 3).
- Las soluciones 1, 2, 4, se utilizan a razón de 1 ml/1 de cultivo (solución 2 solamente para Diatomeas).
Las vitaminas se utilizan en dosis de 0,1 ml/lt de cultivo.
- Se preparan 1 lt de las soluciónes 1 y 4 y, 100 ml de la solución 3 y se guardan en refrigeración.
- Se esterilizan las soluciones 1 y 4 en cantidades reducidas (100 a 200 ml cada vez), según las necesidades, en Erlems de 250 ml.
- Solución Metasilicato
Para evitar la precipitación al esterilizar la solución 2 :
Pesar 3 g de metasilicato. Poner en un Erlems de 250 ml tapado. En otro Erlens 100 ml de agua destilada. Esterilizar los dos. Cuando ambos están muy calientes todavía, se vierte (al mechero) el agua en la fiola conteniendo el silicato, de tal forma, se obtiene una solución bien clara. (Se puede hacer lo mismo con 6 g y 200 ml).
- En producción total, 1 lt sirve para 25 días aproximadamente.
- Preparación de las soluciones de cultivo.
El agua se esteriliza en botellas de 5 lts.
Preparar las soluciones para cultivos de 4 lts (4 por día).
Son 4 ml de cada solución/botella (excepto Tt que no necesitan silicatos).
16 ml para las 4 botellas. Utilizar pipetas de 25 ml.
Chupar 16 ml de cada solución madre. Repartir equitativamente.
Vitaminas : 1,6 ml a repartir en las 4 botellas, utilizando una pipeta de 2 ml
Repartir agua estéril en botellas de 1 lt para cultivos de 1 lt y cepas.
4 botellas de 1 lt para producción.
1 botella de 2 lt para cepas de Diatomeas
1 botella de 1 lt para cepas de tetraselmis
7 ml de cada solución madre. Utilizar pipeta de 10 ml
para cada solución madre.
Las soluciones para cepas sirven para sembrar 250 ml, 100 ml y tubos. Se necesitan al día aproximadamente 1,3 lt para Diatomeas y 0,5 lt para Tt.
Tener siempre en refrigeración 1 botella de 2 lt para Diatomeas y otra de 1 lt para Tetraselmis. Cuando se empiecen a utilizar, volver a prepararlas para que nunca falten soluciones para cepas. Guardar en refrigeración. Sacarlas de la refrigeradora por la mañana y trasladarlas en sala de cepas para que tengan una temperatura adecuada.
Fertilización según normas cubanas. Hacer soluciones para no tener que pesar para cada tanqueta.
| Fertilización mg/l | de cultivo | Solución | g/l |
| KNO3 | 200 | 200 | | |
| Superfosfato | 20 | 20 | | |
| } Sol. A | |||
| Na2EDTA | 10 | 10 | | |
| FeCl3 | ? | 1,5 | | |
| Na2SiO3 | 16 | 16 | } Sol. B |
Se utilizan 1 ml/l de cultivo de las soluciones A y B (B para Diatomeas). En las normas, la fertilización para flagelados es doble de la que se presenta aqui (respecto a nitratos y fosfatos) que corresponde a diatomeas, pero sin embargo esta fertilización puede ser suficiente también para flagelados.
Con 1 litro de solución hay para 5 días de producción aproximadamente.
Cada 10 días, se puede preparar 2 litros de cada solución. 1,5 mg de hierro corresponde al orden de las dosis utilizadas en varios medios ; incluirla en la solución da más precisión que el número de gotas de una solución saturada.
• Vitaminas
Utilizar las dosis indicadas en las normas. Echar en los volúmenes en el momento de sembrarlas.
Utilizar las fertilizaciones según las normas en vigor en Cuba (probablemente la mitad de estas concentraciones serían suficiente). Véase informe sobre este tema.
Con el fin de poder garantizar la producción y el trabajo diario en función del aliemento requerido para determinadas fechas, es importante establecer esquemas de producción que definen para cada especie :
Número de días atribuidos a cada volumen
Número de cultivos diarios de cada volumen
Número total necesarios de cada volumen
Tiempo total de la secuencia de producción
Volúmenes diarios de agua para esterilizar
Cantidad de cristalería en servicio
Cronogramas de repique de cepas
Para simplificar se tratan separadamente los volúmenes de producción y las cepas.
III.1. ESQUEMA DE PRODUCCION PARA VOLUMEN DE PRODUCCION
Producción requerida : 5 m3 de Chaetoceros y 1,5 m3 de Tetraselmis al día.
| Diatomeas | Chaetoceros | Flagelados | Tetraselmis | ||||
|---|---|---|---|---|---|---|---|
| Volumen Cultiv. | No de Vol./día | No días | No Vol. Total | No Vol. Total | No días | No de Vol./día | Volumen Cultiv. |
| 4 m3(8) | 1 | (3) 2 | 3(4) | 3(4) | 5–6 (7–8) | 1/2 | 3 m3 (6 m3) |
| 1 m3 | 2 | 5(3 2)* | 12 | 7 | 6 | 1 | 0,5 m3 |
| 40 lt | 3 | 4 | 15 | 7 | 6 | 1 | 40 lt |
| 4 lt | 3 | 3 | 9 | 4 | 4 | 1 | 4 lt |
| 1 lt | 3 | 3 | 9 | 4 | 4 | 1 | 1 lt |
| 175 ml | 4 | 4 | 16 | 10 | 5 | 2 | 175 ml |
Ver comentario en II 2
Modificación del esquema de producción
Producción requerida : 4 m3 de Chaetoceros
1 m3 de Thalassiosira
1,5 m3 de Tetraselmis
| Volumen Cultivo | No de Vol./día | No días | No Vol. Total | No Vol. Total | |||||||
| Diat. | Tt | ch | Th | Tt | ch | Th | Tt | ch | Th | Tt | |
| 4 m3 | 3 m3 | 1 | - | 1/2 | 2 | - | 5-6 | 3 | - | 3 | 6 |
| 1 m3 | - | 1 | 1 | - | 5 | 5 | - | 6 | 6 | - | 12 |
| - | 0,5 m3 | - | - | 1 | - | - | 6 | - | - | 6 | 6 |
| 40 lt | 2 | 1 | 1 | 4 | 4 | 6 | 10 | 5 | 7 | 22 | |
| 4 lt | 2 | 1 | 1 | 3 | 3 | 4 | 6 | 3 | 4 | 13 | |
| 1 lt | 2 | 1 | 1 | 3 | 3 | 4 | 6 | 3 | 4 | 13 | |
| 175 ml | 4 | 2 | 2 | 4 | 3 | 5 | 16 | 6 | 10 | 32 | |
| 21 | 18 | 30 | |||||||||
III.2. COMENTARIOS DE LOS ESQUEMAS DE PRODUCCION
Producción para 1 nave
Chaetoceros (sin Thalassiosira)
De los 2 tanques de 1 m3 que se producen al día, 1
sirve de alimentación y el otro de inóculo para l
tanque de 12 m3 con 3 m3 de agua, dando 4 m3 de
alimento) en 2 días.
Así se producen 5 m3 al día
Se dispone de 1 tanqueta de 40 lt al día para iniciar 1
bloom en un nuevo tanque de larvas
Tetraselmis
Se siembra 1 tanque de 0,5 m3, más 2,5 m3 de agua en un
tanque de 12 m3, esto se realiza cada dos días. Se
utiliza este cultivo los quintos y sextos días, lo que
da una disposición en alimento de 1,5 m3 al día.
Modificación del esquema para dos naves
Chaetoceros : 8 m3 al día Mismo esquema que para 1 nave hasta la producción de 2 tanques de 1 m3 al día. Ambos sirven de inóculo para 1 mismo tanque de 12 m3; 2 m3 de inóculo más 6 m3 de agua dan 8 m3 de alimento en 3 días.
Tetraselmis
Mismo esquema que para 1 nave hasta la producción de 1
tanque de 500 lt al día : 2 de estos tanques (de 2 días
sucesivos) sirven de inóculo para 1 mismo tanque de
12 m3; 1 m3 de inóculo más 5 de agua dan 6 m3 de
alimento que se usan los séptimos y octavos días, lo
que da una disposición de 3 m3 al día.
Selección : Para algunas etapas, se deja una posibilidad de selección (1 nave)
Chaetoceros
| 200 ml → | 1 lt | Se utilizan 3 de 4 |
| 40 lt → | 0,5 m3 | Si no hay necesidad de iniciar un bloom, se utilizan 2 de 3. |
Tetraselmis
Se utiliza uno de los 2 tanques de 500 lt (de 2 días
sucesivos).
Eventualmente, se puede descartar un cultivo al nivel
de la tanqueta si se ve que se presenta malo.
Tiempo de crecimiento/tiempo de rotación
Hay que distinguir entre el tiempo de crecimiento y el tiempo de rotación de un volumen.
Por ejemplo, para los tanques de 12 m3 Chaetoceros. El tiempo de cultivo es de 2 días pero el tiempo de rotación es de 3, porque al segundo día el tanque sigue ocupado durante el día y se limpia al final del mismo, de tal forma que se pueda volver a sembrar solamente al día siguiente.
Para los tanques de 1 m3 Chaetoceros, se podría ganar un sexto día de crecimiento utilizándolos por la mañana, uno para sembrar y el otro para alimentación, volviendo a llenar y sembrarlos al medio día. En la práctica es dificil, por eso se considera un tiempo de cultivo de 5 días y un tiempo de rotación de 6.
Tanquetas Diatomeas
En realidad faltan 3 puestos. Hay 12 puestos. Se pueden guardar los cultivos 4 días, si se vuelven a utilizar los 3 puestos el mismo día que se desocupan. Para eso, hay que tener 3 tanquetas adicionales para no tener que esperar para lavar las que salen ese mismo día. Pero para que la temperatura del agua de los tanques tenga tiempo de bajar (sea homogénea con la temperatura de los Erlens) sería conveniente llenar las tanquetas por la tarde para sembrarlas al día siguiente por la mañana, dejándolas la noche con su tapa.
En lo que concierne a los Erlens de vidrio, el número total de volumen indicado corresponde al número de volúmenes en producción a decir presentes en los algarios. Eso permite organizar los algarios en especies, volúmenes y fechas.
Hay que respetar los tiempos de cultivo atribuidos a los volúmenes para no desorganizar la producción, los cultivos de revisión y de siembra (el único volumen que tiene una fluctuación de más o menos 1 día es el 0,5 m3 Tetraselmis). Si por algún problema un día no se respeta el tiempo de uno o varios cultivos, hay que rectificar la desorganización provocada para volver lo más pronto posible al esquema de producción establecido.
Según los resultados obtenidos, por las cepas utilizadas, o por cualquier cambio se puede decidir cambiar el tiempo atribuido a un volumen, o eventualmente cambiar la secuencia de los cultivos. En este caso, hay que volver a establecer un esquema de producción (para Ch, se puede probablemente bajar el tiempo en volúmenes de 1 lt, ver suprimir esta etapa).
En caso de falta de inóculo para sembar un volumen, se puede hacer un repique con otro cultivo del mismo volumen a fin de evitar un hueco en la producción. Pero eso debe tener un carácter excepcional y nunca utilizarse como método de trabajo.
III.3. ESQUEMA PRODUCCION DE CEPAS
Este esquema está de acuerdo con el esquema precedente modificado para incluir producción de Thalassiosira.
Para sembrar el primer volumen de producción (250 ml) se utiliza:
Esquema Chaetoceros
Los inóculos de los Erlens de 250 ml son tubos con 15 ml de cultivo.
Se utilizan tubos como inóculos para tener más posibilidad de selección y renovación rápida de las cepas de producción, y porque las cepas de esta especie resultan mejor en tubos que en Erlens.
Se necesitan 4 tubos al día para sembar los 4 Erlens de 250 ml al día.
Los tubos se utilizan los quintos y sextos días de crecimiento. Se hace el repique el sexto día.
Así, se necesitan 3 series de tubos con 2 días de intervalo entre ellos.
Cada serie lleva 11 tubos :
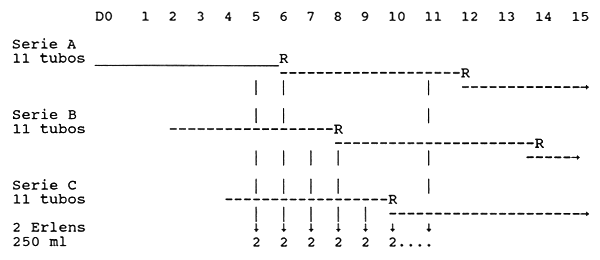
Al quinto día se revisan todos los tubos de 1 serie, se marca el mejor que servirá para hacer el repique.
Los repiques de tubo en tubo se hacen con inóculo de 0,7 ml en cada tubo.
Se van a tener 11 × 3 = 33 tubos de producción
Estos tubos deben mantenerse en buen estado y renovarse regularmente (véase capítulo siguiente. Gestión del stock de cepas).
Thalassiosira
Las cepas de producción, a decir las que sirven de inóculo para los Erlens de 250 ml, son Erlens de 100 ml. Estos Erlens se repican sobre ellos.
Tiempo de crecimiento Erlens 100 ml - 6 días
Volumen de inóculo para repique 100 ml/100 ml-15 ml
Volumen de inóculo para siembra Erlens 250 ml-25 ml
Se necesitan 2 Erlens de 100 ml al día.
Uno sirve de inóculo para los 2 Erlens diarios de 250 ml
El otro (el mejor de los dos) sirve para repique de los dos Erlens de 100 ml que se utilizarán después de cinco días de crecimiento.
Se tienen 6 × 2 = 12 Erlens 100 ml en el algario.
Iniciación. Renovación de los Erlens de 100 ml
En caso de paro largo de la producción, o de baja de la calidad de los 100 ml, hay que volver a crear la serie de Erlens 100 ml a partir de tubos.
En este caso :
Se necesitan 2 tubos/día durante 6 días para sembrar los Erlens.
Se hacen 2 series de 8 tubos a 3 días de intervalo.
Se utilizan los tubos los días 6, 7 y 8 de crecimiento
Se hace el repique el dí a 6
Esquema producción Thalassiosira
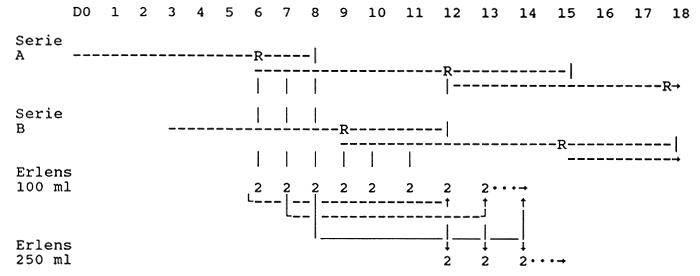
Se revisan los 8 tubos el día 6 y se utiliza el mejor para hacer el repique. Al octavo día se controla la calidad de 1 tubo para verificar que no han envejecido.
Transcurren 12 días desde el tubo hasta el ler Erlens de 250 ml.
Una vez iniciada la serie de Erlens 100 ml, se pueden mantener las 2 series de tubos con menos tubos, 4 por serie por ejemplo.
Estos tubos deben renovarse regularmente (véase gestión de cepas).
Tetraselmis
Las cepas de producción son Erlens de 100 ml, que se repican sobre ellos.
Tiempo de crecimiento Erlens - 8 días
Volumen del inóculo para los 2 Erlens 100 ml - 20 ml
Volumen de inóculo para siembra Erlens 250 ml - 25 ml
Se necesitan 2 Erlens de 100 ml al día
El otro para hacer 2 Erlens de 100 ml que se utilizarán después de los 8 días de crecimiento.
Hay 8 × 2 = 16 Erlens de 100 ml en el algario.
Iniciación. Renovación de los Erlens de 100 ml
Por las mismas razones vistas anteriormente se puede necesitar renovar la serie de Erlens 100 ml a partir de tubos.
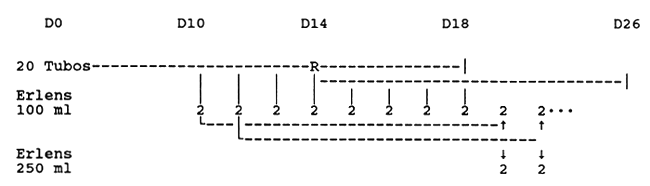
Se necesitan 19 días desde el tubo hasta el Erlens 250 ml.
Se revisan 10 tubos el décimo día, 10 el día catorce. Se aislan los 2 mejores para el repique.
Una vez iniciada la serie de Erlens 100 ml, se sigue manteniendo la serie de tubos, pero se puede disminuir la cantidad de tubos, 6 por ejemplo.
Nota :
Los tubos que se utilizan para Thalassiosira y Tetraselmis, son tubos pequeños (por falta de una cantidad suficiente de grandes) con un volumen útil de 7 ml.
Los repiques se hacen con 0.7 ml aproximadamente.
Se recomienda tener un calendario de los repiques de las diferentes series de tubos.
Guardar siempre 1 tubo de la serie vieja, el tiempo de verificar que el repique funcionó bien.
Número total Erlens y tubos.
Las cepas constituyen la base de toda la producción. De su calidad depende la calidad de toda la producción. Por eso, hay que prestar mucha atención y seguir su evolución para controlar, previniendo a tiempo cualquier problema. Lo fundamental es trabajarlos con puntualidad, respetando los esquemas atribuidos.
Los esquemas descritos en el pasaje precedente constituyen una parte de la gestión de las cepas, permitiendo tener el número de tubos y de Erlens necesarios para la producción, la otra parte es el trabajo que debe hacerse sobre estas cepas con el fin de mantener su calidad y renovarlos.
Como hemos visto, cuando se hace un repique se utiliza siempre el mejor tubo, para ir mejorando los tubos por selección. Pero con el tiempo, siempre aparecen células degeneradas en los cultivos, suciedad, un fenómeno global de envejecimeinto de las cepas. Por eso, hay que renovarlos, seleccionando las mejores células disminuyendo los niveles de bacterias.
Se utilizan dos métodos : Dilución y siembra en medio fisico.
a) Método de diluciones sucesivas
El principio es hacer diluciones sucesivas de 1 tubo, de 10 en 10, hasta obtener una serie de tubos que tienen una probabilidad estadística de una célula/tubo.
El tubo con el cual se hace este proceso debe ser de buena calidad para tener la oportunidad de obtener, después de tres semanas, varios tubos procedentes cada uno de una célula de buena calidad. Este método permite volver a tubos de población homogénea.
- Esquema diluciones (véase p. 65)
La serie de tubos contenida demora alrededor de 3 semanas para crecer. Generalmente, no crecen todos al mismo tiempo ya que al inicio pueden tener de O a algunas células.
Se revisan con puntualidad cuando crecen, y se utilizan los mejores.
- Diluciones “sencillas” (véase p.66)
a) Cultivos sobre medio sólido
El principio es de cultivar las células sobre el agar en caja de Petri.
Las células de un cultivo se reparten en la superficie del Agar. Crecen colonias de células diferentes ; una vez que han crecido, se recogen las células buenas y se siembran en tubos en medio líquido.
Preparar medio sólido con agua de mar y nutrientes y 1 ó 2 % Agar (10 – 20 g/lt).
Esterilizar.
Añadir vitaminas justo antes que se solidifique el medio cuando la temperatura esté bajando (aproximadamente 45°C).
Repartir el medio en cajas de Petri. Esperar que se solidifique y enfríe.
Distribuir una gota del cultivo en crecimiento en la superficie de cada placa, en forma de zigzag. Dejar crecer con luz.
Chequear al ojo el desarrollo de las células en las cajas, generalmente demoran como 1 ó 2 semanas. No abrir las cajas.
Observar al microscopio la repartición y la calidad de las células, la eventual presencia de bacterias, hongos etc. Sin abrir las cajas. Apuntar en las cajas los lugares donde hay buenas células sin bacterias.
Recoger células, apuntando con un alambre, de la manera más precisa posible, abriendo la caja al lado del mechero. Sembrar las células en tubos con medio líquido, utilizar las mejores.
Este método permite disminuir el nivel de bacterias, recogiendo las células en partes donde no se ven bacterias.
Se pueden utilizar también tubos inclinados con medio sólido, sembrando células en la superficie. Cuando han crecido las células, estos tubos se pueden guardar en refrigeración a 3 ó 4°C, donde no se desarrollan más por varios meses.
Los tubos obtenidos con estos métodos sirven para remplazar los tubos “viejos” de las series. Se utilizan para hacer series nuevas, descartando las viejas. Aunque los tubos de las series parecen buenos, hay que tener siempre series nuevas en formación por esos métodos, teniendo así reservas de cultivos para cualquier problema que pueda suceder.
Globalmente la idea es de siempre aprovechar los mejores tubos multiplicándolos e incluyendolos en las series de producción.
IV.1.2. Frecuencia de utilización de los métodos
Chaetoceros 1 dilución al mes 4 placas cada 15 días (cada vez hacer cada placa con tubos diferentes y de diferentes series.
Tetraselmis 4 placas cada 15 días
Thalassiosira 4 placas cada 15 días
IV.1.3. Ejemplo de renovación Chaetoceros
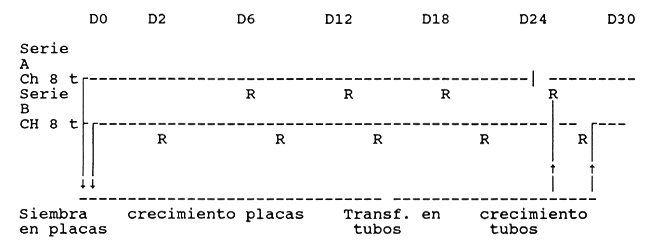
Se renuevan las series A y B.
IV.1.4. Método de desinfección por antibióticos
Si se trabaja de manera correcta, el nivel de bacterias no debe afectar los cultivos. También el cultivo en placas permite reducir la cantidad de bacterias. Cuando las células están en buen estado fisiológico, no dejan a las bacterias desarrollarse. Por eso, antes de pensar en desinfección con antibióticos hay que pensar en mantener las cepas en buen estado, con un trabajo puntual de renovación.
Se recomienda evitar el uso del cloranfenicol que puede ser necesario en tratamiento de larvas, y su utilización en fitoplancton crearía antibioresistencias disminuyendo su eficiencia en cría de larvas por mucho tiempo.
Esquema de método de desinfección
| Penicilina sulfato 5 | Solución antibióticos dosis mg/ml |
| Estreptomicina sulfato 1,6 | |
| - Preparar 10 ml de solución | |
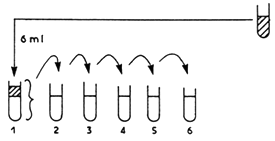 | 10 ml solución antibiótica |
| 6 tubos con 6 ml de cultivo cada uno. |
En tubo # 1 : 6 ml cultivo más 6 ml antibióticos.
En tubo # 2 : 6 ml cultivo más 6 ml mezcla del tubo # 1.
En tubo # 3 : 6 ml cultivo más 6 ml mezcla del tubo # 2.
El tubo # 6 tiene 1/64 de la concentración en antibiótico
de la solución inicial..
Esquema del método de diluciones sucesivas
Diluciones sencillas : Para tener una respuesta más rápida, se puede hacer otro tipo de dilución más sencilla, de la manera siguiente : Además del repique normal de una serie de tubos se hace un repique con un inóculo más pequeño, inoculando alrededor de 0,01 ml en cada tubo (1 gota). Aplicada a los tubos de Ch, este método puede ayudar a mantener la calidad de estos tubos.
IV.2. ORGANIZACION DE LA SALA DE CEPAS Y RECOMENDACIONES
Tenemos entonces para cada especie en producción :
Cultivos inóculos de producción : Erlens 100 ml Tt y Th igual a 28 Erlens. Tubos Ch, 3 series igual a 33 tubos grandes.
Tubos de renovación para Erlens : Tt 1 serie (de 8 a 20) Th 2 series (de 8 a 16)
Tubos o placas de mantenimiento : Renovación de cepas.
Además, se puede tener otras cepas de las mismas o diferentes especies que no se incluyen en la producción. Tener al máximo 2 cepas diferentes por especie ; por no tener muchos tubos, las cepas o especies que no se utilizan en producción pueden guardarse con una concentración más baja de nutrientes (Guillard F/8, por ejemplo), para disminuir la frecuencia de repiques.
Se recomienda tener un calendario de trabajo en cepas, indicando las fechas de repique que se debe respetar para las diferentes especies y series.
En los algarios, las cepas deben organizarse por especies, atribuyendo lugares fijos a las diferentes series de tubos y a los Erlens. Una organización en el espacio precisa y constante de las cepas da una información visual rápida muy importante (se ve enseguida si sobra o falta algo).
Todos los tubos y Erlens se agitan una vez al día.
Se preparan soluciones separadas para uso exclusivo en sala de cepas.
Luz
Para Chaetoceros, 1 fluorescente/algario.
Para Th y Tt, 2 fluorescente/algario.
Temperatura.
Mantener alrededor de 22 – 23°C.
Personal
Limitar estrictamente la entrada, permitida solamente a
las personas que tienen que hacer un trabajo dentro.
Dejar las puertas cerradas.
Limitar lo más posible el número de personas que se ocupan de las cepas.
Menos personas se encargan y responsabilizan de las cepas, más tienen conocimientos del estado de las cepas, de su evolución, de los trabajos de renovación en curso, y entonces de lo que hay que hacer.
Mejorando, asi, la calidad de su atención y de su trabajo.
Normalmente, de esta sala se encarga el responsable del área con su sustituto.
V - METODO DE TRABAJO ESTERIL, RECOMENDACIONES, MANIPULACIONES
Las manipulaciones se hacen en las salas correspondientes, cerca del mechero.
Tubo, cajas de Petri, Erlens 100 ml, Erlens 250 ml : Sala de cepas/l lt, 4 lt : sala de volúmenes menores.
Mientras se hacen las manipulaciones en el mechero, solamente la persona que hace la manipulación debe estar presente, y nadie puede entrar o salir de la sala.
Las manipulaciones de siembra o de introducción de nutrientes deben hacerse de la manera siguiente :
Tener cuidado de no quemar el inóculo con la llama.
Respecto a las muestras, se recomienda cojer muestras de los 250 ml y l lt cerca de la llama para que sea homogenea en la técnica aséptica.
No guardar de l día para otro la botella de agua estéril ya abierta.
Para repiques en tubos : Para facilitar manipuleo, vertir solución en Erlens 250 ml, y del Erlens en los tubos. Marcar los tubos al nivel deseado, y vertir del Erlens en el tubo sin utilizar pipeta.
Utilizar la pipeta adecuada para inocular toda la serie de tubos que se van hacer.
Ejemplo : 11 tubos de Ch aproximadamente 0,8 ml de inóculo de tubo.
Chupar 5 ml con pipeta de 10 ml. Inocular sucesivamente todos los tubos ya llenados con la solución, cada uno con 0,8 ml.
Se recomienda, en producción, esterilizar todos los días las mismas cantidades de agua, recipientes y cristalería necesarias cada día, a fin de crear una rutina. Se recomienda tener un juego en reserva de todo el material, para que la producción no sea afectada en caso de falta de luz, falla del equipo de esterilización, etc.
El material que se está utilizando no es para el día siguiente, sino para el segundo día.
Material y agua a esterilizar para la producción (1 m3Th, 4 m3 CH, 1,5 m3, Tt).
Agua :
| Cultivos 4 lt : 4/día | 4 Erlens × 3 litros de agua de mar |
| Cultivos 1 lt : 4/día | 2 Erlens × 4 lt/día de agua de mar |
| Cultivos : 3lt/día | 2 Erlens × 4 lt/día de agua de mar |
Estufa
Erlens de 1 lt : 5
Erlens de 2 lt : 1
Erlens 250 ml : 8 más 2 de reserva para repiques en tubos
Erlens 100 ml : 4
Pipetas para preparar soluciones :
25 ml : 3
10 ml : 3 más l para repique
2 ml : 3
1 ml : 3
Tener en permanencia de reserva para repiques 2 pipetas de 10 ml
3 pipetas de 10 ml
Prever para diluciones 6 pipetas de 1 ml y 2 de 10 ml
Recomendaciones
| Esterilización del agua | : 35 min. 120°C en el autoclave. |
| Material seco | : 20 min. 150°C en la estufa |
Erlens de 5 lt para producción ; esterilizar con el tapón de caucho y varillas puestas, recubriendo con un papel.
Pipetas. esterilizar con un algodón en la parte superior, para filtrar la entrada de aire directo del medio ambiente.
VI.1. CRONOGRAMA DE TRABAJO DIARIO (Véase cronograma adjunto)
Es importante tener planificado el trabajo diario, que en producción debe ser el mismo todos los días. El cronograma de trabajo establecido en rutina tiene los objetivos siguientes.
Ordenar el trabajo en función de los imperativos de trabajo y de gestión sanitaria.
Repartir las diferentes tareas y responsabilidades entre los miembros del personal en función de estos mismos imperativos.
Tener una relativa seguridad que nada queda olvidado.
Facilitar el control del trabajo.
VI.2. COMENTARIOS SOBRE EL CRONOGRAMA DE TRABAJO DIARIO
Recomendaciones tanquetas y cultivos exteriores.
Sacar afuera temprano en la mañana las tanquetas destinadas para sembrar. Disponerlos al lado de su respectivo tanque exterior, con aeración. Vertir un tanque exterior al mediodía.
Llenar enseguida con agua de mar las tanquetas destinadas a ser sembradas para que la temperatura tenga un tiempo para bajar. Fertilizar y sembrar al mediodía.
Revisión cultivos
Los cultivos destinados a la alimentación deben revisarse 2 veces al día, pues las concentraciones pueden cambiar de la mañana a la tarde, y un tanque bueno puede haber caido por la tarde.
Se cuentan los cultivos y se revisa la calidad de las células, así como una eventual contaminación. Se anotan estas observaciones.
En función de las observaciones, se recomienda hacer una lista de transferencias para evitar cualquier olvido o malentendido.
División tareas
La división de las tareas entre técnicos y ayudantes ; interior, exterior, es para evitar movimientos de fuera para dentro y viceversa, a fin de limitar probabilidades de contaminación debida a estos movimientos.
Método bombeo y distribución algas en larvicultura
Bombear el cultivo requerido hasta la poseta con la bomba sumergible.
Llenar con agua de mar la poseta de al lado.
Según las instrucciones, bombear la cantidad de fitoplancton requerida hasta larvicultura, midiendo con la calibración del tanque.
Una vez bombeada la cantidad deseada, cerrar la válvula de la poseta de algas y abrir la de la poseta de agua de mar siguiendo bombeando durante 1 a 2 min. para empujar el fitoplancton quedado en la red.
Al aviso, el personal de larvicultura debe apagar el bombeo y cerrar la válvula.
VII - LIMPIEZA Y REGLAS DE PROFILAXIA
Todo el cloro debe utilizarse en solución en agua dulce.
VII.1.2. TANQUES Y AREA EXTERIOR
Los tanques deben lavarse tan pronto se desocupen.
Tanquetas
Preparar en un balde solución de cloro 500 ppm (10
litros),
Repartir en las 4 tanquetas,
Lavar con esponja o cepillo,
Enjuagar bien con agua dulce,
Escurrir boca abajo.
Tanques 1 m3 - 12m3
Preparar la solución de cloro 500 ppm,
Echar un poco de la solución de cloro en el tanque
vacío.
Cepillar con agua de mar para evacuar residuos de
cultivo.
Cepillar con la solución de cloro todo el tanque.
Enjuagar con agua dulce.
Notas :
Para los tanques de 6 m3, es importante enjuagar con agua dulce porque no desaguan bien. Los charcos que quedan en el fondo deben ser de agua dulce.
Al llenar un tanque, darle siempre una enjuagadita con agua de mar.
Antes de botar un tanque al desagüe, echarle cloro en solución y esperar unos 15 min. que actúe.
Las mangueras de aire se sacan y se dejan en solución de cloro 50 ppm hasta el día siguiente. Se enjuagan y vuelven a colocar.
Hay que echar cloro en solución en los charcos de agua que queden en el piso del área exterior.
• Agua de mar
La red de fitoplancton, desde el filtro UV se enjuaga todos los días con agua dulce. Por eso, se junta la red de agua dulce a la de PVC con una manguera, y se abre el agua dulce. El agua dulce tiene que circular en toda la red, por eso hay que abrir las válvulas mas alejadas (del punto de entrada de agua dulce) primero, e irlas abriendo sucesivamente acercándose a este punto. Dejar circular el agua 5 minutos. Las válvulas deben quedar abiertas de noche para que la tubería drene. Al día siguiente, tener cuidado de enjuagar la red con agua de mar antes de llenar cualquier volumen, pues la tubería no drena totalmente. Todas las mangueras utilizadas deben aenjuagarse igualmente con AD.
• Una vez a la semana, la red se limpia con agua de mar clorada (100 ppm) desde la cisterna si es posible. Dejar circular el agua clorada, e ir cerrando las válvulas de manera que el cloro quede actuando toda la noche (vaciar los filtros UV que no deben quedar con agua clorada). Al día siguiente, enjuagar con agua de mar.
Esto debe hacerse en sincronización con la limpieza de la reserva de agua, que se hace igualmente una vez por semana.
• Red de distribución de fitoplancton
Debe enjuagarse con agua de mar en cada distribución y al final del día. Las válvulas de las posetas deben quedar abiertas para que drene la red de este lado.
Aire
• Cada vacío sanitario, lavar tubería con agua clorada.
• Cambiar en sala de cultivos menores la manguera de aeración una vez cada 2 semanas.
Para lavarlas dejarlas de 12 a 24 horas en solución de clora 50 ppm. Enjuagar con agua dulce y dejar secar al sol.
Lavar pisos de toda el área interior todos los días.
Limpiar repisas, salas asépticas con alcohol 2 veces a la semana.
Hay que estar siempre atento a todos los factores negligencias que puedan causar contaminaciones.
Respetar la regla de área limitada del departamento
Evitar ir a otros departamentos del centro.
Respetar la organización y división del trabajo
Limitar idas- venidas de fuera adentro. Estar conciente de las zonas sucias y limpias. Utilizar las botas adentro, pero no llevarlas al exterior.
Utilizar los lavapiés a la entrada del departamento en el límite área extárea int.
Dejar las puertas cerradas. Limitar la entrada en las salas asépticas a las personas que tienen que realizar un trabajo.
Lavar tanques desocupados enseguida.
No dejar envejecer cultivos. Respetar esquema de producción.
Respetar los programas de limpieza de las redes y de las salas.
Utilizar solamente agua pasada por UV.
Verificar regularmente eficiencia de la filtración :
Estado de las cisternas de agua. Verificar que se cumpla la programación de limpieza.
| HORA | RESPONSABLE AREA | TECNICOS ADENTRO | AYUDANTES AFUERA | LAVADO |
| 8.30 | - Sacar soluciones “cepas” de la refrig. y trasladar los a la sala de cepas. | - Agitar tubos y volúmenes cepas. | - Preparar los tanques con cloro 100 ppm. | |
- Hacer vuelta general volúmenes interiores y exte - riores | - Cojer muestras de cultivos volúmenes menores. | - Coger muestras exteriores de los volúmenes destinados a la alimentación y a transferirse el mismo día, más tanquetas. | ||
| 9.00 | - Revisar muestras exteriores de los tanques destinados a la alimentación. Anotar y entregar larvicultura. | - Preparar soluciones cultivo para Erlens de 4 lt, l lt, cepas. | - Poner red de agua en servicio. Prender lámpara ultravioleta. | - Llenar Erlens 5 lt de agua de mar. |
| 10.00 | - Revisar muestras exteriores e interiores de los volúmenes que van a transferirse del más grande al más pequeño. (Anotar en una lista de transferencia). | - Trasladar Erlens 4 lt revisados en sala tanquetas. | - Sacar afuera tanquetas para tanques exteriores. | - Esterilizar en la autoclave |
- Sembrar Erlens 4 lt | - Entrar y llenar tanquetas limpias para el día. | - Preparar tubos, pipetas, material para esterilización, estufa. | ||
- Sembrar Erlens 250 ml, 1 lt. | - Llenar tanques ext. destinados a sembrase. | |||
- Recibir y trasmitir instrucciones larvicultura para alimentación. | - Sembrar 4 lt tanquetas | - Empezar bombeos tanques → poseta de distribución. | - Esterilización | |
- Empezar bombeos poseta → larvicultura. | ||||
| 11.00 | - Entregar lista e instrucciones de transferencia. | - Preparar fertilizantes en tanques exteriores. | - Seguir bombeos transferencias exterior y alimentación. | |
| 12.00 | - Hacer vuelta, verificar trabajo. | - Pasar cristalería sucia al cuarto de lavado. | - Lavar tanques desocupados. | |
- Revisar cepas destinadas a la producción Erlens 100 ml Tubos. | - Preparación de medios | - Sembrar tanquetas de 0,5 m3. | - Lavar cristalería sucia. | |
- Lavar tanques desocupados. | ||||
| 2.00 | - Transferencia | |||
| Tubos → 250 ml | ||||
| 100 ml → 250 ml | ||||
| 3.00 | - Revisar muestras tanques ext. alim. tarde. Anotar y entregar larvicultura. | - Limpiar repisas salas asépticas. | - Cojer muestras tanques para alimentación, tarde. | |
- Trabajar mantenimiento cepas Revisión tubos, siembra placas, diluciones, etc. | - Supervisión, esterilización, material, agua. | - Bombeos para alimentación. | ||
| 4.00 | - Registrar observaciones hoja diaria. | - Limpieza pisos. | - Lavar tanques desocupados. | |
- Vuelta, revisión general y material estéril. | - Enjuagar red con agua dulce. | - Transferir agua estéril y material sala de algas. |