Las larvas utilizadas en estos ensayos provienen de una de las experiencias de reproducción artificial realizadas por INAPE en enero de 1982 (Exp. No. 12, Varela, Fischer, Fabiano, 1982). Todos corresponden a una misma hembra que desovó en forma natural el 13/01/82. La eclosión de las larvas se produjo el 14 de enero en una temperatura de 24°C. Las larvas recién eclosionadas tenían una longitudmedia total de 5,0 mm.
En la figura 4 aparece el diagrama de la alimentación ensayada, Se designa como día 1 la fecha en que recibieron alimentos por primera vez (15 de enero de 1982), consistentes en yema de huevo cocida e hígado crudo homogeneizados por separado.

Figura 4 - Diagrama de la alimentación ensayada
El día 4 (18/01/82) se separan las larvas en dos lotes de 6000 ejemplares cada uno, recibiendo uno de ellos nauplius de Artemia salina suplementada con homogeneizado de hígado y el otro lote solamente homogeneizado de hígado.
El día 7 (21/01/82) se divide cada uno de los lotes en tres sublotes: Artemia 1000, 2000 y 3000, que reciben como alimento únicamente nauplius de Artemia; a hígado 1000, 2000 y 3000, que reciben como único alimento hígado homogeneizado.
El contaje de las larvas de cada tratamiento es exacto y corresponde a densidades de 20, 40 y 60 larvas por litro.
El día 16 los tratamientos de Artemia vuelven a suplementarse con hígado.
Durante toda la experiencia la frecuencia de alimentación fue de tres veces por día, seis días a la semana. No se calculó la cantidad de alimento suministrado.
Se registraron diariamente temperaturas máximas y mínimas del agua y niveles de oxígeno disuelto para todos los acuarios.
En la figura 5 aparece la temperatura diaria promedio y los nive - les de oxígeno correspondientes al tratamiento Artemia 3000, de mayor densidad de larvas.
La temperatura osciló entre 24–27°C y el O2 se mantuvo en forma relativamente estable alrededor de 7 ppm, registrándose un valor mínimo de 6 ppm a una temperatura de 25°C, valor que representa un 70% de saturación.
Se considera que estas características físico-químicas no pueden haber afectado negativamente a las larvas estudiadas. Niveles de oxígeno disuelto inferiores a 2 ppm son considerados perjudiciales para larvas de Ictalurus punctatus (bagre de canal) (Steinbach, 1977). A pesar de esto, todas las larvas del lote de hígado 3000 murieron por razones desconocidas en la noche del día 5 al 6, por lo que se carece de informaciones sobre este tratamiento.
Se realizó también diariamente limpieza de los acuarios, retirando restos de alimentos y otros detritos.
El índice de sobrevivencia fue calculado en base a los contajes totales de las larvas realizados los días 21/1 (7°) y 1/2 (10°).
Los resultados se presentan en el cuadro 1 y figura 6. La mayor sobrevivencia se logró en el tratamiento que recibió Artemia e hígado con una densidad de 20/1t (Artemia 1000). Esta fue del 80%. El tratamiento alimentado con hígado y con la misma densidad, tuvo una sobrevivencia del 55%.
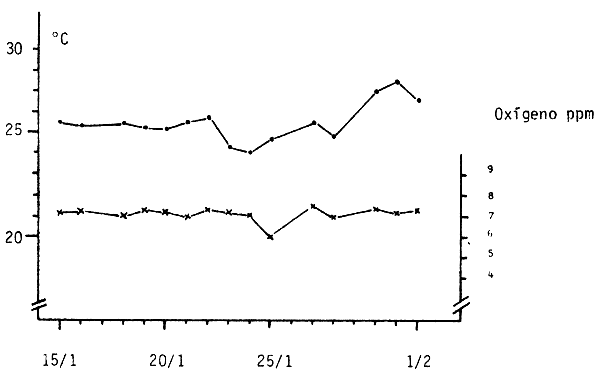
Figura 5 - Temperatura del agua (promedios) y oxígeno disuelto durante la experiencia
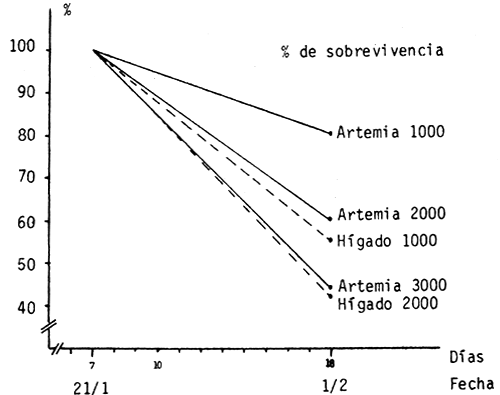
Figura 6 - Tasas de sobrevivencia de los diferentes tratamientos
Cuadro 1
Tasas de sobrevivencia y mortalidad de los diferentes tratamientos
| Densidad inicial | Número inicial | Número final | Sobreviv. % | Mortalidad por día en 11 días % | ||
| Fecha | 21/1 | 21/1 | 1/2 | 1/2 | ||
| Artemia | 1000 | 20/lt | 1000 | 800 | 80 | 1,8 |
| Artemia | 2000 | 40/lt | 2000 | 1200 | 60 | 3,6 |
| Artemia | 3000 | 60/lt | 3000 | 1300 | 42 | 5,8 |
| Hígado | 1000 | 20/lt | 1000 | 550 | 55 | 4,1 |
| Hígado | 2000 | 40/lt | 2000 | 850 | 43 | 5,2 |
| Hígado | 3000 | 60/lt | 3000 | - | - | - |
En general se observa una diferencia significativa en la sobrevivencia entre las larvas alimentadas con Artemia e hígado y las que recibieron sólo hígado, en todas las densidades.
Cuando se considera la influencia de la densidad en la sobrevivencia se observa que ésta es mayor en las densidades bajas, independientemente de la alimentación.
Estos resultados coinciden con los descritos por Hogendoorn (1980) quien administrando ración iniciadora de trucha a larvas de bagre africano (clarias lazera C.V.) por un período de cuatro semanas obtuvo una sobrevivencia del 1%, mientras que suplementando la ración en los primeros cuatro días con Artemia logró una sobrevivencia del 82%.
Debido a problemas de manejo, no fue posible pesar las larvas, por lo que los datos sobre crecimiento se tomaron en base al largo total.
Los resultados se presentan en el cuadro 2 y figura 7.
Cuadro 2
Tallas de los distintos tratamientos en los diferentes muestreos
| Fecha | 15/1 | 19/1 | 22/1 | ½ | Crecimiento/ día (%) | ||
| Long. Total X mm | 5.0 | 6.1 | Artemia | 1000 : | 6.3 | 9.8 | 5.3 |
| Artemia | 2000 : | 6.4 | 9.1 | 4.6 | |||
| Artemia | 3000 : | 6.4 | 8.6 | 4.0 | |||
| Long. Total X mm | 5.0 | 6.1 | Hígado | 1000 : | 5.0 | 9.2 | 4.7 |
| Hígado | 2000 : | 6.3 | 9.0 | 4.4 | |||
| Hígado | 3000 | - | - | - | |||
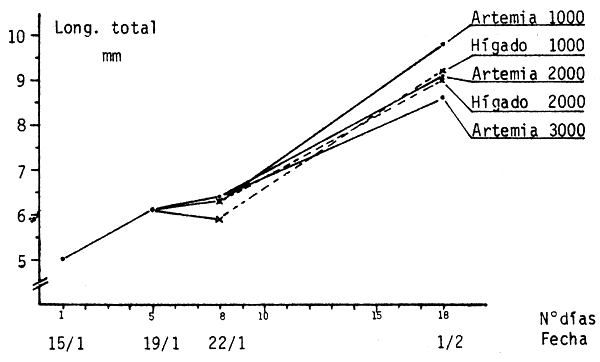
Figura 7 - Crecimiento en longitud según los diferentes tratamientos
En el cuadro 3 se presentan los valores “t” (Student) obtenidos de comparar las longitudes finales de los diferentes tratamientos.
Cuadro 3
| Tratamientos | G.L. | “t” |
| Híg. 1000 - Híg. 1000 | 38 | -0.57 |
| Art. 3000 - Art. 2000 | 40 | -1.60 |
| Art. 2000 - Art. 1000 | 40 | -1.88 * p = 0,05 |
| Art. 3000 - Art. 1000 | 40 | 4.01 * p = 0,01 |
| Híg. 2000 - Art. 2000 | 40 | -0.24 |
| Híg. 1000 - Art. 1000 | 40 | 1.58 |
Se puede apreciar que las únicas diferencias significativas que existen entre las longitudes finales, corresponden a las diferentes densidades de los tratamientos de Artemia. No hay diferencias significativas entre las dos densidades de hígado ni entre los dos tipos de alimento a una misma densidad.
Estos resultados, a pesar de no ser muy completos, indican la fundamental incidencia de la densidad sobre el crecimiento. Steinbach (1977) determinó que para las larvas de bagre de canal la tasa de crecimiento disminuye al aumentar la densidad de siembra.
Las larvas empleadas en esta experiencia se obtuvieron del desove No. 14 realizado en el laboratorio de INAPE en febrero de 1982 (Varela, Fischer, Fabiano, 1982). Las larvas provienen de una sola hembra, desovada en forma natural en acuario durante la noche del 16 al 17 de febrero de 1982. Las larvas recién eclosionadas (18/02/82) tenían una longitud media de 4,4 mm. Dado lo avanzado del período de reproducción, estas larvas están comprendidas entre las menores obtenidas en el período 1981–1982 (Varela, Fischer, Fabiano, 1982).
Las temperaturas máximas y mínimas se registraron diariamente en los acuarios. La temperatura media diaria se presenta en la figura 8.
El nivel de oxígeno disuelto fue determinado en varias oportunidades a lo largo de la experiencia, manteniéndose en los mismos valores de la Experiencia No. 1.
Al tercer día de vida (20/02/82) las larvas se repartieron en 10 acuarios, a razón de 10000 (200/lt) por acuario. El contaje de las mismas se hizo por el método de comparación visual. A los 14 días de vida se concentraron las larvas de 9 acuarios dentro de las canastas incubadoras nuevamente (1000/lt) (acuarios 2 al 10). Debido a su desarrollo, ya no podían atravesar las mallas. Las larvas de los otros acuarios (1 al 12) se mantuvieron sin cambios como testigos del efecto que este nuevo sistema pudiera producir.
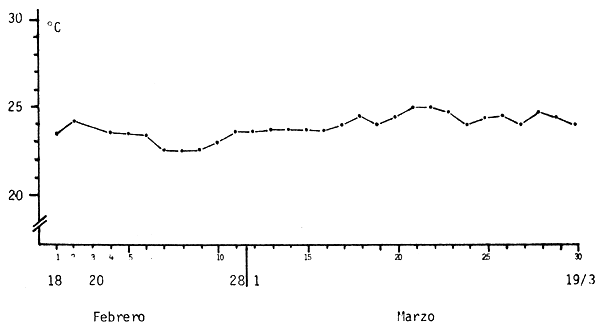
Figura 8 - Temperatura media del agua durante la experiencia
Este nuevo sistema se empleó, ya que se estaba haciendo muy difícil la limpieza de los acuarios. Con el mismo, los alimentos no ingeridos y los detritos pasaban hacia el acuario y podían ser retirados sin la interferencia de los peces.
En esta oportunidad no se administraron alimentos vivos. El primer alimento consistió en yema de huevo cocida y molida (homogeneizada). Con este alimento se lograría una buena expansión del tubo digestivo. Se administró el mismo desde antes de la absorción total del saco vitelino (tres días de vida) por tres días. Se administraba en forma diluída en agua, 4 veces al día (figura 9).
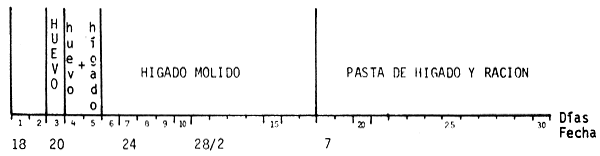
Figura 9 - Esquema de alimentación ensayada
Luego se continuó la alimentación con hígado vacuno molido (al cual se le sacaban previamente cápsula y paredes de grandes vasos). Este se administraba cuatro veces al día, seis días por semana. Además, se administraba una vez al día, ración balanceada de INAPE I, en forma de polvo molido finamente. Esta ración está compuesta de: harina de pescado, harina de carne, sorgo, afrechillo de trigo y maíz.
Desde el día 18 se administraba una pasta de hígado y ración INAPE I.
En el cuadro 4 se presenta el número final de larvas de cada uno de los acuarios. En base a estos resultados se calculó la sobrevivencia para los dos tipos de manejo (confinados en canastas y libres), que se presenta en la figura 10.
Cuadro 4
Sobrevivencia en los diferentes acuarios
| Acuario No | Número inicial | Número final | Sobrev. % | Sobrev. % Promedio | Mortalidad por día - % Promedio |
| 1 | 10000 | 1215 | 12.2 | 12.2 | 2.9 |
| 12 | 10000 | 1215 | 12.2 | ||
| 2 | 10000 | 1600 | 16.0 | 18.5 | 2.7 |
| 3 | 10000 | 1930 | 19.3 | ||
| 4 | 10000 | 1480 | 14.8 | ||
| 5 | 10000 | 1877 | 18.8 | ||
| 6 | 10000 | 2250 | 22.5 | ||
| 7 | 10000 | 2060 | 20.6 | ||
| 8 | 10000 | 2120 | 21.2 | ||
| 9 | 10000 | 1665 | 16.7 | ||
| 10 | 10000 | 1850 | 18.5 | ||
| 18.7 |
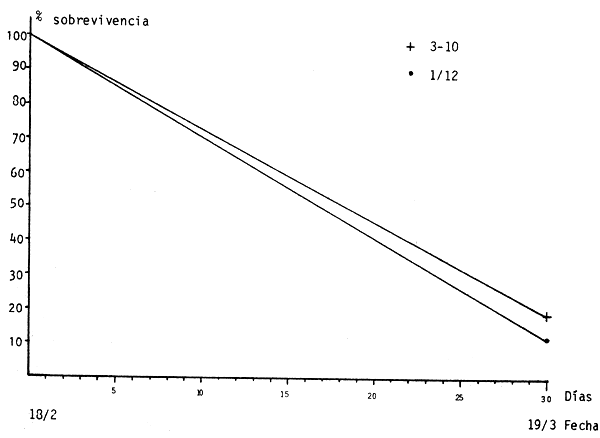
Figura 10 - Sobrevivencia en los diferentes tratamientos
Ante estos resultados se planteó la hipótesis nula Ho : P1 = P2 que implicaría que las diferencias de proporciones observadas son debidas al azar y no a los diferentes tratamientos. Para la Ho:
μ P1 - P2 = 0
donde:
P1 = tasas de sobrevivencia de larvas en canastas
P2 = tasa de sobrevivencia de larvas libres
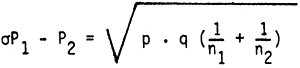
donde:
p = (1215 + 1848)/20000 = 0.15
q = 1 - p = 0.85
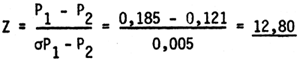
En base a un ensayo unilateral a nivel de significación del 0,001, se rechaza la Ho ya que Z resulta ser marcadamente mayor que el nivel de significación de 2,33.
Estos resultados indican que hubo una sobrevivencia significativamente mayor de las larvas confinadas en las incubadoras sobre las libres en el acuario. Este hecho es contradictorio con los resultados de la experiencia anterior. Como conclusión preliminar, se considera que esto se debería a que el sistema de larvas confinadas en canastas de malla, implica mejores condiciones ambientales para las mismas, manteniéndolas separadas de los restos de alimento que ineludiblemente se acumulan en el fondo del acuario. Se pudo apreciar en reiteradas oportunidades que muchas larvas quedaban aprisionadas en estos restos y eran contaminadas por hongos, produciéndose mortandades importantes. Con el sistema de las incubadoras de malla se eliminó este problema en gran parte.
Se considera que la mayor densidad sigue influyendo negativamente en la sobrevivencia, pero en este caso este hecho habría sido enmascarado por la influencia de un sistema de manejo sobre otro. Para dilucidar definitivamente este aspecto se deberán realizar ensayos mucho más amplios que el presente.
Estos resultados se graficaron en la figura 10.
Las tasas de sobrevivencia de 12 y 18% en un período de cuatro semanas son similares a las obtenidas en experiencias con Clarias lazera alimentado con iniciador de trucha e iniciador de trucha y plancton congelado (Hogendoorn, 1980).
El crecimiento se determinó a través de sucesivos muestreos en los cuales se tomó también el largo total de las larvas. Los resultados se presentan en el cuadro 5 y en la figura 11.
La tasa de crecimiento diario hasta el 13° día (02/03/82) fue de 6.5%. A partir de la separación en dos lotes el día 14° y hasta el día 27°, la tasa de crecimiento fue de 8.8% para las larvas en los canastos y de 5.3% para las libres.
Cuadro 5
Tallas y desvío estándar de los distintos acuarios en diferentes muestreos
| Fecha | DIA No | 1/12 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 3–10 X | |||||||||
| X | S | X | S | X | X | S | X | S | X | S | X | X | X | |||||||
| 18/2 | 1 | 4,4 | 4,4 | 4,4 | ||||||||||||||||
| 25/2 | 8 | 7,2 | 0,4 | 7,2 | 0,4 | 7,2 | ||||||||||||||
| 2/3 | 13 | 8,1 | 0,6 | 8,1 | 0,6 | 8,1 | ||||||||||||||
| 3/3 | 14 | 9,1 | 0,5 | 8,6 | 0,4 | 8,6 | ||||||||||||||
| 5/3 | 16 | 9,5 | 0,2 | 9,1 | 0,5 | 9,4 | 0,5 | 8,7 | 0,5 | 9,2 | 0,5 | 9,2 | 0,9 | 9,6 | 0,6 | 9,1 | 0,7 | 9,2 | ||
| 8/3 | 19 | 9,2 | 1,0 | 9,4 | 0,4 | 9,8 | 0,9 | 9,6 | 0,6 | 9,5 | 0,6 | 9,4 | 0,7 | 9,9 | 0,7 | 9,7 | 0,6 | 9,6 | ||
| 12/3 | 23 | 10,0 | 0,8 | 11,1 | 1,2 | 11,0 | 1,4 | 10,8 | 1,1 | 9,9 | 0,8 | 10,4 | 0,8 | 1,3 | 1,7 | 10,7 | 0,9 | 10,7 | ||
| 16/3 | 27 | 10,7 | 2,3 | 12,4 | 1,3 | 12,0 | 1,6 | 12,6 | 1,8 | 12,2 | 1,3 | 12,8 | 1,6 | 14,0 | 2,2 | 12,5 | 0,9 | 12,6 | ||
| 19/3 | 30 | 12,1 | 3,4 | 14,7 | 2,1 | 15,0 | 2,2 | 15,7 | 2,3 | 14,7 | 2,4 | 13,6 | 1,8 | 14,9 | 2,2 | 14,9 | 2,1 | 14,8 | ||
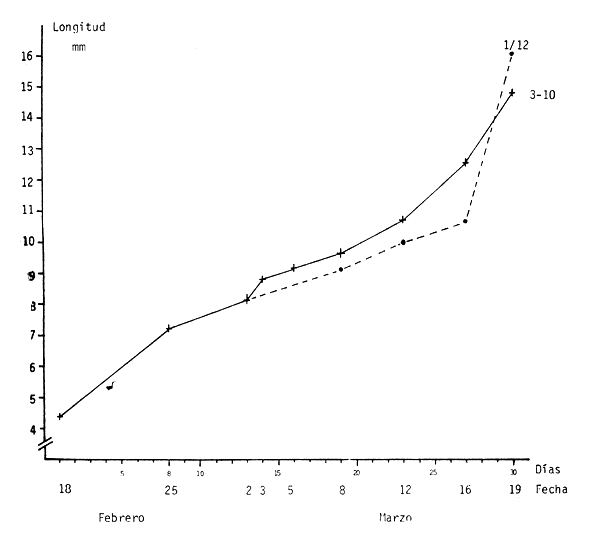
Figura 11 - Crecimiento en los diferentes tratamientos
Entre los días 27° y 30° se constató un incremento notorio en el crecimiento de las larvas de los lotes 1–12, que las llevó a superar la talla final de las de los lotes 3 a 10 al final de la experiencia.
A partir del momento de la separación se puede apreciar en el cuadro 5 una diferencia importante entre el desvío estándar de las muestras libres (1–12) y confinadas (3 a 10), indicando una mayor dispersión de las tallas en las primeras. Este hecho habría resultado en un mayor canabalismo en estos dos lotes, lo que se tradujo en una menor tasa de sobrevivencia y en tallas finales mayores.
En el caso de los lotes en canastos plásticos, la mayor densidad habría llevado a una mayor homogeneidad en el desarrollo.
Comparando estos resultados con la experiencia No. 1, se puede apreciar que hasta el día 19, la tasa diaria de crecimiento fue levemente mayor, pero dentro de un rango similar.