Les crevettes penaeïdes côtières sont trouvées dans les zones intertropicales et subtropicales. La plupart du temps, les crevettes vivent dans des zones influencées par des deltas, estuaires ou lagunes, c'est-à-dire sur des fonds généralement vaseux ou sablovaseux, riches en matières organiques; par ailleurs, une partie du cycle se déroule dans des eaux plus ou moins dessalées. Ce n'est cependant pas obligatoirement le cas et les importantes ressources crevettières du golfe entre l'Iran et l'Arabie Saoudite - bordé de terres arides où les apports d'eau douce sont très limites - sont une exception notable. Les différents paramètres du milieu n'étant pas indépendants, il est souvent difficile d'isoler celui ou ceux qui conditionnent plus particulièrement tel ou tel aspect de l'écologie ou de la biologie des crevettes.
Il n'est pas question d'étudier ici l'écologie des différentes espèces. Nous avons cherché essentiellement de dégager, d'après les données de la littérature, les caractères communs au plus grand nombre d'espèces, qui conditionnent les techniques et les plans d'échantillonnage nécessaires à l'évaluation quantitative des divers stades du cycle vital.
Les crevettes penaeïdes côtières qui alimentent les différentes pêcheries du monde appartiennent à une quarantaine d'espèces réparties en six genres. Très souvent les captures ne sont pas ventilées par espèce et il n'est donc pas possible de dire quelle est la part respective de chacune dans la production mondiale. Nous indiquerons donc simplement les principales espèces capturées dans chacune des grandes régions productrices. Un premier inventaire avait été établi par Eldred et Hutton (1960) et Holthuis et Rosa (1965) et un catalogue complet a été recemment compilé par Holthuis (1980).
MEDITERRANEE
Penaeus kerathurus
KOWEIT (Mohamed et al., 1979)
Penaeus semisulcatus, très dominant; Metapenaeus affinis; M. stebbingi, Parapenaeopsis stylifera. Plus accessoirement, Penaeus japonicus, P. latisulcatus, Trachypenaeus curvirostris, Metapenaeopsis stridulans, T. granulosus.
PAKISTAN (Tirmizi, 1969)
Penaeus semisulcatus, Penaeus merguiensis, Penaeus penicillatus, Metapenaeus stebbingi, Metapenaeus brevicornis, Metapenaeus affinis, Parapenaeus stylifera.
INDE (Jones, 1969)
Penaeus semisulcatus, Penaeus merguiensis, Penaeus indicus, Penaeus monodon, Metapenaeus brevicornis, Metapenaeus affinis, Metapenaeus dobsoni, Metapenaeus monoceros, Parapenaeus stylifera
EXTREME-ORIENT (Kristjonsson, 1969)
Penaeus monodon, Penaeus japonicus, Penaeus orientalis, Metapenaeopsis lamellata, Metapenaeopsis acclivis, Metapenaeopsis barbata, Metapenaeopsis joyneri, Trachypenaeus curvirostris.
AUSTRALIE (Walker, 1975)
Penaeus merguiensis, Penaeus esculentus, Penaeus plebejus, Penaeus latisulcatus, Metapenaeus endeavouri, Metapenaeopsis macleayi, Metapenaeus bennettae.
COTE EST AFRICAINE ET MADAGASCAR
(Hall, 1966; Marcille, 1978)
Penaeus indicus, Penaeus semisulcatus, Penaeus monodon, Metapenaeus monoceros.
COTE OUEST AFRICAINE (Garcia et Lhomme, 1977)
Penaeus notialis, Parapenaeopsis atlantica.
COTE EST AMERICAINE (Perez Farfante, 1969)
Penaeus setiferus, Penaeus duorarum, Penaeus notialis, Penaeus aztecus aztecus, Penaeus aztecus subtilis, Penaeus schmitti, Penaeus paulensis, Penaeus brasiliensis, Xiphopenaeus kroyeri.
COTE OUEST AMERICAINE (Gross, 1973; Edwards, 1978)
Penaeus californiensis, Penaeus vannamei, Penaeus stylirostris, Penaeus brevirostris, Penaeus occidentalis.
2.2.1 Différents stades du cycle biologique
Les femelles pondent des oeufs démersaux. De ces oeufs éclosent des larves au stade nauplius. Ces larves sont planctoniques. Le développement larvaire a été décrit chez plusieurs espèces appartenant pour la plupart au genre Penaeus. Il semble qu'il s'effectue d'une manière assez générale à travers onze stades successifs, le passage d'un stade à l'autre s'effectuant grâce à une mue: 5 stades “nauplius”, 3 stades “protozoé”, et 3 stades “mysis” (Fig. 1). La dernière “mysis” subit une mue qui la transforme en postlarve. Bien que ne mesurant que quelques millimètres, la postlarve a déjà l'apparence générale de l'adulte mais la dentition rostrale est incomplète. La postlarve va passer par plusieurs stades caractérisés chacun par une formule rostrale particulière. Les premiers stades postlarvaires (jusqu'au stade 2 ou 3 dents susrostrales) sont encore planctoniques, mais les suivants sont semi-benthiques. Lorsque la crevette a acquis sa formule rostrale définitive, elle est qualifiée de juvénile. Les organes sexuels externes (petasma chez le mâle et thelycum chez la femelle) ne sont pas encore formés. Lorsqu'ils sont entièrement formés, la crevette est dite subadulte. Le stade adulte est atteint lorsque les crevettes sont capables de se reproduire. La croissance varie entre 30 et 60 mm/mois pendant la phase juvénile (longueur totale) et diminue ensuite avec l'âge. Elle varie également avec la densité des individus et la température ambiante.
2.2.2 Déroulement du cycle dans l'espace et écologie des différents stades
La physiologie des crevettes se modifie au cours de leur développement; leurs facultés d'osmorégulation, en particulier, évoluent. Ceci est lié au fait qu'au cours de leur vie les crevettes effectuent des migrations à travers divers biotopes que l'on peut caractériser essentiellement par leur gradient de salinité.
Schématiquement, le cycle de migration se présente ainsi: la ponte a lieu en mer; les larves et les premières postlarves font partie du plancton. Les postlarves pénétrent dans les estuaires et lagunes ou se rapprochent de la côte. Les crevettes retournent en mer lorsqu'elles atteignent une dizaine de cm. La fin du cycle a lieu en mer. Un diagramme de ce cycle, indiquant les phases exploitées, est donné sur la Figure 2. Kutkuhn (1966) soulignait que les crevettes penaeïdes peuvent présenter de grandes différences, tant du point de vue de leur inféodation aux eaux saumâtres, que de celui de la répartition des adultes le long d'un gradient eaux saumâtres-eaux océaniques. Sur une spirale (Fig. 3) qui va en s'amincissant et dont la largeur représente la portion du cycle vital passée en estuaire, il a placé vingt cinq espèces en fonction de ses propres observations et des données de la littérature, leur position correspondant à celle des adultes dans le gradient de salinité estuaire-mer.
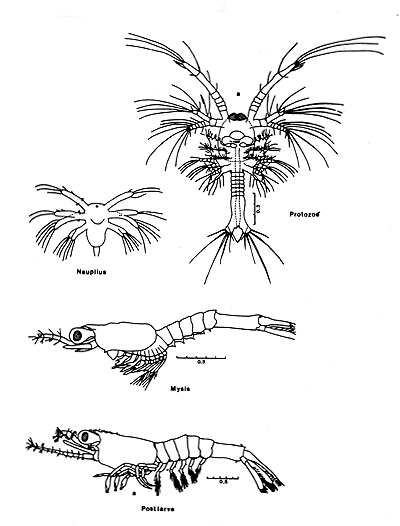
Fig. 1: Stades larvaires de Sycionia brevirostris, Penaeoïdea
(d'après Cook et Murphy, 1965)
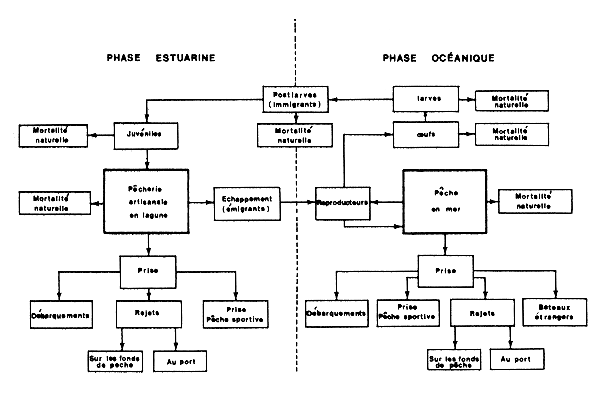
Fig. 2: Relations schématiques entre les divers composants du cycle vital des penaeïdes et l'exploitation (d'après Caillouet et Baxter, 1973)
Au centre de la spirale, il place par exemple Metapenaeus mastersii, espèce australienne qui passe toute sa vie à l'intérieur des estuaires (Morris et Bennet, 1951). C'est également le cas de M. bennettae, Racek (1959) et M. dalli (Penn, sous presse). A l'extrémité de la spirale on trouve notamment l'espèce atlantique Plesiopenaeus edwardsianus qui accomplit tout son cycle sur des fonds voisins de 900 m (Springer et Bullis, 1956; Maurin, 1965) et ne peut donc être classée parmi les penaeïdes côtiers. Entre ces cas extrêmes tous les cas intermédiaires peuvent se présenter. Dans le golfe du Mexique, les adultes de Penaeus aztecus vivent essentiellement et se reproduisent sur des fonds de 55–75 m (Kutkuhn, 1962) et les jeunes ne remontent pas très profondément dans les estuaires. Les adultes de Penaeus setiferus ne sont pas trouvés à des profondeurs supérieures à 35 m, cependant que les juvéniles peuvent pénétrer très loin dans les estuaires, jusqu'à 210 km en amont de l'embouchure (Joyce, 1965). Les adultes de Xiphopenaeus kroyeri sont confinés dans une étroite bande côtière et les jeunes ne pénètrent pas très profondément dans les estuaires (Burkenroad, 1934; Neiva et Wise, 1964). Comme dernier cas type, citons Parapenaeopsis stylifera dont les adultes vivent en mer à des profondeurs inférieures à 40 m et qui accomplit tout son cycle en mer. Bien que peu étudiée encore, il semble que Parapenaeopsis atlantica de la côte ouest africaine doive être rattachée à ce type car les adultes vivent de 0 à 45 m (surtout 15–25 m) et les larves ne sont jamais rencontrées en estuaire (Crosnier et De Bondy, 1967). Il en est de même pour Penaeus semisulcatus dans le golfe entre l'Iran et l'Arabie Saoudite (Basson et al., 1977)
Kirkegaard (1975) a donné également une description des différents schémas de distribution et de migration chez les penaeïdes d'Australie (Fig. 4 et 5).
On peut noter la grande adaptabilité du genre Penaeus, à des conditions de milieu très diverses. Par exemple, Penaeus notialis juvénile habite des eaux presque douces en Casamance (Sénégal) mais également des estuaires sursalés (Sine Saloum dans le même pays). De même Penaeus esculentus juvénile peut être trouvé dans des eaux dont la salinité est inférieure à 35 pour mille et parfois supérieure à 45 pour mille (Penn, sous presse). De même, si la plupart des Penaeus ont un cycle vital amphibiotique avec une phase estuarienne, certains, comme Penaeus latisulcatus et Penaeus esculentus ont leurs nurseries dans la zone littorale marine. C'est également le cas de Penaeus marginatus dont les adultes sont rencontrés à plus de 200 m de profondeur (Crosnier et Jouannic, 1973; Struhzaker et Yoshida, 1975) alors que la plupart des espèces de ce genre dépassent rarement 80–100 mètres de profondeur.
Les crevettes ne migrent pas uniquement le long d'un axe côte-large. Les exigences liées à la nature du substrat, à la richesse trophique du milieu, à l'hydrologie, peuvent obliger les crevettes à migrer le long de la côte. Penaeus setiferus, le long de la côte Atlantique des U.S.A., peut effectuer des migrations atteignant 580 km (Lindner et Anderson, 1956). Ruello (1975) rapporte qu'en Australie, une crevette appartenant à l'espèce Penaeus plebejus a parcouru 930 km.
De nombreux renseignements sur les cycles vitaux des penaeïdes peuvent être trouvés dans les synopsis de la FAO (Mistakidis, 1970), du CSIRO (Kirkegaard et Walker, 1979, Kirkegard et al., 1970).
L'étude d'un stock de penaeïdes côtiers ayant pour objectif la mise en valeur rationnelle des ressources par l'aménagement, implique une bonne connaissance de la chronologie du cycle vital et des relations entre les différentes phases du cycle. En effet, du fait de l'absence de méthode de lecture directe de l'âge des crevettes, seule une analyse détaillée des différentes phases permet d'établir une chronologie des étapes principales (ponte, migration larvaire, migration juvénile, recrutement, etc.) par superposition des variations saisonnières quand elles sont suffisamment perceptibles. Les Figures 6 et 7 donnent un exemple des résultats obtenus en Côte d'Ivoire et une représentation de la chronologie du cycle de Penaeus notialis dans cette région d'après Garcia (1977). D'autre part, la mise au point de modèles prévisionnels (voir Chapitre 9) ou l'étude du recrutement passe par l'obtention de données quantitatives sur les diverses phases du cycle vital.
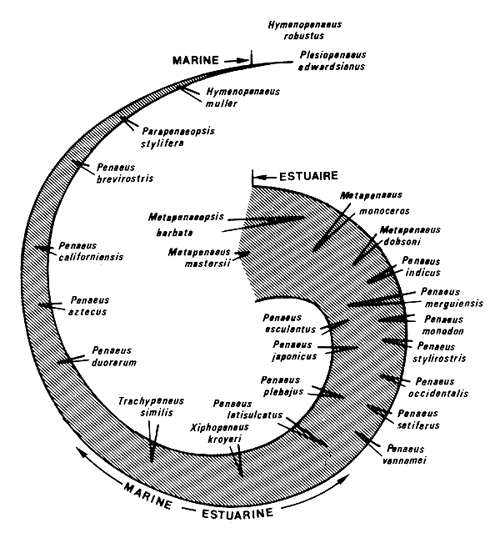
Fig. 3: Degré d'inféodation aux estuaires de diverses crevettes penaeïdes
(d'après Kutkuhn, 1966) (voir texte)
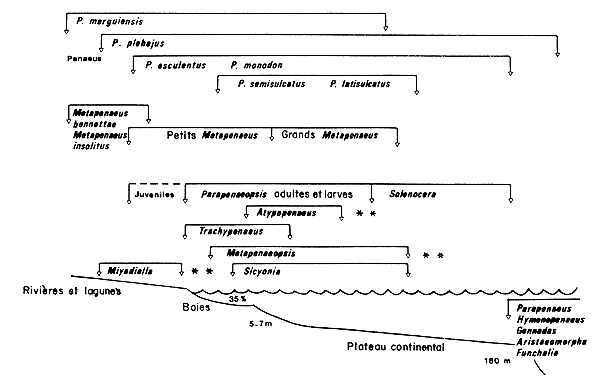
** Pas de données sur les larves
Fig. 4: Distribution le long du gradient mer-lagune des cycles vitaux des principales crevettes penaeïdes d'Australie (d'après Kirkegaard, 1975)
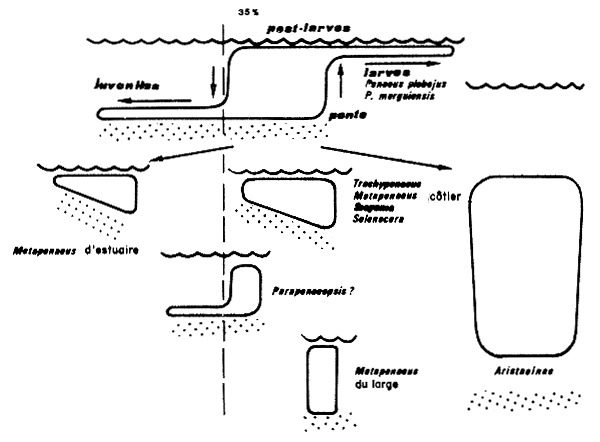
Fig. 5: Différents types de cycles vitaux, distribution dans l'espace par rapport
à la surface  au fond
au fond 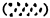 et à l'isohaline 35% (d'après
Kirkegaard, 1975)
et à l'isohaline 35% (d'après
Kirkegaard, 1975)
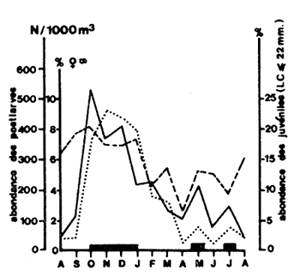
Fig. 6: Comparaison des variations saisonnières de la reproduction (—), de l'abondance des post-larves en lagune (---) et du recrutement des immatures en mer 3 mois plus tard (…) (d'après Garcia, 1977)
Fig. 7: Reconstitution de la chronologie du cycle vital de Penaeus notialis en Côte d'Ivoire
(d'après Garcia, 1977)
L'étude des variations spatio-temporelles de ces phases nécessite la mise en place de programmes d'échantillonnage où les techniques utilisées seront conditionnées par les types de variabilité prévisibles, leurs différentes sources étant rappelées dans le paragraphe suivant en même temps que les méthodes employées.
2.3.1 Les larves et postlarves (planctoniques) en mer
L'un des principaux intérêts d'une étude des larves est de permettre la connaissance des variations saisonnières de la reproduction de la population. C'est une étude en général onéreuse qu'il convient de ne pas engager à la légère. En particulier, bien qu'une certaine homogénéité dans le comportement soit prévisible, il est souhaitable de pouvoir séparer spécifiquement les différentes espèces car les périodes de reproduction peuvent ne pas être superposées (Inglis, 1962). En général, même lorsque les larves ont été correctement décrites, le tri jusqu'au niveau spécifique sera long et fastidieux. Il sera plus facile si la détermination générique suffit.
2.3.1.1 Dispersion des individus et traitement des données
Le mode de dispersion des stades echantillonnés se répercute sur la variabilité des estimations d'abondance. L'utilisation des statistiques pour quantifier cette variabilité et effectuer des comparaisons entre des estimations obtenues, à des périodes ou dans des zones différentes, implique une normalité des distributions et une indépendance entre la moyenne et la variance qui ne sont en général pas réalisées dans le plancton où la distribution la plus classiquement observée est une distribution en essaims (surdispersion). L'analyse du type de distribution permet, par une transformation adéquate des données, de se rapprocher des conditions permettant l'inférence statistique.
Il n'existe pas à notre connaissance d'étude sur le mode de dispersion des larves de crevettes. On peut cependant penser qu'elle peut être du même type que celle que Frontier (1974) a mise en évidence pour les larves de brachyoures tropicaux qui sont également méroplanctoniques et les Lucifer. Lorsque le taxon n'est représenté que par un petit nombre d'organismes, la distribution suit généralement une loi de Poisson où la variance est égale à la moyenne. Dans la gamme habituelle des tailles des échantillons de plancton recueillis il montre que lorsque l'amplitude des variations des nombres observés est grande, la relation entre la moyenne et la variance n'est pas linéaire (Fig. 8). La pente voisine de l pour les petites valeurs (loi de Poisson) est comprise entre 1 et 2 pour les valeurs moyennes et supérieure à 2 pour les valeurs élevées ce qui nécessiterait, pour stabiliser la variance, une transformation différente pour chaque gamme d'abondance. Pour pallier cet inconvénient, Frontier propose une transformation unique de la forme log carré (n + 1), l'addition d'une unité à l'effectif permettant de prendre en compte les effectifs nuls. Cette transformation a de plus le mérite (par rapport à la transformation log) de moins écraser les fortes valeurs et de moins exagérer les variations aléatoires des plus faibles.
Cette transformation a été utilisée par Le Reste (1973) pour l'étude de Penaeus indicus à Madagascar.
D'autres auteurs ont utilisé une transformation log10 (n + 1), que l'on peut considérer comme
valable pour les petits effectifs. D'autres encore, appliquant les résultats de Anscombe (1948), ont
appliqué une transformation 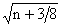 Frontier (1974) rappelle cependant que la transformation log est
le plus souvent préférée pour les êtres vivants car les réponses biologiques aux variations ambiantes qui
les ont suscitées sont souvent exponentielles. D'une manière plus générale, le traitement des données
peut être rattaché à celui, classique, du plancton et l'on se réfèrera utilement pour une étude plus
approfondie à Windsor et Clarke (1940), Silliman (1946), Barnes et Marshall (1952), Alsthrom (1954),
Frontier (1974), Hemple (1973) et Bougis (1974). Des exemples seront trouvés, pour les crevettes, chez
Munro, Jones et Dimitriou (1968), Roessler et Rehrer (1971) en Floride, Kutkuhn et al. (1969), Temple et
Fischer (1967) au Texas.
Frontier (1974) rappelle cependant que la transformation log est
le plus souvent préférée pour les êtres vivants car les réponses biologiques aux variations ambiantes qui
les ont suscitées sont souvent exponentielles. D'une manière plus générale, le traitement des données
peut être rattaché à celui, classique, du plancton et l'on se réfèrera utilement pour une étude plus
approfondie à Windsor et Clarke (1940), Silliman (1946), Barnes et Marshall (1952), Alsthrom (1954),
Frontier (1974), Hemple (1973) et Bougis (1974). Des exemples seront trouvés, pour les crevettes, chez
Munro, Jones et Dimitriou (1968), Roessler et Rehrer (1971) en Floride, Kutkuhn et al. (1969), Temple et
Fischer (1967) au Texas.
La représentation spatiale des abondances pose également un problème. L'utilisation des isoplèthes donne, en général, une bonne image synthétique mais il est nécessaire de choisir une progression numérique des abondances qui soit adaptée. En conclusion à une étude sur la variabilité de base, Frontier (1974) a suggéré l'existence de lois statistiques de dispersion largement indépendantes du groupe zoologique puisque probablement liées au phénomène physique de dispersion dans une phase liquide turbulente et conduisant à adopter la transformation log2 ainsi que nous l'avons rappelé plus haut. Selon cet auteur les données ainsi transformées se distribuent presque normalement avec une variance stable de 0,7026 ou σ=0,838 dans des échantillons prélevés en un même point. Cette variabilité est résiduelle et c'est à elle qu'il convient de comparer les variabilités spatiales. Les isoplèthes devraient donc être choisies sur la base d'un intervalle constant d'amplitude 2 × 1,96σ≃3,29 dans l'échelle des transformées (0 – 3,29 – 6,58 – 9,87 etc.) On aura donc pour les abondances non transformées, la progression suivante: 1,64, 365, 1 400, 4 200, 11 500, 27 000, etc. Cet étagement des isoplèthes a de plus le mérite de moins écraser les fortes valeurs et de moins exagérer les fluctuations aléatoires des plus faibles, ainsi que cela a été dit plus haut.
2.3.1.2 Les variations cycliques
Une bonne connaissance de ces variations permettra d'optimiser l'échantillonnage.
2.3.1.2.1 Le rythme nycthéméral
Temple et Fischer (1967) trouvent une répartition des larves de penaeïdes proches du fond le jour et de la surface pendant la nuit. Cependant, ils notent que lorsque la masse d'eau est instable, la distribution est plus homogène. Kutkuhn et al. (1969) trouvent, en revanche, dans la même région, des larves de P. setiferus et P. aztecus dans la couche d'eau de surface le jour alors qu'un échantillonnage effectué de nuit a permis d'observer un maximum de larves au niveau du fond. Roessler et al. (1969) notent que les protozoés I de P. duorarum sont plus communes au niveau du fond mais que les protozoés II et III entreprennent des migrations verticales conduisant à une augmentation de l'abondance en surface la nuit. Temple et Fischer (1965) et Roessler et al. (1969) confirment la répartition des postlarves planctoniques en surface alors que Kutkuhn et al. (1969) observent une distribution homogène.
Les résultats obtenus ne sont donc pas cohérents.
2.3.1.2.2 Le rythme lunaire
Roessler et al. (1969) notent une augmentation de l'abondance des larves en lune sombre en rélation avec un accroissement de la ponte. Ces observations confirment celles de Munro et al. (1968).
2.3.1.3 Quelques principes de l'échantillonnage
L'emplacement des stations doit tenir compte de la répartition des adultes. Il sera a priori préférable de resserrer les stations dans les zones où l'abondance est la plus élevée. L'échantillonnage périodique d'un certain nombre de stations, prises au hasard dans un quadrillage préétabli, est de nature à réduire la variance pour un même nombre de prélèvements et à permettre son calcul (échantillonnage aléatoire, stratifié ou simple).
Etant donné la brièveté des stades larvaires, l'échantillonnage doit être établi avec une fréquence élevée. A chaque instant, la composition observée d'une cohorte de larves dépendra en partie de son âge absolu, donc du temps séparant l'échantillonnage de la ponte. La durée de la phase larvaire étant d'environ l mois, l'échantillonnage doit être établi sur la base d'une fréquence plus élevée. Si le rythme lunaire de ponte est vérifié, on pourra utiliser la même fréquence pour les prélèvements. Il convient de noter que toute période d'échantillonnage légèrement différente de l'oscillation de base du phénomène échantillonné, introduira une oscillation artificielle dans les résultats. L'idéal, si les moyens disponibles le permettaient, serait d'échantillonner à chaque phase lunaire. Il est souhaitable d'augmenter la fréquence pendant les périodes favorables de l'année (par exemple, celles ou le pourcentage de femelles mûres est élevé).
Compte tenu de l'hétérogéneïté des données sur la distribution verticale des larves, les traits obliques paraissent tout indiqués, surtout si l'échantillonnage a lieu de jour.
2.3.1.4 Les engins de prélèvement
En pratique n'importe quel filet à plancton peut faire l'affaire en adoptant un maillage adapté aux stades recherchés. Nous en citerons quelques-uns:
Le filet de type GULF V est maintenu ouvert grâce à une armature métallique. Il measure 0,40m de diamètre d'ouverture. Un débit-mètre permet de calculer le volume d'eau filtré. Munro et al. (1968) ont utilisé une maille de 293 microns qui laissait passer les nauplii mais assurait un échantillonnage correct des stades plus âgés. Kutkuhn et al. (1969) ont utilisé une maille de 190 microns avec laquelle ils pensent avoir correctement échantillonné tous les stades. Le Reste (1978) a utilisé un filet Clarks-Bumpus modifié par Petit et Bour (1971) dont l'ouverture est de 0,30 m et le vide de maille 180 microns.
En ce qui concerne la manoeuvre des filets, la densité des larves de penaeïdes dans le plancton est trop faible pour que des traits verticaux puissent permettre l'obtention d'échantillons exploitables. Le filet est donc utilisé en trait horizontal ou oblique. Le trait oblique est probablement préférable car il permet de réduire le biais dû à une éventuelle stratification des larves dans la colonne d'eau. Les traits doivent toujours être de courte durée (moins de 10 mn) pour éviter le colmatage. Avec le “Clarke-Bumpus” mentionné plus haut, un début de colmatage apparaît lorsque le volume filtré dépasse 50 mètres cubes. Ce chiffre n'est qu'indicatif car il dépend de la charge solide et biologique de l'eau. Le plancton est conservé dans du formol neutralisé à 10 pour cent.
2.3.2 Les postlarves en migration
Il s'agit ici des postlarves ayant entamé le processus d'entrée dans les estuaires après environ 3 semaines de vie pélagique en mer. Leur comportement sera de plus en plus benthique.
2.3.2.1 Dispersion et traitement des données
L'essentiel a été dit au paragraphe 2.3.1.1. La plupart des auteurs admettent que la variance est proportionnelle à la moyenne des effectifs récoltés et utilisent une transformation log (n + 1) pour la stabiliser et pour pouvoir ainsi utiliser les méthodes statistiques classiques. Rappelons que Frontier (1974) propose l'utilisation de la transformation log carré (n + 1).
2.3.2.2 Les variations cycliques
2.3.2.2.1 Le rythme nycthéméral
Quel que soit l'engin de capture considéré, le nombre de postlarves observé est presque toujours plus élevé la nuit que le jour (Tabb et al. (1962); Baxter (1963); Eldred et al. (1965); Copeland et Truitt (1966); Caillouet et al. (1968); Roessler et al. (1969); Subrahmanyam et Rao (1970); Roessler et Rehrer (1971); Garcia (1977); Young et Carpenter (1977); Lhomme (1979).
Quelques auteurs cependant n'ont pas observé de différences (Eldred et al. (1965) pour P. duorarum; St. Amant et al. (19656); Caillouet et al. (1970).
Les observations sur l'abondance des postlarves migrantes en fonction de la profondeur, sont quelque peu contradictoires. Roessler et al. (1969) et Roessler et Rehrer (1971) signalent que les captures les plus importantes, de nuit, aussi bien en pleine qu'en nouvelle lune, sont faites au niveau du fond. Eldred et al. (1965) ont trouvé nettement plus de postlarves en surface qu'au fond le jour et légèrement plus au fond qu'en surface la nuit. Copeland et Truitt (1966) n'ont pas observé de différence entre le fond et la surface le jour mais ont noté une plus grande abondance en surface la nuit.
2.3.2.2.2 Le rythme lunaire
Les captures sont généralement plus élevées en nouvelle lune (Subrahmanyam (1966); William et Deubler (1968); Roessler et al. (1969); Subrahmanyam et Rao (1970); Roessler et Rehrer (1971); Garcia (1977). Un deuxième maximum moins important est parfois signalé en pleine lune. Cependant, il faut noter que Eldred et al. (1965) et Subrahmanyam et Ganapati (1971) observent parfois le maximum en pleine lune.
2.3.2.2.3 Le rythme tidal
Pratiquement tous les auteurs signalent des captures plus abondantes pendant le flot (Tabb et al., 1962; Eldred et al., 1965; St. Amant et al., 1966; Caillouet et al., 1968 et 1970; Roessler et al., 1969; Subrahmanyam et Rao, 1970; Roessler et Rehrer, 1971; Garcia, 1977; Young et Carpenter, 1977; Lhomme, 1979). Caillouet et al. (1968,1970) signalent cependant que le maximum de jour qu'ils ont observé est associé au jusant ou à l'étale de basse mer.
Les résultats concernant les postlarves benthiques sont donc assez concordants: les captures les plus abondantes sont obtenues la nuit, en période de nouvelle lune, pendant le flot.
2.3.2.2.4 Le rythme saisonnier
L'abondance des postlarves dans les estuaires est la résultante des mécanismes de reproduction et de transport par les courants pendant une période où la survie dépend vraisemblablement des conditions ambiantes, bien qu'en général on tende à considérer que la variation de la reproduction est la seule source des oscillations saisonnières.
L'action des facteurs du milieu sur la migration larvaire se traduit bien dans les variations de la taille des postlarves au moment de la migration dans les estuaires. Ce type de variations a été observé par Baxter et Renfro (1966), Copeland et Truitt (1966), Temple et Fischer (1967), Garcia (1977), Le Reste (1978), Lhomme (1979). Garcia (1977) et Lhomme (1979) ont montré que les variations sont synchrones pour tous les stades (définis par les formules rostrales) et sont positivement corrélées avec la richesse phytoplanctonique en mer et négativement corrélées avec la température. D'autres hypothèses ont été également envisagées pour expliquer ce phénomène: variations de la distance de la zone de ponte par rapport à l'embouchure, changement de la vitesse de croissance, action de refoulement des crues au moment des pluies et hibernation des larves hors des lagunes.
2.3.2.3 Quelques principes d'échantillonnage
Les postlarves sont récoltées dans très peu d'eau sur des hauts fonds vaseux ou couverts de végétaux, ou en pleine eau dans l'axe des chenaux. L'échantillonnage dans un chenal principal, quand il est réalisable, a l'avantage de porter sur une zone de concentration souvent brassée par la turbulence et où les variabilités spatiale et d'échantillonnage seront vraisemblablement plus faibles que dans l'estuaire lui-même. Les rythmes nycthéméraux et lunaires y sont très nets et l'échantillonnage est plus aisément standardisé. Les captures étant en général plus élevées la nuit que le jour (surtout en pleine eau et en surface), pendant le flot et à la nouvelle lune (et si ces faits sont vérifiés pour la zone concernée par quelques tests), il pourra suffire d'échantillonner une fois par mois à la nouvelle lune, la nuit à marée montante. Si les moyens le permettent, il est bon d'effectuer également des observations en pleine lune.
L'abondance variant avec le stade de la marée, on peut échantillonner toute la période du flot par des coups de filets de courte durée pour éviter le colmatage toujours rapide et intégrer la surface de la courbe obtenue pour calculer un indice d'abondance. Garcia (1977) a montré, en Côte d'Ivoire, que lorsque la marée est de type semi-diurne les deux marées hautes qui se produisent au début et à la fin de la nuit fournissent une information redondante et que l'échantillonnage d'un seul cycle de marée est suffisant. Le travail peut encore être réduit en échantillonnant seulement la partie montante du cycle de l'abondance nulle à l'abondance maximale par des traits courts, en arrêtant l'échantillonnage lorsque le maximum est dépassé (un peu après l'étale de haute mer). Lorsque l'échantillonnage est effectué à partir d'un pont, on peut effectuer plusieurs traits simultanés pour calculer une variance. Lorsqu'il est effectué à partir d'une petite embarcation, ceci n'est, en général, pas possible. Lorsque l'échantillonnage est effectué sur le fond, St. Amant et al. (1965) ont montré qu'on pouvait réduire la variance en échantillonnant aléatoirement un quadrillage de stations préétablies au lieu de visiter périodiquement des stations fixes.
La distribution bathymétrique des postlarves en migration n'étant pas claire, il conviendrait d'effectuer des traits obliques (difficiles à réaliser avec une embarcation légère) ou des traits de fond et de surface simultanés (ce n'est réalisable qu'à partir d'une plateforme fixe et avec des courants suffisants, ou une grosse embarcation).
2.3.2.4 Les engins de prélèvement et leurs manoeuvres
De manière générale, le problème posé par le prélèvement des larves de crevettes se rattache largement à celui de la collecte du plancton en général et on pourra se référer utilement, pour une bonne bibliographie, à Jossi (1970).
2.3.2.4.1 Prélèvement le long des berges, en eau peu profonde
(a) Le chalut à postlarves Renfro (1963) (Fig. 9).
C'est l'engin le plus utilisé. Il a une forme conique et comporte 50 mailles au cm2. Il a été utilisé en particulier par Baxter (1963) au Texas, par Brisson et Lucet (1975) au Brésil et par St. Amant et al. (1965) en Louisiane. En opération, le filet est traîné par un homme au moyen d'une bride fixée aux extrémités d'une barre de fer. Quand le filet est traîné lentement, la barre racle le fond, chassant les postlarves vers l'entrée du filet. Le filet est relié par une corde à un poteau planté sur le rivage. Au début du trait la corde est tendue parallèlement au rivage puis utilisée comme un rayon constant lorsque le filet est tiré; ce dernier décrit ainsi un demi-cercle. De cette manière le trait est toujours fait à la même station et sa longueur est constante. Le trait recoupe également plusieurs strates bathymétriques.
Une analyse statistique des performances de cet engin a été faite par Caillouet et al. (1968) qui ont trouvé que l'abondance des postlarves capturées par unité de longueur parcourue était indépendante, entre 15 et 45 m, de la longueur du rayon; ils préconisent donc un rayon de 15 m. Ils conseillent également de faire au moins un aller-retour pour éliminer l'effet éventuel du courant de marée et confirment que la variance des estimations d'abondance est proportionnelle à la moyenne. Berry et Baxter (1969) indiquent que la variabilité entre deux coups de filet successifs est de 2 pour cent seulement mais que la variabilité sur une période de 4 jours est égale à la variabilité saisonnière, ceci étant dû au fait qu'en un endroit donné l'abondance des postlarves peut varier de 0 à un nombre très élevé en quelques heures.
(b) Les traîneaux ou filets sur patins
Pullen, Mock et Ringo (1968) ont utilisé un petit traîneau tiré à la main le long des berges. D'après les auteurs, cet engin très simple est plus facile à utiliser que le chalut Renfro. Allen et Hudson (1970) ont mis au point un traîneau à aspiration par effet venturi. Il permet d'aspirer et de tamiser toute la couche supérieure du sédiment. Cet engin échantillonnant une surface étroite permet une étude fine de la distribution bathymétrique des larves. Il permet de capturer environ 2 fois plus de jeunes crevettes que le traîneau simple de Pullen, Mock et Ringo (1968), et est efficace pour l'estimation de la biomasse benthique dans son ensemble. Brusher et Marullo (1970) ont mis au point un traîneau fermant équipé d'un rouleau excavateur à l'avant et d'un débit-mètre, utilisable dans des zones de profondeur modérée. Tous ces engins sont également susceptibles de capturer des juvéniles avec une efficacité variable.
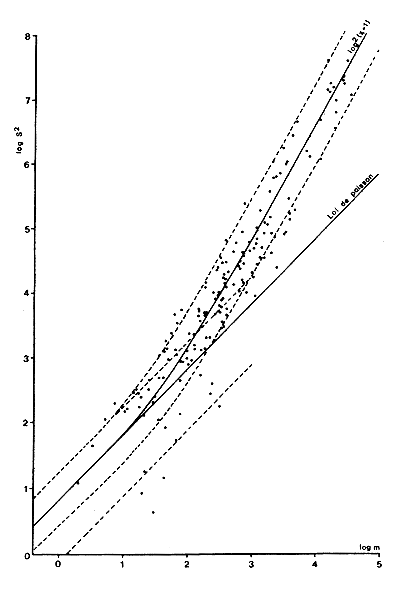 | 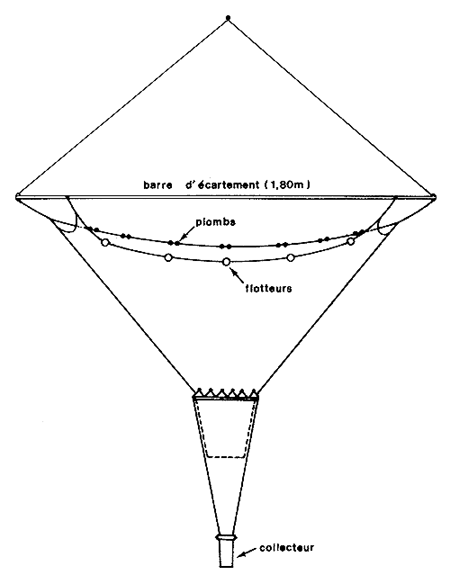 |
Fig. 8: Relation moyenne-variance dans un peuplement zooplanctonique tropical (d'après Frontier, 1974) | Fig. 9: Chalut à post-larves (d'après Renfro, 1963) |
2.3.2.4.2 Prélèvements en pleine eau, dans les chenaux ou les baies
(a) Les filets fixes
Young et Carpenter (1977) ont utilisé un filet dont l'ouverture est losangique, possédant une maille de 1 mm. La profondeur de pêche était réglée par un orin reliant le filet à une bouée de surface. La partie inférieure du filet reliée à une ancre était lestée avec un poids de 13,6 kg. Des émerillons permettaient au filet de pivoter librement et de rester en permanence dans l'axe du courant. Ce dernier était toujours assez fort pour maintenir le filet ouvert. Toutes les 10 à 20 minutes, le filet, remonté pour éviter le colmatage, était remplacé par un nouveau. Les filets étaient disposés en plusieurs points de la section du chenal.
(b) Les filets traînés
Différents types de filets ont été utilisés. Il est préférable d'en adopter un dont le diamètre d'ouverture soit assez grand pour limiter les phénomènes d'évitement. Roessler et al. (1969) ont utilisé un filet de 1 m de diamètre d'ouverture qui semble convenir pour l'échantillonnage des postlarves. Les auteurs ont cependant utilisé une maille (467 microns) qui est peut-être inutilement étroite. Garcia (1977) comparant les captures de deux filets dont la maille était respectivement 500 et 700 microns, n'a pas constaté de différence et a opté pour la seconde maille, ce qui permet de diminuer sensiblement le colmatage. Le filet doit être muni d'un débit-mètre.
(c) Prélèvements en continu
Fontaine et al. (1972) ont mis au point un dispositif qui permet de récolter de grandes quantités de postlarves vivantes. Deux filets sont maintenus juste au-dessous du niveau de la surface, de part et d'autre d'un bateau ancré (ou d'une plateforme) (Fig. 10). Du fond de chaque filet partent deux tuyaux qui se réunissent en un seul sur le pont du bateau. Une pompe permet d'aspirer l'eau et les organismes qui pénètrent dans les filets. L'eau est filtrée à travers trois écrans munis de baguettes dont l'écartement est décroissant. Le matériel recueilli dans la dernière cuve contient une grande proportion de postlarves de penaeïdes bien que 10 pour cent environ d'entre elles aient été retenues au cours du filtrage. Ce matériel est ainsi très facile à trier.
Marullo (1973) a mis au point un dispositif qui permet le prélèvement automatique d'échantillons en pleine eau. A intervalles de temps réguliers, une pompe aspire l'eau qui est filtrée sur un petit filet à maille de 1 mm2. Ce filet, ainsi que onze autres, est fixé sur un support circulaire horizontal. Toutes les deux heures le support tourne légèrement sur lui-même de manière à ce qu'un nouveau filet vienne se placer sous l'arrivée d'eau. A part le filet placé sous l'arrivée d'eau, tous les autres baignent dans un bac rempli de formol dilué qui assure la conservation des échantillons. Malheureusement, le nombre de postlarves capturées par heure est relativement faible (5 en moyenne), bien moindre que dans les captures obtenues simultanément avec le filet de Renfro. Par ailleurs, les variations saisonnières d'abondance obtenues avec les deux engins n'étaient pas synchrones. L'auteur pense cependant que l'échantillonnage pourrait être amélioré en augmentant le diamètre de la prise d'eau, en concentrant l'effort d'échantillonnage pendant le flot et en choisissant un site d'échantillonnage plus judicieux.
2.3.3 Les juvéniles dans les estuaires
2.3.3.1 Distribution
Après leur entrée dans les estuaires, les postlarves se concentrent dans des zones de faible profondeur (inférieure à 1 mètre). Leur distribution est très hétérogène et leur échantillonnage est alors particulièrement difficile.
La salinité a longtemps été invoquée comme facteur essentiel de cette répartition (Gunter, 1950 et 1956; Gunter, Christmas et Killebrew, 1964; Williams, 1955). Des preferendums légèrement différents ont été notés par exemple pour Penaeus setiferus, P. aztecus et P. duorarum vivant dans les mêmes estuaires. Cependant, Zein Eldin et Aldrich (1965) ont montré que la salinité n'avait d'effet ni sur la croissance, ni sur la survie et que d'autres facteurs devaient être responsables de la répartition (nourriture, couverture végétale, nature du sédiment, courants, etc.). Williams (1955) note d'ailleurs la préférence des crevettes pour des fonds meubles riches en matière organique. Ces résultats sont confirmés par Loesch (1965), Galois (1975) et d'autres encore. Pour Garcia (1977), la limite de distribution de P. notialis en Côte d'Ivoire est celle de l'influence marine. Il est vraisemblable en fait que la salinité, ou d'une manière plus générale l'influence marine et en particulier les courants de marée, jouent un rôle dans la définition des limites de la distribution. A l'intérieur de ces limites l'abondance est liée à d'autres facteurs qui prennent le relais et en particulier des facteurs trophiques.
La distribution des crevettes dans les estuaires est également caractérisée par des variations spatio-temporelles importantes. L'importance des mouvements à l'intérieur des estuaires a été montrée par exemple par Tabb et al. (1962), Galois (1975), Parker (1970) et Le Reste (1978). Ces mouvements de balancement entre les berges et les chenaux apparaissent liés aux changements des facteurs ambiants tels que les dessalures liées aux pluies (Galois, 1975). Ces mouvements de faible amplitude ne sont perceptibles qu'avec un échantillonnage extrêmement soigné.
En grandissant, les crevettes migrent vers les zones plus profondes et les chenaux et il existe toujours un gradient de tailles croissantes de l'amont vers l'aval et des berges vers les chenaux (Williams, 1955; Dall, 1958; Tabb et al., 1962; Gunter et al., 1964; St. Amant et al., 1965; Saloman, 1965; Parker, 1970; Ruello, 1975; Galois, 1975; Le Reste, 1978. Au Sénégal, dans le “fleuve” Casamance où l'on rencontre un noyau sursalé dans le cours intermédiaire, l'évolution des tailles de l'amont vers l'aval est inverse (Lhomme, 1979) (Fig. 11).
2.3.3.2 Variations cycliques des rendements
Le caractère nocturne de l'activité des crevettes qui s'enfouissent tend à faire apparaître un rythme nycthéméral des rendements (Saloman, 1968). Garcia (non publié) a également observé une nette augmentation des rendements la nuit avec un chalut à panneaux. Cependant, Clarke et Caillouet (1973), travaillant avec le même type d'engin dans une petite baie, ont pêché davantage de P. aztecus le jour que la nuit et n'ont pas trouvé de différences entre le jour et la nuit pour Penaeus setiferus. Ces divergences peuvent s'expliquer par le fait que dans ces zones de faible profondeur, les variations classiques de capturabilité entre le jour et la nuit sont perturbées par la turbidité des eaux mais également par les remous d'hélices. D'autre part, dans des substrats très meubles, le travail d'affouillement du chalut est considérable et souvent suffisant pour capturer les crevettes enfouies. Munro (1975) indique que cela dépend des espèces. D'autre part, Saloman (1968) a obtenu de meilleures captures en lune sombre (NL, PQ, DQ) qu'en lune claire (PL). Clarke et Caillouet (op. cit.) ont observé le maximum de captures en marée haute.
2.3.3.3 Quelques principes d'échantillonnage
Il est pratiquement impossible d'échantillonner toute la gamme des tailles d'une population (de 2 à 10 centimètres) avec le même engin, en raison de la répartition différentielle des tailles dans des zones d'accessibilité variée. Les berges, couvertes d'herbes ou non, accessibles à pied ou non, suivant la fermeté de la vase, sont échantillonnées à la senne ou au traîneau alors que les chenaux sont le plus souvent échantillonnés au chalut. Il serait donc extrêmement difficile de reconstituer la structure de taille d'une population dans une petite baie et a fortiori dans une lagune.
La croissance des crevettes étant très rapide, la fréquence des échantillonnages doit être élevée (1 campagne par semaine). Pour l'étude de la croissance ou des mouvements à petite échelle, il peut être nécessaire de circonscrire l'étude à une zone réduite judicieusement choisie (en évitant par exemple les zones de passage) après une première prospection générale. Galois (1975) a obtenu ainsi d'excellents résultats avec des moyens limités.
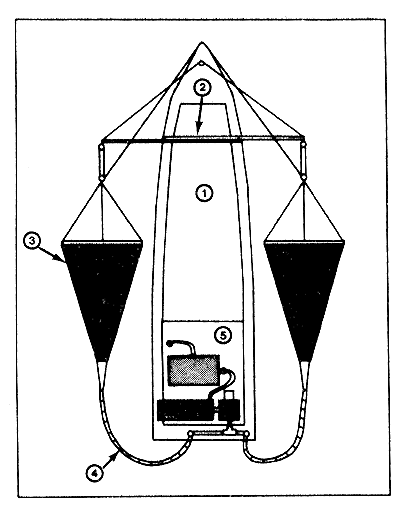
Fig. 10: Diagramme schématique du système de collecte en continu 1. vedette 2. barres transversales 3. filets rectangulaires 4. tuyau de pompage 5. système de pompage et de tri (simplifié de Fontaine et al., 1972)
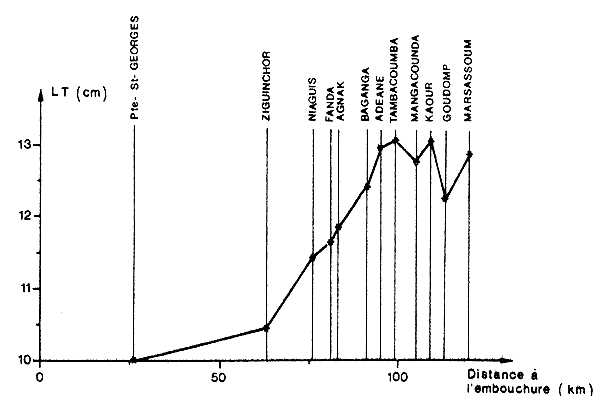
Fig. 11: Evolution de la taille moyenne des crevettes juvéniles le long de l'axe amont-aval dans l'estuaire de la Casamance (Sénégal) (d'après Lhomme, 1979). (Ce schéma est l'inverse de celui qui est généralement admis)
Bien qu'aucune étude n'ait été faite à ce sujet, les techniques de prospection aléatoires stratifiées devraient être utilisées de préférence, en augmentant le nombre des prélèvements dans les zones riches.
2.3.3.4 Les engins de prélèvement utilisés et leur manoeuvre
Ils sont extrêmement variés pour répondre à la variabilité des habitats à échantillonner:
2.3.3.4.1 Les filets sur patins ou traîneaux
Ils sont de formes diverses bien que le fonctionnement soit toujours basé sur le même principe très simple. Allen et Inglis (1958) ont utilisé un petit traîneau poussé de l'arrière par un long manche. Cette façon de procéder permet d'éviter de perturber le substrat avant le passage de l'engin qui capture d'ailleurs aussi bien les postlarves que les juvéniles. Cet engin de faible ouverture, échantillonne mal les juvéniles de grande taille. Penn et Stalker (1975) ont mis au point un dispositif qui permet d'échantillonner de jour les juvéniles enfouis dans le sédiment. Le filet, monté sur un châssis rectangulaire sur skis, est équipé d'un rouleau pour éviter l'envasement. Une pompe projette, à la partie antérieure du filet, un jet d'eau qui affouille le sédiment sur 3 cm provoquant l'émergence des crevettes. Les auteurs considèrent que l'échappement est nul.
2.3.3.4.2 Les engins dérivés de la pêche artisanale
On utilise souvent ces engins, tels quels ou modifiés, et on peut citer par exemple le kili (Sénégal) qui est un petit chalut tenu ouvert par deux bâtons manoeuvrés par deux hommes qui le poussent devant eux le long des berges.
Le principe de la senne de plage est également utilisé. Avec un maillage très fin (tissus de moustiquaire par exemple) elle permet de capturer efficacement les postlarves et juvéniles de petite taille.
Le chalut à panneaux ou à perche est assez répandu. Le premier a la préférence en raison de son maniement aisé à partir d'une petite embarcation. Le plus souvent le chalut d'essai classique (try-net) est adopté avec, éventuellement, une modification du maillage (2,5 à 6 mètres de corde de dos, 50 cm de hauteur environ, 6 à 8 mètres de longueur et maillage variable).
L'efficacité du chalut en tant qu'échantillonneur sur petits fonds n'est pas certaine en raison des perturbations causées par les remous de l'hélice et les réactions d'évitement qu'elles doivent entraîner. Dans cet ordre d'idées Loesch et al. (1976) montrent que l'efficacité du chalut par petits fonds n'est que de 30 à 50 pour cent. Ce résultat est confirmé par Edwards (1977) qui a calculé une efficacité de 35 pour cent pour un petit chalut à perche, en eaux peu profondes. Si l'efficacité varie avec la profondeur d'eau sous la coque, ce qui est possible mais n'a jamais été démontré, il y a là une source de biais.
Le chalut à perche et ses dérivés, utilisé dans la pêche artisanale aux Etats-Unis, est un excellent échantillonneur (Tabb et Kenny, 1969) (cf. paragraphe 3.1.1.2). Il a également été utilisé en Australie par Young (1975).
2.3.3.4.3 La pêche électrique
Lamarque, Therezien et Charlon (1974), dans le cadre de leur essai d'adaptation de la pêche électrique aux eaux tropicales chaudes et conductrices, ont obtenu des résultats fructueux sur les crevettes de Madagascar, dans une mangrove. Les rendements horaires de l'épuisette électrique ont été de 0,3 à 2,7 kg/heure.
Le chalut électrique, très étudié en mer (paragraphe 3.2), ne paraît en revanche pas avoir été utilisé en estuaires. Il est vrai que la température de l'eau, sa stratification, les gradients de salinité et leurs conséquences sur la résistivité de l'eau entraînent des problèmes techniques difficiles à résoudre.
2.3.4 Les subadultes en migration
2.3.4.1 Distribution
Beardsley (1970) a étudié de manière détaillée la distribution des juvéniles en migration dans un canal. Il a montré que 83 pour cent des crevettes capturées l'ont été dans la couche de surface. La distribution dépend du cycle lunaire, et le nombre de crevettes en surface varie de 90 à 70 pour cent entre la pleine lune et le ler quartier (Fig. 12). Il n'a pas mis en évidence de différences liées à la salinité, à la taille, au sexe, à la marée ou à la température. Il a cependant observé des différences dans la distribution latérale en fonction de l'éclairement lunaire, les crevettes préférant apparemment le côté éclairé du canal.
2.3.4.2 Variations cycliques
Un résumé des connaissances sur les rythmes et migrations a été effectué par Allen (1966).
2.3.4.2.1 Rythme nycthéméral
Sauf cas exceptionnel, les crevettes ne migrent généralement pas pendant le jour (Idyll, 1964; Idyll et al., 1964; De Bondy, 1968; Yokel et al., 1969; Hoestlandt, 1969; De Labretonne et Avault, 1971; Garcia, 1977). Cependant, Le Reste (1978) à Madagascar n'a pas observé de différences dans les captures de Penaeus indicus obtenues à l'aide de barrières chinoises.
2.3.4.2.2 Rythme lunaire (Fig. 21)
Les captures sont pratiquement toujours plus importantes pendant la nouvelle lune et la pleine lune que pendant les quartiers, et le maximum absolu est en nouvelle lune (Copeland, 1965; Subrahmanyam, 1967; De Bondy, 1968; Yokel et al., 1969; Garcia, 1972 et 1977). Cela est vraisemblablement dû en grande partie au fait que les pêches sont effectuées à l'aide d'engins fixes pendant le jusant et sont donc plus importantes en période de vives eaux. Yokel (1969) a d'ailleurs démontré dans les Everglades (Floride) que 52 pour cent des variations de rendement observées pouvaient être attribuées aux variations de volume filtré en liaison avec les changements de vélocité du courant et d'amplitude de la marée.
De Bondy (1968) au Sénégal a également noté des variations du sex-ratio dans les captures en fonction du rythme lunaire.
Confirmant cependant les observations de Racek (1959), Boddeke, Dijkema et Stemelink (1977) ont montré un rythme identique pour Penaeus brasiliensis dans un lac de retenue fermé, alimenté par pompage et sans rythme de marée, ce qui laisserait supposer que les courants ne sont pas les seuls facteurs agissant. Ces auteurs indiquent que la sensibilité des crevettes aux stimulis de migration dépend du stade de mue. Cette dernière est centrée sur la pleine lune inhibant la migration qui commence après le dernier quartier lorsque la mue est terminée.
2.3.4.2.3 Rythme tidal
Lorsqu'elles sont pêchées avec des engins fixes, les captures de crevettes sont toujours plus élévées pendant le jusant que pendant le flot (Idyll et al., 1964; Yokel et al., 1969; De Bondy, 1968; Hoestlandt, 1968; De Labretonne et Avault, 1971; Garcia, 1972 et 1977; Le Reste, 1978; Lhomme, 1979). Avec d'autres engins de capture, l'abondance apparente la plus élevée peut se situer à d'autres périodes du cycle tidal. Par exemple, De Labretonne et Avault (op. cit.) l'ont observée pendant le jusant avec un filet fixe mais pendant le flot avec un épervier. La différence peut provenir du fait que certains engins capturent une phase active, nageant en pleine eau et vers l'embouchure, alors que d'autres capturent une phase de la population qui est enfouie, au repos, dans le sédiment. Il est d'ailleurs possible que les indices d'abondance obtenus avec ces deux types d'engins (passifs fixes ou actifs tractés) ne soient pas tout à fait comparables. En général, on peut donc noter que les rendements des juvéniles en migration sont maximums de nuit, à marée descendante et en nouvelle et pleine lune si l'échantillonnage est réalisé avec un engin fixe. Lorsqu'on utilise un engin tracté raclant le fond, il faut s'assurer que l'on mesure bien l'abondance de la phase migrante et pas celle de la population en place dont le processus de croissance n'est pas terminé.
2.3.4.2.4 Rythme saisonnier
C'est celui qu'il importe d'obtenir, la connaissance des rythmes précédents étant surtout utile pour optimiser l'échantillonnage. C'est en effet ce dernier rythme qui nous renseigne sur les variations saisonnières des recrutements, paramètre dont la connaissance est essentielle pour l'étude du stock.
Bien que la reproduction soit le plus souvent continue chez les penaeïdes, on distingue en général une oscillation saisonnière nette que l'on peut relier à l'abondance des femelles mûres ou des postlarves quelques 2 à 3 mois plus tôt (cf. Fig. 6). L'oscillation saisonnière observée est en fait l'évolution de l'abondance apparente définie comme le produit de l'abondance réelle par la capturabilité. Cette dernière est liée aux courants de marées et de crues et on peut donc parfois observer une déformation de l'oscillation de base correspondant aux grandes marées annuelles ou aux périodes de crues. L'oscillation de base peut également être déformée par les chutes brusques de température en automne, qui tendent, dans les secteurs les plus septentrionaux de la distribution, à chasser les crevettes vers des zones plus profondes (Tabb et al., 1962).
Les facteurs pouvant agir sur le départ des crevettes sont certainement nombreux et Garcia (1977) les a passés en revue. Il faut noter qu'ils interfèrent entre eux, ainsi que dans leur action sur le comportement (Zein-Eldin et Aldrich, 1965) et on peut penser en outre que les facteurs décisifs (limitants) ne sont pas forcément les mêmes dans les régions à faible variation thermique annuelle et forte pluviosité (Inde, Madagascar, Côte d'Ivoire) et dans celles qui ont des caractéristiques inverses (Sénégal, Floride, Texas).
La taille moyenne des crevettes en migration suit également une oscillation saisonnière (Fig. 13). Ceci a été observé par de très nombreux auteurs (Tabb et al., 1962; St. Amant et al., 1965; Trent, 1967; Yokel et al., 1969; Pullen et Trent, 1969; Parker, 1970; Ruello, 1973; Garcia, 1972 et 1977; Le Reste, 1978; Lhomme, 1979). Plusieurs hypothèses ont été émises pour expliquer ce phénomène: croissance puis recrutement, compétition pour la nourriture et durée variable du séjour en lagune. Il est vraisemblable qu'en fait la taille à la migration est le résultat complexe des conditions trophiques et de la température pendant la croissance ainsi que la durée du séjour qui, en fin de croissance, peut être écourtée par l'apparition de conditions défavorables (dessalure ou refroidissement).
2.3.4.3 Quelques principes d'échantillonnage
Il doit impérativement avoir lieu de nuit. Il est souhaitable que l'engin échantillonne une couche superficielle assez épaisse pour que la très grosse majorité des crevettes présentes dans la masse d'eau soit prise. Il est préférable, si le chenal échantillonné est large, de faire plusieurs prélèvements simultanés sur toute la largeur, ce qui n'est possible qu'avec des filets fixes. Il faut également noter qu'aux très faibles vitesses de courant, les crevettes sont capables de nager à contre-courant hors du filet. Les passages étroits et les ponts sont de bons sites de travail. Les engins doivent être mouillés au début du jusant et relevés dès que le courant faiblit. Il peut être utile de mesurer le courant ou de placer des débit-mètres près des filets pour connaître le volume filtré. Pendant une phase de marée, il est possible d'effectuer des prélèvements réguliers au fond de filets fixes pour avoir l'évolution des nombres capturés.
Il faut noter également que si l'on cherche un indice de recrutement (donc une grandeur proportionnelle à la quantité de crevettes ayant quitté la nurserie), c'est le nombre par marée qui est important et non le nombre par unité de volume filtré.
Enfin, la pêche artisanale, surtout lorsqu'elle utilise des filets fixes, est un excellent moyen d'obtenir ce type d'indice avec une bonne précision. Un exemple d'analyse approfondie des données obtenues par cette méthode sera trouvé dans Garcia (1977). Un excellent travail d'échantillonnage expérimental rationnel a été effectué par Yokel (1969) et Beardsley (1970).
2.3.4.4 Les engins de prélèvement
2.3.4.4.1 Les filets fixes expérimentaux
Yokel et al. (1969) ont utilisé deux filets de 5,18 m de long dont l'ouverture, de 1,8 × 1,07 était tendue sur un cadre rectangulaire (wing net). Les deux filets d'un maillage de 1,9 cm (étiré) étaient maintenus en surface de part et d'autre d'une embarcation légère. Les filets ancrés de grande taille type “channel net” ont également été testés par Yokel mais restent peu utilisés. Beardsley (1970) a effectué une analyse détaillée de la distribution des crevettes dans la masse d'eau en échantillonnant toute la section verticale d'un canal à l'aide d'un ensemble de 13 filets coniques de 50 cm de diamètre.
2.3.4.4.2 Le chalut à panneaux, de fond ou “pélagique”
A l'entrée de la baie de Galveston, Pullen et Trent (1969) ont récolté leurs échantillons à l'aide d'un petit chalut à panneaux traîné successivement en surface, entre deux eaux et au fond. Les prélèvements étant faits de jour, la capture par unité d'effort augmentait de la surface vers le fond. Le chalutage de surface est réalisé en fixant deux hydrofoils simples aux panneaux d'un chalut ordinaire (Fig. 14). Cet engin, facile à manier, donne des rendements 5 fois supérieurs à ceux d'un chalut de fond classique (Trent, 1967a).
2.3.5 Les subadultes et adultes en mer
2.3.5.1 Distribution
2.3.5.1.1 Répartition géographique
Elle est liée aux conditions de milieu. Les fortes concentrations faisant l'objet d'exploitation se trouvent sur des sédiments meubles dont la teneur en particules fines et matière organique varie suivant les espèces (Grady, 1971; Garcia, 1974).
Lorsqu'il existe plusieurs espèces dans une région, leur distribution relative paraît liée aux conditions hydrologiques et en particulier à leur tolérance vis-à-vis des gradients spatio-temporels de salinité (ou autres facteurs associés). C'est ainsi que l'on peut expliquer l'absence de P. duorarum au large de l'embouchure du Mississipi ou de l'Amazone (Burkenroad, 1939) et la distribution relative des 3 principales espèces ouest-atlantiques.
La répartition à moyenne échelle apparaît parfois liée à la turbidité (Crosnier, 1965; Lindner et Bailey, 1968).
La distribution générale paraît stable, sauf aux limites extrêmes de distribution où les crevettes sont susceptibles de migrations de grande amplitude en hiver (Burkenroad, 1939; Lindner et Anderson, 1956). Dans d'autres régions limites, la migration saisonnière n'a pas lieu et elle est remplacée par une modification du métabolisme (arrêt de croissance et baisse de l'activité). C'est le cas au Sénégal (Garcia et al., 1973; Lhomme, 1977).
2.3.5.1.2 Répartition bathymétrique
Localement, la distribution des crevettes est hétérogène. L'abondance n'est pas uniformément répartie et certaines strates de profondeur sont privilégiées. Si les limites géographiques sont le plus souvent faciles à mettre en relation avec la nature du fond et la présence d'estuaires à proximité plus ou moins immédiate, les limites bathymétriques sont plus difficiles à expliquer. Garcia (1977) a montré que la limite supérieure de distribution de P. notialis sur la côte ouest-africaine est conditionnée par la nature du sédiment, et que la limite inférieure paraît plutôt liée à l'hydrologie. Les conditions qui y prévalent (valeurs absolues et variations annuelles) sont assez curieusement les mêmes que celles que l'on trouve aux limites géographiques d'extension nord et sud de l'espèce.
Selon les zones ou les espèces, l'abondance est maximale au centre de la distribution bathymétrique (Fig. 15) (Garcia, 1974; Costello et Allen, 1970) ou à la côte (Lindner et Cook, 1970).
La distribution des tailles sur un fond de pêche n'est généralement pas homogène non plus. Le long de l'axe de migration des estuaires vers les profondeurs, on trouve souvent les plus petits individus dans la zone côtière et les plus grands adultes en profondeur (Burkenroad, 1939; Lindner et Anderson, 1956; Iversen, Jones et Idyll, 1960; Renfro et Brusher, 1964; Costello et Allen, 1966; George et al., 1968). Ce n'est cependant pas toujours le cas et Garcia (1977) observe en Côte d'Ivoire une zone centrale où les crevettes ont une taille moyenne encadrée de deux zones, côtières et profondes, où les grands individus dominent (Fig. 15).
La distribution des sexes a été peu étudiée. Cependant, Kunju (1970) signale qu'en Inde les Solenocera indica femelles pondent aux limites de l'aire de répartition, alors que les mâles restent dans les zones peu profondes. Garcia a observé en période de reproduction un pourcentage de femelles plus élevé à la côte et décroissant régulièrement vers les profondeurs (Fig. 15).
On verra au paragraphe 2.3.5.2 que toutes ces distributions sont susceptibles de variations périodiques.
2.3.5.1.3 Mode de dispersion
La distribution des individus à un endroit donné peut être parfois considérée comme homogène. Certains auteurs admettent en effet l'absence de comportement de “banc”. C'est le cas pour Penaeus aztecus (Cook et Lindner, 1970). Plus généralement, il semble que les penaeïdes présentent des phases de groupement en bancs, essaims ou “mattes”, P. duorarum (Costello et Allen, 1970), Parapenaeopsis sculptilis (Kirkegaard et Walker, 1970), Penaeus merguiensis (Kirkegaard et al., 1970), Metapenaeus dobsoni (Panikkar et Menon, 1956; De Bruin, 1965), Penaeus schmitti (Perez-Farfante, 1969), Penaeus indicus (Crosnier, 1965), Penaeus merguiensis (Munro, 1975).
2.3.5.2 Les variations cycliques
2.3.5.2.1 Le rythme nycthéméral
Les crevettes adultes s'enfouissent généralement dans le sédiment pendant le jour et nagent au voisinage du fond pendant la nuit; c'est alors qu'elles sont le plus facilement capturées par les chaluts classiques (Idyll, 1950; Williams, 1955 et 1958; Viosca, 1957; Eldred, 1958; Iversen et Idyll, 1960; Dall, 1958; Eldred et al., 1961; Egusa et Yamamoto, 1961; Fuss, 1964; Crosnier, 1964; Fuss et Ogren, 1966; Wickam, 1966; Le Guen et Crosnier, 1968; Garcia et al., 1973; Wickham et Minkler, 1975; Moller et Jones, 1975; Marcille, 1978).
Ce schéma peut cependant être perturbé lorsque l'intensité de la lumière traversant la couche d'eau est faible (eaux turbides, ciel nuageux); des crevettes qui sont normalement pêchées en abondance la nuit peuvent alors être capturées surtout le jour. C'est ainsi que des changements saisonniers du rythme nycthéméral d'activité “apparent” ont été montrés dans plusieurs secteurs du golfe de Guinée, en relation avec les variations hydroclimatiques (Garcia et al., 1973).
Chez certaines espèces, les captures sont plus importantes le jour que la nuit. C'est le cas notamment pour Penaeus indicus (Chabanne et Plante, 1971; Marcille, 1978), Penaeus setiferus (Idyll, 1950; Joyce, 1965), Penaeus schmitti (Perez Farfante, 1969), Metapenaeus macleayi et Penaeus plebejus (Racek, 1959), Xiphopenaeus kroyeri (Neiva, 1969), Penaeus notialis en Côte d'Ivoire (Garcia, Petit et Fonteneau, 1973; Garcia, 1975).
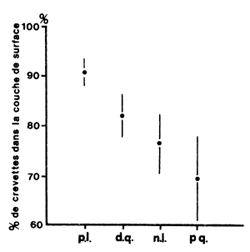 | 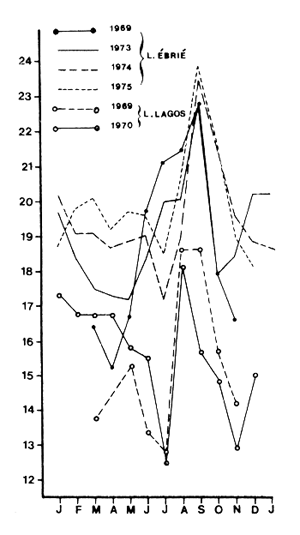 |
Fig. 12: Répartition verticale des crevettes en migration, à diverses phases lunaires (d'après BEARDSLEY, 1970) | Fig. 13: Variations saisonnières de la taille à la migration en Côte d'Ivoire (Lagune Ebrié) et au Nigéria (Lagune de Lagos) (d'après GARCIA, 1977) |
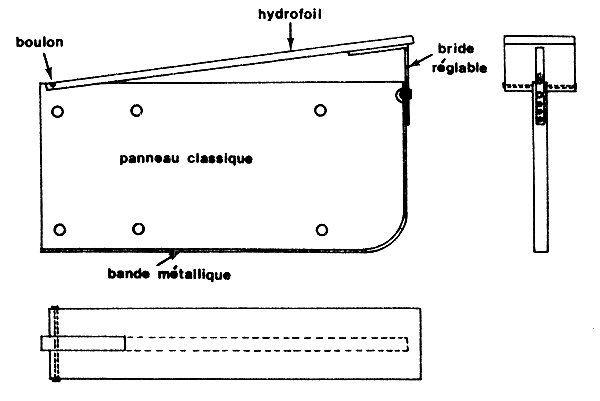
Fig. 14: Modification d'un chalut de fond à l'aide d'hydrofoils pour le chalutage de surface (d'après TRENT, 1967)
Dans les zones où plusieurs espèces cohabitent, l'existence de rythmes différents entraîne des variations nycthémérales de composition spécifique des captures. C'est ainsi qu'à Madagascar l'abondance de P. indicus varie de 10 pour cent (entre 2h et 6h) à 90 pour cent (entre 6h et 18h), pendant que celle de Metapenaeus monoceros passe de 75 à 2 pour cent et celle de Penaeus semisulcatus de 14 à 2,5 pour cent (Chabanne et Plante, 1971).
Des rythmes particuliers peuvent être observés au moment de la reproduction. A Madagascar, par exemple, pendant la période la plus favorable à la maturation des gonades, les femelles de P. indicus qui sont normalement capturées le jour sont alors essentiellement pêchées au début de la nuit.
2.3.5.2.2 Le rythme lunaire
Les crevettes qui sont normalement pêchées la nuit semblent pouvoir être capturées en plus grande abondance en période de nouvelle lune (Iversen et Idyll, 1960; Fuss, 1964; Idyll et al., 1969; Penn, 1976). Mais il est souvent difficile de mettre en évidence un rythme lunaire bien net; par exemple, pour Penaeus semisulcatus et Metapenaeus monoceros à Madagascar, Marcille (1978) signale que les captures sont plus élevées en période de pleine lune à la fin de la saison chaude et au début de la saison fraîche, et pendant le premier quartier de la nouvelle lune en fin de saison fraîche et début saison chaude. Il montre, d'autre part, que les résultats obtenus varient d'une année à l'autre. Les différences observées en moyenne entre les différentes phases sont faibles et leur signification n'est pas certaine.
2.3.5.2.3 Le cycle saisonnier
Il affecte de nombreuses caractéristiques du stock:
(a) Variations de la répartition bathymétrique
La distribution bathymétrique moyenne décrite au paragraphe précédent est susceptible de varier saisonnièrement surtout dans les régions à régime hydrologique contrasté. Crosnier (1963) a suggéré ce type de variations pour Penaeus notialis, Garcia (1974), à l'aide de données précises tirées des cahiers de pêche de la flottille de Côte d'Ivoire, a confirmé l'existence de déplacements cycliques du maximum de densité du stock, en liaison étroite avec les fluctuations de la thermocline (Fig. 17). A Madagascar, en baie d'Ambaro, les crevettes appartenant à l'espèce Penaeus indicus restent pratiquement bloquées dans la zone intertidale pendant la saison sèche alors qu'elles sont largement réparties dans la baie pendant la saison humide (Chabanne et Plante, 1971; Le Reste, 1978). Les variations de la répartition pourraient être liées à la disponibilité de la nourriture. En Inde, de nombreuses espèces effectuent de telles migrations en liaison avec la mousson et l'upwelling (FAO, 1973a, page 24).
(b) Variations de la distribution relative des sexes
Garcia (1974) a montré en Côte d'Ivoire que la répartition bathymétrique du pourcentage de femelles variait en fonction des saisons. En saison chaude, les femelles dominent à la côte et les mâles en profondeur. C'est exactement l'inverse en saison froide. Pendant les transitions, les femelles dominent en profondeur et à la côte (Fig. 16).
(c) Variations du mode de dispersion
Il a été montré, dans certains cas, que le comportement des crevettes et leur aptitude à se grouper en bancs pouvaient varier saisonnièrement. Marcille (1978), utilisant les données de la pêche, montre pour P. indicus, essentiellement capturée le jour, un comportement en bancs permanent. Cette surdispersion se traduit par une pente nettement supérieure à l dans la relation entre la moyenne et la variance des rendements. Pour Metapenaeus monoceros et Penaeus semisulcatus, essentiellement capturées de nuit, il montre des variations saisonnières du comportement grégaire en début d'année et proche de la distribution au hasard en fin d'année (Fig. 18). Il a également montré des variations saisonnières dans l'extension verticale des “mattes”, ou bancs de crevettes P. indicus. Cet aspect sera repris plus loin dans le paragraphe sur la capturabilité et ses variations.
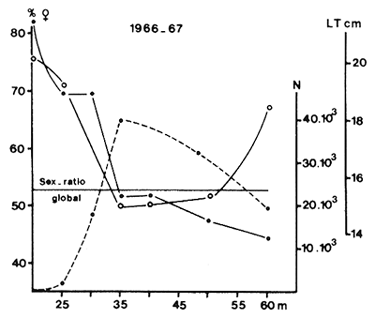
Fig. 15: Distribution bathymétrique de l'abondance numérique (---), de la taille moyenne (o - o) et du sex-ratio (. - .) en Côte d'Ivoire (d'après Garcia, 1974)
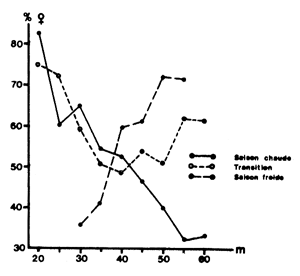
Fig. 16: Distribution bathymétrique du sex-ratio en fonction des saisons (d'après Garcia, 1974)
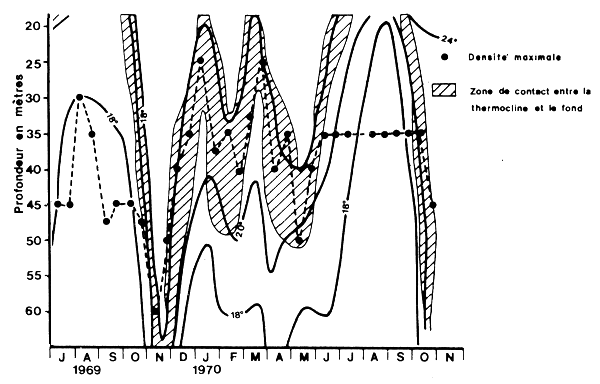
Fig. 17: Variations saisonnières de la profondeur de la thermocline et de la densité maximale en Côte d'Ivoire (d'après Garcia, 1974)
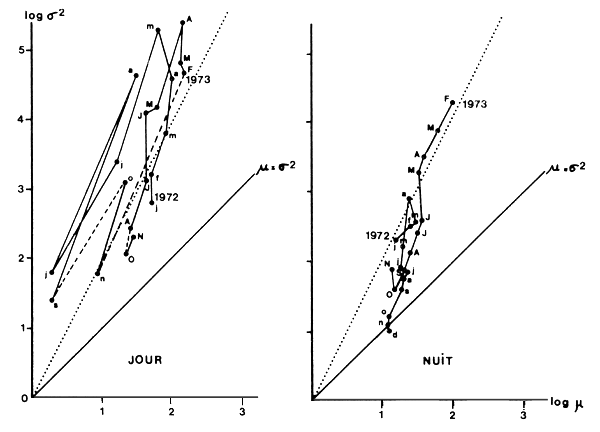
Fig. 18: Relation entre la moyenne (μ) et la variance (σ2) des rendements par coup de chalut à Madagascar pour la pêche de jour sur Penaeus indicus et la pêche de nuit sur P. latisulcatus et Metapenaeus monoceros (d'après Marcille, 1978)
2.3.5.3 Les plans d'échantillonnage
L'échantillonnage devrait tenir compte du fait que la zone de distribution peut se modifier saisonnièrement, de même que les répartitions bathymétriques des abondances et des sexes. Le travail sera facilité si les principaux axes de variation sont connus. La difficulté provoquée par les variations nycthémérales de rendement ou les changements dans la distribution verticale est le plus souvent impossible à résoudre de manière satisfaisante. En revanche, les changements saisonniers de rythme nycthéméral peuvent être pris en compte en changeant également les heures d'échantillonnage, si l'on recherche une espèce particulière.
Deux plans d'échantillonnage peuvent être utilisés: celui des radiales équidistantes (méthode systématique) et celui des prospections aléatoires simples ou stratifiées. Dans le premier cas, la bande chalutée est supposée représentative d'une surface élémentaire et tous les éléments sont prospectés à chaque campagne. La structure de la population sur une radiale est calculée en combinant toutes les données élémentaires pondérées par la surface des éléments. Cette méthode se justifie lors des toutes premières prospections, lorsqu'aucune information n'est disponible sur la structure du biotope ou de la population (Grosslein, comm.pers.).
Les prospections aléatoires simples, où la repartition de l'ensemble des stations est tirée au hasard, présentent l'avantage de permettre le calcul de la variance, ce qui autorise par la suite l'application des tests statistiques de signification des variations observées d'une campagne à l'autre ou d'une zone à l'autre.
Les prospections aléatoires stratifiées où les stations sont réparties au hasard mais à l'intérieur de strates préétablies permettent en outre d'optimiser l'échantillonnage et d'augmenter la précision des indices d'abondance obtenus par un nombre donné de traits (Cochran, 1963). Le schéma de stratification doit être défini de préférence avant la campagne sur la base d'une prospection préliminaire par exemple, et de toutes façons sans utiliser les données de la campagne considérée.
D'une manière plus générale, le problème est aussi celui, très classique, de l'échantillonnage au chalut des populations démersales. Pour une étude sur le traitement des données de chalutage et une discussion sur la valeur du chalut comme échantillonneur, on se réfèrera utilement à Barnes et Bagenal (1951) et au compte-rendu de la Réunion Scientifique Spéciale sur l'échantillonnage de Paris, 1954 (CIEM, 1956). En ce qui concerne les méthodes de prospection, les plans d'échantillonnage, le traitement des données et l'expression des résultats, il existe d'excellents travaux qu'il est utile de consulter (Alverson, 1971; Gulland, 1975; Mackett, 1973; Alverson et Pereyra, 1969; Abramson, 1968; Doubleday, 1976; Grosslein, 1971 et 1974; Pitt, 1976; Ultang, 1977; FAO, 1976; Saville, 1977).
Un aspect marginal mais non négligeable des prospections est l'optimisation des trajets. Leming et Holley (1978) ont proposé un logiciel d'ordinateur permettant cette optimisation. Dans la pratique, les difficultés techniques de toutes sortes inhérentes à la réalisation des prospections tendent à rendre ce type d'approche plus théorique que réellement utilisable.
Le rythme d'échantillonnage doit être adapté à l'espèce. Chez une espèce profonde subtropicale, un rythme mensuel peut être suffisant. Pour un penaeïde tropical littoral, un échantillonnage hebdomadaire est souhaitable, mais parfois difficilement réalisable. Un compromis doit donc être cherché mais en règle générale la fréquence des observations doit rester élevée.