Les masses d'eau peuvent être classées en plusieurs catégories allant de productives à non productives suivant le taux de production de la biomasse (Welch, 1980; Forsberg and Ryding, 1980). Divers indices, tels que la production primaire (Grandberg, 1973), la biomasse algale (Dillon et Rigler, 1974), le manque d'oxygène (Cornett et Rigler, 1979; Welch, 1980), les algues indicatrices (Rawson, 1956), le rendement piscicole (Melack, 1976; Oglesby, 1977), la production de macrophytes aquatiques (Canfield et al., 1983) et la concentration nutritive (Vollenweider, 1976) ou une combinaison des éléments cités ci-dessus (Carlson, 1977) peuvent être utilisés pour étudier la productivité. Cependant, tout dépend des modifications que subit l'apport en substances nutritives (voir ci-dessous).
L'introduction d'un système de culture à clôtures à une masse d'eau modifiera la productivité et bien que la culture en cages et en enclos puisse avoir un effet direct sur la flore et la faune par l'introduction de nouvelles espèces (parasites, poissons exotiques, etc.) et en raison de l'attirance qu'exerce l'endroit sur les oiseaux et les mammifères prédateurs, la plupart des modifications qui se produisent sont des conséquences des modifications que subit la productivité. La direction que prennent ces changements est déterminée par la méthode de culture employée (extensive, semi-intensive, intensive), alors que l'ampleur qu'ils prendront dépendra des caractéristiques du site, du type de clôtures utilisé, des espèces cultivées et de la taille de l'entreprise. Ces différents rapports sont résumés à la figure 13.
On peut constater à la figure 14 que l'impact de la culture en clôtures peut varier d'une absorption nette de substances nutritives, ce qui conduit à une diminution de la productivité, à un rendement net de substances nutritives, ce qui conduit à une augmentation de la productivité. La culture extensive est basée sur une nourriture naturelle, et de ce fait l'empoissonnement, l'élevage et la récolte des poissons extraient les éléments nutritifs du système. Dans la culture intensive on subvient totalement aux besoins nutritifs à l'aide d'un apport externe d'aliments de haute qualité et l'on peut ainsi constater une nette augmentation de l'apport au système de substances nutritives à base de restes de nourriture, de fèces et d'urine. La pente de la ligne et les endroits où elle intercepte les axes X et Y dépendent d'un certain nombre de variantes: les espèces, le site, la saison, la densité d'empoissonnement, la qualité de la nourriture et l'aménagement. A l'endroit où elle rencontre l'axe X la productivité semble en effet ne subir aucune modification et la quantité de nourriture supplémentaire utilisée a un effet équilibrant sur l'impact de l'opération piscicole.
Pour essayer de formuler les changements que subit l'environnement à la suite de la pratique de méthodes de culture piscicole en cages et en enclos, il est nécessaire de savoir:
ce qui détermine l'état trophique de l'environnement;
la quantité de restes/nourriture que le poisson produit/consomme;
les réactions de l'environnement à ces changements.
Il est également nécessaire de savoir à quel degré l'environnement peut être modifié dans le but d'essayer d'aménager le système.
Les écosystèmes aquatiques sont composés d'un grand nombre de différents types d'organismes qui dépendent de la fixation de la lumière exercée par les plantes vertes photosynthétiques sur les composés contenant du carbone et du cycle que suit la substance organique à travers un réseau complexe de chaînes alimentaires, qui en découle. La plupart des lacs et réservoirs puisent leur énergie de base en substance organique de la production autochtone (interne) des algues, des macrophytes et des périphytons (Pomeroy, 1980). Ces plantes ont uniquement besoin de lumière, d'une source en carbone et d'un approvisionnement en substances nutritives. Les végétaux sont consommés par des planctivores et des herbivores qui, à leur tour, seront la proie de carnivores primaires et secondaires. L'élément végétal et animal non consommé s'ajoute aux éléments fécaux pour former le détritus organique sans vie qui est utilisé par un grand nombre d'organismes variés -consommateurs en suspension, déchireurs, brouteurs, gratteurs, consommateurs attachés, bactéries et champignons.
Dans certains lacs et réservoirs entourés de marais tels que le lac Chilwa en Afrique et le Bukit Merah en Malaisie, ainsi que dans de nombreux systèmes lotiques, l'offre en matière organique provenant de l'extérieur (allochthone) peut être plus forte que l'élaboration d'un tissu autochtone par les macrophytes et les algues (Cummins, 1974; Howard-Williams et Lenton, 1975; Townsend, 1980; Yap, 1982, 1983) (voir également 2.2 ci-dessus). Des données sur la productivité d'une variété de masses d'eau profondes ou à bas fonds (réservoirs, lacs, rivières), provenant du monde entier sont résumées à la figure 15. Elles proviennent généralement des résultats du PBI (Le Cren et Lowe - McConnell, 1980), mais certaines d'entre elles, plus récentes, proviennent d'Amérique du Sud tropicale, d'Afrique et des Philippines (Hill et Rai, 1982; Marten et Polovina, 1982; Tundisi, 1983). On peut constater qu'en général la production est plus élevée sous les basses latitudes que sous les hautes latitudes et cela rejoint les découvertes de Brylinsky et Mann (1973), Schindler (1978) et Hill et Rai (1982). Sous les basses latitudes la radiation solaire et les effets de la température ratures plus élevées que sous les hautes latitudes et l'on suppose que la plus forte disponibilité en lumière solaire et les effets de la température sur les cinétiques de croissance, renforcent cette tendance. Ces découvertes sont confirmées très nettement par des considérations théoriques et leur validité a été soumise à des recherches poussées à la fois en laboratoire et sur le terrain (exemple: Schiff, 1964; Talling, 1957, 1971; Goldman et Carpenter, 1974).
Une seconde corrélation a été constatée par Brylinsky et Mann (1973), à partir du document réunissant intégralement les données du PBI entre la production primaire et la concentration nutritive, comme étant mesurées par la conductivité. Les algues et macrophytes ont un besoin en substances nutritives variées pour leur croissance, besoin en vitamines nombreuses et en sels inorganiques (Stewart, 1974; Fogg, 1975, 1980). En théorie, si l'une ou plusieurs de ces substances nutritives venaient à manquer, la croissance serait limitée. Si l'offre d'une substance nutritive particulière était inférieure à la demande du producteur primaire, cette substance nutritive particulière poserait un problème. Depuis plusieurs années des scientifiques et gérents des ressources consacrent une grande partie de leurs recherches à la découverte de la ou des substances nutritives qui posent un problème dans le domaine de la production primaire en eaux continentales. Les débats tournent autour de la question de l'offre et de la demande.
Bien que les vitamines comme la cobalamine, la thiamine et la biotine/ coenzyme R aient été déclarées essentielles à la suite de recherches faites en laboratoire, on a rarement constaté que leur carence soit cause de problèmes dans des conditions naturelles (Welch, 1980). On a donc concentré les recherches sur les substances nutritives inorganiques. Dans les écosystèmes non dérangés la plupart de ces substances nutritives proviennent principalement de l'érosion des rochers et du sol (la litosphère) bien que C, N, B, S et Cl aient également de fortes réserves atmosphériques. Des recherches récentes ont démontré que plusieurs de ces substances nutritives d'origine atmosphérique ne sont jamais ou rarement cause de problèmes. Le besoin en B, S, et Cl est beaucoup moins fort que l'offre (Moss, 1980). Le carbone est l'élément dont la production primaire a le besoin le plus fort et son origine semble être, pour la plupart, atmosphérique. Bien que de grands bassins de composés de carbone organique dissous comme l'acide humique puissent être trouvés dans certaines masses d'eau (par exemple dans les Highlands, en Ecosse) leur résistance à l'oxidation chimique est très forte (Shapiro, 1975). Cependant, le CO2 d'origine atmosphérique se dissout volontiers et pénètre facilement dans les écosystèmes aquatiques par diffusion ou par les eaux de pluie (Hutchinson, 1957). L'opinion générale est que bien que C puisse temporairement être cause de problèmes, la plupart du temps l'offre excède la demande d'un coefficient 30, environ (Schindler, 1971, 1974; Moss, 1980; Welch, 1980).
Malgré le fait que le nitrogène constitue 80 pour cent de l'ensemble de l'atmosphère, il est relativement peu réactif. Avant d'arriver jusqu'à la plante, le N atmosphérique doit être transmis ou par décharge électrique (éclair) ou par fixation biologique par les bactéries et par l'algue bleue-verte. L'importance relative de la fixation de N dans la quantité annuelle totale de N qui pénètre dans une masse d'eau varie énormément passant de <1 pour cent dans le lac Windermere en Grande-Bretagne (Horne et Fogg, 1970) à presque 90 pour cent à Pyramid Lake, dans le Nevada, aux Etats-Unis (Horne et Galant, in Goldman et Horne, 1983) et dépend en premier lieu de la densité en algues bleue-vertes. Les autres sources en N sont les eaux de pluie, qui contiennent à la fois du NH4 et du NO3 bien que la quantité relative de chaque fraction varie entre les zones tempérées et les zones tropicales (Hutchinson, 1957).
En l'absence de O2 les bactéries peuvent dénitrifier NO3 en N2 qui peut alors se perdre dans l'atmosphère. Cependant, on considère aujourd'hui que ce processus n'a pas grande importance en ce qui concerne les carences en N (Welch, 1980). Néanmoins, il existe des preuves sur le fait que N peut être un facteur de limitation de la croissance: cela sera discuté cidessous.
Le plus rare de tous les éléments essentiels qui proviennent presque uniquement du lithosphère en ce qui concerne des besoins plus importants des algues et végétaux est P. Dans le tableau 8, la quantité relative des autres éléments essentiels dans le lithosphère par rapport à P sont représentés dans la colonne 2. Les éléments qui ont une proportion de < 1 sont moins constants que P. Ils comprennent Mn, Co, Cu, Ph et Mo. La troisième colonne représente la proportion de P dans la demande des algues et d'autres végétaux plus longs. La valeur > 1 représente les éléments plus demandés que (exemple: Ca, K, Mg). Dans la colonne 4 on a représenté la proportion de l'offre (colonne 2) par rapport à la demande (colonne 3). La valeur < 1 représente les éléments dont les besoins seront probablement plus facilement remplis par ce qui apporte le lithosphère que par P et l'on peut voir que tous les éléments appartiennent à cette catégorie.
Trois raisons expliquent la rareté de P: premièrement, sa rareté est due au manque de réserves gazeuses dans l'atmosphère (contrairement à C, H ou N); deuxièmement, il est relativement insolubre, il se complexe volontiers avec une grande variété de métaux qui incluent Fe, Al, Mn et Ca, et ainsi se précipite (Stumm et Leckie, 1971). Le phosphore a également tendance à se faire absorber à la surface de substances organiques particulées et à être absorbé par le phytoplancton. Etant donné qu'ils sont tous les deux relativement lourds, ces organismes sont prédisposés à la sédimentation et à être éliminés de la colonne aquatique (Welch, 1980; Sonzogni et al., 1982).
Sur des bases théoriques, donc, P et N sont les principaux éléments nutritifs associés aux limites de productivités. En termes moléculaires le besoin algal en N est environ 16 fois plus fort qu'en P, d'après un calcul de Stumm (1963), (in Welch, 1980):
106CO2 + 90H2O + 16NO3 + 1PO4 + lumière C6H180O45N16P1 + 154½O2
Les résultats d'expériences faites par Chiandani et Vighi (1974) confirment cette théorie et montrent que les demandes algales en N:P peuvent varier de 17-13:1 (8-6:1 rapport poids:poids). Des conclusions similaires ont été atteintes par Palaheimo et Zimmerman (1983). Cependant, les résultats d'expériences en matière de fertilisation au cours desquelles N, P, C et des oligométaux ont été introduits à la masse d'eau sous des formulations diverses et les modifications que la productivité a subies en conséquence (Goldman, 1960; Schindler, 1971, 1974; Schindler et Fee, 1974; Robarts et Southall, 1977) ont démontré qu'un apport en N exerçait peu ou pas du tout d'effet alors que même une petite quantité de P pouvait stimuler la production d'une façon considérable. Les apports en C et en oligométaux ont également un effet limité.
Des preuves indirectes réunies à partir d'analyses et d'importantes séries de données provenant d'un certain nombre d'organismes gouvernmentaux et de chercheurs sur la productivité, le plancton, la biomasse et les niveaux nutritifs dans des lacs et dans des réservoirs ont confirmé que P était en général la substance nutritive déterminante. Ces données sont résumées au tableau 9. Tou d'abord, dans presque tous les lacs dans lesquels les recherches ont été faites, le rapport N:P totaux est supérieur à la valeur critique 8:1, laissant donc supposer que la teneur en N y est adéquate, pour subvenir aux besoins des algues. On a découvert des exceptions dans les régions volcaniques riches en P comme certaines régions du Japon (Sakamoto, 1966), l'Afrique de l'Est et du Centre (Moss, 1980) et South Island en Nouvelle-Zélande (White et al., 1982). Deuxièmement, bien que les corrélations qui existent entre le plancton de la biomasse et le N total soient faibles (exemple: OCDE, 1982; Prepas et Trew, 1983; Howyer et Jones, 1983), on observe des corrélations beaucoup plus fortes au moment des concentrations en P total du printemps et de l'été.
Une fluctuation considérable est associée à la plupart de ces régressions et certains groupes de données montrent des corrélations P total/ biomasse algale plus faibles que d'autres (mesurées par les concentrations de chlorophylle ‘a’). Exemple illustré par les données sur les réservoirs d'Amérique du Nord de Canfield et Bachmann (1981), Jones et Novack (1981) et Walker (1982). Certaines de ces fluctuations pourraient être expliquées par les différences de méthodologie (Hoyer et Jones, 1983) et par les différences inter et intra-spécifiques du contenu en chlorophylle ‘a’ de l'algue (Palaheimo et Zimmerman, 1983). Le contenu en chlorophylle ‘a’ varie non seulement d'une espèce à l'autre mais varie également avec l'âge, le volume de la cellule, l'intensité lumineuse et la concentration en substances nutritives (Nicholls et Dillon, 1978; Grandberg et Harjula, 1982). A l'aide de techniques de régressions multiples on a découvert qu'exception faite d'une seule liste de données, N a peu ou pas d'influence sur les fluctuations (Clasen, 1981; Walker, 1982); OCDE, 1982; Prepas et Trew, 1983; Hoyer et Jones, 1983), confirmant ainsi que les rapports N:P totaux sont en général supérieurs au niveau 8:1 et que peu de masses aquatiques contiennent des proportions N:P idéales pour la croissance des algues.
Cependant, les analyses à régressions multiples ont identifié un facteur supplémentaire important qui peut dans certains cas jouer un rôle considérable dans la fluctuation: la turbidité. En règle générale, la limpidité de l'eau est fonction de la densité algale, d'après les mesures du disque Secchi (Bachmann et Jones, 1974; Dillon et Rigler, 1975). Cependant, des analyses faites par Canfield et Bachmann (1981) à partir d'un grand nombre de lacs et de réservoirs d'Amérique du Nord ont montré que cette relation était plus faible dans les lacs artificiels dont le niveau en solides inorganiques en suspension est plus élevé. D'autres recherches plus récentes ont montré que le rapport biomasse algale/P total est faible dans les masses d'eau peu profondes où les dépôts de sédiments qui se forment au fond sont susceptibles d'être dérangés par les vents et dans les masses d'eau où l'apport en substances nutritives est élevé (Pieterse et Toerien, 1978; Clasen, 1981; Nielsen, 1981; Walker, 1982; Hoyer et Jones, 1983). Les solides inorganiques en suspension peuvent réduire la quantité de plancton dans la biomasse et affecter ainsi la production de plusieurs façon: une forte teneur en turbidité inorganique diminue la pénétration de la lumière et réduit la profondeur de la zone euphotique. Diverses autres recherches ont également montré que PO4 - P était facilement absorbé par les particules inorganiques réduisant ainsi la concentration en P disponible biologiquement (Fitzgerald, 1970; Stumm et Leckie, 1971; Edzwald, Toensing et Leung, 1976; Furness et Breen, 1978; Hoyer et Jones, 1983).
La concentration en phosphate-P est couramment considérée comme étant le facteur limitatif de base gouvernant la biomasse algale et la productivité des eaux continentales tempérées et tropicales au cours de plusieurs mois de l'année. Cependant, la relation P/biomasse algale en application générale, a tendance à être la même dans toutes les masses d'eau qui forment pour elle un groupe homogène malgré le fait que les corrélations P/biomasse algale/production primaire, représentées dans le tableau 9 suggèrent que de nombreuses fluctuations y soient souvent associées en raison d'autres facteurs locaux importants comme la géologie, la profondeur, l'exposition de la masse d'eau, le climat et la taille et utilisation du bassin versant. Au fur et à mesure qu'un nombre plus important de données empiriques est réuni, des modèles plus raffinés gouvernant diverses catégories de masses d'eau seront évolués.
En résumé, les chaînes alimentaires aquatiques fonctionnent ainsi qu'on l'a représenté à la figure 15. Dans les masses d'eau lentiques, c'est la production autochtone de substances organiques et le procédé qui en découle qui alimente le système. Dans les masses d'eau lotiques, systèmes érosifs à courant particulièrement rapide, la quantité de plancton est souvent insignifiante et les sources principales d'énergie proviennent du periphyton, des communautés de macrophytes sur les bords ou des détritus allochtones. La productivité du système peut être contrôlée par tous les éléments représentés à la figure 15: la luminosité, les substances nutritives essentielles ou, dans le domaine des systèmes lotiques, les détritus allochtones.
Le phosphore et occasionnellement la luminosité sont les deux facteurs principaux susceptibles de limiter la production à la fois dans les eaux douces tempérées et tropicales et la productivité sera donc altérée par l'addition ou l'absorption nette de P ou autres substances qui ont une forte influence sur le régime lumineux. Nous ne considèrerons cependant pas le second facteur dans cette section. Il sera exposé dans la section 4.6.
Le phosphore est un élément essentiel à la croissance normale de tous les poissons et au développement des os, à l'entretien d'une régulation à base d'acide et du métabolisme des lipides et des hydrates de carbone (Ketola, 1975; Ogino et Takeda, 1976; Lovell, 1978; Cowey et Sargent, 1979; Lall, 1979; Sakamoto et Yone, 1980; Takeuchi et Nakazoe, 1981). Une carence en P dans l'alimentation peut supprimer l'appétit, la conversion alimentaire normale, nuire à la croissance et dans des cas extrêmes peut affecter la formation osseuse et causer la mort du poisson (Murakami, 1967; Andrews, Murai et Campbell, 1973; Lall, 1979). Bien qu'on ait démontré plusieurs fois que le poisson absorbait une quantité de 32 p marqué, directement dans l'eau (exemple: Tomiyama et al., 1956; Lall, 1979), on pense que le taux d'absorption est généralement très faible et que les poissons trouvent la quantité de P qui leur est nécessaire principalement dans la nourriture (Phillips et al., 1957; Nose et Arai, 1979).
Les besoins en phosphore de différentes espèces de poissons varient entre 0,29 pour cent et 0,90 pour cent du régime (tableau 10). Cependant, ces chiffres se basent sur la quantité de phosphore disponible, qui varie considérablement suivant les espèces car elle dépend de la source alimentaire. La majorité de la nourriture piscicole couramment disponible est principalement d'origine animale, comme la farine de poisson, la farine de viande et la farine d'os dans lesquels on trouve presque toute la quantité de P sous forme inorganique. La quantité restante se trouve sous forme de P-complexes dans les protéides, les lipides et les hydrates de carbone (Lall, 1979). Le total ou presque de ce P est facilement accessible aux poissons carnivores tels que la truite arc-en-ciel (Ogino et al., 1979). Cependant, il existe de grandes variations dans l'accessibilité au P à travers les régimes à base de farine de poisson des omnivores et des herbivores. Alors que le O. niloticus peut consommer 65 pour cent de P à travers la farine de poisson (ce qui représente presque autant que la quantité consommée par la truite arc-en-ciel) (Watanabe et al., 1980a), la carpe commune en consommera une quantité presque nulle (Ogino et al., 1979) en raison de sa carence en liquides gastriques acides (pepsines) (Yone et Toshima, 1979). D'autre part, on trouve 60–80 pour cent du P-total dans les substances végétales sous forme de sels Ca ou Mg d'acide phytique, qui est connu sous le nom de phytine, mais il n'est pas accessible au poisson étant donné que ce dernier ne possède pas l'enzyme nécessaire, phytase, pour détruire le composé (Ogino et al., 1979; Lall, 1979). Quelques preuves montrent que certains omnivores/herbivores comme les carpes sont plus aptes à consommer la fraction non-phytique dans un régime à composition végétale que la truite arc-en-ciel carnivore (Ogino et Takeda, 1976).
On a également prouvé que la disponibilité et l'utilisation de P sont influencées par plusieurs facteurs: la quantité avalée, les réserves du corps en P, d'autres éléments dans les tissus du corps et des entrailles et les ingrédients alimentaires complémentaires (Nakamura, 1982; Tacon et De Silva, 1983). Une proportion importante de l'absorption en P peut ainsi être rejetée suivant la digestibilité de la source alimentaire. L'efficacité de l'absorption et (à des niveaux supérieurs aux besoins alimentaires) le taux de croissance sont cependant indépendants du niveau de P alimentaire et ainsi le rapport entre la consommation et l'excrétion est positif (Nakashima et Leggett, 1980). Le surplus en phosphore par rapport aux besoins alimentaires est excrété en grande partie par les rognos (Forster et Goldstein, 1969). Ces rapports entre consommation, excrétion, la croissance et l'efficacité d'absorption sont exposés dans la figure 16.
La plupart des aliments utilisés pour la culture intensive dans les pays tempérés sont de fabrication commerciale et sont sous forme de boulettes sèches. Dans certaines fermes piscicoles d'Europe on utilise encore les poissons sans valeur comme aliments, mais cette pratique est aujourd'hui réduite dans de nombreux pays (Alabaster, 1982a). Un résumé de la recherche faite par Tacon et de Silva sur la teneur en P des aliments pour salmonidés européens disponibles dans le commerce est donné dans le tableau 11. Les valeurs moyennes indiquent que la teneur en phosphore du régime alimentaire de la truite est de ∼ 1,49 pour cent et que celle du régime du saumon est de ∼ 1,47 pour cent. En Pologne, Penczak et al., (1982) a utilisé des denrées alimentaires (boulettes sèches et boulettes humides de poissons frais, orge, son et levure) contenant en moyenne 1,45 pour cent de P, pendant que Ketola (1982) aux Etats-Unis a eu recours à un régime européen “à faible pollution” (1,40 pour cent) et à un régime dont les éléments étaient disponibles commercialement en Amérique du Nord (2,2 pour cent) pour ses recherches dans le domaine de la culture de la truite.
La culture intensive de carpes et de tilapias est encore dépendante en grande partie de la fabrication des denrées alimentaires à partir de substances disponibles sur place, à l'exception de Taïwan où l'on peut se procurer des régimes formulés pour la culture de tilapias disponibles dans le commerce. La teneur en P des matières premières et régimes utilisés dans différents pays est donnée dans le tableau 12. La teneur en phosphore d'un régime pour tilapias varie entre 1,30 et 2,52 pour cent alors que dans les régimes préparés pour les carpes il varie entre 0,92 et 3,06 pour cent.
Dans le domaine de la pisciculture, des pertes en nourriture sont inévitables pour un certain nombre de raisons. De nombreux poissons se nourrissent près de la surface de l'eau comme les salmonidés se nourrissent à la vue (Blaxter, 1980) et n'absorbent que des particules alimentaires de tailles variables précises qui ont un rapport positif avec l'une des fonctions de la biomasse piscicole (Wankowski et Thorpe, 1978). La taille des boulettes pour salmonidés, d'après les recommandations des fabricants, sont données au tableau 13. Les particules alimentaires n'appartenant pas à la catégorie de tailles recommandées pour un nombre donné de truites ne seront pas consommées mais contribueront au contraire aux déchets que l'opération produit.
Les fabricants estiment que 2 pour cent de la nourriture se transformera en poussière, provenant principalement des miettes de boulettes au cours de l'emballage et du transport. Donc, 2 pour cent au moins de nourriture commerciale pour truites ne sera pas consommée.
La taille de la particule alimentaire dans le régime pour tilapias semble à première vue avoir moins d'importance. Plusieurs espèces cultivées, comme O. nicolitus de O. aureus, se nourrissent de micro-organismes (Bowen, 1982) et d'après Miller (1979) et d'après Coche et Lovshin (Pullin et Lowe-McConnell, 1982) les aliments en poudre conduisent aux mêmes rendements en étangs sans qu'on ait à engager des frais supplémentaires pour la fabrication des boulettes.
Alors que les découvertes citées ci-dessus peuvent s'appliquer à la culture de tilapias en étangs et en enclos, elles ne s'appliqueront pas à la culture en cages. En effet, dans les cages, on a souvent constaté des pertes en nourriture qui sont dues aux courants aquatiques et aux courants provoqués par le poisson au cours de l'opération d'alimentation (Collins, 1971; Loyacano et Smith, 1976; Hoelzl et Vens-Cappell, 1980; Penczack et al. 1982; Phillips et al., 1983). De nombreux auteurs ont donc recommandé l'utilisation d'aliments sous forme de boulettes pour la culture de tilapias en cages (Guerrero, 1980; Coche, 1982; Santiago, 1983). Jauncey et Ross (1983) ont observé qu'en général les tilapias ont une préférence marquée pour les boulettes de taille plus petite, par rapport à la plupart des autres espèces cultivées et les tailles recommandées sont données dans le tableau 13.
Pour résumer, nous pouvons dire que P est un minéral essentiel que les poissons trouvent presque exclusivement dans leur nourriture. La plupart des régimes développés pour la culture intensive ont une trop forte teneur en P, par rapport aux besoins du poisson, ou existent sous une forme particulièrement inaccessible au poisson. Le surplus de P est excrété alors que le P inaccessible disparait dans les fèces. Dans le domaine de la culture de salmonidés qui ont des préférences spécifiques sur la taille de leur nourriture, il arrive que les boulettes abimées ne soient pas avalées, mais qu'elles contribuent au contraire à l'apport de P à la masse d'eau. Les autres sources de P dans l'environnement proviennent de la nourriture qui est emportée au dehors de la cage par les courants naturels et par les turbulences provoquées par les poissons au cours de l'opération d'alimentation.
Les principales pertes en P au profit de l'environnement associées à la culture intensive en clôtures sont résumées à la figure 17. Plusieurs méthodes peuvent être utilisées pour évaluer ces pertes:
mesure des apports directs provenant des enclos et des cages;
calculs théoriques basés sur les informations disponibles sur la teneur en P de la nourriture, etc.;
extrapolation des données sur la culture intensive en étangs et en canaux appliquées à la production en cages et enclos.
Bien qu'un certain nombre d'études visant à déterminer la quantité de déchets provenant des exploitations de truites en cages soient en cours, la seule qui ait été complétée est celle de Penczak et al. (1982). Au cours de cette étude la production de déchets provenant de la culture de truites en cages dans le lac de Glebokie en Pologne, a été déterminée par l'évaluation des “inputs” et des “outputs” de C, de P et de N. On a évalué que la perte totale en substances nutritives au profit de l'environnement, Nutenv, était égale à la différence entre les substances nutritives ajoutées à la nourriture du poisson: Nutnour et les substances nutritives assimilées par les poissons destinés à être récoltés par la suite: Nutpoisson:
Nutenv = Nutnour - Nutpoisson
On a préparé des denrées alimentaires à base de poissons sans valeur et de boulettes et enregistré la teneur en C, P et N, ainsi que les quantités utilisées. Les poids et la teneur en C, P et N des truites récoltées ont été mesurés et les charges en nutrients du lac calculées par kilo de poisson produit en cage.
Les résultats de cette expérience sont résumés au tableau 14 et montrent que le lac s'est trouvé enrichi de 0,75 kg de C, de 0,023 kg de P et de 0,10 kg de N par kg de poissons récoltés.
Beveridge, Beveridge et Muir (1982) ont eu recours à une méthode semblable basée sur les données connues sur la téneur en P des denrées alimentaires, sur les valeurs du FCR (Food Conversion Ratio) et sur la teneur en P des car-casses de poissons. Dans le tableau 16 on a représenté les résultats des calculs effectués sur les teneurs totales en P associées à la culture intensive des truites et des tilapias, calculs effectués à l'aide des formulations alimentaires exposées au tableau 12 et des valeurs de FCR y correspondant (tableau 15). La teneur totale en P des carcasses de truites et de tilapias provient des recherches faites par Ogino et Takeda (1978), Penczak et al. (1982) et Meske, Karl et Manthey (1983).
La charge en P-total au profit de l'environnement est variable car il dépend de la teneur en P et du poids des denrées alimentaires utilisées. Dans le domaine de la culture des truites en cages, les chiffres les plus répandus du FCR sont 1,5–2,0:1 et les charges en P-total par tonne de poissons produite sont donc de 17–25 kg. Dans le domaine de la culture intensive de tilapias les chiffres du FCR varient généralement entre 2,0–2,5:1. On pense que le chiffre du FCR particulièrement élevé en ce qui concerne le régime alimentaire piscicole dans la République centrale africaine serait dû à de mauvaises conditions en O2 (voir Coche, 1982) et il ne sera pas pris en considération ici. L'environnement connaît donc une augmentation en P-total de 23–29 kg par tonne de production de tilapias en cages. Les pertes en P-total sont ainsi approximativement les mêmes en ce qui concerne la production intensive de truites et de tilapias.
Des estimations de charges en P-total provenant de systèmes continentaux de culture intensive de truites sont représentées dans le tableau 17. La plupart des résultats sont basés sur des enquêtes nationales commissionnées dans les pays d'Europe par l'EIFAC et les importantes variations que l'on peut constater dans ces résultats (11–157 kg de P par tonne de poissons produite-1) sont dues aux différences de systèmes d'élevage (étangs, canaux, réservoirs; opérations d'incubation et de croissance); d'alimentation (flottante/destinée à couler, sèche/mouillée; opération alimentaire manuelle/opération alimentaire automatique) et des modes de gestion (traitement/non traitement avant l'évacuation ainsi que l'échantillonnage quotidien, hebdomadaire, mensuel) et des analyses d'effluents (dissous/dissous + particulé P-total, P ortho) (voir résumé, Alabaster, 1982a). Il est donc difficile de faire une comparaison entre les estimations concernant la culture en cages à partir de ces données. Cependant, les résultats fournis par Ketola (1982) sont basés sur des estimations soigneuses des “inputs” et des “outputs” faites à partir d'un seul système de pisciculture et montrent que la truite nourrie à partir de denrées alimentaires standard, disponibles dans le commerce aux Etats-Unis produit une teneur de 22, 77 kg en P-total par tonne de production, ce qui reste dans l'éventail calculé ci-dessus pour la production de truites en cages.
Malheureusement, aucune étude semblable n'a été faite sur les, systèmes continentaux de culture intensive de tilapias.
En ce qui concerne l'estimation des charges en P-total à partir de la culture intensive en cages le système déchets de nourriture poissons a été traité en “boîte-noire enregistreuse” contenant des informations limitées aux “inputs” et “outputs”. Cependant, on n'a pas essayé d'analyser quantitativement ou qualitativement les procédés qui jouent un rôle dans la production de P-perdu à l'intérieur du système. Or, il est nécessaire de passer par cette étape avant d'envisager une formulation car des rapports récents ont prouvé que la forme des pertes en P détermine leur impact sur l'environnement (Lee, Jones et Rast, 1980; Sonzogni et al., 1982).
Les différentes sources de pertes en P provenant de la culture intensive en cages sont résumées à la figure 17. Plusieurs paramètres ou procédés en cause peuvent être quantifiés à partir de données empiriques alors que d'autres peuvent être déterminées théoriquement.
Dans le domaine de la culture intensive de truites, on estime que les pertes totales en denrées alimentaires (poussière et nourriture laissée pour compte) s'élèvent à 20 pour cent, chiffre basé sur le contenu en poussière des denrées alimentaires fournies par le fabricant (2 pour cent) et sur les estimations faites à partir de diverses études donnant 10–30 pour cent de nourriture laissée pour compte (Collins, 1971; Hoelzl et Vens-Cappell, 1980; Penczak et al., 1982). Lorsqu'on procède à la comparaison des chiffres du FCR entre la culture en étangs et la culture en cages, les chiffres se rapportant à la culture en cages sont de 20 pour cent au moins plus élevés, confirmant ainsi la théorie qui dit que les pertes alimentaires en provenance des cages sont comparativement élevées.
Avant la digestion une petite quantité de phosphore est éliminée de la nourriture par filtrage. Cependant, en considérant que la nourriture est ingérée par le poisson en trois minutes et en supposant les pires conditions possibles (petites boulettes, températures élevées), 1 pour cent seulement du P contenu dans la nourriture sera filtré (Beveridge et al., données non publiées).
Il semblerait que d'après des données de Penczak et al. (1982) seulement 32 pour cent du P ingéré (soit 23 pour cent de la nourriture administrées) est assimilé et utilisé, le reste étant dissout dans les fèces ou éliminé par les urines.
La réaction des écosystèmes aquatiques aux augmentations de teneur en P a donné lieu depuis un certain nombre d'années à des débats intenses et une large gamme de modèles prévisionnels ont été développés. Les modèles sont fondamentalement de deux types: modèles dynamiques qui pourraient être définis en tant que “représentations mathématiques de la solution physique, mathématique et biologique gouvernant la croissance algale” (Jones et Lee, 1982); ou modèles statistiques à partir d'enquêtes à grande échelle menées dans les lacs et dans les réservoirs. Le choix d'un modèle approprié dépend en premier lieu de l'endroit pour lequel il sera utilisé et de la qualité des données disponibles (Jørgensen, 1980). Ainsi que nous l'avons exposé dans l'introduction, notre but est d'arriver à prévoir l'impact de la culture intensive en cages et en enclos sur la qualité de l'eau (en particulier sur le nombre de phytoplanctons) afin qu'une ligne directrice complète puisse être établie pour le développement de l'industrie qui prendrait en compte non seulement les effets des modifications de la qualité de l'eau sur la production piscicole mais qui pourrait également être utilisée à d'autres fins. Le modèle ou les modèles doivent pouvoir être utilisés facilement sans avoir recours à un rassemblement de données par des techniciens hautement qualifiés, entraînant des pertes de temps et d'argent, et entraînant de gros frais. Un modèle simple avec peu de composantes variables semblerait donc être le plus approprié.
Les modèles dynamiques varient de types simples à deux ou trois paramètres à des modèles plus complexes, tels que le “CLEANER” élaboré par le Massachussets Institute of Technology, qui possède 40 composants variables. Une étude récente menée par Straskraba (1982) a démontré que les modèles de prévision simples peuvent être aussi précis que les modèles plus complexes, qui requièrent de nombreuses données. En effet, il faut considérer que pour chaque paramètre ajouté on s'expose à une source d'erreurs supplémentaire. Cependant, malgré le fait que l'on puisse beaucoup mieux analyser le fonctionnement des écosystèmes aquatiques grâce à ces modèles, il a été découvert, arrivé à ce point de leur développement, qu'ils ont des capacités prévisionnelles limitées (Jones et Lee, 1982; OCDE, 1982). On a également décidé de les utiliser désormais dans les masses d'eau tempérées uniquement.
Les premiers modèles statistiques basés sur des données empiriques ont été décrits par Vollenweider (1968, 1975, 1976) et développés par la suite par, entre autres, Dillon et Rigler (1974), Kirchner et Dillon (1975) et Jones et Bachmann (1976). Le but de tous ces modèles était de réussir à prévoir les concentrations de P dans les lacs et dans les réservoirs à l'aide d'équations d'équilibre de masse diverses et de faire la relation entre ces équations et l'état trophique (productivité). On a pu calibrer et tester ces modèles, les vérifier et les modifier à l'aide d'un certain nombre de banques de données: The United States Environmental Protection Agency's National Eutrophication Survey (USEPA, 1976); l'OCDE, 1982 (Organisation pour les études sur la coopération économique et le développement des masses d'eau dans les pays d'Amérique du Nord et dans les pays européens); l'étude globale du IBP (Le Cren et Lowe-McConnell, 1980) et une étude faite dans les lacs et réservoirs d'Afrique du Sud (Thornton et Walmsley, 1982; Walmsley et Thornton, 1984). Ces informations sont résumées dans le tableau 19. Après avoir étudié les capacités de prévision des différents modèles, le modèle de Dillon et Rigler (1974) a été choisi comme le meilleur modèle disponible à l'heure actuelle. Il a été soumis à de nombreux tests dans des lacs et des réservoirs peu profonds ou profonds, dans des régions tempérées et tropicales, et il semble être le plus efficace (Mueller, 1982; Thornton et Walmsley, 1982).
La modification apportée par Dillon et Rigler au modèle original de Vollenweider dit que la concentration de P-total dans une masse d'eau est déterminée par la charge en P, la taille du lac (région, profondeur moyenne), le taux d'évacuation (exemple, la fraction de volume d'eau perdue annuellement en raison de l'écoulement) et la fraction de P qui se perd régulièrement dans les sédiments. En état stationnaire,
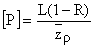
où [P] s'exprime en gm-3 P-total, L est la charge en P-total en gm-2 an-1, z est la profondeur moyenne en in, R la fraction de P-total retenue dans les sédiments et ρ est le taux d'écoulement en volumes par an.
On a adopté ici un procédé d'utilisation du modèle étape par étape.
Première étape: Afin de déterminer le potentiel d'un lac ou d'un réservoir destiné à la culture intensive, on doit évaluer la productivité de la masse d'eau avant l'exploitation en mesurant la concentration en total P [P] en état stationnaire. A l'exception des masses d'eau très peu profondes les lacs et réservoirs tempérés sont souvent stratifiés tout au long de l'année et leurs eaux se mélangent seulement deux fois par an, au printemps et en automne, lorsque la différence de température et donc de densité entre les eaux de surface (epilimnion) et les eaux profondes (hypolimnion) est minime et lorsque l'énergie éolienne est suffisante pour provoquer le mélange. Au cours de la période de stratification, des différences en [P] se développent entre l'epilimnion, dans lequel P est utilisé par les algues, et l'hypolimnion dans lequel [P] est déterminé par l'interaction sédiments/eau, plutôt que par la communauté algale. D'après Dillon et Rigler (1974), Vollenweider (1976) et l'OCDE (1982), [P] en état stationnaire dans les eaux tempérées du nord est donc déterminé de la meilleure facon à l'époque des retournements du printemps.
Par contraste, les eaux continentales tropicales sont soit chaudes monomictiques (se mélangeant une fois par an) ou polymictiques (se mélangant fréquemment) (Ruttner, 1963; Wetzel, 1975; Hill et Rai, 1982) et d'après Thornton et Walmsley (1982) [P] devrait être considéré en tant que la moyenne calculée de la concentration en P-total annuel, [P] des eaux de surface.
Deuxième étape: La capacité d'exploitation d'un lac ou d'un réservoir pour la culture intensive est la différence entre la productivité de la masse d'eau avant l'exploitation et le niveau final de productivité souhaité; ainsi que nous l'avons constaté ci-dessus, [P] peut être utilisé en tant qu'indicateurs de productivité. Cependant, il faut décider au préalable si les prévisions porteront sur la biomasse algale annuelle ou sur la biomasse algale maximum, ainsi qu'elle est mesurée par les niveaux de chlorophylle, respectivement (ch1) et (chl max.). Etant donné que les poissons sont retenus captifs en cages toute l'année durant, il nous faudra considérer le dernier paramètre.
La biomass algale maximum souhaitée est déterminée par un certain nombre de critères, le plus important étant de savoir si la masse d'eau est à buts multiples ou à but unique (par exemple, destinée à la pisciculture uniquement). La nature à buts multiples des eaux continentales est gênée par une productivité en augmentation constante (particulièrement si une masse d'eau est déjà fortement productrice (OCDE, 1982) et les limites doivent donc être soigneusement déterminées. Cependant, il est difficile de trouver des lignes conductrices efficaces et rapides en ce qui concerne les niveaux recommandés puisque les ressources en eau varient en quantité et en qualité de pays en pays. Par exemple, l'eau destinée à la consommation devrait être aussi propre que possible (débarrassée de substances toxiques ou nocives) et cela est plus facile à réaliser lorsque les sources utilisées ne sont ni productive, ni polluées. Cependant, dans les régions aux sols très fertiles, il est possible que les masses d'eau fortement productives soient en majorité, et que celles-ci soient également utilisées pour l'approvisionnement domestique.
Un éventail des valeurs acceptables recommandées et des valeurs maximums permises de [P] pour des masses d'eau à usages divers sont présentées à la figure 18 et au tableau 20. Les valeurs [P] (mg m-3) peuvent être reliées à [chl max.] (mg m-3) et à [ch1] (mg m-3) à l'aide des corrélations trouvées par l'OCDE (OCDE, 1982) pour les eaux tempérées. Ces relations sont résumées dans le tableau 21. Notez que trois équations relient à la fois [ch1] et [P] et [chl max.] et [P] et que deux équations se rapportent à [ch1] et [chl max.]. La valeur de la donnée de base utilisée varie également. La première équation utilise dans chaque cas des données non sélectionnées. Cependant, en ce qui concerne la seconde équation, on supprime les données provenant de lacs dans lesquels la lumière est le facteur restrictif en raison de la forte teneur naturelle en limon ou de lacs dans lesquels on utilise une aération artificielle. Dans tous les cas, il y a progrès en ce qui concerne la corrélation r. Les données utilisées dans la troisième équation sont des données qui ont été examinées plus soigneusement et qui ne proviennent pas de lacs dans lesquesl N pourrait être un facteur restrictif (par exemple N:P ratios <10), ce qui améliore d'autant plus la corrélation. La production primaire annuelle brute ΣPP(gC m-2 an-1) est reliée à la fois à [P] et à la biomasse algale par des équations linéaires:
∑PP = 31,1 [P]0,54; r = 0,71; S.E. = 0,265; n = 49
∑PP = 56,5 [ch1]0,61; r = 0,79; S.E. = 0,242; n = 49,
en dépit du fait qu'il y ait un phénomène d'auto-ombragement réduisant ainsi les niveaux de la biomasse algale lorsque le [P] est élevé (OCDE, 1982).
Malheureusement, nous ne possédons que peu de données concernant la relation entre [P], la biomasse algale et la productivité en eaux tropicales. Cependant, une étude récente de Walmsley et Thornton (1984, sous presse) montre que la plupart des bassins-réservoirs de l'Afrique du Sud présentent des relations entre [chl], [P] et orthophosphate [P]0: similaires à celles des lacs et des réservoirs d'Amerique du Nord et d'Europe, terrains d'étude de l'OCDE.
[ch1] = 2,06 [P]00,387 r = 0,81; n = 29
[ch1] = 0,416 [P]0,675 r = 0,84; n = 16
D'après Melack (1979), ces formules temporelles de biomasse algale et productivité existent en zones tropicales. La plupart des masses d'eau présentent des fluctuations saisonnières prononcées qui correspondent aux variations dans les précipitations, les déversements des rivières ou dans la micticité. Cependant, d'autres masses d'eau présentent peu de variations saisonnières, alors qu'une troisième catégorie présente des changements périodiques abrupts d'un ensemble persistant d'espèces (>10 générations) et un niveau d'activité photosynthétique à une autre condition persistante. Cependant, nous ne sommes pas en possession de suffisamment de données pour relier [chl max.] à ou [P] ou [ch1].
Les quelques données disponibles reliant [ch1] au taux photosynthétique moyen sont résumées dans le tableau 22, bien qu'en raison de la rareté des données et de l'éventail d'unités utilisé on ne puisse pas y trouver une relation.
Troisième étape: La capacité qu'offre une masse d'eau pour des opérations de pisciculture intensive en cages et en enclos est déterminée par la différence, Δ [P], entre [P] avant l'exploitation [P], et le [P] souhaité, accepté une fois que l'opération de pisciculture est établie [P]f.
Exemple: Δ [P] = [P]f - [P]i
Δ [P] est en relation avec la charge en P provenant des enclos piscicoles, Lpoisson' la taille du lac, A son taux d'écoulement, et p, la manière dont la masse d'eau s'accommode de différentes charges (exemple: la fraction de Lpoisson retenue dans les sédiments Rpoisson):
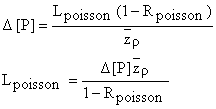
La modification souhaitée/acceptée de [P], Δ[P] (mgm-3) est déterminée de la façon décrite ci-dessus et z peut être calculé à partir de données hydrographiques obtenues de livres ou d'après des levés:
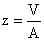 soit V = volume de la masse d'eau (m3) et A = la superficie de
l'endroit: le taux d'eécoulement (m2) = (y - 1) est égal à Qo/V, soit Qo,
volume moyen annuel d'écoulement. Qo peut être calculé en mesurant directement
les écoulements, ou, dans certaines circonstances, peut être déterminé
à partir de données publiées sur les débits entrants moyens annuels
par ruissellement (Adr), les précipitations (Pr) et l'évaporation (Ev),
ce qui donne:
soit V = volume de la masse d'eau (m3) et A = la superficie de
l'endroit: le taux d'eécoulement (m2) = (y - 1) est égal à Qo/V, soit Qo,
volume moyen annuel d'écoulement. Qo peut être calculé en mesurant directement
les écoulements, ou, dans certaines circonstances, peut être déterminé
à partir de données publiées sur les débits entrants moyens annuels
par ruissellement (Adr), les précipitations (Pr) et l'évaporation (Ev),
ce qui donne:
Qo = Ad.r + A (Pr - Ev) (voir Dillon et Rigler, 1975, pour détails supplémentaires).
Le coefficient de rétention, R, peut être déterminé expérimentalement en mesurant la moyenne annuelle de débit entrant et débit sortant, respectivement: [P], [P]i et [P]o
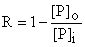
A l'aide d'une analyse à régressions multiples des données provenant de masses d'eau tempérées, Kirchner et Dillon (1975) sont arrivés à la conclusion qu'il existait une forte corrélation entre R et la charge hydraulique annuelle, Q/A, ce qui donne:
R = 0,426 exp (-0,271Q/A) + 0,574 exp (0,00949Q/A), r = 0,94,
où Q = la charge hydraulique annuelle (m3). On a développé plusieurs autres modèles assignés à des masses d'eau de type particulier, telles que les lacs tempérés oligotrophiques ou à écoulement rapide (Larsen et Mercier, 1976; Ostrofsky, 1978) et nombreux d'entre eux ont été analysés critiquement par Canfield et Bachmann (1981). D'après leurs conclusions, la meilleure méthode semblerait être celle qui consiste à utiliser diverses estimations de R, suivant la masse d'eau sur laquelle on est en train de travailler, bien que naturellement le choix de ces estimations dépende également des informations disponibles. Les modèles sont résumés dans le tableau 23.
Il semblerait qu'une relation semblable, quoique définie moins précisément, existe entre R et Q/A dans les lacs et les réservoirs tropicaux (Thornton et Walmsley, 1982) (figure 19). Cependant, nous devons nous contenter d'utiliser les modèles destinés aux eaux tempérées jusqu'à ce qu'on ait pu réunir les données nécessaires à la définition de la relation.
Lpoisson se présente principalement sous forme de particules et la proportion des fèces ou de la nourriture qui contribue à la réserve de P dissout dépend de nombreux facteurs; la teneur des aliments en P, la composition du régime, la forme de la boulette, la température, la profondeur de l'eau sous les cages, la présence/l'absence de poissons détritophages, etc. (Bienfang, 1980; Collins, 1983; Merican, 1983). Le modelage de ces pertes est en cours et des données préliminaires permettent déjà d'avancer que Rpoisson > P. Cependant, jusqu'au jour où de tels modèles seront disponibles, il faut considérer que, dans un premier temps, Rpoisson est égal à R, puis à la suite de l'introduction des cages, et une fois que le [P] en état stationnaire a été atteint (voir ci-dessous), il faut recalibrer le modèle:
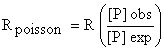
Le temps de réaction d'une masse d'eau à des augmentations en P est une fonction non linéaire du temps de séjour de l'eau t(M) [t(M) = 1/ρ], et de la profondeur moyenne, z. Le temps de réaction attendu, 95 pour cent, t(M)95, qui est utilisé en tant qu'approximation de temps de réaction total, peut être calculé à partir de la figure 20.
Quatrième étape: Une fois que l'on a procédé au calcul de la charge en P-total tolérée/acceptée, Lpoisson, on peut alors estimer la production piscicole intensive en cages (tonnesr-1) en divisant le Lpoisson par la moyenne des pertes totales en P par tonne de production piscicole (tableau 16). Un exemple est donné dans l'annexe 1.
Avant de considérer comment modeler l'impact de la pisciculture extensive en cages sur l'environnement, il faut examiner la raison pour laquelle on utilise cette méthode pour augmenter la production piscicole.
Ainsi que nous l'avons vu dans la section 4.2, le taux de production primaire en eaux continentales dépend de la disponibilité en substances nutritives essentielles et en lumière. A l'intérieur de l'écosystème, la production dans toutes les autres communautés dépend de la production primaire et il n'est donc pas surprenant de constater qu'il y a une relation ΣPP et les rendements piscicoles annuels (Pr) (Hrbáċek, 1969; Henderson Ryder et Kudhongania, 1973; Melack, 1976; Oglesby, 1977, 1982; McConnell, Lewis et Olsen, 1977; Hecky et al., 1981; Marten et Polovina, 1982; Adams, Kimmel et Ploskey, 1983).
Les informations que nous avons sur les rendements piscicoles et sur la productivité dans les lacs tropicaux et dans les réservoirs sont résumées à la figure 21. La ligne décrivant le mieux les données est une ligne curvilinéaire de la forme Y = AeBx, et le coefficient de corrélation, r, est de 0,64. Les données que nous possédons sont très dispersées, ce qui explique la faible valeur de la corrélation et cette variance est sans aucun doute due à la façon dont les données ont été rassemblées. Cependant il nous faut considérer plusieurs facteurs supplémentaires. Tout d'abord nous ne connaissons pas l'importance relative des autres sources d'énergie autochtones telles que le periphyton ou les macrophytes, ou encore les apports allochtones dans les masses d'eau en question. Les macrophytes et le periphyton peuvent tous les deux être des sources d'énergie importantes s'ajoutant à l'énergie totale fixée dans les masses d'eau lentiques (Moss, 1980), et bien que les apports allochtones semblent être relativement peu importants en ce qui concerne la plupart des masses d'eau lentiques (Adams Kimmel et Ploskey, 1983), ils peuvent être importants en ce qui concerne le système énergétique de plans d'eau moins importants à faible rétention, ou en ce qui concerne les systèmes aquatiques entourés de marais (Oglesby, 1977). Dans le réservoir de Bukit Merah, par exemple, en Malaisie, plus de 90 pour cent du C présent dans le système provient de sources allochtones (Yap, 1983), ce qui provoque une forte production de poissons detritophages et des rendements plus hauts que prévus par unité de production primaire.
Deuxièmement, nous ignorons à quel degré d'intensité les entreprises piscicoles sont gérées et quel équipement est utilisé. Une entreprise piscicole faiblement exploitée (par exemple, une entreprise piscicole dont les rendements normaux seraient très inférieurs aux rendements maxima soutenables) donneraient de faibles rendements par unité de production primaire (Marten et Polovina, 1982). Enfin, ce graphique ne prend pas en compte les espèces de poissons récoltés.
Il est intéressant d'examiner la forme générale de la courbe car elle suggère qu'à un faible niveau de production primaire, les coefficients de conversion trophiques (production au niveau trophique 1/production au niveau trophique n-1) sont peu élevés alors que dans les masses d'eau à forte productivité les coefficients de conversion sont beaucoup plus élevés. Il est cependant probable que cela soit dû à un effet de la base de données consultée. Non seulement les données varient qualitativement en ce qui concerne la façon dont la production primaire et les rendements piscicoles ont été estimés, mais aussi, peu de masses d'eau fortement productives ont été prises en compte dans cette analyse. Liang, Melack et Wang, (1981) suggèrent que la relation est en fait sigmoïde et que les données utilisées ici se rapportent uniquement à la partie la plus basse de la courbe. Il est donc avancé que les coefficients de conversion trophiques sont moins élevés dans les eaux à forte productivité.
Slobodkin (1960) et d'autres ont avancé sur des fondements théoriques que les coefficients de conversion en écosystème trophique devraient se situer autour de 10–15 pour cent. Il est cependant courant de rencontrer des coefficients de conversion relativement bas, entre 4 et 10 pour cent, dans les eaux douces (Wright, 1958; Gulati, 1975; Rey et Capblancq, 1975; Coveney et al., 1977; Lewis, 1979). L'efficacité d'un élevage d'herbivores dépend en partie de la qualité du phytoplancton (taille, espèce, etc.) (Zaret, 1980). Dans de nombreux cas cependant, les populations de zooplanctons herbivores sont fortement décimées par la prédation, ce qui explique pourquoi on se heurte à un échec lorsqu'il s'agit de récolter la portion principale de la production primaire. Bien qu'il existe une relation positive entre le zooplancton et le phytoplancton de la biomasse, ce rapport diminue au fur et à mesure que la productivité augmente. D'après des études récentes faites sur les populations de zooplancton, ces populations tendraient à être dominées par du microzooplancton (cilicates, rotifers, nauplii), se nourrissant principalement de bactéries (Gannon et Stemberger, 1978; Bays et Crisman, 1983). Dans les systèmes fortement productifs on remarque donc qu'une plus grande quantité de carbone fixé est détournée vers les rigoles détritiques et si l'on compre les coefficients de conversion observés par rapport aux coefficients de conversion attendus, on constate que la quantité de phytoplancton consommée par les herbivores dans les masses d'eau lentiques ne dépasse pas 30 pour cent.
En augmentant l'intensité de la consommation par le stockage de poissons à régime microphyte une partie de l'apport détritique pourrait être convertie directement en production piscicole, évitant ainsi les pertes d'énergie associées aux longues chaînes alimentaires. Bien qu'il soit possible que des poissons tels que les tilapias et les carpes, qui se nourrissent à la base du réseau alimentaire aquatique, aient des coefficients de conversion faibles en comparaison avec des organismes se nourrissant à des niveaux trophiques supérieurs, il y a néanmoins des pertes d'énergie à chaque étape successive du réseau alimentaire, ce qui explique le rendement relativement faible des entreprises piscicoles se limitant à la capture des poissons à l'extrémité de longues chaînes alimentaires (Jones, 1982).
L'augmentation de l'intensité de la consommation de l'herbivore aura tendance à réduire la taille moyenne du phytoplancton individual, entraînant par la même occasion une augmentation du taux de renouvellement (Cooper, 1973) ou, ainsi qu'on l'appelle généralement, de la production relative (Production/Biomasse = P/B). Cela stimulera, sans dépasser certaines limites, la productivité générale du système (Opuszynski, 1980).
Une raison de plus pour pratiquer l'empoissonnement dans les masses d'eau continentales: dans de nombreuses eaux douces tropicales, particulièrement en Asie et en Amérique du Sud, il n'est pas possible d'utiliser tous les niveaux trophiques (Fernando et Holcik, 1982). Les poissons provenant de rivières ne sont pas bien adaptés aux zones lacustres des lacs et des réservoirs dans ces systèmes où les cichlidés et les clupéidés n'ont pas été introduits.
Les raisons pour lesquelles il convient de modifier les écosystèmes aquatiques en y introduisant l'aquaculture extensive (entreprises piscicoles, ranching, zones de pêches, culture en enclos et en cages) sont résumées à la figure 22. En empoissonnant les écosystèmes aquatiques avec les espèces de poissons appropriées, c'est-à-dire qui se nourrissent à la base du réseau alimentaire, les niches vacantes du système pourront être utilisées et la consommation du phytoplancton encouragée, augmentant ainsi le P/B du phytoplancton et réduisant les pertes d'énergie entre les apports d'énergie autochtones et les rendements piscicoles. Les effets contraires possibles seront exposés dans la discussion.
Les principales espèces cultivées en culture extensive en enclos sont les tilapias (O. niloticus et O. mossambicus), bien que dans certains pays l'on procède à l'élevage des carpes (H. molitrix, A. nobilis) et des milkfish de cette façon. On utilise plus facilement les cages que les enclos. Etant donné que les recherches sur l'alimentation de ces poissons dans des conditions de culture extensive n'ont pas encore été très poussées, il nous faut nous référer à des données provenant d'études sur la consommation alimentaire dans des conditions naturelles et en étangs piscicoles et aux résultats d'études nutritives afin de déterminer la quantité probable de nourriture consommée et la relation entre la ration alimentaire et la production piscicole.
Les régimes des tilapias et des carpes sont résumés dans le tableau 24. Comme la plupart des autres tilapias le O. niloticus est principalement herbivore, et dans des conditions naturelles son régime sera principalement à base de phytoplancton. Cependant, dans les étangs à fort empoissonnement et à haute fertilisation organique, dont la principale source d'énergie provient des rigoles détritiques et dans lesquels la compétition intraspécifique pour la nourriture peut être sévère, le O. niloticus se nourrit d'engrais organiques, nourriture qui lui permet de croître régulièrement. La principale valeur nutritive ne provient cependant pas du détritus lui-même, mais des micro-organismes dont les particules sont recouvertes. L'O. mossambicus est une espèce plus omnivore et on a découvert qu'il ingérait une grande variété de substances végétales, ainsi que du zooplancton, des larves et des oeufs de poissons et des détritus. Il est probable que ces deux espèces, dans les conditions provoquées par l'élevage en cages, se nourrissent cependant principalement de phytoplancton et de détritus.
Des études menées sur les régimes des carpes en cages démontrent que la carpe argentée se nourrit essentiellement de phytoplancton (8–100 um), alors que la carpe à grosse tête consomme du phytoplancton, du zooplancton et des détritus dans un éventail de 17–3 000 um (Cremer et Smitherman, 1980).
Dans la section suivante, dont le sujet est la production potentielle à partir de la culture extensive, on insistera particulièrement sur la culture de tilapias en cages qui est la forme la plus courante de culture extensive. L'utilisation d'enclos et la culture des carpes sera discutée dans la section 4.6.
La consommation alimentaire des poissons peut être résumée par l'équation suivante: C = P + R + F + U, où C = consommation alimentaire en termes énergétiques (joules); P = énergie dépensée pour la croissance tissulaire (y compris les dépôts de graisse, le développement des oeufs et des spermes); R = énergie dépensée pour le travail (y compris l'entretien physique, la digestion, l'activité); F et U = les pertes d'énergie à travers respectivement les fèces et les urines.
La quantité d'énergie utile disponible pour l'animal ou pour l'assimilation (A), ainsi qu'on la désigne généralement, peut être tirée de:
A = C - (F + U)
= P + R
L'assimilation est souvent évaluée en termes d'efficacité d'assimilation (A):
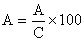
On a découvert que les valeurs de A variaient suivant les tilapias, car elles dépendent de 40 à 55 pour cent de la source alimentaire et de la température (voir tableau 25).
Plusieurs populations de tilapias subissent des migrations diurnes, des chaudes régions littorales où elles vivent pendant la journée vers les eaux du large plus profondes et plus fraîches, la nuit (Fryer et Iles, 1972; Bruton et Boltt, 1975; Caulton, 1975). Caulton (1978) a démontré que ce comportement avait un effet considérable sur l'A du T. rendalli. A 18°C (température nocturne moyenne, A = ∼48 pour cent, alors qu'à 30°C (température diurne moyenne) A = 58 pour cent. Cependant, les poissons retenus captifs dans des cages flottantes ne sont pas tellement exposés aux fluctuations de température diurne (∼ 1°–2°C) et si l'on considère que la température subit une fluctuation annuelle de 25°–30°C, il ne faut pas s'attendre à constater une variation en A de plus de 5 pour cent (d'après Caulton, 1982).
Une portion seulement de l'énergie assimilée profitera à la croissance. Des recherches faites par Caulton (1982) ont montré que le T. rendalli peut utiliser approximativement 0,5 A pour sa croissance, à condition qu'il puisse réduire ses exigences en énergie métabolique par un phénomène de migrations vers des eaux plus froides la nuit. Cependant, si nous considérons une température constante de 28°C, ∼0,2 A passe dans la croissance, ce qui nous amène à une valeur générale de conversion alimentaire (valeur énergétique du tissu végétal consommé/valeur énergétique de l'élaboration du tissu poisson) de ∼10 pour cent. Un O. mossambicus nourri à partir d'un régime algal a montré un coefficient de conversion alimentaire plus élevé, de 16 à 22 pour cent à 25°C et l'on a assumé que le coefficient de conversion alimentaire du O. niloticus élevé en cages, se situait quelque part entre les valeurs concernant les autres espèces (15 pour cent), en raison de l'absence d'autres données. (N.B.: Cette valeur est une estimation qui ne tient pas compte des effets de la qualité de la nourriture, de l'âge, des conditions de reproduction, etc. (Fischer, 1979).
En théorie, donc, 10–15 pour cent de la production primaire pourrait être convertie en tissu de poisson (de tilapias).
Dans la figure 23 la production piscicole est comparée à la production primaire. Une masse d'eau dont la production primaire s'élèverait à 1 000 g (m-2y-1) aurait un rendement de 1 000–1 500 g de tissu de poisson (m-2 y-1) ou 1 000–1 500 tonnes km-2, y-1, considérant que le coefficient de conversion alimentaire est de 10–15 pour cent et que la teneur en carbone du poisson est de 10 pour cent du poids mouillé (à la sortie de l'eau). En comparaison, le rendement piscicole d'une zone de pêche typique en eaux tropicales continentales dont le taux de production primaire est sensiblement le même, s'élève à 6 tonnes environ.
Ainsi que nous l'avons vu ci-dessus la différence entre les rendements piscicoles réels et les rendements théoriquement possibles est énorme et les possibilités d'amélioration de cet état de choses par la gestion de l'écosystème sont nombreuses.
Si l'on se réfère aux théories sur les pêches classiques de Russell (1931) et Beverton et Holt (1957), la taille d'un cheptel piscicole exploitable est déterminée par quatre facteurs (le taux de recrutement, le taux de croissance, le taux de mortalité due à la pêche et de mortalité naturelle), qui fonctionnent ainsi que nous l'avons représenté par des diagrammes (figure 24). On peut s'apercevoir que:
en excluant les prédateurs et en minimisant les effets de la maladie sur le taux de mortalité naturelle;
en laissant de côté les facteurs qui gouvernent le taux de recrutement en pratiquant un empoissonnement artificiel;
en stimulant le P/B des producteurs primaires et en maximisant le coefficient de conversion du système par un choix approprié des espèces;
en procédant à la récolte avant que le coefficient de conversion alimentaire soit affecté par les effets adverses de l'âge ou de la reproduction;
en minimisant les pertes d'énergie dues à la recherche de nourriture et
en maximisant le taux de mortalité due à la pêche,
les rendements piscicoles par unité de production primaire pourraient être maximisés.
Deux méthodes principales peuvent permettre d'arriver à mettre en pratique les méthodes citées ci-dessus. Il est possible de remplir le critère (ii) et le critère (iii) à l'aide des méthodes conventionnelles d'empoissonnement et de gestion des pêches et d'avoir ainsi un degré d'influence sur les autres méthodes. Le taux de mortalité naturelle peut être influencé par un programme de destruction des oiseaux et mammifères piscivores (voir FAO, 1983, pour détails sur l'aménagement des lacs de Chine) et par l'intensification des pêches, ce qui éliminerait les pertes dues à la vieillesse. Une augmentation de la mortalité due à la pêche provoquerait un accroissement du P/B des poissons. Les poissons dont on en peut pratiquer l'élevage dans les systèmes lentiques, tels que les carpes chinoises, pourraient également être stockés ce qui minimiserait les pertes énergétiques associées au développement de gonade et la production des oeufs et de laitance. De telles méthodes de gestion sont plus faciles à mettre en place dans de petites masses d'eau.
En Chine, on est arrivé à une augmentation des rendements grâce à ces méthodes, allant jusqu'à 15 fois le rendement d'origine (Tapiador et al., 1977; Liang, Melack et Wang, 1981; FAO, 1983) (tableau 26). Si l'on prend 0,04–0,06 pour cent de moyenne d'efficience de conversion entre la production de base et le rendement piscicole précédant l'empoissonnement (voir figure 21), on atteint une augmentation de 0,6–0,9 pour cent.
Les modifications des données de Liang, Melack et Wang (1981) en ce qui concerne les lacs à aménagement intensif près de Wuhau, en Chine, présentent un éventail d'efficiences de conversion en termes de superficie de la production primaire aux rendements piscicoles allant de 0,5–2,3 pour cent (brut) ou 0,2–2,2 pour cent (net) (tableau 27). Cependant, ces chiffres sont probablement surestimés étant donné que dans la plupart des lacs des fertilisants organiques et des denrées alimentaires supplémentaires avaient été utilisées.
On peut, par contraste, pratiquement atteindre le critère visant à maximiser les rendements de production primaire à l'aide de la culture extensive en cages et, par conséquent, les rendements devraient être plus élevés. Une approximation des efficiences de conversion susceptibles d'être atteintes a été retracée dans la figure 25 d'après des données d'Almazan et de Boyd (1978) dans le domaine des rendements de tilapias (O. aureus) par rapport à la production de base dans des étangs piscicoles fertilisés inorganiquement. Les courbes supérieures représentent les rendements piscicoles, considérant des coefficients de conversion de 10 et 15 pour cent, alors que le tracé du milieu correspond aux données d'Almazan et de Boyd. La courbe inférieure représente les rendements piscicoles en provenance des lacs et réservoirs tropicaux (figure 21, retracée). On peut constater que la courbe représentant le rendement de tilapias a la même forme (Y = AeBx) que celle correspondant aux lacs et réservoirs tropicaux, mais que sa corrélation (v = 0,91) est bien meilleure à l'intérieur de l'échantillonnage examiné ici. Pour chaque valeur donnée de ΣPP, les rendements sont 20 fois (18–24) plus importants dans les étangs aménagés de façon extensive que dans les pêches en lacs ou en réservoirs normaux. L'efficience de conversion entre la production primaire et les rendements piscicoles varie de 1,4 pour cent dans les étangs à forte production à 1,3 pour cent dans les étangs relativement peu productifs, ce qui se rapproche des estimations faites dans les étangs piscicoles à aménagement extensif, en Malaisie (Prowse, 1972) et en Inde (Sreenivasan, 1972).
Cependant il ne faut pas perdre de vue que les étangs examinés sont uniquement des étangs au ΣPP sur un échantillonnage réduit (420–1 640 g C m-2 y-1). Les rendements piscicoles ne continueront pas à augmenter exponentiellement avec une productivité en hausse, car à un niveau de productivité élevé, les algues ne sont plus consommées suffisamment (voir section 4.4.1, ci-dessus). L'endroit où la courbe s'arrondit, qui correspond au moment où les augmentations de ΣPP commenceraient à provoquer des Pr moins importants, se situe probablement aux niveaux de ΣPP de >2 500 g (m-2 y-1), car Liang, Melack et Wang (1981) ont découvert qu'une courbe exponentielle était ce qu'il y avait de mieux adapté pour décrire leurs données qui incluaient des niveaux d'ΣPP plus importants que ces derniers. Il se peut que les rendements relativement élevés à bas niveaux de production primaire décrits dans la figure 25 prêtent à confusion, étant donné qu'aucune étude n'a été faite dans des étangs à ΣPP 420 g (m-2 y-1). Une courbe logistique traversant le point d'origine serait, ainsi que l'ont proposé Liang, Melack et Wang (1981), la mieux adaptée pour décrire la relation.
On se base sur les rendements de culture extensive en étangs pour estimer les efficiences de conversion auxquelles on peut s'attendre à partir des cages aménagées pour la culture extensive. Néanmoins de nombreuses différences existent entre ces deux méthodes de culture extensive. On peut s'attendre à de plus forts rendements par unité de production primaire dans les cages puisque la prédation et les pertes d'énergie respiratoire pendant l'alimentation, sont plus importantes dans les étangs. Cependant, les poissons d'étangs profonds peuvent se déplacer vers des eaux plus fraîches la nuit, conservant ainsi leur énergie. La possibilité qu'a le poisson en cages de brouter les algues peut également être réduite en raison de sa dépendance sur un approvisionnement principalement passif. Considérant cela et en l'absence de toute donnée précise, les estimations habituelles des rendements piscicoles annuels provenant de la culture extensive en cages s'échelonne probablement entre 1,0 et 3,5 pour cent de la production primaire (tableau 28), ce qui dépasse les rendements provenant des lacs et des réservoirs aménagés (tableau 27). Cependant ces valeurs correspondent à des opérations de pisciculture dans des conditions idéales (prenant en considération les espèces et la qualité des poissons utilisés pour l'empoissonnement, le taux d'empoissonnement, la taille des mailles, la situation des cages, etc. - voir ci-dessous) et l'on doit donc s'en servir avec prudence.
Première étape: Déterminer la production primaire brute annuelle, du site, ΣPP. Etant donné que de nombreuses masses d'eau continentales tropicales ressentent la saisonnalité en ce qui concerne l'évolution de la production primaire, il se peut que l'on ait à procéder régulièrement à des mesurations.
Deuxième étape: Convertir ΣPP en rendements piscicoles annuels potentiels à l'aide du tableau 28 et de la figure 25.
Troisième étape: La véritable organisation de la production prévue dépend d'un certain nombre de composants variables. Il faut établir le nombre de récoltes par an et la taille des poissons au moment de la récolte. Si, par exemple, il s'agit d'un élevage de tilapias, il serait alors souhaitable de faire deux récoltes par an de poissons de 160 g (6 poissons/ kg-1). Il se peut cependant que la saisonnalité dans la production primaire se ressente dans le fait qu'une récolte demande plus de temps pour croître. Afin d'atteindre la taille visée pour la récolte, la somme de la production primaire au cours de la première période de croissance de la première récolte, ΣPPc1, devrait être approximativement la même que celle de la deuxième récolte, ΣPPc2, bien que l'on ne tienne pas compte ici des variations possibles dans l'efficacité de la récolte du poisson à diverses densités algales et que cela devra être remanié dans la pratique.
La culture semi-intensive en cages et en enclos est le mode de pisciculture en clôture le plus répandu et est également, malheureusement, le plus difficile à évaluer et à planifier. Le principe de la culture semi-intensive consiste à nourrir les poissons de denrées alimentaires de faible qualité pour compléter leur ration alimentaire de nourriture naturelle. Cependant, ainsi que l'ont présenté Escover et Claveria (1984, sous presse) dans le rapport sur leurs travaux récents menés aux Philippines, les pratiques varient considérablement dans chaque exploitation particulière suivant la taille de la ferme, la disponibilité en denrées alimentaires et les frais engagés (tableau 29).
La charge biotique utile des eaux continentales pour la culture semi-intensive dépend de:
la productivité de la masse d'eau et de la quantité de nourriture naturelle disponible; et
la quantité et de la qualité de la nourriture supplémentaire utilisée.
Première étape: Déterminer la production primaire annuelle, ΣPP, du site envisagé d'après les explications données dans la section 4.4.4 ci-dessus.
Deuxième étape: Calculer le rendement piscicole annuel potentiel, Pr, de l'endroit en utilisant les renseignements du tableau 28.
Troisième étape: Calculer la quantité annuelle moyenne des denrées alimentaires diverses utilisées et le TCA (Taux de consommation alimentaire) de façon à déterminer le rendement piscicole dû au supplément de nourriture. Les valeurs de TCA sur quelques denrées alimentaires les plus répandues pour la culture du tilapia sont données au tableau 30.
Quatrième étape: Calculer la charge en P-total associé à l'utilisation d'un supplément de denrées alimentaires, Lpoisson et à l'aide du modèle de Dillon et Rigler (1974), calculer l'augmentation de [P] total (voir étape 3; section 4.3). L'augmentation en [P] total, peut être utilisée pour calculer les augmentations dans la production de base, ΣPP poisson, dues à la pisciculture bien qu'il soit probable que l'on arrive à un résultat de 10 pour cent de la production piscicole totale (voir annexe 3).
Cinquième étape: Estimer les rendements piscicoles dus au PPpoisson à l'aide des efficiences de conversion exposées dans le tableau 28. Calculer les rendements piscicoles totaux à partir de la culture semi-intensive soit:
Rp = (a ΣPP) + (Σnourriture TCA) + (b ΣPP poisson)
soit, a et b efficience de conversion attendue de la production primaire à la biomasse poisson (voir tableau 27) et Σnourriture quantité totale de denrées alimentaires ajoutées. Un exemple concret est présenté dans l'annexe 3.
Les modèles présentés ci-dessus, destinés à l'estimation de l'impact écologique et donc de la charge biotique utile des masses d'eau continentales pour différentes méthodes de culture en cages et en enclos sont aux tous débuts de leur développement. On a particulièrement insisté sur la culture en cages et sur les espèces les plus communément cultivées, telles que les salmonidés et les tilapias.
On a fait un résumé des principales régions à problèmes associées à chaque modèle dans le tableau 31. Dans le domaine de la culture intensive, le choix d'un critère de qualité de l'eau souhaitée/acceptable est un sujet de préoccupation majeur. Bien que l'USEPA (1976), l'OCDE (OCDE, 1982) et d'autres organismes aient mis en place des objectifs d'aménagement (quoiqu'on n'en soit encore qu'à un stade d'essai), leur préoccupation majeure a été en premier lieu de minimiser l'apparition de problèmes en chaîne dans les masses d'eau à utilisation multiple. Un domaine de préoccupation majeure et encore sans solution persiste dans la mise en place d'objectifs d'aménagement pour les masses d'eau dans lesquelles la pisciculture est l'unique et première activité et dans lesquelles la santé du poisson est la chose la plus importante à prendre en considération. Au fur et à mesure que la production piscicole intensive se développe en un endroit, la qualité générale de l'eau (turbidité, O2, NH4 libres, niveaux NO2, etc.) se détériore et les risques de mortalité de poissons augmentent. La relation entre la production et le risque doit être exponentielle étant donné qu'au fur et à mesure que la qualité de l'eau se détériore le nombre de facteurs de mortalité augmente, et leurs effets combinés sont synergistiques plutôt qu'additifs (figure 26).
Le modèle ne tient pas compte des modifications que subit la composition des espèces de plancton, modifications qui peuvent être considérables étant donné que les algues bleu-vertes qui prospèrent dans les conditions de culture intensive en cages, peuvent donner un mauvais goût au poisson (voir section 3.3.2), bien que les exploitations piscicoles soient prêtes à faire face à des problèmes périodiques qu'elles peuvent résoudre (à condition qu'elles aient accès à l'eau de mer/à l'eau courante propre) pour obtenir, en retour, une production plus élevée. De même, il sera possible de tolérer d'un point de vue économique un faible taux de mortalité dû à la mauvaise qualité de l'eau ou à la maladie. Les objectifs de gestion des masses d'eau destinées à la pisciculture uniquement seront donc probablement déterminées dans le but de pouvoir prévoir des normes de qualité de l'eau qui soient acceptables plutôt que désirables.
La nature exacte du rapport entre la qualité de l'eau et les risques dépendra probablement du site. En effet, de nombreux facteurs locaux demandent à être pris en compte, y compris les espèces cultivées, la qualité du stock, l'équilibre de l'empoissonnement et la condition dominante, la qualité de l'eau en cet endroit précis, la distance entre la zone d'alevinage et la zone de croissance, les méthodes d'élevage (exemple: la fréquence du triage), la composition de la communauté algale, etc. Tous ces facteurs peuvent avoir une grande influence sur le taux de mortalité du stock, mais il est extrêmement difficile de les quantifier.
La détermination d'objectifs acceptables de la qualité de l'eau est un domaine encore très contesté en ce qui concerne la pisciculture. Considérant cela, les chiffres donnés dans le tableau 20 doivent être utilisés avec prudence, en ce qui concerne la détermination des objectifs d'élevage et doivent être modifiés, si besoin est, d'après l'expérience acquise et d'après les informations réunies à partir du système de contrôle écologique.
Les estimations des teneurs en P faites d'après les opérations intensives en cages Lpoisson seront probablement reprises dans un futur proche, puisque les données sur la nature des déchets et sur la biodisponibilité sont publiées.
L'utilisation de ce modèle se limite aux masses d'eau où P est limité, bien que la plupart des lacs et des réservoirs fassent partie de cette catégorie. Il se peut que l'on ait tiré des facteurs de correction ou des rapports entre le P-algal de la biomasse et la production primaire pour d'autres types de masses d'eau (exemple: Hoyer et Jones, 1983, problème de la lumière). Les endroits convenant le mieux au modèle sont les masses d'eau de petite taille, bien mélangées, ou les endroits dans lesquels les cages sont très dispersées. Les cages situées à proximité du débit sortant d'un lac ou d'un réservoir auront sans doute beaucoup moins d'impact sur la masse d'eau que ne le prévoit le modèle.
Le type de modèle utilisé ci-dessus peut être cause d'erreurs considérables dans les prévisions (voir Reckhow, 1983) en ce qui concerne, semble-t-il, particulièrement les prévisions de [ch1] et [chl max.] provenant de [P]. Selon Reckhow (1983) les estimations du [P] dues aux caractéristiques du bassin versant et des variables hydrologiques entraînent souvent des erreurs de ± 30 pour cent alors que les données de l'OCDE (1982) permettent de penser que les erreurs tourneraient autour de ± 20 pour cent. Les estimations du [chl max.] ou du [ch1] provenant de [P] entraînent des erreurs supplémentaires d'environ ± 35 pour cent (d'après les calculs de l'OCDE, 1982). L'erreur totale entraînée par la prévision du [ch1] ou du [chl max.] tournerait donc autour de ± 55–65 pour cent. Bien que l'importance de l'erreur en question paraisse considérable, les prévisions devraient être suffisantes pour servir de guide d'installation afin d'atteindre des niveaux acceptables de production piscicole intensive, qui pourront être modifiés d'après les données réunies au sujet de la qualité de l'eau quand l'exploitation piscicole sera en fonction. On ne peut que trop insister sur l'importance de l'installation d'un système de contrôle de la qualité de l'eau.
Le modèle utilisé pour la culture extensive est également basé sur un certain nombre d'hypothèses non vérifiées et l'on doit donc utiliser les chiffres de conversion de la production primaire à la biomasse piscicole avec précaution. Les conclusions ont été tirées à partir de la culture des tilapias bien que les données soient similaires en ce qui concerne d'autres poissons se nourrissant à partir de phytoplancton, tels que la carpe argentée (Opuszynski, 1980). Les poissons se nourrissant à base de zooplancton, tels que la carpe à grosse tête, convertissent probablement la production primaire en biomasse piscicole moins efficacement et c'est la raison pour laquelle ils ont servi à des essais de contrôle de l'eutrophisation (Yang, sous presse). Il serait cependant nécessaire d'avoir une connaissance plus approfondie des effets de l'accroissement de la prédation sur les niveaux trophiques particuliers, car il semble que la zooplanctonophagie puisse provoquer des augmentations de biomasse phytoplanctonique (Elliott et al., 1983).
Malheureusement, les efforts entrepris pour estimer les meilleures conditions d'empoissonnement à partir de données sur l'approvisionnement en oxygène et en nourriture sont inadéquats à l'heure actuelle (annexe 4) et laissent imaginer des densités d'empoissonnement qui, même en considérant les pires conditions possibles (températures élevées, conditions de basse pression, petits poissons, augmentation des demandes métaboliques à la suite des repas, etc.) sont 5–20 fois plus élevées que dans la pratique. Les densités d'empoissonnement dans les cages d'exploitation à culture extensive aux Philippines tourne autour de 1–10 kg m3 suivant la productivité du site. Les niveaux d'empoissonnement appropriés doivent donc être toujours déterminés sur des bases empiriques.
Les modèles préliminaires d'empoissonnement illustrent l'importance qu'a l'eau qui passe à travers les cages pour maintenir un approvisionnement régulier en nourriture et en oxygène et suggèrent que la taille des mailles devrait être maintenue aussi large que possible et que les cages devraient être situées le plus loin possible les unes des autres de façon à minimiser les effets des structures sur les courants (voir figure 27). Dans le réservoir de Selatar où l'on pratique la culture extensive en cages de la carpe marbrée, les cages sont disposées de cette façon (figure 28).
Il n'est pas surprenant que le modèle suggéré pour la culture semi-intensive en cages, étant une combinaison des modèles pour la culture extensive et pour la culture semi-intensive, contienne les erreurs associées à ces deux modèles. Il est également difficile de réunir des informations sur la quantité et la qualité de la nourriture utilisée et en l'absence de données concrètes, il est encore plus difficile de déterminer leur importance diététique lorsqu'elles sont utilisées comme denrées alimentaires supplémentaires. Cependant, il faudrait réduire la surexploitation même à l'aide du modèle existant, et le procédé typique d'aménagement d'un lac ou d'un réservoir (figure 10) devrait être modifié de façon à minimiser le risque financier des pisciculteurs les plus vulnérables (figure 29).
Tous les modèles cités ci-dessus ont plus à voir avec la culture en cages qu'avec la culture en enclos. A l'heure actuelle, la culture en enclos piscicoles a beaucoup moins d'importance et elle est pratiquée uniquement dans quelques pays d'Asie du Sud-Est (voir section 1.3). Elle est également pratiquée dans le domaine de la culture extensive et semi-intensive et ne convient pas obligatoirement à toutes les espèces de poissons. En raison du fait que les poissons élevés en enclos ont accès au benthos, il est possible que la conversion de la production primaire à la biomasse poisson soit plus élevée, bien qu'il soit difficile de déterminer de combien jusqu'à ce qu'on ait procédé à des études comparatives. Des données préliminaires venant des Philippines laissent penser que la production des tilapias en enclos piscicoles puisse atteindre 800 g m-2 mois-1 sans avoir recours à des denrées supplémentaires (Guerrero, 1983), ce qui est 10 fois supérieur à la production de tilapias élevés en cages avec de la nourriture supplémentaire dans la même région, au même moment (tableau 32). Les densités d'empoissonnement étaient cependant différentes. L'inconvénient majeur de cette méthode semble être la récolte et Guerrero (1983) a rapporté comment 15 pour cent seulement des poissons cultivés ont été récoltés dans les enclos. Toujours est-il qu'en tenant compte de ces chiffres préliminaires, un effort de recherche supplémentaire considérable paraît nécessaire.