3.1. Limnologie
Les conditions climatologiques
Température
Les moyennes annuelles restent pratiquement constantes, la valeur est de 20, 2°C en 1985 et de 20,1°C en 1986 à Gisenyi. Les variations mensuelles de la température moyenne au cours d'une année démontre des minima en juin, juillet et septembre en 1985 et en mai, juin et juillet en 1986, cette période coïncide avec la saison sèche (FIG.5).
Pluviosité
Les différences entre les secteurs géographiques ont été observées. La précipitation annuelle est supérieure dans le Sud (Cyangugu) soit 1483,5 mm (1986), la valeur au Centre (Kibuye) est la plus basse soit 997,6 mm et au Nord (Gisenyi) elle est de 1299,9 mm (1986). La pluviosité est plus élevée du côté Ouest 1591–1784 mm (1943 – '45 et '51).
Les mois les plus pluvieux sont mars et novembre en 1985 et
avril, juin et novembre en 1986 à Gisenyi (FIG.5).
La pluviosité a été inférieure en 1985 à Gisenyi et Cyangugu
comparée à la valeur en 1986 respectivement 1261, Omm et 1390, 3mm.
A Kibuye la précipitation est supérieure en 1985, soit 1030,5mm.
En général, pour ces années la pluviosité est déficitaire
vis-à-vis de la normale, la saison sèche s'est prolongée jusqu'en
semptembre et également les mois de janvier et février sont
déficitaires.
Température et l'oxygène dissous de l'eau
La température de surface ne varie pas dans les différents secteurs géographiques ayant une valeur maximale de 24,6°C à 24,7°C, à l'exception du Bassin de Bukavu et de la Baie de Kabuno (Sake) où l'eau est plus froide, la température maximale est respectivement de 23°, 4°C et de 23,5°C à 23,9°C (Verbeke 1984). En mars '87 ces différences géographiques ont également été démontrées en comparant des relevés faits au même moment de la journée (8–10 heures), dans le Bassin Nord une valeur de 24,7°C est notée, dans le Bassin de Bukavu 23,9°C et 23,7°C dans la Baie de Kabuno (FIG.6–7).
La couche vivante du lac s'étend de 0 à 70 mètres environ. Dans cette couche la température baisse avec la profondeur. En saison de pluie, il y a une stratification nette et la couche est divisée en épilimnion, le thermocline à 25 m et en dessous l'hypolimnion. Le thermocline est brusque et relativement important (1°C). En saison sèche (juin-juillet) le thermocline s'estompe par un refroidissement del'air qui abaisse la température dans l'épilimnion, suite auquel une circulation totale de la couche de 70 m a lieu. Un brassage partiel a lieu à la petite saison sèche (décembre à février) (Damas 1937 - Verbeke 1954).
L'oxygénation se fait seulement dans les premiers 70 m.
La diminution de la concentration d'oxygène dissous se fait
parallèlement au thermocline. En saison de pluie à la hauteur
du .. thermocline 25 à 30 m une chute brutale est constatée,
l'hypolimnion est presque dépourvu d'oxygène. En période de
brassage l'hypolimnion contient encore des quantités notables
d'oxygène. L'épilimnion par contre est toujours saturé d'oxygène
6,0 à 7,5 mgr/l (Damas 1937).
En mars '87 un thermocline estompé a été observé, l'oxygène
diminue graduellement avec la profondeur avec des quantiés
encore notables jusqu'à 40 à 50 m (FIG.6).
Verbeke (1954) a constaté une différence entre le Nord et le Sud en ce qui concerne la limite inférieure de l'oxygénation (FIG.8).
Sur nos stations au Sud la quantité d'oxygène diminue déjà à partir de 10 m mais atteint une valeur minimale seulement à 50 m. Dans le Nord l'oxygène diminue à partir de 20 m mais atteint la valeur minimale à 40 m (FIG.6).
Dans la baie du Kabuno l'évolution de la température et l'oxygène est particulière. La couche aérobie est très mince. La température diminue très vite jusqu'à 15 m et augmente à partir de là. En concordance la quantité d'oxygène chute très vite entre 8 et 15 m, là elle atteint son niveau minimal (FIG.7). Les émanations de gaz volcaniques et de sources hydrothermales sont responsables de cette situation (Verbeke, 1954).
Le pH
Le pH varie très peu d'un endroit à l'auture du lac, allant de 8,8 à 8,9 (mars '87). Le pH se maintient à peu près constant dans l'épilimnion et diminue légèrement dans l'hypilimnion 8,2 à 8,5 (FIG.7).
Dans la baie de Kabuno le pH est plus acide, 7,9 en surface, 6,9 à 10 m et 6,1 à 15–50 m (FIG. 7). Ce pH acide est provoqué par de grandes quantités de CO2 libre d'origine volcanique (Schmitz et Kufferath 1955).
La conductivité
Egalement ce paramètre varie très peu d'un endroit à l'autre
du lac. La valeur varie entre 1276 et 1294 μmhos/cm.
Cette valeur reste invariable jusqu'à une profondeur de 40m,
à partir de là elle augmente graduellement (FIG.7).
Dans les conditions particulières de la Baie de Kabuno la valeur de l'épilimnion est de 1469 μmhos/cm, à partir de 10m elle augmente fortement, 3,75 μmhos/cm à 15 m et 5,72m μmhos/cm à 60 m.
Transparence
Les variations mensuelles indiquent que la transparence est supérieure en saison de stratification en relation avec une plus faible abondance de plancton (FIG. 9).
La densité plus élevée de zooplancton en février '86 vis-à-vis
de mars '87, est correlée à une transparence supérieure.
Une poussée de phytoplancton (Microcystis) est responsable de la
baisse de la transparence en mars (TABLEAU 1–3-FIG.10).
Une différence géographique a été notée, la transparence est inférieure dans le Bassin de Bukavu avec néanmoins des quantités de zooplancton du même ordre de grandeur que les autres secteurs. La transparence est aussi déterminée par la densité de particules inertes en suspension. Probablement c'est le cas pour le Bassin de Bukavu étant donné sa plus faible prodondeur et la présence de fonds vaseux.
Le zooplancton
La quantité de zooplancton augmente deux fois au cours d'un
cycle annuel, une légère augmentation après le brassage partiel
et une forte augmentation après le brassage total (FGI. 9).
L'enrichissement des eaux superficielles en sels dissous cause
le développement du phytoplancton, suivi du développement du
zooplancton.
A ce moment les Cladocères représentent 49 % du total, pendant
la période de faible densité les Cladocères ne constituent que
1 à 5 %. La poussée des Cladocères est suivie de celle des
Copepodes (Verbeke, 1954 FIG.9).
Dans les échantillons de 1986 et 1987 les Rotifères prennent
une part très importante (environ 30 à 65%) dans la communauté
pélagique du zooplancton ce qui n'était pas le cas avant l'introduction
du Limnothrissa miodon.
De profonds changements ont eu lieu causés par la pression de
prédation exercée par Limnothrissa miodon (Reyntjens, 1981).
Le nombre d'espèces a augmenté et les grands organismes
(Cladocères, Copepodes) ont disparu au profit d'espèces plus
petites de Rotifères.
Dans nos échantillons, les Cladocères représentent 2 à 5%
du total en février et mars et 12 à 13% en septembre.
La proportion moyenne des Copépodes + Nauplii est de 41% en
février, 59% en mars et 44% en septembre.
L'évolution est restée semblable à celle notée en 1954 mais
les proportions ont diminué en faveur des Rotifères.
La proportion des Rotifères est de l'ordre de 59% en février,
37% en mars et 39 en septembre (TABLEAU 3).
Une différence en densité est observée parmi les secteurs
géographiques du lac (FIG.13 - TABLEAU 3).
En septembre une plus grande densité est constatée dans le
Bassin Central où le Bassin Est a une valeur plus élevée.
Dans le Bassin Nord également l'abondance est supérieure dans
l'Est. La moyenne du Bassin de Bukavu est légèrement supérieure
à celle du Nord.
En février les différences entre la partie Nord, Central et
Sud sont semblables.
En mars l'abondance supérieure est située dans le Bassin de
Bukavu et la valeur inférieure est trouvée dans le Bassin Nord.
La situation de la densité à l'Est et à l'Ouest est inverse
par rapport à septembre.
3.2. Caractéristiques biologiques
Reproduction
- Maturité
La taille à première maturité n'a pas pu être déterminée, étant donné que les individus prématurés (60–78mm LF) ont été en trop petit nombre dans les échantillons.
D'après Spliethoff et De Iongh (1983), la taille à première
maturité est de 60,6 mm pour les mâles et 62,4 mm pour les
femelles. Une acquisition plus précoce de la maturité a eu lieu
par rapport au lac Tanganyika où les mâles atteignent la maturité
à 64 mm et les femelles à 75 mm LF (Ellis 1974).
Dans les autres milieux d'introduction, le lac Kariba et Cahora
Bassa une plus forte réduction a eu lieu.
- La fraie, période de reproduction
L'évolution de la proportion d'individus mûrs, en stade de
maturité III, IV et V démontre une activité de fraie durant
toute l'année, néanmoins deux phases d'activités de pointe
se manifestent (FIG.11).
Une période prolongée avec le maximum d'individus mûrs s'étend
de septembre à mars (1985) ou de septembre à janvier (1986)
et une période plus courte de mars à juin (1985) ou de mai à
juin (1986).
En 1986 les périodes d'activité sexuelle maximale sont de
plus courte durée qu'en 1985. Egalement les proportions d'individus
mûrs sont supérieures (69–94%) durant la fraie maximale de 1985 par
rapport à 1986 (72–86%).
En 1980, la durée des périodes de ponte a été plus courte, la fraie
principale d'août à octobre et la petite fraie de mars à mai
(Spliethoff et De Iongh 1981 FIG.12).
Ces différences de proportions d'individus mûrs et de la durée
de la fraie sont sans doute liées à des changements dans les
conditions environnementales d'une année à l'autre.
- Rapport des sexes
Pour la période de mars 1985 à février 1986 le rapport moyen est de 0,72 pour mars 1986 à février 1987 il est de 0,76. La moyenne globale est de 0,74, ce qui correspond à 58% des femelles contre 42% de mâles.
En zone littorale un rapport moyen de 0,64,soit 61% de femelles contre 39% de mâles est observé (Mutumba 1987).
La prédominance des femelles chez les individus âgés laisserait conclure à une mortalité supérieure chez les mâles, imputée sans doute à l'acquisition précoce de la maturité et une croissance plus rapide.
Les variations mensuelles observées sont sans doute dues à un échantillonnage biaisé à la suite d'une pêche sélective, causée par des changements dans la répartition spatiale au cours de l'année, soit par une formation de bancs des sexes séparés, reconstitution de bancs mixtes et migration différentielle.
La prédominance de mâles pendant la petite fraie et à la fin des périodes de ponte pourrait être causée par un pareil phénomène de formation de bancs séparés de mâles et femelles (FIG. 13).
A Cahora Bassa une variation géographique a été observée,
résultant des migrations (Vostradovsky, 1984).
Etant donné le petit nombre d'échantillons prélevés à Kibuye
et Cyangugu, rien n'est connu à ce sujet au lac Kivu.
- Fécondité
La fécondité varie entre 4658 et 13150 ovules. Elle s'accroît
avec la taille jusqu'à la classe de taille 100–105 mm LF où le
nombre d'ovules diminue (TABLEAU 4).
A Cahora Bassa la fécondité varie entre 360 et 2660, la moyenne
est de 832 ovules (Vostradovsky 1984). Les mêmes chiffres ont
été trouvés au lac Kariba.
La valeur supérieure de la fécondité au lac Kivu indique que les conditions y sont plus favorables qu'au lac Kariba et à Cahora Bassa.
- Condition/croissance
Relation longueur-poids
Pour la période de mars '85 à février '86 la relation longueur-poids est P=0,0128 LF 2,9 (r = 0,956) et pour la période de mars '86 à février '87 P=0,0168 LF 2,7 (r=0,0967). En 1979 Lays a trouvé P=0,000029 LF 2,7
Au lac Tanganyika le Limnothrissa est un peu plus lourd, la relation est P=0,000011 LF2,98 (Mann 1975) et en 1978 Cayron a trouvé un exposant b de 3,16.
Au lac Kariba l'exposant b = 2,37 (Cochrane, 1978).
Dans le milieu d'origine les conditions sont plus favorables
pour le Limnothrissa que dans les milieux d'introduction.
Néanmoins la situation est plus avantageuse au lac Kivu qu'au
lac Kariba.
L'exposant plus élevé en 1985 par rapport à 1986 indique des
meilleures conditions environnementales en 1985.
Cinq groupes de taille ont été discernés à partir de la relation longueur-poids (FIG.14–15).
| Groupe | I | 39–51 mm LF | b=2,6 (1985) | b=2,5 (1986) |
| Groupe | II | 51–75 mm LF | b=3,2 (1985) | b=3,4 (1986) |
| Groupe | III | 75–90 mm LF, | b=3,1 (1985) | b=2,5 (1986) |
| Groupe | IV | 90–99 mm LF, | b=1,9 (1985) | b=1,7 (1986) |
| Groupe | V | 99–108mm LF, | b=3,9 (1985) | b=3,0 (1986) |
Pour les individus de taille supérieure (90–135mm LF) dans
la frange littorale, l'exposant b est de 3,8 pour la période
de mars '85 à mars '86 (Mutumba, 1987). Ces individus appartiennent
au groupe V.
Pour le groupe II, les prématures et le groupe III une meilleure
croissance en poids est observée. La valeur inférieure pour le
groupe IV montre que les poissons perdent leur embonpoint en
veillissant.
Chez les individus de taille supérieure (Groupe V) la situation
se rétablit, ceci est sans doute dû un changement
dans le régime alimentaire, ces individus deviennent insectivores
(Spliethoff et De Iongh 1981).
Pour le groupe IV la disponibilité de zooplancton ne doit
plus suffir pour soutenir la croissance. Ce groupe se trouve
à la transition d'un mode d'alimentation à l'autre.
La valeur inférieure des juvéniles de 39 à 51 mm LF pourrait indiquer le même processus. Les petits juvéniles (20–35mm LF) se nourrissent de phytoplancton et les plus grands juvéniles de phyto et zooplancton (Spliethoff et De Iongh), ils semblent être en transition vers un régime alimentaire consistant principalement de zooplancton chez les adultes.
Une différence entre femelles (b=4,05) et mâles (b=3,24) est signalée par Mutumba dans la zone littorale, ce qui indique une croissance pondérale différentielle entre les sexes.
Ainsi le Limnothrissa detient une grande plasticité pour sa croissance en changeant le taux de croissance en fonction de la disponibilité de nourriture.
Facteur de condition
Des variations importantes du coefficient de condition K=105 p/LF3 avec les saisons et pour les groupes de taille existent (FIG.16).
L'évolution du coefficient moyen mensuel est semblable pour les groupes de taille, les plus grandes valeurs sont trouvées durant les périodes de ponte maximale. Cette meilleure condition est en relation avec la poussée planctonique suite au brassage des eaux.
Le coefficient de condition moyen pour tous les groupes est de 0,985 en 1985 et de 0,974 en 1986.
La valeur moyenne élevée pour les individus de taille supérieure dans la zone littorale de 0,992 (Mutumba, 1987) est sans doute en relation avec une plus grande richesse planctonique et d'insectes vis-à-vis de la zone pélagique.
Adiposité
L'adiposité ou la quantité de tissu adipeux dans la cavité abdominale subit les mêmes variations saisonnières que le facteur de condition (FIG.17).
Le poids maximal représenté par le tissus adipeux est de 24,9% du poids total (1985) et 16,1% (1986) pour les individus de 78 à 105 mm. De plus les pourcentages d'individus remplis de tissus adipeux sont plus faibles en 1986 qu'en 1985. Pour les individus de 102 à 105 mm LF la proportion de tissu adipeux est très faible 0,8% et 0,9%, par rapport aux tailles inférieures 22,4% à 33,1% (1985) et 14,6%–21,4% (1986). Ainsi chez les individus veillissant moins de tissu adipeux est produit en relation avec le poids total.
Les poissons maigres
L'occurence d'individus maigres est observée parmi les
tailles de 90–102 mm LF correspondant au groupe IV detenant
une valeur de b inférieure par rapport aux autres groupes
(FIG.18).
Leur proportion est maximale au cours de la saison sèche,
quand les conditions alimentaires sont moins bonnes (FIG.19).
Rythme d'activité
Le poisson connait 2 périodes importantes d'activité durant lesquelles il se nourrit, à l'aube entre 4 et 6 heures et au crépuscule entre 18 et 20 heures (Spliethoff, De Iongh 1981-Mutumba 1987).
La proportion de poissons capturés est plus élevée entre 4 et 8 heures indiquant une activité intense à l'aube. En fin d'après-midi la période d'activité est plus courte 18–20 heures (FIG.20).
Une activité de moindre importance, mais de longue durée est apparente la nuit entre 20 et 2 à 4 heures, elle coïncide en général avec les phases lunaires du premier quartier et de la pleine lune.
Le pourcentage d'estomacs remplis est plus élevé le soir par
rapport au matin (TABLEAU 5). On peut noter également que la
période de digestion est plus longue le soir que le matin.
Les poissons se nourrissent donc principalement le soir, la
période à l'aube est moins importante.
Mutumba (1987) a trouvé un pourcentage d'estomacs remplis plus
élevé le matin.
Sans doute des différences saisonnières existent.
Apparemment pas toute activité est consacrée à la prise de nourriture ce que démontre l'activité intense le matin.
Régime alimentaire
Le Limnothrissa fait preuve d'une grande plasticité au niveau
de son régime alimentaire, ce qui a sans doute contribué à la
réussite de son introduction au détriment du Stolothrissa
tanganicae un planctonivore spécialisé.
Le Limnothrissa n'est pas exclusivement planctonivore quand la
nécessité s'impose il est capable d'utiliser un autre type de
nourriture.
Les individus veillissant deviennent insectivores et même
cannibales, prédateurs des juvéniles.
Le cannibalisme a été mis en doute comme étant un artéfacte de
l'attraction lumineuse qui concentre les poissons
(Henderson, 1976; Gliwicz, 1984).
Des expériences à l'aide de filets maillants sans attraction lumineuse ont été effectuées dans la zone littorale (Mutumba 1987).
Le cannibalisme a effectivement été observé durant une
certaine période septembre à avril (FIG.21) coïcidant avec
la période de ponte maximale. Ce changement du régime alimentaire
peut être incité par l'augmentation des besoins énergétiques
pour la préparation des gonades malgré les conditions
optimales existant à ce moment.
Une autre explication peut être que c'est la grande densité
d'alevins à cette période, fournissant des proies faciles qui
incite le poisson au cannibalisme.
Surtout les individus de grande taille, 105 à 125 mm LF se nourrissent de juvéniles (FIG.22). Le cannibalisme est observé plus fréquemment chez les femelles que chez les mâles. Les alevins retrouvés dans les estomacs ont une taille de 9 à 45 mm LF. La taille de la proie augmente avec la taille du prédateur, une longueur moyenne d'un peu plus d'un quart 26,2%) de la taille du prédateur est observée.
Répartition différentielle
Distribution verticale
La limite bathymétrique inférieure de la distribution des poissons est correlée à la présence de quantité suffisante d'oxygène, indiquant ainsi l'étendue de la couche oxygénée.
Au cours de la saison de pluie (novembre, septembre,
octobre, février) la profondeur maximale atteinte est
généralement de 40 à 50 m.
A la fin de la saison de pluie, lors de la stratification
(mars, juin) la limite se situe aux alentours de 40 m, de
35 à 45 m et parfois même à seulement 30 m.
Des différences géographiques existent en relation avec des différences de pénétration de l'oxygène, étant donné que la limite inférieure de l'oxygénation est située à plus grande profondeur au Sud. Ainsi la profondeur maximale à plus laquelle des poissons sont présents est plus élevée au Bassin de Bukavu et au Bassin Central.
Dans cette partie, en saison de pluie, la limite se trouve
régulièrement à 55–60 m et atteint parfois 65 m (radiales
10–29). Dans le Bassin Nord seulement à quelques endroits la
profondeur de 58–60 m est atteinte.
En saison de stratification, la limite peut dépasser 45 m et
même atteindre 55 m dans le Bassin de Bukavu et Central
(radiale 15 – 20 et 26 – 30).
Dans la baie de Kabuno, la limite inférieure de la distribution est située à 10 m en relation avec la disparition d'oxygène à partir de cette profondeur.
Formation d'aggrégations
Le Limnothrissa miodon est un poisson pélagique grégaire c'est-à-dire qu'il constitue des bancs.
On distingue 2 types de distribution, la distribution de jour
présentant principalement des aggrégations et la distribution
de nuit où les poissons sont dispersés et se déplacent individuellement.
De jour 2 formes d'aggrégation ont été remarquées, des aggrégations
compactes ou bancs et des aggrégations peu cohérentes.
Au delà du banc, les poissons tendent à se regrouper en vastes concentrations, qui se profilent en couches distinctes à différentes profondeurs.
En général, il y a 3 couches. La couche supérieure est
la plus haute, 10 à 20 m de hauteur, les 2 couches inférieures
ont une hauteur de 3 à 10 m (FIG.23).
La profondeur à laquelle se situent ces couches diffère selon la
saison. En saison de pluie, la couche supérieure s'étend entre
5–10 m et 20–30, la 2è couche se trouve entre 35 et 40 m et
la 3è couche se situe aux alentours de 50 à 60 m.
En période de stratification surtout les 2 couches inférieures
se déplacent vers des profondeurs plus faibles.
La 2ème couche se situe entre 30 et 35 m et la 3ème couche
entre 40–50 m ou entre 20–30m et la 3ème entre 35 et 40m.
Les couches sont séparées par un espace vide mais parfois les 2 couches supérieures se touchent, tout en restant distinguables par une différence de configuration.
Parfois, seulement 2 couches se profilent, dans ce cas la 2ème couche a disparu. Pendant la stratification la couche supérieure s'étend de 5–10 m à 20–30m et en saison de pluie elle se situe entre 10 et 30–35 m (FIG.24–25).
Deux formes de bancs sont observées dans ces couches.
La forme la plus courante est le type de banc élongé, plus
profond que large, abondamment présente dans la couche
supérieure et dans la partie supérieure de la 2 ème couche.
Ces bancs peuvent atteindre une hauteur de 8 à 12 m en moyenne
et 17,5 m au maximum (FIG. 23–25).
La deuxième forme rencontrée est irrégulière et plus large
que profonde. Ce type est dominant dans la partie inférieure
de la 2ème couche et dans la 3ème couche.
Les aggrégations peu cohérentes se sont manifestées à
différents moments de la journée, entre 11 et 13 heures,
tôt matin et tard dans l'après-midi. En mars '87 cette dispersion
s'est maintenue durant plusieurs jours consécutifs.
Aucune relation avec les phases lunaires est apparue, ce
phénomène se présentait à toutes les phases. Une relation
causale existe avec des conditions de mauvais temps, orage,
forte averse ou vents forts.
Pendant et après le mauvais temps les bancs se dissolvent et
les poissons se dispersent. Cette situation se maintient
plusieurs heures après le mauvais temps, ainsi après une nuit
orageuse les poissons ne se rassemblent pas en bancs compacts
mais restent dispersés durant toute la matinée (mars 87 FIG.26).
Ces aggrégations peu cohérentes se maintiennent dans les couches.
Les 3 couches avec leurs bancs typiques sont observées dans toutes les zones, la zone pélagique, intermédiaire et littorale (FIG.27).
La baie de Sake présente une distribution abérrante, une seule couche existe avec une hauteur d'environ 10 m consistant principalement de poissons dispersés et peu de bancs de forme irrégulière, sans doute due aux caractéristiques limnologiques particulières (FIG.28).
La distribution de nuit est caractérisée par 2 couches de
poissons isolés. A partir de 15–16 heures les poissons se
dispersent graduellement, les 3 (2) couches se confondent
pour former une couche uniforme de poissons isolés qui monte
vers la surface de 17 à 18 heures, reflétant l'activité de
l'alimentation. Entre 18 et 19 heures cette couche se divise
en 2 couches une à la surface ou juste en dessous jusqu'à 10 m
et la 2ème couche à partir de 15 m avec une limite inférieure
variable.
Vers 5 heures les 2 couches forment une couche qui monte à la
surface. Entre 5 et 7 heures les bancs se forment et les
couches se profilent.
Pour la distribution de nuit les phases lunaires semblent
jouer un rôle. A la pleine lune la lère couche commence à
2–4 m en dessous de la surface pendant les autres phases
lunaires cette couche commence à la surface. La 2ème couche
s'étend de 15 à 35 m, avec une forte concentration de poissons
autour de 20 à 30 m à la pleine lune. A la nouvelle lune cette
couche est plus large, allant de 15 jusqu'à 55 m avec une
concentration autour de 35–40m.
Au dernier quartier la 2ème couche est semblable à celle trouvée
à la nouvelle lune dans la première moitié de la nuit et elle
devient étroite comme à la pleine lune dans la deuxième partie
de la nuit.
L'inverse se produit au premier quartier (FIG.29).
Chez les poissons pélagiques grégaires les individus de
même taille se rassemblent en bancs. La variabilité des
tailles individuelles y est petite chez les jeunes poissons et
y augmente pour les individus plus âgés.
Les regroupements en couches distinctes peuvent témoigner d'une
répartition différentielle pour des classes de taille.
L'analyse de l'intensité des échos (prospection février 1986:
Johannessons/Hood, 1987) ont révélé que des poissons de
taille inférieure se trouvent dans les couches profondes.
La composition de ces couches n'a pas pu être contrôlée par
une pêche expérimentale parce qu'un engin de pêche approprié
n'était pas disponible.
Cette répartition différentielle a des conséquences pour l'étude de ce poisson. Dans les bancs les cohortes sont masquées. “Du fait de l'étendue de la période de reproduction et de la variabilité de croissance individuelle, l'écart type de la distribution des fréquences de tailles d'une cohorte augmente pour les jeunes poissons dans la phase de croissance accélérée puis décroît pour les individus plus âgés. Dans les bancs c'est l'inverse qui se produit, l'écart type des distributions des fréquences de taille tend à augmenter avec la taille moyenne. Ainsi le banc peut rarement être représentatif d'une cohorte, les bancs de jeunes individus proviennent d'une ou parfois plusieurs fractions de cohorte, les bancs d'individus âgés proviennent de plusieurs cohortes” (Freon, 1984).
En conséquence pour l'étude de la structure de la population, de la croissance et des modèles de production structuraux la formation d'aggrégations entraîne des erreurs importantes.
Distribution zonale
Il semble que superposée à la répartition verticale, une répartition zonale différentielle existe.
Spliethoff et De Iongh (1981) ont indiqué que les juvéniles se trouvent au littoral, ceux de 10 à 35 mm LF près de la côte (zone littorale fond 0–20 m) les tailles de 30 – 60 m LF s'éloignent de la côte et restent en zone côtière (fond 20–60 m), les individus de taille supérieure à 60 mm LF migrent vers le large. Les adultes de taille supérieure à 110 mm vivent dans la zone côtière et littorale (FIG. 30).
Dans la frange littorale des individus de 90 à 135 mm ont été observés par Mutumba (1987) (FIG. 31).
En zone pélagique la présence d'adultes de taille de
78 à 108 mm a été confirmé par la pêche à l'aide de différents
engins de pêche (senne tourante, filet maillant,
filet soulevé (FIG. 37-38-39).
Par les observations écho-acoustiques on peut mettre en doute
que les individus de cette classe de taille se limitent à
la zone pélagique étant donné que les couches et les bancs
observés en zone pélagique se maintiennent sans interruption
et changement dans la zone intermédiaire (250–500 m) et la
zone littorale (<250 m) (FIG. 27).
Dans la frange strictement littorale (fond 0–70 m) les sardines se confondent avec les poissons benthiques, ainsi aucune conclusion ne peut être tirée.
Les individus de taille 63 à 78 mm LF, ne sont pas ou
peu présents dans les captures avec les différents engins de
pêche (FIG. 37-38-39).
Probablement cette classe de taille reste en profondeur comme
déjà indiqué par analyse des échos. La couche profonde est
observée dans les 3 zones, ainsi cette classe de taille inférieure
doit se trouver également dans les 3 zones.
Les juvéniles de taille 30–60mm LF sont principalement
littoraux, mais cette situation n'est pas permanente.
Pendant la période de ponte maximale, durant la période de
décembre à mai les juvéniles envahissent la zone intermédiaire
et pélagique. Durant cette période en 1986 un grand nombre
d'unités ont apporté des captures avec des quantités considérables
de juvéniles.
Les expériences de pêche dans les différentes zones ont démontré
la présence de juvéniles aussi bien dans la zone intermédiaire
que dans la zone pélagique (FIG. 32).
En décembre et janvier les juvéniles de 42–66 mm se trouvent
dans les 3 zones.
De février à mai les juvéniles de 51–63 mm sont pêchés dans
la zone intermédiaire et pélagique. En juin les juvéniles
se trouvent seulement en zone littorale.
Egalement les jeunes en maturation de taille de 63–78 mm LF
sont observés dans les 3 zones à partir de février.
Sans doute des grandes densités de juvéniles provoquent des
migrations vers le large.
3.3. Exploitation
Les techniques de pêche
Les unités artisanales
La technique utilisée pour la pêche du Limnothrissa est la pêche au filet soulevé à bord de catamarans avec l'attraction lumineuse. La surface de bouche est de 180 m2 et la profondeur de 15 m, les mailles de 10 et 12 mm étirée.
Techniques introduites à titre expérimental
En octobre 1981 la pêche à la senne tour nante et coulissante a démarréavec le bateau de pêche Isambaza FAO 90 avec un moteur de 50ch. Les caractéristiques du filet sont les suivantes : longueur de 180 m, profondeur 51,5 m, mailles étirées de 10 mm. En 1985 le filet a été modifié : longueur 300 m, profondeur 95, mailles étirées de 15 mm et la poche en 10 mm. Egalement une pirogue en planche avec un moteur hors-bord de 40 ch. a été dotée d'une senne tournante et coulissante de 200 m de longueur, 75 m de profondeur, à mailles étirées de 15 mm.
Egalement des essais avec un filet maillant et dérivant en monofilament de 260 × 60 m, à mailles étirées de 18 mm, ont eu lieu depuis février 1987.
Dans le cadre d'une amélioration de la performance de pêche des unités artisanales, un trimaran équipé d'un filet soulevé avec 400 m2 la surface de bouche, 24m de profondeur a été mis en essai par le projet en juin 1986, ainsi qu'un catamaran avec les pirogues plus distanciées, équipé d'un filet soulevé avec 350 m2 la surface de bouche et une profondeur de 17 m en octobre 1986.
Nombre d'unités au projet
Actuellement le projet comprend 3 centres de pêche, le centre principal à Gisenyi et 2 sous-centres à Kibuye et à Cyangugu.
Le centre de Gisenyi a démarré en novembre 1979 avec une unité, au cours des années le nombre a augmenté progressivement, en 1986 il y avait 30 unités (TABLEAU 7).
Le sous-centre de Kibuye a démarré avec 2 catamarans en novembre 1981 et en 1986 la flotille consistait en 8 unités.
Le sous-centre de Cyangugu a démarré avec 2 unités en janvier 1985. Ce nombre est maintenu en 1986.
Distribution géographique de la flotille
La zone de pêche de Gisenyi
Cette zone s'étend du centre jusqu'à l'embouchure de la rivière Koko située à environ 32 km au sud de Gisenyi.
Actuellement 20 lieux de pêche ont été localisés (FIG. 33 ANNEXE I).
Les lieux préférés sont Douanes, Gaz Méthane et Gahondo. Ainsi les déplacements vers le sud ne dépassent pas en général 8 km et vers l'Ouest l'écart de la côte ne dépasse pas 6 km (TABLEAU 8).
Zone de pêche de Kibuye
Cette zone s'étend de Koko, le lieu de pêche au Nord à
8 km du centre, jusqu'à la baie de Mugonero à 12,5 km
au Sud du centre.
Actuellement 24 lieux de pêche ont été localisés, dont 14 se
trouvent au Nord du centre et 10 lieux au Sud (FIG. 34-ANNEXEII).
Les lieux préférés sont Nyamunini, Kigezi, Mpangara,
Ruganda, Cyangwe, Rusenyi et Mpembe.
En moyenne les déplacements maximaux alors ne dépassent pas
10 km (TABLEAU 8).
Dans cette zone la côte est très découpée avec des baies profondes et de nombreuses îles, offront des sites abrités du vent.
La zone de pêche de Cyangugu
Cette zone ne dépasse pas la limite du Bassin de Bukavu, elle s'étend de Cyangugu à l'extrême Sud jusqu'à Mukoma à 18 km au Nord-Est du centre et l'île Bindia à 15 km au Nord-Ouest du Centre.
Actuellement 22 lieux de pêche ont été identifiés (FIG. 35 ANNEXE III).
Les lieux les plus fréquentés sont Mwito, Gihaya, Muhali et Muhumba (TABLEAU 8).
Ainsi les déplacements atteignent régulièrement 12 km. Le Bassin de Bukavu, étant très étroit, 6,5 km environ, les pêcheurs opèrent à moins de 2 km de la côte.
Production
La production totale des unités artisanales des 3 centres augmente graduellement d'année en année, à la suite d'une part d'une augmentation du nombre d'unités et d'autre part d'une augmentation du nombre moyen de sorties par unité (TABLEAU 6 et 7) excepté pour 1986 à Gisenyi et Kibuye.
Les moyennes annuelles des prises par unité d'effort par contre n'augmentent pas graduellement, mais démontrent des variations irrégulières qui reflètent des fluctuations annuelles dans la densité de la population (TABLEAU 7).
Les PUE diffèrent dans les 3 secteurs géographiques. La très faible valeur à Cyangugu dans le Bassin de Bukavu est l'indice d'une faible densité du stock, ce qui a été démontré par les observations écho-acoustiques (voir 3.4. Estimation de la biomasse).
Kibuye, dans le Bassin Est présente des PUE légèrement supérieures par rapport à Gisenyi, laissant entrevoir une densité de stock plus élevée. Les observations écho-acoustiques indiquent à certaines périodes une biomasse plus importante dans le Bassin Est, à d'autres moments c'est le contraire. Une pêche plus performante grâce à des sites abrités peut être en cause également.
Durant l'année des variations saisonnières dans la PUE se manifestent (FIG. 36).
Les valeurs les plus élevées pour le secteur de Gisenyi, sont observées de janvier à mai, une période secondaire de bonne production se manifeste d'août à octobre.
A Cyangugu la période de haute production va d'octobre
à avril avec des maxima de février à avril.
Les périodes coïncident avec les saisons de pluie et par
conséquent avec les périodes de reproduction. Les maxima
se situent dans la phase de recrutement au stock, avec des
niveaux de densité du stock maximale.
Egalement les meilleures conditions de temps contribuent à une hausse des prises.
Les maxima observées en saison sèche reflètent une baisse de la biomasse mais également des performances diminuées dues au mauvais temps par vents très forts et aux migrations en dehors des zones de pêche.
A Kibuye des valeurs élevées de la PUE se manifestent de décembre à juillet, avec des maxima en janvier et juillet. L'occurence des hautes valeurs en saison sèche est contradictoire aux fluctuations ailleurs dans le lac. Des migrations du poisson vers des lieux abrités peuvent être en cause, ce qui n'est toutefois pas confirmé par une biomasse plus élevée dans cette zone (juin '85).
En 1986 la production à Gisenyi et Kibuye a été plus
faible qu'en 1985 malgré le même nombre d'unités.
La PUE a fortement diminué et de plus une diminution du
nombre moyen de sorties a eu lieu.
Une partie de cette baisse peut être attribuée à la
vente de poisson sur les marchés locaux par les pêcheurs
avant les débarquements enregistrés au centre, ce qui a
biaisé les données de production au projet.
Depuis 1980 déjà une activité commerciale de petite ampleur
de la part des pêcheurs à l'issu du projet a été constatée.
Depuis 1986, un absentéisme accrû (baisse du nombre de
sorties enregistrée) a indiqué que la vente sur les mar chés
locaux prend de l'importance.
Des observations faites de décembre à mars '87 sur le terrain indiquent des quantités allant de 6 à 20kg/unité vendues avant l'enregistrement des captures, ce qui a entraîné une sous-estimation de la PUE (DIQUELOU, 1987).
Néanmoins une diminution de la biomasse n'est pas à exclure, étant donné que les caractéristiques biologiques indiquent des conditions moins favorables en 1986.
Chez le Limnothrissa, par son cycle de vie très court, la population est très instable et subit des fortes fluctuations de densité. D'autre part à cause de son potentiel de productivité très élevé la population peut se rétablir très vite après des conditions temporairement défavorables.
En 1986, le trimaran (PUE de 93,6 kg) et le catamaran
agrandi (PUE de 42,1 kg) présentent des PUE plus élevées,
suite à l'agrandissement de l'ouverture de bouche.
Des essais au filet maillant dérivant ont donné une capture
maximale de 212 kg par nuit.
La senne tournante du bateau Isambaza présente des PUE allant de 275,3 kg (1981) à 594,3 kg (1982), le minimum obtenu est de 180,5 kg en 1985. La moyenne pour la période 1981–1984 est de 388,8 kg.
Sélectivité de la pêche
La distribution des fréquences de taille des poissons est
quasiment identique chaque mois au cours de 1985 et 1986
dans les captures de la pêche artisanale à Gisenyi et à
Kibuye (FIG. 37). La structure de taille est principalement
unimodale, à certains moments bimodale et très rarement
trimodale.
La taille modale de la distribution est la même chaque
mois. Le groupe de taille de 87 à 102 est dominant chaque
mois, avec la taille modale de 91,5 ou 94,5 mm LF.
De janvier à mai 1986 un deuxième groupe de taille 42–63 mm
est présent et même parfois dominant (taille modale 43,5 ou
46,5 mm).
En 1979–1980 (Mahy, 1980) la structure de taille des
captures est principalement bimodale (FIG. 38).
Les juvéniles de 35–70 mm LF avec la taille modale de
52,5 mm sont souvent dominants sur le groupe de 90–110 mm LF.
Cette distribution indique que les pêcheurs ont opéré dans la zone littorale et intermédiaire, par rapport à 1985–1986 où toutes les zones sont fréquentées.
Mais pour les 2 périodes, les individus de tailles intermédiaires, de 63–87 mm LF sont sous-représentés.
La structure de taille des captures de la senne tournante
et du filet maillant dérivant en zone pélagique
est bimodale avec la dominance du groupe de 87 à 108 mm
mais le 2ème groupe 78–87 mm LF est bien représenté également
(FIG.39).
La présence des juvéniles dans la pêche artisanale indique
que la sélectivité de la pêche ne se situe pas au niveau
du maillage du filet, mais elle est causée d'une part par la
répartition différentielle des individus de différentes
tailles (individus de taille 63–78 m se trouvant en profondeur).
Un autre facteur de comportement peut intervenir, une
différente réaction sur l'attraction limineuse.
La présence de toujours les mêmes tailles modales dans la
distribution des fréquences démontre que la sélectivité
joue au niveau des bancs, ainsi les cohortes n'apparaissent pas.
3.4. Estimation de la biomasse
Estimation par observation écho-acoustique
En novembre 1984, Johannesson a évalué la biomasse à
3046 tonnes soit 22,9 kg/ha pour la partie rwandaise du
lac, pour une surface de 388 m2 (1331,5 km2) (TABLEAU 9–10).
Des évaluations en mars et juin 1985 dans la partie rwandaise
sur une surface de 1275 km2 ont donné respectivement 2386 t
(18,7 kg/ha) et 2847 t (22,3 kg/ha) TABLEAU 11–12).
En février 1986 la valeur pour une surface d'environ
1180,2 km2 est de 4050 t (34,3 kg/ha) Johannesson 1987).
Des observations sur l'ensemble du lac, le territoire zaïrois et 2631t (31,3kg/ha) soit 43% au Rwanda (TABLEAU 13).
En mars la valeur est de 7870 t (40,7 kg/ha dont 4721t (42,0 kg/ha) soit 60% au Zaïre et 3148 t (39,0 kg/ha) soit 40% au Rwanda (TABLEAU 14).
Un niveau plus élevé de la biomasse en mars est sans doute causé par une augmentation de la population due au recrutement accrû. La valeur calculée en territoire rwandais est en novembre 1984 comparable à celle de septembre 1986 et celle de février comparable à celle de mars 1987.
En mars 1985 une augmentation de la biomasse n'est pas
constatée. La faible valeur est en contradiction avec les
niveaux élevés des captures (PUE = 54,8 kg à Gisenyi et
PUE = 66,1 kg à Kibuye).
La valeur en juin 1985 est au niveau de septembre et novembre,
une baisse de la biomasse est possible en période de stratification.
En couvrant qu'une partie du lac, une sous-estimation de la biomasse peut survenir à cause des migrations temporaires vers la zone littorale et/ou vers la partie non prospectée. Pour toutes les prospections la zone littorale n'a pas été couverte. Il s'agit d'une surface de 333 km2 soit 14% de la surface totale.
Estimation de la biomasse par des variables biotiques
Index morpho-édaphique MEI (Ryder et al-Henderson & Welcomme, 1974).
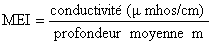
Pour le lac Kivu au lieu d'employer la profondeur moyenne, on prend la profondeur de la couche oxygénée, soit 70 m
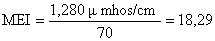
Selon la formule pour la production potentielle (Henderson & Welcomme) FY = 14,3136 MEI 0,4681, nous obtenons la valeur de 55,79 kg/ha
Pour la surface totale du plan d'eau 2370 km2, la production
totale est de 13.200 t et pour la partie rwandaise de 5580 t
(1000 km2).
Selon la formule pour les captures potentielles en tonnes/an/pêcheur-unité (Henderson & Welcomme) fy = 0,7779 MEI
0,3775 la valeur est de 2,3 t/an/unité.
Le nombre optimal d'unités pour les lacs africains est de
1,5 km2.
Pour la totalité du lac, cela donne 3555 unités et pour la
Rwanda 1.500.
La productivité potentielle totale est alors de 8177 t et de
3450t pour les eaux rwandaises.
Estimation basée sur la biomasse du zooplancton (Reyntjens 1980)
Le potentiel est de 55 kg/ha, donnant une production
totale de 13.000 tonnes pour l'ensemble du lac et de
5500 tonnes pour la partie rwandaise.
Se basant sur le modèle de Kerr la biomasse en poisson
a été évaluée à partir de la biomasse du zooplancton et les
captures potentielles ont été calculées avec le modèle
de Gulland.
La distribution géographique de la biomasse
On constate des différences dans la biomasse entre les secteurs géographiques (FIG. 40–44) (TABLEAU 11, 12, 13, 14,16).
Pour toutes les observations la valeur la plus faible est
constatée pour la Bassin de Bukavu, 17,3 kg/ha (novembre 1984),
12,2 kg/ha (mars 1985), 23,4 kg/ha (septembre 1986) et
29,5 kg/ha (mars 1987).
La productivité plus faible du Bassin de Bukavu est confirmée
par les niveaux bas de la PUE enregistrés au centre de pêche
en 1985 et 1986.
Ainsi les densités élevées de zooplancton comparables et même
supérieures aux niveaux du zooplancton dans les autres parties
du lac ne soutiennent pas une biomasse importante du poisson.
A cet effet, la turbidité des eaux provoquée par des particules
inertes en suspension présente peut être un facteur défavorable
pour le Limnothrissa.
Dans les autres secteurs une corrélation positive entre
l'abondance du zooplancton et celle du poisson a souvent été
retrouvée, (en septembre et mars pour le Bassin Nord et
Central et pour les parties Est et Ouest (Zaïre).