Le tamarugo appartient à l'ordre des légumineuses, famille des mimosacées. Il s'agit d'une espèce autochtone, peu connue dont on ignore les étapes successives de l'apparition et de la dispersion. On a estimé à quatre cents ans environ l'âge de sujets se trouvant dans le secteur de la Tirana (Muñoz Pizarro, 1965).
Le tamarugo atteint en moyenne 15 m de hauteur, 0,50 à 0,80 m de diamètre du tronc, 15 à 20 m de diamètre de la cime. Les jeunes rameaux sont fins et anguleux, pourvus d'épines à base large, longues de 3 cm environ. Les feuilles composées bipennées sont courtes, glabres, se détachant facilement, à 15 paires de folioles de 5 mm de long. Inflorescences en épi; fleurs parfaites, actinomorphes, hermaphrodites; calice gamosépale et corolle gamopétale bien différenciés; cinq sépales fusionnés, formant un capuchon pubescent à la base, s'amincissant vers le sommet; cinq pétales jaunes, pubescents seulement dans la partie médiane, avec de longues villosités sur leur face interne; androcée à dix filets staminaux courts ou longs, de couleur vive, à anthère versatile; gynécée à style long ou court; ovaire unicarpellaire, entouré et protégé par plusieurs villosités blanches. La hauteur des étamines peut dépasser celle du pistil, l'égaler ou n'être qu'une partie de celle-ci. Le fruit est une gousse épaisse et courte, de 25 mm, ayant la forme d'une gousse d'arachide. Les graines sont petites, de couleur foncée, comprimées, séparées par des cloisons.
Les fleurs de tamarugo sont pollinisées par des insectes de l'ordre des hyménoptères tels que Centrix mixta et l'abeille commune Apis mellifera, qui sont ses principaux agents pollinisateurs, leur période d'activité maximale se situant entre début septembre et novembre.
La croissance de l'arbre se poursuit pendant toute l'année; elle est maximale entre août et novembre, c'est-à-dire à la période de pleine floraison, et minimale entre mars et juillet. Cependant, Acevedo (1970) a observé une période de repos hivernal correspondant à un arrêt de la sève.
Le tamarugo possède un double système radiculaire: i) un système pivotant ou d'ancrage, formé de 3 ou 4 grosses racines non ramifiées, qui atteignent, dans des sols de terre franche, une profondeur maximale de 7 à 8 m; ii) une masse ou ensemble de racines absorbantes, qui se développe et ne s'enfonce pas au-delà de 1,50 m. Ces dernières présentent, dans toute la projection de leur volume, une humidité qui atteint facilement 40%, selon des mesures relevées dans le secteur de Refresco en septembre 1966 et janvier 1967, sur des arbres âgés de 30 ans prospérant dans un sol dont la nappe phréatique était à 13 mètres de profondeur (Toro, 1967).

Sujet naturel de tamarugo dans la Pampa del Tamarugal, secteur de La Tirana. On peut observer la hauteur de l'arbre par rapport aux personnes se trouvant à l'extrême droite. (Photo Mario Habit).

Vue panoramique de la localité de Refresco dans la saline de Pintados, Pampa del Tamarugal. Plantation artificielle de tamarugos plantés en rideaux brise-vent pour les plantations futures.
En l'état actuel des connaissances, il est pratiquement impossible d'évaluer la longueur de la période productive du tamarugo. On sait qu'elle débute entre la 7ème et la 8ème année suivant la plantation, mais on en ignore la durée. Les sujets existant dans la Pampa permettent cependant de penser que cette production se poursuit pendant de nombreuses années; l'expérience dont on dispose est suffisante pour affirmer que la vie utile du tamarugo est assez longue pour amortir un programme d'investissement.
En 1968 on s'est livré à des études visant à établir la relation entre la croissance du tamarugo et les variables contrôlées telles que l'âge, l'espacement de plantation, et la profondeur de la nappe phréatique (Instituto Forestal, 1971).
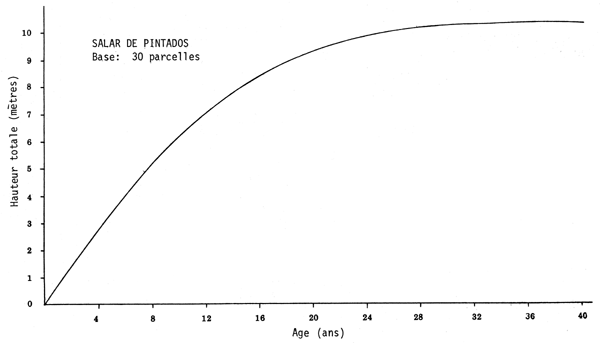
Pour faire cette analyse on a construit des courbes exprimant les paramètres mesurés (hauteur totale, diamètre de la cime) en fonction des variables connues, âge et espacement. La relation âge-hauteur est asymptotique; au cours des 24 premières années la croissance est active, et l'arbre atteint une hauteur moyenne de 10 mètres, qui n'augmente pas de manière significative à l'âge de 40 ans (voir graphique page suivante).
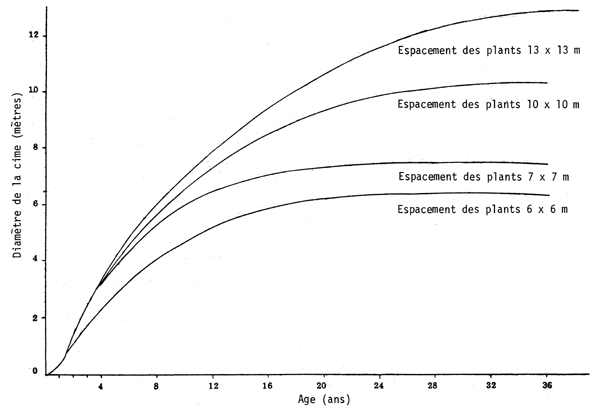
En ce qui concerne la relation entre le diamètre de la cime, l'espacement et l'âge de la plantation, on constate qu'avec les écartements les plus forts, 13 × 13 m, les arbres atteignent à l'âge de 36 ans un diamètre de cime moyen de 12 mètres, tandis que dans les plantations de même âge à 6 × 6 m ce diamètre n'est que de 6,50 mètres (voir graphique page 26).
L'analyse des variations de la hauteur en fonction de la profondeur de la nappe phréatique et de sa salinité permet de conclure qu'il n'existe aucune tendance dans un sens ou dans l'autre. Néanmoins, il n'est pas encore possible d'affirmer qu'il n'existe pas une telle relation, vu que dans toutes les essences forestières la hauteur est incontestablement l'un des paramètres le plus étroitement liés aux facteurs édaphiques.
RELATION AGE-HAUTEUR TOTALE DE PROSOPIS TAMARUGO
RELATION AGE-DIAMETRE DE LA CIME EN FONCTION DE L'ESPLACEMENT DES PLANTS DE PROSOPIS TAMARUGO
De nombreuses expériences de laboratoire avec des cultures en solutions nutritives ont démontré la relation étroite entre la croissance et la pression osmotique de la solution (Instituto Forestal, 1971). Il en ressortirait que les solutions salines, en raison de leur concentration en substances solubles, inhibent la croissance.
Il s'y ajoute un autre facteur, à savoir le déficit hydrique du sol, qui peut entraîner une diminution de l'absorption de l'eau par les racines, et par conséquent le ralentissement ou la régulation de la croissance. La tension de l'eau du profil du sol est en rapport étroit avec la profondeur de la nappe phréatique.
La croissance de la cime du tamarugo, qui détermine le rendement en feuilles et en fruits, est en relation directe avec les espacements initiaux, qui sont de 6 m × 6 m, 7 m × 7 m, 10 m × 10 m et 13 m × 13 m. Par conséquent, si l'on connaît le rythme de croissance de la cime en fonction des variables analysées, on pourra déterminer la rapidité avec laquelle une superficie plantée sera entièrement couverte, selon la densité initiale de plantation.
La productivité du tamarugo dépend de l'âge, de l'espacement de plantation, de la profondeur et de la qualité de l'eau de la nappe phréatique; elle est aussi influencée par la conduite des plantations dans le jeune âge, ainsi que, dans une large mesure, par les attaques d'insectes et les traitements appliqués.
La fructification se produit uniformément dans la cime de l'arbre; les fruits en tombant se répartissent à terre avec une densité maximale sur la projection de la cime.
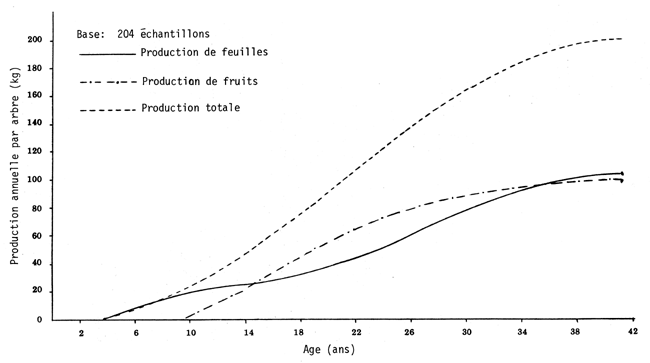
Il semble que les rendements ne varient pas beaucoup. Ainsi, Oyarzún (1967) rapporte les résultats d'un contrôle effectué in 1957 sur 19 arbres, donnant un poids moyen de 2,10 kg de fruits par métre carré de projection de la cime; de même, on a observé sur des arbres âgés de 30 ans un rendement moyen de 3,40 kg de matière sèche (fruits et feuilles mortes) par mètre carré de cime, ce rendement étant de 1,80 kg/m2 sur des arbres âgés de 18 ans (Instituto Forestal, 1964). (Voir graphique page suivante).
On estime que le poids de fourrage produit par mètre carré de projection de la cime est constitué pour 50% par les fruits, et 50% par les feuilles sèches.
RELATION AGE-PRODUCTION FOURRAGERE DE PROSOPIS TAMARUGO
Le tamarugo est un arbre qui fait preuve d'une très grande plasticité physiologique, lui permettant de se développer dans des conditions qui seraient mortelles pour tout autre végétal. L'humidité nocturne due au brouillard, à la rosée et à l'humidité relative se caractérise par ses fluctuations aussi bien que par son niveau élevé. Avec d'autres espèces, on a pu établir par exemple qu'une rosée artificielle appliquée pendant la nuit à de jeunes plants de Pinus insigne prolongeait leur vie de 45 jours bien qu'ils fussent installés dans un sol sec.
Bien que l'on connaisse l'existence d'un phénomène d'absorption, divers chercheurs affirment qu'elle ne serait pas vitale pour la plante, et que sa fonction serait plutôt d'atténuer la transpiration des tissus, en constituant une couche humide protectrice à la surface des feuilles (Slatyer, 1967).
Dans des essais effectués sur Phaseolus vulgaris avec comme marqueur HHO18, on a observé une substitution rapide à l'eau intracellulaire de molécules d'eau atmosphérique, qui se produisait non seulement dans les tiges et les feuilles, mais également au niveau cellulaire des tissus (Vartepetyan et Kursanov, 1962). Cette observation tend à démontrer que dans certaines conditions il y a inversion du flux d'eau de la racine vers les feuilles dans le végétal, qui capte l'eau atmosphérique par l'intermédiaire de sa surface foliaire et la transportevers les tissus radiculaires, pour être éliminée par différence de potentiel dans l'exsudation moléculaire. Néanmoins, d'après certains chercheurs, cette exsudation d'eau dans le sol serait peu importante et ne servirait qu'à prolonger pendant un certain temps la vie de quelques plantes en périodes de grande sécheresse (Muller-Stoll, 1965; Stone et al., 1950; Kramer, 1959; Polster, 1963; Slatyer, 1967). Des recherches effectuées en laboratoire, puis dans des zones arides et semi-arides, donnent cependant à penser qu'il pourrait y avoir accumulation d'eau dépassant le niveau correspondant à la capacité de rétention minimale (Breazeale et al., 150; Breazeale, 1953 a, 1953b; Gindel, 1966).
Les expériences menées dans la Pampa del Tamarugal ont démontré que l'irrigation foliaire était efficace pour prolonger la vie de jeune plants de tamarugo. En soumettant de jeunes plants en conditions de laboratoire, et de jeunes arbres sur le terrain, à des traitements avec de l'eau marquée au tritium, on a pu établir un transport actif d'eau atmosphérique, qui s'accumule dans la rhizosphère, c'est-à-dire dans la masse de racines absorbantes (Sudzuki, 1969).

Fruits (gousses) de tamarugo. Sur la photo du bas, fourrage composé de fruits et de “foin de feuilles”.
Des observations sur l'irrigation foliaire de jeunes plants de tamarugo réalisées par Sudzuki (1969) en conditions en laboratoire ont montré qu'ils résistaient très bien à un déficit hydrique. De l'examen des résultats obtenus, il ressort que les plants qui présentent la plus faible perte de poids journalière sont ceux qui ont reçu une irrigation foliaire (tableau 6), ce qui laisse penser que les feuilles du tamarugo possèdent la faculté d'utiliser l'eau de l'atmosphère, et éventuellement de compenser ainsi en partie les pertes dues à l'évaporation et à la transpiration.
TABLEAU 6: Perte de poids journalière moyenne (en grammes) de jeunes plants de tamarugo, comparée à celle de pots sans plants avec apport d'eau, d'un pot scellé, et d'un bac empli d'eau
| Plants | Pots sans plants | Bac empli d'eau | |||
| Irrigation foliaire | Irrigation du sol | Sans arrosage | Avec apport de 100 g d'eau | Pot scellé | 100 g |
| 0,96 | 4,95 | 3,1 | 4,15 | 0 | 5 |
Par la suite, Sudzuki s'est attaché à étudier l'absorption foliaire et les conditions nécessaires pour que se produise cette absorption, et à déterminer si l'eau absorbée était susceptible de circuler à travers les tissus et atteindre les racines, et si calles-ci pouvaient exsuder l'excédent d'eau dans le sol au niveau des racines absorbantes. A Refresco et Canchones, dans la Pampa del Tamarugal, on a employé des plants de tamarugo en sachets de polyéthylène qui étaient fermés à hauteur du collet des plants, avec 5 témoins et 5 traitements. On s'est servi de tritium pour marquer l'eau, en adoptant une dose de radioactivité de 4 μCi/ml; pour appliquer le tritium on a placé les plants sous une tente de polyéthylène, et procédé à des pulvérisations nocturnes avec un atomiseur jusqu'à saturer l'atmosphère ambiante. Le lendemain, on a enlevé la tente et extrait le marqueur à l'aide d'une pompe à vide munie d'un condenseur à double paroi, dans lequel on avait mis de l'azote liquide pour faciliter l'obtention du vide. Pour la détermination du tritium, on a utilisé du dioxane comme diluant de base et du naphtalène comme diluant secondaire dans la solution de liquide scintillant. L'activité spécifique a été établie à l'aide d'un compteur à scintillateur liquide pendant 10 minutes.

L'eau constitute pour les animaux comme pour les tamarugos le principal élément biologique qui rend possible le fonctionnement de l'écosystème.
D'après ces mesures les applications de marqueur faites pendant la nuit donnaient des résultats positifs, et l'on obtenait une certaine radioactivité dans la terre de plants maintenus le jour dans une atmosphère contenant du tritium; il a fallu répéter l'opération pendant 3 ou 4 jours, avec plusieurs applications journalières de tritium. Les résultats concordent avec ce qu'affirment certains chercheurs (Slatyer, 1967; Stone et al., 1950) au sujet des conditions dans lesquelles s'effectue l'absorption foliaire. Le fait de detecter une radioactivité significative de 0,05% avec une seule application démontre que le radioisotope circule avec une certaine rapidité à travers les tissus de la plante jusqu'à atteindre la zone des racines absorbantes, ce qui est en accord avec les travaux de Vartepetyan et Kursanov (1962); les résultats obtenus par Sudzuki (1969) sont indiqués dans le tableau 7 qui compare les témoins et les plants traités avec l'indicateur radioactif.
TABLEAU 7: Radioactivité de l'extrait aqueux de la terre contenue dans les racines de jeunes plants de tamarugo soumis à pulvérisations pendant une nuit sous une tente de polyéthylène, en comparaison avec le témoin (Pampa del Tamarugal, 1968)
| Témoin c.p.m. | B.G. c.p.m. | Traitement 4 μCi/ml c.p.m. |
| 215 | 249 | 956 + |
| 233 | 238 | 1 080 + |
| 244 | 673 + | |
| 251 | 1 264 + | |
| 125 | 504 + |
En bref, Sudzuki conclut que cette espèce est capable d'absorber par les feuilles l'humidité atmosphérique et de la transporter jusqu'aux racines, qui l'exsudent goutte à goutte dans le sol; en outre, la quantité d'eau absorbée par le feuillage dépend de l'heure à laquelle on a appliqué une humidité de saturation, le maximum étant obtenu pendant la nuit, et par ailleurs la quantité et la rapidité avec laquelle l'eau marquée parvient au sol sont inversement proportionnelles à la taille de l'arbre, comme on peut le voir dans le tableau 8.
TABLEAU 8: Accumulation de radio-isotopes dans la rhizosphère de tamarugos âgés de 7–8 ans, avec pulvérisation d'eau marquée au tritium pendant la journée et pendant la nuit, dans les localités de Canchones et de Refresco (Sudzuki, 1969)
| CANCHONES | REFRESCO | ||||||||
| Traitement | Nombre de pulvérisations | Nombre de pulvérisations | |||||||
| 0 | 3 | 4 | 5 | BG | 0 | 3 | 4 | 5 | |
| Journée | 15,52 | 14,14 | 17,66 | 40,48 | 15,03 | 14,04 | 15,75 | 14,79 | 16,85 |
| 14,14 | 15,10 | 14,70 | 18,00 | 18,11 | 13,64 | 14,21 | 15,33 | 15,00 | |
| 15,68 | 14,14 | 15,68 | 20,54 | 15,58 | 13,86 | 16,19 | 18,81 | 15,08 | |
| 17,35 | 14,07 | 17,81 | 21,49 | 11,74 | 13,89 | 16,34 | 17,66 | 19,77 | |
| Moyenne | 15,67 | 14,36 | 16,42 | 25,13 | 15,11 | 13,86 | 15,62 | 16,65 | 16,66 |
| 14,69 | 14,87 | 16,91 | 28,76 | 14,14 | 17,97 | 18,68 | 81,46 | ||
| 14,63 | 17,92 | 16,25 | 65,99 | 15,13 | 18,41 | 16,37 | 75,99 | ||
| Nuit | 16,40 | 17,58 | 18,25 | 20,13 | 11,35 | 18,71 | 22,02 | 48,58 | |
| 15,00 | 15,10 | 17,18 | 137,15 | 14,32 | 18,03 | 17,86 | 63,52 | ||
| Moyenne | 15,18 | 16,36 | 17,14 | 64,01 | 13,74 | 18,28 | 18,74 | 66,39 | |
Pastene (1972) confirme que l'absorption foliaire est un fait établi, et que dans le cas du tamarugo elle est suffisamment importante pour permettre une accumulation d'eau dans le sol en contact avec les racines; il pose par ailleurs la question de savoir dans quelle mesure cette absorption est essentielle pour l'arbre. Répétant les expériences réalisées par Sudzuki à Santiago en 1966, cet auteur a augmenté sensiblement la taille de l'échantillon dans la Pampa del Tamarugal, et introduit quelques variantes méthodologiques; employant des plants de taille différente pour les deux études qu'il a faites en l'espace de 55 jours, il conclut que les plants ont la capacité de capter l'eau de l'atmosphére et signale que les plants soumis à l'irrigation foliaire ont montré un processus d'adaptation se traduisant par un accroissement de la surface foliaire, dont l'effet visible était un ralentissement de la croissance en hauteur et un accroissement du nombre de pousses. Il fait observer cependant que la capacité d'absorption foliaire n'est pas constante, mais dépend beaucoup de la plus ou moins grande humidité du sol, de l'humidité de l'air, de la température et d'autres facteurs qui réagissent les uns sur les autres. Il semble que les plants de tamarugo laissés sans arrosage plus ou moins longtemps accélèrent leur processus d'absorption foliaire pour capter le plus d'eau possible pendant les jours de forte humidité et l'emmagasiner dans le sol comme réserve pour les périodes de faible humidité; qui plus est, l'exsudation, ou passage de l'eau dans le sol, est parfois si importante que l'humidité du sol excède la capacité de rétention minimale (voir illustration p. 35).
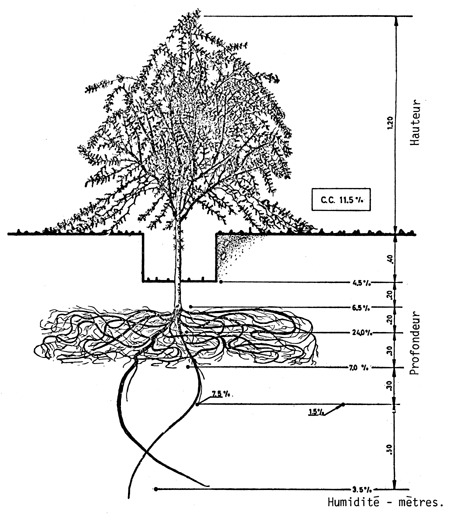
Tamarugo de 2–3 ans à Refresco, Pampa del Tamarugal. Pourcentage d'humidité du sol à différentes profondeurs (d'après Sudzuki, 1969).
La notion de xérophytie a été vue surtout sous l'angle de la morphophysiologie, c'est-à-dire de l'explication des mécanismes dont dispose la plante pour emmagasiner l'eau ou éviter les pertes, ou encore pour échapper aux périodes de déficit hydrique. De nombreux auteurs appellent ce phénomène résistance à la sécheresse. Cette caractéristique s'explique physiologiquement par l'intervention de divers processus: i) modification du quotient respiratoire, influant sur l'inhibition normale de la conversion d'amidon en sucre; ii) altération des protéines; iii) concentration dans les cellules de colloïdes hydrophiles, qui limitent les pertes; iv) rapidité plus ou moins grande avec laquelle certaines plantes atteignent le point de flétrissement permanent; v) pression de turgescence au niveau cellulaire, qui jouerait un rôle critique dans la croissance cellulaire; vi) ajustement osmotique au niveau cellulaire, agissant comme mécanisme d'adaptation en cas de déficit hydrique; vii) modifications dans le flux énergétique; viii) différence de potentiel dans l'ionisation des métabolites et stabilisation des membranes vivantes, agents responsables du maintien de la turgescence cellulaire; ix) accommodation génotypique de la réponse au milieu des espèces, et des variétés et écotypes.
Levitt (1956) classe les plantes du point de vue de leur résistance à la sécheresse en faisant intervenir deux aspects: i) présence d'un mécanisme quelconque qui permet aux plantes de mieux faire face aux périodes critiques; ii) aptitude à augmenter la capacité du métabolisme cellulaire. Sudzuki (1975) y ajoute un troisième facteur, à savoir le mécanisme grâce auquel les plantes peuvent utiliser l'humidité atmosphérique, ce qui l'amène à examiner la forme et les processus selon lesquels certaines plantes exploitent cette importante source d'eau. C'est pourquoi le terme de résistance à la sécheresse, ou xérophytie, doit être pris dans un sens plus vaste qui inclut non seulement la manière dont les plantes retiennent l'eau, mais aussi dont elles l'obtiennent.
D'après les études de Sudzuki (1969), l'humidité dans le profil du sol est très variable; c'est ainsi que dans la localité de Refresco, on a observé que la quantité d'eau dans la rhizosphère des racines absorbantes excédait la capacité de rétention minimale, étant de 24% alors que celle-ci n'était que de 11,5%. Il semblerait donc que les racines absorbantes puissent accumuler une quantité d'eau exsudée supérieure à celle qu'il faudrait pour parvenir à un équilibre entre le déficit de diffusion de pression et les forces de rétention d'humidité du sol, et que par conséquent l'eau absorbée par les feuilles ne passerait pas des tissus du végétal dans le sol par l'effet d'un simple processus physique de succion de ce dernier, provoqué par le gradient négatif résultant de la sécheresse, et tendant à équilibrer le déficit de diffusion de pression et la force de rétention d'humidité du sol, mais qu'il interviendrait sans doute un autre processus encore inconnu, qui permettrait d'exsuder une plus grande quantité d'eau dans le sol.


Tamarugo âgé de 3 ans dans la saline de Pintados, domaine de Refresco (photo du haut). Vue générale d'un secteur du même domaine, prêt à être mis en exploitation. Arbres de 6–7 ans.
Sudzuki, Botti et Acevedo (1973) ont montré les relations hydriques du tamarugo, en étudiant des gradients de potentiels du système sol-plante-atmosphère et de certains facteurs physiologiques qui pourraient éclairer davantage le processus d'absorption foliaire. Acevedo (1977) a établi que le tamarugo présente une activité physiologique plus grande en été, avec une circulation de sève et une pousse actives; par contre, en hiver il serait apparemment à l'état de repos, sans mouvement de sève apparent, avec une pousse ralentie et une abondante chute de feuilles. Il a également constaté que le potentiel hydrique des feuilles du tamarugo oscillait entre -15 atm et -47 atm en été, et entre -24 atm et -80 atm pendant l'hiver. Cependant, au cours de la période d'observation (été et hiver 1973), on n'a pas relevé de potentiel hydrique atmosphérique susceptible de favoriser l'absorption foliaire.
En ce qui concerne le potentiel hydrique du sol, Acevedo (1977) rapporte que le plus faible potentiel hydrique total du sol, mesuré dans la zone des racines absorbantes, était d'environ -52 atm, ce qui en comparaison du potentiel hydrique de la plante de -32 atm observé en été créerait un gradient favorisant le passage de l'eau dans le sol. La turgescence relative mesurée dans les feuilles a donné des pourcentages très élevés et assez constants pendant toute la journée en été et en hiver, ce qui indiquerait que le tamarugo n'a pas de déficit hydrique dans la rhizosphère. Cet auteur a établi en outre que les stomates présentent un rythme inversé d'ouverture, c'est-à-dire qu'ils s'ouvrent de préférence pendant la période d'obscurité (nuit); ils ne sont jamais fermés ou ouverts à 100%. Les variations d'ouverture des stomates sont en rapport étroit avec le pourcentage d'humidité relative; plus élevé est ce dernier, plus grand est le pourcentage de stomates ouverts, comme on a pu l'établir clairement au printemps et en été.
Botti (1970) définit le régime hydrique du tamarugo en analysant les gradients de potentiel et certains aspects physiologiques de la plante qui influent sur le processus d'absorption de l'eau. Ainsi, opérant à Canchones, dans la Pampa del Tamarugal, il parvient aux conclusions suivantes: i) le gradient de potentiel hydrique est inversé, de l'atmosphère vers le sol, lorsque l'humidité relative de l'atmosphère est égale ou supérieure à 95%; ii) un pourcentage élevé de stomates restent ouverts pendant la période d'éclairement, et fermés pendant la période d'obscurité; iii) durant l'été le flux de sève descendant se poursuit la nuit pendant 4 à 8 heures, et le flux ascendant pendant le reste du temps; iv) la turgescence relative des feuilles présente une valeur très élevée (80–90%) et constante tout au long de la journée et de l'année, et on observe dans le plant de tamarugo un repos physiologique hivernal, phénomène se traduisant par une abondante chute de feuilles due à l'arrêt de la circulation de sève et de la pousse; v) le sol situé au voisinage de la rhizosphère active a une teneur en humidité (18,8%) supérieure à celle des autres zones de même profondeur, qui n'arrivent qu'à 1,5%.
1. Récolte des graines. On repère les arbres porte-graines en fonction de leurs caractéristiques phénotypiques. Après la récolte les fruits sont nettoyés mécaniquement, puis broyés dans un moulin en pierre avec un écartement de 4 mm; ensuite, par criblage et flottation, on obtient la semence propre. Pour prévenir les dégâts d'insectes, il faut traiter les graines avant emmagasinage avec de l'aldrine à 0,2%. Un kilogramme contient entre 65 000 et 75 000 graines. On traite les semences à l'acide sulfurique pendant 7 minutes, afin de détacher la cuticule et de faciliter les échanges gazeux et la pénétration de l'eau par le micropyle, seul orifice que possède la graine, ce qui entraîne la réhydratation des colloïdes et déclenche le processus de germination. On peut remplacer ce traitement par un scarifiage.
2. Pépinière. On prépare un mélange de terre et de fumier de mouton dans la proportion de 2:1, et on en emplit les sachets en plastique non perforés de 12 cm de diamètre et 30 cm de long, que l'on dispose sur des plate-bandes bien nivelées. On sème 3 à 5 graines par sachet, à une profondeur de 1,5 cm. En ce qui concerne l'arrosage, il importe essentiellement de maintenir humide la partie superficielle où se trouvent les semences sans provoquer d'accumulation d'eau, afin d'éviter les attaques de champignons. Préalablement au semis, il convient de traiter le sol avec un fongicide spécifique, ou avec un produit de fumigation comme le bromure de méthyle (CH3Br), afin d'éviter l'apparition d'agents pathogènes au début de la germination et aux premiers stades de développement des jeunes semis.
Une fois que les graines ont germé et que la plantule a émergé, on arrose plus abondamment mais moins souvent, afin de donner de l'humidité à la racine qui s'enfonce 9. Il importe de ne pas employer trop d'eau.

Tamarugo non élagués
Les plants restent en pépinière de 3 à 5 mois, jusqu'à ce que leur taille atteigne 8–10 cm. Le développement des racines étant rapide et vigoureux, il faut éviter qu'elles ne traversent ou ne déchirent le sachet de plastique (Lanino, 1972).
3. Plantation. Les plantations ont été faites en blocs de 1 km2, soit 100 hectares, à écartements de 10 × 10 m et 15 × 15 m, au carré et en quinconce.
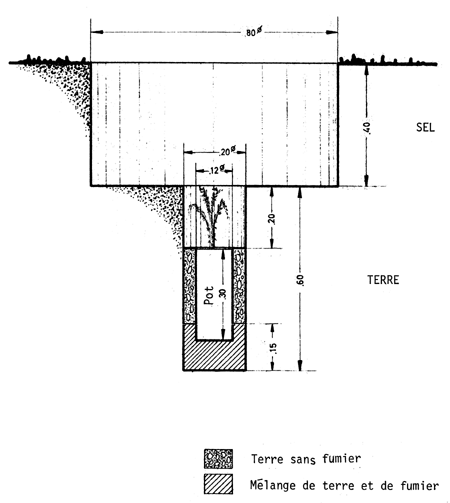
Les trous de plantation, d'environ 30 cm de diamètre sur 40 à 50 cm de profondeur, se font à la main ou mécaniquement. Dans le premier cas, ils peuvent avoir un diamètre plus grand en raison de l'enlèvement de la croûte saline superficielle; dans le second cas, l'opération s'effectue au moyen d'un tracteur à chenilles à lame frontale d'un modèle spécial, qui ouvre une sorte de tranchée de 80 cm de large sur 1 m de long à la base. Cette opération permet d'atteindre la couche arable ou “sol tendre”, comme on l'appelle également. La profondeur de cette cuvette, qui a en général 80 cm de diamètre, dépend du terrain et de l'épaisseur de la couche saline qu'il faut dépasser avant de faire le trou de plantation proprement dit, après avoir découvert le sol. Ce trou a 30 cm de profondeur sur 20 cm du diamètre; il est pratiqué à la main ou au moyen d'une tarrière actionnée mécaniquement.
Avant de planter on sature d'eau le trou de plantation pour l'humidifier le plus profondément possible.
4. Arrosage. Pour que les plants s'installent normalement, il faut les arroser de manière que l'eau pénètre jusqu'au niveau des racines et y entretienne l'humidité. Le nombre d'arrosages d'installation des plants varie considérablement selon les conditions de la nappe phréatique et la profondeur de l'humidité (Lamagdelaine, 1972); on peut admettre qu'il est de 11 en moyenne. La reprise des plants se manifeste par l'émission de nouvelles pousses; on peut alors n'arroser que tous les 20 jours (Lanino, 1972).
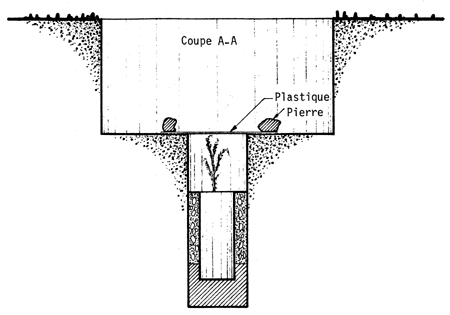
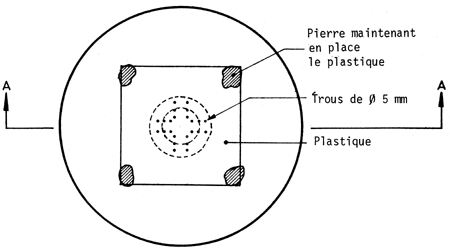
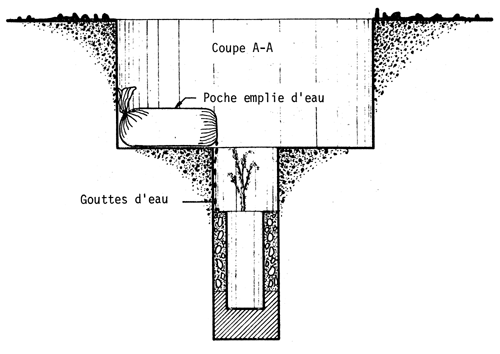
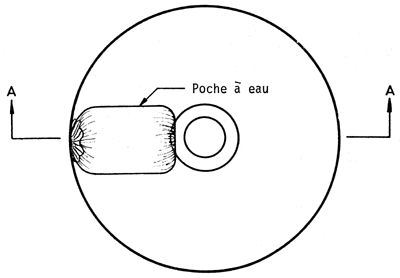
Dans le coût de la plantation, l'un des postes les plus importants est l'arrosage. Pour réduire le nombre d'arrosages, on peut soit atténuer l'évaporation de l'eau en disposant une feuille de plastique dans le trou de plantation, soit irriguer lentement (goutte à goutte)ce qui permet une meilleure utilisation de l'eau. A cet égard, Carvallo (1970) compare quatre traitements visant à réduire le nombre d'arrosages: i) fermer le sachet de polyéthylène qui sert de pot à la hauteur du collet du plant; ii) couvrir le trou avec une feuille de polyéthylène de 40 × 40 cm et de 0,06 mm d'épaisseur, perforée au milieu et tenue en place par des cailloux de sel; iii) placer une feuille de polyéthylène de 25 cm de diamètre et de 0,06 mm d'épaisseur dans le trou à la hauteur du collet du plant, en y pratiquant une coupe radiale pour la mettre en place, et en la recouvrant de terre; iv) apporter l'eau lentement au moyen d'une poche remplie d'eau, selon deux modalités: a) poche percée à une extrémité d'un petit trou par lequel l'eau sort goutte à goutte; b) dans la perforation de la poche passe une mèche qui est en contact avec le collet du plant et y maintient une humidité constante; enfin v) est le témoin, planté dans les conditions habituelles. (Voir planches pages 43 à 47).
Les arrosages furent effectués dans les 3 premiers traitements avec 5 litres d'eau tous les 10, 20 et 30 jours, et les feuilles de plastique furent retirées à 30 jours et à 90 jours. L'auteur conclut qu'il n'y a pas de différences entre les traitements en ce qui concerne la survie des plants de tamarugo; il n'y a pas non plus de différences significatives entre les divers calendriers d'arrosage, autrement dit on pourrait arroser tous les 30 jours seulement; le fait de laisser en place le plastique et les poches d'eau à distribution par goutte à goutte et par mèche n'a pas non plus d'influence. En définitive, l'auteur recommande de modifier la fréquences des arrosages, et de les faire tous les 20 jours, ce qui en réduit le coût de 50%.
Les travaux de constitution du peuplement ne sont pas terminés lorsque les plants sont bien enracinés et que cessent les arrosages. Etant donné l'abondance des branches basses et la présence d'épines sur ces branches, il faut les élaguer lorsque l'arbre a entre 4 et 6 ans, parce qu'elles gênent l'accès des animaux au fourrage.
L'élagage se fait à la main avec un faucillon. Les branches sont éliminées ou taillées à la hauteur voulue pour que les animaux puissent pénétrer. Les branches coupées sont ensuite entassées, et peuvent servir à l'établissement des haies pour délimiter les enclos.
Les données dont on dispose sur la capacité fourragère du tamarugo sont rares et incertaines, à l'exception d'un rapport d'Elgueta et Calderón (1970). Une caractéristique générale de l'espèce est la grande variabilité individuelle que l'on observe dans la production de fourrage entre des arbres voisins du même âge. Cette variabilité se retrouve chez toutes les espèces propagées par graines, mais elle est ici encore plus prononcée du fait que la Pampa del Tamarugal est selon toute vraisemblance le centre d'origine de cette espèce (Klein, 1970).
SCHEMA D'UN TROU DE PLANTATION
SCHEME MONTRANT LA DISPOSITION DE LA FEUILLE DE PLASTIQUE AU COLLET DU PLANT
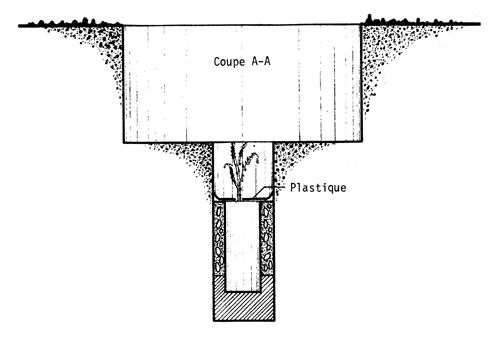
SCHEMA MONTRANT LA DISPOSITION DE LA FEUILLE DE PLASTIQUE EN COUVERTURE AU-DESSUS DU PLANT

Plantation de tamarugo au travers de la croûte saline.
SCHEMA MONTRANT LA DISPOSITION DE LA POCHE A EAU


Elagage du tamarugo pour permettre au bétail d'accéder au pied des arbres.
Afin d'évaluer le rendement en fruits -- indépendamment des feuilles --, Klein (1970) a récolté en divers points du boisement adulte, tout ou partie de la production de 42 arbres des sections No l et No 3 de la forêt de Junoy, plantés vers 1930, à écartement de 20 × 20 m au carré. Un des secteurs avait été traité une fois à l'endosulfan, et l'autre laissé tel quel. On a effectué la récolte partielle au moyen de 8 gouttières de l m2 de surface disposées radialement par rapport au tronc, et la récolte totale en balayant le sol et en rammassant tout le matériel pour le trier ensuite. On a noté les caractéristiques de l'arbre (rayon, hauteur moyenne, nombre de tiges par pied, nombre et diamètre des tiges à l m de hauteur, type de cime, nombre de branches rampantes, type de fruit, répartition des fruits sur la surface de la cime, état sanitaire général). On a étudié en laboratoire 100 échantillons de fruits de chaque arbre, en observant les paramètres suivants: volume, poids et état sanitaire. Pour ce dernier point, on a examiné les types de dommages présents et les agents responsables, parmi lesquels la pyrale violette (Leptotes trigemmatus Butler) et la teigne du fruit (Cryptophlebia carpophagoides Clarke), ainsi que les dégâts causés par la souris de la pampa (ratón pampino).
Dans l'évaluation des dommages, Klein tient compte de l'énorme variabilité des rendements en fruits par rapport aux données relativement homogènes concernant la surface de cime.
Les observations effectuées font ressortir un rendement moyen de 57,361 kg de fruits pour des tamarugos adultes traités chimiquement, ce qui correspond à un rendement moyen de 0,508 kg par mètre carré de surface de cime, chiffre très inférieur à celui estimé par Oyarzún (1967) et par d'autres auteurs.
Quant à la méthode employée par Klein (1970), elle consiste à comparer le poids total de fruits (effectivement) récoltés avec le poids calculé (tableau 9), à partir du poids récolté dans des gouttières de tôle, à raison de 9 par arbre.
La relation entre le pourcentage de fruits endommagés par les insectes et le poids de 100 fruits a également été étudiée, ainsi que le montre le tableau 10.
L'analyse des résultats permet de faire des observations intéressantes:
Malgré la pulvérisation d'endosulfan, 39 pour cent des fruits sont attaqués principalement par la teigne du fruit (Cryptophlebia carpophagoides).
Malgré le dommage causé par les insectes, l'incidence sur le poids des fruits n'apparaît pas très significative.
Il est important de souligner que, bien que l'on n'observe pas une relation directe entre le poids du fruit et les attaques d'insectes, celles-ci entraînent une perte élevée aux premiers stades du développement des fruits, c'est-à-dire peu après le début de la coagulation de la pulpe.
L'attaque d'insectes la moins forte s'est produite sur un arbre producteur de gousses petites.
TABLEAU 9: Validité de la méthode de récolte partielle employée pour évaluer le rendement en fruits du tamarugo
| Numéro de l'arbre | Poids de fruits total (réel) récolté (kg) | Poids de fruits calculé (kg) | Différence entre valeurs réelle et calculée |
| 13 Z | 141,48 | 133,50 | + 7,98 |
| 17 Z | 63,36 | 65,04 | - 1,48 |
| 19 Z | 98,37 | 105,92 | - 7,55 |
| 22 Z | 54,33 | 56,96 | - 2,63 |
| 23 Z | 27,90 | 26,37 | + 1,53 |
| 26 Z | 123,90 | 97,77 | + 26,13 |
| 28 Z | 49,56 | 45,83 | + 3,63 |
| 30 Z | 46,11 | 45,28 | + 0,83 |
| 31 Z | 41,55 | 43,75 | - 2,70 |
| 646 | 620,76 | + 26,34 |
TABLEAU 10: Relation entre le pourcentage de fruits mûrs endommagés et leur poids (Klein, 1970)
| Numéro de l'arbre | Fruits endommagés (%) | Poids de 100 fruits (g) | Volume de 100 fruits (cm3) |
| 11 Z | 42,8 | 89,70 | 225 |
| 12 Z | 21,5 | 77,77 | 225 |
| 13 Z | 22,0 | 71,26 | 225 |
| 14 Z | 28,8 | 80,81 | 250 |
| 15 Z | 28,8 | 67,88 | 225 |
| 17 Z | 45,4 | 70,30 | 200 |
| 18 Z | 65,6 | 70,66 | 225 |
| 19 Z | 39,7 | 92,95 | 300 |
| 20 Z | 57,0 | 68,16 | 250 |
| 21 Z | 46,7 | 70,53 | 225 |
| 22 Z | 49,6 | 101,80 | 325 |
| 23 Z | 43,0 | 80,14 | 250 |
| 24 Z | 15,0 | 55,14 | 175 |
| 25 Z | 38,0 | 63,26 | 225 |
| 26 Z | 33,3 | 75,44 | 250 |
| 27 Z | 37,3 | 96,20 | 325 |
| 28 Z | 70,7 | 95,20 | 300 |
| 29 Z | 38,1 | 86,08 | 275 |
| 30 Z | 24,0 | 64,20 | 200 |
| 31 Z | 47,7 | 92,56 | 275 |
| Moyenne | 39,75 | 78,5 | 247 |


Vues aériennes de parties du boisement planté par la Corporacion de Fomento dans le domaine de Refresco, Pampa del Tamarugal.
La comparaison avec les données obtenues dans le secteur non traité permet de conclure que:
Le rendement en fruits du tamarugo est en relation étroite avec la variabilité individuelle que présente l'espèce. Il est indispensable de déterminer si elle est due à des formes existant à l'intérieur de l'espèce, ou à des écotypes définis.
Les attaques d'insectes ont une influence sur le rendement en fruits. C'est ainsi que dans le secteur traité à l'endosulfan on observe un accroissement de 31,2%.
Il n'apparaît pas clairement de différences individuelles dans la résistance aux attaques d'insectes. Le fait que les arbres produisant des fruits petits sont en moyenne moins touchés ne signifie pas nécessairement qu'il y a résistance.
Les données diffèrent de celles présentées par Elgueta et Calderón (1970) pour l'année 1969, comme le montre le tableau 11.
La connaissance des arthropodes phytophages associés au feuillage, aux rameaux, aux fleurs et aux fruits du tamarugo, et notamment de ses ennemis naturels et des insectes pollinisateurs indigènes et introduits, constitue un des aspects importants dans le fonctionnement de l'écosystème et son aménagement à long terme. Le complexe entomologique du tamarugo a été étudié par Klein et Campos (1977), qui le divisent en cinq groupes selon le rôle nuisible ou utile des différentes espèces: i) insectes et acariens du feuillage; ii) insectes qui détruisent l'inflorescence; iii) insectes qui s'attaquent au fruit et à la graine; iv) pollinisateurs naturels; v) pollinisateurs introduits. Les informations qui suivent sont empruntées principalement à ces auteurs.
Leptotes trigemmatus Butler (Lepidoptera: Lycaenidae): “Palomilla violeta” (Pyrale violette). Dans le nord du Chili on la trouve répartie dans toutes les vallées et les ravines où l'on cultive la luzerne, les oasis de piémont, et toute la Pampa del Tamarugal jusqu'à sa limite dans la vallée de Quillaga. Les hôtes principaux sont: la luzerne (Medicago sativa), le tamarugo, l'algarrobo (Prosopis chilensis), le Prosopis strombulifera, l'“algarrobo argentin” (Prosopis burkartii), et le cressa (Cressa cretica). On a observé des papillons adultes se nourrissant sur des fleurs de “brea” (Tessaria absinthioides) et d'eucalyptus (Eucalyptus sp.). Les dégâts sont causés par la chenille, et n'ont d'importance notable que dans les pépinières et sur les plants nouvellement transplantés. Sur des sujets jeunes et vigoureux il se développe de nouvelles pousses secondaires qui parviennent généralement à échapper aux attaques ultérieures. Le dommage se caractérise par une perforation circulaire de la foliole, provoquant une nécrose partielle; il n'y a qu'un seul trou par foliole. Une fois son développement achevé, la chenille descend pour faire sa chrysalide, de préférence sous les croûtes de sel ou sous l'écorce détachée du tronc, où on peut la trouver en grande quantité durant les mois d'octobre et novembre. La population diminue notablement dès que commence la maturation du fruit au mois de décembre, et on n'observe une reprise des dégâts que lors de la floraison secondaire hivernale. Il se produit vraisemblablement une migration massive des adultes depuis les luzernières des vallées andines vers la Pampa dès que commencent la pousse et la floraison des Prosopis en septembre, ce qui expliquerait le niveau élevé des populations initiales.
TABLEAU 11: Comparaison entre les valeurs obtenues par l'Instituto Forestal (Elgueta et Calderón, 1970) et Klein (1970) pour le rendement en fruits du tamarugo
| Paramètres | Instituto Forestal | Klein | |
| avec traitement à l'endosulfan | sans traitement | ||
| Campagne | 1969 | 1970 | 1970 |
| Nombre d'arbres observés | 9 | 20 | 22 |
| Système de récolte | 9–12 bacs de 1 m2 sur la projection de la cime | 8 gouttières en tôle de 1 m2, et récolte totale | 8 gouttières de 1 m2, et récolte totale |
Moyenne kg de fruits par m2 de surface de cime | 0,781 | 0,508 | 0,387 |
Rendement moyen en fruits par arbre (kg) | 91,45 | 57,36 | 49,88 |
En ce qui concerne les ennemis naturels, il existe un faible parasitisme des oeufs causé par le microhyménoptère Uscama sp. Les oeufs parasités prennent une couleur gris foncé. Un déprédateur important des oeufs est le “mírido” (Rhinacloa aricana) Carvalho (Hemiptera: Miridae), que l'on trouve en populations nombreuses tant dans les plantations nouvelles que sur les tamarugos adultes.
Tephrinopsis memor Dognin (Lepidoptera: Geometridae) “gusano medidor” (chenille arpenteuse). Cette géométride est largement distribuée dans la Pampa del Tamarugal, principalement sur le tamarugo, bien que l'on ait observé des chenilles s'alimentant également sur l'algarrobo. La chenille aux premiers stades est de couleur vert jaunâtre, puis vire à un vert plus foncé avec des franges jaunes; au dernier stade elle mesure 2,4 cm de long, et se nourrit voracement des inflorescences -- où elle cause le plus de dégâts -- et des feuilles du tamarugo comme de l'algarrobo. La limitation naturelle, dans certains peuplements, s'opère par des guêpes du genre Polystes qui s'attaquent aux chenilles à un stade avancé de développement.
“Pegador” de hojas (colleuse de feuilles). Microlépidoptère non identifié, largement distribué dans le nord-ouest de l'Argentine sur Prosopis alba et P. nigra, dans la zone phytogéographique connue sous le nom d'El Monte. Dans la Pampa il est largement répandu sur les tamarugos et les algarrobos. La larve au maximum de son développement mesure jusqu'à 3,8 mm sur 2,8 mm de large, et est de couleur jaune orangé; elle réagit au toucher par des mouvements convulsifs. Elle peut causer une défoliation très importante, surtout sur des arbres jeunes.
Hemiberlesia rapax (Comst.) (Homoptera: Diaspididae). Il s'agit d'une cochenille répandue depuis Arica jusqu'au Llanquihue; elle s'attaque au tronc et aux branches, mais ne présente pas une importance économique majeure. Elle est parasitée par divers endoparasites.
Heteropsylla texana Craw. (Homoptera: Psyllidae). Se rencontre occasionnellement sur le feuillage et les inflorescences du tamarugo, sans y produire de dommages appréciables. Pour l'algarrobo, il présente un problème sérieux en raison de la défoliation et de la formation de galles qu'il cause sur les rameaux; les dégâts les plus importants sont dûs à l'avortement des fleurs, au flétrissement du bourgeon terminal, et à l'abondante sécrétion sucrée.
Aphis sp. (Homoptera: Aphididae). Connu sous le nom de puceron du tamarugo, cet insecte de couleur café foncé attaque les jeunes pousses des plants. Les dégâts ne revêtent d'importance qu'au printemps dans les pépinières. Il est bien combattu par des prédateurs (chrysopes et syrphes), et par un parasite non identifié.
Cécidomyie (Diptera: Cecidomydae). Espèce non identifiée. Se rencontre dans tout le Grand Nord, associée avec les Prosopis; on la rencontre aussi dans le nord-est de l'Argentine, sur des arbres appartenant au même genre. Les oeufs, de 0,12 mm de large sur 0,8 mm de long, sont de couleur orangée, avec une enveloppe lisse et brillante. Les larves au dernier stade atteignent 1,3 mm de long. Les adultes sont d'apparence très délicate; le mâle est de couleur café foncé à noire, et la femelle de couleur orange à rouge intense. Immédiatement après l'éclosion des oeufs, les larves introduisent leur appareil buccal en un point déterminé du tissue foliaire, et ne changent plus de place jusqu'au dernier stade larvaire, lorsqu'elles se détachent pour aller faire leur nymphe dans le sol. Les dégâts se caractérisent par une tache circulaire de couleur vert pâle avec un bord chlorotique, là où la larve est fixée; il se produit des défoliations dont l'intensité varie selon l'époque de l'année. Cette espèce attaque également l'algarrobo, provoquant de fortes défoliations en particulier au début de la période estivale (janvier).
Deux microhyménoptères: Platygaster luctuosa (Hymenoptera: Platygasteridae) et Diglyphus sp. (Hymenoptera: Eulophidae), parasitent les larves et les nymphes de la cécidomyie. Aux mois d'octobre et novembre on observe d'autres ennemis naturels tels que Chrysopa sp., qui s'attaquent à divers stades de développement larvaire.
Eriophyes tamarugae (Wilson). (Acarina: Eriophydae). Phytopte du Tamarugo. Se rencontre associé au tamarugo dans toutes les salines de la Pampa del Tamarugal. La femelle mesure 180–220 microns de long sur 48 microns de large (Wilson, 1968). Les dégâts se manifestent principalement sur le feuillage des plants de pépinière et sur les arbres adultes. La foliole attaquée s'enroule, grossit et se déforme, poussant de manière anormale. La couleur vire peu à peu du jaune au café foncé, jusqu'à ce que la feuille tombe. En ce qui concerne les ennemis naturels, certains névroptères de la famille des Hemerobidae exercent une action limitante. Cependant, le plus important est l'acarien Agistemus collyerae González (Acarina: Stigmaeidae), que l'on trouve sur les folioles attaquées, se nourrissant des adultes de phytopte.
Ithome sp. (Lepidoptera: Walshiidae). “Polilla de la flor” (teigne de la fleur). Largement distribuée dans la Pampa del Tamarugal dans tous les secteurs où prospèrent le tamarugo et le Prosopis burkartii, mais on ne l'a pas observée attaquant les inflorescences d'algarrobo.
L'adulte est de couleur noir grisâtre satiné; au repos, il atteint jusqu'à 5,3 mm de long sur 1,3 mm de large. Les oeufs, plus ou moins cylindriques, ont 0,38 mm de long, pour un diamètre de 0,15 mm. A la naissance, les larves sont petites, mesurant 1 mm de long; elles sont de couleur blanchâtre, avec une calotte céphalique de couleur café foncé. Aux derniers stades, elles mesurent 5,3 mm de long; leur couleur vire au jaunâtre, avec des taches dorsales de couleur ocre. La nymphe est de couleur jaunâtre, virant au café foncé lorsqu'approche la sortie de l'imago; elle mesure de 2,5 mm jusqu'à 3,8 mm de long, sur 0,8 mm de large dans la partie médiane. La femelle dépose ses oeufs dans les boutons floraux de tamarugo, à une profondeur de 0,5 mm. L'oeuf exige semble-t-il un milieu humide pour se développer normalement. On n'a pas trouvé d'oeufs dans des fleurs écloses. La chenille à sa naissance se nourrit de préférence de la base du pistil, et ensuite des étamines. A mesure qu'elle se développe, elle passe d'un bouton floral (ou d'une fleur ouverte) à un autre, perçant un petit tunnel jusqu'au bouton adjacent. On peut ainsi trouver de 9 à 20 boutons floraux collés les uns aux autres, le rachis étant détruit par les galeries, et la circulation de la sève arrêtée, ce qui provoque par la suite le flétrissement et la chute des fleurs sans que celles-ci présentent de dommage apparent. On peut estimer les dégâts occasionnés à la floraison principale à 20–40% du total. On n'a pas trouvé d'ennemis naturels.
Leptotes trigemmatus Butler. Dès ses premiers stades la chenille de la pyrale violette perce le bouton floral ou la fleur ouverte pour introduire la tête et le prothorax au niveau des pétales. Lorsqu'il s'agit de boutons fermés, elle en consomme pratiquement tout l'intérieur, et dans le cas d'inflorescence ouverte, elle détruit la base du pistil, c'est-à-dire l'ovaire, et peut détruire entièrement la fleur.
Tephrinopsis memor Dognin. (Lepidoptera: Geometridae). Les dommages intéressent les fleurs ouvertes, et consistent en une destruction partielle des étamines, du style et du stigmate, et de la partie supérieure des pétales dont les bords supérieurs sont mangés dans la proportion de 30 à 50%; ils compromettent généralement plus de la moitié de l'inflorescence. L'attaque se produit lorsque la floraison est avancée.
Franhiniella rodeos Moult. (Thysanoptera: Tripidae). “Trips del tamarugo”. Très abondant dans les inflorescences, en particulier après l'ouverture des boutons floraux, ce thrips endommage la partie supérieure des pétales, dont les bords apparaissent tachés et nécrosés. On n'a pas évalué les dommages qui en résultent, malgré les populations importantes que l'on observe à partir de septembre.
Cryptophlebia carpophagoides Clarke. (Lepidoptera: Olethreutidae). “Polilla del fruto” (teigne du fruit). On la trouve dans toute la Pampa del Tamarugal, la vallée de Lluta et la vallée d'Azapa. Le papillon adulte est de couleur gris pâle avec des taches de couleur métallique ou noire sur la face supérieure des ailes antérieures, ressemblant beaucoup à la teigne du pommier. Il mesure de 10 à 11 mm de long, avec une envergure de 25 à 26 mm. La chenille est de couleur blanche, avec une calotte céphalique de couleur noire virant au café. Dès sa naissance elle pénètre dans le fruit, où elle se nourrit des graines. Elle en sort par un orifice irrégulier caractéristique pour passer à une autre gousse. Une fois achevé son développement larvaire, elle migre vers un endroit protégé, en général un lambeau d'écorce détaché de l'arbre. Les adultes commencent à apparaître fin septembre; leur population atteint une densité maximale en octobre, puis se maintient à un niveau plus bas en novembre-décembre. Les dégâts les plus importants se produisent sur les fruits peu développés, dont toute la grappe peut être détruite. La proportion de fruits endommagés était de 17,4% dans les essais réalisés par Klein et Campos (1977); on estime qu'elle peut atteindre 30%.
Parmi les ennemis naturels, on connaît plusieurs parasites du stade d'hivernage, appartenant à l'ordre des Hyménoptères: Dibrachys cavus Walker, Bracon hebetor Say, Periossocentrus sp. On peut estimer à 25–30% le taux de parasitisme des larves hivernantes.
Leptotes trigemmatus Butler (Lepidoptera) s'attaque aussi aux fruits du tamaruga, notamment à leurs premiers stades de développement, en entraînant la chute. En général, les gousses parasitées cessent de croître et prennent une couleur vert sombre pour se déshydrater et finalement tomber.
Scutobruchus gastoi Kingsolver (Coleoptera: Bruchidae), “Bruco del tamarugo” (bruche du tamarugo), est une espèce endémique de la Pampa del Tamarugal. Les adultes mesurent 2,2 mm de long, et sortent des gousses mûres en laissant des orifices d'environ 1 mm de diamètre, ressemblant beaucoup à ceux laissés par la “palomilla violeta”. Les individus de la dernière génération hivernent dans les fruits tombés au sol, émergeant en grand nombre l'année suivante au moment de la floraison.
Bien que le tamarugo bénéficie d'une pollinisation anémophile tant ouverte que fermée, l'intervention des insectes aurait son importance pour obtenir une bonne fructification.
Il serait possible de développer l'apiculture en raison de la grande quantité de fleurs riches en nectar, mais on se heurte en l'occurrence aux constraintes imposées par le climat, la durée de la période de floraison et l'absence d'autres plantes mellifères (Klein et Campos, 1977; Rolando, 1974).
C'est l'abeille solitaire Centrix mixta Friese qui joue le plus grand rôle dans la pollinisation non seulement du tamarugo mais également des autres espèces de Prosopis. Elle construit ses nids dans le sol salin, avec une galerie cimentée, résistante. Les adultes commencent à apparaître vers la mi-août, date qui coïncide avec le début de la floraison du tamarugo, du chañares (Gourliea decorticans) et des agrumes des oasis; leur activité s'arrête avec la fin de la floraison, qui se situe fin novembre. En hiver, quand il se produit une seconde floraison, on ne rencontre pas d'abeilles solitaires.
On a essayé l'abeille domestique, Apis mellifera, pour améliorer la pollinisation et obtenir un revenu supplémentaire. L'espèce s'est très bien adaptée écologiquement, et la quantité et la qualité (couleur et saveur) du miel produit permettent d'envisager un encouragement au développement de cette activité.
Cependant, la floraison étant concentrée sur trois mois, il faut nourrir artificiellement les ruches. Avec une conduite appropriée et une transhumance vers les vallées préandines, on pourrait néanmoins satisfaire ces exigences sans autre grosse dépense que le coût du transport.
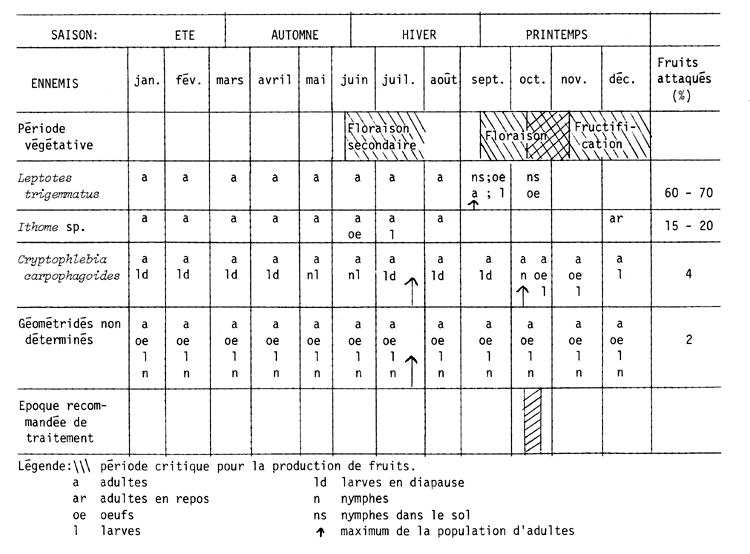
Cadahia (1970) présente un calendrier biologique des principaux parasites qui attaquent le tamarugo pendant la période végétative, en indiquant le pourcentage de dégâts dans les fruits, et le moment le plus propice pour effectuer les traitements (tableau 12).
Les trois espèces considérées comme les plus importantes sont la teigne de la fleur (“polilla de la flor”), la pyrale violette (“palomilla violeta”) et la teigne du fruit (“polilla del fruto”). Les deux premières présentent plusieurs générations dans la période critique; en revanche, on pense que Cryptophlebia carpophagoides Clark n'a qu'une seule génération, étant donné que l'on observe que ses larves, après le dernier stade larvaire, entrent dans une phase de diapause qui dure jusqu'au début de l'année suivante. Les dégâts causés à l'inflorescence par la teigne de la fleur et par la pyrale violette sont très importants, et peuvent, selon León (1974), atteindre 52% et plus.
TABLEAU 12: Etude biologique des principaux parasites attaquant le tamarugo pendant la période végétative, pourcentage de dégâts sur les fruits, et époques recommandables pour les traitements (Cadahia, 1970)
Pour combattre les insectes qui attaquent le tamarugo, León (1974) s'est livré dans le nord de la saline de Pintados à un essai, afin de comparer des formules d'insecticides émulsifiables et en poudre sur les trois espèces les plus importantes parasitant les fleurs et les fruits. En conclusion, les traitements à l'endosulfan à 4% étaient statistiquement supérieurs, donnant le pourcentage le plus élevé de fruits sains, quoique le rendement en fruits mûrs soit le même qu'avec endosulfan 35% E; en outre la durée dix fois moindre du traitement avec les produits en poudre qu'avec le produit émulsifiable employé rend leur usage encore plus recommandable.
Des expériences antérieures effectuées par Klein (1969) indiquent comme traitements les plus efficaces endosulfan E.C. à 0,07% de produit actif et endosulfan W.P. à 0,5% de produit actif; ces traitements accroissent notablement les rendements de 45,1% et de 100% respectivement. Cet auteur a en outre étudié le rendement potentiel en fruits du tamarugo en faisant abstraction de l'incidence des parasites. Il traitait aux époques suivantes: débourrement, floraison, formation des fruits, avec endosulfan W.P. à 0,5% de produit actif, et méthylparathion à 0,43% de produit actif, le premier étant appliqué le 12 février, le 6 novembre et le 12 novembre, le second le 10 décembre après disparition de l'abeille pollinisatrice Centrix mixta. Les résultats indiquaient une augmentation du rendement, de 210 kg à 427 kg pour deux arbres. En ce qui concerne le mode d'application, on a comparé les traitements aériens et au sol avec endosulfan à 5% de produit actif en émulsion dans le gas-oil. D'après les résultats, les traitements au sol avec 100% sont plus efficaces que les traitements aériens avec 30%; ces derniers de plus nuisent à l'abeille Centrix mixta.
La grande étendue désertique qui comporte une seule alliance végétale fondamentale est très pauvre du point de vue de la végétation et de la flore. Les unités qui la composent ne représentent pas des associations définies; les plantes que l'on peut y rencontrer accidentellement sont parmi les plus xérophiles de la zone. C'est ainsi qu'on ne peut réellement distinguer une alliance ni une fidélité phytosociologique.
On trouve parfois une couverture végétale très ouverte, pauvre, faite d'arbustes et d'herbes pérennes, marquant le cours d'écoulements souterrains qui suivent des ravines sèches en surface. Celles-ci peuvent ou non présenter un écoulement superficiel lors des années accidentellement pluvieuses; en général il existe dans ces secteurs un sous-sol légèrement plus humide que dans les autres parties du désert.
La communauté végétale actuelle, relativement homogène, est formée d'un très petit nombre d'espèces, la plus grande variété se trouvant là où la nappe souterraine est le plus près de la surface. Au tamarugo sont associées les espèces suivantes: Prosopis strombulifera (Lam.) Benth., connu sous le nom de “fortuna”; Prosopis burkartii, Muñoz, le“tamarugo argentin”; Tessaria absinthioides DC, “brea”; Distichlis spicata, “grama salada” (chiendent salé); Cressa cretica L., “retama” (cressa); Atriplex spp., “pillaya”; Euphorbia terapacana Phil.; Tagetea minuta L. On trouve en outre dans cette zone Prosopis chilensis Mol., “algarrobo”, qui y a probablement été introduit (León, 1974). Ce n'est que dans de petits secteurs bordant les salines qu'on rencontre diverses espèces d'Atriplex, Chenopodium et Distichlis, qui prospèrent sur des promontoires sableux engendrés par l'érosion éolienne.
La population faunistique associée aux formations végétales où se trouvent son habitat et ses niches les utilise comme territoire de pacage ou de chasse. Dans cet écosystème, le facteur écologique limitant est évidemment l'eau, qui commande en grande partie la répartition et le type de faune vivant dans ce milieu. Ce facteur limitant a confiné la faune sauvage dans des secteurs bien délimités, d'où une exploitation anarchique par l'homme qui a entraîné la disparition de nombreuses espèces utiles et réduit les populations faunistiques au point que beaucoup d'entre elles sont en voie d'extinction (IREN, 1976).
L'aridité limite sérieusement le développement d'une faune assez importante. Cependant, dans les secteurs où il y a de l'eau superficielle ou souterraine, et dans ceux bénéficiant d'un épais brouillard au sol, il pousse des peuplements ouverts d'espèces arborescentes, qui fournissent aux consommateurs primaires de l'écosystème nourriture et bonne protection (IREN, 1976).
1. Reptiles, ordre des sauriens
Phrynosaura reichei. Désigné sous le nom de lézard (“lagarto”), on le trouve en population de très faible densité, du fait qu'il vit dans un milieu hostile privé d'eau, où son unique source de nourriture est constituée par les arthropodes amenés jusque là par le vent. Il passe la plus grande partie de la journée caché sous les croûtes de sel, pour éviter une dessiccation excessive.
Tropidurus tarapacensis. Connu sous le nom de “lézard du désert” (“lagarto del desierto”), on le trouve dans des milieux bien définis caractérisés par la végétation de tamarugo, ou dans des secteurs plus dynamiques tels que les hameaux groupés autour des stations de chemin de fer.
2. Mammifères, ordre des carnivores
Dusicyon culpaeus. C'est le “culpeo” du nord, abondant depuis la côte jusqu'au plateau. Il vit de préférence la nuit, et parcourt des grandes distances en quête de petits animaux.
Dusicyon griseus domeikoanus. Connu sous le nom de “chilla”, on l'observe assez rarement dans la zone du tamarugo; il est plus fréquent et plus abondant dans les vallées.
Galicitis cuya ou “Quique”: c'est un petit furet de moeurs diurnes, qui parcourt son territoire avec sa famille en file indienne. Il capture principalement des rats, des souris et des petits oiseaux. C'est l'animal le plus caractéristique de la Pampa del Tamarugal, où il est écologiquement bien adapté.
3. Ordre des rongeurs
Ctenomys robustus. Connu sous le nom de “tuco-tuco”, c'est un rongeur hautement spécialisé pour la vie souterraine. Il se nourrit de racines et d'insectes. Il possède une membrane supranasale qui lui permet de fermer les narines, et en outre des dents petites et fortes, en forme de ciseau, grâce auxquelles il peut creuser des galeries profondes.
Phyllotis darwini rupestris. Connu sous le nom de “lauchón”, il cohabite dans la Pampa del Tamarugal avec un petit rongeur d'espèce voisine, Akodon andinus dolichonix. Il est acclimaté dans tout le pays et se nourrit de larves d'arthropodes et de résidus végétaux.
De l'examen des données existantes sur la faune sauvage de la Pampa del Tamarugal, il ressort que son aire s'est réduite et concentrée, sous l'effet de la chasse abusive et de la persécution que lui livre l'homme, ainsi que de l'introduction d'herbivores domestiques (IREN, 1976).
L'avifaune du désert est moins riche que celle des autres vertébrés, et surtout que celle des arthropodes. Elle est particulièrement rare dans la Pampa del Tamarugal, du fait que sa présence est conditionnée par la présence d'eau d'abreuvement (Donoso, 1967).

Prosopis tamarugo de 4 ans, en concurrence avec l'espèce indigène Atriplex atacamensis dans la saline de San Pedro de Atacama. Mars 1978.
9 Il est indispensable d'inoculer les plants avant leur mise en place.