La pregunta que más difícil resulta responder en base a los resultados obtenidos en investigaciones de corta duración, consiste en el grado de los cambios o las fluctuaciones a largo término a que se ve sometido un sistema ecológico o una comunidad. Quizás uno de los primeros sistemas donde ha sido estudiado con cierto detalle un fenómeno de constantes “sustituciones” en la dominancia entre dos ecosistemas es el conocido como “ciclo de Russell” (ver en Cushing, 1982 su descripción y referencias). De forma breve: un cambio en la circulación oceánica genera cambios importantes en las características de las masas de agua, en el plancton y en los stocks de peces pelágicos dominantes del canal de la Mancha y la parte sur del mar del Norte, fundamentalmente en cuanto a la dominancia de los stocks de sardina y arenque. Acontecimientos similares se han dado en lugares diversos del planeta, por ejemplo, en las costas del oeste de América del Sur, del Japón y de California (ver Sharp y Csirke, 1983) para citar sólo algunos de los lugares donde se han producido modificaciones importantes en la biomasa y distribución de los stocks pelágicos dominantes.
Tales fenómenos también se dan en aguas interiores y en el bentos, y se ha tomado un ejemplo de estos medios de altas latitudes porque muestra lo peligroso de considerar los ecosistemas marinos como: (a) estables e (b) irreversibles, y también las dificultades con que se enfrentan los ecólogos al tratar de evaluar los mecanismos de cambio, incluso en el caso de sistemas costeros relativamente accesibles.
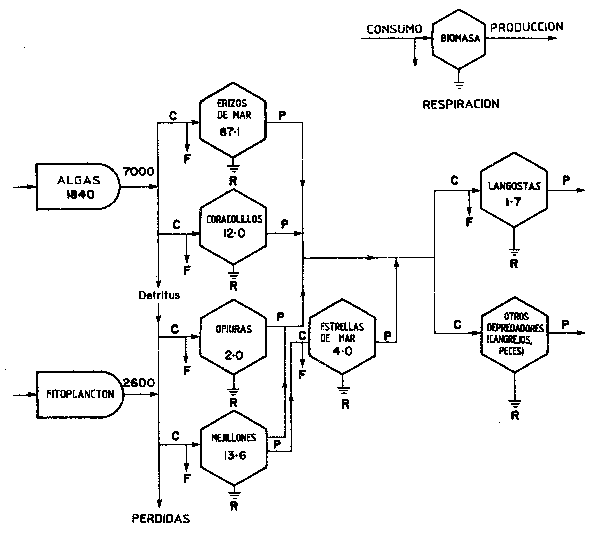
El gráfico de Miller, Mann y Scarratt (1971) de la Figura 49 se basa en la representación de circuitos de energía de Odum para mostrar los resultados de un primer análisis del flujo de energía en la comunidad sublitoral de algas (campos de algas) del suroeste de Nueva Escocia, en el cual mediciones in situ de biomasa por unidad de área, y estimaciones de la tasa de respiración fueron utilizadas para cuantificar la tasa relativa de transferencia de materia entre los componentes del ecosistema, cada una expresada en términos de producción por metro cuadrado de zona sublitoral, basándose en la relación entre las tasas de respiración y producción obtenidas por McNeill y Lawton (1970).
La primera conclusión importante de este ejercicio es que la producción anual de las algas excede el consumo de los herbívoros en más de diez veces. La mayor parte de esta materia no consumida in situ, más los detritus “secundarios” en forma de materia fecal es trasportada fuera del subsistema local en forma de restos de hojas o de otras partes de plantas y como en otros sistemas que generan detritus, como pueden ser los manglares, las praderas submarinas contribuyen de forma importante a las cadenas tróficas de las áreas de plataforma adyacentes. Esta contribución ha sido estimada por Mann (1972) resultando aproximadamente equivalente a la correspondiente a la del fitoplancton hasta la isobata de 90 m en Nueva Escocia, considerando su potencial como una fuente de materia orgánica de las cadenas alimentarias litorales.
En segundo lugar, las langostas, las estrellas de mar y otros depredadores primarios tales como el pez lobo Anarhichas lupus controlan la población de los herbívoros, la más importante de las cuales es la de erizos marinos, Strongylocentrotus droehbachiensis, que es el principal consumidor de algas y que en los años 60 mostró los mayores incrementos de abundancia asociados a un considerable declive de los stocks de algas. La ausencia de control de las poblaciones de erizos debida a la sobreexplotación de los depredadores primarios fue considerada por Breen y Mann (1976) y Chapman (1981) como la principal razón del evidente retroceso de las praderas de algas en los años 70 en muchos sustratos rocosos favorables para su desarrollo en el litoral de Nueva Escocia. En los años 70 así mismo demostró (Pringle, Sharp y Caddy, 1982) que la sobrepesca o la destrucción de habitats propicios actuando como “cuellos de botella” del desarrollo, fueron probablemente los factores responsables del descenso en las poblaciones de langosta, más que posibles situaciones de escasez de alimento. Dada la amlitud de los hábitos alimenticios de las langostas, la sobrepesca o la pérdida de zonas protegidas pudieron ser las causas principales del descenso de la langosta.

Figura 49 Flujo de energía a travésde la comunidad béntica submareal en la zona de algas de la bahía de Santa margarita en Nueva Escocia . Las unidades son kcal/m²año, excepto para la biomasa que es kcal/n². Los valores de producción fitoplanctónica corresponden a platt (1971) (de Miller, Mann y Scarratt,1971)
Explicación: La Figura 49 se basa en la nomenclatura para circuitos de energía desarrollada por H.T. Odum (ver Platt, Mann y Ulanowicz, 1981), donde el campo de algas es visto como una combinación de receptor de energía (por fotosíntesis) y como unidad de consumo para su propio desarrollo (por respiración), con un stock permanente de 1 840 kcal/m² que contribuye con 7 000 kcal/m²/año al mantenimiento de las poblaciones de herbívoros y detritívoros (cada una a su vez constituida en población consumidora para su propio mantenimiento).
En la Figura 49 se muestra que el consumo de materia vegetal genera heces y detritus y también una parte importante de las pérdidas netas de energía química de los componentes de la red alimentaria por respiración, que se indica con el símbolo de retorno al sustrato (o al “sumidero” en la terminología más propia de circuitos de energía).
A la luz de subsiguientes debates centrados en la naturaleza de las interacciones descritas por Miller, Mann y Scarratt (1971) (ver la revisión de Pringle, Sharp y Caddy, 1982), parece evidente que pese a su interés, no se demuestra que las mediciones de flujo de energía realizadas en uno o que pese a su interés, no se demuestra que las mediciones de flujo de energía realizadas en uno o dos puntos contribuyan a la determinación de la importancia relativa de los eslabones descritos. Esto se debe en parte a que varios elementos de información esenciales no fueron considerados, como son el tamaño relativo y las interacciones espaciales de las especies componentes del sistema, además de sus tasas de alimentación. Así mismo va demostrándose que los componentes no incluidos en el diagrama de energía preliminar que se ha citado pueden jugar un papel activo. Es el mismo caso del sistema erizo de mar-Macrocystis-Zreja de mar-erizo de mar-nutria de mar, citado por Pringle, Sharp y Caddy (1982), donde el papel clave jugado por otros componentes (una estrella de mar y un labrido, para no citar los posibles efectos de la contaminación costera) han sido considerados como factores importantes causantes de los cambios observados en la comunidad, además de los componentes previamente identificados y que se han citado anteriormente. Es muy importante tener alguna idea de la tasa relativa de alimentación y de los solapamientos espaciales de un depredador dado con una u otra presa.
El aspecto que más ha acaparado la atención de quien ha trabajado sobre el sistema de Nueva Escocia durante los años 70 fue la aparente irreversibilidad de la creciente biomasa de erizos y el retroceso de la biomasa de algas, pero como se vio posteriormente, hay que ser prudente a la hora de establecer conclusiones de amplio carácter zoogeográfico y a largo plazo, acerca de la evolución de un sistema. El cambio descrito estableciendo la dominancia de los erizos se mostraba irreversible porqué de continuar la activa acción de los erizos sobre los maduros asentamientos de algas, estos erizos, pese a mostrar un estancamiento en su crecimiento, podían persistir y mantenerlos “improductivos” libres de las esporulaciones de las algas mientras actuaran sobre la materia detrítica y libres de esporulaciones de otras plantas que pudieran colonizar la superficie de las rocas. En tal situación, Breen y Mann (1976) concluían, basándose en las evidencias, diciendo que era “difícil prever un mecanismo que permitiera la recuperación de los campos de algas”.
En 1980, tal mecanismo hizo su aparición en forma de un agente patógeno de los erizos de mar (Miller, 1985a), con un impacto bastante parecido al que en 1983 diezmó las poblaciones de erizo tropical Diadema antillarum en amplísimas áreas del Caribe (Lessios, Glynn y Cubit, 1984). La acción del agente patógeno en Nueva Escocia se mostró virulenta y de fácil trasmisión y se estima que en dos años (Miller, 1985a), murieron alrededor de 250 000 t de erizos. Inmediatamente se dio, una recuperación de las algas, y se estima que el área actualmente despoblada de algas puede soportar una biomasa de algas de 1,8 millones de toneladas con una producción anual de alrededor de 7 milliones de toneladas. Será interesante ver que otros efectos ecológicos aparecen después de tal incremento en la producción litoral de materia orgánica, no sólo en cuanto al stock de langosta, sino en la producción litoral en general.
Como resultado de esta experiencia, se puso en evidencia de forma circunstancial que tales epidemias se habían producido en el pasado, y Miller (1985) establece una sucesión de carácter cíclico de período más o menos largo (Figura 50) con dominancias alternativas de erizos y algas.
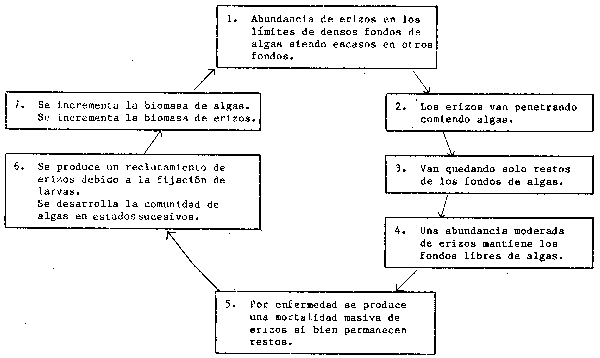
Figura 50 Ciclo de las algas-erizos de mar (de Miller,1985)
El panorama aparece algo más claro y más optimista que en 1970 para este sistema, aunque como ocurre en la mayoría de investigaciones de ecosistemas, nuevas preguntas van surgiendo en tanto otras van siendo contestadas. Como por ejemplo, si es tal la virulencia del agente patógeno, ¿cuál es su origen?. ¿Cuál será la contribución relativa del habitat recuperado en su papel de alimento de los recursos costeros como puede ser la langosta que habita en la zona de algas?. De cualquier forma hay algo sobre lo que no cabe duda y es que la estabilidad del ecosistema se ha alejado de la idea axiomática que imperaba hace menos de 10 años.
Areas de Algas para Alevinaje - Habitats de Concentración de Juveniles y de Alimentación para Numerosas Especies Ocupantes de Arrecifes
Las praderas submarinas existen en un amplio margen de latitud, desde Tasmania hasta Japón y al mar Báltico (ver la revisión de Pollard, 1984), y en todas las áreas donde aparecen juegan un importante papel ecológico, relativo sólo en parte a su importancia al contribuir con detritus a las redes alimentarias, especialmente dirigidos a la alimentación de pequeños crustáceos epibénticos como pueden ser los anfípodos. Esta última parte es importante en cuanto a las dietas de los primeros estados juveniles de los peces, muchos de los cuales se sirven de las praderas submarinas para protegerse de los depredadores. De tal forma que este habitat proporciona protección a los estados juveniles de los peces y a las langostas y constituye un área de alimentación para depredadores y herbívoros, especialmente en los trópicos, en las áreas proximas a los arrecifes de coral. Esta actividad alimenticia tiene lugar en las praderas submarinas y frecuentemente durante la noche para regresar durante el día al arrecife, de forma cíclica. Estas observaciones nos llevan a ser cautos cuando planteamos que la altísima producción estimada en algunas zonas arrecifales es debida exclusivamente a la producción primaria propia del arrecife.
Al parecer la bibliografía referente a que parte de la producción de las praderas submarinas es resultado directo de la acción que sobre ella ejercen los herbívoros plantea algunos problemas. Como ya hemos citado para otras plantas macroscópicas, una gran parte de esta producción vegetal se incorpora a la red alimentaria en forma de detritus y en especial por medio de los eslabones propios de crustáceos y peces juveniles. Las altas producciones de los peces de las praderas submarinas se deben al abundante reclutamiento (primera clase de edad incorporada ese año) y sus altísimas tasas de crecimiento (Thayer, Adams y La Croix, 1975).
Otra característica de esta y de otros tipos de vegetación marina (así como también de otros tipos de productos del subsuelo marino) es la enorme superficie ofrecida para la fijación de larvas, epifauna y epiflora. Esta característica, quizás, tiene una importancia ecológica comparable a la contribución directa de las praderas submarinas a la cadena trófica a través de los herbívoros, y este aspecto de ofrecimiento de sustrato y protección frente a depredadores es común a muchas áreas de alevinaje de peces. En el caso de las praderas submarinas, puede ser que un cambio en la naturaleza fractal del habitat pueda hacerlo menos seguro de cara a la protección de organismos mayores de una cierta talla, determinando con ello la talla a la cual los peces jóvenes se trasladan a un nuevo habitat. Así mismo, y pese a su importancia para los estados juveniles clave, se ha señalado que las praderas, con algunas excepciones, son relativamente menos importantes como zonas de puesta de los peces.
El creciente grado de conocimiento acerca del significado de estos centros de producción primaria de la zona costera y litoral, y de los impactos potenciales de las variadas actividades humanas (dragados, desagues, vertidos urbanos, etc.) en estos habitats, constituyen un campo de aplicación de la ecología marina, cuyas directrices contribuyen directamente al mantenimiento de los niveles óptimos de producción pesquera en las zonas costeras.
Mediante acciones a gran escala en los ecosistemas costeros, van acumulándose experiencias sobre las posibilidades de recuperación de praderas submarinas en regresión (por ejemplo, Thorhaug, 1985).
Un ejemplo de diseño y uso potencial de conceptos cualitativos en la ordenación de pesquerías lo constituye la comunidad de peces demersales de la plataforma y el talud continental de Baleares y del Mediterráneo occidental: una fauna intermedia en complejidad entre la de áreas relativamente pobres en especies como pueden ser el Atlántico noroeste y las áreas de afloramiento en todo el mundo y las mucho más complejas y diversificadas comunidades de áreas tropicales. Macpherson (1981) establece una matriz de las interacciones tróficas de esta comunidad describiendo también la importancia de los invertebrados bentónicos y planctónicos en la red alimentaria. Estos componentes inferiores de los tres “niveles tróficos” establecidos en la Figura 51 reciben un número trófico arbitrario, empezando por aquellas especies de peces-círculo interior - que comen exclusivamente invertebrados. Curiosamente, Molva es la única de estas especies de peces en la que los invertebrados no juegan un papel significativo en su dieta. A pesar de que no se indique, no hay que olvidar que los invertebrados no ocupan un sólo nivel trófico, y que incluso en el caso de invertebrados comedores de peces se da un considerable grado de repartición del recurso (Macpherson, 1981).
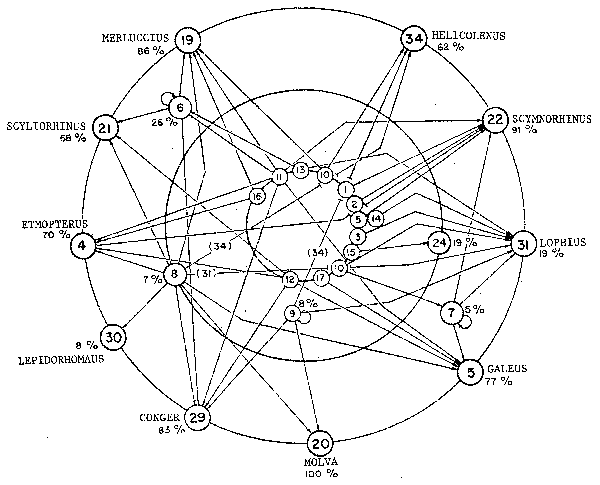
Figura 51 Se muestran con detalle los eslabones de la red alimentaria de una comunidad de peces demersales del Mediterráneo (Macpherson, 1981). Los depredadores “apicales” se sitúan en el exterior de los tres círculos concéntricos, y los “peces presa” (comedores exclusivamente de invertebrados) en los círculos interiores. Los porcentajes asignados a cada componente indican la participación de los peces en sus respectivas dietas. Los componentes (por ejemplo, 6, 7 y 9) con flechas dirigidas sobre si mismos presentan un cierto grado de canibalismo
Clasificación Trófica y Planteamiento de un Modelo de Compartimentos para Representar las Interrelaciones Tróficas
La Figura 52 plantea una posible forma de resumir el Cuadro 1 del trabajo de Macpherson (1981), constituyendo en esencia un modelo de compartimentos que indica de donde procede la energía del sistema. Desde un punto de vista estructural es esclarecedor, dado que en estos dos grupos de “peces presa” que se sitúan en los dos amplios círculos basales se incluyen por un lado los comedores activos de bentos y por otro los de plancton (en cualquier caso se da un cierto grado de solapamiento puesto que casi todos los comedores de bentos ocasionalmente pueden tomar algún alimento planctónico, en especial en los primeros estados de su vida y vice-versa aunque con menor frecuencia).
Tomando en consideración los depredadores de nivel superior, en la Figura 51 se señala que para muchos de ellos los invertebrados aún constituyen una parte significativa de la dieta. Pero pese a todo podemos establecer tres grupos básicos de depredadores:
1. depredadores de peces comedores de plancton (Micromes y Scyliorhinus);
2. comedores de peces comedores de bentos (Phycis), y
3. comedores mixtos que consumen la mayoría de especies.
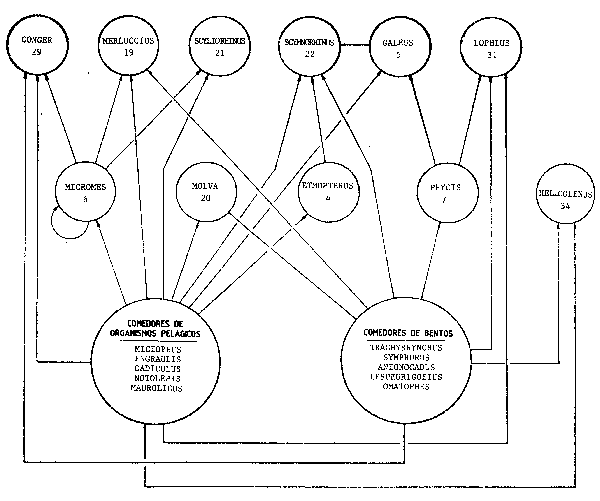
Figura 52 Modelo de compartimentos aplicado al mismo sistema de la Figura 51, mostrando los dos principales grupos de peces depredados (“peces presa”), agrupándolos en función del tipo de alimento predominantemente utilizado por cada uno
De esta clasificación, sin olvidar lo anteriormente comentado, se desprenden posibles implicaciones que merecen ser investigadas:
(a) el tamaño de la población de las especies del primer grupo y de sus presas son a priori más inestables que las del segundo grupo;
(b) las especies de los grupos (1) o (2) se ven probablemente menos afectadas de forma recíproca por las medidas de ordenación dirigidas a las especies del otro grupo que las especies del mismo grupo.
Por otro lado podemos considerar a los modelos de compartimentos como biológicamente interesantes y enormemente útiles para mostrar como se distribuye la biomasa o la energía, aunque su aplicación será menor si se basan exclusivamente en criterios tróficos. En consecuencia desde ahora nos centraremos en este tipo de relación (Figura 51) que describe las interacciones entre especies.
El uso del formato circular para representar las redes alimentarias como se hace en las Figuras 51 y 53 es ampliamente utilizado por la necesidad de hacerlas inteligibles y procurando que los cruces producidos por los enlaces entre los diferentes componentes sean mínimos y, en el caso de que se produzcan, sean lo más próximos posible a un ángulo recto. En principio parece que sería más lógico reservar el círculo interior a los depredadores apicales (ver por ejemplo la Figura 53), pero si bien el énfasis comercial recae en estas especies economicamente más importantes, que generalmente se sitúan arriba en la red alimentaria y que representamos con los círculos mayores, la disposición que aparece en las Figuras también tiene una cierta lógica puesto que conserva la idea básica de disipacón de productividad bentónica hacia arriba en la red alimentaria pro encima del objetivo de un determinado depredador apical que no es lo que en este caso más importa.
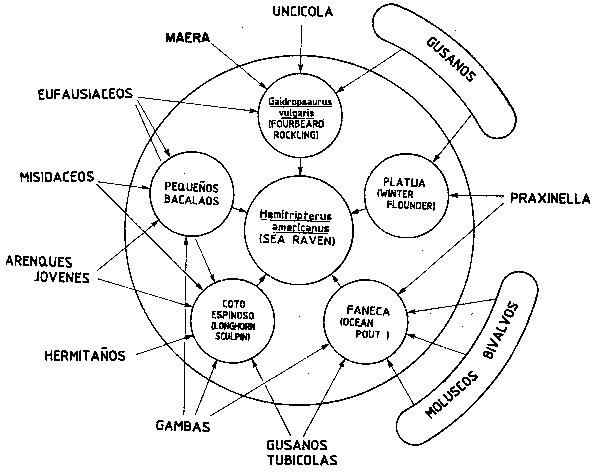
Figura 53 Representación del “tratamiento de la energía” del “sea raven” (Hemitripterus americanus). Contrastando con la Figura 43 las especies presa se sitúan fuera del círculo central (Tyler, Gabriel y Overholtz, 1982)
Aunque los círculos concéntricos en la Figura 51 no representan en forma precisa los niveles tróficos, se ha adoptado la convención de hacer figurar especies de hábitos caníbales en un nivel trófico ligeramente superior (la mitad de un nivel) con respecto al que les correspondería normalmente, en base al hecho de que ellas comparten algunas de las características de sus depredadores. Así, Antonogadus (especie N° 9), que, a excepción de su predilección por sus congéneres, se alimenta exclusivamente de invertebrados, figura en una posición intermedia entre los niveles primero y segundo. Esto se aplica igualmente a las especies de Micromesistius (6) y Phycis (7), las cuales son caníbales, pero consumen además otras especies de peces e invertebrados. Podría ser o no una coincidencia el hecho que estas especies caníbales, junto con aquellas del grupo 8, juegan un papel clave en la dieta de los depredadores apicales, y se puede hipotetizar que ellas son capaces de remontar en la jerarquía hasta ocupar el lugar de uno o más depredadores apicales cuando estos están expuestos a una depauperización transitoria.
Varias son las características de esta red alimentaria que pueden ser importantes y que nos llaman la atención:
1. Dejando de lado la posible distinción de algunas especies (6, 7, 8, 9 y 24) que están un sólo eslabón, como máximo, por encima de los comedores de invertebrados (en realidad los invertebrados constituyen una buena parte de su dieta), no existe una distinción real entre los niveles arbitrarios 2 y 3. De hecho, para la mayoría (a excepción de Molva), los invertebrados constituyen una parte importante de su dieta, así el “porcentaje de invertebrados”en el contenido estomacal es inversamente proporcional al “peso”en la red alimentaria, de tal forma que puede ser usado como índice aproximado de nivel trófico.
2. Así mismo y como consecuencia de (1), esta red alimentaria debe ser considerada como preliminar y aproximativa. A pesar de que pueden existir algunos componentes en niveles altos que no han sido incluidos (por ejemplo, tiburones), parece que no serán muchos si todo componente depende en su dieta de un sólo elemento.
3. Otra característica interesante de esta red alimentaria es la relativa baja frecuencia de canibalismo (que por otro lado puede ser visto como una forma de control intraespecífico de la población, o como un mecanismo de supervivencia de la población en condiciones alimenticias límite, como se verá más adelante), y la ausencia aparente de depredaciones recíprocas. Este último fenómeno (que se mencionó con anterioridad con referencia al arenque y al bacalao) sin duda se da si los estados larvarios son tenidos en cuenta, mientras que no aparece entre los componentes de la macrofauna de peces. La explicación de esto parece estar en los rangos individuales de talla de las especies en sus estados adultos que son relativamente estrechos (comparado con las especies comerciales de altas latitudes) y en la estratificación por tallas que en esta comunidad está bastante desarrollada con muchas especies de pequeña talla y una relación entre el tamaño de la boca y el tamaño del cuerpo relativamente elevada en el caso de los peces depredadores. Sería interesante conocer hasta qué punto esto es así en las comunidades de peces tropicales. La relación tamaño de la boca/talla podría ser realmente una medida del grado de “compresión” de la red alimentaria en el rango de tallas total del ecosistema. Un ejemplo del amplio rango de esta relación en la naturaleza la tenemos en la Figura 10B. (No olvidar, no obstante, la importancia de la separación entre los radios branquiales en los comedores facultativos de materia particulada, por ejemplo, la caballa).
4. Se da un elevado grado de solapamiento entre las dietas de los depredadores apicales, lo que sugiere que el sistema podría acomodarse a una intensidad moderada de esfuerzo pesquero sobre cualquiera de las especies depredadoras, es decir que la probabilidad de explosiones o catástrofes en el tamaño de la población de las presas como resultado de la reducción de la abundancia de un depredador es baja. Esta especulación es particularmente interesante si vemos las importantes fluctuaciones que se dan en series históricas locales de capturas de una de las principales especies depredadoras, la merluza (Merluccius merluccius). Podemos preguntarnos si los otros depredadores que comparten las mismas presas mostraron un incremento de población desfasado con las fluctuaciones de merluza o si de otra forma la causa principal de las fluctuaciones fueron fluctuaciones de la presa. Una investigación de estos cambios relativos de abundancia con el tiempo puede ser muy interesante en este caso. La subsección de la red alimentaria a que nos estamos refiriendo y que se detalla a continuación puede tener implicaciones de cara a la ordenación de la pesquería:
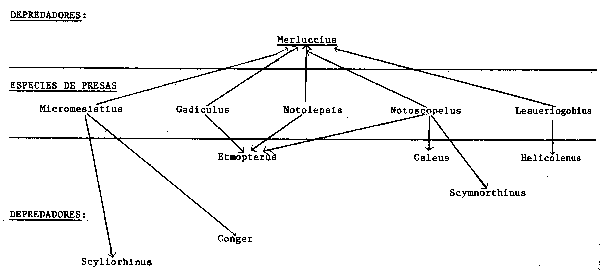
Entre Merluccius como especie comercial clave, y otros componentes del sistema se detectan dos tipos de interacción: competición entre depredadores y impactos mutuos entre las poblaciones de depredadores y de presas. Mediciones simples de estos dos impactos potenciales se dan en el Cuadro que se incluye a continuación, en el que se expresan el porcentaje de similitud de dietas (entre dos depredadores), y la combinación de disponibilidad y “preferencia” (dado como el orden que corresponde a cada presa según su porcentaje en los estómagos de merluza y de otros depredadores). Ambos criterios pueden utilizarse para determinar si los cambios observados en el tamaño de la población de merluza es probable que produzcan impactos en otros componentes de la red alimentaria directamente vinculados con ella.
| Clasificación en función de la similitud de la dieta con Merluccius (%) | Clasificación en función de la depredación ejercida por Merluccius atendiendo a la proporción de cada presa en los contenidos estomacales | |||
| 1. | Scyliorhinus | 35,4 | Lesueriogobius | 1 |
| 2. | Etmopterus | 33,0 | Micromesistius | 2 |
| 3. | Conger | 26,5 | Notolepis | 2 |
| 4. | Galeus | 10,3 | Notoscopelus | 6 |
| 5. | Helicolenus | 10,1 | Gadiculus | 9 |
| 6. | Scymnorhinus | 4,8 | ||
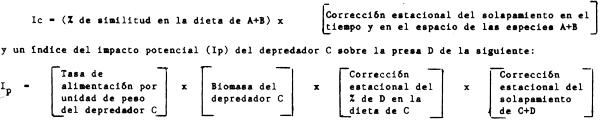
Se puede pensar en otros índices simples, en particular, el consumo relativo de una presa dada por un depredador dado. Este índice puede ser fácilmente medido como:
(% en peso de una presa dada en el estómago) x N° (en peso) de depredadores.
Este índice puede ser corregido antes de compararlo con el correspondiente a otras especies introduciendo la tasa de consumo de alimento del depredador, y procediendo a una corrección ideal de tipo estacional basada en el porcentaje de solapamiento de habitats del depredador y de la presa. En conclusión, un índice de competencia (Ic) entre los depredadores A+B que puede establecerse de la siguiente forma:
Una comparación de los componentes de una red alimentaria de este tipo permitiría detectar grupos de dos especies que más probablemente prodrían verse afectadas por los cmabios en la biomasa de las otras. Esta comparación resultaría útil en evaluaciones preliminares del riesgo que se corre por los efectos de una incidencia intensa de una o más especies sobre otras de dieta similar o de cuales son los depredadores clave o los componentes clave de la dieta para las especies en cuestión.
Ecosistemas de Areas de Afloramiento
En general, las cadenas alimentarias propias de sistemas demersales del Mediterráneo tales como las que acabamos de estudiar, se caracterizan por una limitación de nutrientes, y por lo general presentan una alta diversidad, con un extenso grupo de especies participando de la biomasa.
Contrastando con este tipo de habitat podemos considerar el ecosistema de las áreas de afloramiento (ver Sharp y Csirke, 1983; Bas, Margalef y Rubies, 1985 para tener una visión más detallada de este tipo de sistemas). Las áreas de afloramiento constituyen el soporte de algunas de las pesquerías más productivas del mundo. Incluso en bajas latitudes, estos sistemas dependen de aguas frías y ricas en nutrientes que suben a la superficie como resultado de la acción de fuerzas hidrodinámicas, principalmente vientos costeros que generalmente son de carácter estacional como lo son los afloramientos en la mayoría de los casos. La fuerza del afloramiento varía de un año a otro (Figura 54) y en consecuencia la captura de peces (Figura 55), con lo que la producción pesquera a corto plazo en estas áreas es muy dependiente de los factores ambientales, además del esfuerzo pesquero.
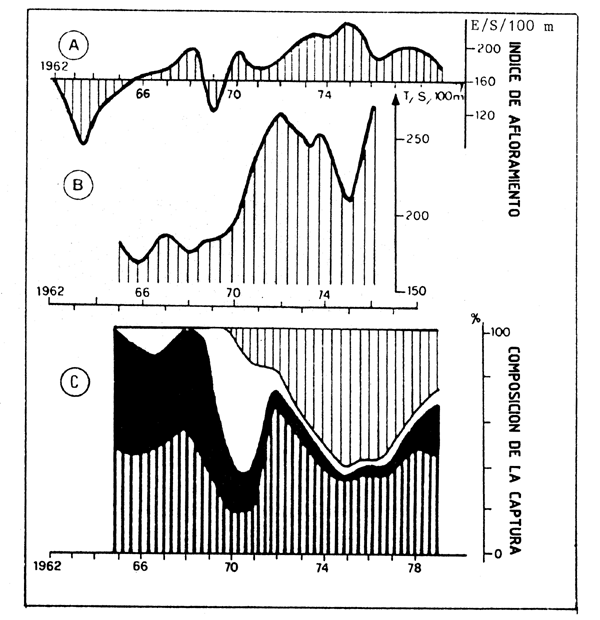
Figura 54 (A) Variacions observadas en la fuerza del afloramiento de la parte central del área dela COPACO(CECAF)
(B) Variaciones observadas en la fuerza del afloramiento en la parte sur del área
(C) Cambios observadas en la composición de la capura por especies (Gulland y Garcia, 1984)
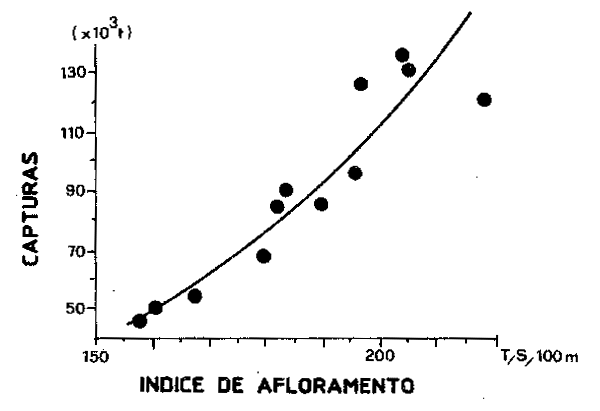
Figura 55 RelaciÓn entre las capturas anules y el afloramiento en el área de la COPACO(CECAF) (Gulland y Garcia, 1984)
Constrastando con otros habitats de alta diversidad y pobres en nutrientes como puede ser el tipico ejemplo de las áreas de arrecifes de coral en los trópicos, las áreas de afloramiento son ricas en nutrientes, y soportan una elevada producción fitoplanctónica que lleva a unas redes alimentarias superficiales con una marcada dominancia de las relativamente pocas especies residentes. Cada componente se caracteriza por su elevada biomasa, la cual presenta una considerable variabilidad en el tiempo. En algunos aspectos, como señala Cushing (1982), estos sistemas muestran una similitud con las pesquerías de las productivas áreas de altas latitudes tales como las del mar del Norte, con algunos cambios obvios como son la de “bacalaos” que con frecuencia son reemplazados por merluzas, la caballa por jureles y los arenques y los espadines por sardina y anchoa. Esto es por supuesto una gran simplification, dado que algunos grupos como las merluzas también se encuentran fuera de los sistemas de afloramiento, mientras que componentes importantes como son por ejemplo los cefalopodos y los esparidos no se mencionan. Para la mayoría de los sistemas de afloramiento esta similitud es reforzada no obstante por la estacionalidad de la producción, la cual contribuye también a la generalmente baja estabilidad y diversidad de estos sistemas.
Ryther (1969) señala que la longitud media de las cadenas tróficas es menor en las áreas oceánicas de afloramiento - directamente relacionada con la baja diversidad y estado inicial de la sucesioón - que en la mayoría de otros sistemas estables de otras áreas. La mayor parte de la producción es transportada fuera del punto de afloramiento, horizontalmente hacia zonas adjacentes (Figura 56) y verticalmente hacia el fondo a las cadenas tróficas del bentos (Figura 4). Así, se ha visto que los niveles tróficos inferiores en las áreas de afloramiento aparecen con frecuencia desplazados en el espacio, unos respecto de otros, cada vez más lejos del centro del afloramiento. De tal forma que en las costas del noroeste de Africa, por ejemplo, la producción primaria no es intensa en la zona litoral, situándose la mayor parte de la producción zooplanctónica cerca del borde de la plataforma continental. Los peces y otros altos depredadores de las cadenas tróficas de afloramientos estacionales (por ejemplo Figura 21) requieren un cierto grado de movilidad estacional o de migración con lo cual se facilita aun más el transporte desde el centro de producción. El transporte puede ser pasivo, el agua fría elevada puede ser transportada por lo menos a 100 km del punto de surgencia, con lo que se constituye lo que hemos venido llamando estructura de disipación (Figura 56), en la cual el centro de producción de los sucesivos elementos altos de las redes alimentarias se va desplazando lateralmente (por deriva o migración) desde el centro de producción primaria. Jones (1982) señala que la importancia de este tiempo de permanencia en la superficie consiste en que la producción primaria puede completarse y ser asimilada por la cadena trófica antes de que el agua fría se unda de nuevo, en el caso de cadenas tróficas cortas. Por advección lateral el impacto de los sistemas de afloramiento, no obstante, puede extenderse a considerable distancia desde su centro, tanto por la “derrame” horizontal de nutrientes como por la precipitación vertical de detritus. El “derrame” se produce también en las migraciones estacionales de muchos peces, con lo que se disipan nutrientes desde los centros de alta producción. La migración se debe también a fenómenos asociados a los afloramientos estacionales tales como el establecimiento de oxyclinas y termoclinas, las cuales pueden establecerse cuando aguas del fondo pobres en oxígeno se acercan a la superficie haciendo que estas aguas se conviertan en impracticables para un buen número de especies. El derrame también se produce verticalmente hacia los sistemas bénticos, los cuales pueden mostrar una tendencia a las condiciones de anoxia debidas a la descomposición la aboundante “lluvia” de detritus proveeniente de la producción del sistema pelágico.
Esto es consecuencia de la generalmente baja diversidad de los ecosistemas de afloramiento, es decir a las redes alimentarias simples y al espectro de organismos que en un momento dado será probablemente un tanto discontinuo. Pese a la abundancia de alimento esto puede llevar a problemas de localización del tamaño apropiado de partículas alimenticias en momentos clave del desarrollo de las especies residentes, puesto que las preferencias en cuanto al tamaño de los alimentos van cambiando necesariamente hasta que una especie completa su desarrollo.
Una consecuencia de ésto puede ser el hecho de que algunos componentes clave. de los medios de baja diversidad den muestras de canibalismo en momentos de su desarrollo, por ejemplo, calamares (Amaratunga, 1983), anchoveta (Santander, 1981) y merluzas (Lleonart, Salet y Macpherson, 1983): los reclutas de Merluccius (y los individuos menores de una cohorte (machos), en el caso de Illex), constituyen una “red de seguridad” para la dieta de las hembras maduras, contribuyendo así a la producción de una segunda generación que de otra forma toparía con condiciones tróficas inciertas. Tales mecanismos también deberían constituirse en control de la densidad dependiente de la población, “amortiguando” las amplias fluctuaciones en la abundancia que se producen en redes alimentarias relativamente simples (en la Figura 57 tenemos una visión bastante especulativa de un mecanismo de este tipo en redes alimentarias de afloramiento).
Csirke (1980) describe como el reclutamiento de anchoa es una función de dos procesos: un mecanismo dependiente del stock donde la producción de huevos decrece a niveles altos de población, y un mecanismo dependiente de la densidad donde la supervivencia de los prereclutas es función del tamaño de la clase anual y de fenómenos medioambientales. Dentro de estos fenómenos anuales se incluye el variable grado de desarrollo del fenómeno (de afloramiento) de El Niño, el cual por otro lado, tiene una influencia de control sobra el equilibrio existente entre la anchoveta y la sardina (Santander, 1981): el primero de estos mecanismos viene asociado a la elevada producción de áreas próximas al afloramiento y el último se muestra más dominante en aguas oceánicas menos productivas alejadas de la costa. En años de afloramiento menos intenso, estos márgenes específicos se hacen más estrechos, y una competencia directa de larvas, así como altas densidades de puesta de anchoveta cerca de la costa, pueden dar lugar a niveles elevados de canibalismo de huevos de anchoveta (ver Csirke, 1980; Sharp y Csirke, 1983 como ampliación a los aspectos referidos).
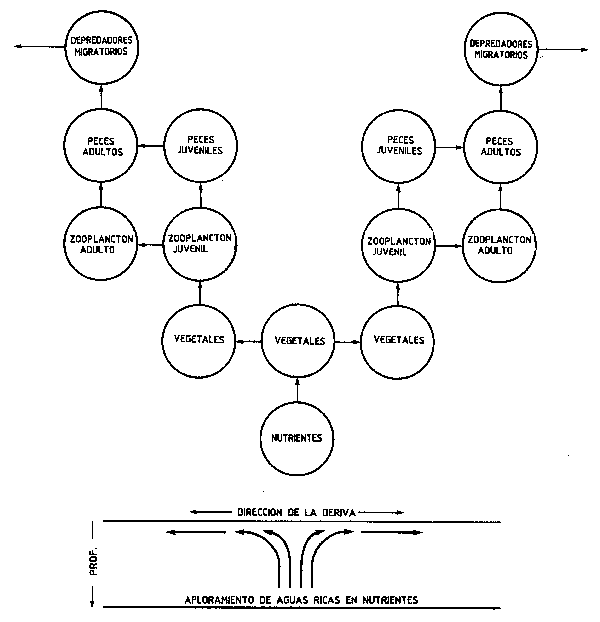
Figura 56 Tipica estructura de disipación de una red alimentaria de áreas de afloramiento (Modificación del gráfico de Jones, 1982)
Hemos descrito al medio ambiente pelágico como un sistema dinámico y agregado de forma contagiosa, que refleja los procesos diurnos, estacionales e históricos. Quizás se podría considerar la elevada actividad migratoria de los componentes de esta red alimentaria oceánica como un sistema “integrador”. Esta actividad amortigua las discontinuidades en la biomasa mediante desplazamientos relativamente rápidos entre los centros de abundancia, explotándolos y por lo tanto reduciendo su abundancia a “niveles básicos”. Cualquier lugar que constituya una posibilidad de alimentación para los depredadores nómadas o migratorios y que presente máximos de abundancia en las especies presa que le son propias, ve “amortiguados” estos máximos en gran parte debido a estas visitas, que abandonan las “zonas de crecimiento” correspondientes en todos los niveles de la red alimentaria.
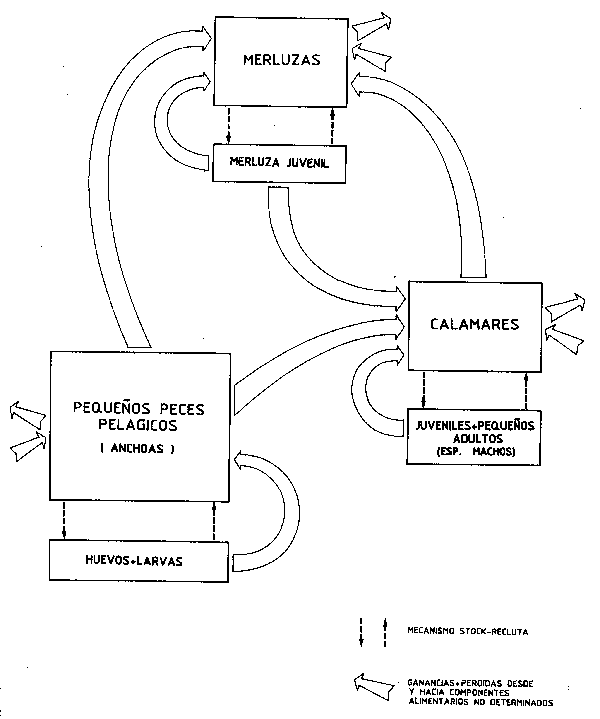
Figura 57 Generalizació n de los mecanismos interespecíficos e intraespecícifos de retro alimentación (feedback) (depredacín y canibalismo) como un mecanismo de control de la población dependiente de la densidad en sistemas de afloramiento
El concepto de interacciones en “equilibrio” de las especies en cualquier red alimentaria sólo puede mantenerse si la mayor parte de flujos de materia entre los diferentes componentes, debidos a muertes, migración, crecimiento y reclutamiento, se compensan unos con otros, incluso frente a la explotación humana. Se ha observado que la reproducción y el éxito en la supervivencia no son sólo variables de carácter estacional sino que su carácter es anual en la mayoría de las especies, y esto constituye una pequeña evidencia de la coordinación general o de la sincronía entre las puestas exitosas de los componentes de la red alimentaria. Por ello, cualquier intento que trate de establecer un “equilibrio” en terminos de producción y consumo para una red alimentaria difícilmente resultará exitoso, si bien esto no debe minimizar su valor como guía de posibles interacciones dinámicas.
Se podría pensar que la mayoría de individuos que alcanzan tallas grandes en los sistemas tropicales no topan con las limitaciones de carácter alimentario propias de altas latitudes, debidas a los marcados ciclos estacionales de producción primaria, donde al finalizar cada invierno, la disponibilidad de alimento es escasa y en consecuencia el crecimiento se ralentiza o se detiene. En los habitats tropicales, no obstante, pese a la continua productividad trófica y a la continua actividad alimentaria ejercida sobre ella, el crecimiento quasi-estable, de la población presa, con reproducciones esporádicas o continuas, viene asociado a una distribución poco homogénea de las presas y a elevadas tasas metabólicas. Se da un continuo reclutamiento de tallas depredadas que en un supuesto ideal daría lugar a un crecimiento continuo y relativamente rápido de los altos depredadores. Estos precisan, no obstante, una elevada movilidad para satisfacer sus necesidades energéticas, especialmente en aguas oceánicas, debido a las relativamente bajas densidades de tallas apropiadas de presas en muchos de los estratos tiempo-área.
En altas latitudes los grandes depredadores, por ejemplo, el bacalao, tienden a dispersarse una vez pasado el máximo de producción, posiblemente por una simple búsqueda de alimentación fuera de los principales centros de producción. Los peces de latitudes altas tienden durante el invierno a aletargarse, con una actividad metabólica mínima por efecto de la temperatura. Muchas especies eligen lugares con bajas temperaturas para invernar.
Lo que está claro es el contraste entre los ciclos estacionales aceleradores y ralentizadores de los ecosistemas de latitudes altas y la continua y rápida renovación en los ecosistemas tropicales. Pero en tanto que las interacciones depredador-presa de altas latitudes han merecido gran atención (Anderson y Ursin, 1977; Ursin, 1982), el sistema pelágico tropical sólo recientemente ha empezado a ser estudiado de forma similar.
Estudios recientes acerca de la alimentación de los atunes tropicales realizados por Olson (1982) han empezado a establecer correctamente los problemas y las posibles interacciones entre los altos depredadores y sus presas en un medio pelágico-oceánico tropical. Reconociendo que se han producido diversos intentos de estudio de estos procesos de forma cualitativa en el campo de la ecología de túniods (Blackburn, 1968; Williams, 1966; Magnuson y Heitz, 1971), satisface ver la creciente utilidad de estos trabajos, una vez que se cuenta con datos cuantitativos acerca de los elementos consumidos.
El rabil, por ejemplo, es un depredador oportunista que se sitúa por encima de la termoclina y en aguas intermedias de los océanos tropicales de todo el mundo. Basándose en aproximaciones groseras de su nivel de actividad (especialmente la natación, crecimiento y metabolismo basal), Sharp y Francis (1976) estimaron que un rabit (de 85 cm de talla y 12, 1 kg de peso), invierte sólo 9,5 por ciento de su consumo energético en crecimiento y 19 por ciento en el metabolismo basal. Alrededor del 71,5 por cieno de la energía alimentaria es invertida en la natación.
Olson (1982) continuó estos estudios examinando contenidos estomacales de rabiles, su valor calorffico y su tiempo de evacuación. Olson utilizó un Indice de Importancia relativa (IIR) que conjuga información sobre frecuencia (F), volumen o peso (W) y número (N) de elementos en los estómagos, de forma que IIR = (%N + %W) %F (Figura 58).
Una metodología que todavía se viene utilizando en la actualidad para estimar la ingestión diaria de alimento se basa en el trabajo de Bajkov (1935). El método de Bajkov determina la cantidad de alimento comido durante un intervalo de tiempo dado midiendo la cantidad de alimento contenido en el estómago al principio y al final del intervalo e introduciendo una corrección para la cantidad evacuada del estómago en el mismo intervalo de tiempo. Bajkov (1935) asume que el pez se alimenta continuamente y que la tasa de excreción gástrica es lineal y constante para cualquier tipo de alimento consumido, y sugiere que el alimento diario (1) viene dado por D = 24 A/n, donde A = cantidad media de alimento en el estómago y n es el número de horas que tarda en completar la evacuación del estómago. Muchos investigadores han establecido desde entonces que la tasa de evacuación gástrica en los peces se ajusta a un modelo exponencial, y que se ve significativamente afectada por los cambios en el tipo de alimento y en el tamaño de las partículas alimenticias (Elliot y Persson, 1978; Windelle, 1978; Fänge y Grove, 1979). Eggers (1977) y Elliot y Persson (1978) demuestran matemáticamente que con la utilización de una tasa instantánea de evacuación gástrica “se obtiene una estimación correcta y solida” de la alimentación diaria. Si se toman muestras de estómagos con frecuencia a lo largo de todo el día a fin de detectar cualquier periodicidad en la actividad alimentaria, y las cantidades de alimento en el estómago al principio y al final de un período de 24 horas son iguales (Elliot y Persson, 1978; Eggers, 1977), entonces el alimento diario viene dado por:
D = 24 AiRi
donde A es la cantidad media de la especie i en todas las muestras de estómagos, y R es la evacuación gástrica instantánea por hora y para la especie i. Existiendo la posibilidad de que el rabil se alimente sólo durante el día (Reintjes y King, 1953; Schaefor, Broadhead y Orange, 1963), se han analizado muestras de estómagos provenientes de la captura de los cerqueros para estudiarlo. Si se asume que la alimentación tiene lugar durante las horas diurnas, la anterior ecuación se ve modificada de la forma siguiente:
D = 12 AiRi
Olson señala que diferentes tipos de organismos alimenticios pueden ser digeridos y evacuados con tasas bastante diferentes, y que las tasa de evacuación gástrica de una variedad representativa de organismos naturales utilizados como alimento deberían ser medidas en experiencias de laboratorio para estimar las tasas cuantitativas de cuantitativas de consumo alimenticio, esenciales en estudios de carácter energético.
Tales mediciones fueron llevadas a cabo en rabiles cautivos, y el peso de los contenidos estomacales fue trasformado en calorías (las calorías por grama de los diferentes elementos alimenticios fueron estimadas tanto por medio de una bomba calorimétrica como tomándolas de la bibliograffía). Se obtuvo una amplia gama de calorías para los contenidos estomacales de cada talla de rabil, estimándose la alimentación diaria en valores que iban desde 0 hasta alrededor de 480, 2 600, 5 600 y 17 000 kcal/día para las clases de edad 1, 2, 3 y 4+, respectivamente.
Estas cifras de consumo diario se consideran subestimadas puesto que están basadas en la cantidad de alimento encontrado en el estómago de los atunes después de que los peces hayan permanecido durante varias horas en el cerco, hayan sido congelados a bordo, parcial o completamente descongelados antes de ser desembarcados, muestreados, congelados de nuevo, descongelados y finalmente examinados. Estos procesos y una desconocida tasa de regurgitación antes de morir reduciría el volumen de alimento encontrado en las muestras de estómagos con respecto a los contenidos hallados en peces recientemente capturados. En cualquier caso, la cantidad de alimento diario es sin duda mayor, si bien no sabemos en qué medida.
Aunque las estimaciones de alimento diario basadas en muestras de estómagos sean bastante bajas, Olson las usa para obtener expresamente estimaciones de biomasa de las presas consumidas por el rabil. Las calorías ingeridas por día fueron trasformadas en gramos de alimento, y los valores de alimento diario obtenídos se muestran separadamente para cada clase de edad en el Cuadro 11. La estimación de biomasa total de las presas ingerida por pez y por día fue distribuida para cada tipo de presa en base a la proporción relativa en que cada una aparecía en las muestras de estómagos tomadas en 1970. Estas estimaciones preliminares indican que el rabil de clase 4+ puede comer, por lo menos 730 g de melvas (7,3 individuos de 20 cm de talla media), 440 g de nomeidos (146 individuos de 3 g de peso medio) y alrededor de 233 g de otras presas cada día. Los rabiles de clase 3 al parecer comerían una media de por lo menos 235 g de melvas (2,4 individuos), 100 g nomeidos (33 individuos) y alrededor de 125 g de otras presas por día. Los clase 2 comen por lo menos 80 g de melva por término medio al día (Figura 58).
Debemos hacer una advert4encia importante. Estos datos y su análisis se basan en los contenidos estomacales medios, admitiendo que el período de alimentación se mantiene a lo largo de las 24 horas del día. No conocemos la proporción de alimentación que tiene lugar durante el día y durante la noche para estas especies, pero la tasa de alimentación es probable que durante la noche sea inferior a la estimada a partir de los datos diurnos que se han utilizado. En tal caso, la tasa de consumo diaria sería menor que la estimada e incluida en el Cuadro. En cualquier caso, si consideramos la ración máxima correspondiente a cada grupo de talla (todos los estómagos en repleción máxima en cada grupo de talla), Olson (comunicación personal) estima que los cuatro grupos de talla consumirían el 16, 0%, 15,7 %, 19,0 % y 16,7 % al día si se utilizandop el modelo de alimentación de 12 horas y el 32 %, 31,3%, 38,0% y 35,5% al día utiliza el modelo de alimentuiación de 24 horas. El modelo de 12 horas ofrece unos resultados que se correspondern exactamente con los obtenidos por Magnuson (1969) por medio de experiencias de alimentación en los cuales se proporcionó alimento ad libitum a los listados durante períodos de 12 horas. Olson señala:
| Edad | |||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | Total | |
| Biomasas de presas ingeridas por pez-1 día-1 (g) | 88 | 730 | 461 | 1 403 | |
| Número de individuos estimados en CYRA (Sharp y Francis, 1976) | 31 731 100 | 14 257 730 | 6 406 050 | 3 661 630 | 56 056 510 |
| BIOMASAS MEDIAS DE LAS PRESAS INGERIDAS POR LA POBLACION DE RABIL/DIA (en t) | |||||
| Scombridae | 1 161 | 1 505 | 2 686 | 5 352 | |
| Gonostomatidae (Vinciguerria lucetia) | 1 221 | 426 | 122 | 180 | 1 949 |
| Nomeidae (Cubiceps sp.) | 352 | 649 | 1 608 | 2 599 | |
| Cefalópodos (calamares, pulpos, argonautas) | 1 151 | 372 | 197 | 88 | 1 808 |
| Exocoetidae (peces voladores) | 87 | 346 | 239 | 179 | 851 |
| Pleuroncodes planipes (cangrejos rojos) | 264 | 155 | 113 | 102 | 634 |
| Peces no identificados | 75 | 75 | 88 | 238 | |
| Balistidae (peces ballesta) | 21 | 69 | 90 | ||
| Resto | 69 | 30 | 41 | 138 | 278 |
| Biomasa total de presas ingerida/día (t) | 2 792 | 2 917 | 2 952 | 5 138 | 13 799 |
| Biomasa de presas ingerida/año (x 10³ t) | 1 019 | 1 065 | 1 077 | 1 875 | 5 036 |
“Se puede empezar por obtener una estimación de las enormes cantidades de melva (Auxis sp.) consumidas por la población de rabil”. Para ello se obtuvieron algunas estimaciones aproximadas del alimento consumido por el rabil de la Comisión Reguladora del Area del Rabil (CYRA) en 1970 (Cuadro 11). Las estimaciones de consumo de alimento por individuo se multiplicaron por el número de individuos correspondientes a cada clase de edad de rabil calculados en el CYRA por análisis de cohortes (Sharp y Francis, 1976). Estas estimaciones indican que por lo menos 13 799 t de alimento fueron ingeridas diariamente por la población: 5 352 t de las cuales fueron melvas (alrededor de 53,5 milliones de individuos). Un total de por lo menos 5 milliones de toneladas se consumieron a lo largo del año, de las cuales unos 2 milliones correspondieron a melvas. De nuevo nos encontramos sin duda con una subestimación de las enormes cifras de Auxis consumidas anualmente por el rabil.
Un nuevo punto de comprensión significativamente importante en la energética de los túnidos que nos viene de análisis detallados de este tipo consiste en que:
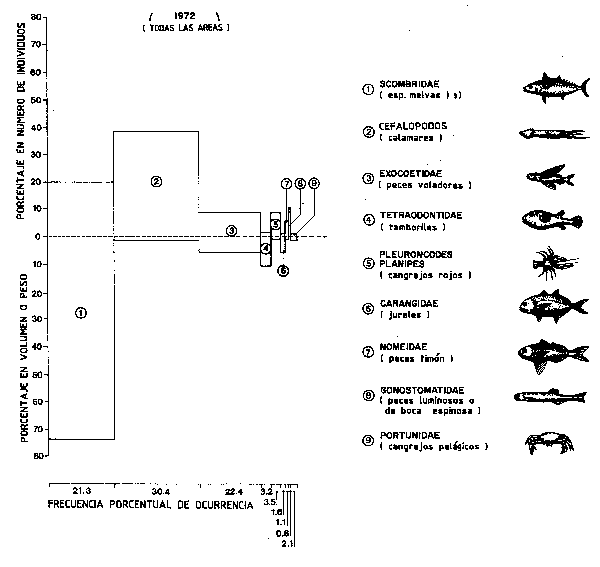
Figura 58 Proporciones relativas de diferentes elementos alimenticios propios de los contenidos estomacales del rabil del Pacífico oriental (Olson, 1982)
(a) el rabil presenta una eficiencia ecológica global (biomasa consumida frente a la biomasa ganada en el crecimiento) de alrededor del 0,15 por ciento, debido a su extremadamente costoso sistema de locomoción (Sharp, 1983);
(b) la cantidad de alimento consumido por los túnidos (y en consecuencia la producción, e incluso el stock-presa) debe ser muy elevado. Esto tiene implicaciones importantes con relación a los niveles reales de producción en mar abierto, que podrían haber sido subestimados de manera significativa.
Por supuesto todo esto debe someterse a nuevas discusiones. Sharp y Dotson (1977) basándose en mediciones de engrasamiento y experimentos hidrodinámicos determinaron que el flujo de engrasamiento en albacora podría corresponder a la energía consumida exclusivamente en los “desplazamientos migratorios”, mientras que las actividades diarias se mantendrían gracias a la dieta diaria y a su conversión en energía.
La cuestión de los componentes residentes frente a los migratorios en los estudios de la mayoría de los recursos ampliamente distribuidos ha sido una cuestión molesta. El engrasamiento y las tasas de crecimiento pudeden ser útiles para identificar nuevos migradores, es decir que proporción de peces se incorpora a las áreas de alimentación/pesca en cada momento. Valores de engrasamiento desde 2 hasta alrededor del 18 por ciento del peso total del cuerpo se han estimado para la albacora (Dotson, 1978; Sharp y Dotson, 1977), lo que evidencia la naturaleza dinámica de las reservas grasas (engrasamiento), y quizás también la naturaleza “mosaico” de estas poblaciones. Los peces costeros de una talla de 63 cm habían consumido una media de 404 g de grasas para incorporarse a la pesquería, frente a los peces de talla similar situados a unas 1 000 millas mar adentro, antes de que diera comienzo la pesquería costera. Dos semanas más trade desde su llegada a la costa, los peces de tallas similares fueron muestreados de nuevo y su engrasamiento estaba de nuevo en la gama registrada en las muestras tomadas mar adentro. Estas observaciones obviamente son propias de depredadores muy móviles integradores de sistemas amplios.
Los cálculos anteriores pueden compararse con una igualmente interesante serie de estudios referidos a la natación de estadios larvarios. Vlymen (1974, 1977) demostró que las larvas de Engraulis mordax (anchoa de California) presenta un consumo de su respiración total por natación relativamente alto, es decir el 24,6 por ciento en condiciones medias de actividad en el caso de una larva de 1,4 cm. Las larvas de anchoa menores presentan una eficiencia menor debido a su esporádico comportamiento natatorio, incrementándose la eficiencia al crecer y asentarse en su modo de natación de impulso-y-planeo.
El análisis de Vlymen (1977) acerca de las microdistribuciones de alimento, crecimiento y comportamiento de las larvas de anchoa muestra la importancia de la sucesión de turbulencias y de otras discontinuidades oceanográficas para la supervivencia de las larvas de peces. (Estos conceptos son examinados en el N° 28 del “IOC Workshop Report”). En el medio marino se dan discontinuidades y distribuciones contagiosas de partículas y de organismos (Sheldon y Parsons, 1967; Sheldon, Prakkash y Sutcliffe, 1972; Platt y Denman, 1975, 1977; Owen, 1980), lo que influye profundamente en los procesos locales, y particularmente en la abundancia local desde depredadores primarios hasta terciarios, algo más tarde de que se haya producion la explosión e la productividad primaria (Sharp, 1981b). En general la sucesión de acontecimientos en el espacio y en el tiempo en las cadenas alimentarias marinas están correlacionados (Figura 59; Carlenton, 1985). La eficiencia energética relativa de los depredadores más móviles, secundarios y terciarios, por ejemplo los túnidos tropicales, en busca de una explosión de presas tras otra, es muy inferior a la de las larvas de peces o incluso a la de peces neríticos adultos. Esto lo muestran por ejemplo, Sharp (1983), Sharp y Dotson (1977), y Sharp y Francis (1976).
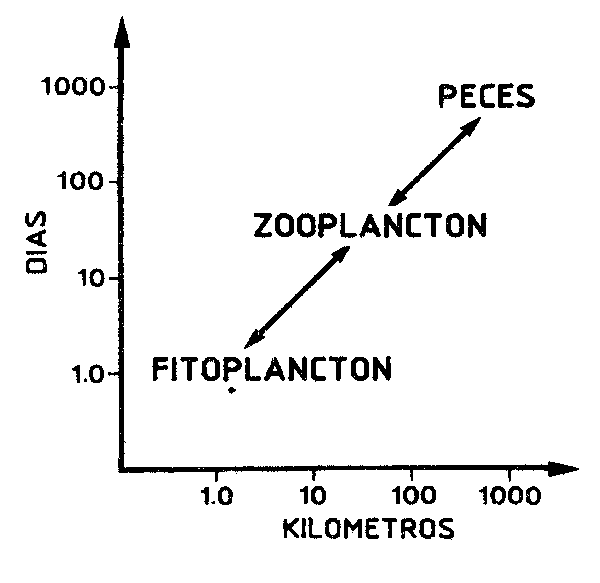
Figura 59 Relaciones escalonadas en el medio ambiente pelágico entre fitoplancton (P), zooplancton (Z), y peces (F) (Carlenton, 1985)
Al revisar los tópicos propios de las interacciones energéticas, con la finalidad de incorporar argumentos al conjunto de herramientas utilizadas en pesquerías, se muestra con claridad que existen una serie de conceptos semi-mitológicos en la ciencia de pesquerías que deben ser analizados con detenimiento, particularmente en relación a los efectos depredador-presa.
Uno de los primeros consistiría en asumir que la explotación de adultos de la especie A a priori daría paso a los más jovenes, de crecimiento más rápido y miembros más productivos de la misma especie. No está probado que este principio sea siempre correcto y emana del concepto de “capacidad de persistencia” inherente a muchos modelos ecológicos y de poblaciones pesqueras. Este asume que la biomasa de individuos de una especie dada que puede ser soportada por el medio ambiente es finita. Nos aproximamos a esta situación sólo cuando se dan, o una distribución de edad estable y en consecuencia unos requirimientos fijos, o cuando la población está compuesta de individuos idénticos, por ejemplo, células individualizadas en un medio estable y rico en un medio estable y rico en nutrientes. Estas condiciones pueden no ser aceptables en el caso de poblaciones de peces en la naturaleza debido al comportamiento y a las discrepancias energéticas entre especies y grupos de talla/edad de la mayoría de peces. Los adultos rara vez entran en competencia con estados juveniles o anteriores, y pueden ocupar loci diferentes en la red alimentaria. Excepto en el caso de los escómbridos por ejemplo Katsuwanus y Euthynnus, que carecen de vegiga natatoria o reservas grasas, y en consecuencia tienen unos elevadísimos requerimientos energéticos crecientes con la talla, los peces que van alcanzando las tallas mayores, por ejemplo por encima de 10 kg, pueden ser realmente más eficientes, desde un punto de vista ecológico, que los individuos menores. El caso más usual, no obstante, será que cualquier vacuum, ocasionado por la explotación de una especie A, es ocupado por otra especie, llamémosla especie B, con una capacidad reproductiva superior, un crecimiento más rápido y una tasa de renovación energética más eficiente, es decir ecológicamente más eficiente.
Estos comentarios por supuesto tienen validez justo hasta que la “capacidad de persistencia” actúa como limitante del tamaño de cualquier especie. Esto sólo ocurriría en estados adultos, en períodos de pesca escasa o nula y de abundancia extremadamente elevada. Las “limitaciones de la población” más corrientes pueden, no obstante, ser establecidas en base al “habitat de supervivencia” disponible para las larvas de los peces. Algunos años la capacidad de persistencia (K) requerida por una especie puede simplemente no tener un límite apreciable, o puede constreñir severamente sólo los estados larvarios o los primeros estados juveniles, de tal forma que la pesca de adultos tenga impactos sustancialmente pequeños en los cambios de la productividad de la población.
La asunción utilizada con frecuencia en los modelos simples de pesquerías monoespecíficas, de que las especies viven en un vacuum biológico con pocos o ningún efecto sobre otras especies relevantes de cara a su ordenación, no es tan fácil de utilizar en la actualidad. Las fluctuaciones en el tamaño del stock señaladas para especies migratorias y depredadoras tales como los bonitos (especie Sarda), caballas (especie Scomber) y barracudas (especie Sphyraena) indican que, sin duda, pueden darse importantes fluctuaciones en la mortalidad natural en todas las tallas y en todos los estadios de la vida de sus especies presa.
Todo esto nos lleva de nuevo al rompecabezas del rabil y de Auxis descrito por Olson (1982) y Sharp (1983a):
A modo de ejemplo de los efectos de “feedback” de un depredador potencial en los sistemas oceánicos, los estudios de Olson (1982) muestran que en el año 1970, el rabil sometido a explotación en el océano Pacífico oriental consumió un mínimo de 13 800 t de alimento cada día, incluyendo unas 2 000 t de Viciguerria sp. y cefalópodos, unas 2 500 t de Nomeidae y unas 5 300 t al día de otros túnidos, principalmente Auxis. Auxis por sí sólo representa alrededor de 2 millones de toneladas al año como mayor depredador consumido por la población explotada de rabil. (Esto equivale a la totalidad de túnidos capturados por el hombre cada año). La biomasa de Auxis es, probablemente, del orden de 5 millones de toneladas o más en el Pacífico oriental, y la depredación ejercida por el rabil deja un millón de toneladas adicional en el ecosistema como alimento para él o para otras especies. Auxis es sin duda uno de los escómbridos más voraces y ecológicamente ineficientes, que consume por encima del 20 por ciento de su biomasa diariamente. De tal forma que se podría pensar que serán necesarios unos 70 millones de toneladas métricas de escómbridos para ser consumidos como alimento por los Auxis supervivientes a la depredación ejercida por el rabil (equivalente a la captura total anual efectuada por el hombre en el mar: FAO, 1984). En tanto que se sospecha que Auxis ejerza el canibalismo y/o se alimente de larvas y juveniles de rabil, podemos anotar los efectos que se observan entre las poblaciones de Auxis y T. albacares debidas a la captura por parte del hombre de rabiles adultos (es decir T. albacares adultos): paradógicamente, la explotación de T. albacares podría significar una reducción de su reclutamiento debido a una mayor supervivencia de Auxis!
Auxis es realmente capaz de actuar como depredador sobre las larvas de rabil, pero sus hábitos alimentarios en el Pacífico oriental todavía no han sido estudiados. Yokota et al., (1961) examinaron los estómagos de 30 Auxis thazard capturados en aguas japonesas en 1959 y encontraron que su dieta incluía jóvenes Auxis y listado. Los calamares son citados por Arnold (1979) como “voraces depredadores que se alimentan cuando son jóvenes de macroplancton y posteriormente de pequeños peces”. Hurley (1976) lanzó la teoría de que las larvas de calamares son con probabilidad depredadores importantes de larvas de peces. Nosotros debemos empezar por analizar los hábitos alimentarios de estos miembros importantes de la cadena trófica pelágica que culmina en los túnidos con el fin de poder determinar las posibles relaciones depredador-presa, tan importantes para explicar las fluctuaciones naturales de la población (Olson, 1982) (ver también Caddy 1983, para conocer algunos detalles de las interacciones propias de los cefalópodos).
Probablemente es más importante el hecho de que la eficiencia de Auxis en la conversión de energía alimentaria en biomasa, es más baja, incluso, que la propia del rabil comentada en la primera parte. Esto sugiere que además de estar rebajando la talla media de los depredadores en el Pacífico oriental como causa de la intensa explotación a que se está sometiendo a los grandes rabiles, el hombre también podría estar disminuyendo la producción global de las especies de interés tales como el rabil al desviar el ecosistema a un modo más “disipativo”, y en consecuencia a una eficiencia ecológica menor de las especies tales como Auxis. Si esta cuestión fundamental puede ser dilucidada en la práctica, y Auxis (o Vinciguerria, Nomeidae o cefalópodos en este caso), pueden ser explotados, es otra cuestión. Es obvio que existen biomasas explotables más importantes, y que pueden incrementarse en tanto la explotación de los túnidos más valiosos da comienzo, pero es igualmente evidente que la energía invertida en la explotación de estas especies de pequeña talla deberá ser muy elevada y que sus perspectivas de comercialización serán menos prometedoras que en el caso de los túnidos.
Quizás un cambio fundamental en estos últimos años desde nuestro punto de vista, en lo reference a la aplicación de redes alimentarias a pesquerías comerciales, es la verificación de que si bien la productividad biológica de los medios marinos es superior a las estimadas con anterioridad debido al papel desempeñado por las pequeñas células fotosintetizadoras (cyanobacteria), cuya abundancia no ha sido previamente estimada por los oceanógrafos, una parte significativa de esta energía de la red alimentaria pasa a través de los componentes no interesantes desde el punto de vista pesquero, por ejemplo a través de organismos “gelatinosos” tales como salpas y medusas. Estos depredadores gelatinosos no están adecuadamente representados en la mayor parte de las muestras obtenidas mediante la mayoría de artes, y son bastante capaces de absorber, sin cambios dramáticos, la energía alimentaria no usada por los stocks comerciales de pequeños peces pelágicos abusivamente explotados.
Junto con la importancia del reciclado de energía, por ejemplo a cargo de los detritívoros, esto refuerza la conclusión de que las redes alimentarias centradas en especies demersales en la naturaleza, contrariamente a las experiencias de laboratorio, deben ser vistas como limitadas y abiertas o “permeables”, con la posibilidad real de que incluso después de que los principales vínculos de la red alimentaria hayan sido dilucidados, puedan existir todavía vínculos tróficos no definidos que sean significativos. Así mismo está claro que nuevas pautas pueden devenir importantes en estas redes alimentarias como resultado de intervenciones en el sistema.
La cuestión de los bucles de reajuste (“feed-back loops”) en los ecosistemas marinos sólo podrá ser planteada de forma correcta acudiendo a la bibliografía reciente y más relevante. Para abreviar, se trata de privar a estos procesos de su naturaleza sutil y extraordinaria. Quizás la mejor forma de iniciar nuestro análisis fuese con el artículo de Ursin (1982) en el cual se examina la relativa estabilidad de los ecosistemas marinos. Descubre que unos subcomponentes “triangulares” de las redes alimentarias pueden generar influencias altamente estabilizadoras. Esto se da a todos los niveles, desde los depredadores unicelulares o coloniales, hasta los peces, y demuestra que a cada nivel de la red alimentaria, la abundancia de los componentes individuales aparece localmente comprimida. Se facilitan algunos ejemplos (de Ursin) en la Figura 52. En un contexto pesquero, es importante anotar que en tanto el depredador dominante disminuye a causa de la explotación, normalmente se produce un incremento del depredador subdominante con una sustitución (parcial). Esta es una de las razones que explica porque al eliminar los depredadores superiores no se produce extraordinario incremento en los rendimientos de los peces presa tal como podrían predecir los modelos simples de redes alimentarias.
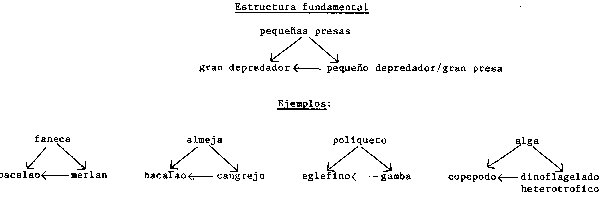
Figura 60 Componentes triangulares de redes alimentarias en ecología marina
Lo que también resulta evidente a la vista de estos componentes triangulares de las redes alimentarias es la importancia decisiva de la talla en el modelado de las redes alimentarias (ver Borgmann, 1983 y la Figura 46).
Jones (1982, 1982a) consideró una situación en que organismos individualizados se situarán por si mismos fuera de su habitat “más conveniente” y se vieran sometidos a una depredación mayor que el resto de la población, con lo cual se introduce un cierto reajuste (“feedback”) para compensar los cambios que se producen a corto plazo en la abundancia relativa.
En términos funcionales, los omnívoros (en un sentido más general que el del consumo de dos o más niveles tróficos) pueden contribuir a la estabilización de las redes alimentarias marinas. Estamos considerando de nuevo el impacto de la biomasa del depredador sobre su presa para superar las limitaciones de alimento en la biomasa del depredador. El control del depredador puede actuar cuando su biomasa es abundante con relación a la biomasa de la presa, pero sólo en el caso de que el depredador no dependa exclusivamente de uno o dos organismos para su alimentación. De forma alternativa el impacto causado cuando se controla la biomasa de la presa será mayor cuando el depredador es un obligado consumidor de la especie en cuestión. En su forma más simple, estos efectos recíprocos pueden ser modelados desarrollando los ciclos depredador-presa de Lotka-Volterra; como por ejemplo en Shirakihara y Tanaka (1981).
El problema de la eficaz localización de alimento cuando se dan variaciones estacionales es resuelto de diversas maneras: migraciones tróficas (desplazándose de un máximo de densidad de la presa a otro, que aparece temporal y espacialmente apartado), alimentación oportunista (cambiando de una especie presa a otra según sea su abundancia), y alimentación omnívora (alimentándose de más de un nivel trófico y/o rango de tallas). Otras posibilidades consisten en alimentarse de forma alternativa (por ejemplo, organismos intermareales), adaptarse a alimentarse de grandes partículas de alimento que existen en bajas densidades (es el caso de las especies abisales o de aguas profundas que con frecuencia consumen organismos de su misma talla), o convirtiéndose en comensales simbióticos o parásitos (como por ejemplo las remoras que son llevadas por los tiburones de un alimento al siguiente).
Otro modelo del ecosistema “a gran escala” diferente al de Anderson y Ursin (1977), que resulta enormemente interesante, es el desarrollado por Taivo Laevastu y sus asociados (Laevastu y Favorite, 1980; Laevastu y Larkins, 1981) tomando en consideración los factores medio-ambientales, pesqueros y el balance depredador-presa, y donde las tasas de la población (de crecimiento, mortalidad, etc.) se establecen en función de los cambios de biomasa contrariamente a la mayoría de los modelos de poblaciones que utilizan los cambios en el número de individuos (es decir que se usan tasas ponderales). La valoración de la competición entre la explotación ejercida por el hombre y el consumo de peces realizado por otros mamíferos marinos, es uno de los diversos resultados estimulantes de esta aproximación, evidenciando como los conflictos de intereses se muestran en los sistemas marinos como complejos bucles de reajuste (“feedback loops”). Por ejemplo, los esfuerzos para recuperar las poblaciones de mamíferos marinos pueden conllevar una disminución de la parte de peces explotables para el consumo humano en los ecosistemas de latitudes altas, lo que hace precisa una elección de la sociedad. Los principios naturales son suficientes, pero una vez definido el “punto de equilibrio” conveniente desde un punto de vista socio-político, no lo son tanto, de forma que los diversos objetivos precisan ser considerados in toto, y no como “problemas” separados, inconexos, resolviéndose cada uno en particular.
El reconocimiento de la complejidad de las interacciones que se dan en el mar no es más que una ayuda en nuestro proceso de reflexión acerca de lo que podemos esperar de la explotación del mar como un sistema con cambios de estado continuos en sus variables. La “estabilidad relativa” de Ursin no implica que el concepto de equilibrio sea siempre el más apropiado; implica simplemente que la energía no es desperdiciada.
De una forma sencilla, la productividad total de un ecosistema es la suma de la productividad de los componentes. No obstante, esto no simplifica de forma obvia la integración de los niveles tróficos y su producción con el fin de obtener una estimación de la producción de un sistema dado. El problema reside en las diferentes eficiencias propias de los diversos inter e intra niveles tróficos componentes, su distribución en el tiempo y en el espacio, el número de interacciones típicas que se dan en la red alimentaria, y las pautas vitales seguidas. Las variables eficiencias de los diversos grupos tróficos precisa en primer lugar, de series comparativas y del contraste con distribuciones, comportamientos, y desarrollos diversos.
Para analizar de una forma realista los ecosistemas, es necesario reconocer la variedad y la plasticidad inherente a las respuestas biológicas a las perturbaciones físico-químicas. Parece poco probable, en especial en los trópicos, que el concepto clásico, propio de medios terrestres, de los cambios sucesivos, pueda ser aplicado de forma indiscriminada, dado que todo cambio que se produce en el sistema debe ser aprovechado por una o más especies como una oportunidad que afectará a todos los estados futuros. Afortunadamente este aspecto de la ecología es ampliamente admitido en los trabajos recientes, y por ello nosotros nos reservamos cualquier comentario recomendando que los interesados en:
(a) el desarrollo de la diversidad de especies consulten a Huston (1979);
(b) el desarrollo de redes alimentarias consulten a Odum (1968), Pomeroy (1974) y Platt, Mann y Ulanowicz (1981); y
(c) la adaptabilidad biológica y la estabilidad de ecosistemas consulten a Conrad (1972, 1976) y Johnson (1981).
Eficacia ecológica
La eficacia o eficiencia ecológica viene generalmente expresada en términos de cambio de biomasa de una especie en relación al peso de biomasa consumida. Esto puede calcularse en forma de calorías, peso seco o peso húmedo.
La eficiencia de todo componente de un ecosistema depende de:
(a) la abundancia y concentración de cada alimento original componente en relación a su propia abundancia y concentración;
(b) la vulnerabilidad de estos alimentos originales;
(c) el trabajo invertido en buscar (encontrando o no) y en capturar estos alimentos;
(d) la proporción de estos alimentos que son asimilados en forma de energía utilizable, crecimiento y/o nutrientes vitales;
(e) la proporción de alimento disponible asimilado por cada componente para su crecimiento somático o reproductor;
(f) la complejidad de la organización somática del organismo.
Todo requerimiento energético de cualquiera de los componentes, es decir, su utilización de energía o de alimento puede ser descrita de la forma siguiente:
I = M + G + E
donde I representa la entrada de energía en forma de luz, proteínas, caroidratos, grasas que pueden ser controlados por medio de elementos trazadores como pueden ser el nitrógeno, el carbono, el oxígeno, etc., dependiendo de los organismos o sistemas a estudiar;
donde M representa la energía metabólica que normalmente puede ser utilizada en muy diversos tipos de trabajo metabólico resultado de la conversión bioquímica interna y finalmente se traduce en trabajo externo, desplazamiento de calor y en la simple y breve turbulencia remanente posterior a la realización de un trabajo por parte del organismo para vencer la gravedad o para efectuar un desplazamiento. (Nota: el mismo símbolo, M, es utilizado para designar la tasa de mortalidad natural, lo que pone en evidencia la falta de estandarización de los conceptos utilizados por los biólogos de campo y los que trabajan en el laboratorio);
donde G representa el crecimiento en términos de biomasa, sea crecimiento somático o reproductor, siendo esta la única variable que puede tomar valores positivos como negativos;
donde E representa la excreción, secreción o liberación de materia de origen orgánico (como pueden ser los exoesqueletos de los crustáceos).
Los requerimientos energéticos propios de un flujo óptimo o máximo de energía a través de un organismo dependen en buena medida de las características del medio y sobre todo en el caso de peces (poiquilotermos). La temperatura y la disponibilidad de oxígeno (o los niveles de dioxido de carbono o de sulfidrico que rodean al organismo) determinan los límites respiratorios de la mayoría de los organismos acuáticos. Aunque no es nuestra intención discutir aquí cuestiones relacionadas con la ecología fisiológica, se debe señalar que el oxígeno utilizado o la respiración de un ecosistema es una medida directa de su tasa de producción biológica (McNeill y Lawton, 1970). Como respuesta a la modificación de las variables mencionadas, se han desarrollado adaptaciones y especializaciones diversas dirigidas a paliar o evitar el “stress” como pueden ser el desarrollo de superficies respiratorias, pigmentos respiratorios y especializaciones bioquímicas/genéticas y circulatorias. Las habilidades de los organismos para persistir en medios difíciles o estresantes vienen determinadas por adaptaciones a los gradientes medioambientales y por la distribución no homogénea de los organismos utilizados como alimento. El almacenaje de energía excedente en forma de carbohidratos (por ejemplo, glicógeno) junto con los lípidos y las proteínas, para ser utilizada en trabajos metabólicos, incrementa la adaptabilidad del organismo a la variable disponibilidad de alimento, así como satisfacción de los diversos requerimientos de la éstasis; por ejemplo con el aumento de los lípidos incrementa la flotabilidad.
La movilidad propia de los diferentes estadios del desarrollo de los diferentes componentes de la red alimentaria no ha sido, habitualmente, considerada con la importancia que merece. De hecho, hasta hace poco no se ha dado la importancia debida a las escalas de espaciotemporales de las influencias biofísicas en el marco del ecosistema (Fasham, 1984; Owen, 1980; Sharp, 1980a; 1980b; Simpson, et al., 1979; Iles y Sinclair, 1982; Bakun y Parrish, 1980; Parrish, Nelson y Bakun, 1981). Quizás la forma más ilustrativa para iniciar la evaluación de las eficiencias ecológicas, sea el examen de los consumos de energía para desplazamientos en relación a la talla de organismo. Aunque no siempre, como ya se ha señalado, es frecuente que se indique de esta forma la posición trófica del organismo.
En la revisión de los microorganismos marinos llevada a cabo por Rheinheimer (1980) nos encontramos que muchas de las bacterias marinas son flageladas. La bacteria marina típica tiene una temperatura óptima situada entre 18° y 22°C, si bien se da una amplia banda de óptimos que incluidos psicófilos facultativos con óptimos por debajo de 0°C. Las bacterias generalmente son aerobias, pero pueden actuar con frecuencia como anaerobias. Son escasos los sustratos orgánicos de los cuales, las bactérias, no puedan derivar nutrientes, incluso los componentes inorgánicos también pueden ser utilizados como fuentes de energía por algunas. Una importante fuente de nutrientes es la liberación o la excreción de los nutrientes necesarios para el crecimiento de las bacterias por parte de los productores primarios (fitoplancton) así como por otros organismos, vivos o muertos. La actividad de una bacteria se limita a una reducida escala, si bien ello no constituye el principal factor limitante de su distribución. Obviamente las pequeñas partículas son dispersadas, sobre todo por las turbulencias de mezcla a todas las escalas, hasta llegar a las corrientes oceánicas. Esto posibilita el que las bacterias puedan localizar fuentes de alimento “locales” y al mismo tiempo hace que las bacterias sean accesibles a los organismos que se alimentan de ellas.
Las bacterias son unas magníficas oportunistas, con una de las mayores eficiencias de conversión potenciales posible: del orden del 50 al 60 por ciento. Las bacterias marinas se encuentran en altas densidades en las zonas costeras y en los sedimentos donde muchos organismos bentónicos dependen de ellas para su alimentación. Los copépodos y otros pequeños crustáceos del zooplancton (por ejemplo las larvas de langosta) se alimentan de bacterias (Rheinheimer, 1980). Los ciclos de abundancia y escasez debidos a la presión alimenticia ejercida sobre las bacterias se evidencian rapidamente al igual que en las poblaciones de los depredadores. Los cianofitos bénticos son explotados por rotatorios, nematodos, crustáceos y otra micro y meiofauna y los cianofitos planctónicos son comidos por el plancton y por peces suplementariamente, pero decrecen en importancia una vez que los depredadores aumentan de talla.
Muchos organismos fitoplanctónicos no son móviles, con lo que su supervivencia es estrictamente una función de las condiciones del lugar donde se encuentran, es decir la luz, del nitrógeno y de otros nutrientes esenciales, de las turbulencias locales y del nivel del sistema de transporte, que deberá mantenerse en unos niveles aceptables. Por contra existe un fitoplancton móvil (flagelados) e incluso algunas bacterias, que teóricamente son capaces de resistirse a turbulencias disipadoras o disrupciones a bajos niveles de energía. Todas estas especies en gran manera dependen de sistemas de transporte físico para su distribución, sus necesidades fisiológicas y para la localización de alimento para mantener su productividad. En este sentido son altamente “eficientes” como individuos muestreadores de un vasto e indeterminado volumen y que no necesitan invertir grandes proporciones de su energía metabólica en natación tal como hacen muchas especies de niveles tróficos superiores.
Las larvas de peces y los estados planctónicos de otros organismos pueden incidir intensamente sobre los elementos fitoplanctónicos unicelulares y coloniales. Sus tasas de conversión y producción varían enormemente, dependiendo de la movilidad de cada especie (Theilacker y Dorsey, 1980), y de factores tales como la distribución o concentración de los elementos alimenticios buscados en cada caso (Vlymen, 1970; Beyer, 1981; Beyer y Laurence, 1981). La cuantificación de la productividad de las poblaciones de peces no es fácil de relacionar con el paso de los estadios larvarios a adultos, puesto que cuando los estados postlarvarios o juveniles devienen móviles se hacen más difícilmente capturables. Muchas larvas de peces también son difícilmente capturables debido a sus distribuciones críticas o muy dispersas.
Una muestra interesante de la importancia del reciclado de detritus en el medio planctónico la conforman los pequeños crustáceos que se constituyen en elementos importantes de este sistema. Lasker (1966) refiriéndose al eufausiáceo Euphausia pacifica señala que en períodos de tres o ocho días efectúa mudas, dependiendo de la temperatura e independientemente de la cantidad de alimento ingerido. La contribución al detritus con el exoesqueleto mudado representa el 10% del peso (seco) del cuerpo del individuo, es decir que es igual a la biomasa media de la población de eufausiáceos cada cincuenta días, habiéndose aventurado la cantidad de 1,5 g/m². Juntamente con los exoesqueletos abandonados por otros crustáceos planctónicos, este componente podría representar una parte significativa del balance energético de los detritívoros de las cadenas tróficas marinas, además de la materia fecal y de las partículas alimenticias perdidas en la ingestión.
Hay muchas diferencias en las formas y la relativa habilidad para la natación de los organismos planctónicos, desde el arrastre pasivo, hasta la práctica independencia de los transportes físicos locales. Por ejemplo, Vlymen (1970) calculó el consumo proporcional de energía de Labidocera trispinosa, un copépodo calanoideo, debido al comportamiento migratorio vertical, y a sus aceleraciones características a modo de breves impulsos propios de su comportamiento esquivo. El valor relativo del consumo total de energía para mantener su actividad en proporción a la respiración total, es del orden de 0,1 a 0,3 por ciento. Esta eficiencia realmente increíble está directamente relacionada con las altas aceleraciones de que hacen gala estos copépodos.
En una serie similar de estudios realizados sobre la energía propia de la natación de larvas de peces, Vlymen (1974, 1977) demostró que las larvas de Engraulis mordax (anchoa de California) poseen un consumo de su balance respiratorio total relativamente elevado a causa de la natación, 24, 6 por ciento en condiciones de actividad media en el caso de una larva de 1, 4 cm. Weihs (1980) también demostró que la razón por la que las larvas de engráulidos recién nacidas nadan a impulsos durante los primeros días, consiste en que resulta más efectivo para los peces de una longitud total inferior a 5mm. Por encima de esta talla, el sistema de impulso-y-planeo resulta más efectivo que la natación continua. No obstante, los carángidos, o mejor, los ecombrioformes son más eficientes que los anguiliformes (anguilas) si mantienen una actividad natatoria continua, de aquí los diferentes modos de natación de engráulidos y las caballas.
El análisis de las microdistribuciones de alimento, del crecimiento y del comportamiento de las larvas de anchoa llevado a cabo por Vlymen (1977) muestran de forma directa la importancia de los fenómenos físicos de turbulencias graduales o discontinuas, para la supervivencia de las larvas de peces. Como ya se ha indicado, en el medio marino se da una distribución de partículas y organismos, amplia y discontinua (por ejemplo, ver IOC Workshop Report N° 28. Sheldon y Parsons, 1967; Sheldon, Prakash y Sutcliffe, 1972; Platt y Denman, 1975, 1977; Owen, 1980). Esto tiene efectos importantes en los procesos locales, y en particular en la abundancia de depredadores primarios a terciarios, algún tiempo después de producida la explosión de producción primaria (Sharp, 1980b). La eficiencia energética relativa de los depredadores secundarios y terciarios más móviles yendo de una explosión del escalón primario a la siguiente, está muy por debajo de la de las larvas de peces, o incluso de la de los peces neríticos adultos.
La eficiencia de las conversiones caloríficas dependerá de la energía disipada a causa de la natación, del valor calorífico o nutritivo del alimento y de la distribución del alimento. Experimentos de laboratorio realizados con dos especies de Engraulidae muestran una eficiencia en la conversión calorífica de los adultos de alrededor del 12 por ciento (Hunter y Leong, 1981). Estos autores también discuten acerca de la proporción de este alimento que es invertida en crecimiento y en reproducción para cada clase de edad de hembras de anchoas del norte. A continuación se incluye un Cuadro que resume los resultados obtenidos.
| Edad | Peso | Porcentage de ración | Ración | |
|---|---|---|---|---|
| (yr) | (g) | Crec. | Reproducción | (cal) |
| 1–2 | 7,33–13,25 | 5 | 8 | 127 |
| 2–3 | 13,25–19,33 | 3 | 10 | 214 |
| 3–4 | 19,33–24,69 | 2 | 11 | 312 |
La proporción de alimento para crecimiento desviado hacia la reproducción lógicamente va asociada a una reducción de la tasa de crecimiento que en la mayoría de las especies se produce al aproximarse a la madurez. Un gran número de datos referidos a experiencias de laboratorio y en habitats controlados sobre crecimiento y fisiología (por ejemplo referidos a acuacultura) han sido recopilados por Brett y Groves (1979), Brett (1979) y Ricker (1979). Las “observaciones medias” acerca del balance de energía de los peces que ofrecen Brett y Groves (Figura 18, p. 337, 1979) se resume a continuación:
| Aprovechamiento | Pérdidas | |
|---|---|---|
| Energía ingerida Heces | 100% | |
| Heces | 20% | |
| Energía digerible Pédidas no fecales | 80% | |
| Pédidas no fecales | 7% | |
| Energía metabolizable Pérdidas en forma de calor | 73% | |
| Pérdidas en forma de calor | 14% | |
| Energía neta utilizable Para mantenimiento del metabólismo Pérdidas en forma de calor | 59% | |
| Para mantenimiento del metabólismo | 7% | |
| Pérdidas en forma de calor | 30% | |
| Energía neta utilizable para crecimiento y para mantener la actividad (Eficiencia en la conversión): | 22 por ciento | |
Señalemos que el crecimiento y los componentes activos del metabólismo están en la misma línea, de forma que están completamente interrelacionados (el nivel de actividad determina el crecimiento en unas condiciones físicas y de nivel de consumo de alimento dadas). El valor real de la eficiencia, como se ha venido indicando en el presente documento, depende sobremanera de la talla corporal y del nivel de actividad. Jones (1982) señala que la eficiencia en la conversión de energía asimilada por los tejidos corporales (crecimiento), es superior en los estadios juveniles, y disminuye con la talla y con la edad llegando a valores próximos a cero en los peces viejos. No obstante, Jones sugiere que en general, en los peces adultos (de talla próxima a la talla comercial) el valor del 10 por ciento estimado por Slobodkin (1961) puede ser bastante apropiado.
Intentos recientes de relacionar de forma directa el consumo metabólico para mantener la actividad, con las tasas de crecimiento observadas (Kerr, 1982), precisan de una revisión a la luz de los conocimientos actuales acerca de la relación entre la energía de la natación y la distribución no uniforme de los recursos alimenticios. Un pez con una estrategia alimenticia pasiva (por ejemplo un ejemplar en el laboratorio), responde de forma positiva al ofrecimiento de alimento hasta la saciedad, en tanto que en la naturaleza los peces que se mantienen permanentemente nadando deben compensar la energía invertida en los desplazamientos entre concentraciones de alimento, e integrar la disponibilidad- vulnerabilidad de los recursos alimenticios existentes en el medio como un todo (Vlymen, 1977; Sharp y Dotson, 1977; Sharp y Francis, 1976; Olson, 1982; Carey y Olson, 1982). Realmente, los cambios en la temperatura y en el oxígeno, de carácter estacional, las variaciones producidas, a largo o corto plazo, en la acumulación o distribución de las presas, y la densidad local de especies competidoras, determinan el consumo necesario para mantener la actividad, siendo el crecimiento y el desarrollo de las células reproductivas un simple reflejo de la acumulación de energía por encima de la precisa para el mantenimiento y para la obtención de alimento. Los peces, a modo de estrategia evolutiva general, también pueden utilizar de forma alternativa la energía invertida en el crecimiento somático y la destinada a reproducción.
En la naturaleza, los parámetros fisiológicos tales como las tasas de respiración, excreción, reproducción y crecimiento deben ser tomados como constantes en unas condiciones preestablecidas. Parafraseando a Ricker (1979), no es probable que los organismos acuáticos presenten relaciones sencillas entre las tasas de ingestión y el crecimiento o la producción subsiguiente. Es preciso obtener datos acerca del crecimiento y observarlos en el contexto de las condiciones ambientales, siendo la temperatura la primera variable a controlar. No obstante, como se acaba de señalar, la distribución espacial y la abundancia de las partículas de alimento y el trabajo preciso para que un organismo las obtenga, también son importantes.
Aunque se han hecho muchas consideraciones generales centradas en el coste de la locomoción, en particular con referencia a los peces (Hoar y Randall, 1978; Webb, 1975), es todavía inusual la consideración del “trabajo realizado” como una variable estrechamente ligada al contexto natural, en lugar de utilizar la bibliografía o estimaciones de este consumo de energía extremadamente variable derivadas de experiencias de laboratorio. Antes de que estas variables pueden ser cuantificadas en
la práctica será preciso un esfuerzo muy considerable, y lo que se pretende en este capítulo consiste, principalmente, en establecer una introducción a estos conceptos aún difíciles de cuantificar.
Muchos, o incluso la mayor parte de los organismos del medio ambiente marino inician su vida en el plancton, y después se produce la transición, al aumentar su talla a los niveles tróficos superiores. A pesar de que el crecimiento y la capacidad de persistencia constituyan objetivos superados entre los organismos marinos, a escalas pequeñas de tiempo y distancia, se precisa una eficiencia superior para satisfacer estos requerimientos energéticos, aun siendo suficientemente abundante en un medio difícil para que sea utilizable de forma individual.
La relación general entre la talla de reproducción y el tiempo del ciclo (turnover) en el medio marino, es una indicación clara de que a pesar de las grandes variaciones existentes en la talla y en la forma del cuerpo, el comportamiento, la movilidad y las preferencias alimenticias, se dan unas ciertas limitaciones de energía a cada escala con el fin de asegurar la persistencia de los organismos y el potencial colonizador.
Desarrollándose a partir de simples reproducciones de carácter fisil, y mediante la encapsulación de grandes embriones o de estrategias ovovivíparas, la motivación evolutiva para hacer más complejas la reproducción y el desarrollo parece ser uno de los mayores requerimientos de energía, con la finalidad de situar huevos fertilizados en un medio de cría “protegido” (Alvariño, 1980; Sharp, 1980a, 1980b). ¡Parafraseando el cuento del huevo y la gallina, sería equivalente a la definición de un organismo y su estrategia vital como la forma en que un huevo asegura la supervivencia de otro huevo! En términos prácticos, las estrategias vitales y las adaptaciones parecen estar dirigidas de forma conjunta a la optimización tanto del número de huevos puestos en el medio inmediato, como de la selección de aquellos estadios larvarios o post-larvarios y de los desarrollos característicos que proporcionen las mejores oportunidades a los gametos para ser depositados con mayor probabilidad en unas condiciones de cría lo más seguras posible. La evitación de riesgos (individuales) importantes, por medio de la fecundación interna, es una solución que estabiliza el medio del embrión, y permite a los jóvenes incorporarse al ecosistema con unas tallas mayores y aparentemente más seguras. La cría de los jóvenes en el caso de especies que muestran un cuidado por parte de los padres, traslada el énfasis de la selección natural de los problemas de desarrollo a corto plazo de tiempo y distancia, es decir aquellos que se refieren a la distribución de huevos y larvas, a los que afectan a los adultos. Esto podría sugerir que la energía consumida por un pez adulto, bien podría ser menor en los peces ovovivíparos, muy evolucionados o en aquellos que presentan un cuidado de los padres a sus crías que en los que producen millones de huevos y una escasa supervivencia. No obstante, el número de jóvenes producidos por los ovovivíparos es menor, (estrategas de la K) y ello limita la tasa de colonización de los medios vacantes. Lo que contrasta de forma bien definida con la situación de las especies muy fecundas con huevos pelágicos (estrategas de la r). Estas diferentes capacidades de las larvas pelágicas y de los jóvenes recién nacidos ciertamente establece las bases de unos requerimientos medioambientales de los jóvenes muy diferentes, tanto como lo condicionen las diferentes presiones de selección implicadas.
Los huevos de especies ovíparas, al igual que el fitoplancton, son arrastrados por las turbulencias, a no ser que la puesta se efectue sobre un sustrato, sea flotante (como es el caso de los peces voladores Hirundichthys), o sobre el fondo, como por ejemplo el arenque (Clupea sp.) o sea demersal, es decir más densa que el agua de mar, y se hunda hasta el fondo donde las turbulencias juegan un papel más útil en su desarrollo. Este último tipo de huevos miden entre unos 0,5 mm y 3,5 mm, siendo los huevos pelágicos de alrededor de 1 mm de diámetro. La larva eclosiona transcurrido un cierto tiempo, dependiendo sobre todo de la temperatura (Theilacker y Dorsey, 1980), y durante algunos días, alrededor de diez, desde la eclosión se vale de su saco vitelino para asegurar el desarrollo. Una vez agotado el saco vitelino, cuenta con alrededor de una semana para encontrar alimento. El tiempo invertido en el proceso, en relación con la disponibilidad de alimento apropiado y la abundancia de depredadores es obviamente crítico (Alvarino, 1980).
Parrish, Nelson y Bakun (1981) describen las discontinuidades zoogeográficas en la corriente de California, definiendo diversos habitats pelágicos, cada uno con sus transportes locales característicos. Cuando la dominancia corresponde a los transportes costeros, la mayoría de las especies de peces carecen de huevos epipelágicos, abundando los ovovivíparos (por ejemplo Sebastes sp.), y predominantemente se producen huevos demersales. En cambio cerca de los giros oceánicos aparecen peces pelágicos con huevos epipelágicos y larvas. Por otro lado, las especies pelágicas de hábitos más migratorios aparecen estacionalmente, penetrando en el sistema costero en busca de zonas de alevinaje apropiadas. Cuando las encuentran efectúan la puesta y parten de nuevo. Como vemos desde la propia perspectiva del habitat de cada organismo, los problemas de transporte de energía y de materia hacia y desde cada localización consiste en un problema de movilidad o de dimensiones del habitat, para cada uno de los diversos depredadores y de sus componentes alimentarios.
La variedad de las comunidades de plancton en relación a su movilidad es tremenda, con formas móviles que recorren kilómetros en períodos de una semana o menos, o por el contrario otras que dependen para su dispersión de procesos físicos de transporte de la columna de agua que ocupan.
Las formas marinas menos móviles, pequeños invertebrados, huevos y larvas de peces y las especies que les sirven de alimento, se distinguen por desarrollar sus interacciones a una escala de metro-día (Sharp, 1980a), mientras que los peces más móviles exploran kilómetros en períodos de semanas o días. Las especies de mayor talla, más migratorias (exploradores) distribuidas en todos los océanos con una escala temporal de años, agotan concentraciones de alimento “locales”, aportan o retiran energía o materia, y la transportan o disipan a grandes distancias. Cada una de estas situaciones deberá ser tenida en cuenta cuando se muestree la población o cuando se proceda a la interpretación de los datos de experiencias de campo o de laboratorio.
TOP NEXT