Recientemente se han logrado importantes progresos en cuanto a la comprensión de los sistemas marinos, y en este sentido se pueden citar textos tales como los de Longhurst (1981) o Platt y Ulanowicz (1981) como descripciones del pensamiento actual en el campo de la oceanografía biológica. Diversas descripciones y mecanismos generales evidencian la importancia de la producción biológica en los océanos, pero hasta ahora, las posibilidades de elaborar predicciones de qué cantidad de esta producción y de qué forma se incorpora al rendimiento pesquero, son todavía limitadas. Partiendo de un examen de la información disponible acerca de las tendencias de los desembarcos de aquellas pesquerías de las que se cuente con largas series históricas de datos Caddy y Gulland (1983) distinguieron de forma empírica cuatro clases de stocks de peces:
(1) aquellos para los que una situación de equilibrio podría asumirse para un período de tiempo significativo;
(2) pesquerías cíclicas caracterizadas por fluctuaciones en los desembarcos con una aparente periodicidad regular.
(3) aquellas que presentan fuertes irregularidades en los desembarcos de un año a otro; y
(4) pesquerías caracterizadas como irregulares o transitorias. Obviamente esta clasificación es empírica, por cuanto los desembarcos están afectados tanto por las “variaciones” en el esfuerzo pesquero (Caddy, 1983), como por los factores ambientales per se, actuando a través del mayor o menor éxito en los reclutamientos de un año a otro (ver Holden, 1978, que cita algunos ejemplos referidos a una de las áreas marinas más estables, el mar del Norte).
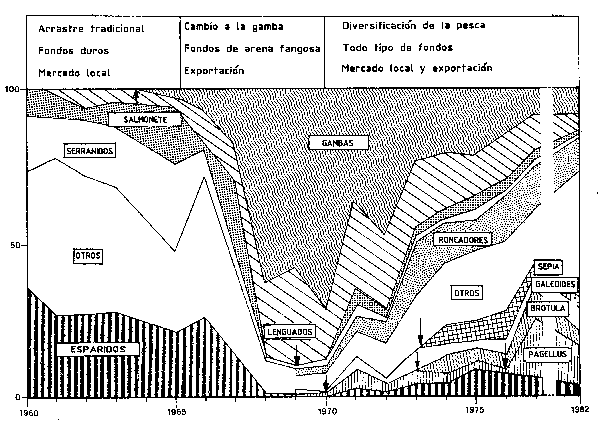
No obstante el punto más interesante, consite en que en una visión retrospectiva, la estadística pesquera de este siglo sugiere que las especies (y las áreas) en que las asunciones de equilibrio parecen ser válidas son relativamente escasas en número y en duración. De forma recíproca, entre las áreas pesqueras más productivas encontramos áreas de elevados, aunque irregulares, rendimientos pesqueros, por ejemplo, el afloramiento de Perú (Rasmusson, 1984) y la corriente de Kuroshio (Kondo, 1980; Kawasaki, 1980). Lo normal parecen ser las fuertes variaciones a largo plazo de las condiciones hidrográficas, y en consecuencia en los niveles de producción y en las especies dominates, y que los organismos existentes en cada momento acomodan sus ciclos vitales a la situación en que se desenvuelven (Cuardo 10). Resulta innecesario indicar que la persión de pesca ejercida por el hombre y las variaciones en la estrategia de explotación (ver como ejemplo la Figura 61), también pueden influir de forma significativa en la composición de especies, incluso en estas áreas, si bien es preciso situarse en el contexto apropiado de “capacidad de persistencia” el medio para las especies en cuestión.
Asimismo cabe señalar que las evaluaciones de recursos, al carecer frecuentemente de los datos precisos referidos a períodos de tiempo suficientemente extensos, han tenido a reducir las “asunciones de equilibrio” a periodos de 10–12 años. Otros factores que aconsejan precaución de cara a posibles aplicaciones poco críticas de las asunciones de equilibrio en evaluaciones de stocks monoespecíficos, antes de que el contexto ecológico y medioambiental de las especies en cuestión haya sido considerado, son las interacciones multiespecíficas.
En general, el “éxito” relativo de cada generación de peces viene determinado por el acierto con que resuelven la serie jerárquica de requerimientos, relacionados con la supervivencia, que caracterizan cada estadio de su vida. La situación es compleja, y Bakun et al. (1980) se refieren a este “preciso” período denominándolo “umbral de supervivencia”. En latitudes altas las posibilidades de culminación de los primeros períodos de la vida están íntimamente ligadas al breve ciclo estacional de producción: la explosión primaveral. Casi todas las especies ajustan sus períodos de reproducción a esta explosión, y un buen número de especies poseen mecanismos propios para localizar condiciones y lugares de reproducción ideales. Consecuencia de esto es el escaso número de especies que han evolucionado adaptándose a estas breves y localizadas compulsiones, en comparación con el número de especies que encontramos en latitudes tropicales. No obstante ésto no impone límites absolutos al potencial productivo de los sistemas de altas latitudes, ya que las bajas temperaturas, la escasa complicación de las redes alimentarias y la longevidad de unas especies con limitados movimientos migratorios, tienden a convertir a los sistemas de latitudes altas en ecológicamente más eficientes que los sistemas tropicales, es decir en sistemas en los que la producción de biomasa por unidad de energía introducida es mayor.

Figura 61 Combios en el porcentaje de las especies componentes de los desembarcos de la pesquería de arrastre de Senegal. Las flechas indican la aparición de nuevas especies objectivo en la pesquería (Gulland y Garcia, 1984)
La enorme productividad de, por ejemplo, la corriente de Perú antes de la caída de la anchoveta peruana, puede con toda probabilidad ser atribuida a la gran magnitud del sistema de afloramiento, aunque no se puede dejar de lado la baja posición ocupada por la anchoveta en la red alimentaria con relación, por ejemplo, a arenques y sardinas. Perú y Chile al principio de los años 80 sólo alcanzaron una pequeña parte de la biomasa de anchoveta alcanzada en los años precedentes. Esto puede ser explicado en parte como consecuencia de las diferentes posiciones que cada especie mantiene en la red alimentaria, como también por diferentes eficiencias ecológicas resultantes de los diferentes modos de natación utilizados por la anchoveta y la sardina respectivamente (Sharp, en prensa; Weihs, 1973; Ware, 1975, 1980). Ursin (1982) ha sugerido que durante la caída del stock de anchoveta, se puede pensar que los invertebrados herbívoros aprovecharon el “vacío” dejado por la ausencia de anchoveta, con lo que quedó una menor energía disponible para los peces comercialmente explotables. Es probable que ambos mecanismos actúen conjuntamente, y este cambio en la dominancia de especies puede reflejar la existencia de una nueva variable: la influencia sobre los pequeños pelágicos para que se produzca un cambio en su habitat preferido. (Resulta interesante señalar, no obstante, que en 1986, después de un período de aplicación de un esfuerzo pesquero reducido sobre la anchoveta, en el que se han dado condiciones favorables evidentes para el crecimiento de la población, se ha producido una recuperación significativa del stock de anchoveta.)
Hasta hace poco, no ha sido frecuente el que se cuestionaran las ideas acerca de la estabilidad de los sistemas tropicales multiespecíficos, exceptuando en lo que se refiere a los efectos de la soprepesca. Existen, no obstante, ejemplos diversos propios de pequeños pelágicos en áreas de afloramiento (por ejemplo, Ophistonema sp. y Cetengraulis sp.) en los que se observan importantes fluctuaciones en la abundancia, como en América Central y del Sur y en Baja California donde la presión pesquera es escasa o nula, y observaciones similares se pueden hacer en diversos lugares (Troadec, Clark y Gulland, 1980). Los espectaculares cambios en la dominancia de especies como es el caso de la explosión del stock de Balistes sp. en el golfo de Guinea (Figura 62), puede relacionarse en parte con la sobrepesca de Sardinella, pero el factor medioambiental aparece como decisivo.
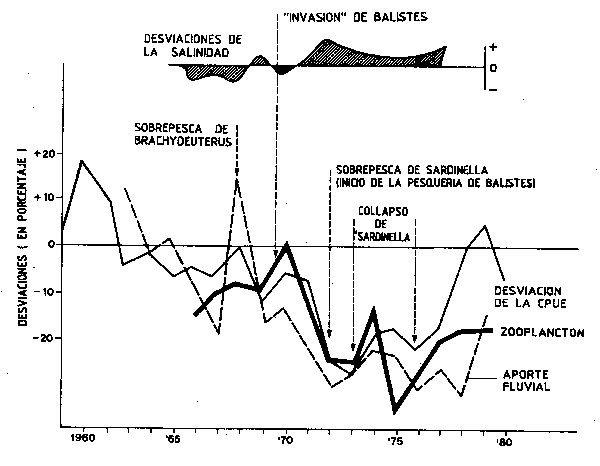
Figura 62 Tendencias de las desviaciones de los aportes fluviales, abundancia planctónica, salinidad y acontecimientos de la actividad pesquera propios de la pesquería de arrastre de Côte d'Ivoire en relación con los cambios de especies componentes del recurso (colapso de Sardinella sp. e irrupción de Balistes sp.) (de Gulland y Garcia, 1984)
En el caso de pesquerías litorales o de plataforma de los trópicos, tales como las del Pacífico Suroriental, el número de especies consideradas en un lugar dado puede ser relativamente grande en comparación con las pesquerías litorales o de plataforma de altas latitudes, si bien las diferencias que se dan entre áreas contiguas también son probablemente considerables en áreas tropicales debido al, relativamente, mayor número de especies y a su distribución más reducida y dispuesta a modo de mosaico. La integración de las estadísticas de captura en un área amplia en el caso de recursos litorales de los trópicos con un alto grado de regionalización en la ordenación, tenderá a amortiguar estas diferencias, enmascarando las características y la magnitud de las poblaciones que ocupan espacios reducidos.
Estimaciones de carácter ecológico de la diversidad y de la estabilidad se han definido también en el contexto terrestre para áreas relativamente pequeñas, tomando como unidades de referencia, por ejemplo en el caso de prados, metros o kilómetros, en comparación con las unidades de ordenación de decenas o cientos de kilómetros utilizadas en la mayoría de pesquerías de altas latitudes (ver la revisión de carácter teórico de Pielou, 1969). En áreas homogéneas se han llevado a cabo inventarios de especies y descripciones de poblaciones, de tipo ideal, y la representación de los cambios, o de las diferencias, podrían asociarse de una forma ideal a discontinuidades del habitat. El principal problema propio de la naturaleza del “muestreo a distancia” de muchas de las investigaciones pesqueras (por ejemplo, la “integración” de dos o más comunidades de peces en un mismo lance de arrastre de fondo efectuado a lo largo de varias millas), hace que este muestreo ideal sea difícilmente realizable, y es importante tenerlo en cuenta cuando se aborda el análisis de tales prospecciones.
Al planificar campañas de investigación pesquera, puede no darse la suficiente importancia a la financiación del proyecto en su totalidad y a los ejercicios de identificación, incluso en el caso de que se haya sugerido la realización de un “cartografiado” preliminar de habitats, comunidades y recursos y el análisis de la información resultante (Caddy y Garcia, en prensa), como esencial para la evaluación de los stocks, al igual que en el caso de la planificación de los recursos litorales y de los estudios del impacto de la contaminación. Estas detalladas investigaciones acerca de la estructura de las comunidades marinas por lo general se han limitado a los medios marinos muy próximos a la costa donde se ha producido una gran transferencia de métodos propios de la ecología terrestre. Estas investigaciones, especialmente en arrecifes o zonas de barreras rocosas (epifauna o comunidades que “viven en el fondo”), sugieren que la “estructura de detalle” de las comunidades del fondo en la plataforma poco profunda es del mismo orden que la de las comunidades terrestres, como podrá testificar cualquiera que se sumerja en un arrecife de coral. Este no es el caso de las comunidades de la infauna del fondo de la plataforma y de mayores profundidades (ver por ejemplo, Thorson, 1957), si bien en este caso las unidades ecológicas utilizadas probablemente también serán menores que lo que puede parecer a primera vista.
Así las estimaciones de la estabilidad y la diversidad se verán más o menos afectadas por la escala considerada (tiempo y espacio) según sea su conceptualización. Un estudio de comunidades con numerosas especies migratorias podrá mostrar una situación estable si se efectúa un muestreo al año, mientras que resultará muy lejos de la estabilidad si los muestreos se efectúan con una frecuencia mensual. Si nos basamos en coordenadas geográficas en lugar de las características del habitat para establecer límites estadísticos podremos causar impactos muy importantes en lo referente a la caracterización de situaciones diversas propias del medio marino. El fenómeno de El Niño observado en el período 1982–83 afectó significativamente a la fauna a las islas costeras ecuatoriales del Pacífico, con la desaparición de algunas especies en comunidades de atolones y arrecifes causados exclusivamente por cambios en los vientos y las subsiguientes variaciones en las corrientes. Las zonas costeras de transición que delimitan las aguas tropicales y subtropicales, también se han visto modificadas en el Pacífico oriental desde alrededor de 1978 (Sharp y Csirke, 1983). Estos cambios podrían haber confundido cualquier muestreo o sistema de ordenación basado en críterios geográficos, en el caso de que se hubiera pretendido limitar la captura de alguna especie en particular en las zonas de transición. Mientras que los estudios de estabilidad-diversidad llevados a cabo tanto en las islas del Pacífico como en el litoral continental, tienden a mostrar la desaparición de algunas especies, relacionada con cambios de los índices de estabilidad y diversidad, los muestreos basados en unidades geográficas amplias y fijas han explicado la causa real de los desplazamientos de estas especies. Algunos stocks pueden aparentar una disminución y otros stocks y especies pueden de forma imprevista devenir abundantes en otras áreas estadísticas, pero el desplazamiento de los límites de distribución de las diferentes especies pueden no resultar tan evidentes. Un fenómeno de este tipo parece que se ha producido en Africa oriental en los últimos años.
Sharp y Csirke (1983) dan ejemplos de cambios importantes en la abundancia, distribución y especies componentes de pesquerías neríticas a lo largo del mundo. Incluso en el caso de que una pesquería tienda a englobar a más de un stock y a especies que conforman unidades de explotación que pueden constituir o no una población bien delimitada, las inestabilidades de un buen número de poblaciones neríticas sean demersales o pelágicas resultan bastante evidentes si nos fijamos en los datos de explotación. Como ya se ha indicado, las poblaciones que se mantienen estables constituyen un caso relativamente raro si nos basamos en escalas temporales de carácter histórico, y la diversidad ecológica también estará sujeta a los cambios que se produzcan en aquellos medios donde tiene lugar una actividad pesquera ejercida sobre poblaciones inestables. La agregación de poblaciones constitutivas de un recurso debido a la movilidad de la flota pesquera con frecuencia enmascara la escala espacio-temporal de la variabilidad de estas poblaciones, y se hace preciso que los datos pesqueros se tomen en base a los desembarcos referidos a su área/momento de captura antes que (optar por la fácil solución de) por barco y puerto de desembarco.
Como se ha sugerido, los ciclos vitales de un sõlo año propios de un buen número de especies que viven en áreas tropicales de plataforma, presentan grandes fluctuaciones de la abundacia, y estas poblaciones comparten algunas de las características del tipo “explosión de decadencia” típicas de las formas planctónicas, de vida corta, de altas latitudes. Esta característica se debe, en parte, a la falta de correspondencia entre la composición de las capturas o la abundancia relativa de las especies en pesquerías separadas por menos de cincuenta millas náuticas (por ejemplo en el archipiélago indonesio; Pauly, comunicación personal; Bakun et al., 1980). Si verdaderamente este es el caso, entonces es probable que lo que podemos encontrar en cualquier momento es el resultado de “colonizaciones locales” de éxito diverso realizadas por diferentes especies de un conjunto de especies oportunistas que operan en un incierto contexto de freza. La magnitud de los cambios en la abundancia de las especies dominantes de un año a otro, y de un lugar a otro, puede con frecuencia ser considerable. Según que los requerimientos específicos de los primeros períodos de la vida sean satisfechos o no, la presencia o ausencia de depredadores y el impacto de una explotación intensiva de carácter local o la veda estacional para la pesca litoral, todos facilitan el que las larvas, los juveniles o los adultos puedan ser retirados del sistema o alternativamente proporcionan el tiempo necesario para crecer y para reproducirse. El que las estadísticas de captura aparezcan como relativamente estables a un nivel nacional o regional, puede ser simplemente el resultado de una integración de cifras, es decir una visión demasiado extensa de la situación en un momento dado. Esto puede que sea inevitable o incluso deseable desde una perspectiva económica de los recursos nacionales pero puede ser fuente de problemas si no se procura determinar la “escala apropiada” para la investigación de los recursos marinos, o en aspectos más prácticos, en el asesoramiento a las autoridades administrativas en cuestiones como el campo de acción más conveniente para la aplicación de medidas de ordenación de los recursos en una bahía, golfo, estuario, etc., dado.
Las anteriores consideraciones pueden extenderse a especies de mar abierto tales como los túnidos. En el noroeste y este del océano Pacífico se han llevado a cabo continuas estimaciones del reclutamiento en base a las estadísticas anuales de capturas por clase de edad, pese a que la estratificación subregional oficialmente reportada fue escasa. La impresión generada por esta amplia integración de datos de captura, es que los túnidos no presentan fluctuaciones de población del mismo orden que las de otras especies pelágicas, es decir que sólo se han producido cambios en la biomasa o en el reclutamiento a lo largo de la pesquería del rabil del Pacífico oriental, o de la pesquería de listado del Pacífico del noroeste en 2 o 3 ocasiones.
No obstante, en la pesquería de listado del océano Pacífico oriental hay regiones que en algunos años parece que principalmente sustentan poblaciones “locales” y otros años una mezcla de varias cohortes independientes consistentes en rabiles locales y nómadas procedentes de áreas adyacentes. En el Cuadro 14 de Sharp y Francis (1976), se incluye una descripción de las variaciones anuales en las capturas de cohortes en tres áreas subregionales. Puede considerarse que incluye componentes “locales” además de nómadas de la población de rabil del océano Pacífico oriental. La relación entre dos cohortes semestrales (peces reclutados en un mismo período de 6 meses) cualesquiera de cualquiera de las tres subregiones, es de alrededor de 5x, mientras que entre subregiones para un mismo período de reclutamiento la variación se apróxima a 19x. Las capturas de rabil efectuadas a lo largo de toda la costa del Pacífico oriental han sido relativamente estables desde que se completó el desarrollo de la explotación en esta zona en 1961. Tomando en consideración la captura de rabil en la zona comprendida entre la costa y las 20 millas desde la costa entre 1961 y 1976, la relación entre las capturas mayores y menores es inferior a 3x. Esto muestra la estabilidad regional característica de las poblaciones en las que se incluyen muchos componentes nómadas, en el caso de que se tome en consideración áreas suficientemente extensas, lo que contrasta con las variaciones locales y subregionales.
En el Cuadro 15 se han incluido ejemplos de pesquerías pelágicas que han presentado fluctuaciones anuales de sus capturas superiores a 5x de los niveles de captura más bajos, en el período comprendido entre 1970 y 1977. Podemos pensar que algunas de estas variaciones de captura sean debidas a cambios no relacionados con interacciones que se creen inducidas por el medio ambiente (es decir, debidas a cambios en el esfuerzo pesquero o a una deficiente cobertura de los desembarcos). De cualquier forma, muchas de estas fluctuaciones, en particular los grandes incrementos de captura observados en este período, son reflejo de fluctuaciones reales del reclutamiento y en consecuencia de la biomasa, opuestas en cierto grado a la variación del habitat local.
Paloheimo y Regier (1982) proponen la consideración de diferentes escalas que pueden resultar relevantes y apropiadas, en las aproximaciones a las pesquerías multiespecíficas, por ejemplo, los Grandes Lagos y el Gran Banco de Newfoundland. Lo que sugiere que para enfrentarse a los ecosistemas multiespecíficos relacionados con pesquerías, la investigación debe adoptar aproximaciones empíricas, si se busca una utilidad práctica de cara a la ordenación de pesquerías. Las aproximaciones con un elevado contenido teórico sólo resultarán útiles cuando el conocimiento del sistema es escaso o cuando lo que se conoce de el es mucho. También señalan que muchos estudios relacionados con la ordenación tienden a ser vagos en lo referente a lo ocurrido como resultado de las medidas de ordenación que se introdujeron con anterioridad, o de lo que se puede esperar de ellas en el futuro. Aunque la pesquería puede producir cambios drámaticos, las causas principales de los efectos a gran escala observados en los sistemas, son variaciones en las propiedades abióticas del ecosistema. Los cambios bióticos serán respuestas a ésto. La Figura 15 de Regier y Enderson, 1973, se incluye para mostrar que esta forma de clasificar las numerosas aproximaciones utilizadas en los estudios de pesquerías explica, también de forma implícita la precisión considerablemente baja que caracteriza las investigaciones relacionadas con ordenación de pesquerías. También se señala que esta baja precisión no es totalmente debida a la difícil predicción de las poblaciones de peces sino, en parte, también, al fracaso en el intento de considerar las covariantes medioambientales que podrían explicar el “aparente ruido casual” de las pesquerías multiespecíficas.
Al igual que concluían Sharp y Csirke (1983), Paloheimo y Regier (1982) señalan que:
“Todo intento de explicar los cambios observados en las pesquerías multiespecíficas que ignore los cambios concomitantes de las variables abióticas parece inútil. De una forma parecida, cualquier modelado de sistemas de agua dulce o de mar que no incorpore el papel jugado por las variables medioambientales también parece estar condenado al fracaso”.
Esto pone de relieve la importancia de la investigación comparada de pesquerías. Un cuidadoso examen de los cambios en la composición de la biomasa de pesquerías locales o regionales, con frecuencia evidencia una biomasa total relativamente estable, con cambios compensados entre las diversas especies componentes. Esta condición casi constante, probablemente, en la mayoría de sistemas marinos, sólo se dará en tanto la producción primaria se mantenga relativamente estable, y siempre que los reemplazamientos de especies sean ecológicamente equivalentes. Los datos estadísticos de base con que contamos en la mayoría de pesquerías industriales de los trópicos se refieren a períodos muy breves, pues datan de los años 60 o incluso de principios de los 70 en la mayoría de los casos. Estos datos muestran las variaciones a corto plazo de las capturas provenientes de poblaciones pelágicas. Los cambios que puedan esperarse a largo plazo sólo se evidenciarán cuando las series de datos y la experiencia sobre estas pesquerías se vaya acumulando.
| Año | Norte | 5 | Sur | Total | Norte | 5 | Sur | Total | Total | Grandes |
|---|---|---|---|---|---|---|---|---|---|---|
| A | A | A | A | B | B | B | B | A + B | ||
| 1964 | 27 452 | 9 401 | 5 209 | 42 062 | 33 561 | 5 881 | 17 515 | 56 957 | 99 019 | 2 921 |
| % total A + B | 26,9 | 9,2 | 5,1 | 41,2 | 32,9 | 5,8 | 17,2 | 55,9 | 2,9 | |
| % total A o B | 65,3 | 22,4 | 12,4 | 58,9 | 10,3 | 30,8 | ||||
| 1965 | 18 967 | 13 512 | 6 406 | 38 885 | 24 064 | 14 164 | 8 386 | 46 614 | 85 499 | 4 543 |
| 21,1 | 15,0 | 7,1 | 43,2 | 26,7 | 15,7 | 9,3 | 51,8 | 5,0 | ||
| 48,8 | 34,7 | 16,5 | 51,6 | 30,4 | 18,0 | |||||
| 1966 | 7 769 | 23 138 | 20 176 | 51 073 | 0 292 | 11 394 | 14 771 | 36 457 | 87 530 | 3 626 |
| 8,5 | 25,4 | 22,1 | 56,0 | 11,3 | 12,5 | 16,2 | 40,0 | 4,0 | ||
| 15,2 | 45,3 | 39,5 | 28,2 | 31,3 | 40,5 | |||||
| 1967 | 20 699 | 9 564 | 7 664 | 37 927 | 29 482 | 8 572 | 11 867 | 49 921 | 87 848 | 1 802 |
| 23,1 | 10,7 | 8,5 | 42,3 | 32,9 | 9,6 | 13,2 | 55,7 | 2,0 | ||
| 54,6 | 25,2 | 20,2 | 59,1 | 17,2 | 23,8 | |||||
| 1968 | 16 361 | 23 921 | 13 552 | 53 834 | 33 917 | 22 132 | 3 128 | 59 177 | 113 011 | 1 602 |
| 14,3 | 20,9 | 11,8 | 47,0 | 29,6 | 19,3 | 2,7 | 51,6 | 1,4 | ||
| 30,4 | 44,4 | 25,2 | 57,3 | 37,4 | 5,3 | |||||
| 1969 | 22 437 | 20 034 | 9 030 | 51 501 | 34 887 | 29 587 | 5 648 | 70 122 | 121 623 | 4 888 |
| 17,7 | 15,8 | 7,1 | 40,7 | 27,6 | 23,4 | 4,5 | 55,4 | 3,9 | ||
| 43,6 | 38,9 | 17,5 | 49,8 | 42,2 | 6,1 | |||||
| 1970 | 39 197 | 15 942 | 10 529 | 65 668 | 43 476 | 13 257 | 11 125 | 67 858 | 133 526 | 9 176 |
| 27,5 | 11,2 | 7,3 | 46,0 | 30,5 | 9,3 | 7,8 | 47,6 | 6,4 | ||
| 59,7 | 24,3 | 16,0 | 64,1 | 19,5 | 16,4 | |||||
| 1971 | 12 372 | 18 719 | 14 453 | 45 544 | 17 357 | 25 283 | 15 712 | 58 352 | 103 896 | 9 277 |
| 10,9 | 16,5 | 12,8 | 40,2 | 15,3 | 22,3 | 13,9 | 51,6 | 8,2 | ||
| 27,2 | 41,1 | 31,7 | 29,7 | 43,3 | 26,9 |
Las tendencias de las capturas regionales y de las abundancias relativas de las especies oceánicas de tipo oportunista tales como los túnidos tropicales y otras especies cosmopolitas, presentan variaciones del orden de dos o tres veces, y son raras las variaciones superiores a cinco veces. En el caso que los registros indiquen cambios de tal magnitud referidos a especies oceánicas de tipo cosmopolita, generalmente corresponderán a cambios en los factores económicos o en estrategia de distribución del esfuerzo, más que a cambios relativos de la abundancia.
Con referencia a los peces demersales se ha señalado que cada tipo de fondo específico y cada profundidad puede tener una fauna de peces característica (por ejemplo, Grady, 1971; Domain, 1972; Caddy y Iles, 1973) a pesar de que en este caso el concepto de “comunidades” específicas de peces que tienden a participar de los rangos comunes de la población resulta menos convincente que en el caso de la infauna del fondo. La utilización del término “comunidad de peces” tiende a ser aplicado más comúnmente en la actualidad con relación a áreas de “fondos vivos” reconocibles de forma significativa, como por ejemplo, arrecifes de coral, praderas de fanerógamas marinas o fondos de algas. Incluso en este caso deben considerarse como descripciones generales, y de bastante difícil verificación estadística dado que, por ejemplo, en los arrecifes de coral hay un número de habitats diferentes, cada uno con su grupo de especies más o menos caraterísticas.
| (A) | (B) | (A/B) | |||
|---|---|---|---|---|---|
| Especies | Area | Máximos de | Mánimos | Relaión | |
| captura | capturas | ||||
| Caranx hippos | Africa occidental | 28 221 | 1 036 | 27, | + |
| Orcynopsis unicolor | Africa occidental | 2 600 | 100 | 26, | - |
| Trachurus capensis | Africa del suroeste | 690 164 | 62 300 | 11, | + |
| Trichiurus lepturus | Africa del suroeste | 28 545 | 3 800 | 7,5 | + |
| Trachurus trecae | Africa del suroeste | 273 700 | 31 298 | 8,7 | - |
| Sardinella spp. | Africa del suroeste | 142 200 | 20 986 | 6,8 | -+ |
| Scomber japonicus | Perú | 65 000 | 8 700 | 7,5 | + |
| Scomber japonicus | Atlántico noroeste | 39 000 | 6 262 | 6,2 | - |
| Rastrelliger spp. | Océano Indico oriental | 16 300 | 2 000 | 8,2 | + |
| Rastrelliger kanagurta | Océano Indico oriental | 203 100 | 35 403 | 5,7 | |
| Anchovies | Océano Indico occidental | 118 062 | 16 900 | 7,0 | - |
| Psenopsis anomala | Océano Pacífico noroeste | 13 000 | 1 994 | 7,0 | - |
| Sardinops melanostictus | Océano Pacífico noroeste | 1 420 512 | 16 900 | 84, | + |
| Engraulis mordax | Océano Pacífico oriental | 289 002 | 44 600 | 6,4 | + |
| Cetengraulis mysticetus | Pacífico tropical oriental | 168 081 | 15 551 | 10,8 | + |
| Trachurus symmetricus | Océano Pacífico oriental | 50 149 | 9 400 | 5,3 | + |
| Sarda chiliensis | Océano Pacífico suroriental | 74 700 | 4 341 | 17,2 | - |
| Scomberomorous sierra | Perú | 2 279 | 400 | 5,7 | + |
| Engraulis ringens | Perú | 13 059 900 | 807 175 | 16, | - |
| Sardinops sagax | Perú-Chile | 1 467 555 | 68 600 | 21, | + |
| Tranchurus trachurus | Perú-Chile | 839 805 | 111 300 | 7,6 | + |
| Thrysitops lepidopodes | Chile | 7 200 | 630 | 11,6 | - |
| Cetengraulis edentulus | Venezuela | 496 | 850 | 5,8 | -+ |
| Decapterus russeli | Malasia-Tailandia | 109 337 | 9 800 | 11,2 | + |
| Scomberoides spp. | Indonesia-Filipinas | 5 186 | 500 | 10, | + |
En el Cuadro, los signos más y menos representan la dirección de la tendencia en el período de referencia. La indicación — + se refiere a fuertes cambios en ambas direcciones.
Como señalan Parrish y Zimmerman (1977), los peces de arrecife pueden clasificarse en cuatro categorías: especies restringidas al arrecife que sólo se encuentran en el arrecife, especies relacionadas con el arrecife que permanecen algún tiempo, no todo en o alrededor del arrecife, especies indiferentes al arrecife que tanto pueden permanecer algún tiempo en los alrededores del arrecife como no hacerlo, y especies que no son de arrecife o que lo son de forma ocasional siendo atípico encontrarlas en el arrecife.
De una manera más general, las especies pueden ser clasificadas, en principio, en residentes y transeuntes — estas últimas que frecuentemente son importantes, son especies que aparecen en la “comunidad” de forma estacional (Tyler, 1971). Incluso en el caso de los invertebrados bentónicos, realizando muestreos sucesivos se ve con claridad que el número total de especies encontradas aumenta de forma asintótica con el número de muestras que se han tomado (Figura 63), de tal forma que para determinar el número de especies existentes en un área para poder calcular los índices de diversidad, etc., será necesario determinar el número de muestras que se deben tomar.
Muestreo y Pesca: Métodos y Necesidades
La información básica acerca de qué cantidad y qué especies de peces pueblan un área marina dada se obtiene en gran manera de forma indirecta, es decir por inferencia de las capturas de peces, en particular de las realizadas por medio de artes de pesca (“sistemas remotos de muestreo”) de diversos tipos, cada uno con su eficiencia y selectividad específicas para cada especie o talla. En algunas á se han utilizado técnicas de observación más “directas”, tales como el sonar, la fotografía submarina, y observaciones con vehículos submarinos, para obtener estimaciones cuantitativas de las poblaciones de peces y crustáceos, aunque también tienen sus dificultades y limitaciones propias, siendo susceptibles de problemas de identificación y calibración y de problemas de los efectos de la observación en el comportamiento de los peces que se están observando. En el caso de los métodos visuales, la limitación general viene dada, también, por el área de acción del equipo de muestreo, dado que aunque la densidad media de peces por área de mar puede ser del orden de 1 a 10 peces/metro cuadrado si nos encontramos con cardúmenes densos, en general en las zonas de pesca la densidad media será de 1 pez por entre 10 a 1 000 m², o incluso en el caso de los grandes depredadores marinos como los túnidos las densidades “medias” serán mucho más bajas.
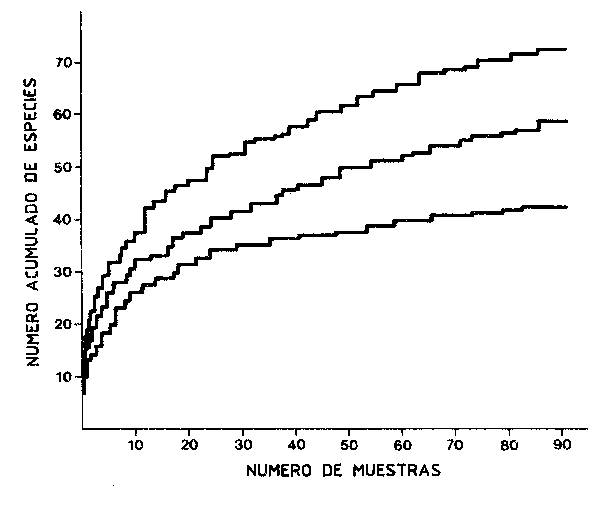
|
Figura 63 Muestra de cómo el número de
especies tiende a un valor
asintótico al crecer la frecuencia
o el área de muestreo
(reproducido de Smith y Tyler,
1973) |
Es importante recordar no obstante, que la efectividad o “poder de pesca” de los barcos que están realizando el muestreo de una población de peces no depende exclusivamente del diseño del arte de pesca utilizado. Un patrón que posea un conocimiento especial de las áreas de mayor densidad cuenta con una ventaja a la hora de competir, y en general los depredadores se aprovechan de las concentraciones de presas con el fin de mejorar su “relación coste-beneficio”. De tal forma que los conocimientos del patrón constituyen un componente importante del poder de pesca de su barco, que en definitiva puede resultar tan importante en términos prácticos como la potencia de los motores propulsores del barco a la hora de determinar la tasa de captura de las especies disponibles al arte.
Este segundo factor, “disponibilidad” o “vulnerabilidad” para la pesca determina también la posibilidad de muestrear o ejercer la pesca comercial con un determinado tipo de arte/barco y puede variar con el tiempo. La elevada vulnerabilidad del arenque, de los cefalópodos, de los serránidos y de otras muchas especies durante la puesta, es sin duda un factor a tener en cuenta por parte de los administradores a la hora de determinar las estaciones de pesca, las áreas de veda, etc.
Pautas de Distribución
Sharp y Francis (1976) estimaron la densidad media de los rabiles mayores de 40 cm de talla en el Pacífico oriental en 34,5 mg/m². Por supuesto, un túnido de 40 cm o más pesa bastante más de 34,5 mg, y lo mismo ocurre con los cardúmenes. Sharp (1978) estimó que el cardumen de atúnes típico buscado por los artes de pesca modernos está compuesto por cardúmenes “tipo”, es decir por grupos de peces de talla similar y con un único o similar desarrollo vital, formados por unidades de 2 000 a 3 000 kg. Los cardúmenes muestreados en la pesquería del Pacífico oriental son mayores que algunos de los tamaños considerados como umbral (según el criterio específico de cada capitán). Al examinar diversas series localizadas de datos con el fin de discernir los efectos medioambientales en el tamaño de los cardúmenes, Sharp (1978) señala que en dos perídos que se caracterizaron por diferentes regímenes térmicos, la proporción de los diferentes tamaños de cardúmenes capturados cambia de forma drástica. El cuadro que se incluye a continuación muestra los resultados obtenidos:
| Toneladas = | 0–10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 100 | >100 |
|---|---|---|---|---|---|---|---|---|---|---|
| Mar. 1 – Abr. 15 | 71 | 21 | 4 | 2 | 1 | 1 | ||||
| Abr. 16 – Mayo 30 | 59 | 20 | 8 | 4 | 2 | 2 | 2 | 1 | 1 | 2 |
El cambio observado consiste en una disminución de los cercos menores(0–10 t) y en la proporción de cercos en los que se capturaron más de 20 t. De 881 cercos realizados entre el l de marzo y el l de abril, en sólo el 8 por ciento se capturaron más de 20 t. En el segundo período se realizaron 499 operaciones de cerco y el 22 por ciento resultaron de más de 20 t.
Lo destacado por Sharp (1978) es que el tamaño de los cardúmenes cambia con el volumen del habitat apropiado y por ello cambia la densidad de los “cardúmenes tipo” locales y las tasas de interacción. En el último período citado anteriormente, el volumen del habitat fue menor que el propio del primer período, de aquí que más cardúmenes tipo se encontrarán y se agregarán. Este ejemplo obliga a que en el muestreo de stocks de peces se tomen en consideración, la dinámica del sistema, así como también la disponibilidad y la selección de los muestreadores, que en este caso son los capitanes de pesca.
A modo de ejemplo simplista y centrándonos de nuevo en el rabil del Pacífico oriental, en su contexto de depredador nómada dominante de este amplio sistema, podemos considerar que los cardúmenes tipo de 2 a 3 t suponen alrededor de 50/80 km² de superficie oceánica, y que agregaciones no inusuales de 200 t conforman la biomasa total previsible en alrededor de la mitad de un área de 10° de longitud por 10° de latitud en el Pacífico oriental tropical. En estos cardúmenes se da una relación inversa entre la talla media de los peces y su probabilidad de aparición en las grandes agregaciones. Señalemos que un cardumen de 200 t formado por peces de 50 cm, que consume por lo menos el 10 por ciento del equivalente a su biomasa cada día con el fin de mantenerse, en la situación normal de densidades observadas en los recursos litorales, tomará, como depredador, 20 t al día representando una perturbación importante para los recursos pesqueros y las redes alimentarias locales.
Lo que de nuevo se demuestra con ésto es que los peces no están dispersos al azar sino que lo hacen de forma contagiosa en una amplia extensión dependiendo tanto del estadío de la vida en que se encuentren, como de la unidad de área muestreada. La distribución estadística que quizás proporciona la mejor descripción general de la probabilidad de que un número dado de organismos sean capturados por unidad de muestreo es la distribución binomial negativa (Figura 64), al igual que si se pretende encontrar una buena descripción del número de peces que se capturarán en sucesivas muestras obtenidas por medio de un arte de pesca de arrastre (Taylor, 1953)1, y también describe de forma correcta la distribución de poblaciones bentónicas (ver Elliott, 1971). Si muestreamos peces con un arte de “barrido” (arrastre, draga) se nos plantearán problemas específicos a la hora de la interpretación de los datos, si bien estos serán menores que si se emplean sistemas de captura que dependan de la atracción de los peces (nasas, trampas, anzuelos cebados) o artes de pesca pelágica (redes de enmalle, cercos y cañas) para los cuales no se ha desarrollado, todavía, una teoría de muestreo adecuada. El problema con el que topamos con todos los artes de pesca antes de considerar los datos que nos proporcionan para la evaluación de la abundancia real es básicamente la definición de su selectividad y la disponibilidad de las diferentes especies y tallas para el arte, y sobre todo si consideramos que las artes de pesca más utilizadas se han desarrollado (después de mucho tiempo) con el fin de proporcionar una diferenciación máxima entre las especies deseadas y no deseadas.
Muestreo de Comunidades Demersales
El arrastre de fondo es probablemente el arte de pesca mejor conocida, y quizás también el arte que para los peces demersales mejor satisface los principales requisitos del muestreo, es decir, que la captura de una especie dada en un área sea aproximadamente proporcional a la abundancia. No obstante, incluso en este caso, especies de comportamiento diferente, por ejemplo en su respuesta a la acción concentradora de los cables de arrastre y en su habilidad de escape, junto con la luz de las mallas, determinarán la composición de la captura por especies. Las características del arrastre, tales como la dirección relativa de la corriente, la velocidad del arrastre, la abertura de la boca del arte, y la presencia de bolos en la relinga inferior o sobrecopos, también afectarán a la composición de la captura. No obstante, quizás, el más importante de todos los factores en relación con los estudios de “comunidades” (definidas como aquellos grupos de especies que aparecen generalmente de forma conjunta en el mismo habitat) de peces demersales, es la duración del arrastre, puesto que para arrastres largos (de varios kilómetros) se pueden mezclar de forma artificial varios grupos de organismos cada uno procedente de diferentes subáreas del fondo del mar barridas por el arrastre.
1 Se han ensayado otras distribuciones estadísticas utilizadas en la ciencia de las pesquerías, como por ejemplo la distribución de la probabilidad del tamaño de los reclutamientos anuales para una poblacion monoespecífica (ver Hennemuth, Palmer y Brown, 1980)
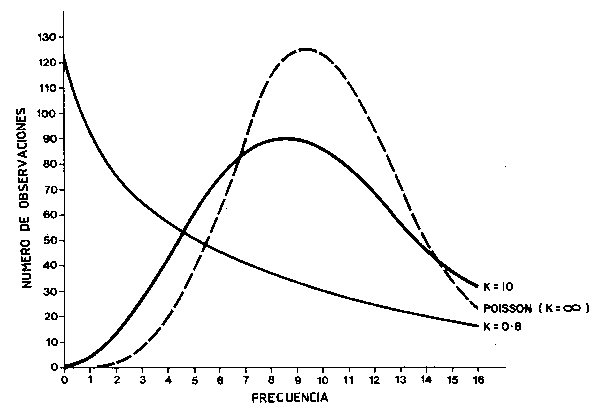
Figura 64 La distribución binomial negativa comparada con la de poisson. La media en ambos casos es 10 y están basadas en 1 000 observaciones (Taylor, 1953)
Como señala Thorson (1975), los fondos (teóricamente “arrastrables”)1, constituyen por lo menos el 90 por ciento de los fondos marinos de los océanos del planeta y están habitados por un mosaico de grupos diversos de invertebrados propios del fondo. Thorson sugiere que cada grupo de organismos está constituido por un número de especies relativamente fijo, conformando una “comunidad” y que las comunidades se diferncian por el tipo de sedimento y por la profundidad.
Como ya se ha señalado, en principio podemos clasificar a las especies en residentes y transeúntes - estas últimas, con frecuencia importantes, sólo aparecen en la “comunidad” con carácter estacional (Tyler, 1971). Incluso en el caso de invertebrados bentónicos, está claro que con sucesivos muestreos el número total de especies encontradas va creciendo de una forma generalmente asintótica con el número de muestras tomadas (Figura 63), de tal forma que para definir el número de especies de un área para el cálculo de índices de diversidad, etc., será necesario definir el número de muestras.
Por razones de este tipo, y porque el término comunidad obliga a estudios de campo de carácter más objetivo, el concepto de “asociación” de peces ha ido ganando adeptos en estos últimos años. El concepto de análisis de gradiente, basado originalmente en el trabajo de botánicos terrestres (por ejemplo, Whittaker, 1967), introduce la idea de que los aparentes cambios de la flora (y por supuesto de la fauna asociada) son explicados en términos de respuestas comunes a los gradientes de los parámetros medioambientales (como por ejemplo, la altura, el pH, la temperatura, el drenaje, etc.). En consecuencia, el grupo de especies que aparecen típicamente juntas se consideró que respondían a una común variable medioambiental más que a cualquier “atracción” intrínseca entre ellos. Por supuesto que se pueden citar muchas excepciones, como por ejemplo las referentes a casos de parasitismo, comensalismo, simbiosis, y casos de depredación obligada, donde dos o más especies coexisten independientemente del medio ambiente, en tanto este no sea absolutamente desfavorable. El concepto de gradiente y la idea de asociación de especies (es decir aquellos organismos que debido a sus independientes aunque comunes respuestas y preferencias medioambientales tienden a aparecer de forma conjunta) resulta muy atractiva, en especial desde que, a diferencia del concepto de comunidad, se ha visto que permite el control estadístico de las hipótesis subyacentes y que fomenta el estudio la ecología fisiológica de los organismos marinos.
1 Muchas de estas áreas del fondo son, lógicamente, abisales y no arrastrables
La asociación de peces, en la práctica, puede considerarse como una forma de clasificación alternativa a las planteadas en otros apartados de este documento, especialmente, la red alimentaria, y puede valer la pena estudiar algunas diferencias, señalando al mismo tiempo que ambas aproximaciones son estrictamente complementarias y lógicamente deberían apoyar de forma conjunta cualquier aproximación encaminada a la comprensión de las pesquerías multiespecíficas.
La asociación de peces está compuesta por aquellas especies disponibles al muestreo en un área, pudiéndose demostrar mediante un análisis estadístico recurrente que aparecen conjuntamente. No es necesario que todas estas especies estén ligadas tróficamente, aunque muchas de ellas pueden estarlo (o como depredador-presa, o porque comparten depredadores o presas comunes). De hecho, puesto que los componentes de una asociación reflejarán el métodos de muestreo utilizados, pueden (a diferencia de los componentes de las redes alimentarias) tender a un rango de tallas de adultos relativamente restringido.
Han sido diversas las herramientas estadísticas utilizadas para mostrar el grado de concurrencia de las especies en una serie de muestras, y se han usado varios índices de similitud entre diferentes muestras (ver por ejemplo, Greig-Smith, 1964; Whittaker, 1967; Day y Pearcy, 1968; Pielou, 1969). Esto es factible para grupos de estaciones de muestreo con fauna similar, o entre grupos de especies con una distribución espacial similar, mediante un análisis de grupos (Romesburg, 1984), para mostrar la similitud jerárquica de los diferentes grupos de estaciones de muestreo (Figura 65). Existen varias rutinas (ver por ejemplo, Davies, 1971), para construir una matriz de carácter jerárquico de similitud de índices, en forma de dendrograma o de tabla de contingencia, si se cuenta con datos de un muestreo sistemático. Las metodologías de tratamiento de los muestreos multiespecíficos han progresado rápidamente, y en particular, el Análisis de Componentes Principales va siendo cada vez más utilizado (ver Mahon et al., 1984). Incluso antes de que se optara por este tipo de aproximaciones de carácter sistemático, como se señaló anteriormente, pueden elaborarse mapas referidos a las especies residentes (así como mapas estacionales para las especies transeúntes), con el fin de mostrar el grado de solapamiento de los diferentes recursos y de las pesquerías correspondientes.
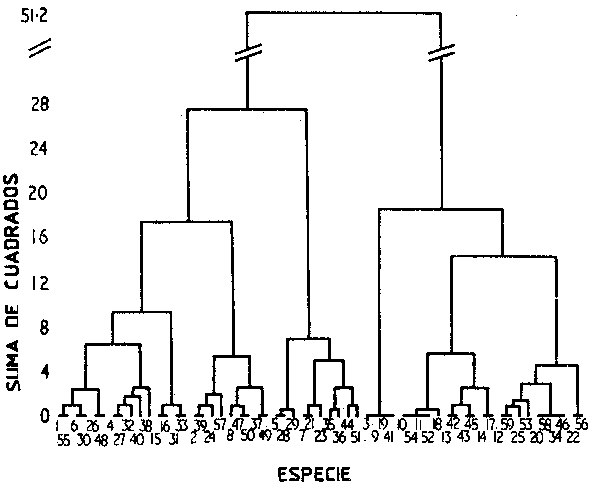
Figura 65 Clasificación jerárquica de estaciones en forma de dendrograma (de Hughes y Thomas, 1971). Se indican los subgrupos de estaciones de muestreo
Esta caracterización de las asociaciones de peces, incluso de forma aproximada, se muestra como una precondición necesaria para comprender los stocks multiespecíficos, y puede resultar muy útil complementarla con el análisis de contenidos estomacales, y con la elaboración de redes alimentarias de carácter preliminar tal como hemos sugerido en este documento.
Tal como señalan Tyler, Gabriel y Overholtz (1982): “Las agencias pesqueras en muchas partes del mundo ya cuentan con datos suficientes de distribución para elaborar mapas de asociaciones … (y) … ya existen suficientes datos recolectados … de tal forma que los regulares pueden ser separados de los estacionales. Así mismo también existen análisis de estómagos en numero suficiente, en las regiones pesqueras más importantes que permiten construir primeras aproximaciones de grupos consumidores de energía …”. Estos “grupos consumidores de energia” consisten en (uno o más) subgrupos de especies “regulares” (residentes durante todo el año) en un área, y ligadas tróficamente, y Tyler sugiere que estos subgrupos constituyen las unidades multiespecíficas naturales de ordenación (Figura 66). Esto requerirá un particular planteamiento de la investigación y la administración de los stocks de peces, es decir una administración (u ordenación) basada en las “Asociaciones Unidad de Producción” (AUPs) cada una de ellas compuesta por diversas especies. Estos “grupos consumidores de energía” demersales, se ven afectados por tres funciones directoras: la pesquería, el medio ambiente físico y sus fluctuaciones, y los impactos de las especies transeúntes (depredadores, presas o competidores ocasionales). Este planteamiento preliminar puede conducirnos hacia el difícil objectivo de dilucidar las probables interrelaciones existentes entre las especies importantes. A pesar de que el concepto de asociación se refiere a especies residentes a lo largo de todo el año, puede resultar demasiado restrictivo para (por ejemplo, estuarios y afloramientos) áreas en que las condiciones oceanográficas hacen que la residencia a lo largo de todo el año sea imposible y MacDonald et al., (1984) han descrito asociaciones que mantienen su identidad a pesar de los desplazamientos batimétricos de carácter estacional. Existen también algunas evidencias (Overholtz y Tyler, 1985) de que las asociaciones pueden persistir por largo tiempo a pesar de que se den cambios drásticos en la abundancia relativa de los componentes que la constituyen.
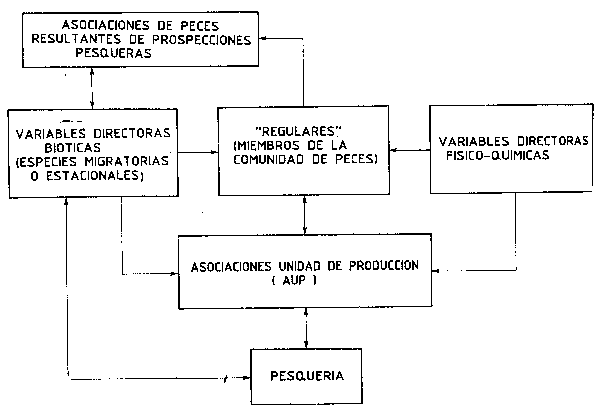
Figura 66 Planteamiento esquemático de la investigación y la ordenación de una asociación de stocks de peces (de Tyler, Gabriel y Overholtz, 1982)
Deberíamos recordar (como se muestra en las Figuras 7 y 8) que la red alimentaria es una representación estática de una secuencia recurrente de acontecimientos que tienen lugar en el mar. Tal como se puede deducir de estas ilustraciones, la biomasa de un componente dado en el momento presente debería ser, en teoría, si no en la práctica, si conocemos las eficiencias de la transferencia de materia entre los diferentes componentes, y la tasa de consumo de carácter metabólico de los organismos marinos, trasladable hacia atrás al momento en que tuvo lugar la síntesis inicial. Esta secuencia temporal de acontecimientos no siempre está clara, debido a la existencia de “bucles” propios de los carroñeros, los deritívoros y del canibalismo, que retrasan el movimiento de materia “hacia arriba” en la red alimentaria. Sin embargo, la Figura 8B puede ser vista como un caso análogo a un análisis de cohortes de un stock monoespecífico, y quizás constituye una visión equilvalente al análisis multiespecífico de cohortes propuesto por Pope (1979).
También para peces demersales y pelágicos, se ha señalado que el tipo de fondo/profundidad/masas de agua específico puede tener cada uno una fauna íctica característica (ver ejemplos en Grady, 1971; Domain, 1972), y que las agregaciones de peces son dinámicas y se forman como respuesta a los gradientes medioambientales y también como respuestas de carácter reproductor y alimentario, de forma que el concepto de “comunidades” específicas de peces con tendencia a compartir los límites comunes de población, resulta menos convincente por regla general que en el caso de la infauna del fondo. El uso del término “comunidad de peces” tiende a ser aplicado corrientemente en áreas de “fondos vivos” específicamente reconocibles, como por ejemplo los arrecifes de coral, las praderas de fanerógamas marinas y los fondos de algas. Incluso en este caso resulta ampliamente descriptivo, siempre que, por ejemplo, los arrecifes de coral contengan una serie de habitats diferentes, cada uno con más o menos especies características.
La relación entre la tasa de alimentación y el crecimiento ha constituido la mayor preocupación de los biólogos marinos durante los últimos 30 años, existiendo una amplia y variada bibliografía (ver como referencias clave Ivlev, 1961 y Winberg, 1960). Mucha menor atención han merecido los efectos de la tasa de alimentación sobre la tasa de mortalidad de aquellas especies situadas en el escalón trófico inmediatamente inferior y que constituyen el alimento de las especies en cuestión.
Conover (1978) ha reunido un grupo representativo de valores de tasas de alimentación en relación con la talla del cuerpo y con la temperatura, referidos a una serie de invertebrados y peces de mar, y pese a evidenciar la dificultad de establecer generalizaciones amplias acerca de la tasa de alimentación de los comedores de alimento en grandes partículas, cuando la totalidad de los datos han sido recogidos conjuntamente, llega a dos conclusiones fundamentales:
(1) un incremento de la temperatura provoca un incremento de la tasa de alimentación;
(2) los peces pequeños requieren proporcionalmente una mayor ración (referido al porcentaje de peso del cuerpo consumido diariamente) en unas condiciones dadas, que los peces mayores.
El análisis de las correlaciones entre la talla del cuerpo y el consumo de alimento, incluso entre grupos taxonómicos, no es probable que resulte un ejercicio muy fructífero si el nivel normal de actividad de las especies no se toma en consideración. La actividad contribuye significativamente a la tasa de metabolismo y se incrementa con la temperatura, por ello la inclusión de la temperatura ambiente en cualquier comparación mejora las posibilidades de estimación de la tasa de alimentación. La mayoría de los datos disponibles proceden de experiencias realizadas en estanques cerrados y dado que la mayor parte de la actividad natatoria se produce en respuesta a la alimentación, se producen unos bajos niveles “de mantenimiento” de las tasas de actividad y alimentación, aun cuando la tendencia contraria de “alimentación hasta la saciedad” característica, por ejemplo, de las operaciones en acuacultura, lo compensa en parte.
A pesar de lo anterior, existen diferencias básicas obvias entre el nivel de actividad y en consecuencia la tasa de alimentación entre por ejemplo, perciformes activos e inactivos, por ejemplo entre una caballa y un pez plano, o entre un pulpo y un calamar (ambos cefalópodos), incluso a una misma temperatura y talla. Lo podemos ver claramente en la Figura 67, donde la tasa de alimentación está representada contra el peso del cuerpo utilizando los datos de los Cuadros 5–24 de Conover (1978) (reuniendo todas las dietas). Estos calamares y caballas poseen tasas de alimentación por lo menos dos veces superiores que los menos activos habitantes del fondo, como son los peces planos y los pulpos. Un examen preliminar de estos datos, parece indicar que se dan pocas variaciones en la tasa de alimentación de los peces en un nicho ecológico o con relación a una pauta de actividad dados. Sin olvidar esto, se analizaron detenidamente series más amplias de datos disponibles, como es la serie de peces depredadores habitantes del fondo (peces planos, ganoideos, serránidos, etc.) que se representan con círculos en la Figura 67, comedores de una variedad de dietas para las cuales no se hizo distinción en este análisis.
Expresando de forma empírica esta relación mediante una regresión múltiple, tenemos:
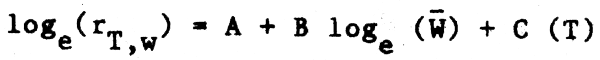
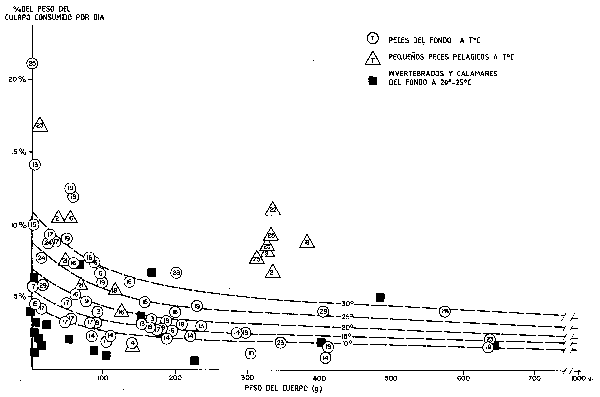
Figura 67 Relación entre el peso del cuerpo (g) y la temperatura ambiente, y la consiguiente tasade comsumo(%de peso del cuerpo por día invertebrados (datos de Conover, 1978).La regresíon múltiple mostrada con líneas de trazos se ha ajustado exclusivamente a los datos correspondientes a los peces demersales (los puntos correspondientes a peces pelágicos e invertebrados se han incluido exclusivamente a efectos de comparación)
Se efectuó un cálculo preliminar de los parámetros de esta ecuación para un grupo limitado de 59 puntos del Cuadro 5.25 de Conover (1978) (ignorando la naturaleza de las dietas). Se encontró para 13 especies de peces demersales comprendidos entre 20 y 633 gramos de peso y a una temperatura ambiente de entre 8, 6°C y 20°C la siguiente regresión múltiple:
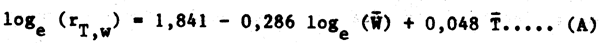
donde rT,w es la tasa de alimentación (porcentaje del peso del cuerpo por día) y  y
y 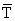 son
respectivamente el peso del cuerpo y la temperatura media (o en algún caso la mediana). Un R² de
0,55 indica que las variables consideradas sólo explican alrededor de la mitad de las variaciones
observadas, con lo que esta relación debería ser reexaminada en cuanto se disponga de una mayor base
de datos y un mayor rango de tallas. Pese a ésto, este análisis preliminar que hemos realizado
también indica que de las dos variables independientes, el peso del cuerpo es la más significativa,
explicando por lo menos el 40 por ciento de la variación, mientras que un porcentaje menor viene
explicado por la temperatura. Efectos específicos de las pautas de actividad y del tipo de dieta
probablemente explican una parte significativa de la variación inexplicada1 pero incluso en el caso
de que se dispusiera de una serie de datos cuantitativos que incluyera estas incógnitas o que
fácilmente se pudiera disponer de ella, no es probable que, de forma individual, éstas resultarán
ser más importantes que la talla para determinar la tasa de alimentación.
son
respectivamente el peso del cuerpo y la temperatura media (o en algún caso la mediana). Un R² de
0,55 indica que las variables consideradas sólo explican alrededor de la mitad de las variaciones
observadas, con lo que esta relación debería ser reexaminada en cuanto se disponga de una mayor base
de datos y un mayor rango de tallas. Pese a ésto, este análisis preliminar que hemos realizado
también indica que de las dos variables independientes, el peso del cuerpo es la más significativa,
explicando por lo menos el 40 por ciento de la variación, mientras que un porcentaje menor viene
explicado por la temperatura. Efectos específicos de las pautas de actividad y del tipo de dieta
probablemente explican una parte significativa de la variación inexplicada1 pero incluso en el caso
de que se dispusiera de una serie de datos cuantitativos que incluyera estas incógnitas o que
fácilmente se pudiera disponer de ella, no es probable que, de forma individual, éstas resultarán
ser más importantes que la talla para determinar la tasa de alimentación.
En relación con la base de datos utilizada, aunque no siempre se defina específicamente, es probable que se pueda asumir que la mayoría de los datos proceden de experiencias realizadas en estanques (debido sobre todo a que el rango de tallas es limitado). Pese a que la limitación de alimento no constituye en estas experiencias un factor limitante, la limitación de la actividad es probable que si lo constituya. En el medio natural, el alimento es más propenso a mostrarse limitado y/o no uniformemente distribuido, pero no se puede renunciar a utilizar valores derivados de la ecuación A para obtener estimaciones preliminares de la tasa de alimentación en la naturaleza, reconociendo, no obstante, que éstas son posiblemente los límites inferiores y que en base a los niveles de actividad se determinarán valores más reales.
Olson (comunicación personal) facilitó (Cuadro 17) estimaciones de las raciones diarias basadas en trabajos de campo mostrando la importancia de su estacionalidad en algunas especies. El papel dominante de la talla sobre factores definidores de importancia ecológica se pone de manifiesto también en las Figuras 11 y 12, donde se muestra la relación entre la tasa intrínseca de incremento del tamaño de la población (función indirecta de la tasa de alimentación) y la talla y la relactión entre la talla y la concentración teorica de “partículas” en el mar (incluidos los organismos vivos).
La relación que se muestra en el Cuadro 17, pese a basarse en una serie de datos bastante limitada, sugiere que dentro del rango usual de tallas comerciales, un rango sorprendentemente limitado de tasas alimenticias entre el l y el 5 % del peso del cuerpo por día, debería cubrir la mayor parte de la variación para la mayoría de las especies de peces demersales (relativamente inactivas) (Figura 67). La posibilidad de considerar especies de peces pelágicos es limitada debido a la disponibilidad de series de datos. En cualquier caso para dos especies para las cuales contamos con datos (un escombrido y un carangido respectivamente) tenemos:
| Pneumatophorus japonicus | Seriola guingueradiata |
|---|---|
| alimentándose de | alimentándose de |
| Engraulis japonicus | carne de Trachurus |
 = 334 g = 334 g |  = 323 g = 323 g |
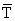 = 21,5 C = 21,5 C | 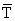 = 24,6 = 24,6 |
| rT = 11,1 | rT = 8,6 |
La tasa de alimentación en los dos casos son 4,2 y 2,7 veces las esperadas para peces de igual talla menos activos a la misma temperatura. Esto sugiere que la tasa de alimentación de depredadores pelágicos de talla media y pequeña (por ejemplo, caballas, jureles), en la misma zona puede ser de 2 a 4 veces mayor que la correspondiente a peces demersales similares. Esta diferencia es incluso mayor para los depredadores oceánicos más activos, los túnidos (Sharp y Francis, 1976). Estos peces marcan un límite superior para la tasa de alimentación, y partiendo de un modelo basado en mediciones de actividad metabólica del listado a 24°C, Sharp y Francis (1976) proporcionan un rango de estimaciones de la tasa de alimentación situadas entre el 11 y 21 % del peso del cuerpo/día correspondiente a un kilogramo de rabil. Esto se sitúa prácticamente fuera del rango de valores de nuestras observaciones y sugiere que debemos ser extremadamente precavidos al estimar tasas de alimentación para organismos (por ejemplo túnidos y calamares oceánicos) cuya actividad locomotriz consume gran parte del balance energético.
1 El concepto de que el nivel de mantenimiento o “basal” del metabólismo y del consumo de alimento es aproximadamente la mitad al del medio natural corresponde a Winberg (1960), pero no se han considerado diferencias del nival de actividad específico de diferentes especies
La característica más sorprendente de la base de datos correspondiente a los peces de fondo, es la relativamente pequeña variación de la tasa de alimentación como un porcentaje del cuerpo a partir de 30 g en adelante.
A pesar de la escasez de puntos por encima de 500 g de peso corporal podemos esperar que la tasa de alimentación en relación al peso del cuerpo de los peces mayores en el mismo medio sea menor, aunque, no exageradamente.
Las implicaciones de estas observaciones para la dinámica de poblaciones y para la relación depredador-pesa merecen algunas consideraciones. Primeramente, a unas abundancias relativas dadas de un depredador y de su presa, se puede establecer:
(1) La mortalidad natural M probablemente no variará de forma rápida con la talla individual del depredador para una relación de la biomasa depredador/presa dada, por encima de la talla individual de la presa consumida (25/50 g) por peces de 300 a 500 g o más.
(2) La tasa de mortalidad natural de un organismo dado generalmente aumentará con la temperatura. Esto se evidencia en la relación establecida para M por Pauly (1978) analizando una numerosa base de datos1:
log10 M=0,2107-0,0824 log10Woo + 0,6757 log10K + 0,4687 log10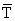
(3) La tasa de mortalidad natural ejercida por un stock pelágico de depredadores sobre una presa dada probablemente excede al ejercido por una población de peces de fondo que ocupan el mismo nicho alimentario.
(4) Como consecuencia de 3, la proporción de una cantidad dada de productividad del nivel trófico inferior (por ejemplo de peces “presa”) recuperable de un stock de depredadores demersales será probablemente superior que el obtenido por explotación de un stock pelágico que comparte las mismas especies “presa”.
Medio Ambiente y Reclutamiento
En general, la mayoría de peces juveniles y adultos disponen de más posibilidades que los primeros estadios del desarrollo en que gozan de una menor movilidad. Hay toda una serie de cuestiones que constantemente están replanteándose y que se refieren a las relaciones entre la temperatura, el tiempo de desarrollo larvario de los peces y la depredación.
La temperatura medioambiental absoluta dentro del rango normal de variación a que se ha adaptado una especie no resulta crítica, en la mayoría de los casos, para la supervivencia de las larvas, puesto que pese a las razones metabólicas, dentro del rango normal de temperaturas de las larvas de peces, las situadas entre las intermedias y frías proporcionan una mejor supervivencia dado que los depredadores en habitats más cálidos también se rigen por las mismas leyes térmicas que las larvas. Si utilizamos el Q10 a modo de factor biológico aplicable en gran número de situaciones, podemos decir que el logaritmo de la actividad del depredador se incrementa con la temperatura, de modo que los depredadores son especialmente voraces en un habitat “cálido”, anulando casi todas las ventajas de las larvas de peces que se derivan del rápido desarrollo de huevo a larva.
Concluyendo, el desarrollo de las larvas de los peces se afronta jugando entre las altas tasas de desarrollo propias de altas temperaturas y las altas tasas de depredación debidas precisamente a la misma razón. La conclusión a la que parece que se está llegando, sobre todo en los trópicos, es que las temperaturas por debajo de la media pueden incluso resultar una ventaja para el desarrollo de las larvas de los peces. El Cuadro 18 centra el problema en su esencia.
Si tomamos la isoterma de los 26°C como el punto central del paso huevo/larva y el desarrollo en los trópicos y consideramos los requerimientos alimento/respiración a esta temperatura a modo de línea de base, los efectos de la temperatura sobre el nivel de actividad pueden calibrarse como una función simple de Q10 variando entre + 41,4 por ciento con cinco grados de incremento de la temperatura ambiente por encima de 26° C, o por el contrario sólo 29,3 por ciento al disminuir cinco grados por debajo de 26°C. No obstante, el consumo de energía debida exclusivamente a la continua natación de larvas o poslarvas varía enfunción del cubo de la velocidad de natación. Resulta evidente que esto provoca dramáticas diferencias en la relación alimento/respiración.
1 Esta ecuación sugiere que la temperatura es más importante que el peso del cuerpo para determinar el valor de M lo cual concuerda con nuestros resultados. Lo que no está tan claro en esta ecuación es cuáles podrían ser los efectos sobre la M de las presas al darse cambios en la abundancia del depredador
| Especies | Talla media | Temperatura del agua | Mes o estación | Ración diaria | Origen |
|---|---|---|---|---|---|
| (g o cm) | (°C) | ||||
| Lucio del norte | 32–49 cm | 2 | Abril | 0,03a b c | |
| Esox lucius | (talla estandar) | 14–18 | Jun. | 1,8a c | |
| Jun. | 3,1c | Diana (1979) | |||
| Platija americana (hembras de 11 años) | 256 g | 2–3 | Mar-Abr. | 0,08c | MacKinnon (1973, 1973a) |
| Hippoglossoides platessoides | Agosto | 1,4c | |||
| Rabil | 2 629 g | 23–32 | todos | 0,61 | |
| Thunnus albacares | 8 603 | 0,92 | |||
| 22 655 g | 0,76 | Olson (present study) | |||
| 219 g | 17 | Jun. | 1,0 | ||
| Stizostedion vitreum vitreum | 354 g | Sept. | 3,0 | Swenson and Smith (1973) | |
| Centrarchidos varios | 40 cm-lucio | ||||
| 16 cm-otros | 6–26 | Verano | 1–2 | Seaburg and Moyle (1964) | |
| Tiburón mako | |||||
| Isurus oxyrinchus | 63 000 g | 18,8 | - | 3,2 | Stillwell and Kohler (1982) |
| Rodaballo diamante | Lane (1975) | ||||
| Hypsopsetta gluttulata | 96 g | 12,5–24,0 | todos | 3,8 | Lane, Kingsley y Thornton |
| (1979) | |||||
| Perca | >20 cm | - | Jun.-Jul. 1971 | 6,5 | |
| Perca fluviatilis | (talla total) | Agosto 1971 | 5,2 | ||
| Sept. 1971 | 3,2 | ||||
| Jun. 1972 | 4,7 | ||||
| Agosto 1972 | 4,3 | Thorpe (1977) |
| a Machos | c dadas en kcal/kg/día-trasformadas en porcentage de peso cuerpo/dia en base a 1 000 kcal/kg. |
| b Hembras |
| Temperatura ambiente (°C) | Indice de | Indice |
|---|---|---|
| actividad | respiración/alimentación | |
| 31 | 1,414 | 283 % |
| 30 | 1,320 | 230 % |
| 29 | 1,231 | 187 % |
| 28 | 1,149 | 152 % |
| 27 | 1,072 | 123 % |
| 26 | 1,000 | 100 % |
| 25 | 0,933 | 81 % |
| 24 | 0,870 | 66 % |
| 23 | 0,813 | 65 % |
| 22 | 0,758 | 43 % |
| 21 | 0,707 | 35 % |
En los análisis convencionales de pesquerías basados en dinámicas monoespecíficas, estamos acostumbrados a asumir que la tasa de mortalidad natural M puede ser considerada como una constante a lo largo de la fase explotada de la vida de la especie. Esta asunción se hace necesaria a fin de resolver la ecuación de captura, incluso en el caso en que se pueda demostrar mediante análisis de sensibilidad que la predicción de rendimiento que se desprende de la ecuación está particularmente influenciada por las variaciones de este, variante y difícilmente medible, parámetro. La asunción de una M constante es tolerable para evaluaciones monoespecíficas, y puede considerarse como una consecuencia lógica de la lenta tasa de cambio de la tasa de alimentación con la talla para los depredadores por encima de unos 50 gramos de peso, tal como vemos en la Figura 67. De cualquier modo esta conclusión es válida siempre que las abundancias relativas del depredador y de la presa permanezcan más o menos constantes, cosa que no siempre ocurre. Desde la perspectiva de un intento de comprensión de las interacciones multiespecíficas, considerar el valor de M como una variable resultante de las abundancias relativas y de las tasas dealimentación del depredador y de la presa en el ecosistema, puede constituir una alternativa lógica a las asunciones “estáticas” de (por ejemplo) el modelo ECOPATH. El punto que se está constituyendo como fundamental es el establecido en el último seminario del ICLARM/CSIRO sobre Toría y Ordenación de Stocks Multiespecíficos están Tropicales, consistente en que en el caso de pesquerías donde los efectos multiespecíficos están empezando a sesgar de forma considerable las evaluaciones monoespecíficas, precisamos de herramientas, aunque no refinadas, que nos permitan basar nuestras conclusiones en acontecimientos que afectan al sistema en su conjunto. Una posible aproximación al modelado de M como un parámetro a estimar determinado por la intensidad de depredación (en sus términos más simples, una función de las abundancias relativas del depredador y de la presa y de la tasa alimenticia del depredador), podría resultar preliminarmente útill para comprender la dinámica del sistema.
Otra posibilidad por la que podemos optar para simplificar los modelos multiespecíficos, consiste en expresar las tasas de crecimiento, mortalidad y migración en términos de biomasa en lugar de utilizar el número de individuos (por ejemplo, como en Laevastu y Larkins, 1981). Estos autores indican que en áreas en las que escasean los datos, la utilización de tasas ponderales pueden resultar preferibles a los modelos basados en el número de individuos, incluso en el caso de que tal opción signifique la imposibilidad de integrar de forma simple los resultados obtenidos en modelos estructurales (por clase de edad). Las definiciones propuestas son, por ejemplo:
La biomasa (Bn) en el año n, será:
Bn = Bn-1 exp (gn - Zn)
donde: Zn es la tasa de mortalidad en el año n
Bn-1 es la biomasa en el año anterior, y
gn es la tasa exponencial de crecimiento de biomasa en el año n.
De forma similar la mortalidad natural causada por depredación (Mp) será:
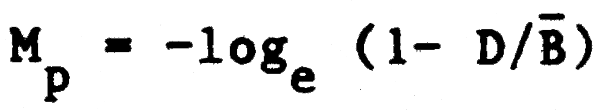
donde D es la biomasa consumida por depredación y 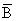 es la biomasa media a lo largo del año. Estos
conceptos se desarrollarán algo más en el capítulo próximo sugiriendo algunos índices simples, con
el fin de valorar el probable impacto de los diferentes depredadores en la mortalidad natural de la
presa.
es la biomasa media a lo largo del año. Estos
conceptos se desarrollarán algo más en el capítulo próximo sugiriendo algunos índices simples, con
el fin de valorar el probable impacto de los diferentes depredadores en la mortalidad natural de la
presa.
La Relación Entre las Biomasas del Depredador y de la Presa y la Tasa de Mortalidad Natural de la Presa
La relación entre la depredación y la tasa de mortalidad natural de la población de la presa fue expresada como una función de la biomasa del depredador por Munro (1979, 1982) de la forma siguiente:
M= Mx + gP …………… (1)
donde P = a la biomasa de los depredadores y Mx es la mortalidad debida a causas naturales diferentes a la depredación (por ejemplo, enfermedad, vejez, etc., conlo que no acaban como presa de los depredadores habituales). Evidentemente en este contexto, Mx resultará probablemente menor, en tanto enfermedades y vejez den lugar a una mayor depredación, y desde un punto de vista trófico estos dos tipos de factores actuarán, simplemente facilitando la transferencia de biomasa de la presa al depredador, con lo que probablemente podría justificarse escribiendo:
Mx + gP …………… (2)
Esta segunda ecuación asume, no obstante, que la biomasa del depredador P actúa de forma análoga al esfuerzo de pesca (f) en la ecuación F = qf. Esto resulta algo engañoso, ya que la ecuación (2) asume una abundancia constante de la presa, o que una biomasa dada de depredadores actúa “catalíticamente” induciendo a una mortalidad de presas dada, independientemente de la biomasa de la presa. En vista de las necesidades tróficas del depredador, la biomasa de la presa también debe constituir un término de la ecuación, especialmente si atendemos a la teoría depredador-presa, en que la biomasa depredador+presa tienden cada una a oscilar desfasadamente con respecto de la otra. Evidentemente, en tanto la biomasa de la presa disminuye manteniéndose la biomasa media del depredador, M debe incrementarse si los requerimientos alimenticios del depredador deben ser satisfechos. No obstante, puede formularse una burda aproximación bastante intuitiva, atendiendo de nuevo a la simple relación entre una presa y su depredador en un sistema no explotado, e ignorando los problemas derivados de la disponibilidad. Según Laevastu y Larkins (1981) se puede postular una relación entre las mortalidades del depredador y de la presa tal que la proporción de presas consumidas en un intervalo será una función de las biomasas o densidades relativas del depredador y de la presa en un marco determinado.
En primer lugar se asume que los requerimientos alimenticios del depredador en la unidad de tiempo pueden ser expresados como una fracción (o múltiplo) simple de su propia biomasa = aBi+1.
Al final del intervalo de tiempo, ignorando los efectos del crecimiento de depredadores y presas, la biomasa original de la presa B'i se reduce a (B'i - aBi+1), y la correspondiente tasa de disminución de biomasa por depredación M'i será:
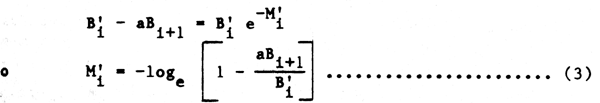
Por supuesto que esta formulación asume que podemos definir las tasas de mortalidad en términos de biomasa con mayor facilidad que en número de ejemplares. Esta tasa (M') ha sido establecida como una tasa ponderal, y no es necesariamente idéntica a la tasa de mortalidad natural, M en número de ejemplares. Esta aproximación puede resultar aceptable como primera aproximación, pero la depredación específica de cada talla y la composición por clases de edad de depredadores+presas deberán ser tomadas en consideración, tal como ya se indicó anteriormente. Así mismo la asunción de una tasa de alimentación constante implícita en la constante a ignora los cambios dependientes de la densidad en la energética de la alimentación ligados a las estaciones y a la talla, y no tiene en cuenta las diferentes energías necesarias para capturar diferentes presas, y los diferentes presas, y los diferentes valores calóricos de las diferentes presas. Pese a ésto, la ecuación (3) se muestra como un punto de partida razonable para un tratamiento muy simple del problema, y tal como hemos señalado, una expresión similar ha sido utilizada por Laevastu y sus colaboradores.
Atendiendo brevemente a algunas de las dificultades planteadas por la formulación simple utilizada anteriormente, se puede sugerir que en la medida en que discutamos la relación depredador-presa en términos de abundancia media de las especies en el ecosistema a quasi largo plazo (la asunción de “equilibrio” que generalmente subyace en la mayoría de aplicaciones de la teoría de pesquerías) implicando que la relación depredador-presa permanece relativamente estable, la producción excedente debida al crecimiento y a la reproducción de las presas no explotadas por el hombre, será por término medio, aproximadamente equivalente al incremento de biomasa de los depredadores (una vez cedida por conversión de la presa en biomasa del depredador). En base a estas asunciones puede admitirse la sustitución de la biomasa media en la ecuación (3). Con lo que:
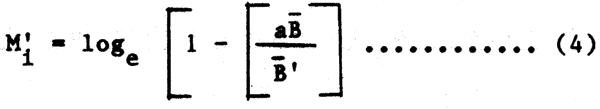
que representa una forma simple de primera mano para obtener órdenes de magnitud de M, lo que nos da una idea de las interrelaciones tróficas (es decir de una red alimentaria), y una idea de la biomasa relativa del depredador y de la presa, del tipo de las obtenidas por medio de campañas de prospección a base de operaciones de arrastre estratificadas o campañas acústicas, si éstos pueden ser citados como métodos de estimación de biomasas relativas.
Mortalidad de las Presas a Causa de la Depredación
Atendiendo a la interrelación entre una presa y su depredador, e ignorando los problemas de disponibilidad, se pueden postular relaciones entre un depredador y la mortalidad que ejerce sobre sus presas, tales que la proporción de presas consumidas en un intervalo será función de la abundancia relativa de depredadores respecto a la biomasa de las presas. Por otro lado, si la abundanicia de presa cae por debajo de los requerimientos alimenticios del depredador pueden dar lugar a cambios de presa, emigración del depredador, o incluso en un caso extremo muertes naturales del depredador por inanición, que no pueden ser contemplados en esta aproximación de carácter simplista.
En todas estas circunstancias la simple aproximación anterior se viene abajo. No obstante si asumimos que de la Figura 67 se puede extraer alguna idea acerca de la magnitud de la tasa media de alimentación annual (es decir, que a' = 365 a), resulta interesante observar qué orden de magnitud o qué M se obtiene en la ecuación 4.
Podemos considerar una pareja depredador-presa donde un depredador A, con un peso medio individual de 700 g y una biomasa media de 1 000 t, es el depredador único, y que actúa exclusivamente sobre la especie B, una especie presa con una biomasa de 15 000 t, siendo la temperatura ambiente de 10°C. Aplicando la ecuación 4 la predicción de M annual correspondiente a la especie B debida a depredación, series:
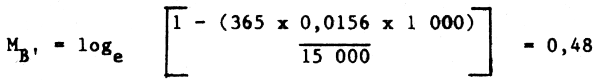
Asumiendo un incremento de la temperatura ambiente a un nivel en que se doble la tasa alimenticia de A, entonces:
MB' = 1,42
y si la biomasa A se reduce a 600 t a causa de la pesca (manteniéndose constantes la biomasa de la presa y la temperature):
MB' = 0,61
Obviamente los valores obtenidos deben ser considerados con cierto escepticismo, pero esta aproximación puede resultar útil en la predicción de los efectos de cambios importantes de la biomasa relativa o de la temperatura, o para comparar el impacto producido por especies residentes y migratorias sobre una presa. Para abordar este último aspecto la ecuación podría ser modificada con el fin de que proporcionará alguna idea del impacto de la depredación estacional ejercida por múltiples depredadores a través del valor de M correspondiente a la especie presa B'. Así, si I = 1,2,3 …n depredadores con una biomasa Bi, cada uno de los cuales permanece una parte del año ti alimentándose de la especie presa B' con una tasa diaria ai, y siendo Pi la proporción de la dieta cubierta por B', entonces aplicando el mismo planteamiento lógico, tenemos:
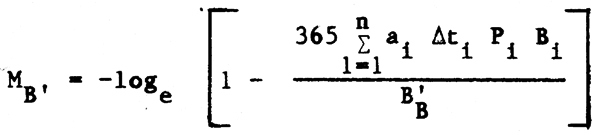
Así si una presa A con una biomasa de 10 000 t, y tres depredadores C, D y E forman parte de una “asociación unidadad de producción” simple, cuyas características son:
| Tasa diaria de alimentación | Proporción de alimentación sobre A | Proporción de A en los contenidos estomacales | Biomasa (t) | |
|---|---|---|---|---|
| C | 0,02 | 0,3 | 0,20 | 100 |
| D | 0,03 | 0,3 | 0,10 | 500 |
| E | 0,06 | 0,8 | 0,15 | 850 |
¿Cual es la predicción de M?. Basándonos en los anteriores será MB' = 0,28.
Quizás como conclusión, el valor de este tipo de aproximaciones es superior por cuanto posibilita una predicción de los efectos de ciertos tipos de modificaciones, que se producen en la población, sobre el valor conocido o no de M, más que como un método para estimar el valor de M. Esta aproximación también parece que puede proporcionar primeras estimaciones de parámetros para modelos simples tales como el ECOPATH, y ser útil para comparar los impactos relativos de, por ejemplo, residentes y transeúntes sobre una presa. Así mismo podría porporcionar un camino para abordar el problema del “no-equilibrio” en pesquerías, dado que los cambios en la tasa de mortalidad natural de las especies en una red alimentaria es probablemente una de las causas de los cambios en la composición de especies que se observan con frecuencia en los sistemas fuertemente explotados.
TOP NEXT