La determinación de la estructura de edades de una población de peces en base de las estructuras de crecimiento está fundada en su periodicidad uniforme y en la sincronía de su formación en una cohorte determinada dentro de la población y en que a intervalos de tiempo regular se deposite una nueva estructura de crecimiento. Al iniciar el estudio de una población debe determinarse que se cumplen los criterios básicos de periodicidad y sincronía. Extrapolar los resultados de otras poblaciones no es válido (Beamish y MacFarland, 1983).
Los métodos de validación pueden dividirse en directos e indirectos. En los directos, el intervalo de tiempo transcurrido entre dos sucesos determinados es conocido permitiendo determinar la periodicidad de los incrementos formados. En los indirectos las tallas medias de cada clase de edad determinadas a partir de los incrementos se comparan con las obtenidas por otros métodos. Cuando los resultados concuerdan se considera válido el uso de los incrementos. Este acercamiento se emplea en especies que no pueden cultivarse o mantenerse en cautividad y de las que únicamente se dispone de datos de la pesquería.
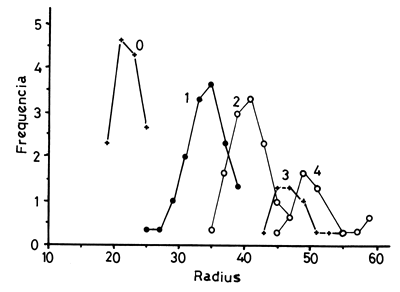
Fig. 10.- Distribución de las distancias del centro del otolito a cada anillo considerado como anual en Lethrinus.
El método más preciso para determinar la periodicidad de los incrementos es criar los peces y sacrificarlos secuencialmente. Al estudiar los otolitos se determinará la edad a la que se inicia la formación (días transcurridos entre la eclosión y la formación del primer incremento) y la periodicidad de los incrementos.
El período entre la eclosión y la reabsorción del saco vitelino debe estudiarse intensivamente para determinar el inicio exacto de la formación. Esta se inicia en función de la duración del periodo embrionario y de la especie. Generalmente el inicio de la formación coincide con la eclosión o con el principio de la alimentación activa (Brothers et al., 1976; Geffen, 1983; Marshall y Parker, 1982; Mcgurk, 1984; Neilson y Geen, 1982; Stenffensen, 1980; Wilson y Larking, 1980; Yzeng y Yu, 1988).
Al graficar el número de incrementos en los otolitos contra el número de días transcurridos desde el nacimiento, se obtendrá una relación lineal de pendiente no significativamente distinta de 1. La ordenada en el eje de abcisas indicará la edad al inicio de la formación. El número de muestras a observar se determina asignando un límite de confianza del 95% al calcular la edad individual a partir de la relación lineal.
Marcar los otolitos con una substancia química que se incorpore a su estructura y actúe como punto de referencia permite trabajar con peces de edad desconocida. El período transcurrido entre el marcado y el sacrifico se conoce, por lo que el crecimiento producido se determina facilmente (Wild y Foreman, 1980).
La captura, marcado y liberación en el medio se ha realizado con especies resistentes que sobrevivan al estrés producido y que sean marcables en números suficientes para garantizar recapturas. Aunque el crecimiento esté afectado por la manipulación, reflejará el crecimiento en condiciones naturales.
Cuando los peces se mantienen en cautividad, es necesario pasar cierto tiempo de aclimatación antes de iniciar el experimento ya que el estrés puede causar detenciones del crecimiento y las consiguientes discontinuidades en el otolito.
El marcador usado más frecuentemente es la tetraciclina que actúa como quelador del calcio y magnesio presente en los tejidos calcificados. Bajo el microscopio de fluorescencia y luz ultravioleta la banda de tetraciclina aparecerá como un anillo amarillo contra el fondo verdoso del otolito. La tetraciclina se degrada con la luz, por tanto los otolitos deberán guardarse en obscuridad (Chilton y Beamish, 1982).
La tetraciclina en forma de OTC (hidroclorato florico de tetraciclina) se suministra a los peces en la dieta o en inyección intraperitoneal a concentración de 25–30 mg por kilo de peso del pez (Wild y Foreman, 1980). El marcado masivo de larvas y juveniles se realiza por inmersión durante 120 m, en una solución de 500 mg/1 de tetraciclina en agua destilada con 3.5% de NaCl tamponada con tris a pH 6.0–6.2 (Hettler, 1984; Schmitt, 1984).
En los experimentos de marcado es frecuente que buen número de ejemplares presenten bandas de fluorescencia difusa o carezcan de ellas (Chilton y Beamish, 1982). En experimentos de marcado con Lutjanus kasmira se encontró evidencia de que durante períodos de crecimiento lento, la cantidad de tetraciclina fijada era demasiado pequeña para dar una banda de fluorescencia clara (Morales-Nin, Ralston y Uchiyama, umpubl.dat.).
Los otolitos pueden marcarse para observación con SEM, produciendo detenciones del crecimiento que se inducen mediante inmersión durante 18 h en una solución 125 ppm de acetolamida (Ralston y Miyamoto, 1981), o mediante estrés experimental inducido por anoxia o shock térmico (fig. 11) (Pannella, 1980).
En este tipo de experimentos suele encontrarse una gran variación individual en el momento y frecuencia de formación de la marca en el otolito, por tanto deben marcarse un buen número de individuos para garantizar resultados en el experimento. Son frecuentes los peces sin una marcar clara o con un anillo fluorescente difuso.
El tipo de relación entre el número de días tras el marcado y los incrementos formados nos indicará el proceso de formación. Una relación lineal con orígen 0 indica correspondencia (número de días = número de incrementos), cuando el origen es distinto de cero indica un período de latencia antes del inicio de la formación. Cuando la relación no es lineal, puede no existir correspondencia o los incrementos ser demasiado finos para ser detectados por microscopía óptica.

Fig. 11.- Discontinuidad del crecimiento del otolito causada por un fuerte estrés ambiental. Escala 12 μm.
A partir de la fecha de captura y de la edad determinada, se puede calcular la fecha de nacimiento de cada pez (Methot, 1983). Al comparar la fecha calculada con el periodo de puesta de la especie se estima la precisión de la determinación de la edad.
El método puede aplicarse únicamente a larvas y juveniles, ya que la mortalidad selectiva puede alterar los resultados en adultos. Discrepancias entre la fecha de nacimiento calculada y el período de puesta pueden ser debidas a detenciones en el crecimiento o a desviaciones de la periodicidad diaria (Geffen y Nash, 1985).
Los patrones cíclicos del crecimiento (semanales, mensuales, estacionales) formados en los otolitos (fig. 12) dependen de factores externos periódicos. Cuando los patrones de crecimiento son regulares y pueden asociarse a un estímulo ambiental, su periodicidad permite determinar la frecuencia de formación de los incrementos. En especies litorales con ciclos de 7–14–28 incrementos, la periodicidad diaria de los otolitos puede darse por sentada (Geffen, 1987). De forma similar, el número de incrementos en un anillo estacional se ha utilizado para determinar su periodicidad (Gjosaeter et al., 1983).
Las fases de metamorfosis en el período larval se reflejan en la estructura nuclear del otolito (Brothers y MacFarlan, 1981; Marshall y Parker, 1982). La edad a la que se producen las distintas fases metamórficas es conocida para muchas especies por lo que pueden relacionarse con la estructura del otolito (Geffen, 1987).
La formación de los incrementos depende de un ritmo interno sincronizado con las fluctuaciones del ambiente a través de un estímulo cíclico (Campana y Neilson, 1985). Un grupo de peces sometidos a las mismas condiciones ambientales deben formar sus incrementos sincrónicamente. Al muestrear repetidas veces a lo largo de un período diario, la evolución del incremento formado en el borde del otolito puede seguirse y su periodicidad ser determinada.
La gráfica del porcentaje de formación del incremento marginal (c), determinado por medición del incremento en formación (ln) y del inmediatamente anterior (ln-1):
c = 100(ln/ln-1)
permitirá determinar el momento de formación del incremento (Mugiya et al., 1981).
Este método ha sido aplicado a peces criados en cautividad (Morales-Nin, 1985 b) y a peces que permanecen en la misma área sin migrar verticalmente a lo largo del día (Ré, 1983). El método puede aplicarse sólo a larvas y juveniles, ya que al preparar los otolitos de peces adultos suele dañarse el incremento marginal.

Fig. 12.- Agrupamientos cíclicos en el crecimiento de otolito de Haplochcomis probablemente relacionados con variaciones rítmicas del medio. (Escala 86 μm).
d) Progresión de la edad media, si la población está compuesta principalmente de una clase de edad, que una vez reclutada no migra, la evolución en el tiempo de las edades medias permite determinar la periodicidad de formación de los incrementos (Darayatne y Gjosaeter, 1986).
La similitud entre las curvas de crecimiento calculadas a partir de los incrementos y por otros métodos puede validar las edades determinadas por recuento de los incrementos. Al comparar las distintas curvas de crecimiento deben considerarse rangos de talla similares ya que el crecimiento cambia con la edad.