La configuración del flujo depende principalmente de la escorrentía producida por las precipitaciones sobre la cuenca fluvial. Estas pueden realizarse en forma de lluvia en las zonas templadas y tropicales, en cuyo caso las respuestas de las corrientes de orden inferior a los cambios en las precipitaciones tienen una relación directa con la estacionalidad de las lluvias. En las regiones frías y en altitudes elevadas las precipitaciones suelen ocurrir en forma de nieve, en cuyo caso la salida del agua por los cauces se relaciona más estrechamente con los períodos de fusión de la nieve. La retención y la afluencia del agua subterránea, factores importantes para mantener el flujo de los cauces fluviales durante la estación seca, contribuyen menos a las inundaciones y tienden a igualar los flujos, reduciendo la amplitud pero prolongando la duración de una inundación. La proporción de agua de lluvia que se traduce en escorrentía o en agua subterránea depende del tipo de terreno y de su cubierta vegetal. Las diferencias locales en estos factores pueden dar lugar a modalidades muy distintas de inundaciones, incluso en corrientes adjacentes. Por esta razón, y por la rapidez con que la escorrentía producida por aguaceros locales puede afectar a corrientes de orden inferior, los gráficos del nivel hídrico o el flujo de los ríos menores suelen presentar un aspecto “picudo”, con muchos cambios rápidos en el caudal. A medida que los arroyos y río menores se funden en ríos mayores y de orden superior, los regímenes de todos ellos se unifican de manera que el flujo se hace más uniforme(Fig. 2.1), reflejando las precipitaciones medias en una superficie cada vez mayor. El destino ulterior del flujo depende de la forma de la cuenca: los ríos de embalse tienen características internas que reducen la variabilidad del flujo, distribuyéndolo de manera más igual a lo largo del año y evitando las crecidas exageradas. Elementos como pantanos extensos, bosques, lagos o incluso las propias zonas de anegamiento peden almacenar agua que afluirá más tarde. Del mismo modo pueden actuar las descargas combinadas de muchos afluentes procedentes de latitudes diversas y cuyos períodos de crecida máxima sean por lo tanto distintos. Los tramos bajos de los ríos, por consiguiente, pueden presentar a menudo características de “embalse”: un buen ejemplo podría ser el río Zaire por debajo de Kisangani. Incluso aquí hay dos crecidas máximas pronunciadas (Marlier, 1973). La existencia de pantanos, bosques y lagos en la cuenca del río no asegura por sí sola la regulación del flujo, y muchos ríos de crecida tienen todas estas características.
Aunque Leopold et al. (1964) mantienen que la rapidez del flujo permanece más o menos constante al descender la corriente en los ríos de los Estados Unidos, es más general la observación de que la velocidad disminuye al disminuir la pendiente. Los ríos de orden inferior tienden a tener flujos más rápidos en congruencia con la mayor pendiente de las corrientes de montaña, mientras que las corrientes de orden superior tienen flujos lentos en los meandros del curso bajo. Sin embargo, algunos ríos de orden superior como el Magdalena en Colombia y el Sepik en Papua Nueva Guinea tienen velocidades considerables en sus sectores potámicos, que pueden correr a más de 2 a 3 metros/segundo en la época de aguas bajas. Porel contrario, el flujo puede cesar por completo en las corrientes de orden inferior o incluso en los cauces principales durante la estación seca, y en muchos ríos modificados la extracción de agua para el riego ha llegado a tal extremo que rara vez hay un excedente neto de agua que desague en el mar. Evidentemente es difícil generalizar sobre la velocidad de la corriente en varios ríos, ya que depende de muchas variables físcas y climáticas, pero la gama de velocidades citadas por Zhadin y Gerd (1961) para los ríos de Asia Menor y de la Unión Soviética sirve para ilustrar la desaceleración general del flujo a medida que el río se acerca a la desembocadura. Las velocidades comprobadas fueron 5–6 m/seg en los tramos altos, 3–3,5 m/seg al pie de las montañas y 2–2,5 m/seg en los tramos de llanura. Por otra parte, las velocidades cambian en tramos relativamente cortos del río, especialmente en el ritrón. Por ejemplo, la velocidad de la corriente en los tramos fluviales caucásicos en época de aguas bajas era 1,25 m/seg en los rabiones y sólo 0,6 m/seg en las charcas subsiguientes.
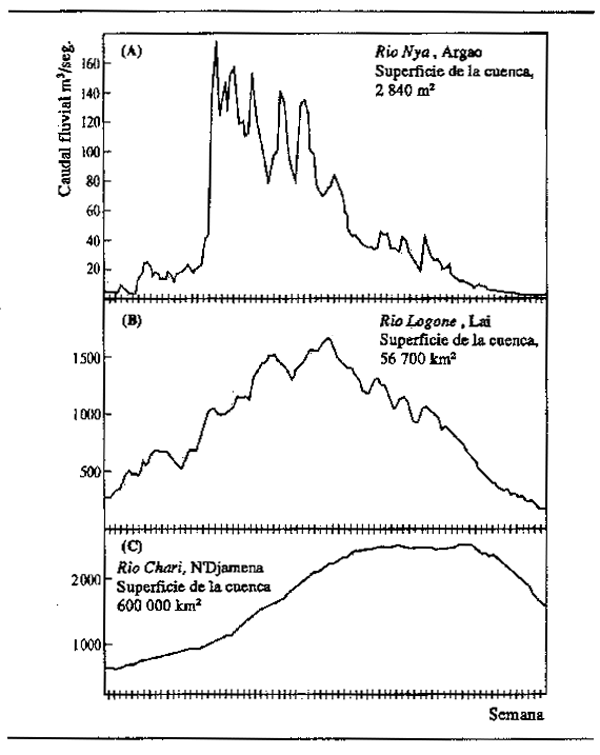
Figura 2.1 Régimen de crecida de ríos con cuencas de diferente extensión en el sistema fluvial Chari-Logone: la curva de crecidas se suaviza a medida que aumenta la superficie de la cuenca
Es muy importante para la flora y la fauna fluviales el hecho de que la velocidad del agua no aumente proporcionalmente con el caudal. Tanto Leopold y Maddock (1953) como Drury (1969) presentan gráficos según los cuales la velocidad media en cualquier punto de un río sólo se duplica cuando el caudal se multiplica por diez. Además, como estas cifras se refieren a velocidades máximas en el centro del cauce, los aumentos de velocidad en el fondo o a los lados del cauce serán aún menores.
La misma idea de velocidad de la corriente puede deducirse del tamaño de las partículas en el lecho del río. La Fig. 2.7 muestra la velocidad media de la corriente que se requiere para mover partículas de varios tamaños río abajo, de manera que los sedimentos existentes en el lecho deberán indicar que las velocidades son justo las inferiores a especificadas en la lista para cada caso. Este método sirve sólo como orientación aproximada para calcular la velocidad media, ya que los resultados obtenidos por diversos autores no son muy coincidentes. Además, la resistencia al movimiento no es función exclusivamente del tamaño de las partículas, ya que la arcilla compacta se deja arrastrar mucho menos fácilmente que la arena, aunque el tamaño de sus partículas sea mucho menor.
Las inundaciones tienen su origen en tres casas:i) desbordamiento del agua sobre el cauce del río; ii) lluvias locales; y iii) mareas.
Desbordamiento del río
Cuando el flujo aumenta, se llega a un punto en que el cauce no tiene ya cabida para evacuar el volúmen de agua que recibe el río. Si el caudal sigue aumentando por encima de este punto (nivel de cauce lleno), el agua desbordará sobre la llanura. En este caso, la horizontalidad del terreno hace que el volumen mayor de agua se alcance por expansión lateral más bien que en profundidad, derramándose y extendiéndose el agua lentamente hacia afuera, obstaculizada en su marcha por la vegetación de la llanura. Este “flujo reptante” es sedimentador (es decir, el limo en suspensión se deposita en la llanura), a diferencia del flujo erosionador que se produce cuando una corriente impetuosa está encerrada en el cauce principal o entre las terrazas que limitan el valle.
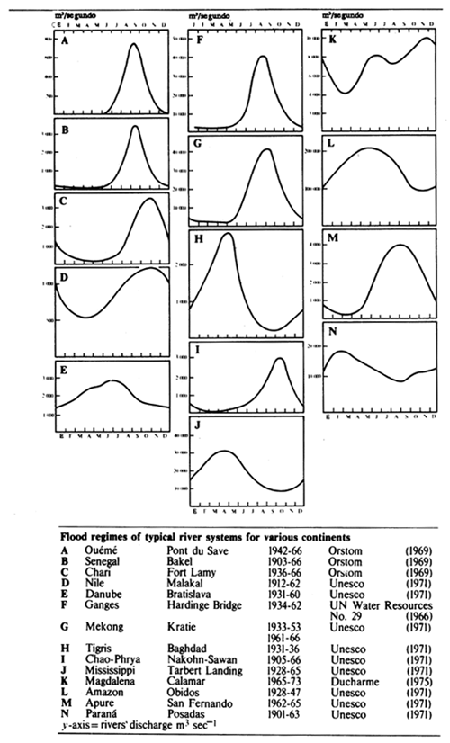
Figura 2.2 Regímenes de crecidas de sistemas fluviales típicos en varios continentes
Los gráficos de variación del nivel hídrico, o flujo de una crecida en función del tiempo (curvas de crecida) respecto a los grandes ríos tienen el aspecto de olas (Fig. 2.2), generalmente de un solo ciclo, aunque aguas abajo de la confluencia de dos sistemas con diferentes regímenes hídricos puede haber crecidas en varios ciclos. La ola de crecida se mite en ampiiiud (diferencia entre los caudales máximo y mínimo) y duración (tiempo transcurrido desde una fase de aguas bajas hasta la siguiente). Avanza valle abajo a una velocidad que puede depender de muchos factores, entre ellos la pendiente y el grado de encajonamiento del valle, el tipo de vegetación y la intensidad de la crecida. En el río Níger, por ejemplo (Fig.2.3A), la cresta de la crecida tarda más de 100 días en pasar de Koulikoro a Malanville. Siendo esta distancia de 1 160 km, la velocidad media a la que viaja es de 17 km diarios. Velocidades análogas de transmisión se encuentral en el río Senegal, donde los 620 km de Galougo a Dagana son recorridos en un mes (17 km/día) (Fig. 2.3B) y en el Chari, donde los 745 km entre Mossala y N'Djamena se recorren en 42 días (18 km/día) (Fig.2.3C). La crecida avanza valle abajo a unos 13 km/día en el Brahmaputra, 29 km/día en el Mekong medio y 13 km/día en la llanura inundable del bajo Mekong. En los llanos de Kafue la velocidad de transmisión es 11 km/día, y en el Gran Delta del Níger 13 km/día. Estas cifras son promedios calculados sobre distancias considerables, habiendo variaciones de velocidad entre los diversos sectores de un mismo río. En general, cuanto más extensa es la llanura, menor es la pendiente y mayor es la cubierta vegetal, será menor la velocidad de la cresta de crecida. El avance de una ola de crecida por una zona de anegamiento es actualmente fácil de comprobar utilizando imágenes tomadas desde satélite. Por ejemplo, en la Fig.2.4 se indican cuatro fases del paso de la crecida por la llanura de Yaeres (según Quensiere, 1981).
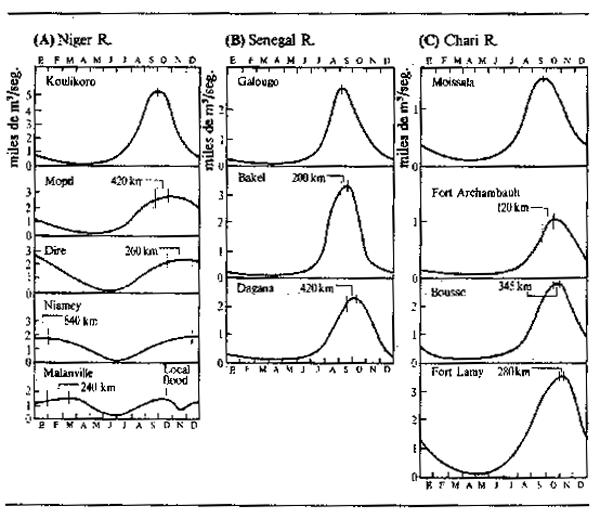
Figura 2.3 Tiempo invertido por la ola de crecida para cubrir la distancia entre puntos determinados de tres sistemas fluviales africanos. El tiempo que tarda la ola de crecida para cubrir la distancia entre dos puntos se indica mediante las líneas verticales que muestran el período de máxima crecida y la línea transpuesta del punto anterior aguas arriba, como pude verse en el gráfico; las cifras se refieren a la distancia entre un punto y el siguiente
En los ríos largos, cuando las fechas de las lluvias son bastante uniformes en todo su recorrido, la llegada de la cresta principal de crecida en los tramos inferiores puede demorarse hasta la estación seca. Tal demora es típica del Nío Níger, que experimenta dos crecidas en Malanville (Benin) (Fig.2.3), una en agosto-noviembre causada por las lluvias y las aportaciones de los ríos locales y una segunda en diciembre-marzo debida a la llegada de las masas de agua de las cabeceras del río.
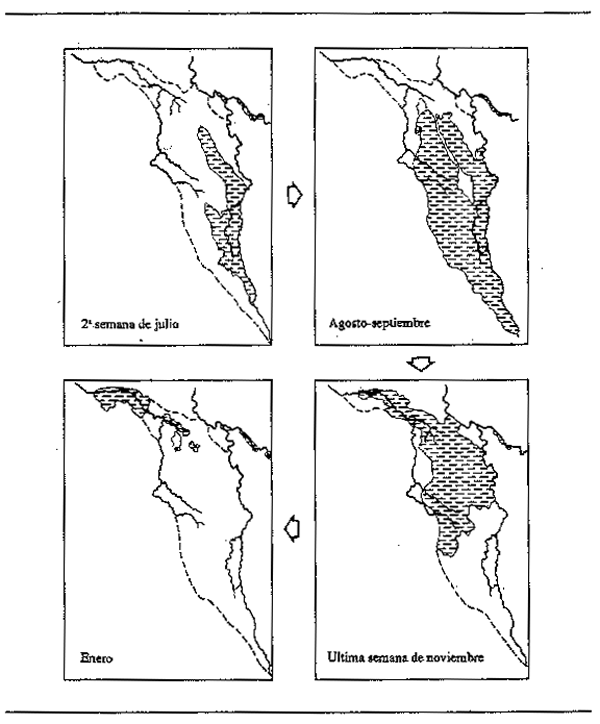
Figura 2.4 Fases sucesivas en la inundación de los Yaeres por desbordamiento del río Logone (según Quensiere, 1981). —: Límites de la superficie total de anegamiento
Al pasar la ola de crecida por el llano inundado, tiende a reducirse en intensidad y a aumentar en duración, siempre que no reciba grandes masas de agua complementarias de otros afluentes. Este proceso se observa mejor en un río como el Níger, cuyo cauce discurre un buen trecho por tierras áridas y semiáridas.
Lluvias locales
Las precipitaciones en la llanura misma o en las cuencas inmediatamente circundantes de corrientes de orden inferior saturan el suelo y producen anegamientos locales que a menudo preceden bastante tiempo a la crecida principal. Ya los trabajos de Svensson (1933) mostraron que en el río Gambia algunas depresiones son inundadas sólo por precipitaciones locales y están conectadas al río y a otros pantanos bajos por un solo canal o caño. Las variaciones en la altura del río pueden no repercutir sobre estos pantanos, pero los peces pueden penetrar en ellos ascendiendo por los canales. El anegamiento temprano causado por las lluvias en las depresiones inundables se ha observado en varios sistemas. También en Africa, Carey (1971) describió inundaciones de este tipo en el Kafue. La inundación del Alto Chari (Bhar Salamat y Bahr Azoum) Parece deberse casi por completo a lluvias locales (Durand, comunicación personal), y en el Nilo Sudd los pantanos se llenan uno o dos meses antes de que desborden los ríos. Extensas zonas de los Llanos venezolanos (Matthes, com.pers.) y del Gran Pantanal o Chaco paraguayo del río Paraguay se inundan de esta manera (Carter y Beadle, 1930). Un tipo análogo de inundación ha observado Ohya (1966) en el río lrrawaddy, Birmania, donde el anegamiento por el agua de la lluvia precede en un mes aproximadamente a las riadas principales. El anegamiento pluvial difiere del producido por desbordamiento en que el flujo neto del agua se dirige de la depresión inundada hacia el río, y no en sentido contrario. El anegamiento pluvial prepara la inundación al saturar el suelo, llenar las depresiones de la llanura y recargar los depósitos de agua subterránea, de manera que el terreno apenas podrá absorber los desbordamientos subsiguientes.
Mareas
Las inundaciones causadas por la acción de las mareas afectan naturalmente a las partes de las zonas de anegamiento adyacentes a la costa. No obstante, se producen efectos secundarios por el represamiento de los flujos de agua dulce cuando el nivel de la marea es muy alto. Volker (1966) dividió los estuarios de los ríos en cuatro secciones (Fig.2.5): Zona A, donde las mareas verticales producen una inversión en la dirección de la corriente y donde el agua salada penetra en el cauce del río o en la llanura inundada; Zona B, en la que el agua del río sigue siendo dulce pero donde se observan todavía los efectos de la marea y la inversión de la corriente; Zona C donde el nivel del agua acusa todavía el efecto de la marea originando diferencias en la velocidad de la corriente, aunque ésta se dirige siempre hacia el mar; y Zona D, cuyo nivel de aguas y cuya corriente dependen únicamente del caudal recibido de más arriba; esta última zona se confunde aguas arriba con el río principal.
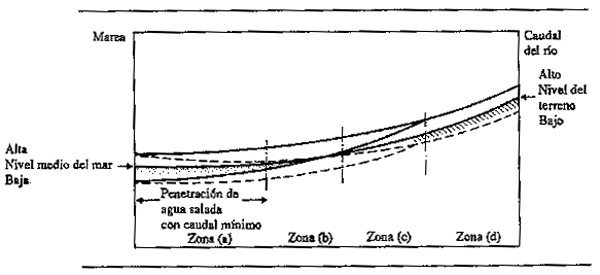
Figura 2.5 Zonas de interacción entre el agua de mar y el agua dulce en los estuarios y en las llanuras costeras deltaicas (según Volker, 1966)
La curva de crecida en cualquier punto del río resulta del caudal recibido del curso alto, de las aportaciones de los afluentes locales y de las precipitaciones en la zona inmediata. Esto puede representarse gráficamente como se indica en la Fig. 2.6, donde el eje ‘x’ es el tiempo. El eje ‘y’ puede representar cualquiera de los indicadores de la calidad del agua, los más corrientes de los cuales son el nivel, el coeficiente de descarga y el volumen de almacenamiento. Aunque el nivel del agua fluctúa constantemente, la crecida puede dividirse en dos partes. En la primera, el agua está contenida en el cauce del río y las modificaciones de caudal se traducen en cambios de profundidad y velocidad. Mientras la corriente no sale de su cauce, el aumento del caudal se debe principalmente al aumento de la profundidad de las aguas. Esta fase tiene como límite la altura de cauce lleno, por encima de la cual el agua desborda del cauce y se derrama sobre el llano. En adelante, los cambios en el volumen de agua entrante alteran relativamente poco el volumen de agua saliente, ya que el exceso de agua se almacena temporalmente en la llanura, donde el aumento de volumen se realiza principalmente mediante la extensión de la superficie anegada. El nivel de cauce lleno suele ser difícil de definir con exactitud, ya que varía de un lugar a otro en el río y también de un año a otro. Las leyes hidráulicas detalladas de las zonas de anegamiento son muy complejas y no es este el lugar de analizarlas; han sido objeto de muchos estudios e intentos de formulación de modelos matemáticos, como los elaborados por Weiss y Midgley (1975 y 1976).
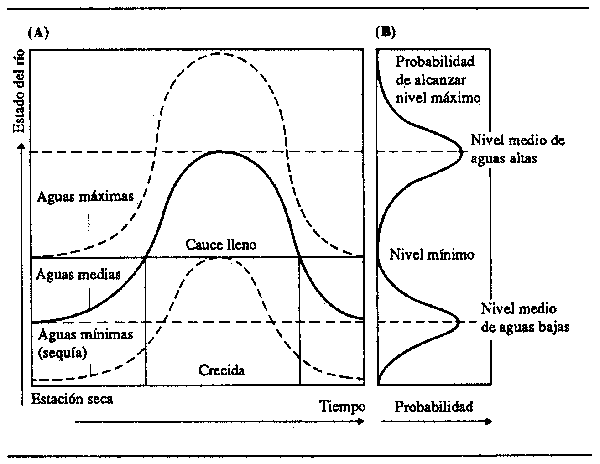
Figura 2.6 Diagrama de (A) un régimen de crecida anual generalizada, y (B) probabilidad de alcanzar niveles máximos y mínimos
La intensidad de la crecida varía de un año para otro en función de las fluctuaciones de la pluviosidad. Teniendo en cuenta esas variaciones, puede establecerse a lo largo de cierto número de años una distribución de la frecuencia con la que se alcanza cualquier nivel de crecida. Estas distribuciones (Fig. 2.6) pueden ser normales, pero lo más frecuente es que sean irregulares. El número de años que deben transcurrir, por término medio, entre una crecida de una altura determinada y la siguiente crecida de la misma altura se llama el período de retorno. La crecida de 100 años, por ejemplo, es el nivel de crecida que puede esperarse una vez cada 100 años. La probabilidad de que se presente una crecida determinada se corresponde con su período de retorno: la crecida de 100 año, una probabilidad de presentarse de 0,01.
No sólo varía la intensidad de la crecida de un año a otro, sino que se comprueba cada vez mejor que la variabilidad es de índole índole cíclica y puede referirse a tendencias climáticas mundiales a largo plazo (Winstanly, 1975: Bryson, 1974). Según estos ciclos, los años de crecida o sequía excepcionales tienden a agruparse, de manera que hay bastantes probabilidades de que aparezcan dos o más años seguidos de crecida intensa o que un año de bajo nivel de las aguas vaya seguido inmediatamente por otro año análogo. Cuando ocurre esto último, pueden resultar sequías como las que experimentaron los ríos sahelianos entre 1970 y 1974 y de nuevo en 1980–85. Esta forma de concentración de fuertes crecidas y sequías puede tener graves consecuencias sobre la ecología íctica, como veremos en la sección relativa a la dinámica de las comunidades de peces en las zonas de anegamiento. La variación del nivel de crecida es un fenómeno normal, y el conocimiento de sus límites y de los valores medios es esencial para comprender la ecología de estos sistemas. En el Cuadro 2.1 pueden verse las diferencias en la amplitud de las curvas de crecida, medidas por las descargas máxima y mínima. Las variaciones son muy acusadas, obteniéndose valores especialmente altos que tienden al infinito en los ríos que prácticamente dejan de fluir durante la estación seca. Un ejemplo de los efectos de tales variaciones sobre las zonas reales de anegamiento es el del río Senegal, como se indica en el Cuadro 2.2.
El Cuadro 2.3 presenta la pluviosidad media en ciertas zonas de anegamiento. En las regiones tropicales y subtropicales, las lluvias aportan sólo una contribución moderada al balance hídrico de la llanura, contrarrestada ampliamente por las tasas de evapotranspiración (Cuadro 2.4). Este exceso de la evaporación sobre las precipitaciones hace que el caudal neto efluente de algunas zonas de anegamiento sea mucho menor que el caudal entrante. Así, de los 71 100 millones de m3 que entran en el Delta Central del Níger por los ríos Níger y Bani en años de flujo normal, sólo 38 000 millones de m3 salen en Dire, lo que supone una pérdida neta del 46%. Análogamente, 27 000 millones de m3 de agua entran en el Sudd en Bor, y sólo 14 000 millones salen en Lago No, es decir una pérdida del 48% del agua. En algunos sistemas, por ejemplo los pantanos de Okavango, la evaporación casi contrarresta la afluencia de agua durante el año, de manera que no hay caudal efluente apreciable.
| Descarga en m3/segundo | ||||
|---|---|---|---|---|
| Cuenca vertiente (km²) | Máxima media | Mínima media | Máx/min | |
| Amazonas (Obidos) | 4 688 000 | 207 400 | 89 300 | 2.3 |
| Brahmaputra (toda la cuenca) | 580 000 | 72 460 | 2 680 | 27.0 |
| Mekong (toda la cuenca) | 795 000 | 67 000 | 1 250 | 53.6 |
| Ganges (toda la cuenca) | 977 500 | 61 200 | 1 170 | 52.3 |
| Orinoco (Ciudad Bolívar) | 850 000 | 46 200 | 7 520 | 6.1 |
| Indo (toda la cuenca) | 970 000 | 31 200 | 490 | 63.7 |
| Mississippi (Tarbet Landings) | 3 928 000 | 30 800 | 7 930 | 3.9 |
| Paraná (toda la cuenca) | 2 039 000 | 25 130 | 6 300 | 4.0 |
| Magdalena (Calamar) | 238 000 | 10 000 | 3 900 | 2.6 |
| Oubangui (Bangui) | 500 000 | 9 640 | 1 070 | 9.0 |
| Nilo Azul (Jartum) | 325 000 | 5 950 | 138 | 43.1 |
| Senegal (Bakel) | 218 000 | 3 430 | 26 | 131.9 |
| Chari (N'Djamena) | 600 000 | 3 390 | 199 | 17.0 |
| Chao Phrya (Nakhon Sawan) | 110 371 | 3 363 | 32 | 105.1 |
| Níger (Mopti) | 281 600 | 2 820 | 67 | 42.1 |
| Danubio (Bratislava) | 131 600 | 2 820 | 67 | 42.1 |
| Tigris (Bagdad) | 134 000 | 2 720 | 286 | 99.5 |
| Benue (Garoua) | 64 000 | 1 920 | 32 | 60.0 |
| Ouémé (Pont du Save) | 23 600 | 758 | 0.63 | 1203.0. |
| Año | Significación estadística | Superficie máxima anegada (ha) |
|---|---|---|
| 1924 | Máxima crecida registrada | 838000 |
| 1964 | Gran crecida del quinquenio | 766000 |
| 1969 | Crecida media | 549000 |
| 1926 | Crecida débil del quinquenio | 215000 |
| 1972 | Crecida más débil registrada | 104000 |
Las elevadas tasas de evaporación significan también que, para conservar el agua, las charcas o lagunas deben rellenarse anualmente en mayor medida que las pérdidas debidas a la evapotranspiración (entre 1, 2y2, 2 m según los datos del Cuadro 2.3), o bien deben recibir aportaciones del agua subterránea.
| Precipitaciones anuales (mm) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| E | F | M | A | M | J | J | A | S | O | N | D | Media | |
| AFRICA | |||||||||||||
| Malí (Bamako) | - | - | 0.4 | 15.2 | 37.7 | 137.2 | 348.0 | 205.7 | 43.2 | 15.2- | - | 1120.1 | |
| Sudán (Wau) | - | 5.1 | 22.9 | 66.0 | 134.6 | 165.1 | 190.5 | 208.3 | 167.6 | 124.5 | 15.2 | - | 1099.8 |
| Botswana (Maun) | 106.7 | 8.7 | 71.1 | 17.8 | 5.1 | 2.5 | - | - | - | 22.9 | 5.84 | 8.64 | 434.3 |
| Zambia (Lusaka) | 235.1 | 190.5 | 142.2 | 17.8 | - | - | - | - | - | 10.2 | 91.4 | 149.9 | 835.7 |
| ASIA | |||||||||||||
| Kampuchea Dem. | 7.6 | 10.2 | 25.4 | 78.7 | 144.8 | 147.3 | 152.4 | 154.9 | 226.1 | 251.5 | 139.7 | 43.2 | 1391.9 |
| (Phnom Penh) | |||||||||||||
| Tailandia | 5.1 | 27.9 | 27.9 | 58.4 | 132.1 | 152.4 | 175.3 | 233.7 | 233.6 | 355.6 | 45.7 | 2.5 | 1470.7 |
| (Bangkok) | |||||||||||||
| Bangladesh | 7.6 | 30.5 | 61.0 | 137.2 | 243.8 | 315.0 | 330.2 | 337.8 | 248.9 | 134.6 | 25.4 | 5.1 | 1877.1 |
| (Dacca) | |||||||||||||
| Pakistán | 63.5 | 63.5 | 68.6 | 48.3 | 33.0 | 58.4 | 205.7 | 233.7 | 99.1 | 15.2 | 7.6 | 30.5 | 927.1 |
| (Rawalpindi) | |||||||||||||
| AMERICA DEL SUR | |||||||||||||
| Venezuela | 35.6 | 20.3 | 17.8 | 25.6 | 96.5 | 139.7 | 160.0 | 180.3 | 91.4 | 101.6 | 71.1 | 33.0 | 972.8 |
| (Ciudad Bolívar) | |||||||||||||
| Colombia | 10.2 | - | 10.2 | 22.9 | 86.4 | 86.4 | 76.2 | 18.2 | 12.9 | 274.3 | 226.1 | 114.3 | 934.7 |
| (Cartagena) | |||||||||||||
| Brasil | 248.9 | 231.1 | 261.6 | 221.0 | 170.2 | 83.8 | 58.4 | 38.1 | 45.7 | 106.7 | 142.2 | 203.2 | 1881.0 |
| (Manaus) | |||||||||||||
| Argentina | 78.7 | 78.7 | 99.1 | 124.5 | 66.0 | 30.5 | 30.5 | 40.6 | 61.0 | 71.1 | 94.0 | 114.3 | 889.0 |
| (Paraná) | |||||||||||||
| Evapotranspiración anual en mm | ||
|---|---|---|
| Media | Mínima y máxima | |
| AFRICA | ||
| Delta del Níger (Malí) | 2 150 | 1 900–2 450 |
| Sudd (Sudán) | 1 900 | 1 800–2 000 |
| Pantano de Okavango (Botswana) | 1 800 | 1 700–1 900 |
| Llanos de Kafue (Zambia) | 1 650 | 1 550–1 750 |
| ASIA | ||
| Delta del Mekong (Viet Nam) | 1 600 | 1 500–1 700 |
| Chao Phrya (Tailandia) | 1 600 | 1 500–1 700 |
| Delta del Ganges (Bangladesh) | 1 500 | 1 400–1 600 |
| Valle del Indo ±30°N (Pakistán) | 1 750 | 1 600–1 900 |
| Valle del Indo ±25°N | 2 000 | 1 900–2 300 |
| AMERICA DEL SUR | ||
| Llanos (Colombia) | 1 400 | 1 300–1 600 |
| Magdalena ±5°N (Colombia) | 1 500 | 1 400–1 600 |
±8°N (Colombia) | 1 300 | 1 100–1 400 |
| Río Amazonas-Manaus (Brasil) | 1 300 | 1 200–1 400 |
| Río Paraná | 1 250 | 1 150–1 350 |
Hay una clara relación entre la velocidad de la corriente de un río y la cantidad de carga sólida que arrastran sus aguas. Cuanto más fuerte es la corriente, mayores son la carga y el tamaño de las partículas (véase Fig.2.7) que puede arrastras la corriente. Este hecho tiene muchas repercusiones tanto para la morfología del río como para la biología de muchos de los organismos que viven en él. Morfológicamente, dado que todo río tiende a transportar la cantidad máxima de material en suspensión para una corriente determinada, los sedimentos se recogerán o depositarán al compás de las variaciones de la corriente y de la carga. Así la desaceleración de la corriente lleva a la formación de tierras de aluvión, a la sedimentación de parte de la carga con el consiguiente desarrollo de muchas de las características morfológicas del río, tales como diques naturales, bancos y zonas de anegamiento. La aceleración de la corriente hace que el río recoja sedimentos produciendo erosiones o derrubios. Durante el ciclo de crecida, estos dos procesos tienden a alternar. Al subir las aguas, los ríos llevan una fuerte carga de limo; pero al derramarse las aguas sobre la llanura el debilitamiento general de la corriente hace que se sedimenten las materias en suspensión, con lo que el agua decantada adquirirá cierta claridad. Al bajar el caudal, la aceleración de la velocidad del agua produce erosiones localizadas; pero, a medida que el flujo se debilita progresivamente en el período de aguas bajas, las masas hídricas parmanentes de la zona de anegamiento, y a menudo el propio cauce principal, depositan la mayor parte de su carga.
La cantidad de materia en suspensión en las aguas condiciona la penetración de la luz en el agua. Por ejemplo Bonetto (1980) determinó para el río Paraná la relación:
s = a ebh
donde ‘S’ es la penetración de la luz medida por el disco de Secchi, ‘h’ es la velocidad de la corriente medida por la altura del río y ‘a’ y ‘b’ son constantes.
La producción de sedimentos de los ríos más representativos del mundo se indica en el Cuardo 2.5. La materia en suspensión transportada por un río en relación con su caudal es un índice de la estabilidad del sistema. Los ríos que transportan una gran cantidad de sedimentos en relación con su caudal, por ejemplo el lndo, tienden a ser inestables, con lechos cambiantes y sucesiones en rápida evolución de zonas de anegamiento, mientras que los ríos cuya producción de sedimentos es baja para su caudal suelen cambiar mucho más lentamente.
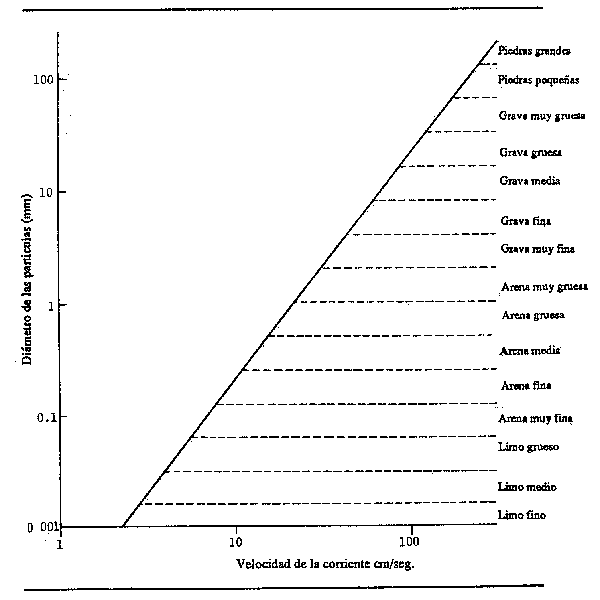
Figura 2.7 Velocidades de la corriente necesarias para mover partículas minerales de varios tamaños (línea trazada a partir de datos de Nielson, 1950); la terminología de los tamaños de las partículas se inspira en Gregory y Walling (1973)
La idea de la espiral de nutrientes postula que un átomo nutriente recorre un ciclo de tres componentes del ecosistema de la corriente (Newbold et al., 1981). Cada componente es transportado aguas abajo con la corriente, de manera que la ruta del átomo describe una espiral imaginaria. Los tres componentes son: a) el agua en que el átomo nutriente va disuelto; b) la fase de partícula, en la que el átomo queda absorbido en la materia de la partícula y se sitúa así en el fondo, aunque continúa el transporte aguas abajo por empuje, suspensión, erosión, etc.; c) la fase de consumidor, en la que el átomo se incorpora a una materia viva. Durante esta fase puede pasar directamente a través de una serie de organismos antes de volver de nuevo a la fase hídrica. La distancia total viajada entre una vuelta al agua y la siguiente se denomina longitud de la espiral (S). Esta longitud puede tomarse como medida de la eficiencia con que se utilizan los nutrientes en un sistema determinado: cuanto más corta es la longitud de la espiral, más eficiente es el uso, ya que el átomo nutriente es utilizado con más frecuencia en una longitud determinada de la corriente.
Durante la fase de consumidor, la mayor parte de los nutrientes están contenidos en microorganismos, pero los invertebrados que se alimentan de éstos y de plantas superiores pueden influir sobre la longitud de la espiral acelerando la suelta de nutrientes. Los organismos colectores o micróvoros tienden a acortar la espiral, mientras que los herbívoros pueden alargarla.
| Río | Superficie de la cuenca | Media anual de carga en suspensión | ||
|---|---|---|---|---|
| km² | Total t×106 | t/km² | Carga/descarga | |
| Amazonas | 6 062 080 | 406.4 | 67 | 1.92 |
| Negro | 93 875 | 1.5 | 16 | |
| Zaire | 3 968 000 | 72.4 | 18 | 1.82 |
| Mississipi | 3 184 640 | 349.5 | 109 | 20.0 |
| Missouri | 1 352 192 | 243.4 | 180 | |
| Ohio | 196 044 | 15.2 | 77 | |
| Nilo | 2 944 000 | 123.8 | 42 | 44.2 |
| Paraná | 2 278 400 | 91.4 | 40 | 6.13 |
| Uruguay | 384 000 | 15.2 | 39 | |
| Volga | 1 335 014 | 21.1 | 16 | |
| Indo | 1 231 260 | 488.7 | 396 | 87.3 |
| Níger | 1 100 800 | 5.1 | 5 | 0.8 |
| Murray-Darling | 1 059 840 | 35.7 | 33 | |
| Ganges | 1 047 552 | 1625.6 | 1551 | 86.9 |
| Brahmaputra | 552 960 | 812.9 | 1469 | 41.0 |
| Yangtzé | 1 012 864 | 560.8 | 553 | 25.7 |
| Orinoco | 938 752 | 96.9 | 103 | 5.7 |
| Danubio | 806 400 | 21.8 | 27 | 3.5 |
| Mekong | 386 560 | 190.0 | 491 | 17.3 |
| Irrawaddy | 362 752 | 336.3 | 927 | 24.9 |
| Vístula | 190 873 | 1.7 | 9 | 1.55 |
| Eufrates | 119 219 | 4.8 | 40 | 3.4 |
| Chao Phrya | 105 216 | 12.7 | 120 | |
Los ríos transportan en grandes masas, aunque por lo general no exactamente cuantificadas, de materia orgánica disuelta y en partículas desde el componente terrestre de la cuenca vertiente hasta los océanos (véase Fig. 2.8). Las aportaciones directas suelen consistir en materia orgánica en partículas gruesas (MOPG) en forma de hojas, frutos, flores, polen, ramas, etc., mientras que las aportaciones indirectas consisten en productos de lixiviaciones y otras materias disueltas tales como carbonatos inorgánicos de las rocas y de los suelos. Los procesos biológicos tienden aguas abajo a degradar la MOPG (que comprende desde árboles enteros hasta partículas de 1 mm) transformándolo en materia orgánica en partículas finas (MOPF; partículas de 50 mm a 1 mm) y en materia orgánica en partículas ultrafinas (MOPU; partículas de 0, 5 a 50 mm). Los compuestos disueltos aumentan en concentración en el curso bajo, y Visser (1979) y Balogun (1970) han comprobado la existencia de una amplia gama de aminoácidos, ácidos grasos, azúcares, hidrocarburos y pigmentos, tanto sueltos en el agua como integrados en partículas sedimentarias. Al mismo tiempo los organismos vivos contribuyen a la concentración de CO2.
El carbono en partículas y los compuestos integrados en partículas sedimentarias siguen procesos similares a los sedimentos y otros nutrientes por cuanto pueden almacenarse en la llanura por sedimentación, pueden ser reciclados por agentes biológicos y pueden reincorporarse a la corriente hacia los océanos por erosión (Fig. 2.9). Las tasas de almacenamiento pueden ser muy altas. Por ejemplo, en las zonas de anegamiento de los ríos pequeños de las zonas forestales de América del Norte, el almacenamiento pueden situarse entre 48 y 96 g C/m/año (Sedell et al., 1974), y en los pantanos maduros de las llanuras inundables pueden llegar a 113 g C/m/año, cifra registrada en el río Atchafalaya (Gagliano y Van Beek, 1975).
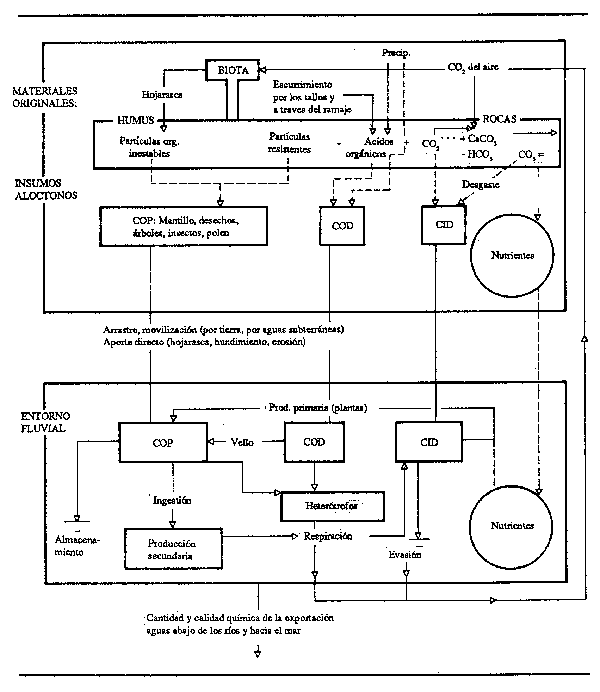
Figura 2.8 Modelo general de biogeoquímica del carbono en los ríos (según Richey, 1981)
La composición química de las aguas del río depende de numerosas variantes físicas, químicas y biológicas, perotres mecanismos básicos controlan la química del agua de superficie: las precipitaciones, la naturaleza de las rocas del lecho u el proceso de evaporación-cristalización (Gibbs, 1970) (Fig. 2.10). En la mayoría de los grandes ríos tropicales, la composición iónica del agua depende básicamente de la lluvia y de la roca o los sedimentos sobre los que fluye el río. En los ríos que corren por regiones áridas y calurosas, la tasa de evaporación y de cristalización de las sales concentradas es la influencia principal, y las zonas de anegamiento situadas en tales regiones pueden transformarse en pantanos salinos. Ejercen influencias secundarias sobre la composición iónica las macrofitas y el fitoplancton, y en medida cada vez mayor las diversas actividades humanas industriales, agrícolas y domésticas.
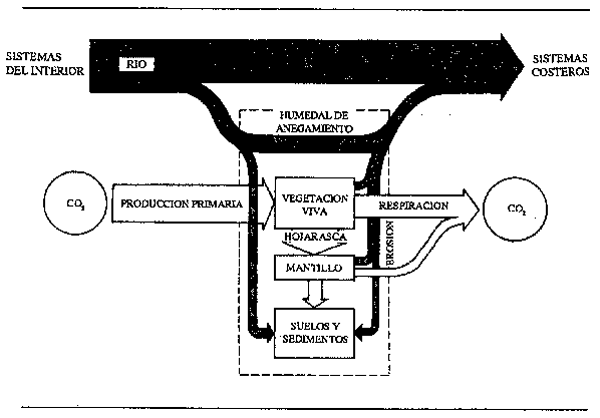
Figura 2.9 Flujo del carbono orgánico entre un humedal de anegamiento y el río contiguo (Mulholland, 1981)
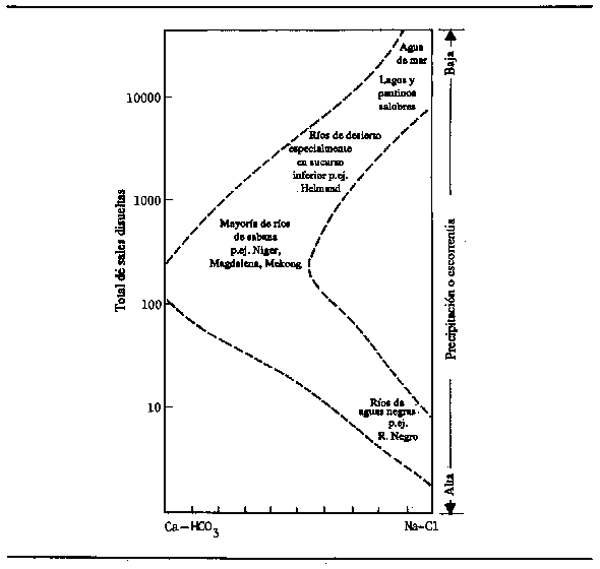
Figura 2.10 Diagrama de los mecanismos básicos que controlan la química del agua de superficie (Adaptado de Gibbs, 1970)
El total de sólidos disueltos (TSD) puede tomarse como medida idónea de la concentración iónica total en el agua. Naturalmente, la concentración y la abundancia relativa de iones en el agua de los ríos es muy variable, aunque hay una tendencia a que la variabilidad de los ríos tributarios se nivele en un promedio en los ríos mayores. La Figura 2.11, tomada de Holland (1978), muestra claramente que aunque el TDS varía considerablemente respecto a cada tipo de escorrentía, es inconfundible el aumento de la concentración al disminuir la escorrentía.
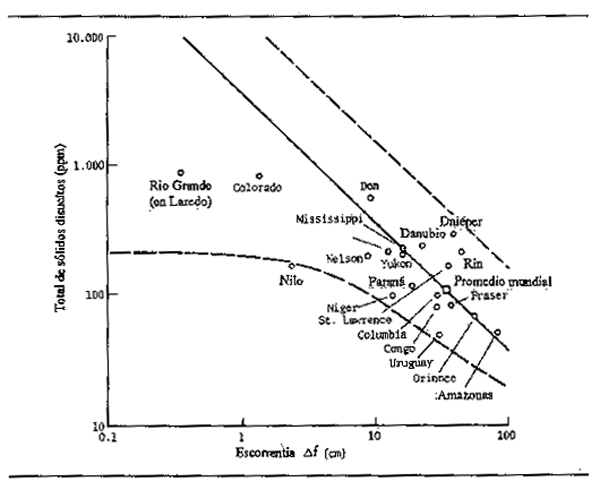
Figura 2.11 Total de sólidos disueltos en algunos grandes ríos en relación con la escorrentía anual media (según Holland, 1978)
La composición de las aguas fluviales en los diversos continentes se muestra en el Cuadro 2.6. Holland (1978) analiza más detalladamente la concentración y el origen de la mayoría de los iones principales presentes en los ríos.
| Continente | HCO | SO | Cl | NO | Ca | Mg | Na | K | Fe | SiO | Total |
|---|---|---|---|---|---|---|---|---|---|---|---|
| América del Norte | 68.0 | 20.00 | 8.0 | 1.0 | 21.0 | 5.00 | 9.00 | 1.40 | 0.16 | 9.00 | 142.00 |
| América del Sur | 31.00 | 4.80 | 4.90 | 0.70 | 7.20 | 1.50 | 4.00 | 2.00 | 1.40 | 11.90 | 69.00 |
| Europa | 95.00 | 24.00 | 6.90 | 3.70 | 31.10 | 5.60 | 5.40 | 1.70 | 0.80 | 7.50 | 182.00 |
| Asia | 79.00 | 8.40 | 8.70 | 0.70 | 18.40 | 5.60 | 9.30 | -- | 0.01 | 11.70 | 142.00 |
| Africa | 43.00 | 13.50 | 12.10 | 0.80 | 12.50 | 3.80 | 11.00 | -- | 1.30 | 23.20 | 121.00 |
| Australia | 31.60 | 2.60 | 10.00 | 0.05 | 3.90 | 2.70 | 2.90 | 1.40 | 0.30 | 3.90 | 59.00 |
| Mundo | 58.40 | 11.20 | 7.80 | 1.00 | 15.00 | 4.10 | 6.30 | 2.30 | 0.67 | 13.10 | 120.00 |
| Aniones | 0.96 | 0.23 | 0.22 | 0.02 | 1.43 | ||||||
| Cationes | 0.75 | 0.34 | 0.27 | 0.06 | 1.43 |
Unas listas detalladas del contenido iónico de cada uno de los ríos tropicales excederían del propósito de este libro. Existen compilaciones de tales datos basadas en los trabajos de numerosos autores para Africa (Welcomme, 1972) yAmérica Latina (Ardizzone y Ziesler, 1977). Las observaciones relativas a Asia no han sido compiladas sistemáticamente, pero Jhingran (1975) citaba datos de los ríos indios y Johnson (1967) daba detalles de la química de algunos ríos de Malasia. Meybeck (1976 y 1979) y Martin y Meybeck (1976 y 1979) han realizado estudios sobre la significación del transporte de iones a escala mundial.
En las regiones en que las rocas se han empobrecido y los suelos están lixiviados, la principal fuente de nutrientes son las precipitaciones: son los ríos agrupados en la zona inferior derecha de la Fig. 2.10 En la cuenca del Amazonas por ejemplo, la composición química de las corrientes de agua negra del Hylaea o de los ríos mayores de agua negra puede parecerse a la del agua de lluvia. La frecuente analogía de la composición de las aguas de lluvia y de río indica que los iones obtenidos por lixiviación del suelo pueden equilibrarse con los transportados por la lluvia. Análogamente, la química de las cabeceras de los ríos Paraná y Paraguay está dominada por las precipitaciones atmosféricas (Bonetto, 1975) y, en la misma amplia región, la conductividad del agua de lluvia que cae sobre Mato Grosso, Brasil, es a menudo mayor que la de las corrientes (Gree, 1970. En Africa, Visser (1974) observó que la composición de las aguas fluviales y lacustres en un radio de 100 millas de Kampala indicaba que la lluvia aportaba por término medio la totalidad del sodio, el amonio y el nitrato, más del 75% del cloruro y más del 70% del potasio. En el río Gombak de Malasia, Bishop (1973) consideró las precipitaciones como un factor muy importante en la determinación de las concentraciones iónicas.
Los ríos de las tres principales regiones tropicales de bosques húmedos nacen en suelos podsolíticos lixivados muy pobres. Sioli (1968) describió tales aguas en la cuenca del Amazonas como más o menos transparentes, sin cantidades apreciables de partículas inorgánicas, pero con muy escasa penetración de la luz a causa del color pardo debido a las sustancias del humus disueltas. El PH suele ser muy bajo, y pobre la concentración de nutrientes disueltos. Los análisis más detallados de la composición de las aguas negras del Lago Tupe del Río Negro (Rai y Hill, 1981) revelan que en estas aguas tienden a dominar el sodio y el sulfato. Aguas análogas se han hallado en las cabeceras del Orinoco (Edwards y Thorne, 1970), y se han descrito también en Africa (Matthes, 1964) y Malasia (Johnson, 1968). Las descripciones y los análisis de los tres continentes se recogen en el Cuadro 2.7.
| Zaire (R.Tshuapa) | Amazonas (R.Negro) | Malasia | Agua pluvial amazónica | |
|---|---|---|---|---|
| (Matthes, 1964) | (Ungemach, 1972) | (Johnson, 1967) | (Ungemach, 1971) | |
| pH | 4.0–6.5 | 4.6–5.2 | 3.6–5.9 | 4.0–5.4 |
| Conductividad | 24–32 | 6.8–10.4 | 1.5–20 | |
| T.S.D. | 30–65 mg l-1 | |||
| Fe | abundante | 268–535 ug l-1 | 10–100 ug l-1 | |
| +Ca | muy poco | 232–450 ug l-1 | 0–1 904 ug l-1 | 20–500 ug l-1 |
| +Mg | muy poco | 108–254 ug l-1 | 182–17 867 ug l-1 | 10–30 ug l-1 |
| +Na | 435–1 358 ug l-1 | 2 092–22 480 ug l-1 | ||
| +K | 235–601 ug l-1 | 586–7 429 ug l-1 | ||
| NNO3 | rastros | 15–53 ug l-1 | 5–300 ug l-1 | |
| NNO2 | rastros | 0.035–1.27 ug l-1 | ||
| PPO4 | rastros | 3.2–8.6 ug l-1 | 1–3 ug l-1 | |
| N orgánico | 70–80 ug l-1 | 209–478 ug l-1 | 10–150 ug l-1 | |
| Cl | 1 800–2 600 ug l-1 | 283–30 631 ug l-1 | 80–320 ug l-1 | |
| Si | 2 000–2 740 ug l-1 | 2000–2740 ug l-1 | ||
| SO4 | falta | falta | 4 803–216 903 ug l-1 |
Las aguas negras de las tres zonas continentales son similares en su composición general, excepto que el sulfato es todavía más corriente en las aguas de Malasia que en las de Sudamérica y Africa. En Sudamérica está prácticamente ausente de muchas aguas negras, y en Africa se encuentra sólo en las aguas que proceden de regiones volcánicas. Johnson (1969) describió un tipo aberrante de agua negra de Malasia que, corriendo sobre piedra caliza, adquiere concentraciones iónicas totales superiores del orden de 150–700 mg/1, lo que corresponde a los valores máximos relativamente altos del Cuadro 2.7. Las aguas de tipo “Gelam” tienen también valores de PH muy bajos de 3,5–4,9 que revelan un exceso considerable de sulfato. Una tercera serie de aguas negras son las enriquecidas con la contaminación orgánica, elevándose su PH ma 6 o más. Esta serie puede indicar de qué manera las aguas negras de otros continentes reaccionarán a la contaminación de origen urbano, al intensificarse los asentamientos urbanos en esas zonas.
Además de las aguas negras, el Amazonas y el Orinoco se alimentan de ríos de agua clara. En el caso del Amazonas, éstos nacen en los macizos del Brasil central, y respecto al Orinoco proceden del Escudo Guayanés. Estas aguas son tan pobres en nutrientes como las aguas negras y tienen también valores bajos de PH entre 4,0 y6,6. Sin embargo, no están oscurecidas por substancias del humus. Una tercera categoría de ríos amazónicos, los ríos de agua blanca, se acercan más al modelo general de otros ríos tropicales tal como se describen en el resto de esta sección y son la fuente principal de nutrientes de la cuenca en la que, al depositar sus fuertes cargas de limo, mantienen la productividad de las várzeas inundables.
Los paisajes ecuatoriales de tierras bajas en el Amazonas y el Zaire dan a estos dos ríos muchas características comunes. No obstante, hay diferencias considerables entre ambos sistemas a causa de la altitud y el relieve de las cuencas, así como de la formación geológica y la vegetación (Marlier, 1973). Los bosques tienen menor extensión en el Zaire, y el cauce principal del río se divide en tramos tranquilos y rápidos. Las crecidas son también menos intensas que en el Amazonas.
Conductividad
La conductividad es otra medida de la suma total de iones presentes en una masa hídrica, y es una aproximación útil para calcular la riqueza química. Como medida, no obstante, no da una indicación de la composición iónica real del agua, por lo que puede no transmitir información sobre factores limitativos como la falta de nutrientes esenciales.
Las aguas fluviales son menos variables que las de los lagos, y las conductividades de los ríos principales de agua blanca tienden a parecerse entre sí, con pocas excepciones. En efecto, las variaciones entre ríos tributarios dentro de un mismo sistema fluvial pueden ser mayores que las que se observan entre distintos cauces fluviales principales. Ello se debe a que las corrientes de orden inferior son más sensibles a los condicionamientos locales de la geología y la vegetación, mientras que los cauces de orden superior extraen el promedio de las condiciones de toda una serie de afluentes de orden inferior. (Cuadro 2.8).
Dentro de un mismo sistema, la conductividad cambia a lo largo del año. La composición iónica general del agua viene determinada en gran medida por los tres procesos mencionados en el párrafo introductorio de esta sección. La concentración de sustancias disueltas, que comprenden compuestos orgánicos no medidos por la conductividad, está bajo la influencia de cinco factores: i) efectos de dilución, por los que el agua de crecida o de lluvia con concentración iónica débil reduce la conductividad; ii) efectos de solución, el “efecto ribera” de Braun (1952), en virtud del cual las sales encerradas en tierras antes secas por obra de la vegetación muerta, los excrementos de animales, las cenizas de plantas quemadas, etc., penetran en la solución al extenderse las aguas de crecida sobre superficies mayores; iii) efecto de desagGe, por el que el agua freática rica en nutrientes es desplazada hacia el cauce del río al aumentar las filtraciones; iv) concentración por evaporación; y v) absorción por los componentes vivos del sistema. Normalmente, estos efectos combinados tienden a producir conductividades más altas en la estación seca que en la húmeda, tanto en las lagunas como en los cauces fluviales, es decir que hay una relación inversa entre profundidad del agua y conductividad. Las mismas tendencias se han observado en los ríos Oshun (Egborge, 1971), Ogun (Adebisi, 1981), Kafue (Tait, 1967; Carey, 1971; y Universidad de ldaho et al., 1971), Senegal (Reizer, 1974) y Zambeze (FAO/NU, 1969) en Africa. Sin embargo, el desagGe de aguas freáticas ricas en nutrientes puede dar lugar a elevaciones locales de la conductividad en corrientes pequeñas durante la época de lluvias. Varios de estos autores han observado también un máximo secundario de conductividad (debido a los efectos de solución) cuando el agua invade el llano anegable, pero este efecto es de corta duración.
| Conductividad (k20μhmos cm-1) | |||
|---|---|---|---|
| ASIA | |||
| Gombak | 29–41 | 6.6–7.0 | Bishop, 1973 |
| Mekong | c. 280–630 | Com. para la Coord. de Invest. de la Cuenca Inferior del Mekong | |
| Meklong | 8.2 | Sidthimunka, 1970 | |
| AMERICA DEL SUR | |||
| Sistema del Magdalena | |||
Magdalena: desembocadura | 490–630 | 6.2–7.2 | Ducharme, 1975 |
sobre confluencia | 131 | 6.7–7.4 | Ducharme, 1975 |
Cauca | 250–500 | 6.5–7.6 | Ducharme, 1975 |
San Jorge | 320–350 | 6.5–6.6 | Ducharme, 1975 |
| Sistema del Amazonas | |||
Amazonas/Solimoes | 28.1–83.8 | 6.8–7.5 | Schmidt, 1972 |
Marañón | 129 | Gessner, 1960 | |
Ucayalib | 150 | Gessner, 1960 | |
Negro | 8.4–8.6 | 4.4–4.7 | Schmidt, 1972 |
Tapajos | 11.9–14.9 | 4.5–5.3 | Schmidt, 1972 |
| Sistema de La Plata | |||
Paraná/Paraguay alto | 31.1–72.1 | 7.0–7.9 | Bonetto, 1975/76 |
Paraná medio | 112.0–184.0 | 7.2–7.7 | Bonetto, 1975/76 |
Paraguay | 69.7–335.0 | 6.9–8.2 | Bonetto, 1975/76 |
| AFRICA | |||
| Konkoure | 22.1 | 5.9–6.2 | Livingston, 1963 |
| Bandama | 90–200 | 6.7–7.6 | Welcome, 1972 |
| Chari | 22–73 | 6.9–7.7 | Welcome, 1972c |
| Lagone | 41–82 | Welcome, 1972c | |
| Sistema Congo/Zaire | |||
Zaire, cauce principal | 37.1–76.7 | 5.5–6.5 | Gosse, 1963 |
Ubangi | 19.4–56 | 6.2–6.7 | Micha, 1973 |
Luapula | 150–180 | 6.2 | Soulsby, 1959 |
Ruzizi | 628 | Marlier, 1951 | |
Lualaba | 145–255 | ||
| Lt. Scarcies | 35–55 | 7.1–7.4 | Welcome, 1972c |
| Gt. Scarcies | 60 | 7.1 | Welcome, 1972c |
| Moa | 36 | 6.6 | Welcome, 1972c |
| Oshun | 57–96 | Egborge, 1971 | |
| Níger | 31–70 | 6.7–7.2 | Daget, 1957 |
| Sokoto | 6.9–8.1 | Holden & Green, 1960 | |
| Sistema del Nilo | |||
Nilo Blanco | 220–500 | 8.0–8.9 | Hammerton, 1972 |
Nilo Azul | 140–390 | 8.2–9.1 | Hammerton, 1972 |
Kagera | 93–99 | Talling & Talling, 1965 | |
Sobat | 112 | 702 | Talling, 1957 |
Corriente de Bugungu | 245–395 | 7.1–7.8 | Welcome, 1969 |
Bahr-el/Gahzal | 550 | 7.8 | Talling, 1957 |
| (L.No) | |||
Semliki | 400–910 | Beauchamp, 1956 | |
| Orange | 159 | 7.7 | Keulder, 1970 |
| Ouémé | 60 | Welcomme, com.pers | |
| Ruaha | 32–136 | 6.3–7.9 | Petr, 1974/76 |
| Senegal | 72 | 6.8–7.1 | Reizer, 1971 |
| Sistema del Volta | |||
Volta Negro | 41–124 | 6.5 | Welcome, 1972c |
Volta Rojo | 62 | 6.5 | Welcome, 1972c |
Volta Blanco | 119 | 7.2 | Welcome, 1972c |
| Sistema del Zambeze | |||
Lago Kariba | 50–96 | 7.4 | Coche, 1968 |
Curso alto | 57–126 | FAO/NU, 1969 | |
| (Llano de Barotse) | |||
Shire | 220–450 | 7.5–8.8 | Hastings, 1972 |
Kafue | 130–220 | 7.5–8.8 | FAO/NU, 1968 |
Curso bajo (Mozambique) | 108–153 | 7.7–8.0 | Hall et al., 1977 |
c Welcomme, 1972, compiló datos recibidos en a un cuestionario de la FAO.
La situación en cuanto a los ríos latinoamericanos es menos clara. Bonetto et al., 1978, indican que, como cabía esperar, la conductividad en la Laguna La Brava se eleva durante el período de aguas bajas. Asimismo, cuando las crecidas invaden lagos aislados de la llanura, diluyen los sólidos disueltos que se han concentrado durante la estación seca (Bonetto, Dioni y Pignalberi, 1969). Schmidt (1972) observó concentraciones iónicas siempre más elevadas durante la estación seca en el río Amazonas en comparación con las lluvias, y Junk (1973) señaló una fluctuación similar entre altas conductividades en la estación seca y conductividades más bajas en la crecida en algunos lagos de la zona inundable. Sin embargo, tanto él como Schmidt (1972a) han descrito igualmente lagos en los que la conductividad es mínima durante la estación seca y máxima durante la primera fase de entrada de agua del río. La explicación propuesta es que el anegamiento inicial con aguas blancas ricas en nutrientes y la solución de sales procedentes de tierras inundadas producen una alta concentración iónica durante los períodos de crecida. Durante la estación de aguas bajas, el agua se diluye por drenaje del agua negra pobre en nutrientes procedente de los ríos forestales y por el agua pluvial.
En la zona litoral de la llanura, representada por la vanguardia de la ola de crecida, el suelo rico en nutrientes se inunda con agua fresca y la solución de sales produce un aumento local de la conductividad. Esto tiene indudablemente una gran significación para los regímenes de productividad de las zonas de anegamiento durante la primera parte de la fase de crecida, cuando estas zonas litorales de aguas someras representan una proporción considerable de la superficie total del sistema acuático.
Las diferencias en la química del agua, incluido el pH, producen variaciones en el tipo de organismos acuáticos que habitan en aguas diversas. Por ejemplo, en aguas muy ácidas se encuentran especialmente comunidades particulares de peces, que tienen con frecuencia poca resistencia a una mayor elevación del pH.
Los ríos forestales, con sus aguas negras características y abundantes materiales tomados del humus, pueden tener una acidez ligera o muy acusada, oscilando el pH entre 4 y neutro. Los ríos de sabana suelen ser neutros o ligeramente alcalinos (Cuadro 2.8). Al haber vegetación en descomposición en el fondo de la mayoría de las aguas estacionarias de la planicie inundable, con frecuencia hay ligeras diferencias respecto a los valores más altos del pH en la superficie (Bonetto, 1975; Carey, 1971; Schmidt, 1973). Las variaciones en el pH son también comunes en las orillas, donde los suelos recién inundados pueden producir un descenso local del pH, como en algunos pantanos africanos, o una brusca elevación en otros. La elevación repentina del pH de las aguas de crecida en el Delta Central del Níger, hasta llegar a 8, ha sido atribuida por Blanc et al. (1955) a los efectos de la solución de excrementos animales. Pruebas experimentales confirmaron que las boñigas de las vacas elevan rápidamente el pH del agua. Sin embargo, estos efectos son temporales, y se restauran rápidamente unas condiciones de mayor acidez. La laterita o hematita, que es común en el suelo de las regiones tropicales, y los tipos turbosos de suelos que se encuentran en la superficie de las llanuras inundables, pueden reducir el pH (Mizuno y Mori, 1970). Los pantanos tienden a acidificarse al avanzar la estación seca; Carey (1971) y Holden y Green (1960) han observado en particular que el pH es más bajo en los pantanos que en los ríos en esa época. También D'Aubenton (1963) observó descensos en el pH bajo la capa de vegetación flotante del bosque inundado de Tonle Sap. Por el contrario, las condiciones en algunas lagunas de superficie despejada pueden hacerse cada vez más alcalinas al concentrarse las sales de calcio por la evaporación (Holden y Green, 1960). Los valores más bajos del pH en los pantanos suelen dar lugar a un descenso general del pH en todo el sistema cuando, al empezar la época de las crecidas, las aguas ácidas son desalojadas por el agua de la lluvia o de la crecida con poca capacidad amortiguadora.
Las fluctuaciones diurnas del pH dependen sobre todo de las actividades respiratorias y fotosintéticas del fitoplancton. En la zona bien iluminada de los lagos de la várzea amazónica, es corriente un descenso del pH durante la noche, con un mínimo a primeras horas de la mañana (Schmidt, 1973). Es razonable suponer que hay tendencias análogas durante todo el día en la mayoría de los lagos de zonas de anegamiento.
Latitud, altitud, grado de insolación, composición del sustrato, turbiedad, aportes de agua freática o pluvial, viento y cubierta vegetal, son factores que pueden influir todos ellos sobre la temperatura del agua en los ríos y en los lagos de las zonas de anegamiento. Generalmente, las temperaturas del agua en superficie siguen bastante de cerca a la temperatura del aire, aunque cuando el aire es cálido y seco es más probable que la relación se establezca con la temperatura mínima del aire, a causa del efecto refrescante de la evaporación. En el ciclo anual normal en los trópicos, las temperaturas del agua en la estación seca son más elevadas que las de la estación húmeda. En la zona templada, las temperaturas de invierno son más bajas que las de verano, y los ríos pueden helarse durante una buena parte del año en las latitudes y altitudes más altas. En latitudes relativamente bajas, o en altitudes elevadas en los trópicos, las temperaturas pueden bajar todavía hasta el extremo de reprimir el crecimiento e incluso causar mortandades de peces. En el río Paraná, por ejemplo, una combinación de temperaturas bajo cero y aguas bajas produjo mortandades masivas en 1962 (Vidal, 1964).
El agua del cauce pricipal de un río rara vez se estratifica térmicamente, ya que la turbulencia propia del flujo del río mantiene bien la mezcla. Por otra parte, las condiciones de estratificación son comunes en las masas hídricas, incluso poco profundas, de las llanuras anegadas. Hastings (1972), por ejemplo, observó estratificaciones diurnas en las lagunas del pantano de South Elephant (Fig. 2.12), cuya profundidad era sólo de 1,6 m. Análogamente Sánchez (1961) y Junk (1973) comprobaron estratificaciones, por lo menos temporales, en lagunas de 1 a 2 m de profundidad de la várzea amazónica en Perú y Brasil, y Ducharme (1975) (Fig. 2.12), Mikkola y Arias (1976), Arias (1975) y Zárate y Cubides (1977) han registrado condiciones de estratificación en varias ciénagas
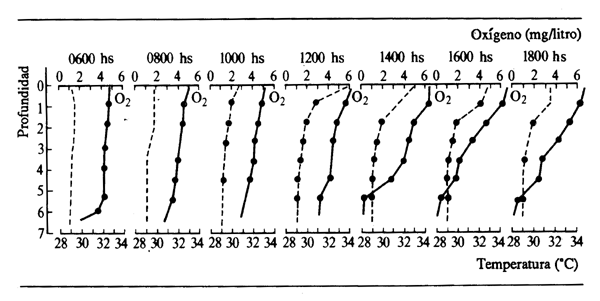
Figura 2.12 Ciclo diurno de temperatura y oxígeno disuelto en la Ciénaga de Ayapel (Río Magdalena), 24 de octubre de 1974 (según Ducharme, 1975)
del sistema del Magdalena con profundidades de 1,5 a 6 m. En la estación seca, el Lago do Castanho amazónico tiene sólo alrededor de 1,5 m de profundidad, pero los días sin viento se opera una clara estratificación de sus aguas (Schmidt, 1973). En tiempo de crecida la profundidad del lago llega a 11 m y la estratificación es más persistente, aunque los perfiles de temperatura son muy variables de un día a otro (Fig. 2.13) por los cambios de las condiciones locales. Las principales fluctuaciones cotidianas tienen lugar en aguas de menos de 3,5 m de profundidad, lo que lndica que normalmente el agua experimenta el recalentamiento diurno sólo hasta esa profundidad. En el río Paraná, que está expuesto a temperaturas más bajas especialmente en invierno y durante la noche, Dioni y Pignalberi (1969) han observado una estratificación inversa.
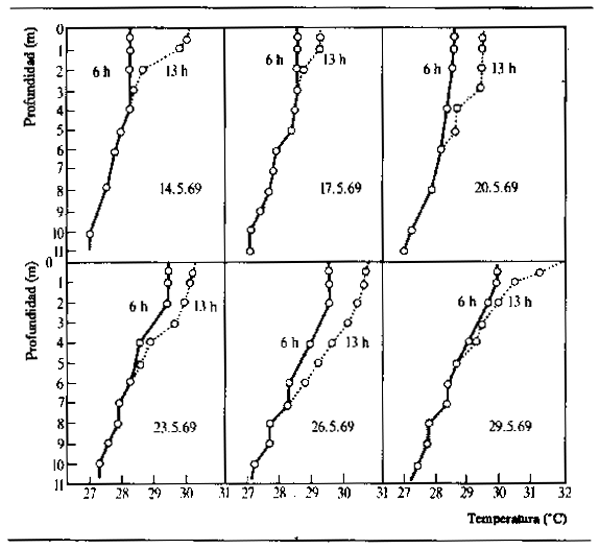
Figura 2.13 Figura 2.13 Fluctuaciones diurnas de temperatura y cambios en la estratificación del Lago do Castanho en breves intervalos durante mayo de 1969 (aguas altas). (Según Schmidt, 1873)
Puede concluirse que en los lagos no cubiertos de vegetación de las llanuras inundables, se realiza normalmente una estratificación térmica de las aguas durante una del año por lo menos. En los lagos menos profundos, a causa del calentamiento de la superficie, la estratifición alcanza el punto máximo entre las 14.00 y horas, pero tiende a desaparecer por la noche o bajo la influencia de vientos fuertes o persistentes. La diferencia de densidad por grado con temperaturas elevadas es mayor que con temperaturas bajas: por ejemplo, el descenso de densidad entre 29 y 30 grados centígrados es aproximadamente el mismo que entre 4 y 10 grados. Por esta razón, con temperaturas elevadas las diferencias de densidad son muy acusadas incluso con ligeras diferencias de temperatura, y la resistencia a la mezcla es consiguientemente alta. En las lagunas profundas, la estratificación puede durar varias semanas o incluso meses.
El agua protegida por la sombra de bosques inundados o ribereños se calienta menos y tiene más uniformidad térmica que la expuesta directamente a la acción del sol, aunque la estratificación térmica se ha observado tanto en el bosque anegado en torno a Tonle Sap (D'Aubenton, 1963) como en los bosques lgapó del curso bajo del Río Negro (Schmidt, 1976, y Geisler, 1969). La vegetación flotante, por otra parte, da lugar a una mayor variación de temperaturas. Al limitarse la evaporación y dada la fuerte absorción de luz solar en los parajes tranquilos, pueden alcanzarse temperaturas muy altas en las masas de vegetación flotante. Bonetto, Dioni y Pignalberi (1969) comprobaron temperaturas excepcionales de hasta 40C en las aguas superficiales de un lago en un meandro abandonado cubierto con Salvinia (Fig. 2.14). Temperaturas similares se han comprobado en la superficie del Lago Calado en masas de Paspalum repens (Junk, 1973). Las temperaturas descienden más rápidamente que en aguas de superficie despejada, a causa de la sombra proyectada por la vegetación. Las capas flotantes de vegetación ayudan también a mantener las condiciones para la estratificacón térmica al limitar la acción del viento y de las olas.
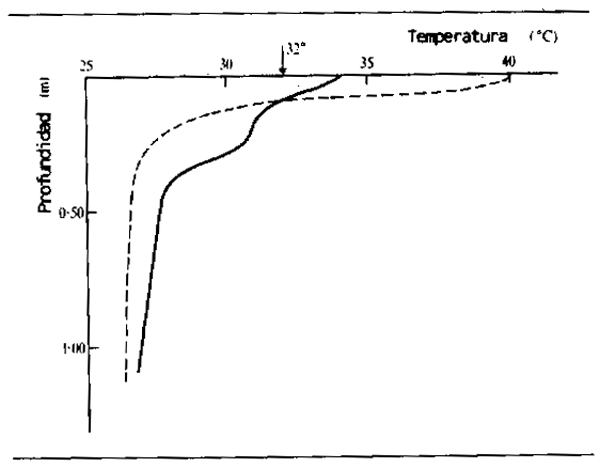
Figura 2.14 Un caso extremo de acumulación de temperatura en el agua bajo un lecho de Salvinia a mediodía. Línea continua = agua de superficie despejada; línea de trazos = agua cubierta de vegetación. La flecha indica la temperatura del aire. (Según Bonetto et al., 1969)
Un hábitat importante pero poco investigado es la parte extrema de aguas someras y de superficie despejada en el borde de la zona de anegamiento. Al ocurrir la crecida, tiene lugar aquí el primer contacto entre el agua en ascenso y el suelo seco rico en nutrientes. Por su poca profundidad, las temperaturas del agua durante el día pueden ser muy altas, estableciéndose una gradación entre el borde mismo de la zona y el agua más fría hacia el interior (Fig. 2.15).
La distribución del oxígeno disuelto dentro del sistema acuático es uno de los principales factores que influyen sobre la distribución de los peces. En el ritrón, las aguas suelen estar bien oxigenadas gracias a la turbulencia del flujo en los rabiones. Sin embargo, en los trópicos estas zonas pueden quedar separadas en una serie de charcas durante la estación seca cuando el flujo es mínimo. Es posible entonces que las charcas pierdan oxígeno y lleguen incluso a la anoxia por efecto de la descomposición de la materia orgánica, la demanda de oxígeno de los peces y la elevación de la temperatura. En el potamón la situación es más compleja. Cuando las aguas de crecida invaden las llanuras inundables del río Paraná hay una elevación inicial en las concentraciones de oxígeno disuelto en el agua de superficie despejada y bajo la vegetación flotante. Efectos similares se han observado en muchos otros sistemas, particularmente el Sokoto (Holden y Green, 1960) y el Kafue (Universidad de ldaho et al., 1971) en Africa, el Chaco Paraguayo (Carter y Beadle, 1930) y el Magdalena (Arias, 1975; Zárate y Cubides, 1977) en América del Sur. Durante la primera parte de las inundaciones, el agua de crecida o de lluvia puede desalojar al agua desoxigenada de los lagos y pantanos remanentes de la anterior estación seca. Por consiguiente, los niveles de oxígenos disuelto tienden a ser bajos durante el período inicial de elevación de las aguas, aunque se mantienen bastante altos durante altos durante la mayor parte de la crecida. Unos niveles más elevados de oxígeno disuelto durante la época de crecida se beben principalmente a la acción del viento y a la mezcla producida por las turbulencias. En algunos lagos mas profundos, no obstante, pueden persistir durante todo el año estratificaciones, con escasez de oxígeno cerca del fondo. Gradaciones verticales en el contenido de oxígeno se han observado también en los bosques inundados de lgapó en la cuenca del Río Negro (Geisler, 1969; Schmidt, 1976). En aguas desoxigenadas, pueden formarse concentraciones de H2S por la descomposición del fango y los detritos del fondo.
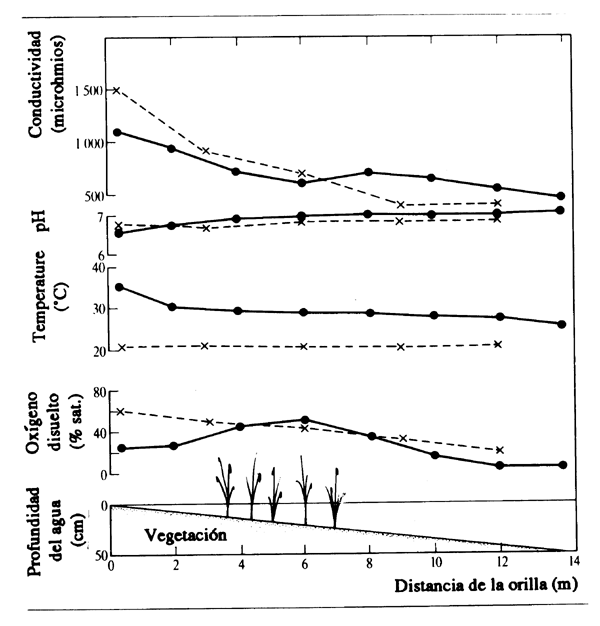
Figura 2.15 Cambios en las condiciones físicas y químicas en función de la distancia desde el borde del agua en una laguna de zona de anegamiento: (x--x--x) a las 08.00 horas; (•--•--•) a las 12.00 horas. (Según Welcome, 1970)
En la estación seca, las soluciones de oxígeno dependen de una serie de factores tales como el volumen de la masa hídrica, la demanda biológica de oxígeno (DBO) de los detritos orgánicos o los contaminantes, el grado de estratificación térmica, la cubierta vegatal, el desarrollo de fitoplancton y la acción del viento. En general hay una tendencia, incluso en las masas hídricas relativamente poco profundas, hacia la estratificación con mayores concentraciones de oxígeno disuelto cerca de la superficie. La acción del viento es generalmente insuficiente para asegurar la mezcla completa en los lagos más profundos en los que se da también una estratificación térmica. En las masas hídricas menos profundas sin cubierta vegetal, la acción del viento puede producir la mezcla en toda la columna de agua (Schmidt, 1973). Sin embargo, la resistencia a la mezcla es relativamente elevada por la razón indicada en la sección anterior. Ducharme (1975) consideró que, si bien el viento es el principal agente oxigenate en los grandes lagos, las concentraciones de oxígeno disuelto en las charcas menores son producto sobre todo de la actividad fotosintética del fitoplancton. Esto significa que las masas hídricas menores experimentan mayores cambios diurnos que las grandes en el oxígeno disuelto. La actividad fotosintética eleva el contenido de oxígeno del agua durante el día, particularmente cerca de la superficie, pero el oxígeno disuelto es retirado del agua por la acción de las plantas y de la demanda bioquímica de oxígeno causada por el limo y los sólidos orgánicos en suspensión, con lo que el nivel de oxígeno desciende durante la noche (Fig, 2.16).
Se han observado mortandades masivas de peces en Brasil (Brinkmann y Santos, 1973) y en los llanos de Kafue (Tait, 1967). En ambos casos las mortandades se atribuyeron a descensos repentinos de la temperatura que enfriaron la superficie del agua de los lagos, hecho que, unido a unos fuertes vientos, produjo una rápida ruptura de la estratificación, una brusca desoxigenación y la contaminación con H2S hasta niveles letales. Las mortandades en la zona inundable del río Apure se han atribuido también a la desoxigenación (Matthes, comunicación personal). Esta se produce cuando las depresiones que contienen hierba no quemada se inundan con agua de lluvia. Al persistir la estratificación térmica, las capas superiores del agua (epilimnion) retienen el oxígeno y los peces sobreviven allí. Sin embargo, el oxígeno se agota rápidamente en las capas inferiores, donde se acumula H2S. Más tarde, la turbulencia producida por la irrupción de aguas fluviales de crecida mezcla las capas matando rápidamente a los peces. Bryan y Sabins (1979) observaron otras muertes masivas de peces causadas por el agotamiento brusco del oxígeno en aguas de pantanos en río Atchafalaya, afuente del Mississippi. Estas mortandades parecen frecuentes en las llanuras inundables tropicales, ya que se han observado en muchos sistemas. También se han registrado mortandades análogas en zonas inundables con agua fría, donde una elevada DBO originada por la contaminación reduce el oxígeno disuelto bajo la capa de hielo en invierno hasta niveles no tolerables por los peces.
Las capas de vegetación flotante son una característica muy común de los ríos tropicales y de los lagos de zonas inundables. Sus efectos son análogos cualquiera que sea la especie vegetal que constituye la capa. La Figura 2.16 por ejemplo muestra el efecto de rodales de Paspalum repens sobre las concentraciones de
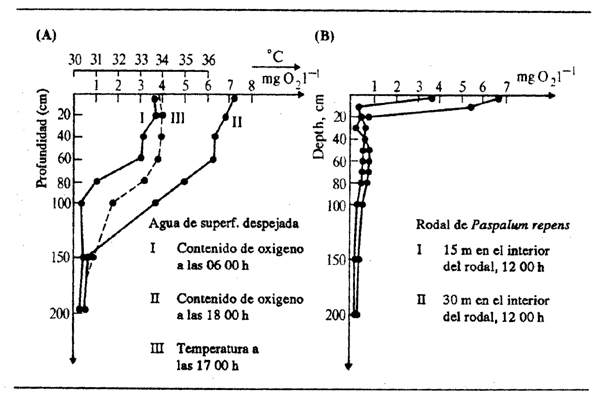
Figura 2.16 Cambios diurnos en el contenido de oxígeno disuelto y en la temperatura en aguas de superficie despejada y bajo vegetación flotante (Paspalum repens) en Lago Calado, 8 de septiembre de 1968. Según Junk, 1973)
oxígeno en Lago Calado, en la várzea amazónica, pero se han trazado gráficos similares para columnas de agua bajo Eichhornia crassipes (Arias, 1975, y Zárate y Cubides, 1977), Salvinia herzogii (Boneto, Dioni y Pignalberi, 1969), Leersia hexandra (Junk, 1973), Cyperus papyrus (Carter, 1953) y Vossia (Tait, 1967). El efecto general de la cubierta vegetal es reducir las concentraciones de oxígeno disuelto, frecuentemente hasta cero (Beadle, 1974), coincidiendo con la producción y suelta de H2S. Dada la gran cantidad de materia orgánica en descomposición atrapada en las masas de raíces de las plantas flotantes, la desoxigenación llega a menudo a un máximo en esa zona y a veces aumenta ligeramente a partir de ahí al aumentar la profundidad. El grado de desoxigenación por debajo de la capa vegetal flotante depende de los movimientos del agua, pues unas fuertes corrientes pueden eliminar las desigualdades de contenido de oxígeno debajo de dicha capa. Puede suponerse, por consiguiente, que las condiciones bajo la vegetación flotante son menos extremas durante las inundaciones, cuando el movimiento constante del agua puede mantener por lo menos alguna cantidad de oxígeno disuelto. La densidad de la cubierta vegetàl influye también en la medida de desoxigenación del agua: a mayor densidad, menos oxígeno por debajo. La cubierta vegetal contribuye a reducir la cantidad de oxígeno disuelto de dos maneras. Primero, se crea una considerable demanda bioquímica de oxígeno por parte tanto de la materia orgánica atrapada como de sus propias partes vegetativas en descomposición, lo que retira el oxígeno del agua. Segundo, se impide la aireación renovada del agua al reducir la acción del viento y de las olas sobre su superficie y al proyectar una sombra perjudicial para el crecimiento del fitoplancton.
Diferencias en el contenido de oxígeno parecen existir también en la zona litoral de aguas someras (Fig. 2.15). El oleaje y la turbulencia en el borde del agua pueden dar lugar a un cinturón estrecho de agua rica en oxígeno, especialmente por la noche, aun cuando un poco más hacia el interior el agua pierda todo su oxígeno. Este efecto, en caso de generalizarse, puede tener una importancia considerable para la ecología pesquera, ya que muchas de las formas juveniles se encontrarán en esta zona.