1. Acuicultura y medio ambiente se influyen mutuamente. La acuicultura utiliza recursos del medio ambiente y produce cambios medioambientales. La mayoría de estas mutuas influencias tienen efectos beneficiosos. En esta sección se ofrece una rápida visión de conjunto sobre los beneficios y los posibles efectos negativos de la acuicultura costera (ver sub-secciones 3.1 y 3.2). Se consideran también las implicaciones de contaminación de las costas para la acuicultura costera (3.3). Por último, se ponen de relieve las implicaciones sociales del desarrollo de la acuicultura costera (3.4).
3.1 Beneficios de la acuicultura costera
2. Generalmente, los beneficios derivados de la expansión de la acuicultura incluyen la provisión de alimentos, que contribuye a mejorar la nutrición y la salud, la generación de ingresos y empleo, la diversificación de la producción primaria y, cada vez más importante para los países en vías de desarrollo, ingresos de divisas, mediante la exportación de productos de alto valor (PNUD/Noruega/FAO, 1987; Schmidt, 1982).
3. Se promueve también la acuicultura por su capacidad para compensar el bajo índice de crecimiento de las capturas pesqueras. El almacenamiento y la suelta de crías en las aguas continentales y costeras es el fundamento de la pesca basada en el cultivo (Larkin, 1991).
4. Un desarrollo sólido de la acuicultura puede contribuir a la prevención y control de la contaminación marina, ya que se fundamenta en la buena cualidad de los recursos acuáticos.
5. La cría de moluscos y algas puede en algunos casos contrarrestar procesos de enriquecimiento nutritivo y orgánico en aguas eutrópicas. Por el contrario, la producción de aguas oligotrópicas puede resultar intensificada a causa de los deshechos nutritivos y orgánicos vertidos por las factorías acuícolas.
6. La acuicultura puede contribuir a la rehabilitación de zonas rurales a través de la reutilización de terrenos degradados.
3.2 Posibles efectos negativos de la acuicultura costera
7. Tras de una breve descripción de las zonas clave de interés ecológico (GESAMP, 1991c; Weston, 1991; Gowen et al., 1990; PNUMA, 1990a; Pullin, 1989; Rosenthal et al., 1988), se da cuenta de los principales efectos negativos posibles del cultivo de algas, mariscos y peces (Braaten y Hektoen, 1991; Pillay, 1990; Chua et al., 1989; Baluyut, 1989; Iwama, 1991).
3.2.1 Esferas principales de interés ecológico
Enriquecimiento nutritivo y orgánico
8. Muchas actividades acuícolas provocan invariablemente el vertido de productos metabólicos de desecho (heces, seudoheces y excreciones) y piensos no comidos en el medio marino. Por lo general, el recipiente para desechos solubles es la columna de agua y para deshechos orgánicos el sedimento.
9. El vertido de sustancias nutritivas solubles inorgánicas (nitrógeno y fósforo) tiene la posibilidad de generar un enriquecimiento nutritivo (hipernutrificación) seguido posiblemente de eutroficación (aumento de producción primaria) de una masa de agua. Los referidos cambios en la ecología del fitoplancton puede provocar floraciones de algas que pueden ser perjudiciales para los organismos silvestres y de cultivo. Sin embargo, no hay pruebas de que las floraciones de algas estén causadas por la acuicultura costera.
10. La mayor proporción de desechos sólidos vertidos, que es fundamentalmente carbono orgánico y nitrógeno, se deposita en el lecho marino cerca de la granja. El enriquecimiento orgánico del ecosistema bentónico puede dar como resultado el aumento de consumo de oxígeno por la sedimentación y formación de sedimentos anóxicos, y, en casos extremos, emanaciones de dióxido de carbono, metano y sulfito de hidrógeno; aumento de la remineralización del nitrógeno orgánico y reducción en la biomasa de la macrofauna, abundancia y composición de especies.
11. Están comprobados efectos muy localizados de concentraciones reducidas de oxígeno disuelto en el fondo y la superficie de las aguas cerca de los lugares de cultivo, debidos a la considerable exigencia bioquímica de oxígeno de los desechos orgánicos vertidos y a las necesidades respiratorias de las poblaciones cultivadas.
Degradación de los hábitats húmedos
12. Las zonas húmedas costeras tales como manglares son de los ecosistemas más productivos a la hora de mantener la integridad ecológica y la productividad de las aguas costeras adyacentes, y son terrenos importantes para la reproducción y cultivo de muchas especies de peces y mariscos que se explotan comercialmente. Algunos países tropicales han perdido extensas zonas de manglares, debido a su desbroce y conversión en estanques de peces y camarones, acompañado a menudo por la salinización y acidificación de suelos y mantos acuíferos.
Uso de sustancias químicas
13. En la acuicultura costera se utilizan una variedad de sustancias químicas. Entre las que se incluyen: productos terapéuticos, desinfectantes, anestésicos, biocidas, hormonas y desarrollo de promotores para el control de predadores, prevención y control de enfermedades y parásitos y para cambio de sexo, viabilidad productiva y crecimiento de los organismos que se cultivan. El interés está centrado actualmente en: la longevidad de los compuestos bioactivos en los tejidos animales, el destino y el efecto de estos compuestos o de sus residuos en el medio ambiente acuático (por ejemplo, toxicidad en otros organismos) y la estimulación de resistencia antibiótica en colectividades microbianas.
Interacciones biológicas
14. La introducción y el traslado de especies y crías para los objetivos de la acuicultura puede alterar o empobrecer la biodiversidad y los recursos genéticos del ecosistema marino a través de cruzamientos, predaciones, rivalidades, destrucción del hábitat y, posiblemente, a través de la transmisión de parásitos y enfermedades.
15. El cultivo de moluscos a gran escala en las ensenadas costeras puede tener influencias mutuas con el tejido marino alimentario por los cambios sustanciales de fitoplancton y detritus orgánicos, así como por la competencia con otros herbívoros planctónicos.
16. Pueden darse enfermedades, por el hecho de que muchas prácticas acuícolas y las condiciones de las explotaciones de la acuicultura pueden estresar a las especies cultivadas. El estrés acrecienta la susceptibilidad y la predisposición a enfermedades infecciosas. Ciertas condiciones de la calidad del agua aumentan la virulencia de posibles elementos patógenos. En presencia de estrés y de elementos patógenos pertinentes, pueden sobrevenir brotes de enfermedad. Sin embargo ha sido especialmente difícil mostrar con claridad que se han transmitido elementos patógenos entre organismos cultivados y silvestres (Iwama, 1991; Baluyut, 1991).
3.2.2 Posibles efectos ecológicos de los sistemas de cultivo
17. Normalmente se suele distinguir entre sistemas de cultivo extensivos, semiintensivos e intensivos, teniendo en cuenta los efectos medioambientales de las explotaciones concretas de acuicultura. En sistemas extensivos, los organismos cultivados se mantienen a bajas densidades y pueden recibir en ocasiones un alimento adicional mediante fertilización. En la acuicultura semiintensiva, los organismos cultivados se mantienen a densidades más altas que en los sistemas extensivos. Los medios de cultivo son a menudo fertilizados y se puede proporcionar una alimentación suplementaria. En la acuicultura intensiva, los organismos cultivados se mantienen a altas densidades y la alimentación es regular, normalmente en forma de piensos especialmente preparados/manufacturados. La Figura 1 ilustra la contribución relativa de los organismos de alimentación natural y de la alimentación artificial en el presupuesto alimentario de peces y camarones en sistemas de cultivo extensivo, semiintensivo e intensivo (Tacon, en prensa).
Cultivo de algas
18. Las algas, al ser organismos autotrópicos, están en el nivel trópico más bajo del ecosistema acuático; toman nutrientes del agua y producen oxígeno disuelto durante el día, pero consumen oxígeno durante la noche. Se cultivan algas (Trono, 1986, 1990; Wu, 1990; Llana, 1991; Santelices y Doty, 1989; Bird, 1989; Tseng, 1987) en aguas poco, profundas en las riberas, utilizando cuerdas, redes, que o bien se fijan al fondo o bien se enganchan a balsas o boyas flotantes. Cada vez más se cultivan algunas clases de algas, en estanques, depósitos y canales basados en la tierra.
19. Los principales efectos posibles de los sistemas basados directamente en el mar (ver Cuadros 1 y 2) proceden probablemente de las grandes superficies que se requieren para un cultivo viable de algas, lo cual posiblemente afecta a las colectividades bentónicas y a la productividad primaria en la columna de agua (Phillips, 1990). La sedimentación de materia orgánica procedente de unidades de cultivo separadas del fondo puede producir cambios en las colectividades bentónicas, sobre todo allí donde ha disminuido la velocidad del agua corriente.
20. Hasta el momento no se ha demostrado el impacto ecológico de las sustancias químicas que se utilizan para acabar con organismos contaminantes y predadores y para controlar las enfermedades, como son por ejemplo ácido sulfónico p., aminobenceno, cloro o paracuat, aplicado en cultivos Porphyra y Gracilaria (Chen, 1991). Para compensar la falta de nutrientes se aplican fertilizantes inorgánicos y, en ocasiones, abonos orgánicos. La fertilización de cultivo Laminaria en China ha provocado un aumento en la producción de fitoplancton y de invertebrados en las zonas de cultivo (PNUD/FAO, 1989).
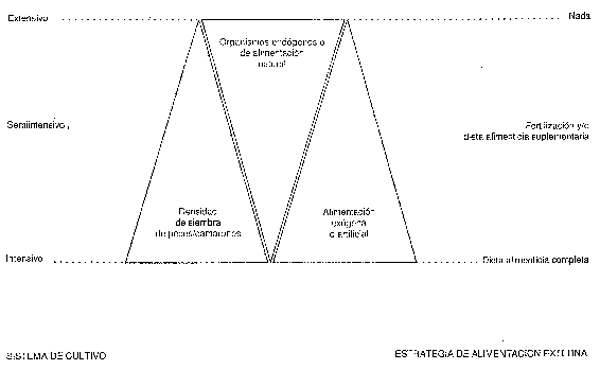
Figura 1: La contribución relativa de organismos de alimentación natural y de alimentación artificial en el presupuesto nutritivo de peces y camarones, en sistemas de cultivo extensivo, semiintensivo e intensivo (Tomado de Tacon, en prensa).
21. Hay también preocupación por los efectos negativos del traslado de especies de algas de una región a otra. Por descuido, el Sargassum muticum se ha introducido desde Japón en Europa, donde se ha extendido hasta el punto de causar verdaderos problemas a la navegación en algunas zonas (Rueness, 1989).
Cultivo de bivalvos
22. Los bivalvos, al ser organismos sedentarios, necesitan un sustrato para el desove y el subsiguiente crecimiento; durante este tiempo, se alimentan de fitoplancton, detritus, protozoos y bacterias. El cultivo de ostras, mejillones, almejas, berberechos, veneras se basa en fitoplancton disponible de forma natural y requiere una superficie considerable de zonas entre mareas y de aguas próximas a la orilla. Los bivalvos se cultivan tanto en el fondo como fuera de él, utilizando diferentes clases de sustratos, tales como conchas, tejas, postes, cuerdas, bateas, plataformas flotantes, balsas, etc. (Nash, 1991; Dore, 1991; Pérez Camacho et al., 1991); Angell, 1991; Lovatelli, 1990; Cai y Li, 1990; Chew, 1989; Sitoy, 1988).
23. El cultivo de bivalvos a gran escala consume cantidades importantes de fitoplancton, sobre todo cuando hay una densidad alta de unidades de cultivo en una gran superficie. Esto puede evidenciar el efecto de reducción de la productividad primaria en ensenadas costeras. En Japón, el cultivo de 50 000–60 000 ostras reduce la cantidad de seston (fundamentalmente fitoplancton) en un 76–95%. El cultivo en suspensión de mejillón verde en Nueva Zelanda eliminó hasta un 60% del alimento disponible así como el de agua en las piscifactorías, de tal modo que puede ser necesaria la producción primaria de una zona muchas veces superior a la de la piscifactoría real para sostener un crecimiento máximo de mejillones cultivados (Hickmann, 1989). El cultivo de mejillones en balsas en las rías españolas destruye un 35–40% de plancton y detritus (Figueras, 1989), y se retiene un 30% del carbono, un 42% del nitrógeno, y un 60% de la clorofila a de las partículas de materia orgánica presentes en el agua (Pérez Camacho et al., 1991). Sin embargo, se ha sugerido también que se puede estimular la productividad primaria por medio del aumento del índice del ciclo de nutrientes (Rosenthal et al., 1988), aunque no hay pruebas del aumento de la producción primaria cerca de las zonas de cultivo. El cultivo de bivalvos compite con otros herbívoros planctónicos, como se ha visto en la Ría de Arosa en España, donde el cultivo de mejillones en suspensión ha sustituido los copépodos como el organismo pelágico de pasto más importante.
24. Las estructuras de cultivo de bivalvos modifican la velocidad y dirección actuales de los movimientos del agua. Por el contrario, estos cambios pueden modificar las pautas de erosión y sedimentación de la materia en partículas. La reducción de la corriente de agua puede provocar una disminución de la erosión natural por la acción de las olas, que a su vez es seguida de sedimentación y acumulación de la materia en suspensión en las zonas de cultivo.
25. Además de estos efectos físicos, los bivalvos producen pseudoheces y heces (llamados biodeposición) que constituyen desechos orgánicamente ricos, propios del cultivo de bivalvos. Por ejemplo, en la Bahía de Hiroshima una balsa con capacidad para 420 000 ostras genera 16 toneladas métricas de heces y de pseudoheces a lo largo de los 9 meses de crecimiento, lo que supone - con unas 1 000 balsas en explotación - un fuerte impacto en la deposición de sedimento en la bahía. El cultivo de ostras sobre tablas en Francia llegó a volúmenes de 7,6–99 g C/m²/dia, dependiendo de la temporada y de la producción de plancton. En Suecia, la deposición sedimentada en una explotación de 100 t de mejillones se estimó en 7 kg de materia seca por m² (equivalente a 1 kg C/m²) durante un período de cultivo de l,5-2 años, lo que era debido a un índice de sedimentación de hasta 3 g C/m²/día (Dahlback y Gunnarson, 1981). Así pues, para una granja con una superficie de l 500 m2, la sedimentación de materia seca podría alcanzar unas 10 t, y el sedimento por debajo de las balsas podría acumular hasta unos 10 cm por temporada de cultivo (Sweden, 1983). Los datos sobre producción de desechos, sedimentación y acumulación de sedimentos que lleva consigo el cultivo de mejillones están resumidos (NCC, 1989) en los Cuadros 3 y 4. Un 30% aproximadamente de los cultivos de ostras y mejillones de Francia plantean problemas de sedimentación, que obligan en ocasiones a la recolocación y abandono de los yacimientos (Weston, 1991).
| OPERACIONES Y PROBLEMAS | EFECTOS POSITIVOS | EFECTOS NEGATIVOS |
|---|---|---|
| Limpieza y preparación de las zonas de cultivo * > * * | Mejora de la producción y tratamiento | Posibilidad de pérdida de especies autóctonas y de la diversidad del hábitat |
| Gestión rutinaria (desherbaje, recogida) * > * * | Iguales que los de arriba | Iguales que los de arriba |
| Resguardar de la luz por el crecimiento de las algas * > * * | Reducción de la rivalidad | Reducción de la columna de agua y de la producción bentónica |
| Disminución de olas y corrientes de agua * > * * * | Protección de especies delicadas | Aumento de la sedimentación |
| Consecuencias estéticas * > * * * | Aumento de la productividad costera en ecosistemas degradados | Conflictos entre los usuarios Pérdida de valor de los recursos |
| Espacio * > * * * | Aumento de la productividad de ecosistemas estériles o degradados | Conflictos entre los usuarios(por ejemplo, con los pescadores) |
| Superficie y volumen del sustrato * > * * * | Aumento de la productividad de ecosistemas estériles o degradados | Cambios en el ecosistema |
* = efectos minimos
* * = posibilidad de efectos importantes
| OPERACIONES Y PROBLEMAS | EFECTOS POSITIVOS | EFECTOS NEGATIVOS |
|---|---|---|
| Calidad del agua * > * * | Aumento de oxígeno,destrucción de nutrientes, producción de algas | Reducción del fitoplancton costero |
| Ciclo de nutrición | ||
| “Enfermedades” | ||
| Fertilización y tratamientos químicos * > * * | Producción de algas | Calidad del producto |
| Aumento de la producción de policultivos | Cambios en la calidad del agua | |
| Benzos * > * * | Aumento de la producción de policultivos(por ejemplo, con moluscos) | Cambios en las especies bentónicas y en la producción |
| Productividad de la columna de agua * > * * * | Aumento de la producción de invertebrados y peces de aletas | Predadores |
| Protección de pececillos | Cambios en la estructura de la colectividad | |
| Policultivo |
* = efectos mínimos
* * = posibilidad de efectos importantes
26. La deposición de partículas de desechos orgánicos puede provocar cambios físicoquímicos del sustrato, especialmente en las inmediaciones del lugar de cultivo. El enriquecimiento del sedimento con materiales orgánicos estimula la actividad microbiana produciendo la desoxigenación del sustrato y de las aguas del fondo, debido a la reducción de las concentraciones de oxígeno en los intersticios y al aumento de consumo de oxígeno, aumento en la reducción de sulfato, aumento de la denitrificación y a la creciente liberación de nutrientes inorgánicos, tales como nitrato, nitrito, amonio, silicato y fosfato procedentes de los yacimientos de mejillones (Smaal, 1991). La regeneración de nutrientes potencialmente limitados puede aumentar la productividad primaria.
27. Las poblaciones bentónicas de cultivos en suspensión pueden verse afectadas de varias maneras (Kaspar et al., 1985). Puede faltar totalmente la macrofauna en la zona directamente debajo del lugar de cultivo. Alrededor del lugar de cultivo se reduce la riqueza de las especies y llegan a predominar las especies oportunistas que toleran el enriquecimiento. En el noroeste de España, donde el traslado de la materia orgánica procedente de las piscifactorías aumentó la biomasa de la macrofauna bentónica más allá de la zona de la ensenada costera, los cangrejos cambiaron su dieta y abundaron como respuesta al cultivo de mejillones (Freire et al., 1991). Sobre la base de la literatura sobre el tema, Gowen et al., (1988) resumieron los posibles efectos ecológicos del cultivo de mejillones en balsas (ver Figura 2).
28. La introducción de bivalvos podría tener efectos ecológicos negativos (Chew, 1990), especialmente cuando se introducen también parásitos y enfermedades. La reintroducción en Europa de la ostra plana Europea (Ostrea edulis) procedente de Norteamérica provocó la propagación de la Bonamia ostreae, un parásito de células malignas en las ostras, que devastó la industria de la ostra plana Europea. Con la introducción en Norteamérica de la ostra del Pacífico (Crassostrea gigas) procedente de Japón, se introdujeron conjuntamente dos predadores de bivalvos, la ostra rizada Japonesa (Ceratoderma inornatum y la ostra plana alargada (Pseudostylochus ostreophagus), así como el parásito Mytilicola orientalis, que puede afectar gravemente a varias especies de bivalvos. Al introducir y trasladar especies de mejillones, se corre también el riesgo de propagar enfermedades infecciosas y parásitos que son perjudiciales para mejillones y otros bivalvos (Bower y Figueras, 1989).
Cultivo de camarones
29. La mayoría de los cultivos de camarones se hacen en estanques de barro, aunque también se usan en algunos casos corrales y jaulas (Tookwinas, 1990; Walford y Lam, 1987). Los estanques de camarones pueden ocupar zonas costeras extensas que han requerido a menudo la conversión de plantaciones de arroz, salinas, plantaciones de cacahuete y azúcar, terrenos abandonados y bosques de manglares (Chong, 1990a; Aitken, 1990).
| Especies y sistema | Producciófecal | Referencia |
|---|---|---|
| Mytilus | 14,3-149,3 | Arakawa et al. |
| galloprovincialis | mg Ps/individual/24h | (1971) |
| M. edulis | 1,76 gPs/gPs mejillón/año | Kautsky y Evans(1987) |
| población de orillas naturales | 0,13 gC mefillón/año | |
| 0,0017gN mejillón/año" | ||
| 0,00026 gP mejillón/año" | ||
| M.edulis | 9,5 kg carbono/m²/año | Rodhouse et al.(1985) |
| balsas | 1,1 kg nitrógeno/m²/año | |
| M.edulis | 0,88 kg carbono/m²/a/ño | Rosenberg y Loo (1983) |
| cuerdas largas | ||
| M. edulis | 27 g carbono/m²/24h | Cabanas et al. |
| balsas | (1979) | |
| M.edulis | 2,4–3,3 g carbono/m²24h | Dahlback y Gunnarsson |
| cuerdas largas | 1,7 (según situación) | (1981) |
M.edulis | 0,5-2,5 g carbono/m²/24h | Tenore et al. (1982) |
| balsas |
| Especies y sistema | Profundidad | Velocidad de la corriente | Acumulación de sedimento | Referencia |
|---|---|---|---|---|
| M. edulis | 11–13 m | “muy floja” | 7-30 cm | Weston(1986a) |
| M. edulis | 8–13 m | -3 cm/s | 10-15 cm | Dahlback y |
| cuerdas largas | Gunnarsson | |||
| (1981) | ||||
| M. edulis | no se da | >1 cm/año | Misdorp et al. | |
| (1984) | ||||
| M. edulis balsas | > 15 m | hasta 200 cm/s | no hay signos | Rodhouse et al. |
| de presencia | (1985) | |||
| de biodepósito | ||||
| de conchas | ||||
| de mejillón | ||||
| M. edulis balsas | “corrientes | no hay signos | Earll et al. | |
| fuertes” | de presencia | (1984) | ||
| 2 cuerdas largas | de biodepósito | |||
| 3 cuerdas largas | de conchas | |||
| de mejillón |
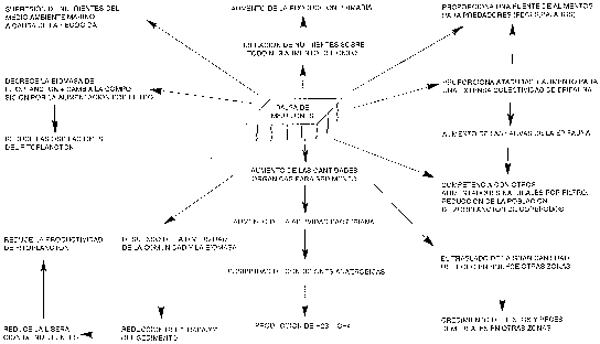
Figura 2: Resumen de los posibles efectos ecoloógicos del cultivo de mejilloón en balsaa. Nota: algunos efectos son contradictorios, y no todos los efectos son visibles en el mismo lugar (vuelto a dibujar a partir de Gowen et al., 1988)
30. Aunque no hay duda de que importantes zonas de manglares virgenes han sido desbrozadas para la construcción de estanques de camarones (Terchunian et al., 1986; Kapetsky, 1987a), es importante reconocer que se han utilizado también los ecosistemas de los manglares para otros fines, tales como silvicultura, agricultura y piscicultura en estanques (Andriawan y Jhamtani, 1989; Soemodihardjo y Soerianegara, 1989; Zamora, 1989; FAO, 1985a; Neal, 1984).
31. La eliminación de manglares para el cultivo en estanques puede afectar de manera significativa la configuración de la línea de costay las pautas de erosión de las costas, la generación y el ciclo de nutrientes en las zonas costeras, así como los hábitats -de muchas especies - cosa importante también desde el punto de vista comercial -, que utilizan el ecosistema de las mareas como fundamento de reproducción, crianza y alimentación (Honculada Primavera, 1991; Saclauso, 1989; Matthes y Kapetsky, 1988). Las pautas de producción acuática pueden cambiar las formas de alimentación basadas en detritus a otras basadas en plancton, según la superficie de manglar perdida y el grado de degradación (Kapetsky, 1987b).
32. Los estanques hechos a partir de pantanos de manglares muestran suelos típicos de sulfato ácido (Pedini, 1981; Simpson y Pedini, 1985, 1987). Se produce oxidación de pirita (Fe S2) cuando se seca el fondo del estanque, lo que produce la liberación de ácido sulfúrico en el agua del estanque y en las masas de agua adyacentes, provocando la acidificación y la generación de fosfato de aluminio soluble altamente tóxico (Chua et al., 1989) y las branquias se atascan con hidróxido de hierro (Singh, 1987). Si el suelo de manglares de los estanques se sustituye por suelo de tierra y es amontonado cerca de bosques de manglares, como se ha hecho en algunos proyectos en Tailandia (Chantadisai, 1989), se pueden producir serios problemas de sedimentación y aluvión. La aplicación a largo plazo de cal para neutralizar los suelos de sulfato ácido, junto con prácticas de fertilización, pueden sin embargo endurecer los suelos del fondo del estanque, haciéndolos menos adecuados para el cultivo de camarones en estanque.
33. En las zonas de mangles que quedan entre las mareas sólo se pueden utilizar de forma apropiada métodos más bien extensivos de cultivo, ya que cuentan con el flujo de la marea para suministro y cambio de agua. Los métodos de cultivo intensivo que requieren normalmente más de 1 m de profundidad del agua del estanque, en la preparación del estanque, tendrán que bombear para secarlo completamente, si está colocado en una zona de manglares entre las mareas. Poernomo (1990) compara la conveniencia económica y medioambiental de zonas entre mareas y fuera de las mareas para los diferentes sistemas de cultivo (ver Figura 3 y Cuadros 5 y 6)
34. La construcción de canales para el suministro, drenaje y bombeo de aguas salobres continentales produce cambios hidrológicos, aluvión e invasión de agua salada (Mahmood, 1987; Cholik y Paernomo, 1987). El bombeo y acarreo de agua salada a incubadoras tierra adentro puede afectar a la calidad del agua freática (Yap, 1990). La extracción de aguas freáticas para suministro de agua dulce de cultivos intensivos en estanque puede producir la salinización de estos acuíferos vacíos de agua dulce y ha tenido ciertamente graves consecuencias de hundimiento de tierras en Taiwan (Liao, 1989).
35. Es muy probable que el uso de fertilizantes y piensos (peces que no sirven, carne de mejillón, cabezas de camarón y dietas preparadas) para aumentar la producción (Kontara, 1988), altere la calidad del agua y del sedimento en los estanques y en las aguas adyacentes. Su uso excesivo lleva consigo el peligro de aumento de nutrientes y de la cantidad de materia orgánica (Akiyama y Chwang, 1989).
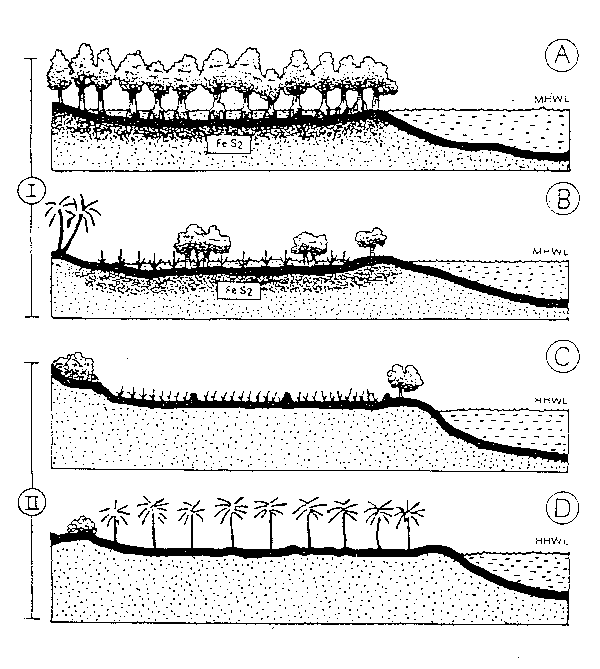
Figura 3: Zonas costeras de cultivo de camarón. I. Zona entre mareas: Bosque virgen de mangles (A); bosque secundario (B). II. Zona por encima de la marea: Campo de arroz (C); plantación de coco (D). (tomado de Poernomo, 1990)
| Zona costera | Línea de marea | Propiedades del suelo | Trabajo de construcción y costo* * | Productividad del estanque | Tratamiento del suelo | Aplicación de cultivo tecnológico | |
| Tipo/textura | pH* | ||||||
| ZONAS ENTRE MAREAS | |||||||
| bosque virgen de manglares | sumergido en pleamar de marea muerta(PMM) | turba/pirita | 2,5–3,5 | + + + + | muy baja al
comienzo | recuperación (secar y lixiviar antes del uso) | extensivo |
| bosque secundario de manglares (arbusto) | sumergido en PMM | pirita/turba | 2,4–4,0 | + + + | muy baja al
comienzo | recupereación antes del uso | extensivo a semiintensivo |
| marisma herbosa | sumergida en pleamar de marea | pirita/arcilla marga | 3,5–5,0 6,5–7,0 | + + | baja al comienzo al comienzo | recuperación antes del uso | extensivo a semiintensivo |
| plantación de coco | sumergida a PMI a lo largo de zanjas | pitria/arcilla marga | 3,5–5,0 6,5–7,0 | + + | relativamente baja al comienzo | recuperción antes del uso | extensivo a semiintensivo |
| ZONAS POR ENCIMA DE LA MAREA | |||||||
| Campo de arroz/cultivo de tierra seca | en torno sobre el nivel de pleamar de marea viva(PMV) | arcilla marga a marga | 7,0 | + | alta desde el principio | sin tratamiento especifico | sólo intensivo |
| plantación de coco | sobre el nivel de PMV | arcilla marga arenosa | 7,0 | + | alta desde el principio | sin tratamiento específico | sólo intensivo |
| hierba y otros | sobre el nivel de PMV | marga arenosa arena margosa | 7,0-8,0 | + | alta desde el principio | sin tratamiento específico | sólo intensivo |
| arenoso | 7,0–8,0 | poroso. Malo para “tambak” | - | - | - | ||
* pH del suelo una vez secado
* *
+ muy fácil, mínimo costo
+ + fácil, bajo costo
+ + + difícil, costo alto
+ + + + muy difícil, costo muy alto
| Parámetros y escenario de desarrollo | Zona entre mareas | Zona por encima de la marea |
|---|---|---|
| Tipo de terreno | Marismas de mangles y hierbas | Terreno regado, seco y llano |
| Elevación | Entre mareas, entre la PMI y la BMI | En pleamar, menos de 2 m sobre el nivel de PMI |
| Tipo de suelo | Muy a menudo suelos con posibilidad de sulfato ácido (contiene, en una cierta extensión, pirita y turba) | Generalmente no tiene suelo de sulfato ácido |
| Costo del terreno | Las zonas no desarrolladas son propiedad del gobierno, pueden ser arrendadas a coste muy bajo | El terreno es casi siempre de propiedad privada, o reclamado o cultivado, coste alto a muy alto |
| Limpieza del terreno | Muy costoso para zonas de bosque | Pequeñísimo |
| Costa en construcción | Bajo para estanques extensivos con estanques poco profundos y de gran tamaño, mientras muy alto para estanques intensivos | Sólo para estanques intensivos. Bajo para estanques con diques de tierra, alto para estanques con diques de hormigón |
| Trabajo de desarrollo | Se cuenta fundamentalmente con trabajo manual, mecanización limitada, consumo de tiempo | Ampliamente mecanizado. Manual sólo para pequeños trabajos finales |
| Acondicionamiento de preproducción del estanque | Mediante recuperación. Se necesitan varios meses, si hay sulfato ácido | Las explotaciones productivas pueden empezar inmediatamente después de terminada la construcción |
| Preparación del estanque | El secado del fondo del estanque es un problema. Es peor si la calidad del dique es mala | Fácil el secado completo. Tiempo mucho menor para la preparación del estanque |
| Relleno del estanque | Mediante la gravedad natural en pleamar. Bombeo mínimo en cultivo semiintensivo | Depende totalmente de bombas independientes del nivel de la tecnología de cultivo y de la densidad de siembra que se aplique |
| Control de plagas | Dificultad para controlar la entrada de organismos nocivos extraños | Mucho menor entrada de organismos extraños superfluos y más fácil el control si entran algunos |
| Recogida | Consumo de tiempo y depende mucho de las condiciones de la marea. Puede afectar a la calidad del producto | Rápido, se puede hacer en cualquier momento |
| Impacto en el medio ambiente | Destrucción del medio ambiente de marisma de mangles si no se controla estrictamente. | Penetración hacia tierra de agua de mar y salinización del terreno y de los recursos de aguas freáticas |
36. Los fertilizantes, como superfosfato-triple, urea, estiércol de vaca, excremento de pollo, salvado de arroz (Apud et al., 1983; Chamberlain, 1991; Sin et al., 1989), que se utilizan para favorecer el crecimiento de organismos alimentados con camarones, puede contribuir a la cantidad de nutriente y de materia orgánica. Además el uso de piensos produce cantidades de nutriente y de materia orgánica en forma de metabolitos disueltos (amoníaco, urea y dióxido de carbono) y materia en partículas (piensos no comidos y heces), que pueden provocar la concentración de sedimentos anóxicos y una super-población de algas en los estanques. En los sistemas semiintensivo e intensivo de estanque se bombea y drena al día hasta un 30–40% del volumen de agua del estanque, para proporcionar oxígeno y para eliminar el exceso de nutrientes y de materia orgánica. Por lo que las necesidades de agua son considerables; por ejemplo, en Taiwan, se requiere una producción de 11 000–21 430 m³/t para cultivos semiintensivos y 29 000–43 000 m³/t para intensivos (Chien et al., 1988; Wickins, 1986; ambos citados en Phillips et al., 1991).
37. Los efluentes vertidos influirán en las condiciones de la calidad del agua en el estanque. Se han registrado amplias gamas (Phillips et al., en prensa) en los parámetros de calidad del agua efluente durante un período de crecimiento de cinco meses en una piscifactoría intensiva de camarones en Tailandia (Cuadro 7). Es esperable una gran cantidad de materia orgánica y nutrientes en los efluentes durante la recogida y el drenaje y limpieza de los estanques, a consecuencia del vertido adicional de material que anteriormente estaba unido al sedimento en forma de partículas. Desgraciadamente hay una falta general de datos empíricos sobre la cantidad y calidad de los efluentes procedentes de estanques de camarones, así como sobre los correspondientes efectos ecológicos en las masas de agua receptoras. Sin embargo, los posibles efectos negativos del vertido de efluentes ricos en nutrientes y materia orgánica pueden ser una creciente sedimentación y procesos de aluvión, hipoxia, hipernutrificación y alteraciones de las estructuras productivas y colectivas de las poblaciones bentónicas.
38. En la acuicultura de camarones se utilizan diferentes sustancias químicas (Sunaryanto, 1988; Baticados et al., 1990; Liu, 1989). En las incubadoras de camarones y en los estanques de crecimiento se aplican antibióticos como cloranfenicol, oxitetraciclina, furazolidona, estreptomicina, nitrofurazona, para tratar y prevenir brotes de enfermedades. El abuso de antibióticos (Brown, 1989) puede ser muy perjudicial a causa de la posible generación en los camarones de elementos patógenos resistentes a los fármacos (e.g., Vibrio) y el peligro de transmitir la resistencia a los fármacos a patógenos humanos. La extensión de especies resistentes a los fármacos en las zonas de cultivo de camarones se debe probablemente a la alta concentración de piscifactorías. El abuso de antibióticos en las incubadoras de Taiwan ha producido una resistencia y una supervivencia escasa del camarón en situación de crecimiento (Lin, 1989). Se sabe que el abuso de formalina y malaquita fresca es perjudicial para las algas y el zooplancton, incluidos los nauplios de pencidos. Las especies superfluas se erradican mediante la aplicación de sulfato de cobre como alguicidas, piscicidas biodegradables basados en plantas, tales como polvo de tabaco (nicotina), pastel de semillas de te (saponin) extracto de raíces de “derris” (rotenona); lo mismo que plaguicidas orgánicos o molusquicidas, tales como hidrocarbonos clorados (DDT, endrina, aldrina, tiodán) y estaños orgánicos (brestán y acuatin). Estos plaguicidas orgánicos son de especial interés a causa de su toxicidad y persistencia, y de sus posibles implicaciones en la calidad del producto y en la salud humana. No se han estudiado por el momento los efectos ecológicos de desinfectantes y productos químicos en el tratamiento del agua y del suelo, tales como hiperclorito de sodio, cloruro de benzalconio, carburo de calcio, Na-EDTA, y zeolitos.
39. Hay cada vez más pruebas de que algunos elementos patógenos del camarón como el virus infeccioso hipodérmico de la necrosis hematopoiética (IHHNV) y el monodonbacilovirus (MBV) se han propagado a través de la introducción y transporte de especies de camarones para el comercio. Los brotes de enfermedades en los camarones se han atribuido también a la intensificación y deterioro excesivo del agua y a la calidad del sedimento en los estanques de camarones y en las aguas adyacentes a causa de una saturación de desechos. Síndrome de caparazón blando, enfermedad roja y camarones azules parecen estar vinculados al problema de sulfato ácido del suelo (Baticados et al., 1990; Brock, 1991), aunque no hay todavía conclusiones evidentes. Algunas piscifactorías han sido abandonadas y recolocadas a causa de enfermedad y problemas de ordenación de los estanques, que habían provocado pérdidas de producción. En relación con esto, Lin (1989) ha resumido las causas del colapso producido en 1988 en la industria del camarón en Taiwan (ver Anexo 1).
40. Una nueva implicación biológica del cultivo de camarones se refiere a los insumos de semillas y piensos. Además aunque está aumentando la siembra de postlarvas criadas en incubadora, se prefieren a menudo las postlarvas silvestres (Hirono y Van Eys, 1990), lo cual puede conducir a una captura excesiva de postlarvas y al rechazo de unos 10 kg de larvas y pececillos de otras especies por 1 kg de larvas de camarón criado en incubadora (Silas, 1987).
| Tamaño del estanque (ha) | 0,48 – 0,56 |
| Profundidad del estanque (m) | 1,5 – 1,8 |
| Salinidad (ppt) | 10 – 35 |
| Temperatura (°C) | 22 – 31 |
| pH | 7,5 – 8,9 |
| Total de fósforo (mg/l) | 0,05 – 0,4 |
| Total de nitrógeno (mg/l) | 0,50 – 3,4 |
| Total de amoníaco (mg/l) | 0,05 – 0,65 |
| Oxígeno disuelto (mg/l) | 4,0 – 7,5 |
| Clorofila a (μg/l) | 20 – 250 |
| Total de sólidos en suspensión (mg/l) | 30 – 190 |
| Frecuencia del cambio de agua (%/día) | 5 – 40 |
41. En 1988, el cultivo de camarón en Asia absorbió 180 000 t de harina de pescado que se utilizó para piensos compuestos; para el año 2000 se necesitará alrededor de 1,1 millón de t de piensos para camarón. Esta creciente demanda puede eventualmente invadir las especies capturadas para alimento humano así como las crías de dichas especies (New y Wijkstrom, 1990).
Cultivo de peces de aletas
42. La mayor parte del cultivo costero de peces de aletas se realiza en estanques, recintos, jaulas, depósitos y canales (Chua, 1982; Padlan, 1982; Beveridge, 1987).
43. Con el cultivo de especies de peces herbívoros y que se alimentan de detritus, tales como chanos y mújoles en estanques de aguas salobres incluso antes de que empezara a extenderse el cultivo de camarones, se ha comprobado una fuerte degradación del terreno, especialmente en zonas de manglares. El cultivo en agua salada de chano/mújol se enfrenta también a posibles problemas ecológicos relacionados con suelos de sulfato ácido, deterioro de la calidad del agua y del sedimento, exceso de fertilización y uso de sustancias químicas (organoestaños o molusquicidas), que pueden afectar gravemente a los ecosistemas de manglares adyacentes (Poernomo y Singh, 1982; Ti et al., 1982; Kapetsky, 1982).
44. Sin embargo, los posibles problemas ecológicos relacionados con el enriquecimiento de nutrientes y de materia orgánica en o fuera de la unidad de cultivo se dan normalmente en cultivos semiintensivos, y en especial intensivos, de peces carnívoros en que se requiere suministro de piensos (Mok, 1982). Los desechos de nutrientes y de materia orgánica, disueltos o en forma de partículas, que proceden de alimentos no comidos y de excrementos, se caracterizan generalmente por un aumento en sólidos en suspensión (SS), Demanda Biológica de Oxígeno (DBO) Demanda Química de Oxígeno (DQO) y contenido de carbono, nitrógeno y fósforo. Desgraciadamente, la mayoría de la información disponible sobre desechos procedentes de piscifactorías se refieren a especies de zonas templadas.
45. A continuación se dan algunos ejemplos de cargas de efluente procedentes de piscifactorías basadas en tierra. La demanda de oxígeno y la liberación de nutriente al año por tonelada de trucha arco iris en una piscifactoría danesa se calculó en 300 kg DBO5/t/año, y 10 kg Total-P/t/año y 81 kg Total-N/t/año (Sweden, 1983). Para depósitos poblados con salmón adulto del Atlántico, la escala de valores (Bergheim y Forsberg, 1992) para cantidades de efluente expresadas en g/kg pescado/24 horas fue la siguiente: 0,5 – 0,4 g de materia seca en suspensión (MSS), 0,01 – 0,05 g total de fósforo (TP), 0,15 – 0,30 total de nitrógeno (TN) y 0,1 – 0,2 g total de nitrógeno amoníaco (TAN), con una proporción de conversión alimenticia de 1,0 – 1,2 de pienso seco por kilogramo de aumento de peso del pescado. La Figura 4 muestra los resultados de este estudio; en ella se relaciona la carga del efluente con la cantidad de alimento dado.
46. Rosenthal et al., (1988) encontraron importantes diferencias al hacer el resumen de las cargas estimadas de una serie de piscifactorías intensivas de truchas que utilizaban sistemas de estanques y depósitos (Cuadro 8). Algunos análisis comparativos más recientes (Beveridge et al., 1991) sobre la calidad de los efluentes en la acuicultura de agua dulce de salmónidos (Cuadro 9) confirma la variabilidad de datos para las cargas de efluentes. La conclusión es que hay muchas variables que rigen la calidad de los efluentes tales como especies, tamaño método e intensidad del cultivo, tratamiento, temperatura, modo de vertido y alcance de dilución o tratamiento anterior al vertido.
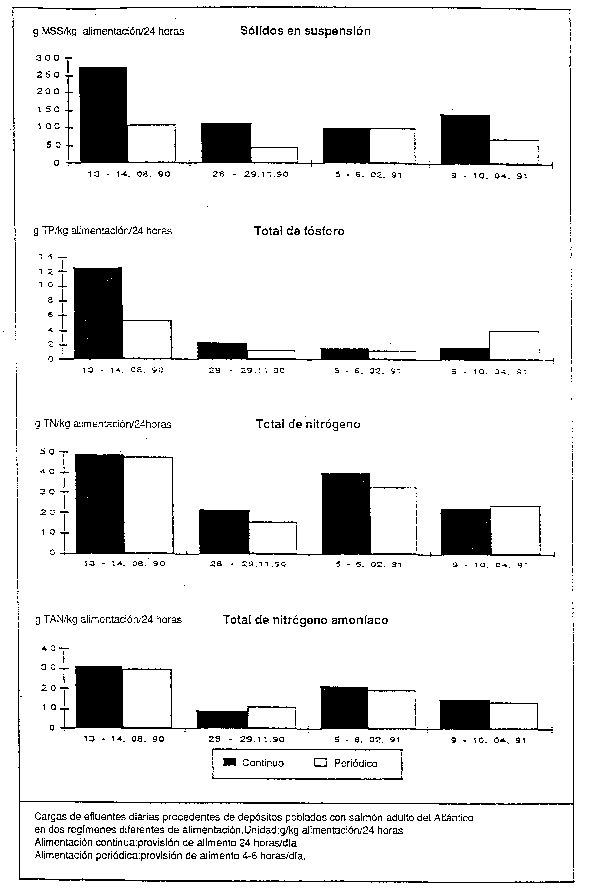
Figura 4: Ejemplo de cargas de efluentes procedentes de depósitos poblados con salmón adulto del Atlántico (tomado de Bergheim y Forsberg, 1992)
| Sistemas | Especies | Tamaño | Proporción de alimentación (% del peso corporal) | Tipo de alimentación | Carga neta | Referencia |
|---|---|---|---|---|---|---|
| Depósitos y estanques | Trucha parda (biomasa 2 260 kg) | 2,2–100 g | 17,5–1,3% | bolitas secas manual + automático | 11,5 g COD/kg fish/24h 2,7 g BOD7/kg fish/24h 0,05 g Total-P/kg fish/24h 0,9 g SS/kg fish/24h | Bergheim et al. (1982) |
| Depósitos y estanques | Trucha parda (biomasa 7 320 kg) | 1,0–25,0 g + reproductores | 3–6% | bolitas secas + mojadas, manual | 75,3 g COD/kg/24h 83,3 g BOD7/kg/24h 0,43 g Total-P/kg/24h 0,24 g PO4-P/kg/24h 1,4–3,8 g Total-N/kg/24h | Bergheim et al. (1982) |
| Estanques | Trucha parda Trucha arco iris (biomasa 2 690) | 0,2–500 g | 0,55–4,5% | bolitas secas manual | 17,0 g COD/kg/24h 7,1 g SS/kg/24h 0,45 g Total-N/kg/24h 0,08 g Total-P/kg/24h 0,05 g PO4-P/kg/24h | Bergheim et al. (1982) |
| Depósistos y estanques | Trucha parda (biomasa 5 970 kg) | 1–550 g | 0,5–16% | seco automático | 3,1 g COD/kg/24h 1,6 g BOD7/kg/24h 1,2 g SS/kg/24h 0,13 g Total-N/kg/24h 0,05 g Total-P/kg/24h 0,03 g PO4-P/kg/24h | Bergheim et al. (1982) |
| Estanques 12 700 m² | Trucha arco iris | 35–150 g 500–2 000 g | ? ? | bolitas secas | 0,4–0,8 g Total-N/kg/24h 0,05 g Total-P/kg/24h 1,6–4,6 g BOD7/kg/24h | Bergheim + Selmer-Olsen (1978) |
| Estanques | Trucha arco iris | 2,0–300 g | ? | bolitas secas, pienso húmedo | 0,5–1,4 g Total-N/kg/24h 0,13–0,18 g Total-P/kg/24h 1,9–5,7 g BOD5/kg/24h | Markham (1978) |
| SS | DBO | NH4-N | NO2N | NO3-N | TOTAL N | PO4 | TOTAL P | Ref. | |
|---|---|---|---|---|---|---|---|---|---|
| (a) g kg pescado-1día-1 | |||||||||
| 0.0–7,1 | 1,6–2,7 | - | - | - | 0,1–3,8 | 0,02–0,27 | 0,01–0,43 | a | |
| - | 1,4–8,1 | - | - | - | - | - | - | c | |
| 0,8–0,9 | - | 0,3–0,8 | - | 0,13–0,21 | - | 0,07–0,17 | - | b | |
| - | - | 0,03 | - | 0,05 | 0,12 | 0,033 | 0,10 | d | |
| (b) kg ton pescado-1 año-1 | |||||||||
| 474–4 015 | 510–990 | 37–180 | - | 0–548 | - | - | 22–110 | e | |
| 1 350 | 285 | 55,5 | 1,81 | 10,2 | - | - | 15,7 | f | |
| 350 | 45 | - | - | 83 | - | 11 | g | ||
| (c) g kg pienso-1 | |||||||||
| - | 80–300 | - | - | - | - | - | 11 | c | |
| 183 | 165 | 25 | 0,27 | 0 | - | 26 | 4,0 | h | |
| 80–280 | 100–370 | - | - | - | 37–48 | - | 4,7–10,8 | i | |
a Bergheim et al. (1982);
bClark et al. (1985);
cButz y Vens Cappell (1982);
dKorzeniewski et al. (1982);
eAlabaster (1982);
fSolbe (1982);
gWarrer-Hansen (1982);
hButz (1988);
iMakinen(1988)
47. En lo que se refiere al vertido de desechos procedentes de piscifactorías marinas en jaulas, la producción de desechos sólidos procedentes de piscifactorías de salmónidos se estima en una escala que va de 0,3 a 0,7 peso en seco de desechos de alimentos y heces por kilogramo de pescado producido (Weston, 1991). Según informes, una típica red noruega de cultivo en recintos con una producción anual de salmón de 200 t y técnicas de alimentación bien crontroladas proporciona un nivel de carga anual de 2 t de fósforo, 18 t de nitrógeno y 100 t de oxígeno como EOB7 (Seymour y Bergheim, 1991). Gowen y Bradbury (1987) señalaron la generación de 19,4 t o de desechos de carbono orgánico, 2,2 t o de desechos de nitrógeno orgánico y 4,0 t de desechos de nitrógeno soluble de una piscifactoría de salmónidos con una producción anual de 50 t utilizando 100 t de piensos al año (ver Figuras 5 y 6). Los resultados de un estudio de campo indicaban que hasta un 76% del carbono y un 76% del nitrógeno dado como alimento al salmón criado en jaula es vertido al medio ambiente marítimo en forma de desecho sólido y soluble y que los principales factores de control del nivel de enriquecimiento del bentos y de la columna de agua son el tamaño de la piscifactoría, la agricultura y la hidrografía en el lugar (Gowen et al., 1988).
48. Es evidente que se requiere una proporción considerable de cambio de agua para eliminar los desechos y proporcionar oxígeno tanto a piscifactorías basadas en la tierra como en el mar. La dilución/dispersión, distribución por zonas y sedimentación de los desechos vertidos y sus posibles efectos ecológicos en las piscifacorías vienen determinados por las velocidades de la corriente y la profundidad de las masas de agua que reciben los desechos de efluentes procedentes de estanques/depósitos y de jaulas.
49. Se ha indicado que el vertido desde las piscifactorías de nitrógeno inorgánico disuelto (amoníaco, nitrato y nitrito) y, en el caso de ambientes de aguas salobres, fósforo, puede afectar a la población existente, la composición de las especies o la productividad de fitoplancton y macroalgas. Weston (1991), sin embargo, preveía efectos localizables y medibles en las poblaciones de microalgas sólo en casos de una actividad inusual de cultivo denso en ensenadas costeras pobres en flujos (ver también Aure y Stigebrandt, 1990; Frid y Mercer, 1989; Turrel y Munro, 1989).
50. Las partículas de materia orgánica vertida se asientan en las proximidades de la piscifactoría, si la velocidad de fijación de las partículas es más alta que la velocidad del agua corriente. Los sólidos que se depositan en el lecho marino son ricos en carbono, nitrógeno y fósforo en relación a los sedimentos naturales (Holmer, 1991), y tal vez ocasionan cambios físico-químicos en los sedimentos de o próximos a las piscifactorías, incluso un aumento del contenido de carbono orgánico, seguido de un incremento de los índices de consumo de sedimentos de oxígeno y una disminución del potencial de sedimento redox (Brown et al., 1987), generación de sulfuro de hidrógeno y metano (Lumb, 1989), y aumento de nitrógeno inorgánico y orgánico (Kaspar et al., 1988), fósforo, silicona, calcio, cobre y zinc (Rosaenthal et al., 1988). Se señala, sin embargo, que estos efectos físicos y químicos se limitan únicamente a los lugares inmediatos a las piscifactorías.
51. La propagación de los consiguientes efectos ecológicos en las poblaciones macrobentónicas que se hallan debajo y alrededor de los cultivos en jaulas se pueden describir (NCC, 1989) según las siguientes pautas (ver también Cuadro 10): (a) falta de macrobentos (la zona azoica, si existe, se halla generalmente sólo debajo de las jaulas), (b) predominio de especies que toleran el enriquecimiento (la zona de oportunismo, que cubre una superficie de hasta 30 m a partir del lugar) y (c) una vuelta gradual a las condiciones anteriores, cosa que normaLmente se da a 30 m de la piscifactoría, aun cuando los efectos pueden ocasionalmente propagarse hasta 100 m del lugar de la piscifactoría. Son previsibles efectos parecidos sobre la población bentónica en las proximidades de los conductos de descarga de piscifactorías basadas en tierra, aunque no se dispone de datos de campo específicos.
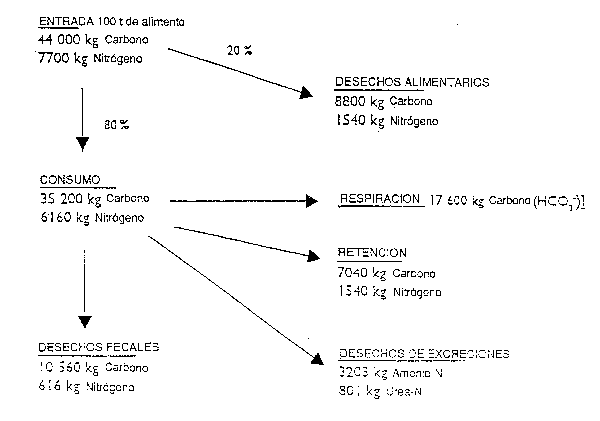
Figura 5: Flujo estimado de carbono y nitrógeno en una piscifactoría de salmónidos con una producción anual de 50 t (tomado de Gowen y Bradbury, 1987)
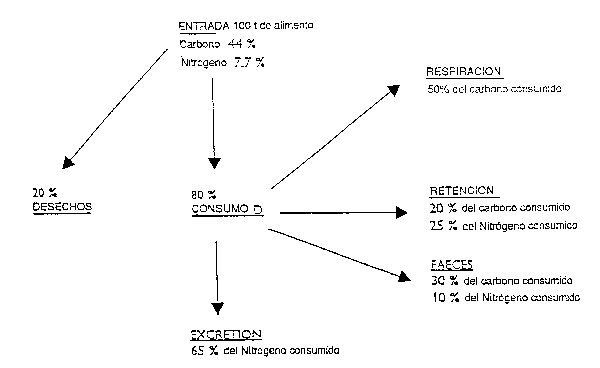
Figura 6: Promedio estimado del flujo de carbono y nitrógeno en una piscifactoría de salmónidos (tomado de Gowen y Bradbury, 1987)
52. La magnitud y la zona de propagación de los efectos de enriquecimiento dependerán generalmente de una variedad de factores tales como las características productivas de la piscifactoría, profundidad, topografía del fondo, velocidad de la corriente y exposición a los movimientos de crecimiento de las aguas (por ejemplo, tempestades) que determinarán la propagación lateral de las partículas depositadas, la cantidad de materia orgánica por unidad de superficie y el arrastre y redistribución de los desechos del fondo (ver también Hakanson et al., 1988; Lauren-Maatta et al., 1991; Kupka Hansen et al., 1991). Puede también ser importante la capacidad de las poblaciones indígenas para asimilar y mineralizar los desechos orgánicos.
53. En la cría de peces de aleta se utiliza una amplia gama de sustancias químicas, tales como productos terapéuticos y biocidas, vacunas, hormonas, vitaminas, pigmentos de carne, anestésicos, desinfectantes, componentes para el tratamiento del agua y sustancias químicas presentes en los materiales que se utilizan en la fabricación de las unidades acuícolas. La utilización de sustancias químicas varía mucho según especies, intensidad de cultivo y situación. El Cuadro 11 muestra la diversidad de métodos y objetivos de las aplicaciones químicas. La cantidad utilizada y la forma de aplicación determinarán el alcance de los efectos ecológicos.
54. Por lo que respecta a los antibióticos (Grave et al., 1990), que normalmente se administran con el pienso, es evidente que tan sólo un 20–30% es ingerido realmente por el pez; por tanto, un 70–80% aproximadamente enriquece el medio ambiente (Samuelsen, 1989), sobre todo el procedente de alimentos médicos no comidos. La oxitetraciclina, por ejemplo, puede quedar depositada en los sedimentos, donde permanece en concentraciones capaces de producir efectos antibacterianos durante 12 semanas después de terminado el tratamiento (Jacobsen y Berglind, 1988). Los antibióticos pueden propagarse a la fauna bentónica presente o a los peces silvestres por alimentarse directamente de los desechos de las piscifactorías. En grupos de bacterias aeróbicos y ocasionalmente anaeróbicos pueden desarrollarse fuerzas resistentes a los antibióticos, que afectarían a los índices y pautas de mineralización y descomposición bacteriana de los sedimentos (Holmer, 1991; Bjorklund et al., 1990)
55. El uso de componentes organofosforados triclorfón (Neguvon) y diclorvos (Nuvan) para el tratamiento del piojo del salmón ha despertado interés, a causa de su posible toxicidad en organismos que no son objeto del tratamiento, como bogavantes, cangrejos y mejillones (Egidius y Moster, 1987), y larvas de arenques y bogavantes (McHenery et al., 1991). Sin embargo, para predecir realmente supuestos efectos tóxicos son necesarios datos sobre cantidades, reacción química, degradación, persistencia y distribución de la sustancia tóxica.
56. Antiincrustantes, como tributiltin (TBT), que fueron muy utilizados en el tratamiento de estructuras sumergidas y en redes de cultivo de jaulas y corrales, en la actualidad se usan mucho menos, por temor a un aumento de la acumulación de estaño orgánico y componentes basados en el cobre en la carne de los peces de cultivo (Beveridge et al., 1991).
| Especies y sistema | Efectos | Referencia |
|---|---|---|
| Jaulas de salmón plateado, Puget Sound | Gran abundancia y poca diversidad directamente debajo de las jaulas, predominio de Capitella capitata | Pease (1977) |
| Cola-amarilla, Bahía de Uchiura, Japón | Aumento de policetos oportunistas y disminución en proporción relativa de moluscos y crustáceos con aumento de materias orgánicas | Kitamori (1977) |
| Jaulas de salmón del Atlántico, Irlanda | Azoico debajo de las jaulas, predominio de Capitella capitata en la zona alrededor de las jaulas | Stewart (1984) |
| Jaulas de salmón del Atlántico, Noruega | Analizados tres piscifactorías: 1. Poca diversidad y población con predominio de especies oportunistas. 2. Bioestimulación debajo de las jaulas 3. Efecto “mínimo” debajo de las jaulas. | Ervik et al. (1985) |
| Jaulas de salmón del Atlántico, Escocia | Zona de azoico debajo de algunas piscifactorías | Earll et al. (1984) |
| Jaulas de salmón del Atlántico, Shetland | Zonas de azoico debajo de algunas piscifactorías. Debajo y fuera de las jaulas, predominio de Capitella capitata. Efectos restringidos a 40m de las jaulas. | Dixon (1986) |
| Jaulas de salmón del Atlántico, Escocia | Zona azoica debajo de las jaulas, rodeada por C. capitata y Scolelepis fuliginosa a 8 m fuera del sitio. [Zona enriquecida hasta 25m y limpia a partir de > 25m] | Brown et al.. (1987) |
57. Las consecuencias de introducciones y traslados de peces marinos pueden ser generales e irreversibles. A raíz de la introducción de especies de salmón del Pacífico (Oncorhynchus kisutch, O. gorbuscha y O. keta) en aguas del Atlántico se prestó primeramente atención a la posible rivalidad con el salmón del Atlántico (Salmo salar) en corrientes de desove y zonas de cría, así como a la importación de enfermedades tales como necrosis infecciosa hemapoiética (INH) causada por un virus, y enfermedad bacteriana de riñón (BKD) causada por el Renibacterium salmoninarum (Sindermann, 1986). En 1987, el salmón Atlántico de unos 30 ríos de Noruega se contagió de Gyrodactylus salaris, un trematodo ectoparásito, que penetró en Noruega con crías de salmón importado de Suecia en la mitad de los años 70 (Folke y Kautsky, 1989). La introducción de “Tilapia mossambica” (Oreochromis mossambicus) se considera una “verdadera pesadilla” (Juliano et al., 1989) para los cultivos de aguas salobres de Filipinas, a causa de la competencia para la alimentación con los chanos de cultivo.
| PRODUCTO QUIMICO | USO | FW/SW | METODO | OBSERVACIONES |
|---|---|---|---|---|
| TERAPEUTICOS Acido acético Formalín | ectoparásitos ectoparásitos | FW FW/SW | D D A | Uso con CuSO4 en zonas de agua dura 165–250 ppm hasta 1 hora, 20 ppm 4 horas uso en jaulas marinas como baño - común |
| Malaquita verde | ectoparásitos y hongos | FW/SW | D F S B | Huevos y peces, 100 ppm 30 sec. 4 ppm 1 hora común en fw, uso ocasional en jaulas como marcador de tinte |
| Acriflavina (o hemisulfato de proflavina) | ectoparásitos, hongos y bacterias | FW | D | |
| Nuvan (diclorovos) | piojos de salmón | SW | B | 1ppm por 1 hora, lonas alrededor de jaulas marinas |
| Sal Yodo amortiguado | ectoparásitos bacteriócida | FW FW | D B B | Alternativa ocasional a la formalina Uso para desinfección de huevos 10 mins. 1 000 ppm |
| Oxitetraciclina | bacteriócida | FW/SW | T | Antibiótico muy usado para enfermedades de los sistemas |
| Acido oxolínico | bacteriócida | FW/SW | T | Antibiótico muy usado para enfermedades de los sistemas |
| Romet 30 (Sulfadimetoxina y ortomeprima) | bacteriócida | FW/SW | T | Antibiótico para enfermedades de los sistemas |
| Tribissen (Trimetoprima/sulfadiacina) | bacteriócida | FW/SW | T | El tercer antibiótico más usado |
| Hayamina 3500 | surfactante/ bacteriócida | FW | A | Componente cuaternario de amoníaco usado para el tratamiento de enfermedades bacterianas de las branquias |
| Benzalconio Clorido | bacteriócida | FW | A | Superficie antibacteriana; ‘Roccel’ (semejante a lo señalado arriba) |
| Cloramina T | bacteriócida | FW | A | Como arriba, también eficaz para algunos protozoos |
| VACUNAS | ||||
| SW | B | No muy usada | ||
| Vacuna Vibrio Anguillarum | ||||
| Vacuna entérica Redmouth | FW | B S I | Muy usada en el cultivo de truchas | |
| Aeromonas Salmonicida Vibro | SW | I | No muy usada | |
| Vacuna Anguillarum | ||||
| ANESTESICOS | ||||
| FW/SW | B | Muy usada aprox. 1:10 000 dilución | ||
| MS222 (tricaina metano-sulfonada) Benzocano | FW/SW | B | Muy usado, requiere acetona para disolverse | |
| Dióxido de carbono | FW/SW | B | Usado algunas veces para la cosecha | |
| DESINFECTANTES | ||||
| FW/SW | S | Desinfectante general para depósitos | ||
| Hipoclorito de calcio | etc. | |||
| Yodóforo líquido, por ej. FAM 30 | FW/SW | S | Para equipos y baños de pie | |
| Hidróxido de sodio | FW | S | El más comúnmente usado para estanques en tierra | |
| TRATAMIENTO DEL AGUA | ||||
| FW | A | Usada en estanques de tierra | ||
| Cal | ||||
| Permanganato potásico | FW/SW | B A | Oxidador y detoxificador | |
| Sulfato de cobre | FW/SW | A | Algicida y hierbicida | |
58. En un estudio general, Baltz (1991) concluye que más de 120 especies de peces marinos y eurialinos se han introducido con éxito en todo el mundo. La mayoría de las introducciones ni establecieron poblaciones, ni lograron sus objetivos cuando fueron introducidas deliberadamente, o a menudo tuvieron efectos nocivos cuando las especies llegaron a establecerse. La biodiversidad de los ecosistemas costeros puede estar amenazada por la extinción de especies nativas y la interrupción de la estructura y función en las poblaciones naturales. El alcance de las mutuas influencias genéticas entre poblaciones cultivadas y silvestres dependerá principalmente de la probabilidad de reproducción entre razas o especies diferentes (por ejemplo, extensión de fugas, barreras ecológicas o de comportamiento para la “inter-reproducción”) y de la magnitud relativa de la crías de peces fugados en comparación con las crías silvestres.
59. Es muy probable un aumento de abundancia, biomasa y diversidad de peces y de otras especies en las proximidades de estructuras de piscicultura, especialmente jaulas y corrales en la medida en que el sitio de cultivo es capaz de representar una zona de disponibilidad creciente de alimento (alimento no ingerido, poblaciones macrobentónicas densas) para poblaciones de peces silvestres.
60. El cultivo de peces carnívoros se basa en piensos de pescado, y se calcula que se requieren 5,3 t de pescado para 1 tonelada de salmón cultivado en jaula (Folke y Kautsky, 1989; Folke, 1988). Con la creciente demanda de piensos de pescado, la acuicultura, en algunos casos, puede interferir indirectamente en las poblaciones naturales de peces.
Efectos secundarios negativos
61. Es importante reconocer que es muchas veces la propia acuicultura la que se ve afectada por los cambios ecológicos derivados de las prácticas de cultivo. Por ejemplo, las corrientes de agua pueden verse reducidas de forma significativa a causa de las estructuras de cultivo (jaulas, recintos, balsas, etc.) que pueden llevar al aumento de la deposición y a la acumulación de desechos orgánicos debajo o alrededor de la unidad de cultivo, aumento de la sedimentación y deterioro de la calidad del agua (por ejemplo, aumento de la turbiedad a causa del alto contenido de materias en suspensión). Además, puede verse reducido el suministro de oxígeno, y darse una salida de gases de sulfuro de hidrógeno y mentano de los sedimentos del fondo, lo cual afectaría a una mayor propensión y propagación de enfermedades (Lumb, 1989).
62. El cultivo en estanques que depende del flujo de la marea o de bombeo para la renovación del agua puede también enfrentarse a un continuo aumento del deterioro de la calidad del agua. Por ejemplo, las exigencias de renovación total del agua en los sistemas intensivos de estanques de camarones en Indonesia superaban a menudo la velocidad de flujo de las corrientes de la marea que sirven para alimentar los canales y acequias de drenaje. El resultado claro es que en lugar de sustituir los desechos con agua limpia, estas piscifactorías reciclan muy a menudo aguas residuales (Chamberlain, 1991). Los sistemas extensivos de cultivo que se basan en la productividad natural de las aguas utilizadas pueden reducir o desviar el caudal de agua a través de las estructuras de cultivo y una intensa sedimentación, reduciendo por ello la disponibilidad de alimento y nutrientes.
63. El uso de sustancias químicas puede también suponer un riesgo potencial para los organismos cultivados (Ackefors et al., 1990), y puede provocar la contaminación de los productos acuícolas, lo cual reduce la calidad del producto y su aceptación por parte del consumidor. El desarrollo de sustancias patógenas resistentes a los fármacos, presentes (y posiblemente latentes) en y alrededor de la unidad de cultivo, puede tener efectos secundarios muy negativos en la productividad de la piscifactoría. El abuso de sustancias químicas en incubadoras puede provocar la reducción de la idoneidad, un crecimiento escaso y una disminución de los índices de supervivencia durante la fase de crianza. El tratamiento quimico excesivo puede hacer menos aptos los suelos de los estanques.
64. Predadores como peces y pájaros son atraídos a los cultivos, lo mismo que a la población natural de peces de la zona, y al suministro ya preparado de alimento de los peces. Cabe la posibilidad no sólo de que tales depredadores dañen y consuman peces valiosos, sino también de que aumenten las enfermedades en la zona al servir como huéspedes intermediarios en el ciclo vital de los parásitos. Los predadores así como los que pastan en el epifiton de las estructuras de la piscifactoría pueden dañar las redes u otros materiales del recinto, provocando fugas.
65. La magnitud de los efectos secundarios negativos en la ecología a causa de las prácticas acuícolas costeras puede aumentar con la expansión y/o la intensificación. Un aumento en la superficie y/o en el número de unidades piscícolas (depósitos, perchas, almadías, jaulas, etc.) y piscifactorías puede verse seguido del deterioro de la calidad medioambiental requerida en y más allá de la zona de acuicultura.
66. Como resultado de la expansión de sistemas de piscicultura basados en alimentos y nutrientes disponibles naturalmente, puede llegar a agotarse la productividad de las masas de agua en las zonas costeras. La ocupación y la degradación a gran escala de hábitats de marea, incluso zonas de manglares, puede también afectar a la provisión de semillas silvestres. Sin duda, la acumulación de piscifactorías tendrá efectos añadidos de vertido de desechos y una demanda creciente de oxígeno. Los efectos negativos secundarios de sedimentación, turbiedad, acumulación de sedimentos ricos en materia orgánica, aguas de fondo hipóxico o anóxico, salida de gases tóxicos, proliferación de desechos, etc., pueden, pues, afectar a todas las piscifactorías de la zona, especialmente si están situadas en ensenadas abrigadas y poco profundas, con índices bajos de cambio de agua. Los sistemas de cultivo situados en tierra se enfrentan a problemas similares, tales como, por ejemplo, el cultivo intensivo de camarón en Taiwan y Tailandia, donde las piscifactorías tienden a concentrarse en espacios adecuados, lo cual causa problemas muy serios de autopolución (Csavas, en prensa). Csavas afirma que “el agua desaguada por una piscifactoría es a menudo utilizada por las granjas vecinas, haciendo así del cambio de agua en zonas de fuerte acumulación de estanques un ejercicio inútil”.
3.3 Degradación del medio ambiente costero y posibles efectos de la acuicultura costera
67. La zona costera en cuanto entidad económica proporciona emplazamientos para una amplia serie de actividades, tales como agricultura (por ejemplo, arroz, coco, banano), silvicultura (por ejemplo, manglar, palmera nypa), pesca y acuicultura, asentamientos humanos, industrias manufactureras y de extracción (por ejemplo, extracción de arena, petróleo, minerales), recogida de desechos, puertos y transporte marítimo, infraestructura de transporte por tierra, proyectos de control y suministro de agua, obras de protección de las riberas, turismo y recreo. Los múltiples usos de recursos o actividades en las zonas costeras pueden producir una variedad de cambios en las condiciones medioambientales o socio-económicas, lo cual a su vez puede tener repercusiones de interés social. El Anexo 2 da una visión general de los resultados del posible impacto causado por los múltiples usos de los recursos costeros. La Figura 7 ilustra algunas fuentes de polución en la zona costera. Los lectores que estén especialmente interesados en aspectos de la contaminación costera y marítima, pueden consultar: Phillips y Tanabe (1989); Gómez et al. (1990); Sen Gupta et al. (1990); GESAMP (1990b); UNEP (1990b); GESAMP (1990a); GESAMP (1987); GESAMP (1980); Maclean (1989).
68. Es importante reconocer que en muchas zonas costeras la contaminación y la modificación del hábitat derivadas de actividades humanas distintas de la acuicultura afectan progresivamente a la utilización de recursos productivos en la acuicultura y limitan las posibilidades de éxito y desarrollo de la industria acuícola (Stickney, 1990; Chua y Tech, 1990; Menasveta, 1987).
69. A continuación se señalan, a modo de ejemplo, algunos peligros de contaminación para la acuicultura costera (Chua et al., 1989). Una fuerte carga de materia orgánica y microbios en las aguas residuales de zonas y núcleos urbanos muy poblados puede contaminar el cultivo de crustáceos, haciendo estos productos acuícolas contraindicados para el hombre, sobre todo si se consumen crudos o poco cocidos. A modo de ejemplo, en la bahía de Manila, que es uno de los mayores lugares de cultivo de ostras y moluscos de Filipinas, se han registrado recuentos de coliformes de más de 1 000/100 ml. En 1979 se declaró en Singapur una epidemia de gastroenteritis, debida a la ingestión de ostras importadas de Filipinas. A consecuencia de este incidente, descendió la demanda de marisco de Filipinas. La fuerte contaminación orgánica debida a las corrientes de las pocilgas de Malasia y de los molinos de azúcar de Tailandia, caracterizados por una alta demanda de oxígeno bioquímico, dañó seriamente los bancos de berberechos y otros organismos de cultivo. Las piscifactorías de camarones y de ostras de Tailandia se vieron gravemente afectadas por los residuos líquidos procedentes de una destilería.
70. Metales pesados encontrados en los efluentes procedentes de la industria pueden hallarse en animales criados en esas aguas. En la bahía de Yacarta (Indonesia), el análisis de muestras de peces y mariscos mostró que se superaban las normas OMS para metales pesados en un 76% de las muestras estudiadas en lo referente al cadmio; un 51% para el cobre; 44% para el plomo; 38% para el mercurio; y 2% para el cromo. Vertidos grandes de petróleo pueden provocar la muerte de peces a gran escala, y los efectos evidentes en la acuicultura incluyen la contaminación de las estructuras de las piscifactorías y la infección de los organismos cultivados.
71. Altos niveles de plaguicidas, procedentes de residuos agrícolas, pueden ser letales para los organismos cultivados, mientras que se piensa que dosis más bajas producen efectos subletales, como cambios patológicos en diferentes órganos.
72. El vertido de nutrientes inorgánicos y orgánicos en los ecosistemas marítimos puede producir hipernutrificación, y posibles floraciones de fitoplancton. Los peces criados pueden morir por floraciones de algas provocadas por un repentino deterioro de la calidad del agua (asfixia debida a daños en las branquias y/o a la falta de oxígeno), tras el desplome y la descomposición de una floración. Especialmente la cría de bivalvos se enfrenta a problemas graves relacionados con la presencia creciente de floraciones tóxicas de fitoplancton debidas a un número relativamente pequeño de especies de algas que producen una serie de toxinas, cuyos efectos incluyen la muerte de las poblaciones cultivadas, así como la enfermedad e incluso, la muerte en el hombre tras el consumo de moluscos contaminados (Shumway, 1990, 1989).
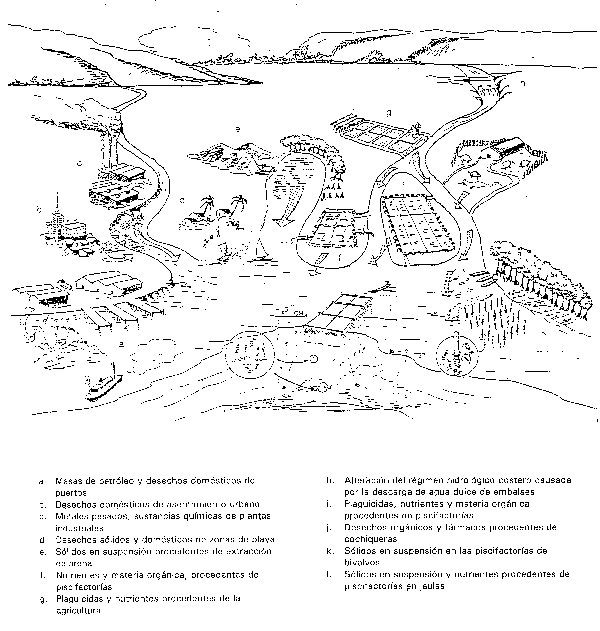
Figura 7: Varias fuentes de contaminación en zonas costeras (tomado de Chua et al., 1989).
3.4 Repercusiones sociales del desarrollo de la acuicultura costera
73. El impacto medioambiental de y en la acuicultura costera puede tener graves repercusiones socioeconómicas y para la salud humana (Huss, 1991; Bernoth, 1991a).
74. Es preocupante que la conversión a gran escala de manglares en piscifactorías de camarones y peces en paises de América Latina y Asia ha afectado a las comunidades rurales dependientes tradicionalmente de los recursos del manglar para su sustento (Chua, en prensa; Mena Millar, 1989; Nath Roy, 1984). Según Bailey (1988), “la extensión del cultivo maritimo del camarón a un hábitat de manglares supone generalmente la transformación de un recurso costero de múltiple utilización y de diferentes usuarios en un recurso de propiedad privada y con un único objetivo. Además, el costo social de la desarticulación del ecosistema costero puede incluir la erosión de la costa, la irrupción de agua salada en las aguas freáticas y en los terrenos agrícolas, y una reducción en el suministro de una amplia gama de alimentos valiosos y de servicios producidos por los recursos disponibles en los bosques de manglares u otros terrenos húmedos costeros”.
75. Asimismo, Smith y Pestano-Smith (1985) afirman que empresas acuícolas a gran escala desplazan frecuentemente a los pescadores y a los piscicultores en pequeña escala. Desgraciadamente, la competencia por los recursos de la tierra y del agua provoca también conflictos por el uso (Shang, 1990; Stansell, 1992), a veces con resultado de violencia, como se ha podido ver entre los cultivadores de camarón y de arroz en Tailandia (New, 1991).
76. Algunos desastres económicos debidos a pérdidas importantes en la producción acuícola se han atribuido a la auto-contaminación, así como a la creciente contaminación de las aguas costeras, que dio pábulo a epidemias y a nocivas floraciones de fitoplancton (Rosenberry, 1990; Chua, en prensa; New, 1990a; Okaichi, 1991; Maclean, 1991).
77. El consumo de mariscos crudos o poco cocidos criados en aguas costeras con fuerte carga de materia orgánica y microbios procedentes de efluentes residuales urbanos pueden provocar graves consecuencias para la salud, como trastornos gastrointestinales, gastroenteritis, hepatitis infecciosa, cólera y fiebres tifoideas (Shuval, 1986). La contaminación por metales pesados, procedentes fundamentalmente de vertidos industriales, supone el riesgo de contaminación del marisco y de envenenamiento humano como ocurrió en la bahía de Minamata, en Japón, con efluentes industriales que contenían metilmercurio (Piotrowski e Inskip, 1981; Huss, 1988). Diferentes formas de envenenamiento humano por mariscos como el envenenamiento paralítico por mariscos, envenenamiento neurotóxico por mariscos, envenenamiento diarreico por mariscos y envenenamiento amnésico por mariscos, se dan en todo el mundo a causa del consumo de crustáceos que acumulan ficotoxinas procedentes de floraciones tóxicas de algas. Los efectos del envenenamiento incluyen trastornos gastrointestinales, parálisis respiratoria, pérdida de memoria y muerte (OMS, 1984).
78. En resumen, las posibles consecuencias negativas de degradación ecológica que afecta directa o indirectamente a las condiciones socioeconómicas del medio ambiente de la acuicultura costera, serían las siguientes:
- descenso de calidad y cantidad en el pescado tanto cultivado como capturado,
- aumento de los riesgos para la salud humana y reducción del nivel nutritivo,
- pérdida de confianza del consumidor y disminución de la comerciabilidad del pescado en los medios locales, nacionales e internacionales,
- conflictos crecientes entre usuarios de los recursos y aumento de la competencia para mercados y créditos,
- disminución y fracasos (colapso) de las empresas acuícolas y/u otras prácticas pesqueras (por ejemplo, pesquerías artesanas) incluyendo el sector poscosecha, y
- disgregación social en el medio rural como consecuencia de:
- cambios en las actividades agrícolas, silvícolas y pesqueras, basadas en la comunidad tradicional:
- disminución de las oportunidades de empleo; cambios hacia trabajos no cualificados y temporeros;
- marginación de los residentes usuarios y no usuarios de los recursos, debida a los cambios crecientes en la distribución de la renta;
- emigración hacia centros urbanos.