REFERENCES
Burd, A. 1978. Long-term changes in North Sea Herring Stocks. Rapp.P.-v.Réun.Cons.int.Explor. Mer. 172: 137–153.
DeVries, D.S. and W.G. Pearcy. 1982. Fish debris in sediments of the upwelling zone off Central Peru: a late Quaternary record. Deep-Sea Res. 28(1A):87–109.
Frogner, E. 1948. Means and extremes of sea temperature by the Norwegian coast. Geofys. Publ. 15(3):82 p.
Höglund, H. 1972. On the Bohuslän herring during the great herring fishery period in the eighteenth century. Inst.Mar.Res. Lysekil, Ser.Biol. (20): 86 p.
Höglund, H.. 1976. Bohusläns sillperioder. Medd. Havsfiskelaboratoriet, Lysekil. No. 207. 43 pp.
Höglund, H. 1978. Long-term variations in the Swedish herring fishery off Bohuslän and their relation to North Sea herring. Rapp. P.-v.Réun. Cons.int.Explor.Mer. 172:175–186.
Holmberg, A. 1963. Perioden 1550–1880. pp. 149–353. In Bohusläns Historia (Erik Lönnroth, ed.). Uppsala, Stockholm/Göteborg.
Lamb, H. 1973. Whither climate now. Nature, Lond. 244 (54/6):395–397.
Lindquist, A. 1964. Zur Fischereihydrographie der Sprotte (Clupea sprattus) an der schwedischen Westküste. Inst.Mar.Res.Lysekil, Ser.Biol. Rep.15, 87p.
Lindquist, A. 1968. Meristic and morphometric characters, year-classes and “races” of the sprat (Sprattus sprattus). Inst.Mar.Res. Lysekil.Ser.Biol.Rep.17. 14 p.
Lindquist, A. 1978. A century of observations on sprat in the Skagerrak and the Kattegat. Rapp. P.-v.Réun,Cons.int.Explor.Mer. 172: 187–196.
Ljungman, A.V. 1879. Bidrag till lösningen of fragan om de stora sillfiskenas sekulära periodicitet. Nord.Tidskr.f. Fiskeri: 257–268.
Soutar, A. and J.D. Isaacs. 1974. Abundance of pelagic fish during the 19th and 20th centuries as recorded in anaerobic sediment of the Californias. Fish.Bull.U.S. 72: 257–273.
by
1International Center for Living Aquatic Resources
Resources Management (ICLARM)
MCC P.O. Box 1501
Makati, Metro Manila
Philippines
2Institute of Fisheries Development and Research
College of Fisheries
University of the Philippines in the Visayas
Diliman, Quezon City
Philippines
* ICLARM Contribution No. 136
Resumen
Se han estudiado en detalle los patrones del reclutamiento de 112 stocks de peces teleósteos de Filipinas, los cuales provienen de 23 familias, 34 géneros y 57 especies. El patrón de reclutamiento anual generalmente muestra una estructura bimodal con dos picos de fuerza diferente, separados por cuatro y ocho meses. Los estimados del reclutamiento fueron obtenidos por una proyección hacia atrás de los datos de frecuencia de longitudes, basándose en datos de 900 mil medidas de longitud realizadas entre 1958 y 1981.
Se muestra que esta periodicidad corresponde al patrón estacional del viento de los monzones en las Filipinas.
INTRODUCTION
Elucidating the factors which determine between year fluctuations in recruitment is one of the major tasks presently facing fisheries research (Bakun et al., 1982) However, faced with the problem caused by a scarcity of data points, a number of workers have chosen to investigate within year fluctuations of recruitment in an attempt to identify factors which may affect reproductive success (see Johannes, 1978 for a review).
This paper is an investigation of the seasonality of recruitment of Philippine fishes based on the detailed analysis of a large body of length-frequency data using the computer programs ELEFAN I and II (Pauly and David, 1981; Pauly, 1982).
Pending a more detailed analysis, which will include a set of climatological and hydrological data, the general features of the recruitment patterns of Philippine fishes are presented here to allow comparisons with data obtained from areas with oceanographic and climatological regimes different from that of the Philippines.
The data presented here also allow for comparisons with inferences drawn earlier by other authors on the spawning and recruitment seasons of Philippine fishes. Concerning these earlier studies, it must be mentioned, however, that the conceptual difference between a spawning and a recruitment season had generally not been made, i.e., studies on gonadal maturation stages and analyses of length-frequency data were both used in inferences regarding “spawning seasons”. In the present study, we report only on the periodicity of recruitment.
MATERIAL AND METHODS
The materials used for this paper consist of length-frequency data sets from approximately 0.9 million fish, collected by individual researchers and the staff of several agencies (foremost, the Bureau of Fisheries and Aquatic Resources) from 1958 to 1981 at various locations throughout the Philippines (Fig. 1). The data cover 112 stocks of teleostean fishes, ranging in size from gobies to tuna and covering 23 families, 34 genera and 57 species (Table 1). These raw data and their sources are fully documented in Ingles and Pauly (1982) and detailed analyses are given in Ingles and Pauly (in press).
Each length-frequency data set was analyzed in terms of growth using the ELEFAN I program of Pauly and David (1981). Applications of this method have been presented in a number of papers (Pauly and David, 1981; Pauly and Ingles, 1981; Pauly and Tsukayama, this volume) and the reader is referred to these for details on the method. The growth parameters L? and K of the von Bertalanffy Growth Function (VBGF) extracted from the length-frequency data described above are given in Ingles and Pauly (1982).
Once growth parameters pertaining to a given stock have been extracted, they can be used to project the data backward onto the time axis such that the pattern of recruitment which generated the structure of the length-frequency data set can be reconstructed (Fig. 2). A computer program named ELEFAN II (Electronic LEngth Frequency ANalysis) which has the computation of recruitment pattern as one of its major routines (Pauly, 1982) was used for this purpose.
Recruitment patterns, as defined and computed by ELEFAN II have the following features:
a) Their exact position on the time axis is known only when to, the third parameter of the VBGF, is known. Since length-frequency data alone do not allow the estimation of to, the abscissa of recruitment patterns is not fixed in real time, and is therefore labelled “1 year” (see Fig. 2).
b) They always include one month with zero recruitment. This is due to the fact that when the projections of the length-frequency data onto the time axis is completed, the lowest of their 12 monthly values of apparent recruitment is subtracted from each of the 12 monthly values; this is done to reduce the “noise” due to fish having grown in a fashion different from that predicted by the growth parameters used (see Fig. 2).
| # | Stock identification Species | % in smaller of two recruitment pulsesb | Smaller time between two recruitment pulses (mo)c | Sample size |
|---|---|---|---|---|
| 1 | Sardinella fimbriata |
43.7 | 5.1 | 1253 |
| 2 | Sardinella fimbriata |
26.0 | 4.3 | 166 |
| 3 | Sardinella longiceps |
30.8 | 4.6 | 1870 |
| 4 | Sardinella longiceps |
- | - | 6191 |
| 5 | Sardinella melanura |
28.3 | 3.0 | 794 |
| 6 | Sardinella sirm |
- | - | 211 |
| 7 | Stolephorus commersonii |
8.3 | 3.4 | 9422 |
| 8 | Stolephorus heterolobus |
19.5 | 5.4 | 2087 |
| 9 | Stolephorus heterolobus |
8.9 | 4.3 | 2345 |
| 10 | Stolephorus indicus |
37.7 | 2.7 | 3402 |
| 11 | Stolephorus indicus |
- | - | 6514 |
| 12 | Stolephorus zollingeri |
6.5 | 4.3 | 29388 |
| 13 | Stolephorus zollingeri |
28.0 | 3.3 | 40864 |
| 14 | Stolephorus zollingeri |
10.6 | 4.2 | 6029 |
| 15 | Saurida tumbil |
18.0 | 4.7 | 4174 |
| 16 | Saurida tumbil |
21.5 | 5.4 | 589 |
| 17 | Saurida undosquamis |
- | - | 26262 |
| 18 | Hemirhamphus georgii |
35.3 | 3.3 | 5098 |
| 19 | Ambassis gymnocephalus |
17.4 | 6.7 | 1477 |
| 20 | Epinephelus sexfasciatus |
32.1 | 4.5 | 738 |
| 21 | Therapon plumbeus |
31.8 | 4.3 | 1588 |
| 22 | Therapon theraps |
30.7 | 2.4 | 2014 |
| 23 | Priacanthus tayenus |
33.7 | 5.4 | 3672 |
| 24 | Sillago sihama |
13.7 | 2.8 | 4652 |
| 25 | Decapterus macrosoma |
33.3 | 5.8 | 3349 |
| 26 | Decapterus macrosoma |
9.0 | 3.5 | 9781 |
| 27 | Decapterus macrosoma |
28.2 | 2.7 | 4075 |
| 28 | Decapterus macrosoma |
75.2 | 3.2 | 25021 |
| 29 | Decapterus macrosoma |
26.9 | 1.8 | 13528 |
| 30 | Decapterus macrosoma |
10.9 | 2.2 | 34836 |
| 31 | Decapterus macrosoma |
11.2 | 2.8 | 8108 |
| 32 | Decapterus macrosoma |
5.3 | 5.8 | 625 |
| 33 | Decapterus macrosoma |
0.8 | 3.5 | 1949 |
| 34 | Decapterus macrosoma |
2.9 | 3.9 | 3079 |
| 35 | Decapterus macrosoma |
16.5 | 4.8 | 339 |
| 36 | Decapterus macrosoma |
35.5 | 3.0 | 16919 |
| 37 | Decapterus macrosoma |
3.0 | 4.5 | 11985 |
| 38 | Decapterus russelli |
6.0 | 4.1 | 13462 |
| 39 | Decapterus russelli |
5.8 | 4.4 | 7026 |
| 40 | Decapterus russelli |
5.9 | 4.2 | 11091 |
| 41 | Decapterus russelli |
2.0 | 4.1 | 7092 |
| 42 | Decapterus russelli |
14.7 | 3.8 | 9116 |
| 43 | Elagatis bipinnulatus |
- | - | 128 |
| 44 | Selar crumenopthalmus |
17.8 | 5.3 | 2287 |
| 45 | Selaroides leptolepis |
20.8 | 5.0 | 4440 |
| 46 | Selaroides leptolepis |
13.3 | 4.1 | 1389 |
| 47 | Mene maculata |
1.2 | 5.1 | 2160 |
| 48 | Gazza minuta |
34.1 | 4.9 | 854 |
| 49 | Gazza minuta |
14.8 | 3.4 | 511 |
| 50 | Leiognathus bindus |
16.1 | 4.7 | 6286 |
| 51 | Leiognathus bindus |
31.6 | 4.8 | 2074 |
| 52 | Leiognathus bindus |
1.7 | 4.0 | 1002 |
| 53 | Leiognathus blochii |
5.6 | 5.3 | 615 |
| 54 | Leiognathus blochii |
16.8 | 4.3 | 1401 |
| 55 | Leiognathus blochii |
48.2 | 2.8 | 931 |
| 56 | Leiognathus blochii |
20.6 | 3.6 | 936 |
| 57 | Leiognathus brevirostris |
28.7 | 4.3 | 29669 |
| 58 | Leiognathus daura |
- | - | 4074 |
| 59 | Leiognathus daura |
3.7 | 5.2 | 6140 |
| 60 | Leiognathus daura |
3.7 | 4.1 | 1301 |
| 61 | Leiognathus equulus |
45.4 | 5.0 | 9660 |
| 62 | Leiognathus leuciscus |
18.7 | 4.0 | 1754 |
| 63 | Leiognathus leuciscus |
- | - | 1872 |
| 64 | Leiognathus lineolatus |
3.4 | 4.5 | 1530 |
| 65 | Leiognathus lineolatus |
3.3 | 3.3 | 3326 |
| 66 | Leiognathus lineolatus |
5.0 | 3.6 | 1685 |
| 67 | Leiognathus splendens |
7.3 | 4.9 | 58090 |
| 68 | Leiognathus splendens |
17.6 | 2.9 | 67005 |
| 69 | Leiognathus splendens |
1.5 | 4.1 | 33879 |
| 70 | Leiognathus splendens |
7.6 | 5.3 | 95253 |
| 71 | Secutor insidiator |
38.2 | 3.9 | 3835 |
| 72 | Secutor insidiator |
- | - | 1253 |
| 73 | Secutor insidiator |
- | - | 181 |
| 74 | Secutor ruconius |
18.7 | 5.0 | 38051 |
| 75 | Secutor ruconius |
34.8 | 3.3 | 10217 |
| 76 | Secutor ruconius |
6.5 | 4.3 | 1820 |
| 77 | Nemipterus japonicus |
37.4 | 4.7 | 3665 |
| 78 | Nemipterus nematophorus |
29.2 | 3.6 | 1290 |
| 79 | Nemipterus nematophorus |
10.5 | 4.2 | 1477 |
| 80 | Nemipterus ovenii |
35.3 | 4.2 | 3276 |
| 81 | Pentaprion longimanus |
- | - | 6174 |
| 82 | Pentaprion longimanus |
45.3 | 4.6 | 3454 |
| 83 | Pomadasys argyreus |
- | - | 2014 |
| 84 | Pomadasys argyreus |
4.6 | 4.9 | 18476 |
| 85 | Pomadasys argyreus |
25.0 | 3.5 | 15217 |
| 86 | Pomadasys argyreus |
25.3 | 3.2 | 7727 |
| 87 | Dendrophysa russelli |
24.2 | 3.9 | 779 |
| 88 | Otolithes ruber |
49.9 | 3.4 | 1444 |
| 89 | Otolithes ruber |
44.2 | 4.2 | 1629 |
| 90 | Pennahia anea |
28.3 | 3.1 | 4354 |
| 91 | Pennahia macropthalmus |
20.0 | 4.0 | 498 |
| 92 | Upeneus moluccensis |
19.2 | 5.3 | 8594 |
| 93 | Upeneus sulphureus |
30.5 | 4.8 | 48547 |
| 94 | Upeneus sulphureus |
14.6 | 4.0 | 787 |
| 95 | Upeneus vittatus |
10.1 | 5.0 | 3816 |
| 96 | Scatophagus argus |
18.1 | 5.3 | 1977 |
| 97 | Liza subviridis |
44.9 | 4.3 | 6104 |
| 98 | Glossogobius giurus |
16.5 | 2.8 | 2191 |
| 99 | Glossogobius giurus |
16.3 | 3.5 | 1577 |
| 100 | Trichiurus lepturus |
8.5 | 3.6 | 3711 |
| 101 | Trichiurus lepturus |
22.7 | 2.7 | 3128 |
| 102 | Trichiurus lepturus |
19.0 | 4.1 | 11993 |
| 103 | Auxis thazzard |
27.9 | 6.2 | 1518 |
| 104 | Auxis thazzard |
42.4 | 2.5 | 1048 |
| 105 | Katsuwonus pelamis |
7.4 | 3.7 | 1118 |
| 106 | Katsuwonus pelamis |
- | - | 1908 |
| 107 | Rastrelliger brachysoma |
17.8 | 4.2 | 2966 |
| 108 | Rastrelliger brachysoma |
23.3 | 5.5 | 2970 |
| 109 | Rastrelliger kanagurta |
6.9 | 3.1 | 431 |
| 110 | Scomberomorus commerson |
43.2 | 5.6 | 444 |
| 111 | Thunnus albacares |
5.2 | 4.5 | 813 |
| 112 | Cynoglossus puncticeps |
45.3 | 3.6 | 2571 |
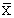 = 20.2% = 20.2% |
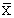 = 4.1 months = 4.1 months |
∑ = 894119 | ||
| S.E. = 1.33% | S.E. = 0.09 month |
aDashes refer to recruitment patterns which could not be separated into two component distributions (see K. pelamis in Fig. 3for an example).
bPercent of recruits in larger pulse = 100 — % in smaller pulse.
cLarger time (in months) between two pulses = 12 — smaller time between two pulses.
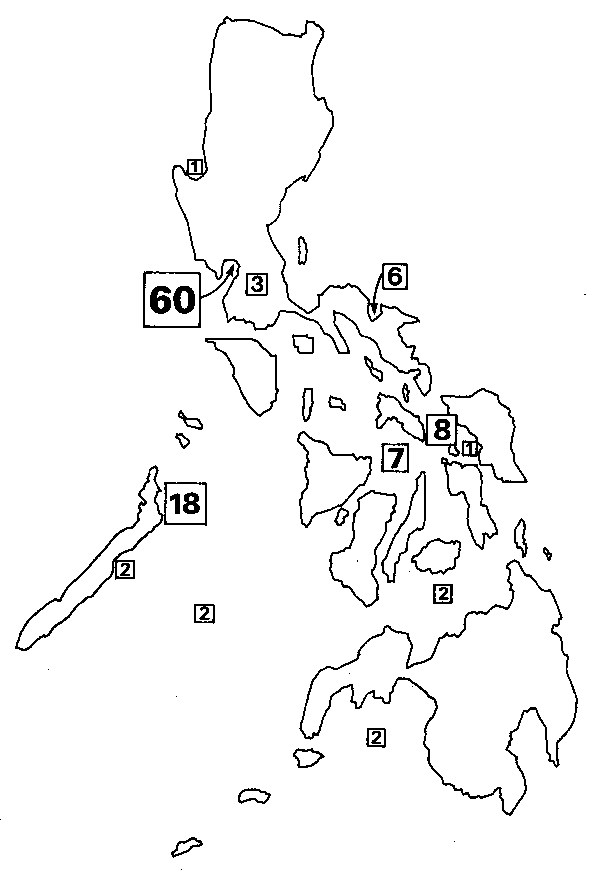
Fig. 1 Sampling location of lenght-frequency data discussed in this paper; the numbers refer to the number of stocks from each locality (total 112, see also Table 1).
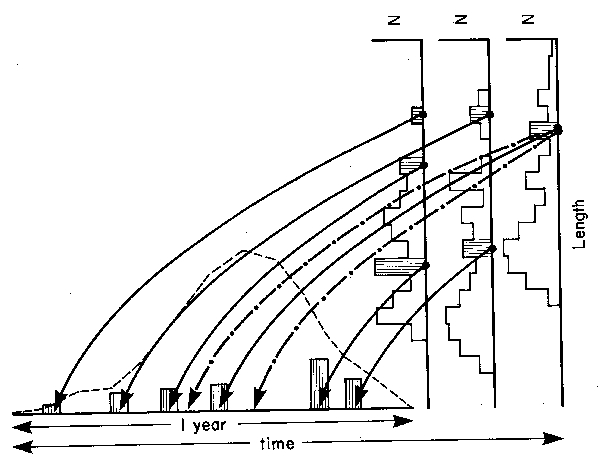
Fig. 2 Schematic representation of method for obtaining recruitment patterns using ELEFAN II. The steps involved are: 1) projection onto the time axis of the frequencies of a set of lenght-frequency data; 2) summation for each month of the frequencies projected onto given months (the dotted line gives the sums achieved for each month after the projection of frequencies suggested by the arrows is completed); 3) subtraction, from each monthly sum of the lowest of the 12 monthly sum, to obtain a zero value where apparent recruitment was lowest; 4) output of monthly apparent recruitment, in % of annual recruitment. The projection of only a few (shaded) frequencies is shown here. In reality, all frequencies are projected, resulting eventually in the superimposed recruitment pattern (dashed line). Note “blurring” effect of individual growth curves (-•-•-) differing from the mean growth curve of the stock (solid lines; also note that t0 is here assumed equal to zero, see text). (Adapted from Pauly et al., 1981).
Pauly (1982) showed how recruitment patterns, as obtained from ELEFAN II, can be used to objectively distinguish fish with one marked recruitment season from fish with two such seasons per year.
In this paper, we have carried this analysis one step further, and used the NORMSEP program of Abrahamson (1971)* to separate the recruitment patterns into normally distributed components. This analysis provided the following information for each recruitment pattern:
- number of normally distributed component distributions (number of recruitment pulses per year)
- standard deviation (s.d.) of each component distribution (the s.d. is proportional to the duration of a recruitment pulse)
- time (in months) separating different recruitment pulses
- proportion of recruits in the component distributions.
Fig. 3 gives examples of recruitment patterns separated into their component distributions.
RESULTS
Of the 112 recruitment patterns examined, only 12 did not consist of two major components (Table 1). The 100 recruitment patterns which separated readily into two component distributions had maxima which were, on the average 4.1 and 7.9 months apart. On the average, the major recruitment pulse of these 100 recruitment patterns contained 80% of the annual recruitment, while the minor pulse contained the remaining 20%.
In the case of five groups of fish, the results obtained here can be compared with inferences on recruitment and spawning seasons drawn earlier by other authors from analyses of length—frequency data (inference on recruitment) and studies of gonadal maturation stages (inferences on spawning). These five groups are as follows:
- Stolephorus spp.: Tiews et al. (1975b) concluded the following on the spawning of anchovies: “although S. heterolobus […] breeds throughout the year, a peak spawning was noted during the northeast monsoon season (October to March) […]. This can be distinguished from a period of little or no spawning activity from April to July. The findings for S. bucaneeri are similar […]. However, it is probable that the spawning time begins earlier in June and does not extend to February. No spawning was observed in March, April and May.” In the case of S. indicus, Tiews et al. (1975b) suggest that it spawns and recruits over the major part of the year.
Our results, on the other hand, showed that recruitment of the stolephorid anchovies, conform to the typical bimodal pattern presented above (see Table 1).
- Saurida tumbil (Synodontidae): Tiews et al. (1972) found that “the S. tumbil population in Manila Bay and adjacent waters had a protracted breeding period and spawns two or even three times a year in a quite irregular manner.” Our results, based on data from the Visayan Sea and from Manila Bay, show that S. tumbil recruits twice a year (Table 1).
*The version of NORMSEP we used is a translation into BASIC of the (FORTRAN) original; it was prepared by Mr. N> David. The program which was run on a Radio Shack TRS 80 Model I I I microcomputer is available from D. Pauly, ICLARM.
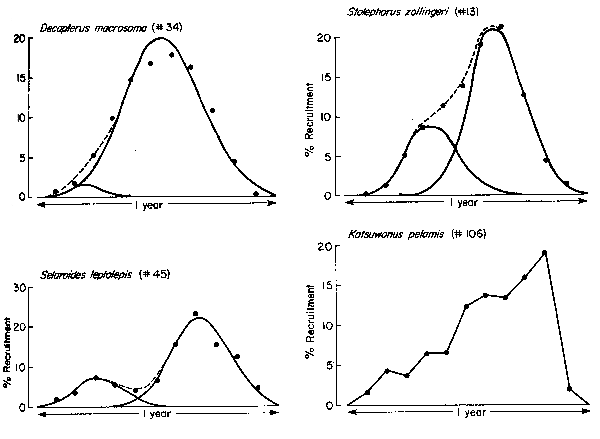
Fig. 3 Examples of recruitment patterns separated into their component distributions (dotted line obtained by combining two normal distributions). Note difficulty in deciding in cases such as that of D. macrosoma whether there are one or two recruitment pulses; also note good separations in two other cases, one with wide overlap (S. zollingeri), the other with little overlap (S. leptolepis). Last case (K. pelamis) is that of a stock where separation into a small number of components is not feasible. More details on 3 of these 4 cases are given in Table 1.
- Decapterus spp. (D. macrosoma and D. russelli): Tiews et al. (1975a) “concluded that the breeding period of both species extends from November to March in Palawan Waters [and that] spawning time seemed to be delayed by 1–2 months, thus extending to April and May.”
Our results suggest either one single, protracted recruitment season or two recruitment seasons, one much shorter than the other (Table 1).
- Rastrelliger brachysoma: Tan (1970) concluded that “spawning occurs from June to February” in Manila Bay. Our analysis of length—frequency data on this fish, collected in the Samar Sea, suggests that R. brachysoma is recruited twice a year, and follows the general pattern outlined above.
DISCUSSION
Although it is generally agreed that the spawning seasons of tropical fishes are generally longer than those of their temperate counterparts (Johannes, 1978), the demonstration is lacking that this also generally applies to their recruitment seasons, Thus, it could be that the eggs produced during a long spawning season generally encounter a “survival window” (Bakun et al., 1982) that is open during a short period only, resulting in sharply peaked recruitment pulses (Munro, in press).
This problem cannot be resolved at present because recruitment patterns (as defined here) from temperate fishes are not available for comparison. The data at hand allow, however, for the generalization that Philippine neritic fishes have pulses of recruitment twice a year - as opposed to their temperate counterparts which generally recruit once a year.
The two recruitment pulses that seem to be typical of Philippine fishes are of unequal strength, and their asymmetry is emphasized by the feature that, rather than dividing the year in two equal halves of 6 months each, the two recruitment pulses divide the year into two periods of unequal duration of about 4 and 8 months. This periodicity is close to the 5- and 7-month rhythm of the monsoon winds which, in the Philippines, blow from the northeast from September to March with peaks from November to January (northeast monsoon), then blow from the southwest from April to August with peaks in May–June (southwest monsoon) (Dickerson, 1928, p. 39).
This study thus supports the hypothesis of a relationship between spawning/recruitment patterns and monsoon winds, as suggested by Weber (1976) and Johannes (1978) for various areas of the tropical Indo-Pacific, including the Phillippines.
Winds generally determine the extent of both horizontal advection and therefore upwelling events and vertical instability, which, as hypothesized in Bakun and Parrish (1981), may have crucial effects on the survival of fish larvae (see also Bakun et al., 1982).
Highly aggregated data such as those presented here do not allow testing of these and related hypotheses directly. However, the generalization presented here that the recruitment patterns of Philippine fishes match the monsoon wind patterns can be tested on a finer scale. We plan to compare single recruitment patterns pertaining to a given stock in a given year and place with the wind patterns (and the patterns of wind—driven phenomena such as upwellings and turbulence) prevailing when and where recruitment occurred. These tests may help establish in more detail the link between wind—driven oceanographic phenomena and increased larval survival in tropical areas such as the Philippines.
REFERENCES
Abrahamson, N.J. 1971. Computer programs for fish stock assessment. FAO Fish.Tech.Rep. (101): pag. var.
Bakun, A. and R.H. Parrish. 1981. Environmental inputs to fishery population models for eastern boundary current regions. pp. 67–104. In Workshop on the effect of environmental variation on the survival of larval pelagic fishes (G.D. Sharp, ed.). IOC Workshop Report No.28. UNESCO, Paris. 323 p.
Bakun, A., J. Bayer, D. Pauly, J.G. Pope and G.D. Sharp. 1982. Ocean science in relation to living resources. Can.J.Fish.Aquat.Sci. 39(7):1059–1070.
Dickerson, R.E. 1928. Distribution of life in the Philippines. Bur.Sci.Monogr. (Philippines) No.21. 222 p. + plates.
Ingles, J. and D. Pauly. 1982. Raw data and intermediate results for an atlas of the growth, mortality and recruitment of Philippine fishes. i–xv + 224 p. (mimeo).
Ingles, J. and D. Pauly. (In press). An atlas of the growth, mortality and recruitment of Philippine fishes. ICLARM Tech.Rep.
Johannes, R.E. 1978. Reproductive strategies of coastal marine fishes in the tropics. Env.Biol.Fish 3:65–84.
Munro, J.L. (In press). Some advances and developments in coral reef fisheries research. Proc.Gulf Caribb.Fish.Inst. 35.
Pauly, D. 1982. Studying single species in a multispecies context. pp. 33–70. In Theory and management of tropical fisheries (D. Pauly and G.I. Murphy, eds). ICLARM Conference Proceedings 9, Manila, Philippines. 360 p.
Pauly, D. and N. David. 1981. ELEFAN I, a BASIC program for the objective extraction of growth parameters from length-frequency data. Meeresforsch. 28(4):205–211.
Pauly, D. and J. Ingles. 1981. Aspects of the growth and mortality of exploited coral reef fishes. pp. 81–98. In Proceedings of the Fourth International Coral Reef Symposium, Manila, Philippines (E. Gomez, C.E. Birkeland, R.W. Buddemeyer, R.E. Johannes, J.A. Marsh, Jr. and R.T. Tsuda, eds). Vol.1.
Pauly, D., N. David and J. Ingles. 1982. ELEFAN II: User's instruction and program listings. Mimeo, pag.var.
Tan, E.O. 1970. Notes on the biology of chub mackerel Rastrelliger brachysoma (Bleeker), in Manila Bay. pp. 479–480. In The Kuroshio, A Symposium of the Japan Current (J.C. Marr, ed.). East- West Center Press, Honolulu. 614 p.
Tiews, K. and P. Caces-Borja. 1965. On the availability of fish of the family Leiognathidae Lacépède in Manila Bay and San Miguel Bay on their accessibility to controversial fishing gears. Philipp.J.Fish. 7:59–86.
Tiews, K., A.N. Mines and I.A. Ronquillo. 1972. On the biology of Saurida tumbil (Block 1801) Family Synodontidae in Philippine waters. Proc.Indo—Pac.Fish.Counc. 13(3):100–120.
Tiews, K., I.A. Ronquillo and P. Caces–Borja. 1975a. On the biology of roundscads (Decapterus Bleeker) in Philippine waters. Philipp.J.Fish. 9:45–71.
Tiews, K., I.A. Ronquillo and L.M. Santos. 1975b. On the biology of anchovies (Stolephorus Lacépède) in Philippine waters. Philipp.J.Fish. 9:92–123.
Weber, W. 1976. The influence of hydrographical factors on the spawning time of tropical fish. pp. 269–281. In Fisheries resources and their management in Southeast Asia (K. Tiews, ed.). West Berlin. 522 p.
por
Haydee Santander
y
Roberto Flores
Instituto del Mar del Perú
Apartado 22
Callao - PERU
Summary
The temporal-spatial variations and interactions with spawning and larval distribution of the anchoveta (Engraulis ringens); sardine (Sardinops sagax sagax); jack mackerel (Trachurus murphyi); and mackerel (Scomber japonicus peruanus) are analysed in relation with environmental conditions as expressed by thermal and salinity structure, coastal upwelling and superficial currents from 1964–1982.
Representative data from this period are included, particularly on the prinicipal spawning and larval abundance areas for these species, for selected areas which emphasize the El Niño periods of 1965, 1972–73, and 1976–77; and also the anti—El Niño periods of 1964, 1967, and 1970–71.
INTRODUCCION
Las especies de peces pelágicos, particularmente los Cupleidae, sufren grandes fluctuaciones en la abundancia de sus poblaciones, motivadas por la alta variabilidad del reclutamiento. Entre las causas atribuibles estan la intensidad del desove y sobrevivencia de sus huevos y larvas, las que a su vez parecen ser influenciadas por la oportunidad en la occurrencia del desove en espacio y tiempo. Es indudable que el alimento es fundamental para la sobrevivencia de las larvas, asi como las condiciones ambientales que determinan la secuencia de los diferentes tipos de alimento apropiado para cada etapa de vida hasta recluta.
Los resultados de Ware et al. (1980) sugieren que las larvas de anchoveta Engraulis ringens requieren de fitoplancton solamente en la primera semana de vida, mientras que en la transicion a la fase de crecimiento necesitan de mayor habilidad para hallar su ración adecuada de zooplancton. Lo que significa que la época y área del desove de estos peces juega un papel fundamental en la sobrevivencia de estas fases. Por lo tanto, de todo el rango de la distribución de las especies, las áreas de desove seleccionadas a través del tiempo, deben proveer las condiciones más apropiadas para la crianza.
En esta contribución se presentan resultados del análisis de los desoves y/o distribución larval de las cuatro principales especies pelágicas frente al Perú: anchoveta (Engraulis ringens) sardina (Sardinops sagax), jurel (Trachurus symmetricus murphyi) y caballa (Scomber japonicus peruanus). Se discute también su relación con algunos procesos ambientales, en particular bajo condiciones denominadas normales y los que presentan anomalías conocidos como años “El Niño”.
CARACTERISTICAS DE LOS DESOVES Y DISTRIBUCION DE LARVAS
Anchoveta
El desove de la anchoveta se extiende en casi toda la costa del Perú, desde Cabo Blanco (03°30'S) hasta 18°30'S y en Chile hasta la latitud de 25°40'S. Sin embargo, el área más importante por la intensidad y frecuencia de los desoves es la comprendida entre 06°00' y 14°00'S.
Esta área reune condiciones muy peculiares, siendo la más importante la configuración de la plataforma, cuya mayor amplitud se presenta entre 7° y 10°S.
La línea costera entre 6° y 14°S tiene una orientación SSE (150°), que resulta casi paralela a la dirección predominante de los vientos alisios del SE. En esta área no se presentan las zonas de gran divergencia tan notables que existen entre Talara y Pta. Falsa (04°30' – 06°00'S) y entre Pisco y San Juan (14° – 15°S). Los remolinos frecuentes se registran principalmente al norte de 7°, entre 6° y 7°S y al sur de 12°, entre 12° y 14°S.
Los vientos en toda la costa son más fuertes en Invierno y más débiles en Verano. Particularmente frente a Chimbote (9°S) son más estables, siendo promedio de 4.6m/seg. Las áreas de afloramiento que varían ligeramente de posición cada año y se ubican principalmente entre 7°, 8°, 9°, 10°, 11° y 12°S, donde los procesos son sostenidos y no de gran intensidad.
En el período de enfriamiento, el afloramiento se intensifica y se desplaza hacia el norte, ampliándose latitudinalmente.
Según Guillén y Calienes (1981), las aguas afloradas de Chimbote provienen de una extension de la Corriente de Cronwell durante la mayor parte del año, principalmente en Otoño e Invierno, y están caracterizadas por un mayor contenido de oxígeno. El ancho promedio de la zona de afloramiento es de 60 km., similar al de Paita (05°00'S) y San Juan (15°S) (Zuta et al., 1978) y su profundidad es mayor que frente a Callao y San Juan en invierno (Tabla No 1).
| Area | Isopycnas (ót) | Profundidad de afloramiento (m) | Vientos Promedio (m/s) | Mes | Velocidad (cm/s) | Período de enfriamiento |
|---|---|---|---|---|---|---|
| Paita:(1) | ||||||
Otoño | 25.3–25.5 | 50 | 4.9(7) | Mayo | 4.6×10-4 | Abril–Agosto |
Invierno | 25.8–26.1 | 150 | Septiembre | 2.2×10-3 | (5 mese) | |
| Promedio 100 | From 1.3×10-3 | |||||
| Chimbote: | ||||||
Otoñ | 25.4–25.6 | 50 | 4.6 | Mayo | 3.9×10-4 | Marzo–Octubre |
Invierno | 25.8–26.0 | 120 | Septiembre | 1.5×10-3 | (8 meses) | |
| Promedio 85 | From0.9×10-3 | |||||
| Callao(2) | ||||||
Otoño | 25.5–25.8 | 40 | 3.2(7) | Mayo | 6.0×10-4 | Abril–Septiembre |
Invierno | 25.6–25.9 | 60 | Septimbre | 3.8×-3 | (6 meses) | |
| Promedio 50 | From 2.2×10-3 | |||||
| San Juan:(1) | ||||||
Otoño | 25.6–25.8 | 40 | 4.8(7) | Junio | 2.1×10-3 | Abril–Septiembre |
Invierno | 25.8–26.1 | 70 | Agosto | 4.0×10-3 | (6 meses) | |
| Promedio 55 | From 3.1×10-3 | |||||
| Oregon:(3) | 2–0.5×10-2 | |||||
| Oregon:(4) | 0.2–7.0×10-3 | |||||
| Noroeste Africa:(5) | 10-1 | |||||
| Baja California:(6) | 5.4–7.9×10-3 |
(1) Zuta et al. (1978); (2) Flores (unpublished data) (3) Halpern (1976); (4) Smith, Pattullo, and Lane (1966);(5) Barton, Huyer and Smith (1977); (6) Stevenson (1974); (7) Zuta and Guillén (1970).
En Chimbote, el período de enfriamiento dura 8 meses (marzo—Octubre), siendo mayor que para otras áreas.
Tanto Walsh et al. (1980), Brockman et al. (1980) y Shaffer (1982) coinciden al afirmar que hay una mayor estabilidad del ambiente fisico en el área norte, comparada con el sur (15°S) en terminos de vientos, corrientes y variabillidad terma).
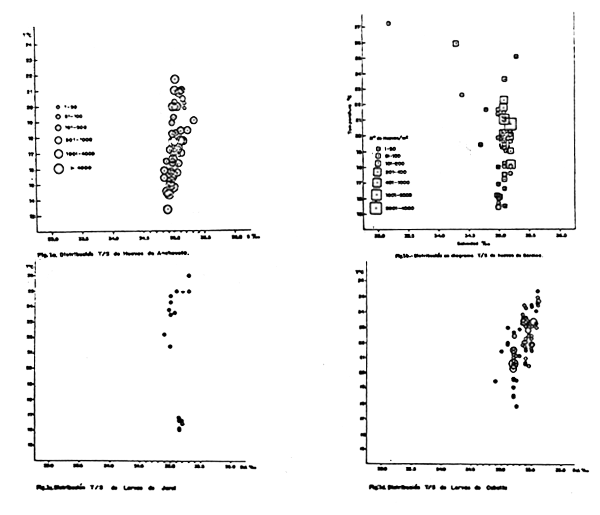
El desove se distribuye principalmente en áreas costeras que corresponden a las Aguas costeras Frías, de salinidades entre 34.9 y 35.0°/00 (Fig. la). La extensión de las áreas de distribución de huevos y crianza de larvas ha variado mucho desde la decada del 60, no solamente por efecto de la reducción que se producía en los últimos años de esta década, sino también por por acción de las anomalías del ambiente, principalmente desde el Fenómeno “El Niñno” 1972–73. Si bien, el efecto de las anomalías ambientales, expresadas en la invasión de las Aguas Ecuatoriales Superficiales (AES) y/o en el avance de las Aguas Subtropicales Superficiales (ASTS) son temporales; cuando ocurren a bajos niveles poblacionales, las consecuencias son más drásticas y más prolongadas.
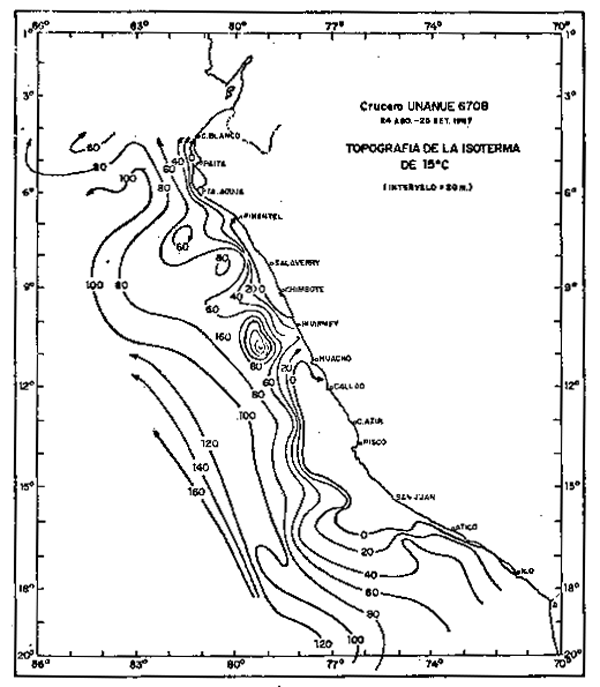
La máxima extensión del desove fue observada en 1966–1967, hasta más allá de 120 millas de la costa, con altas concentraciones mayores a 2000 huevos por metro cuadrado (Fig. 2b). Sin embargo, estas áreas de distribución son en parte el producto de la dinámica del agua. En Agosto de 1967, donde se registró la mayor amplitud del desove, la topografía de 15°C (Fig. 2a) mostró flujos superficiales predominantemente hacia el norte con la presencia de remolinos ciclónicos que influirían en la concentración de los organismos, como fue detectado a través de la distribución del desove.
Las áreas donde se producen los desoves se desoves se ubican actualmente entre 5 y 20 millas de la costa. En Agosto—Septiembre de 1981 se localizaron 18 focos mayores en el momento del desove (Estadío I, recientemente desovados), entre 07°00'S. El 28% de estos focos de desove se presentaron a 8 millas de la costa, 22% a 17 millas, 17% a 5 milas y otro 14% a 14 millas.
 |
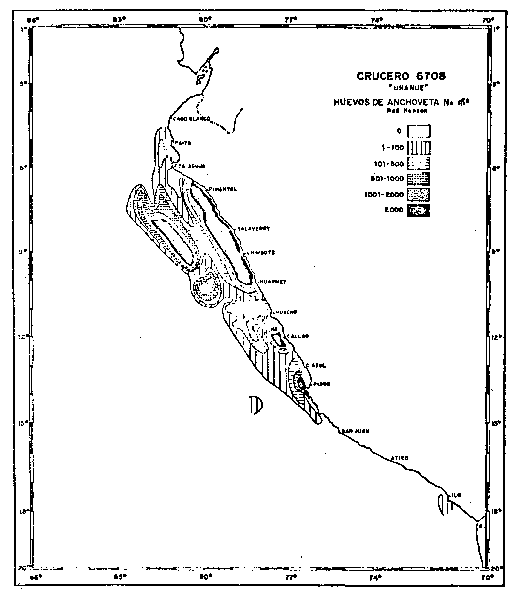 |
| Fig. 2b.- Topografía de la isoterma de 15°C en el Crucero 6708. 24 de Agosto - 25 Septiembre, 1967. | Fig. 2a. - Distribución de huevos de anchoveta. |
Como rasgo común, todos los focos de desove estuvieron ubicados por fuera de los focos de afloramiento. Una de las características observadas a través del tiempo es que las áreas de máxim desove no co—ocurren con los focos de máximo afloramiento y en el sur dnde se encuentra el área más intensa de afloramiento, los desoves son menores (SANTANDER, 1981 b) (Fig. 3). Sin embargo, después de 1972 se han registrado desoves con mayor frecuencia al sur de 14°S.
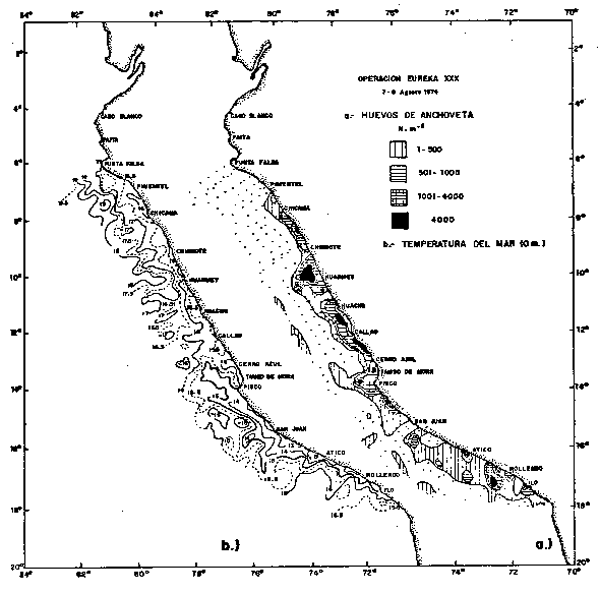
Fig. 3.- Temperatura superficial (°C) en la operación EUREKA XXX. 7/8 Agosto, 1974.
En la Fig. 4 se han graficado los índices de desove (promedio de huevos por estación) para cada 2 grados latitudinales en la época de máximo desove. Se aprecia que en los años de 1965 a 1971, los desoves al sur de 14°S eran muy esporádicos y mayormente limitados al área de 14° a 16°S. En 1972 se experimentaron los efectos del Fenómeno “El Niño” desde Febrero y el patrón de distribución latitudinal cambió por el desplazamiento de los cardúmenes de anchoveta hacia el sur. Consecuentemente ese año los desoves se produjeron principalmente entre 10° y 14°S y al sur de 16°S. En los años siguientes se siguen presentando estos desoves al sur de 14°S, hasta 18°30'S.
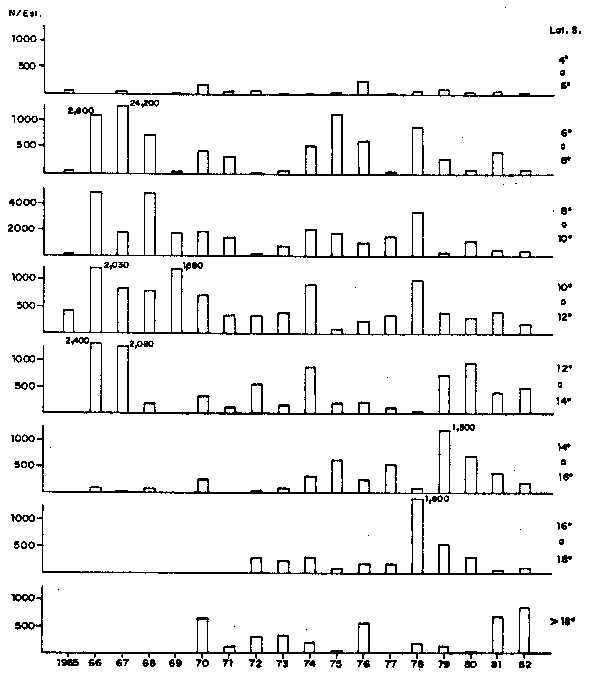
Fig. 4.- Distributión latitudinal del desove de anchoveta en invierno, de 1965 a 1982.
Dos posibles factores parecen haber influido en esta selección de nuevas áreas de desove; inicialmente como un efecto de las condiciones ambientales de 1972–73 y posterior– mente por la alteración de las condiciones ambientales expresadas principalmente por un más frecuente avance de ASTS hacia la costa, en el período de desove. Una consecuencia de esta mayor penetración de las ASTS es la ocurrencia de desoves de sardina en áreas cada vez más próximas a la costa, lo que contribuye a que la sardina se constituya en competi– dor y predador de la anchoveta cuando co—ocurren las áreas de desove y de distribucción larval.
Hasta 1971 se desarrollaba un ciclo de desove típico de Julio a Marzo, con un pico en Septiembre al final de la estación de Invierno. Este patrón estacional tiene una rela– tiva relación con el ciclo de afloramiento: no coinciden sus máximos. En Invierno ocurre el máximo afloramiento, y al final de Invierno el máximo del desove. Sin embargo, si se observa correspondencia entre la secuencia de la producción fitoplanctónica y el zooplanc– ton (Santander, 1974; Mendiola y Ochoa 1980) con el máximo del desove como consecuencia del ciclo de afloramiento.
Sardina
El área de desove de sardina ha experimentado grandes variaciones, tanto en extensión latitudinal como de distancia de la costa, pudiendo diferenciarse que a partir de 1972 se ha registrado una mayor expansión en ambos sentidos (Santander 1981 a).
De 1966 a 1971, los desoves fueron muy pobres y limitados al área norte principalmente (Fig. 5), con las mayores concentraciones en los períodos más cálidos, como en 1969.
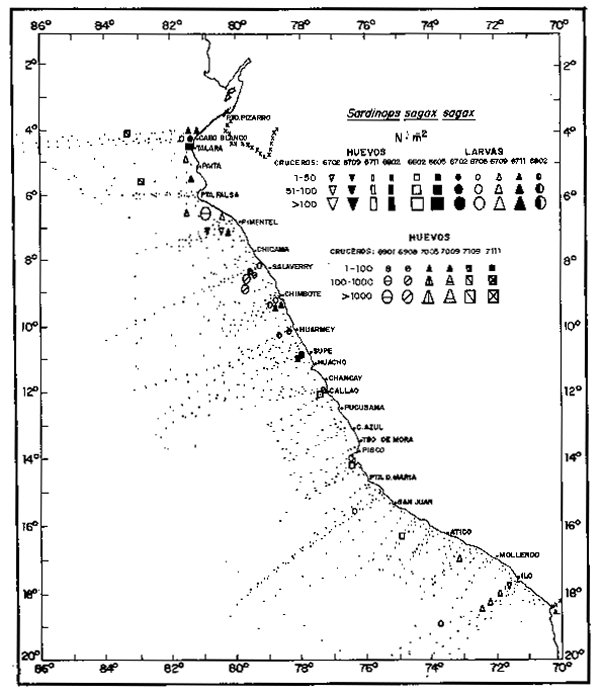
Fig. 5.- Distributión de huevos y larvas de sardina, de 1966 a 1971.
Actualmente, el área de distribución se extiende prácticamente a toda el área frente a la costa, de 03°30' a 18°30'S (Fig. 6). Pero las más frecuentes y mayores concentraciones del desove se dan entre 5° y 12°S. Estas áreas se encuentran cada vez más próximas a la costa, con las mayores concentraciones a 10 ó 20 millas de distancia a la costa, colindante con la anchoveta (Fig. 7). El mayor o menor acercamiento hacia la costa está relacionado con la extensión de las ASTS, con salinidad superior a 35.0°/oo (Fig. 15).
El ciclo de desove incluye 9 meses, de Julio a Marzo y el máximo usualmente se produce a fines de Invierno.
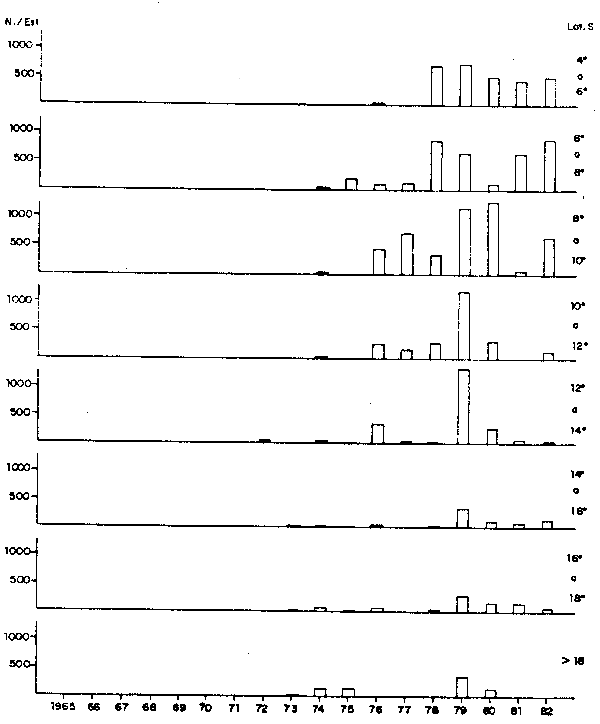
Fig. 6.- Distribución latitudinal del desove de sardina en invierno, de 1965 a 1982.
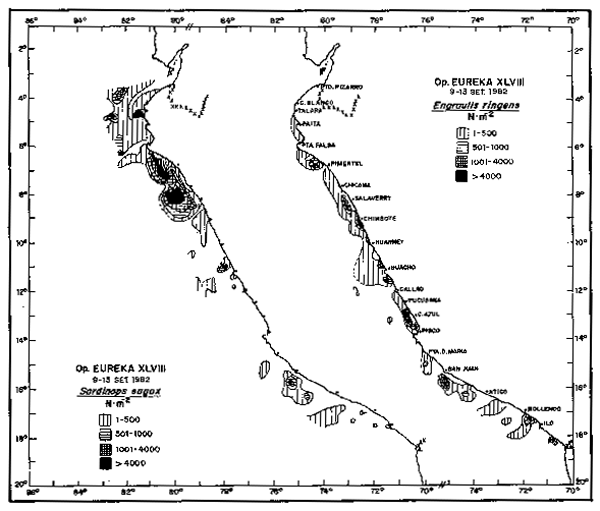
Fig. 7.- Distribución del desove de sardina en la Operación EUREKA XLVIII. 9/13 Septiembre, 1982.
Jurel
La distribución del desove de jurel se ubica principalmente en el área sur, de 16°00' a 18°30'S, aunque se han registrado desoves en diferentes puntos del litoral desde 13°00' hacia el norte, en muy bajas concentraciones. Esta área se extiende a más de 120 millas de la costa.
El área principal de distribución larval, abarca una extención de alrededor de 300 millas de la costa de Mollendo (17°00'S) pero las mayores concentraciones se ubican dentro de 60 millas de la costa (Fig. 8).
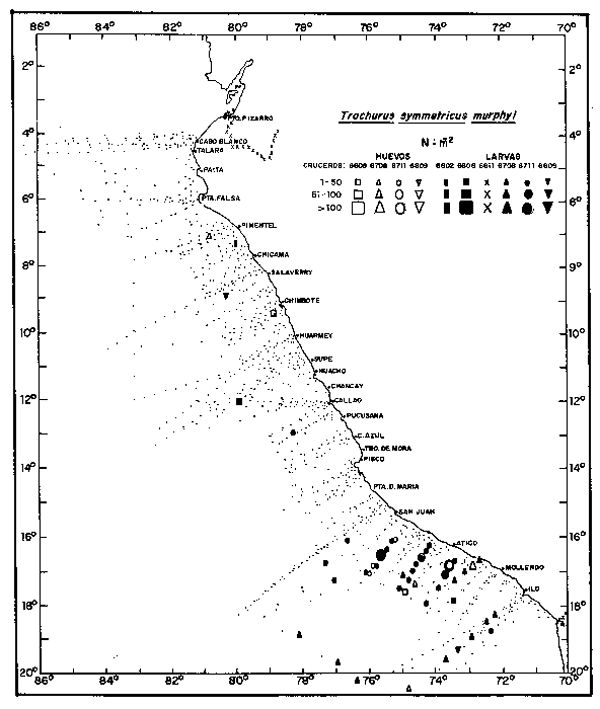
Fig. 8. - Distribución de huevos y larvas de jurel, de 1966 a 1968.
Esta área de distribución está asociada a los bordes de los afloramientos intensos del sur (14° – 16°S), cuyas fuentes principales son las aguas de la sub—antártida (aguas frías y de baja salinidad, ricas en nutrientes), y del frente de estas aguas con las ASTS, con temperaturas mayores a 16°C y salinidades mayores a 35.0°oo en la superficie (Fig. 1c) que dominan las áreas por fuera de las 60 millas de la costa, aproximádose prin– cipalmente en Abril y replegándose por fuera de 90 millas de la costa, en Julio, Agosto y Septiembre principalmente (Fig. 9). En estos meses, estas áreas son ocupadas por aguas de la corriente costera y las afloradas que se presentan mayormente en Septiembre. En el área al sur de 14°S, a diferencia del área norte—central, la plataforma continental es muy angosta; la línea costera tiene una orientación SE (130°) que resulta totalmente pararela a los vientos alisios del SE. Entre Pisco y San Juan (14° – 15°20'S) se presentan zonas de gran divergencia y en Pisco (14°S) son frecuentes los remolinos. Los vientos son de mayor intensidad y persistencia que en las otras áreas de afloramiento, siendo más débiles en marzo y mayo (fines de Verano y Otoño) y más intensos de Junio a Septiembre (Invierno), fluctuando entre 1.3 m/seg (Marzo) y 8.8 m/seg (Junio) con un promedio de 4.8 m/seg (Zuta y Guillén, 1970).
El desove de jurel se produce de Invieno a Verano (Julio Marzo), con una mayor inten– sidad a fines de Invierno en Septiembre.
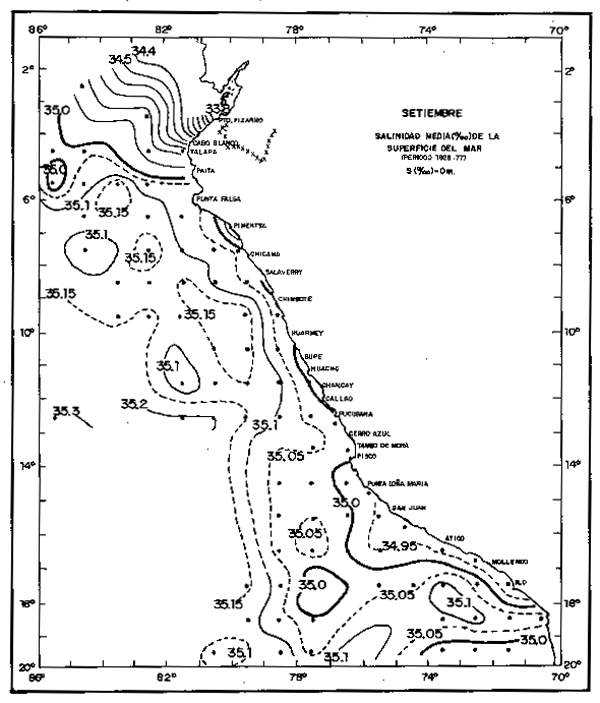
Fig. 9. - Salinidad promedio (0/00) de la superficie del mar en Septembiere. Período 1928–1977. (de Urquizo y Morón, No publicado.
Caballa
El desove de caballa se distribuye en casi toda la costa, de 03°30' a 18°30'S, desde muy cerca de la costa hasta más allá de las 140 millas.
Esta especie desova de Agosto a Marzo, siendo principalmente desovadora de Verano.
En los años 1966 a 1968, el desove se producía en el área norte–central principalmente, de 03°30' a 15°00'S (Fig. 10), y en la período de “E1 Niñ” 1972–73, uno de los grupos del ictioplancton de mayor frecuencia y densidad a lo largo de toda la costa fun el de los Scombridae, siendo la “caball” uno de sus principales componetes.
La distribución de las larvas de esta especie, coincide con la de las aguas subtropicales superficiales (Fig. ld), y experimentan incrementos considerables en su distribución y densidad con el avance de estas aguas.
Las mayores concentraciones por fuera de las 60 millas de la costa, están relacionadas con el prodominio de estas aguas que están presentes durante todo el año y que avanzan hacia la costa de Mayo a Julio, principalmente al norte de 14°S; mientras que reduce su avance de Julio a Septiembre, en especial en el área sur, por fuera de 90 millas.
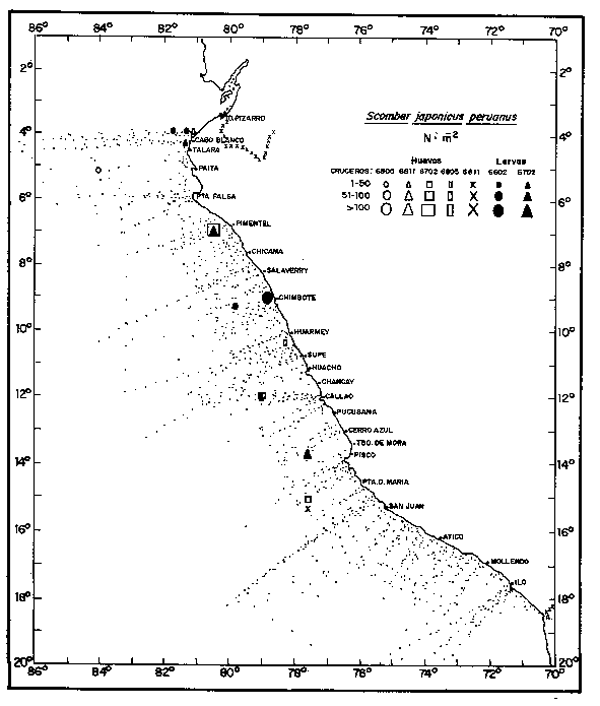
Fig. 10. - Distribución de huevos y larvas de caballa, de 1966 a 1968.
FLUCTUACIONES RELACIONADAS CON EL AMBIENTE
Sin la acción de las pesquerías, la anchoveta durante milenios ha dominado el ecosistema costero frente al Peru (De Vries y Pearcy, 1980), a diferencia de otros sistemas como el de California, donde se produjeron grandes cambios en abundancia de los recursos pelágicos en los dosúltimos siglos.
La información de desove y de distribución larval de anchoveta desde 1961, muestra que los períodos de condiciones ambientales ligermente fríos como 1966, 1967, 1975 le son favorables; en estos períodos ocupan ampliamente el área de desove y el máximo se produce a fines de Invierno.
Durante los fenómenos “E1 Niño” de 1965, 1972 y 1976, de diferente magnitud y forma de manifestarse, los efectos en los recursos también fueron diferentes.
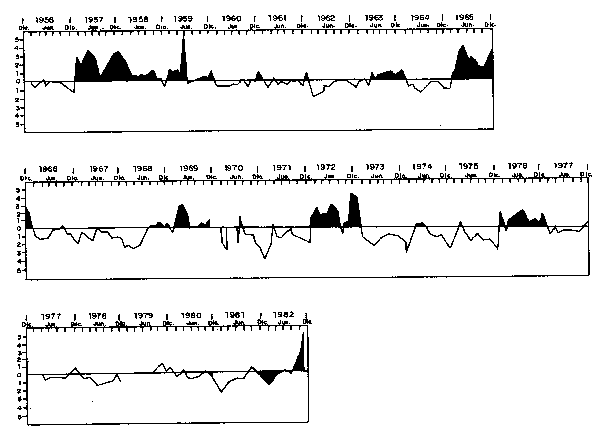
Fig. 11. - Variación anual de temperatura superficial en Chicama (07°43'LS) (datos hasta Abril de 1977 de Guillén y Calienes, 1980).
Durante 1965, la mayor intensidad del Fenómeno ocurriódurante Marzo y Abril, y fue originado por Aguas Ecuatoriales Superficiales (Temperatura Sup. 24° – 27°C, y Slinidad de 33.00 – 34.8°00).
Durante el Invierno de este año dominaron las Aguas Subtropicales superficiales en toda la costa, y las aguas frías ocuparon solamente las áreas muy próximas a la costa.
Las áreas de desove se mantuvieron en las áreas norte—central, (Fig. 12) pero el desove fue pobre, aun cuando el nivel de la población era alto, alrededor de 16 millones de toneladas. E1 ciclo de desove mostro que en Primavera este fue ligeramente mayor que en Invierno cuando las Aguas Costeras Frías ocuparon una mayor extensión.
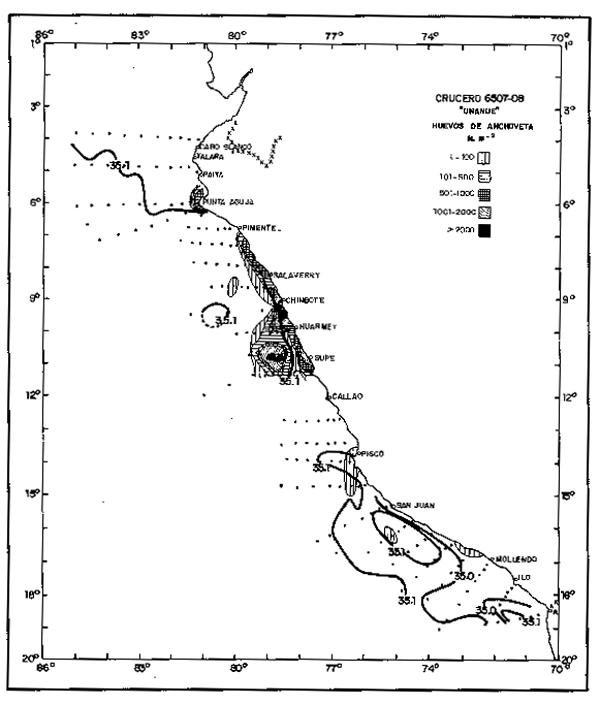
Fig. 12. - Distribución de huevos de anchoveta en el Crucero 6507–08. 8 Julio – 10 Septiembre, 1965.
“El Niño” 1972–73, de gran magnitud especialmente por su larga duración (Febrero 1972Febrero 1973) y sus efectos más intensos, se manifestaron durante el avance de las AES en dos fases: la primera de Febrero a Junio de 1972 y la segunda de Diciembre 1972 a Febrero 1973. En el segundo semestre de 1972 después de la fase inicial del fenómeno, cuando las aguas ecuatoriales, se retrajeron hasta el norte de Talara (04°30'S), las Aguas Subtropicales Superficiales, con salinidades mayores a 35.1°/oo jugaron un rol dominante, particularmente entre Agosto y Noviember, de tal forma que el área Talara y Callao fue casi homosalina (Zuta et al., 1976). En estas circumstancias, aun cuando las AES estaban replegadas hacia el norte, el desove se desplazo hacia el centro y sur, limitado a 20 millas de la costa por acción de las Aguas Subtropicales Superficiales y fue muy reducido(Fig.13). El desove continuó hasta Febrero de 1973, presentándose por primera vez un ciclo de desove totalmente irregular, con máximo en Verano. La irregularidad se repitió en el ciclo siguiente (1973–74) cuando se produjeron pobres desoves en Invierno y un gran desove en Verano de 1974 (Fig. 14).
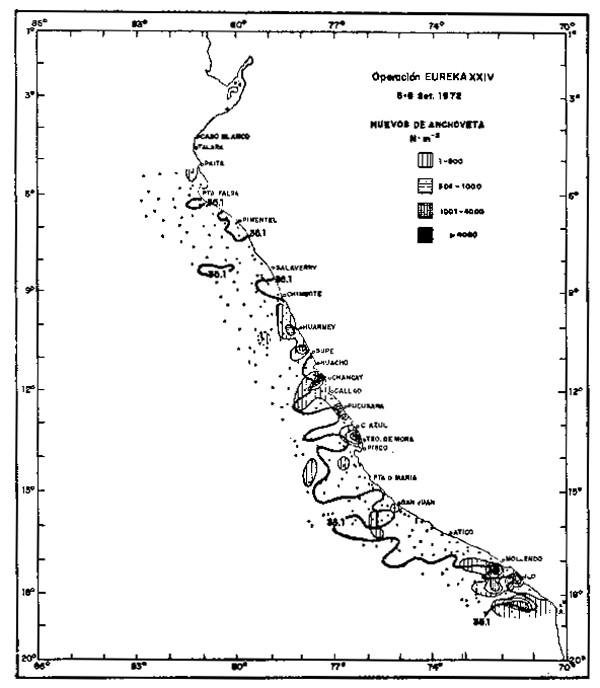
Fig. 13. - Distribución de huevos de anchoveta en la Operación EUREKA XXIV. 5/8 Septiembre, 1972.
E1 Fenómeno “E1 Niño” 1976, de menor intensidad que el de 1972, se manifestóprincipalmente con un calentamiento en Enero y Febrero, observado al norte de 15°S, disminuyendo las temperaturas en los siguientes meses, hasta otoño e inicios de Invierno, donde se rea nudaron las altas temperaturas, alcanzando la máxima desviación termal entre Junio y Agosto, asociado con Aguas Subtropicales Superficiales que dominaron gran parte de la costa peruana. Aun cuando a través de observaciones oceanográficas se determinó que estas anomalías ocurrieron durante 10 meses en 1976, las observaciones biológicas mostraron irregularidades desde Diciembre de 1975 durante todo el año 1976 y con consecuencias hasta inicios de 1977 (Santander, 1981 a; Tsukayama y Alvarez, 1981).
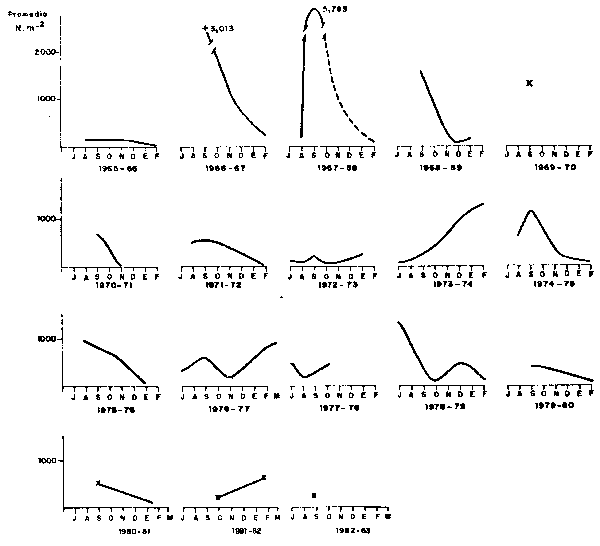
Fig. 14. - CICLOS DE DESOVE DE ANCHOVETA DE 1965 A 1982 EN EL AREA DE 6°–14° L.S.
Con estas condiciones, el desarrollo del ciclo del desove 1976–77 no siguió el patrón normal, observándose una mayor producción del desove en Verano (Fig. 14). En la primera parte del ciclo, Invierno, el desove fue menor al registrado en los de Invierno 1974 y 1975, respectivamente.
Durante el año 1982, antes de la ocurrencia del fenómeno, se registró una estación de Verano fría, con 2° y 3°C por debajo del promedio, principalmente en la parte costera entre 4° y 11°S.
El desove de anchoveta en el norte y centro, fue relativamente intenso, comparados con los Veranos 1979, 1980, e inclusive al de Primavera de 1981 (Fig. 14), obteniéndose un ciclo 1981–82 alterado, con más intenso desove en Verano.
En la estación de Invierno de 1982 (Septiembre) se observaron anomalías térmicas positivas (Fig. 11), con valores de +2°C con respecto al promedio patrón (1928–69). Este calentamiento fue causado por la penetración hasta muy cerca de la costa de aguas subtropicales superficiales, con un mayor impacto entre 8° – 13°S, hasta 10 y 20 millas de la costa. El desove de anchoveta se ubicó principalmente al sur de 10°S (Fig.4). En este período el desove fue menor al observado en el Verano y a los correspondientes de Invierno de los años 1979, 1980 y 1981.
Posteriormente, el calentamiento se ha hecho más intenso, con anomalías positivas por encima de 2° en Octubre, 4° en Noviembre en el área N—C, llegando en Diciembre a 6° en la localidad de Chimbote (09°S). Al sur de Pisco (14°S), las anomalías han sido menores (2° – 4°C).
En el caso de la sardina, desde 1966 hasta 1972, los desoves, fueron muy reducidos (Santander, 1981 a). Desde este año, hasta 1982, el desove se ha venido extendiendo con diferente intensidad a través del tiempo, con tendencia a incrementar hasta 1979, tanto espacialmente, como en densidad (Fig. 6). En los años siguientes, los desoves han venido decreciendo, excepto en Septiembre de 1982, cuando se presentaron las condiciones antes anotadas.
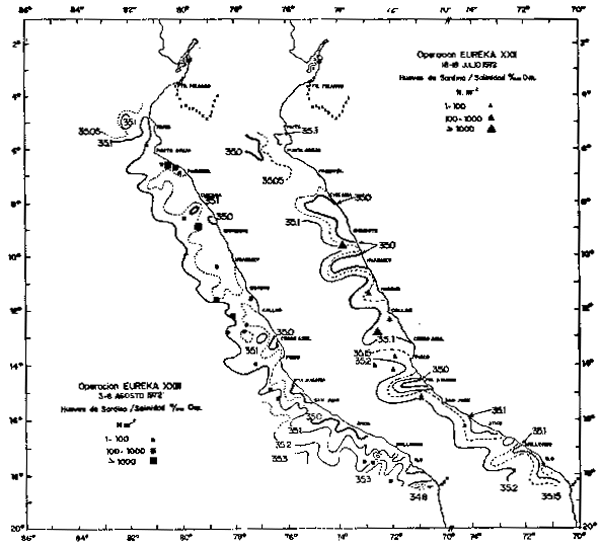
Fig. 15. - Distribución de huevos de sardina. Salinidad superficial (0/00) en la Operación EUREKA XXII. 18/19 Julio, 1972.
Con la ocurrencia del Fenómeno “El Niño” 1972–73, se observó un gran incremento en la distribución del desove y larval, ampliándose su área de distribución a toda la costa. La distribución se localizó en una franja por fuera de las 35 millas de la costa (Fig. 15). Como se ha dicho anteriormente, el pico del desove se produce mayormente al término de la estación de Invierno; pero durante el desarrollo de “El Niño” 1972–73, se produjo un adelanto del máximo en el ciclo del desove hacia el mes de Julio (Fig. 16).
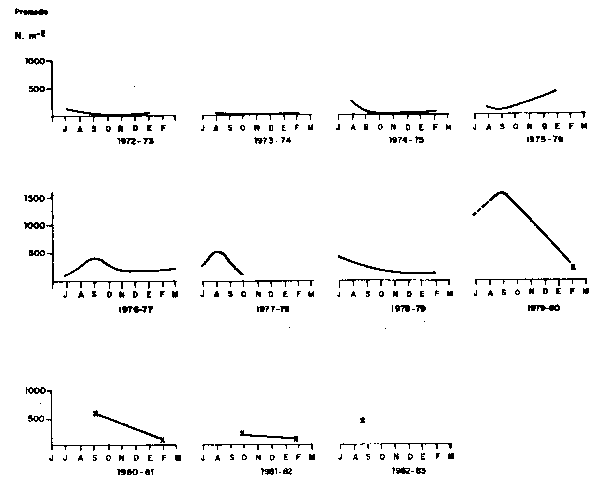
Fig.16. - CICLOS DE DESOVE DE SARDINA DE 1972–1982 EN EL AREA DE 6°–14° L.S.
El efecto del Fenómeno “El Niño” de 1976 en el desove de la sardina fue semejante al observado en 1972 (con una población superior a ladeese año). Después de un año frío (1975), cuando el desove de sardina fue muy escaso, en Agosto de 1976, su distribución se extendió a toda la costa, con densidades superiores a los años anteriores. Durante el ciclo de 1976–1977 el pico del desove se mantuvo en la estación de Invierno (Fig. 16).
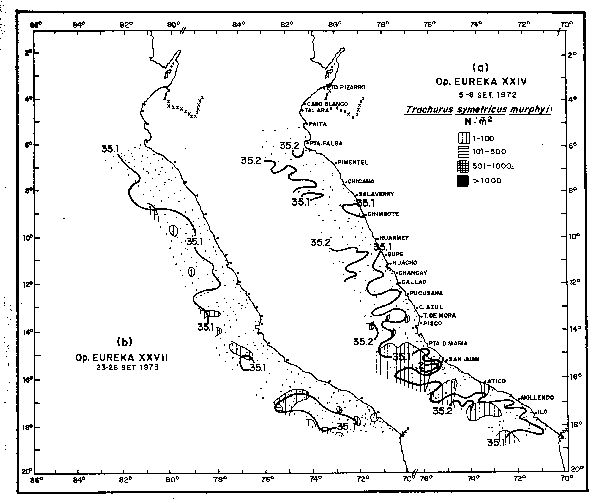
Fig. 17. - distribución de larvas de jurel.
(a) En la Operación EUREKA XXIV. 5/8 Septiembre, 1972.
(b) En la Operación EUREKA XXVII. 23/26 Septiembre, 1973.
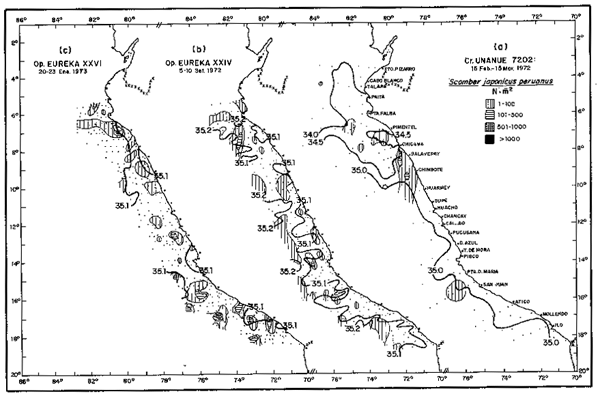
Fig. 18.- Distribución de larvas de caballa.
(a) En el Crucero 72.2. 15 Febrero - 13 Marzo, 1972.
(b) En la Operación EUREKA XXIV. 5/8 Septiembre, 1972
(c) En la Operación EUREKA XXVI. 20/23 Enero, 1973.
En el Verano de 1982, relativamente frío, la distribución del desove de sardina fue muy fraccionado y menor que los encontrados en los veranos de 1979 y 1980. Mientras que en Septiembre del mismo año, el desove de esta especie se extendió amplia y densamente desde 3°30' hasta 8°S; descontinuándose hacia el sur y resultando en un desove superior al encontrado en Verano.
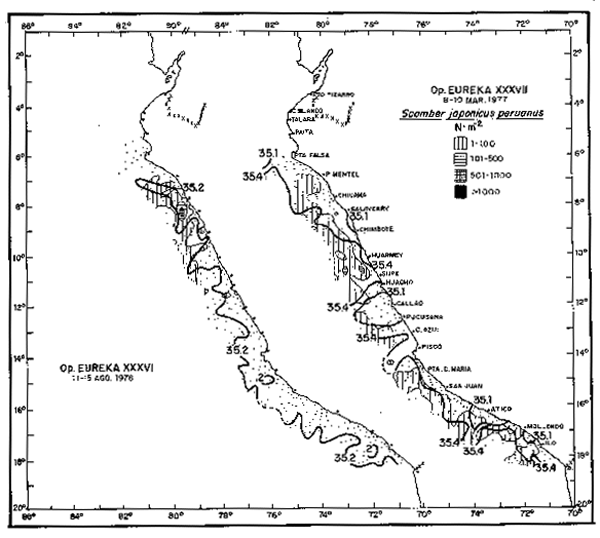
Fig. 19. - Distribución de larvas de caballa.
(a) En la Operación EUREKA XXXVII. 8/10 Marzo, 1977.
(b) En la Operación EUREKA XXXVI. 11/13 Agosto, 1976.
Como una característica general, los calentamientos de los años “El Niño” 1972 y 1976, afectaron favorablemente los desoves de la sardina (Septiembre), y en los inicios del correspondiente a 1982, los desoves se ven incrementados, con una mayor expansión de sus áreas de distribución, adelantándose sus períodos de desove y sus máximos cuando el calentamiento es de gran intensidad o de efectos prolongados como en 1972, o retrasándose para producir su máximo en Verano cuando las condiciones son frías como en 1975 (Fig. 16).
En concordancia con la distribución larval de jurel, relacionada principalmente con los frentes de Aguas Costeras Frías y Aguas Subtropicales Superficiales los registros obtenidos en los años 1966 a 1968, indican que en Noviembre de 1967 (Primavera), cuando las Aguas Subtropicales Superficiales tuvieron una gran aproximación hacia la costa, la distribución de larvas fue más extensa que en los otros 2 años (Fig. 8). Desde 1972, el número de larvas se ha incrementado principalmente en Septiembre de los años “El Niño” 1972, 1973, y 1976.
Es conveniente hacer notar, que aun cuando estos períodos se denominan “El Niño”, las condiciones ambientales no son homógeneas, ni durante todo el año, ni en toda la costa. Particularmente en Septiembre (Invierno) de estos tres años, las condiciones fueron diferentes a la fase de mayor intensidad de el fenómeno, que generalmente es en la estación de Verano.
En Septiembre de 1972, se observó predominio de las Aguas Subtropicales Superficiales en casi toda la costa. En el área sur, el desove de jurel se mostró pararelo con el avance de estas aguas (Fig. 17a). En Septiembre de 1973 cuando el fenomeno ya había finalizado, las Aguas Subtropicales se localizaron en algunas áreas al sur de 16°S (Fig. 17b).
Durante 1976, la densidad de las concentraciones fue menor que en los 2 años enumerados. Y en los años intermedios, 1974, 1975 y 1977, la distribución larval fue muy reducida.
Por ser la caballa desovadora de Verano, es la única especie entre estas cuatro, cuyo desove es afectado directamente durante el Fenómeno “El Niño”.
La distribución de huevos y larvas, muy dispersa en los veranos de los años 1966 a 1968, se incrementó notablemente en Febrero y Marzo de 1972 (Fig. 18a), principalmente de 6° a 10°S, hasta donde avanzaron las Aguas Ecuatoriales Superficiales.
En Septiembre del mismo año, la distribución larval se extendió a toda la costa, en relación con el avance de las Aguas Subtropicales Superficiales, aun cuando la estación de Invierno no es el período usual de desove (Fig. 18b).
En Enero de 1973, durante la segunda fase de “El Niño ”, se produjo la máxima densidad larval registrada hasta la fecha, bajo la acción de dos tipos de aguas cálidas. En el Norte hasta 9°S, por el avance de Aguas Ecuatoriales Superficiales y al sur de 15°S, por el acercamiento hacia la costa de Aguas Subtropicales Superficiales.
Las concentraciones en el área sur fueron de mayor densidad que las observadas en el Norte, sugiriendo este tipo de aguas (Subtropicales Superficiales) como las más favorables. (Fig.18c).
En los años posteriores, las más extensas y densas concentraciones larvales se han producido en los Veranos de 1975, 1977 y 1974 (Fig. 19a) mientras que en los años 1976 y 1982, las concentraciones de Invierno fueron mayores que las de Verano del mismo año. (Fig. 19b), cuando aguas salinas (Aguas Subtropicales Superficiales) dominaron el área de distribución de las larvas.
INTERACCION ENTRE ESPECIES
Los desoves de las cuatro especies enumeradas parecen ubicarse en áreas y períodos de acuerdo a patrones establecidos, que responderían a su estrategia de alimentación y de adaptación a determinadas condiciones ambientales.
En este sentido, las cuatro especies son planctófagas (estadios larvales y juveniles). En estado adulto, la anchoveta y la sardina mantienen este rógimen, siendo la sardina preferentemente zooplanctófaga y la anchoveta muestra tener una dienta combinada de fitoplanc ton y zooplancton (Mendiola, 1978; Alamo, 1981) en relacion con la disponibilidad de su alimento en las áreas costeras donde se distribuye esta especie.
El jurel y la caballa adultos, evidenciaban ser mayormente ictiófagos y zooplanctófagos en forma secundaria (Mejía et al., 1970). Sin embargo, durante 1975 y 1977, analisis de contenidos estomacales de caballa, revelan que organismos del zooplancton constituyeron el total de su dieta y en 1976 (Año “El Niño”), su alimento estuvo constituido casi exclusivamente de anchoveta (Sanches, G., comunicación personal), posiblemente por su distribución más costera, favorecida por el avance de Aguas Ecuatoriales Superficiales en Verano y Aguas Subtropicales Superficiales en Invierno.
La distribución de los adultos de estas especies, cubre casi toda la costa peruana; la anchoveta y sardina son más costera quejurel y caballa, que se encuentran relativamente alejadas de la costa. Sin emargo, en condiciones normales los desoves más importantes ocupan sólo parcialmente el area de distribución de los adultos, estas areas de desove están delimitadas principalmente, por las Augas Costeras Friás y las Augas Subtropicales Superficiales.
De las tres especies desovadoras de Invierno, la anchoveta desova en toda el área costera desde 6°S y hasta 30 millas de la costa aproximadamente, distribución ligada a las Augas costeras Frías; la sardina ocupa el la area norte-central (03°30' - 15°00'S) por fuera de las 20 millas principalmente, colindante conlas áreas de la anchoveta, pero con mayor afinidad con las Aguas Subtropicales Superficiales, pudiendo también adaptarse a las Aguas Costeras frías, y el jurel al sur de 15°s por fuera de las 30 millas de la costa, relacionadas con los frentes de las Aguas Costeras Frías y Aguas Subtropicales.
La caballa, la única desovadora de Verano de estas 4 especies, ocurre a lo largo de todo el litoral por fuera de las 20 ó 30 millas de la costa, en aguas subtropicales superficiales, principalmente.
La distribución de las larvas de estas especies, edemás de tener relación con la distribución de los adultos, parece estar supeditada a las concentraciones de organismos que requieren en su alimentación.
Las larvas de boca grande tienen mayor posibilidad de ingerir presas de mayor tamaño, y anunque las larvas de la anchoveta de California y del Pacific Mackerek (similar a la caballa peruana) tienen aproximadamente el miso ancho de la boca inicialmente, la del Pacific Mackerel incrementa más rápidamente (Hunter, 1981), con posibilidad de un mayor rango en el temaño de la presa. Lo que también debe ocurrir con las larvas de jurel y caballa distantes de la costa, en relación con las larvas de sardina y anchoveta, próximas a la costa, donde los organismos de menor temaño son más abundante que lejos de la costa.
Las fluctuaciones de las poblaciones de las cuatro especies pelagicas más importantes se reflejan en los cambios de la extensión del area de distribución e intensidad de sus desoves.
Antes de 1972, la anchoveta era el eje principal de este ecosistema y como tal dominaba espacialmente las áreas costeras hasta 60 ú 80 millas de la costa.
los desoves de anchoveta eran proporcionalmente extensos y los desoves de las otras especies eran limitados.
En 1972, con un reducido nivel proporcionalmente de anchoveta, ocasionado por el intenso esfuerzo de pesca, principalmente de los últimos años de la década del 60 y la ocurrencia del Fenómeno “El Niño” en la reducción de la distribución de la anchoveta. Al mismo tiempo, especies como la sardina, evidenciaron que su población se incrementaba por las altas capturas registradas desde 1973 (132 mil toneladas) y entre 1978 y 1981 (1.4 millones de toneladas en promedio), Tsukayama ( en prensa).
Al igual que la sardina, las poblaciones de jurel y caballa también paracen haber aumentado lo que a falta de evaluaciones se ha puesto en evidencia por el aumento de sus capturas.
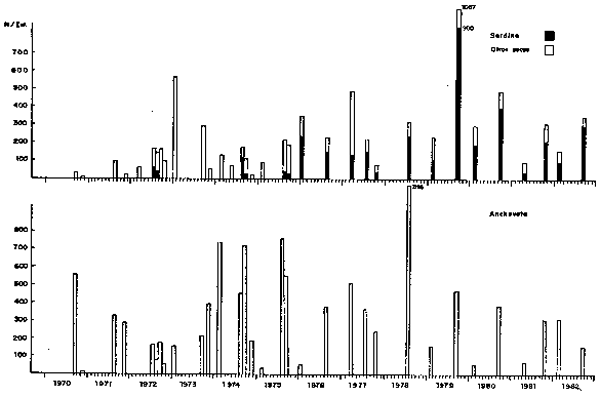
Fig. 20.- Composición del ictioplancton en el área de 04°00' a 18°00' S.
Pararelamente, la composición del ictioplancton desde 1961 mostró cambios concordantes con las fluctuaciones de las poblaciones. De 1961 a 1971, los huevos de anchoveta flucturon entre 80 y 90%, excepto en 1965 que descendió a 65% en un año de anomalías moderadas. En 1972–1973, los huevos de anchoveta constituyeron alrededor del 50% (Ssntander, 1981b). Desde 1974 a la fecha, las proporciones son fluctuantes tendienties al decrecimiento (Fig. 20)
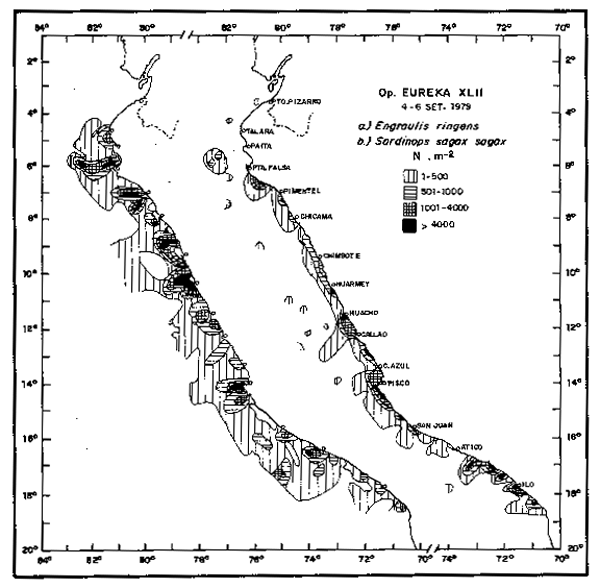
Fig. 21.- Distribución de huevos de sardina en la Operación EUREKA XL II. 4/6 Septiembre, 1979.
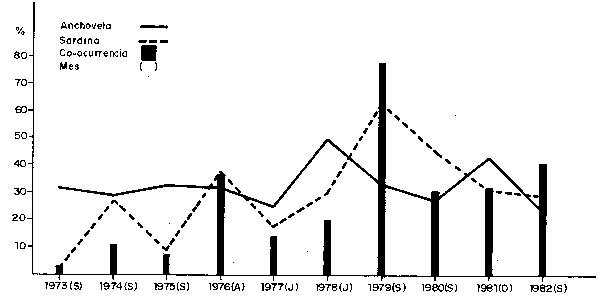
Fig. 22.- Frecuencia y Co ocurrencia de desoves de Anchoveta y Sardina de 1973 a 1982 (Invierno)
Al nivel de ictioplancton, las interacciones parecen ser mós directas entre la anchoveta y saradina, principalmente deside 1972. la reduccion de las condiciones anomalás de 1972–1973, permitieron la aproximación de las óreas de desove de sardina hacia la costa, ocupando parcialmente el area de desove de anchoveta. En los años choveta. En los años subsiguientes, los leve incrementos iniciales (1974-1975)y mayores de 1976 a 1979(fig.21)fueron aparejados con una mayor extensión de sus areas de desove y su continuó y gradual avance en la ocupación de las áreas de desove de anchoveta (fig. 22). De 1980 a 1982 los indices de desove, sugieren que tambien la población de sardina ésta decreciendo, con ligeros incrementos, cuando se producen calentamientos como el observado en Septiebre de 1982 (Fig. 16). La reduccion de estos desoves no implica necesariamente una menor ocupación de las áreas de anchoveta pero si se observa una menor co-ocurrencia de anchoveta y a los desplazamientos hacia el sur.
La sobreposición de las áreas de desove de estas especies, generalmente se presenta en los bordes de ambas y los principales focos de desoves no son co-ocurrentes.
Una consecuencia de la ocupación de áreas comunes para desovar, parece ser el del aumento de la predación sobre huevos y larvas de anchoveta, que se adicional al producido por el de sus progenitores. El numero promedio de huvos de anchoveta en estomagos de sardina, e, Septiembre de 1981, fue el triple delhallado en estomagos de anchoveta (Santander et al., este volumen), que como efecto concomitante debe influir en la falla de los reclutamientos de los 2 ultimós años.
Además de la predación mutua de los adultos sobre huevos y larvas, esta interacción se debe intensificar por la posible competencia por alimentación de estas dos especies en sus diferentes fases de vida, y de la caballa cuando ocurren avances de las Aguas Subtropicales Superficiales que favorecen la ampliación de su distribución hacia la costa. Sin embargo, el pico del período de desove de la caballa no es coincidente con los de las otras 2 especies, y el efecto debe ser menor a nivel de fases larvales.
Información preliminar sobre predación de caballa, sobre huevos de anchoveta y sardina en la localidad de Chimbote (09oS) de 1979 a 1981, muestra que hay una mayor proporción de huevos de sardina en sus contendios estomacales (Miñnano, Com.pers) debido probablemente a una mayor relación distribucional con esta especie.
Las interacciones de estas tres especies con el jurel en el ictioplancton, parecen ser manores por la ubicación espacial del desove, no compartida con anchoveta, ni sardina; ni en el tiempo con la caballa.
Nuestros resultados indican que los incrementos en las cioncentraciones larvales son reducidas y no son somparables a los de caballa, ni mucho menos a los de sardina.
Una causa atribuoble a esta diferencia, puede deberse a un patrón de desove menos intenso, observado por Hewitt (1981) para Trachurus symmetricus de California, a la gran velocidad de natación y a la habilidad de evitamiento, comparada con las larvas de Clupeidae (Lenartz, 1973).
DISCUSION
El conjunto de anomalías conocidas como fenómeno “E; Niño” tienen efectos muy variables en el ambiente marino, se presentan en períodos de tiempo irregulares, con diferente intensidad y donde interactúan procesos físico-químicos y biológicos muy variables, y afectan en diferente grado los huevos y larvas de peces pelágicos, particularmente a las especies, anchoveta, sardina, caballa y jurel. Alteran el proceso reproductivo de los adultos, cambiando los patrones de desove y de distribución larval.
Los fenomenós “El Niño” observados en 1965, 1972-73 y 1976, frente al Perú tienen como característica comun,enlacapa superficial donde se distribuyen estas especies, la transgresión de las Augas Ecuatoriales hacia elsur y de las Augas Subtropicales Superficialeshacia la costa, reduciendo en su avance los afloramientos costeros.
En el caso de la anchoveta, reducen la intensidad del desove, concentran los desoves en áreas muy próximas a la costa y cuando las condiciones son extremas, desplazan estas áreas hacia el sur, donde el efecto de estas anomalías parecen ser menores.
Hasta 1971, en condiciones normales los desoves el área sur de 14oS eran muy esporádicos. En los últimos 10 años se están haciendo más grecuentes con los efectos consiguientes de la colonización de una región de intenso afloramiento, donde los eventos de los vientos, la variabilidad termal y los procesos de mezcla, son mayores. A diferencia de la estabilidad de los procesos de afloramiento y baja turbulencia del área norte-central (6° – 14°S). Según Shaffer (1982), una celda de afloramiento con posibilidades de recirculación de aguna en la capa superficial en las proximidades de 9°s, sería la causante de la regeneración de nutrientes y materia organicia y en consecuencia de la alta productividad del área. Esta celda localizada tambien entre 4° y 6°s, estaría asociada con un flujo sub-superficial hacia el sur, que según Brockmann et al., (1980) hasta 100 se localiza sobre la plataforma y al sur de 12oy 15os, se ubica además sobre el talud, debilitandose en su recorrido hacia el sur.
Desde 1972, esta área norte-central es compartida para el desove y distribución larval con la sasrdina y aunque esta especie se extiende también hacia el norte y hacia afuera de la costa para desovar, sus mayores concentraciones se sitúan entre 5o y 12oS.
Estas dos especies desovan en el mismo período (Julio—Marzo) y co—ocurren parcialmente en los bordes de sus áreas de desove, más no en sus focos de desove, habiendo llegado como máximo a ocupar la sardina el 78% del área de desove de anchoveta, en Septiembre de 1979. Año en el que se registraton las mayores capturas de sardina (1.7 millones de toneladas; Tsukayama, en prensa), concordante posiblemente con el máximo nivel de esta población en los últimos años.
La ocupación de áreas de desove comunes, conlleva a una mayor interración entre estas dos especies planctófagas: de competencia entre larvas de las dos especies y entre adultos al momento del desove y de predacción de adultos sobre huevos y larvas, entre especies.
En condiciones normales los picos de desove de estas dos especies se producen a fines de invierno, aparentemente ligados a los máximos de fitoplancton y zooplancton de los ciclos de producción anual. con la ocurrencia del fenómeno “El Niño” en los años 1972-73 y 1976, este patrón del desove de anchoveta se altero produciendose un pobre desove durante el ciclo y desplazandose el máximo hacia verano (Ciclos: 1972-73; 1973-74 y 1976-77).
En la sardina la traslación del pico deldesove es menos diferenciadoenlos años “El Niño”. Solamente en 1972, seobservo un adelanto del pico del desove, notandose más bienun incremento en la abundancia del desove y una mayor expansión de sus areas, cada vez que ocurre un fenómeno “El Niño”.
La mayor intensidad y extensión del desove de sardina parece ser una consecuencia delLa mayore intensidad y extensión deldesove de sardina parece ser una consecuencia del dominio de las Aguas Subtropicales Superficiales, o de los procesos de menzcla de estás con las Aguas Ecuatoriales Superficiales, mós que del avance de estas; pues durante los años “El Niño” la mayor intensidad del fenomeno se da en verano, suavizandose lo riguroso de las condiciones de las Aguas Ecuatoriales Superficiales en invierno, cuando generalmente dominan las Aguas Subtropicales superficiales y los procesos de mezcla de la columna vertical.
Cuando se iniciaron los incrementos sustanciales de sardina en los años 1972, 1973 y 1974, la mayor intensidad del desove se producía en invierno, pero anterior al máximo de anchoveta. Pudiendo por este hecho haber sido favorecida la sobrevivencia de las larvas de sardina. Walsh et al., (1980) sugieren que cuando las larvas de ambas especies tienen que competir, durante “El Niño” por el mismo alimento, por adelanto en el tiempo de desove es posible que la sobrevivencia de sus larvas se beneficie. Después de 1976, los picos de desove de anchoveta y sardina parecen coincidir en el tiempo con más frecuencia que previamente; lo que incidiría en una mayor competencia.
Tanto la sobreposición de sus áreas de desove, comola coincidencia de los picos de desove y el cada vez más frecuente acercamiento de las Aguas Subtropicales Superficiales, en época de desove, limitan la distribución de las áreas de desove y larval de anchoveta. Usualmente la distribución de larvas ocupa una mayor extensión que la del desove, como efecto de la dinámica del agua, distribuyendo a las larvas en un ára mayor por la diferencia en el tiempo de duración del estadio de huevo (alrededor de dos días), con el de larvas (de 20 a 50 diás; Smith, 1981). Hasta 1971 el area dedistribución larvas era mayor que la de huevos; desde este año y posteriomente en 1972, 1976, 1977, 1980, 1981 y 1982, se ha observado que la extensión larvas es menor que la extensóin del desove, suponiéndose que se debe a una mayor mortalidad de huevas; o a la existencia de un patrón de circulación que las mantiene en áreas más próximas a la costa. Sin embargo, esta última posibilidad significaria un aumento en la densidad este ocurriendo en los últimos años.
El jurel, siendo desovadora de invierno, no tiene mayor interacción con los desoves de anchoveta y sardina, por ocupar diferente área de desove, que las más importantes de anchoveta y sardina. Pero se supone que algun tipo de interaccion? se esta? produciendo en el area? sur, donde en los últimos años se han registrado desoves de anchoveta; principalmente poruna mayor aproximación del jurel cuando las Aguas Subtropicales Superficiales tienen un mayor acercamiento hacia la costa.
la caballa por ser desovadora de verano, en condiciones normales, localiza sus desoves por fuera de las áreas de desoves de Verano de anchoveta y sardina.
El nivel de predación sobre anchoveta adulta ha disminuido y en su lugar el zooplancton parece ser el principal componente de su alimento. Pero en condiciones “El Niño”, además de predar sobre la anchoveta y sardina por un mayor acercamiento hacia la costa, los desoves de caballa se incrementan, sus áreas de desoves son más cercanas a la costa e inclusive se reproduce durante la estación de Invierno.
La triple co-ocurrencia del desove de caballa, anchoveta y sardina en estos periodós es evidenciada también por la predación de la caballa adulta sobre huevos de anchoveta y sardina, siendo mayor sobre esta segunda especies, por yna mayor relación en la distribución.
Los decrementos sucesivos de la población de anchoveta que se venían produciendo desde antes del Fenómeno “El Niño” 1972-73, por la creciente presión pesquera y los óltimos tres del proceso reproductivo y las subsecuentes fases de huevos y larvas.
En constraposición,las otras tres especies pelagicas, sardina, jurel y caballa, han evidenciado incrementos sustanciales a partir de la declinación del stock de anchoveta y de los cambios ambientales que favorecen la amplicación de las areas de desove y larval y posiblemente de una mayor sobrevivencia de huevos y larvas.
REFERENCIAS
Alamo, A. 1981. Estudio sobre la alimentación de la anchoveta peruana Engraulis ringens J. durante los años 1976 y 1977. Bol.Inst.Mar. Péru–Callao. Vol.Extraord. pp. 258–268.
Brockmann, C.E., E. Fahrbach, A. Huyer, and R.L. Smith. 1980. The poleward undercurrent along the Peru coast: 50° to 15°S. Deep-Sea Res. 27A:847–856.
De Vries, T.J. and W.G. Pearcy. 1980. Fish debris in sediments of the upwelling zone off Central Peru: A late quaternary record. Deep-Sea Res. 28(1A):87–109.
Guillén, O. y R. Calienes. 1981. Upwelling off Chimbote. pp. 312–326. In Coastal Upwelling. (F.A. Richards, ed.). American Geophysical Union, Washington, D.C.
Hewitt, R.P. 1981. The value of pattern in the distribution of young fish. Rapp.P.v.Réun.Cons.int.Explor.Mer. 178:229–236.
Hunter, J.R. 1981. Feeding ecology and predation of marine fish larvae. pp. 33–77. In Marine Fish Larvae.Morphology, Ecology and Relation to Fisheries. (R. Lasker, ed.). Washington Sea Grant Program, University of Washington Press, Seattle and London.
Lenarz, W.H. 1973. Dependence of catch rates on size of fish larvae. Rapp.P.-v.Réun.Cons.int.Explor.Mer.164:270–.275.
Mejĺa, J., M. Samamé y A. Pastor. 1970. Información básica de los principales peces de consumo. Serie Informes Especiales Inst.Mar Perú-Callao. 62:1–28.
Mendiola, B.R. 1978. El alimento de la anchoveta Engraulis ringens J. en un área de afloramineto (San Juan). Informe Inst.Mar Perú-Callao. No.49. pp. 1–16.
Mendiola, B. y N. Ochoa. 1980. Phytoplankton and spawning of anchoveta. pp. 241–253. In IOC Workshop Report No. 28 (G.D. Sharp, ed.). IOC/UNESCO, Paris.
Santander,H. 1974. Cosecha estable del zooplancton. Serie Informes Especiales Inst.Mar PerúCallao. 148:1–15.
Santander,H. 1981a. Patrones de distribución y fluctuaciones de desoves de anchoveta y sardina. Bol.Inst.Mar. Perú-Callao. Vol.Extraord. pp. 180–192.
Santander,H. 1981b. Fluctuaciones del desove de anchoveta y algunos factores relacionados. pp. 255–274. En IOC Workshop Report. No. 28 (G.D. Sharp, ed.). IOC/UNESCO, Paris.
Santander, H., J. Alheit, A.D. MacCall y A. Alamo. (Este volumen). Egg mortality of the Peruvian anchovy (Engraulis ringens) caused by cannibalism and predation by sardines (Sardinops saqax).
Shaffer, G. 1982. On the upwelling circulation over the wide shelf off Peru: l. circulation. J.Mar.Res. 40(2):293–314.
Smith, P. 1981. Fisheries on coastal pelagic schooling fish. pp. 2–31. In Marine Fish Larvae. Morphology, Ecology and Relation to Fisheries (R. Lasker, ed.) Washington Sea Grant Program, University of Washington Press, Seattle and London.
Tsukayama, I. En prensa. Recursos pelágicos y sus pesqueríes en el Perú. X Reunión de COCIC. Guayaquil, 25–29 Oct. 1982.
Tsukayama, I. y M.A. Alvarez. 1981. Fluctuaciones en el stock de anchovetas desovantes durante las temporadas reproductoras de primavera 1964–1978. pp. 233–240. En IOC Workshop Report No. 28 (G.D. Sharp, ed.) IOC/UNESCO, Paris. Walsh, J.J., T.E. Whitledge, W.E. Esias, R.L. Smith, S.A. Huntsman, H. Santander and B.R. de Mendiola 1980. The spawning habitat of the Peruvian anchovy, Engraulis ringens. Deep—Sea Res. 27A:1–28.
Ware, D., B.R. de Mendiola and D.S. Newhouse. 1980. Behaviour of first feeding Peruvian anchoveta large Engraulis ringens. pp. 467–474. In Symposium on Early Life History of Fish (K. Sherman and G. Hempel, eds.). Rapp.P.-v.Réun.Cons.int.Explor.Mer. 178.
Zuta, S. y O. Guillén. 1970. Oceanografía de las aguas costeras del Péru. Bol.Inst.Mar. Perú-Callao 2(5):157–324.
Zuta, S., T. Rivera y A. Bustamante. 1978. Hydrographic aspects of the main upwelling areas of Peru. pp. 235–257. In Upwelling Ecosystems. (R. Boje and M. Tomczak, eds.).
Zuta, S., J. Valdivia, D. Enfield y P. Lagos. 1976. Aspectos físicos del Fenómeno “El Niño”. Guayaquil, Ecuador. 4–12 Dic. 1974. pp. 3–61.