A.B. Da Silva
J.E. Vinatea
F. Alcantara
El manual ha sido preparado como parte del Trust Fund de FAO, Proyecto GCP/RLA/075/ITA Apoyo a las Actividades Regionales de Acuicultura para América Latina y el Caribe. Es un compendio de las clases teórico-prácticas servido a los participantes del Curso sobre Reproducción de Peces Colossoma que fuera llevado a cabo en la ciudad de Tarapoto, Estación pesquera de Ahuashiyacu, Departamento de San Martín, Perú, entre el 15 y el 30 de noviembre de 1987.
Se trata de abordar el tema desde tres puntos de vista: primero, haciendo el enfoque específico de la reproducción de Colossomas, C. macropomum y C. brachypomum; en seguida se hace una descripción más generalizada de la metodología de la reproducción inducida de peces reofílicos; y por último, se hace una revisión bibliográfica sobre la inducción final de maduración, ovulación y espermiación en peces cultivados. Incluyese además, una guía para el desove inducido y reversión sexual.
Los autores de los temas referidos, agradecen al Proyecto FAO/ITA y al IIAP/CORDESAM, por la oportunidad brindada y hacer posible la publicación del material abordado.
Mediante la discusión de los aspectos que abarcan la reproducción de peces reofílicos como son los pertenecientes al género Colossoma que por lo común, se resisten a desovar y/o reproducirse naturalmente en estanques y cuerpos de agua ajenos a su hábitat característico, se trata de clasificar una serie de métodos que permiten responder a pacos y gamitanas al proceso de inducción de la reproducción gracias al suministro de hormonas naturales y sintéticas.
Se enfatiza el cuidado y manejo apropiado que debe dispensarse a los reproductores, la época precisa para inyectar las dosis recomendadas de hormonas, el desove, la incubación y el desarrollo larvario hasta que se produzca la resorción completa del saco vitelino, así como las precauciones que debe tenerse en la alimentación y estabulación de los alevines una vez que son trasladados a los estanques de cría y engorde.
Desde hace unos 10 a 12 años, se viene trabajando activamente en algunos países de América Latina, como es el caso de Brasil, Venezuela, Colombia y Perú, en el cultivo extensivo y semi intensivo de peces del género Colossoma, de las especies Colossoma macropomum; C. mitrei; C. brachypomum, comúnmente conocidas como Tambaqui, pacu, cachama, paco y gamitana en Brasil, Venezuela y Perú, resepectivamente.
La demanda de tales peces es cada vez más manifiesta por la bondad y calidad de su carne, especialmente en las poblaciones de la región amazónica y otras regiones tropicales de Sud América.
Los alevines y semillas de esos peces, hasta hace muy poco eran capturados en los ríos de la amazonia y sus tributarios, ya que la reproducción de aquellos peces reofílicos era muy diícil y casi imposible en cautiverio. De esa manera, cualquier práctica de piscicultura tenía que estar sujeta a la disponibilidad de alevines provenientes casi exclusivamente de la naturaleza constituyendo de ese modo, un cuello de botella la reproducción artificial o en cautiverio de tales peces en cuestión.
En su afán de resolver este serio problema, limitante par el despegue de la acuicultura de tales especies nobles, Brasil se convirtió en el país pionero al lograr después de muchos años de indesmayable esfuerzo, la reproducción inducida del pacu y tambaqui con la aplicación de pituitarias y una serie de hormonas estimulantes como el Conceptal, Pregnil, Anternon, Gonadotropina coriónica humana (GCH), etc.
Iguales esfuerzos, naturalmente, en menor escala pero no desalentadores, se hicieron en Venezuela, Colombia y Perú, tendientes a obtener el desove de peces por inducción.
El gobierno peruano, supo manifestar su preocupación en torno a este tema y presentó su planteamiento sobre el deseo e interés existente, tanto en el Ministerio de Pesquería, como en el Instituto de Investigación de la Amazonia Peruana, IIAP, de que el Proyecto GCP/RLA/075/ITA, brindara su apoyo técnico-financiero para viabilizar el dictado de un curso de dos semanas de duración sobre la Reproducción Inducida de ‘pacos’ y ‘gamitanas’, así como otras especies tropicales, como el ‘boquichico’.
La misión del Proyecto FAO/ITA integrada por los doctores L. Loria, F. A. Pagán y A. Tacon, que visitara Perú en Mayo/87, sostuvo reuniones de trbajo en la Representción de FAO en Lima, con representantes del Ministerio de Pesquería del IIAP y algunas universidades. En aquella época, entre otros acuerdos, se decidió dictar un curso de Fisiología y Reproducción artificial de peces, en la Estación de Ahuashiyaco, en la ciudad de Tarapoto, Departamento de San Martín, del 15 al 30 de noviembre de 1987.
Con el curso mencionado, se pretendió alcanzar los siguientes objectivos:
Dar a conocer algunos aspectos importantes de la fisiología de la reproducción y el comportamiento de peces del género Colossoma en su medio natural y en cautiverio después de haber recibido inyecciones con dosis variadas de hormonas estimulates y las suturas practicadas en las hembras.
Manejo apropiado de los peces reproductores y número de inyecciones a ser aplicadas en ejemplares machos y hembras.
Importancia de entender el valor de los grados/hora en el desarrollo embrionario (incubación) y el manejo apropiado que debe dispensar a las larvas recién eclosionadas.
Cuidados que debe tenerse en el manejo de las larvas provistas del saco vitelino y la alimentación inicial de las post-larvas (primer alevinaje) desde la resorción del saco vitelino hasta su traslado a las hapas y tanques de alevinaje.
Aprendizaje de distintos méntodos de cultivo de alimento vivo, ejemplo: rotíferos, cladóceros (Moina, Daphnia, etc) y Artemia, así como plantas acuáticas, Wolfia, Lemna, Azolla, etc.
El curso fue organizado por el Proyecto FAO-GCP/RLA/075/ITA, en colaboración con el Instituto de Investigación de la Amazonia Peruana, IIAP, y la Corporación de desarrollo del Departamento de San Martín, CORDESAN. Además, se contó con la cooperación del Centro de Investigación y Desarrrollo Agropecuario, CIDAP.
Los costos demandados por el consultor y coordinator internacional del curso, así como aquellos referentes a la compra de hormonas, reactivos, etc., fueron cubiertos por el Proyecto FAO/ITA. El apoyo logístico dado por el IIAP y CORDESAN, y las facilidades existentes de estanques, laboratorios y sala de incubación de la Estación Pesquera de Ahuashiyaco, fueron proporcionados por la Dirección Pesquera de San Martín, del Ministerio de Pesquería.
A partir del mes de julio se cursaron las invitaciones a todas las instituciones interesadas, universidades, corporaciones departamentales de desarrollo, estaciones pesqueras, institutos de investigación, principalmente aquellos que estuvieron realizando trabajos de investigación y producción con peces tropicales.
Originalmente, dada la naturaleza tan especializada del curso y a las facilidades de trabajo, y por indicación del consultor responsable, se había sugerido que solo se aceptaran a 10 participantes. Sin embargo, la demanda de candidatos superó todas las expectativas, por lo que las autoridades de los organismos contrapartes nacionales invocaron al Proyecto FAO/ITALIA, para permitir que el número de vacantes se doblara para 20. El Proyecto, después de consultr con el coordinador generl del curso y el consutor, accedió a la petición planteada.
El programa del curso y la lista de participantes aparecen en los anexos 1 y 2, respectivamente.
La relación de profesores responsables y colaboradores figuran en el anexo 3.
La inauguración y la clausura del curso se llevaron a cabo en el salón de actos de la Parroquia Provincial.
En ambas ocasiones estuvieron presentes las autoridades tutelares de Tarapoto, el Presidente de la Corporación de Desarrollo, Dr. Demetrio Tafur, el Director de la filial del IIAP en San Martín, Dr. Carlos M. Castñeda, los participantes y profesores del curso. En representación de FAO y del Proyecto GCP/RLA/075/ITA estuvo, J.E. Vinatea, experto principal de capacitación, quien, como en veces anteriores, resaltó la importancia del evento técnico-académico y el rol fundamental del Proyecto FAO/ITALIA en el desarrollo de la acuicultura en los países de la Región.
En la ceremonia de clausura, tanto el Representante de la Corporación de Desarrollo del Departmento de San Martín, CORDESAN, como el Director del IIAP, exteriorizaron su agradecimiento a la FAO por el esfuerzo positivo realizado en favor de los profesionales peruanos y de la región amazónica en general. El biólogo Luis Campos Baca, en representación de los participantes, realzó la calidad del curso realizado, dejando también sentir su agradecimiento y reconocimiento a la FAO y a los otros organismos que hicieron efectivo la realización del curso. En seguida, se procedió a la entrega de diplomas a los participantes.
La característica del curso fué predominantemente práctico, debido a la naturaleza del trabajo a ser cumplido, y en base a una evalucación inicial que se hiciera, en la que la mayoría de los representantes demostraron tener suficiente conocimiento teórico de la fisiología de la reproducción y el ciclo hormonal de los peces, así mismo, por petición de los propios interesados, para dar énfasis a la práctica de la reproducción inducida.
La mayor parte de las clases teóricas y prácticas se cumplieron en la Estación de Ahuashiyaco, en horario corrido entre las 07:00 y 16 horas, durante los primeros días y durante 24 horas seguidas, atendidas por turnos a cargo de 5 grupos de alumnos y profesores participantes, especialmente los últimos cinco días cuando se produjo el desove por inducción hormonal, la incubación, desarrollo embrionario y la eclosión de larvas de gamitanas.
Los trabajos prácticos tuvieron que ver además con la preparación de estanques para reproductores y alevines; prácticas de encalado y fertilización de tanques para el cultivo de alimento vivo; sembrío, manejo y muestreo de rotíferos, cladóceros y artemias. así mismo, de plantas acuáticas flotantes importantes por su valor protéico y su alta capacidad de nitrificación de suelos de los estanques y arrozales, tales como:Azolla; Lemna; Wolfia, etc.
El manejo de larvas (aquellas provistas de saco vitelino) y post-larvas (después de la resorción del saco vitelino) tuvo especial cuidado e interés de los participantes del curso. La alimentación inicial de alevines basada en microcápsulas Preparadas como huevo de gallina y el alimento vivo, rotíferos y dafnias, fué un asunto que mantuvo ocupado a todo el estudiantado. Se sabía que en años anteriores la producción de alevines había sufrido una altísima tasa de mortalidad (85–90% como consecuencia del mal manejo y deficiente método de alimentación de los peces una vez producida la resorción del saco vitelino).
El curso servido en Tarapoto proporcionó fundamentalmente conocimientos prácticos de:
manejo de reproductores, como determinar la madurez o preparación de los mismos para la recepción de hormonas;
preparación de los macerados y/o emulsiones de hormonas sintéticas/frescas, la correcta dosificación y aplicación mediante inyecciones intramusculares e intraperitoneales (dosis iniciales y desencadenantes);
suturación de los reproductores hembra después de la dosis desencadenante;
contaje de las horas térmicas (número de horas y grados centígrados empleados desde el desove, incubación hasta la eclosión de larvas);
control de desarrollo embrionario y manejo de las larvas después de producida la eclosión (liberación de la cáscara de huevo y regulación del flujo de agua);
alimentación inicial de post-larvas (primer alevinaje) a base de microencapsulado de huevo y alimento vivo, rotíferos, nauplios y metanauplios copepoides de cladóceros;
estabulación de post-larvas en hapas (bersarios) y tanques de alevinaje, control de predadores y alimentación apropiada a base de microalgas (Microcystis, Chlorella Scenedermus, etc) y cladóceros (Daphnia, Moina, Ceriodaphnia, etc);
adelgazamiento de la población de alevines y estabulación en tasas apropiadas al tamaño de los peces por unidad de superficie.
Por otro lado, en relación a las instalaciones de la Estación Pesquera Ahuashiyaco, se debe decir:
• Que todavía no reúne las condiciones ni el equipamiento e instalaciones convenientes para poder llevar a cabo operaciones de desove intensivo y continuado para peces del género Colossoma como pacos y gamitanas. Las incubadoras resultaron ser muy pequeñas y desapropiadas para incubar tanta cantidad de huevos liberados. La turbidez del agua y la oscilación de temperatura fueron también factores que incideron en una mortalidad alta.
Sin embargo, a pesar de las dificultades indicadas, se lograron aproximadamente entre 50 a 70.000 alevines, los que fueron estabulados en hapas y tanques de alevinaje.
Los 5 técnicos, biológicos pesqueros, de la estación participaron en el curso, desempeñándose entusiasta y eficazmente en los trabajos cotidianos de la Estación Pesquera y como líderes de los grupos de participantes. Ellos han sido los más beneficiados porque ampliarán con eficiencia todo lo aprendido y discutido durante las clases.
La evaluación y discusión se realizó en una reunión conjunta de participantes, directivas de IIAP, Ministerio de Pesquería, Universidad de Tarapoto y profesores del curso.
Todos los alumnos y directivos presentes supieron expresar que el curso, indiscutiblemente había sido bien servido, que las clases teórico-prácticas fueron de un nivel elevado y apropiado, que los temas y problemas discutidos habían servido para cimentar conocimientos previos y para aclarar y tomar las providencias de como resolverlos.
También los alumnos redactaron informes sobre los trabajos llevados a cabo.
Una vez más, los participantes del curso hicieron público su reconocimiento a la FAO y al Proyecto GCP/RLA/075/ITA por su valiosa ayuda en la materialización del evento señalado.
En opinión de los representantes del IIAP y Ministerio de Pesquería, tendrían que plantear peticiones debidamente fundamentadas a las autoridades del Ministerio de Pesquería y al IIAP, para que ellos, mediante la Representación de FAO en Perú, solicitaran a la FAO-Roma conceder asistencia técnica y financiera a Perú, a través de un TCP que les permita tener uno o dos expertos para atender todo lo concerniente a la reproducción de peces y manejo de larvas y alevines. Igualmente, harían las gestiones pertinentes para conseguir financiamiento de los bancos Mundial e Interamericano, a fin de terminar de construir las facilidades pendientes (tercera etapa) de la Estación de Ahuashiyaco.
I JORNADA NACIONAL DE REPRODUCCION DE PECES AMAZONICOS PROGRAMA TEORICO PRACTICO DE REPRODUCCION DE GAMITANA Y PACO LUGAR: TARAPOTO
| DIAS | A C T I V I D A D | PROF. RESPONSABLE/COLAB. |
|---|---|---|
| 15 16 18 19 20 22 23 24 25 | Entrega de material, didáctico, reconocimiento de granjas y lugar de
trabajo. Selección de reproductores y matrices para fines de desove. Determinación de las características morfológicas para la identificación de los ejemplares en condiciones de desove. Manejo de los mismos. Ensayo de reproducción de gamitana con G.C.H. Regulación hormonal de los procesos relacionados con el desarrollo de los productos sexuales. Hipofisación. Métodos utilizados. Instrumental necesario. Dosaje en los machos: Sutura en las hembras, razón de la sutura. Manutención de los reproductores y matrices en tanques. Importancia del oxígeno disuelto. Determinación de la hora grado del paco y gamitana. Extrusión de los productos sexuales. Incubación de los huevos, cuidados, desarrollo embrionario. Acompañamiento de las fases de desarrollo en incubadoras. Características más peculiares. Cantidad de huevo por litro. Salida de agua durante la incubación. Eclosión. Manutención de larvas en los tanques. Colecta de hipófisis. Material necesario. Preservación. Visita a los criaderos y/o estaciones de acuicultura en lugares vecinos. Preparación de estanques par larvas y alevines. Práctica del uso del cal para la liberación de organismos nocivos. Empleo de insecticidas. Práctica de fertilización. Alimentación. Importancia en la fase inicial de los peces (larvas y post-larvas). Alimentación artificial, métodos de preparación. Relevamiento de los insumos y subproducto agroindustriales para la preparación de alimentos. (Cultivo de larvas durante período corto). | E.
Vinatea/F. Alcantara A. Becerra/F. Alcantara J.E. Vinatea A. Becerra/F. Alcantara A. Becerra/F. Alcantara J. E. Vinatea |
CAPACITACION/INSTRUCTORES
El programa de reproducción de colossomas pretende brindar un esquema panorámico actualizado que abarca los aspectos bioecológicos de las especies en discusión, técnicas de producción masiva de larvas y alevines, considerando además, el transporte de semillas, manejo de reproductores, estabulación de alevines y manejo de estanques a base de alimentos naturales y artificiales.
El curso estará a cargo de consultores del proyecto GCP/RLA/075/ITA que contará con el valioso apoyo de instrucciones peruanos, Drs. Luis Campos, Humberto Guerra, Miguel Castañeda y Fernando Alcantara.
PROGRAMA TENTATIVO DE CLASES TEORICAS Y PRACTICAS
(Lugar Tarapoto)
| Semana 1 | |
| Día 15 : | Entrega de material didáctico. Reconocimiento de granjas y lugar de trabajo. |
| Programa Teóico | |
| Día 16 : | Características bioecológicas más importantes de los colossomas y peces reolíficos de la amazonía. |
| Día 17 : | • Regulación hormonal de los procesos relacionados con el desarrollo de los productos sexuales. |
| • Preparación de reproductores y selección de matrices. | |
| Día 18 : | Dosaje de hipófisis e hipofisación: |
| • Inyección de hembras | |
| • Inyección de machos | |
| • Administración de las inyecciones | |
| • Preparación de la solución de hipófisis | |
| • Práctica de la inyección | |
| • Sutura de las hembras | |
| Día 19 : | Determinación de las horas-grado del paco y gamitana |
| • Tranquilización, extensión de los productos sexuales | |
| • Ovulación parcial, sacrificio de los machos | |
| • Fertilización de los huevos. Algunas características de los huevos de colossomas (pacos y gamitanas) | |
| Día 20: | Incubación de los huevos |
| • Cuidados a tenerse en cuent5a en la incubación y desarrollo embrionario. | |
| • Las incubadoras. Características más peculiares: | |
| • Cantidad de huevos que deben ser colocados por incubadora, de acuerdo a la calidad de los mismos. | |
| • Desarrollo de los huevos, eclosión. | |
| Semana 2 | |
| Día 23 : | Desarrollo y cuidados en la crianza de larvas y alevines |
| • Preparación de estanques para post-larvas | |
| • Práctica de preparación de los estanques | |
| • Estabulación de post-larvas | |
| • Adelgazamiento de la población en relación al peso/tamaño | |
| • Alimento de los alevines | |
| Día 24 : | Importancia de la alimentación inicial |
| • Alimento natural y métodos de cultivo | |
| • Alimentación artificial, métodos de preparación. Relevamiento de insumos y subproductos agroindustriales para la preparación de alimentos. | |
| Día 25 : | Cultivo de rotíferos y copépodos |
| Día 26 : | Cultivo de microalgas |
| Día 27 : 28 | Estudios de casos de reproducción de peces tropicales en otras especies y tropicales en otras áreas de América Latina. Extracción de hipófisis de Prochilodus y otras especies disponibles. |
| Día 30 : | Seminario de los trabajos de grupos sobre reproducción de peces realizados por los participantes del curso. |
| • Ceremonia de clausura y entrega de certificados. |
| Programa Práctico | |
| Semana 1 | |
| Día 16: | • Estudio anatómico de los colossomas en discusión |
| • Características del tracto digestivo y determinación del índice I/LS y discusión de los hábitos alimenticios. | |
| Día 17 : | • Estudio biométrico y determinación de especies con condiciones aparentes para el cultivo |
| • Estudio del sistema urogenital a fin de establecer características y hábitos de reproducción de especies reofílicas. | |
| Día 18 : | • Estudios de los métodos de enucleacion de hipófisis de peces en exámen y de otros disponibles en la zona. |
| • Métodos de preservación y suministro de hipófisis a los peces recipientes. | |
| Día 19 : | • Empleo de otras hormonas y/o métodos para la inducción a la maduración de gametos y para la reproducción. |
| • Ensayos de hipofisación y aplicacion de inyecciones vía inter-craneal. intraperitoneal y abdominal. | |
| Día 20 : | • Estudio sobre los distintos anastésicos existentes y sus efectos positivos y/o negativos MS 222, Quinaldina, Clorobutanol, etc. |
| • Algunos métodos de reproducción natural con cambios de nivel de agua, fricción del vientre, aletas anal y pectoral, temperatura y/o insolación. | |
| Día 21 : | • Visita a criaderos y/o estaciones de acuicultura existentes en lugares aledaños. |
| Día 23 : | • Preparación de estanques para reproductores |
| • Preparación de estanques para alevines | |
| • Prácticas de encalado y fertilización | |
| Día 24 : | • Inducción a la reproducción y control del proceso desdela liberación de huevos, incubación y desarrollo embrionario de las especies en experimentación. (Este control y trabajos por grupos de tres participantes cada uno, deberá prolongarse hasta el día 28) |
| Día 25 : | • Prácticas sobre cultivo de rotíferos y cladóceros |
| • Preparación de medios de cultivo, acondicionamiento de acuarios, tanques de eternit/fibra de vidrio y otros aparentes. | |
| Día 26 : | • Prácticas de cultivo de microalgas Scenedesmus, Chlorella, Mycrocystis, etc. |
| • Preparación de medios de cultivo | |
| • Acondicionamiento de acuarios, garrafas, frascos, etc. | |
| Día 27 : | • Instalación de incubadoras y discusion sobre la posibilidad de emplear métodos y materiales alternativos existentes en la región. |
| Día 28 : | • Redacción de informes y/o seminarios. |
| RELACION DE COORDINADORES Y PROFESORES | |
|---|---|
| Corrdinadore Contrapartes Nacionales: | • Dr. Fernando Alcantara Bocanegra (IIAP) |
| • Dr. Carlos Miguel Castañeda | |
| Coordinador Internacional: | • FAO, Proyecto GCP/RLA/075/ITA |
| • Dr. J. Enrique Vinatea | |
| Consultor FAO: | • Dr. Amaury Bezerra da Silva |
| Colaboradores: | • Dr. Humberto Guerra (Expositor IIAP) |
| • Dr. Luis Campos Baca (Expositor IIAP) | |
| • Dr. Fernando Alcantara Bocanegra (Expositor IIAP) | |
| • Dr. Gilberto Ascon Dionisio (Ministerio de Pesquería) | |
(Por Amaury Bezzerra da Silva)1
La cantidad de reproductores necesaria es predeterminada por el número de alevines que se desea obtener, así como el número de huevos, considerándose evidentemente, la pérdida por mortalidad. Para establecer el número de reproductores, pretendiéndose una cantidad de alevines es preciso basarse en el peso de cada hembra. Normalmente, una hembra de Colossoma desova en media 100.000 óvulos por kg de peso corporal, esto equivales a afirmar que una hembra de 6 kg podrá producir 600.000 óvulos. Dependiendo del índice de fertilización se podrá o no obtener una significativa cantidad de larvas, consecuentemente de alevines.
Una densidad conveniente de peces irá a asegurar condiciones ideales que influenciarán en el desempeño de los progenitores. Para tal, una carga de 1 kg de peso corporal del pez por metro cuadrado (1 kg/m2) es considerada buena. Para que esto se torne evidente, el vivero tendrá que poseer todas las condiciones de estabulación, tal como agua en calidad y cantidad, alimentación adecuada, etc.
Deberá tener una profundidad en torno de 1.5 m y contener agua en abundancia. Un vivero de 1 ha de área exigirá 100–200 m3 de agua por día, necesarios como para completar la pérdida de evaporación durante la estación de seca. De preferencia, la forma deberá ser rectangular, lo cual facilitará la captura de los peces. Los estanques deberán ser de 1000–4000 m2 de tamaño.
Es conveniente disponer de la suficiente cantidad de reproductores para atender una capacidad de producción de alevines de la estación alevinera.
1 Pesquisador de lo Segundo Directorio del DNOCS, Fortaleza-CE, Brasil
En los peces del sub-orden Charachoidei, el más importante de los peces de agua dulce, normalmente se utiliza la proporción de 2 machos para 1 hembra (2:1), lo cual sirve para garantizar una cantidad suficiente de semen durante los trabajos de reproducción inducida. Muchas veces un individuo macho no libera en elmomento que se practica la fertilización artificial, la cantidad necesaria de esperma para fecundar los óvulos de una determinada hembra; es evidente que un macho en buenas condiciones de desove proporciona volumen más que suficiente para fertilizar óvulos de una hembra o más.
La diferenciación de los sexos en los peces del sub-orden Charachoidei sólo es posible en la época de desove. Los machos presentan vientre comprimido y dejan fluir el semen cuando se les presiona el abdomen. Se debe tener en cuenta que los machos en condiciones para el desove presentan el semen viscoso y de color lechoso; individuos con semen muy fluido y transparente deben evitarse.
Las hembras sexualmente maduras muestran un vientre flácido, no siempre voluminoso, papila genital ligeramente dilatada. Debe evitarse utilizar peces con papila muy prominente y muy colorada, eso demuestra que tales peces estan en un proceso adelantado de reabsorción de sus gónodas; forzar un desove enindividuos en esas condiciones se tendrá un resultado negativo. Si ocurre un desove, el producto sexual será de pésima calidad comprometiendo así la sobrevivencia.
Los machos de pirapitinga, cuando están prontos para desovar emiten ronquidos igual que los Prochilodus machos, lo que no ocurre con el tambaqui.
Los reproductores pueden obtenerse directamente de su ambiente natural o de viveros de la estación. Además de los traumas sufridos durante la captura, los reproductores naturales no se adaptan fácilmente a la vida en cautiverio, se ponen nerviosos, agitados o no se pueden alimentar. La ventaja de tener reproductores en cautiverio desde jóvenes y en condiciones favorables, es de que siempre se dispondrá de individuos capaces de desovar en el tiempo deseado. También la captura de ejemplares criados en cautiverio presentan menos tendencia al trauma, ésta es una de las razones de inhibición de desove de los peces, principalmente de las hembras que dejan de liberar los óvulos a pesar de estar en condiciones para tal proceso.
La formación de futuros planteles de reproductores debe ser una preocupación constante de una estación de piscicultura. Así se hace necesaria la selección de individuos jóvenes que preseten las características ideales para ser buenos reproductores.
La cría de reproductores exige cuidado especial con el medio en que viven. La falta de espacio y una alimentación deficiente son responsables por la degeneración de los productos sexuales. El espacio restringido puede ocasionar fallas en el crecimiento, motivado por el desaparecimiento de ciertos trazos de substancias nutritivas o por la alteración de los mecanismos del metabolismo, ocasionado por los remanentes tóxicos del medio ambiente.
La renovación periódica del agua de los viveros mantendrá los niveles de cualidad ambiental en armonía con la naturaleza del trabajo. Debe evitarse la excesiva luminosidad de los viveros, pues los peces pueden sufrir un efecto negativo sobre el desenvolvimiento de sus gónadas.
La alimentación de los peces es de fundamental importancia para obtener productos sexuales de buena calidad, para tal, la disponibilidad local de insumos de valor proteico y vitamínico es de vital necesidad.
En falta de una buena alimentación, la fase de vitelinogénesis del desenvolvimiento del huevo es afectada, en caso de que haya deficiencia en nutrientes esenciales, particularmente en aminoácidos, vitaminas o minerales, el desenvolvimiento del huevo es fatalmente afectado en deterimento de una buena ovuación que tiende a fracasar.
Es mejor criar un número de reproductores con dieta cualitativa y cuantitativa satisfactoria, de que mantener un plantel inmenso y mal nutrido.
Los peces del género Colossoma son omnívoros de una manera general, siendo que en el Amazonas el tambaqui se alimenta de frutas que caen al agua, zooplancton, algunos vegetales y pequeños peces. En los azudes del Nordeste brasilero, se alimentan de algas filamentosas (Spirogyra), moluscos gasteropoda, zooplancton y pequeños peces. En cautiverio, son mantenidos a base de ración para crecimiento de aves (23% de proteína), en forma peletizada siempre se evita el abastecimiento de ración molida. El tambaqui y la pirapitinga no tienen capacidad de aprehensión de alimento en esa forma, consecuentemente habrá sobra excesiva de ración en el fondo del vivero que se descompone ocasionando depleción de O2, niveles bajos de O2 conducen al pez a no desovar. Paralelamente al uso de pelets, los peces se abastecen con frutos como guayaba (Mirtacea), Mutamba (Esterculiacea), vegetales de hojas tiernas, restos de productos hortigranjeros, Sandillas, etc. En general, es preciso conocer el régimen alimenticio y los hábitos alimentários del pez cultivado, se debe evitar el uso excesivo de alimentos ricos en carbohidratos, ya que producirá exceso de gorduras en detrimento de un buen desarrollo de las gónadas.
Puede mantenerse en el vivero la vegetación acuática submersa en forma controlada Hidrotix gardineri (Pontaderiacea), muy semejante a Chara sp, ese vegetal posee un tenor de 23% de proteínas, constituyendo un excelente alimento para esas especies, pero ante todo, debe evitarse la demasiada proliferación, porque en la noche se torna inevitable el excessivo consumo de O2, ocasionando implicaciones negativas para los peces.
Para el control parcial de esta vegetación se puede introducir un cierto número de machos de cualquier especie de tilapia (Sarotherodon o Tilapia) es suficiente (100 – 200/ha), el control mecánico puede ser hecho, sin embargo, es muy oneroso.
En cuanto a la capacidad de utilización de vegetales como alimento, la pirapitinga posee un mayor potencial que el tambaqui, sin embargo, es ineficaz en el consumo de zooplancton, ya que no posee filtros bronquiales com aquel.
Se tornó clásico el establecimiento de una tasa de alimentación de 1 a 1.5 % para la fase que comprende hasta las proximidades de la época de reproducción, cuando entonces los peces tendrían el alimento disminuido, pero como ambas especies poseen individuos aptos a desovar durante casi todo el año, sería difícil establecer una cantidad determinada de ración para los mismos.
Desde el punto de vista práctico, la cantidad de ración a ser establecida será en función del grado de apetencia de los peces. Restos de alimento en el fondo del vivero, presentando olor característico de putrefacción, indica que estáhabiendo exceso de abastecimiento, eso será fácilmente detectado examinando periódicamente los locales de alimentación del vivero; constatando tal hecho se efectúa el inmediato cambio de agua, restableciéndose así las condiciones normales del vivero, el abastecimiento de ración será gradual hasta que los peces se alimenten normalmente.
Hembras de tambaqui están para el desolve en el 4° año de vida, los machos alcanzan ese estadio a los 3 años de edad.
En el caso de pirapitinga, las hembras y machos están en condiciones de desove a los 3 años de vida.
Es evidente que eso ocurrirá si las condiciones ideales de alimentación. espacio uycalidad de agua fueron establecidas. En la prática, los mejores resultados son obtenidos con ejemplares de edad superior a las descritas encima.
Ambas especies son fáciles de ser manipuladas en los trabajos de colección de productos sexuales. Entrento, se recomienda trabajar con individiuos de 4 a 8 kg de peso; en determinado momento esos peces se movilizan bruscamente, dificultando su manejo, el uso de individuos de menor porte significará la economía de hipófisis.
Después de 5 años de uso esos ejemplares pueden ser descartados/substituidos por otros más jóvenes y de menor porte.
Naturalmente, la ovulación de un pez es realizada a través de la acción de la glándula pituitária, que produce y almacena sus propias hormonas que estimulan la ovulación. Cuando las condiciones exigidas se tornan favorables, la hormona almacenada es liberada en la sangre.
En el proceso de hipofisación, entretanto, la hormona gonadotrópica es obtenida de un pez (donador) para ser aplicada en otro pez (receptor).
La hipofisación sólo se tornará efectiva si los óvulus hubieran alcanzando la fase de latencia o de reposo que sigue inmediatamente después de la vitelogénesis, entonces con los óvulos estructuralmente prontos sigue la acción de la gonadotropina que los desarrollará posteriormente.
Una condición para el éxito de una hipofisación, es la colección de hipófisis frescas de peces donadores; por consiguiente se hace necesario que las mismas contengan una cantidad adecuada de hormonas gonadotrópicas almacenada.
El papel de la hipófisis es de un agente intermediario entre el cerebro y las gónadas, sus células, producen y almacenan gonadotropinas, y las liberan cuando la glándula recibe el comando necesario. La cantidad de gonadotropina varía durante las diferentes estaciones y los diferentes estadios de la vida del pez. Los peces inmaduros poseen apenas cantidades mínimas de esta hormona pituitaria, en cuanto los peces adultos presentan la pituitaria completamente agotada después del desove. A su vez, el nivel más alto de gonadotropina en términos cuantitativos en la hipófisis de los peces sexualmente maduros, ocurrirá cuando sus gónadas alcancen la fase de reposo y durante toda esa fase. Como la migración para el desove es provocada por la gonadotropina, esa substancia se encuentra en su nivel más bajo; de ese modo, es importante escoger el tiempo ideal para colectar hipófisis.
Durante una evolución natural el pez es capaz de regular con precisión el dosaje de su propia hormona. De esa manera, no hay ningún desperdicio. En el proceso de hipofisación en que la hormona procede de otra fuente externa (donador) hay un considerable desperdició. Se torna difícil determinar una dosis exacta resultando en una aplicación más que necesaria de hormona en los reproductores.
El proceso de ovulación es lento, durante varias horas, la duración es regulada por la temperatura. La ovulación puede ser diferenciada en 2 fases: pre-ovulación y ovulación. En la fase de pre-ovulación, la migración del núcleo se completa y el huevo absorbe una cantidad de fluido (hidratación) siendo el tamaño el mismo que al final de la ovulación. En caso de que en la hipofisación no se obtenga éxito en el desarrollo de los óvulos, se interrumpe en esta fase y el pez podrá morir fácilmente, pues los mismos son necrosados pudieron causar un envenamiento interno.
La ovulación se inicia con el desaparecimiento de la membrana del núcleo y el aparecimiento de los cromosomas, terminando con la primera división meiótica, al mismo tiempo, el folículo que mantiene el huevo fijo a la pared del ovario se rompe y se disuelve parcialmente, ocasionanado la liberación de los óvulos en la cavidad del ovario; en ese momento se produce el desove con el flujo de los óvulos a través de la abertura genial.
La variación en el dosaje necesaria de la hormona puede variar significativamente para cada ejemplar de una misma especie, o bien, como por la técnica empleada.
Realmente, un dosaje depende del “grado de preparación” de las hembras, edad, tamaño, sensibilidad y de muchos otros factores (Woynarovich, Horvath), según éstos, “en áreas tropicales y sub-tropicales donde el metabolismo del pez es más alto (debido a la temperatura más elevada) y donde la probabilidad de desperdicio de las hormona es por tanto mayor que en regiones templadas, generalmente se administran 2 o más dosis, la introductoria y la final.
| - Dosis preparatoria: | 10% de la dosis total (3–4mg de hipófisis/kg) |
| - Dosis final: | 90% de la dosis total |
Intervalo de aplicación entre 10 a 14 horas. Esto variar;a de acuerdo al grado de preparación de los peces.
Se recomienda una dosi única (1–1.5 mg/kg). Muchas veces se hacen 2 aplicaciones en el intento de obtener una mayor liberación de semen, quedando con todos los machos sujetos a liberar espermas antes que las hembras estén prontas para ovular.
Se debe evitar dosis excesivas en la aplicación preparatoria, pues la misma podrá inducir al pez a una ovulación parcial en detrimento de la programación normal.
En la dosi decisiva final, se puede aplicar un pequeño exceso como medida de seguridad en orden de 10 a 15%.
Puede ser usado suero fisiológico o agua destilada, para la dosis decisiva se debe usar una cantidad de solvente de 0.5 ml por cada glándula (2.5–3. Omg).
La cantidad de hormonas sólo es importante cuando es demasiado grande o pequeña. Cuando pequeña la pérdida de una gota de solución significaría la pérdida de una cantidad considerable de hormona en cuanto que la administración de un gran volumen de solución se transformaría en un problema difícil. Entonces, se recomienda que la cantidad varíe entre 1–5 ml.
Para determinar el dosaje tiene que ser considerado el peso, número y sexo de reproductores.
Para macerar la glándula se usa un mortero y brazo de prcelana. Se colocan las glándulas y se van humedeciendo con el diluyente, se agrega más diluyente cuando se crea conveniente. Se usa jeringa graduada, retirar con la jeringa toda la mezcla que se lleva a la centrífuga. Hecha la centrifugación se colecta con la jeringa la solución sobrante. Se puede también usar glicerina adicionando una pequeña cantidad de macerado. Después de eso, se adiciona el diluyente en cantidad necesaria y se colecta la solución con una jeringa graduada, esta solución no precisa ser centrifugada, lo cual puede aplicar inmediatamente.
De manera general, se aplica la hormona en los músculos dorsales encima de la línea lateral y debajo de la parte anterior de la aleta dorsal. También se acostumbra aplicar la hormona en la parte dorsal del pedúnculo caudal en caso de peces sensibles.
En los peces de escamas, la introducción de la aguja se debe aplicar entre la superposición de las escamas.
También es común la aplicación intraperitoneal, debajo de las aletas abdominales, en este lugar se evita el reflujo de la solución cuando comúnmente se aplica en los músculos.
Para tener éxito en la hipofisación tiene que tomarse en consideración las condiciones ambientales que son importantes, tales como: temperatura adecuada, elevado tenor de O2 libre y tranquilidad.
Cuando un pez recibe tratamiento hormonal necesita de más del 50% de O2 que normalmente, pues su metabolismo es más acentuado, exigiendo mayor demanda de este gas, esto también es válido en relación a temperaturas elevadas. El exceso de manipulación resulta en mayor consumo de O2, siendo por lo tanto necesario mantener a los peces en ambientes tranquilos evitándoles traumas y con renovación constante y abundante de agua.
La fase de pre-ovulación generalmente puede ser obtenida fácilmente administrándose GCH, sin embargo, es más difícil alcanzar la plena ovulación a través de este método en la mayoría de los peces, a pesar de que muchos peces reaccionan positivamente.
Los peces bien preparados son los que ofrecen condiciones para desovar con el uso de GCH.
El centro de investigaciones ictiológicas Rodolpho von Iherin, en el Nordeste de Brasil, obtuvo éxito con Prochilodus ciarensis, con aplicación únicamente de GCH. Con Prochilodus argenteus se obtuvo desove con aplicación de hipófisis de peces en las dos primeras dosis, siendo que en la tercera, se hubo aplicado GCH.
Ya con pirapitinga, se obtuvo desove en la primera dosis con hipófisis, y en la segunda con GCH.
Así, para Colossoma, recomendamos:
1a. dosis: 2 mg de hipófisis/1 kg de peso corporal
2a. dosis: 5 U.I/g de peso corporal
Se pude ir a una 3a. dosis con 5 U.I./g.
Intervalo de aplicación: 12 horas.
Los machos son inyectados cuando las hembras reciben su segunda aplicación con dosis de 5 U.I./g.
Como normalmente el proceso final de maduración de los óvulos depende de la temperatura del agua, el mismo lleva determinado tiempo para tal. Desde el intervalo de tiempo entre la última aplicación de hormona y la ovulación total, ese intervalo de tiempo es expresado en “hora grado”. Cada hora se mide después de la última inyección hasta la completa ovulación. Se suman las lecturas de cada hora para obtener la “hora grado”, esto ayuda al piscicultor a saber exactamente cuando se debe de la ovulación de la última inyección. El valor de la “hora grado” depende de la especie del pez, del tipo de tratamiento, del tamañ de la hembra y si el pez comienza a desovar inmediatamente después de la ovulación o no.
En el caso de Colossoma a temperatura de 28°C, la hora grado es 250–300.
Algunos peces no desovan naturalmente, aun cuando son inducidos a desovar con aplicaciones de suero pituitario, como en el caso de tambaqui pirapitinga alcanza este estadio. Con todo, para un mejor aprovechamiento de los productos sexuales, la colección de este material puede ser realizado por extrusión.
La ovulación o proceso final de maduración de los óvulos no puede ser interrumpido o anulado. Una vez iniciado el proceso los óvulos tienen que ser expulsados o sometidos al proceso de extrusión; si eso no ocurre, se torna demasiado maduros, sin condición de ser fertilizados.
De esta manera, toda hembra en esa condición tiene que sufrir esta proceso, pues los ovocitos ya alcanzan el estadio de maduración que ocurre inmediatamente.
Esta maduración sufre variaciones de acuerdo a la especie, siendo que en los peces tropicales eso ocurre más temprano que en los peces de zonas templadas.
La mayoría de los óvulos madura o se desarrolla y cae en la cavidad del ovario al mismo tiempo, esto facilita la estrución de modo que fluyen fácilmente.
El conocimiento de hora-grado del pez, ayuda a establecer la hora exacta de la ovulación, dentro de una variación de 10–20 minutos en media.
En las hembras saturadas, la flacidez del vientre y la presencia de algunos óvulos entre las saturas indicarían la maduración, estando en condiciones de realizar la extrusión, a veces los machos son usados como indicadores para las hembras maduras, inician el cortejo a las hembras maduras flanqueándolas constantemente.
Para colectar los óvulos se hace uso de depósitos de plástico o de agata limpios y secos. Se seca la hembra con una toalla suave eliminándose la orina y cuidando de las suturas. Hembras maduras dejan fluir los óvulos en chorros firmes y espesos. Resta apenas la última camada de óvulos que precisan sufrir leve presión para su total retirada. Una extracción forzada indica que el pez no está en condiciones y eso debe ser evitado, pues los óvulos no se presentarían a fertilización.
Simultáneamente, se junta el semen de los machos con el uso de pipeta especial. También se puede colectar el semen directamente de lo macho, depositando sobre los óvulos recogidos mezclando lentamente los productos con una pluma de pato o una cuchara de plástico; en ese caso tienen que limpiarse y enjugarse a los machos.
Poco después se va adicionando agua y con determinado período de 5 a 10 minutos, se colocan los huevos ya fertilizados en incubadoras.
Incubadoras con capacidad para 100 a 200 litros son las más indicadas. Nunca se debe colocar más de 300.000 huevos en una incubadora de 200 litros. Al nacer, las larvas pueden tener problemas con O2 disuelto en agua pudiendo morirse.
Esa fase es de una importancia, pues la sobrevivencia de los huevos dependrá de su buen desarrollo. Por lo tanto, la necesidad de cuidados, especiales durante ese desarrollo, con la temperatura, oxígeno, etc., que podrán intervenir en la calidad de los mismos es necesaria.
Durante esa fase se exige una elevada concentración de oxígeno, siendo que en los estadios iniciales el consumo es insignificante, tornándose más acentuado a medida que su desarrollo avanza.
La temperatura ejerce un papel muy importante, debiendo estar en niveles idénticos a los del ambiente de origen de los peces, evitando excsos mínimos o máximos, pues éstos irían a comprometer el éxito de su desarrollo normal.
Otro requisito básico es la limpieza del agua exenta de plancton. Determinados tenores de materia orgánica orgánica favoreceráel aparecimiento de innúmeros problemas con adversas condiciones de control. De la misma manera, los organismos constitutivos de plancton, tales como Copépodos, Cyclops pueden destruir los huevos de manera considerable, pues al agarrale a los huevos las partes de ese organismo de suma aspereza, destruyen la membrana del huevo matándola.
La manutención de un flujo contante de agua, eliminará las sustacias tóxicas producidas por las huevos, tales como CO2 y NH3que podrían comprometer la vida de los mismos.
De todas maneras el flujo del agua debe ser controlado para evitar los coques mecánicos que podrían en riesgo los huevos de los peces, en sus primeras fases de segmetación celular hasta mórula son extremadamente sensibles. Además los cambios gaseosos son más intensos cuando los huevos ingresan a la fase de blástula, necesitando de mayor oncentración de oxígeno.
Cuando se refiere a luminosidad, los huevos y larvas de algunas especies de peces, son sencibles a los rayos ultravioletas, como consecuencia, deben ser protegidos de los excesos de luz.
Varios son los tipos de incubadoras que podrán ser usadas en la incubación de huevos y larvas de peces del género Colossoma, que poseen huevos libres y de densidad mayor que la del agua. Con todo, la forma ideal es la cónica, con parte del cuerpo cilíndrica (10 %) y la restante cónica (90%) ese formato ayuda considerablemente a mantener las larvas en constante movimiento, evitando así que los huevos se depositen en el fondo de la incubadora, lo cual sería perjudicial para los mismos. Antes de la obsorción del saco vitelino el movimiento de larvas es en sentido vertical con impulsos periódicos.
Es recomendable el uso de incubadoras hechas de fibra de vidrio, por ser resistentes y livianas, fáciles de ser transportadas, incubadoras de zinc pueden ser usadas siempre que la parte interna sea pintada neutra. Ambas pueden ser confeccionadas artesanalmente para disminuir considerablemente los costos.
La entrada del agua dederá ser colocada en la parte inferior de la incubadora con el uso de ducha doméstica, de manera que el flujo del agua en movimiento sea en sentido vertical, de abajo para arriba. La salida del agua se dará por encima de la incubadora, teniendo cuidado de usar un tela de malla de 350–400 micras, a fin de impedir la fuga de huevos o larvas permitiendo con esto que el flujo del agua no sea interrumpido. Mallas de esa dimensión favorecer´ el pasaje de los residuos de la desintegración de la camara de los huevos. El implemento de ese flujo ocasionará el revalse de agua con la inevitable pérdida del material de incubación.
Unos de los problemas graves durante la fase de incubación, es la presencia de organismos indeseables como Cyclops que ocasionan daños en los huevos y larvas de peces, causándoles la muerte. La construcción de un filtro capaz de retener esos organismos se hace necesaria. Dederá ser construido en ladrillos y concreto, constando de secciones individules con arena gruesa y varillas sólidas con dimensiones de acuerdo con las necesidades de uso el agua destinada a las incubadoras deberá pasar por ese filtro.
Larvas de peces del género Colossoma mantienen el saco vitelino hasta el 5° día de vida. Entretanto, en el 3° el mismo ya se reduce bastante en esa fase, pues el pez ya posee abertura bucal, alimentándose simultáneamente del medio interno y externo, nada en sentido horizontal y procura alimento del medio ambiente, pudiendo darse a las larvas, huevo cocido licuado varias veces al día. La ración delhuevo no deberá pasar del 3° día, ya que ocasionará la muerte de las larvas que tendrían dificultad en digerirlos y cuyo uso se hace para distener el intestino facilitando el paso del alimento. Se puede ofrecer zooplancton filtrado en mallas de 60 a 80 micras, con todo se trata de un trabajo lento y oneroso.
La ideal sería que en el cual irán a residir las larvas, éstas encuentren abundante alimentación, indispensable para un rápido desarrollo, evitando posibles problemas por la deficiencia de alimentación.
Aquí reside básicamente el éxito de toda la crianza, e implica cuidados especiales.
La colocación de larvas en vivero, se dará entre el 3° y 4° dóas de vida, muchas veces para evitar la predación de copépodosñ las larvas son mantenidas en incubadoras no mñas de 48 horas. En esa fase la reserva nutricional todavía es suficiente para la manutención de la larva.
La mejor hora para poblar de larvas el vivero, será por la mañana, cuando la temperatura esté baja y sin problemas de choque ambiental.
La colecta de larvas será hecha mediante sistema de sifonaje y con mangueras de plástico, de la incubadora a baldes del mismo material, teniéndose cuidado de evitar choques mecánicos durante esa manipulaciónñ pueden ser utilizados también sacos plásticos. Al llevar los recipientes con las larvas para el vivero, se debe dejar fluir el agua lentamente en los anaqueles, a fin de equilibrar la temperatura del agua de esa manera, las larvas van siendo colocadas también en el vivero, tetornando del balde o saco de agua.
Es evidente que para recibir las larvas, el vivero deberá estar debidamente preparado, consistiendo en:
Graduación del lecho del vivero.
Aplicación de abono orgánico e inorganico esparcido en todo el área del vivero, la cantidad dependerá del tipo de suelo y edad de cada vivero, dos a tres toneladas por hectárea durante la primera aplicación. La experiencia de cada piscicultor establecerá la manera correcta de abonar y la frecuencia con que se haga. El abonamiento a base de fosfato es necesario para la formación de fitoplancton, que servirá de alimento a los rotíferos que, a su vez constituyen el alimento inicial de las larvas durante los seis primeros días de vida en el vivero.
Se debe llenar el vivero gradualmente, para que haya una concentración gradual de zooplancton al alcance de las larvas, éstas, por su tierna edad, no poseen energía suficiente para su locomoción en volumenes mayores para procurar su aliemto por sí mismas. Cada día se eleva el nivel del agua de tres o cinco centímetros, de preferencia de noche, para que muy importante es el tamaño de los viveros para la crianza de larvas; éstos dederán ser con dimensiones de 1.000 a 2.000 m2 cada uno, de mayores extensiones estan sujetos a los viveros que causarían choques mecánicos con la consecuente mortalidad de las larvas.
Después del surgimiento de organismos constituyentes de zooplancton, se hace una selección de los mismos con el uso de insecticidas; Dipterex (1 ppm), Folidol, etc., eliminando los copépodos y cladóceros; los cladóceros son consumidores en potencia de fitoplancton, alimento substancial de los rotíferos y los copépodos que son predadores de las larvas de peces. Tampoco pueden por su tamaño ser ingeridad porlarvas de poca edad, pues la boca delas mismas no poseen la bertura suficiente para esa función. Los copépodos constituyen también predadores de rotíferos.
Una manera de eliminar los organismos predadores de larvas de Coiossoma, es el uso de cal viva, sin tener que sufrir hidratación. De esta forma, el cuidado que debe tenerse en el momento de su adquisición debe ser enorme; la cal hidratada no causa ningún efecto en los predadores de larvas de peces.
La cantidad de cal usada es aproximadamente de 200 a 400 g / m2, esparcida en el lecho húmedo del vivero. constatada la eliminación de predadores (ninfa de Odonata, disticida, rantara, peces, etc.) el residuo de cal podráser eliminado haciendo un lavado del viero antes del relleno normal del mismo. con la cal efectunando la eliminación del zooplancton y pasado el efecto residual de la misma, se podrá efectuar la inoculación de rotíferos capturados en otros viveros, filtrados en mallas de 60 a 80 micras. En poco tiempo estará restablecida la fauna planctónica del vivero.
La densidad es, generalmente, entre 100 a 100 larvas/m2. Debe tenerse todo cuidado con cantidades excesivas de larvas, pues eso podría implicar en una reducción del crecimiento de las mismas causado por el poco volumen alimenticio. También el exceso de larvas, puede traer consigo el consumo exagerado de oxígeno, el de la fauna planctónica que favorecería el aparecimiento de “blooms” de algas nocivas. Constada esa densidad elevada, debrá efectuarse previamente preparados para recibirlos.
Algunos criadores prefieren alimentar a los pequeños alevines después de los seis días en los mismos viveros, pero la mayoría prefiere hacerlo después de completar de los seis días en los mismos viveros, pero la mayoría prefiere hacerlo después de completar el mes estabulado. Se usa una ración finamente molida, con alto poder proteico (42%) que puede ser colocada en determinados puntos del vivero, inicialemente en márgenes humedecidos.
La aplicación deberá ser varias veces al día, siempre con el cuidado de no excederse para evitar poluciones con el vivero. Usase también cuando se retiran las larvas de las incubadoras, la yema de huevo cocida liquidificada para enjuagar el vivero, ello causará el mismo efecto explicado ya anteriormente.
Después de una semana de vida en el vida en el vivero, las larvas ya estarán aptas para alimantarse con organismos mayores; a esa altura o nivel, la fauna de rotíferos ya deberá estar bastante reducida por la acción de los peces, bien como por la presencia de copépodos.
Cada 15 días, se deberá realizar la captura de los peces en el vivero, a fin de certificar su estado nutricional, como también el posible ataque de parásitos.
Da Silva, A.B. 1981, Cultivo de Espécies Nativas de Aguas Cálidas. Parte 1. Instituto del Mar del Perú. FAO, Proyecto PDUD/FAO-PER/76/022. Traducción y Edición del Editor Científico A. Landa C. Callao-Perú.
Da Silva, A.B.; Sales, A.C. y Moura, J.H.S. 1987, Relatório sobre treinamento operacional em Psicicultura na Hungria. DNOCS, 2a. Directoria Regional. Datilografado. 13pp.
Bardach, J.E.; Ryther, J.H. y Mc Larney, W.O. 1973, Aquaculture. The Farming and Husbandry of Freshwater an Marine Organisms. Wiley Interscience. A division of John Wiley & Sons, Inc. USA.
Castagnolli, N. y Cyrino, J.E.P. 1986, Piscicultura nos Trópicos. Editora Malone.
Huet, M. 1970, Text Book of Fish. Fishing News (Books). Translated by Henry Kahn. London, England.
Santos, E. 1962, Peixes da Agua Doce. Zoologia Brasílica II. Briguiet & Cia. Editores. Rio Rio de Janeiro. 2a. Edidiçâo.
Woynarovich, E. y Horvath, A. 1983, Propagaçâo artificial de peixes de águas tropicais. Manual de Extensâo. FAO/CODEVASF/CNPq. Traduçâo Vera Lúcia Mixto Chama. Brasília.
(Fernando Alcántara Bocanegra)2
La reproducción inducida de peces reofílicos en la región de la Amazonía peruana, ha cobrado mucho interés durante los últimos años, debido al desarrollo que está alcanzando la piscicultura de las especies nativas. A la fecha, se ha logrado inducir la reproducción de boquichico, Prochilodus nigricans (Pezo y Sicchar, 1979; Eckman, 1980; Alcántara, 1982; Ruiz et al. 1985); sábalo, Brycon sp (Eckman, 1980); gamitana, Colossoma macropomum (Alcántara, 1985) y paco Colossoma brachypomum (Alcántara y Guerra, 1986). El grado de avance es variado, siendo Alcántara y Guerra (1986) quienes lograron un avance significativo en la producción se semilla de gamitana y paco para el cultivo.
El éxito en las operaciones de reproducción inducida, está determinado por factores inherentes al pez así como por factores externos. Entre los primeros estan, el estado nutritivo del soma y el estado de desarrollo gonadal, aspectos primarios que determinan la calidad de los productos sexuales. Entre los segundos estan, el tipo de hormona necesaria, la dosis adecuada, los cuidados en el manejo de los reproductores a través del tratamiento hormonal.
El presente trabajo tiene por objeto efectuar una síntesis de las normas y procedimientos generales de la reproducción inducida de las especies reofílicas, con la finalidad de orientar los operativos de producción de semilla de las especies de interés para el cultivo en la amazonía peruana.
No se pretende hacer un documento definitivo, ni que el mismo cubra todo el conocimiento sobre los asuntos tratados. La intención es la de proponer una guía práctica y accesible a todos aquellos que pretenden dedicarse a la producción de semilla, por medio de la reproducción inducida.
Se ha omitido los aspectos de la fisiología de la reproducción intencionalmente, por lo que consideramos necesario sugerir que para fines experimentales se revisen estos aspectos que han sido tratados con amplitud, por diversos autores, tales como: Pickford y Atz (1957), Clemens y Sneed (1962), Harvey y Hoar (1979), Woynarovich y Hovath (1981), etc.
2 Instituto de Investigación de la Amazonia Peruana, Iquitos-Perú
El diámetro de los ovocitos debe ser conocido para todos los estadios de madurez de una especie en particular, elaborándose un “atlas” del desarrollo de los mismos. El diámetro de los ovocitos puede ser usado adecuadamente como un indicador del estado de maduración.
se extraen los ovarios de la cavidad abdominal;
se cortan logitudinalmente sus membranas en toda su extensión
se colocan los ovarios en solución Gilson (1:3). Ver anexo;
después de 15 minutos se agita fuertemente el frasco para que ocurra el primer fraccionamiento de la masa de óvulos;
se deja los ovarios en Gilson por varias horas, agitando frecuentemente el frasco hasta que se produzca la separación de las membranas, para no dificultar la limpieza del material;
los ovarios disociados se transfieren a una placa de Petri, o un recipiente adecuado para retirar las membranas mediante una pinza o un pincel;
la masa de ovocitos disociados se transfieren a una solución de alcohol 70%;
se lavan los ovocitos varias veces en alcohol 70% para eliminar todos los residuos de tejidos;
se conservan los ovocitos en alcohol 70%
se homogeniza la masa de ovocitos;
se toma una muestra mediante una pipeta “Stempel”;
se lleva la muestra a observación haciendo uso de una lupa con ocular micrométrico;
se mide el diámetro de los ovocitos agrupándolos en intervalos de clase de 50u;
se calcula la frecuencia relativa (%) de los ovocitos para cada clase de diámetro y se lanzan los resultados en gráficos: abscisa, clase de diámetro, ordenanda, frecuencia relativa por clase. Este procedimiento debe efectuarse por cada individuo.
Nota: El análisis de tales gráficos nos proporcionan información sobre el grado de desarrollo de los ovarios (la moda más avanzada corresponde al grupo de ovocitos más desarrollados). Adicionalmente nos proporcionada información sobre el tipo de desove de la especie en cuestión (el nímero de modas indica los lotes de ovovcitos en desarrollo en distintas fases). Nash y Shehadeh (1980), Vazzoler (1982).
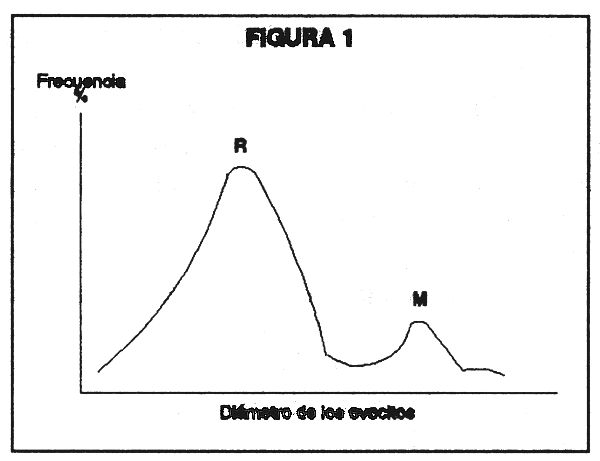
Figura 1. Distribución de frecuencia del diámetro de los ovocitos de la especie.
R = Lote de reserva
M = Lote de maduración
ediante biopsias practicadas a través de la pared abdominal o del oviducto, se toman muestras de ovocitos de la porción media del ovario;
e lava la muestra en suero fisiológico;
e preserva la muestra en una solución de formalina 1% en cloruro de sodio 0.6%;
se llevan a observación en una placa de Petri;
se efctuán las mediciones del diámetro de los ovocitos mediante la lupa con ocular micrométrico;
se procede como en el paso “m” del procedimiento anterior;
la moda del diámetro medio de los ovocitos, nos indicará el estado de madurez de la especie en cuestión, comparando tales observaciones, con un cuadro de distribución de frecuecias del diámetro de la especie, determinado en una época de maduración anterior.
A través de las diferencias fases de desarrollo gonadal, los ovocitos muestran su núcleo en posición centra o periférica, Agostinho et al. (1982). Para fines prácticos, un ovocito con su núcleo en posición central se considera inmaduro o en maduración y en posición periférica, se considera maduro.
Para la observación de la posición del nícleo, se sigue el siguiente procedimiento:
mediante biopsias del ovario, practicadas por vía intraperitonal o genital, se toman muestras de ovocitos;
se lavan los ovocitos en suero fisiológico;
se los coloca en solución por unos minutos (ver anexo);
se llevan a observación.
Este es un criterio subjetivo y ha sido empleado por muchos investigadores. El éxito en la selección según este método estásupeditado a la experiencia y habilidad del operador.
En la selección de las hembras se tiene en cuenta el grado de desarrollo de la barriga y en algunos casos, la dilatacción de la papila genital, además de la observación anterior.
En la selección de los machos se tiene en cuenta la emisión de esperma por presión del vientre con dedos, en la región genital.
Las dosis pueden ser preparatorias o estimulantes y definitivas o desencadenantes. Las dosis desencadenantes son de mayor concetración. El número de dosis estimulante y desencadenantes varía según los autores, no obstante se considera que el menor número de dosis, además de facilitar el trabajo, disminuye las posibilidades de que los peces reproductores se perjudiquen o lleguen al “stress”. En un tratamiento prolongado, de tres a cuatro días, es frecuente observar problemas de micosis (Saprolegnia).
La administración de glándulas hipófisis se realiza en términos de números de glándulas por unidad de peso (Fontenele, 1959; Pezo y Sicchar, 1979; Eckman, 1980; Da silva, 1981; Alcántara, 1983; etc), entérminos de porcentaje de glándula (Bermúdez et al. 1979), o en términos de miligramos por unidad de peso (Alcántara, 1985).
En la tabla 1 se señalan algunas dosis empleadas según autores.
Los aspectos filogenéticos no parecen tener importancia. En las prácticas de piscicultura se ha demostrado que muchos peces responden bien a la administración de extractos hormonales heteroplásticos y a la carpa, Cyprinus carpio, se ha señalado como un donador universal (Kazanskii, 1951, revisado por Pickford y Atz, 1957). En las especies nativas de interés para la piscucultura, se ha demostrado que aceptan bien los extractos heteroplásticos de glándula pituitaria, como inductores gonadotróficos, como se observa en la tabla que antecede.
Se ha utilizado con éxito, diferentes gonadotrofinas para la reproducción de los peces. Entre ellas, se han utilizado gonadotrofinas de origen y su uso humano, así como veterinarios. Estos productos se los adquiere en el mercado local con los nombres comerciales de Pregnyl, Anterón y otros.
| ESPECIE RECEPTORA | ESPECIE DONADORA | DOSIS 1 2 3 4 5 | AUTOR |
|---|---|---|---|
| Prochilogus argenteus | idem | 0.1 0.2 0.3 0.41 | Fontenele 1959 |
| Prochilodus nigricans | idem Abramisbrama | 1.45 id id2 | Eckman 1980 |
| Prochilodus nigricans | idem | 0.5 1.0 1.52 | Alcántara 1982 |
| Colossoma macropomum | Cyprinus carpio | 0.5 1.0 1.5 3.03 | Alcántara 1985 |
| Colossoma macropomum | Arapaima gigas | idem | Alcántara 1985 |
| Colossoma macropomum | Prochilodus nigricans | 1.2 2.0 4.04 | Da Silva 1981 |
Nota:
1 Número de pituitaria
2 Glándulas/kg
3 mg/2kg
4 Glándulas/2kg
Adicionalmente, se ha utilizado con éxito un análogo de la hormona liberadora luteinizante (LH-RH análogo) que se comercializa con el nombre de Conceptal, (Tabla 2). Ruiz et al. (1985).
Un tercer método combina los dos anteriores, así por ejemplo. Da silva (1981) recomienda utilizar las siguientes dosis para inducir la reproducción de gamitana, Colossoma macropomum, con glándulas pituitaria de boquichico, Prochilodus nigricans:
1a. dosis: 1 hipófisis/2kg de peso corporal
2a. dosis: 5U.I./g de peso corporal
3a. dosis: 5U.I./g de peso corporal
La dosis de hormona necesaria puede variar notablemente de un pez a otros dentro de una misma especie y según la técnica que se emplee. La dosis efectiva depende del grado de "preparación: de la hembra, de su edad, talla y sensibilidad. Woynarovich (1981).
Es preciso señalar además, que la dosis varía con los sexos. Tratándose de machos que prestan esperma flúido en el momento de la selección, no se requiere de dosificación. En todo caso, la dosis es menor que para las hembras.
| ESPECIE RECEPTORA | INTRODUCTOR | DOSIS 1 2 3 4 5 | AUTOR |
|---|---|---|---|
| Prochilodus nigricans | Buserelina1 | 0.02 | Ruiz et al. 1985 |
| Prochilodus nigricans | GCH 2 | 5 | Ruiz et al. 1985 |
| Colossoma macropomum | GCH 3 | 0.3 0.3 0.3 1.5 3.0 - - - 0.55 0.45 | Saldaña y Ascón 1985 |
El vehículo puede ser suero fisiológico o agua destilada y en cada ocasión, se recomienda involucrar un volumen menor de un centrímetro de un cúbico. Harvey y Hoar (1979).
Determinada la dosis a administrar, se coloca la glándula hipófisi (entera o en polvo) en un mortero o cápsula de superficie lisa.
Se procede a moler el producto, mediante un pistilo suave, agregando una gota de agua destilada, hasta conseguir la homogeinización completa.
Se agrega agua destilada por gotas hasta conseguir concentrar el producto, cuidando de no emplear más de 1 cc.
Se succiona el producto mediante una jeringa hipodérmica.
Se elimina las burbujas de aire de la jeringa, para proceder a la inoculación.
En la preparación del extracto, algunos autores han centrifugado el producto (Fontenele, 1959; Alcántara, 1983), para inocular solamente el sobrenadante. Sin embargo, en las prácticas de campo, se ha eliminado este procedimiento.
Se ha utilizado tres vías de inoculación de los extractos hormonales: vía intracraneal, vía intraperotoneal y vía intramuscular. La vía intramuscular es la vía más utilizada y las inoculaciones se efectúan a nivel de los músculos dorsales delante de la aleta dorsal y sobre la línea lateral, adicionalmente puede inocularse en los músculos dorsales, por delante del pendúlo caudal.
Se sujetan los reproductores con el mayor cuidado posible y una vez elegida la zona de inoculación, se procede a levantar una escama levemente, para pasar la aguja por debajo de ella.
Se introduce la aguja inoculando el líquido de la jeringa.
Se procede a dar masajes con los dedos, en la zonas de inoculación por unos segundos, para evitar que el líquido inyectado regrese y se pierda.
Al comprobar que no regresa el líquido inyectando, se devuelven los reproductores al estanque de tratamiento hormonal.
Al iniciar la inoculación de un pez debe registrarse la temperatura del estanque de tratamiento hormonal y continuar el registro hasta la ovulación. Esto será muy importante para determinar el tiempo de ovulación de cada especie, el cual es altamente dependiente de la temperatura.
La administración de extractos hormonales gonadotróficos tiene por objeto desencadenar la ovulación en los peces.
La ovulación es un proceso complicado, que requiere varias horas y cuya duración exacta depende de la temperatura. Es posible dividir la ovulación en dos fases: preovulación propiamente dicha. Durante la fase de preovulación se completa el núcleo y el huevo absorbe gran cantidad de fúido (hidratación), alcanzando un tamaño casi igual al que tendrá en el momento de la ovulación. En el medio natural, este proceso se cumple durante la migración de reproducción y en condiciones controladas, luego de la administración de los extractos de glándula hipófica, en las operaciones de reporducción inducida. Sin embargo, si la hipofisación no da resultado, los huevos interrumpen su desarrollo en la fase y el pez puede morir por necrosis necrosis de los huevos, que pueden provocar un envenamiento interno. Woynarovich (1981).
El estrujamiento es la operación consistente en la obtención de los productos sexuales mediante suaves masajes del vientre, tanto de la hembra como del macho, durante los trabajos de reproducción inducida.
Una vez extraído el pez (hembra o macho) se procede a secarlo cuidadosamente con una toalla absorbente, manteniendo ligeramente inclinado al pez, con la cabeza hacia abajo, a fin de posibilitar la eliminación de agua de la cavidad bucal y región bronquial.
Una vez seco el pez, se sujeta firmemente y se procede a masajear suavemente la región ventral aplicando presión y avanzando desde la región pectoral hacia la región ventral. En esta operación, debe evitarse deslizar la mano, de otro modo se desprenderá las escamas de la región comprometida, perjudicando el estado general del pez. Esta precaución debe ser extremada tratándose de peces menores como el boquichico. Prochilodus nigricans y los sábalos, Brycon sp.
Los óvulos deben obtenerse únicamente con líquido ovárico y la prevención de evitar el contacto con el agua se debe a que esta acelera el tiempo de cierre del micrópilo, disminuyendo las posibilidades de fecundación. Por lo tanto, los óvulos deben recibirse en un recipiente seco y limpio.
Finalizando el estrujamiento de la hembra, se sigue el mismo procedimiento con el macho, efectuándose presión del vientre del pez a la altura de los testículos. Durante esta operación, debe evitarse la obtención de esperma con sangre ya que la misma limitará la viabilidad de los espermatozoides para la fecundación.
La fecundación debe efectuarse en seco, mezclando los productos sexuales suavemente con una pluma de ave.
El tiempo de viabilidad de los espermatozoides es muy breve y tratándose de gamitana, Colossoma macropomum, los espermatozoides son viables durante 1–2 minutos; sin embargo, este tiempo puede prolongarse durante unos minutos mediante la adición de carbamida (úrea). Woynarovich (1981).
Para la fecundación es preciso tener en cuenta que el tiempo de ovulación también es relativamente corto. En Prochilodus sp Woynarovich (1981), reportó sobremaduración al cabo de 20–30 minutos desde la ovulación, en el 50% de los óvulos.
Finalizada la fecundación se procede a lavar los huevos, eliminando los restos de sangre, esperma coagulado y escamas, luego se llevan los huevos a las incubadoras.
Tan pronto como los huevos toman contacto con el proceso de hidratación final se acelera y los huevos de dilatan hasta alcanzar, aproximadamente el doble de su diámetro, al momento de la ovulación.
La incubación debe efectuarse a flujo lento de manera que se posibilite un ligero movimiento de los huevos en la base de la incubadora. Debe evitarse que los huevos ocupen toda la columna de agua de la incubadora, señal que indicará un flujo excesivo que puede ser cause de la muerte de los huevos.
El período de incubación varía en función de la temperatura media del agua, entre 16 y 20 horas.
Son diversos los modelos de incubadora utilizados en la incubación de huevos de peces reofílicos, pero todos se basan en dos principios básicos: eliminación de los catabólicos NH3 y CO2 y provisión de oxígeno necesario a través del proceso de embriogénesis.
A través del proceso de incubación se registra la muerte de algunos huevos que se van degradando, esto aumenta la demanda de oxígeno disuelto en la incubadora, por lo cual no debe deternerse el flujo de agua.
Para fines de producción es necesario reportar información cuantitativa. En relación al número de óvulos se procede de la siguiente manera (Alcántara y Guerra, 1986):
Al momento del estrujamiento de la hembra se toma una pequeña muestra de óvulos (aproximadamente de un gramo).
Se pesa el total de óulos en una placa de Petri de peso conocido.
Se pesa el total de óvulos obtenidos (en seco).
Se agrega un poco de agua a la muestra para propiciar la hidratación final de los óvulos que aumentará de tamañ
Luego de diez minutos, se efectúa el conteo de los óvulos de la muestra.
Se efectúa el cálculo del número de huevos aplicando una regla de tres simple.
El número de larvas puede estimarse de acuerdo al método de Rothbard (1982):
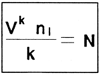
Donde k = Número de muestras (k 1)
n1 = Número de larvas en la muestra
V = Volúmen del recipiente de larvas
N = Número total de larvas
Luego de la eclosión, las larvas estan provistas de un saco vitelino constituido por material nutritivo que la larva utiliza para sus procesos metabólicos durante los primeros días, en los cuales no ingiere alimento. La alimentación se inicia entre los 3–4 primeros días, antes que se agoten las sustancias de reserva del saco vitelino y cuando esto se produce, las larvas pasan por un período crítico, dependiendo totalmente de la disponibilidad de alimento en su medio para satisfacer sus necesidades energéticas.
El alimento natural de las larvas lo constituyen el plancton, sin embargo, las larvas aceptan también alimento artifical diverso.
El alimento natural de origen planctónico de mayor importancia para las larvas es el zooplancton. En tal razón, la cría con alimento natural en condiciones controladas de laboratorio, implica la producción paraleta de fito y zooplancton; en este sentido, se han utilizado por ejemplo, Chlorella sp, y Brachionus sp, alga y rotífero, respectivamente.
En los programas de producción de semilla, sim embargo, se practica el tratamiento previo de los estanques de larvicultura, a fin de propiciar una rápida y abundante producción planctónica.
En la preparación de los estanques para larvicultura puede seguirse el siguiente procedimiento:
El primer día se realiza el vaciado del estanque.
Se aplica insecticida al fondo y paredes del estanque. Puede usarse NEGUVON (TRICLOROFORMO) a razón de 60g/120m2.
El segundo día se realiza el encalado y abonado del estanque. El encalado se realiza a razón de 900–1.050kg/día. Pagán et al. (1983). El abonado puede realizarse con gallinaza a razón de 160kg/ha. Una vez aplicada la cal y el abono, se pasa un rastrillo en el fondo del estanque par favorecer la mezcia adecuada de estos productos. Con este procedimiento se produce un “Pique” de rotíferos entre el séptimo y octavo días despues del inicio del llenado y luego cominezan a oscilar.
El tercer día se aplica abono verde, constituido por hierbas diversas que pueden cortarse en el perímetro de los estanques. La proporción es de 100 a 130kg por 10.000 alevinos sembrados. Después de 3–4 días de colocada el abono verde se le da vuelta y entre 7–10 días después se sacan las hierbas que no se han podrido. En estos casos debe tenerse cuidado con la disponibilidad de oxígeno disuelto.
El cuarto día se produce a la siembra de las larvas a razón de 2.000 larvas/m2.
Appelbaum (1976 en Rothbard, 1982) encotró que el comportamiento de la larva no depende de estímulos ópticos y otros estímulos y que las larvas empiezan a alimentarse con alimento artificial o natural si estos estan disponibles.
Según Pagán et al. (1983) en la cría de alevines de carpas chinas se emplea como alimento suplementario el salvado de arroz a razón de 1kg/10.000 alevines cada 5 días.
Otro alimento suplemetado de gran disponibilidad lo constituyen los huevos de gallina. En acuicultura los huevos de gallina son un excelente alimento para las larvas de peces, en forma de yema de huevos cocidos o en suspensión en agua. La yema de huevo puede ser utilizada luego de concinarla, debido a su especial textura granular.
Método A
Romper un huevo en un recipiente resistente al calor.
Batir el huevo hasta la homogenización (in licuador).
Agregar agua hirviendo (150cc por cada huevo) mientras se agita constantemente.
Dejar enfriar, 50g de huevos contienen cerca de 12g de materia seca.
Administrar por cucharadas directamente a las larvas.
Guardar lo sobrante en refrigeración.
Método B
Los invertebrados predadores en fase larval o adulta pueden desarrollarse juntamente con los organismos planctónicos, o infriltarse desde estanques contíquos.
Los predadores más voraces de las larvas y pequeños alevines son insectos. Entre los más perjudiciales estan las ninfas de Odonata. Sympetra sp,; adultos de Hemiptera (Belostoma sp., Repa sp., Notonecta sp.) y ninfas de Coleoptera.
Para erradicar estos predadores se aplica petróleo a los estanques durante la mañana, cuando no hay viento, en dosis 20–30 litros por hectárea. El tratamiento puede iniciarse 2–3 horas antes de sembrar las larvas y se repite 2–3 veces cada dos días. El aceite dorma una película muy fina sobre la superficie del agua y mata los insectos por asfixia en muy corto tiempo. Las larvas crecen rápidamente en el estanque y después de una semana (3–4 tratamientos), son lo suficientemente grandes para eludir los predadores. Rothbard (1982).
Desde el momento de la selección de los peces en el estanque de preparación de reproductores y a través de todo el proceso de tratamiento hormonal, debe tenerse especial cuidado para el manejo de los reproductores, evitándoles esfuerzos extremos, golpes, incidencia directa de los rayos solares en los ojos, etc., lo que puede ser causa de aparación de cuadros de stress en los peces y posterior regresión gonadal.
Asimismo, cabe señnlar que en todo momento deben tenerse presente las normas de asepsia, en especial con los materiales y equipos a emplearse en el proceso de preparación del extracto e inoculación.
REFERENCIAS BIBLIOGRAFICAS
Agostinho, A.A., Narahara, M.Y. y Godinho, H.M. 1982, Morfologia dos ovários de Plecostomus commersonii (Velenciennes, 1840). Osteichytes-Loricaradae: Desenvolvimiento dos ovocitos e escala de maturidade. 1. Rev. Brasil. Biol., 42 (1). Rio de Janerio- Rj, pp 2–6.
Alcántara, F, 1982, Ensayo sobre reproducción inducida de boquichico, Prochilodus nigricans, Agassiz 1829, en cautiverio. Inst. Mar del Perú. Laboratorio de Inquitos. Infrome interno.
Alcántara, F. 1985, Reproducción inducida de “ gamitana”, Colossoma macropomum, Cuvier 1818, en el Perú. Universidad Nacional de Trujillo. Facultad de Ciencias Biológicas. Tesis Doctoral.
Alcántara, F. y Guerra, H. 1986, Avances en la producción de alevines de gamitana, Colossoma macropomum y paco, C. Brachypomum por reproducción inducida. Inst. Mar del Perú. En prensa.
Da Silva, A.B. 1981, Cultivos de especies nativas de aguas cálidas. Inf. Inst. Mar del Perú N°. 82. Callao, Perú, pp 23–32.
Eckman, R. 1980, Reproducción inducida de Prochilldus nigricans (agassiz 1829) de el bajo Amazonas. Acuicultura. Compañía de Publicación Científica. El Servier, Amsterdam. 20: 381–383.
Fontenele, O. 1959, Injecting Pituitary (Hypophyseal) Hormones into Fish to induce Spawing. Publicación N°. 168. Série 1-C: 1–12.
Harvey, B.J. and Hoar, W.S. 1979, Theory and practice of induced breeding in fish. Ottawa, Ont. IDRC. 48p. ill.
Narahara, M. Y. 1983, Estrutura da população e reprodução de Rhamdia hilarii (Valenciennes, 1840) (Osteichthyes, Siluriformes Pimelodidae). Universidade de São. Paulo, Instituto de Biociências. Tese para obtenção do titulo de Doutro em Ciências. São Paulo, Brasil.
Nash, C.E. and Shehadeh, Z.H. Editors, 1980, Review of breeding and propagation techniques for grey mullet, Mugil cephalus, L. ICLARM Studies and Reviews (3) 87pp. International Center for Living Aquatic Resources Management, Manila, Philipines.
Pagán-Font, F.A., Zimet, J.y Botts, F. 1983, Cría de alevines y jaramugos de carpas chinas. Comentarios para una filmina. FAO.
Pezo, R. y Sicchar, L. 1979, Reproducción inducida por hipofisación en “boquichico” Prochilodus nigricans, Agassiz 1820. Universidad Nacional de la Amazonía Peruana. Tesis título biólogo. Iquitos, Perú, 33pp.
Pickford, G. E. and Atz, J. W. 1957, The physiology of the pituitary gland of fishes. New York Zoological Society, New York. 613pp.
Rothbard, S. 1982, Induced reproduction in cultivated Cyprinidis. The common carp and the group of chinese carp: The rearing of larvae and the primary nursing of fry. Bamadigeh. Vol. 35, N° 1, pp 20–32.
Ruiz, L., Sáenz, A., León, J. y Villanueva, C. 1985, Reproducción del boquichico Prochilodus nigricans, Agasisz, 1829) por medio de hormonas, Universidad Nacional Agraria. Fundación Internacional para la Ciencia de Suecia. Lima, Perú.
Saldaña, R.G. y Ascón, G. 1986, Ensayo sobre reproducción inducida de “gamitana”, Colossoma macropomum (Cuvier, 1981) con gonadotropina coriónica humana. Hidrobios x(1), pp 1–12.
Vazzoler, A.E.A. de Moraes, 1981, Manual de métodos para estudos biológicos de populações de peixes, reprodução e crescimento. CNPq. Programa Nacional de Zoologia. Brasília, Brasil. 106pp.
Woynarovich, E. y Horváth, L. 1981, Propagación artificial de peces de aguas templadas. Manual para extensionistas. FAO. Doc. Tec. Pesca (201), 187pp.
| 1. SOLUCION DE GILSON (Simpson, 1951) | |
| 100 ml alcohol 60% | |
| 880 ml agua destilada | |
| 15 ml ácido nítrico 80% | |
| 20 g bicloruro de mercurio | |
| 18 ml ácido acético glacial | |
| 2. SOLUCION SERRA | |
| 60% alcohol | |
| 30% formol | |
| 10% ácido acético glacial | |
| 3. SOLUCION DE FERTILIZACION CARBAMIDA - SAL (Woynarovich, 1981) | |
| 30 g de carbamida (úrea) | |
| 40 g de sal común (NaCl) | |
| 10 litros de agua | |
| Nota: La solución se añade en 10–20% del volumen de huevos. | |