(J.E. Vinatea) 3
En las últimas decadas se ha experimentado una gran dependencia del hombre en relación a los peces cultivados como una valiosa fuente alimenticia. En tal virtud, también se han incrementado los esfuerzos de los científicos y especialistas, para dominar las técnicas de reproducción y rápida propagación de alevines y jaramugos en estanques y en muchos cuerpos de aguas libres y/o controladas, como represas, embalses, atajados, jagueyes, etc., así como lagos, lagunas y ríos.
Naturalmente, se debe reconocer que el avance de la acuicultura en relación a la crianza de animales domésticos, bovinos, ovinos, conejos, aves y otros, es pequeño y reciente, es decir, hablando estrictamente de su desarrollo técnico - científico. No obstante, formas de acuicultura más o menos efectivas, ya eran practicadas por las civilizaciones chinas y egipcias desde hace más de dos mil años A.C., claro está, como una actividad ornamental fundamentalmente y una fuente subsidiaria de alimentos, en donde primaba el arte y la belleza como criterio básico.
3 Experto Principal de Capacitación. Proyecto FAO/GCP/RLA/075/ITA, Brasilia, Brasil.
Para la descripción de este capítulo, nos basamos en el trabajo de Donaldson, E.M. y G.A. Hunter (1983) quienes afirman que el primer estudio de control hormonal de la reproducción de peces se realizó en Argentina por Houssay, B.A. (1930), al tratar de incluir la ovulación en el bagre Cnesterodon decemaculatus, mediante inoculación intraperitoneal de glándulas pituitaria de Prochilodus platensis. Estas técnicas fueron rápidamente puestas en práctica en Brasil por Von Ihering y Azevedo, 1934: Von Ihering 1935, 1937) para inducir el desove de Prochilodus argenteus. Los resultados de los brasileños fueron seguidos con éxito en la Unión Soviética por Gerbilsku, 1938, para inducir el desove del esturión y con el desove inducido de especies de peces norteamericanos (Hasler et al., 1939, 1940). Donaldson, E.M. y G.A. Hunter, 1983, hacen referencia que todos aquellos estudios y los susiguientes fueron detenidamente revisados por G.E. Pickford y J.W. Atz, 1957 en su bien documentado tratado sobre la glándula pituitaria de los peces. A partir de entonces, millares de publicaciones han aparecido para informar los avances del proceso reproductivo de teosteos. G.E. Pickford, 1964); E.M. Donaldson (1977) y C.G. Swann y E.M. Donaldson (1980) y muchos otros autores más comunican sobre el control del proceso reproductivo, entre los que cabe resaltar estan: Pickford y ATz (1957), Atz y Pickford (1959), Clement y Sneed (1962), Donaldson (1973, 1975), Shehadeh (1975), Fontaine (1976), Harvey y Hoar (1979), Chondar (1980), Woynarovich y Horvath (1980), Pullin y Kuo (1981), Davy y Chovinard (1981), Sundararaj (1981), Lam (1982), Billard (1983) y Fostier y Jalabert (1982).
Es de todo conocido que existen en la naturaleza peces que se reproducen espontáneamente, tanto en aguas libres como en estanques, y otros que se caracterizan por su aparente inhibición de hacerlo en aguas confinadas, ya sea porque no encuentran el medio ni las condiciones favorables para el desove, o simple y llanamente, porque el cautiverio los estrese fisiológicamente, impidiendo como consecuencia la producción y liberación normal de hormonas sexuales estimulantes.
Donaldson y Hunter (1983), señalan claramente que hay dos razones fundamentales para que ciertas especies de peces de mucha importancia alimenticia y económica, alser mantenidos en cautiverio, no quieran reproducirse, como son:
Especies cultivadas fuera de su rango natural en donde las condiciones naturales no son favorables para completar su maduración sexual normal, ejemplo, la carpa forrajera, Ctenopharyngodon idella, el cual es nativo de China y el que viene siendo culticado en Eurpoa, América y el Sudeste Asiático.
Las condiciones ambientales en los estanques son disímiles de aquellas prevalecientes en el medio natural la época del desove. Los factores ambientales que actúan en contra del desove normal podrían inducir sobre respuestas fisiológicas específicas, o también fallar en la culminación del ciclo reproductivo normal, por ejemplo, salinidad inapropiada, temperatura, fotoperíodo, presión hidrostática y ausencia de un subtrato favorable para el desove. Alternativamente, el ambiente de cultivo podría inducir a una respuesta de estress generalizada en el pez que inhibe e incapacita el proceso reproductivo, como sucede con los siguientes factores: densidad, calidad del agua, tasa del flujo, temperaturas extremas, fotoperíodo y salinidad.
En algunas circunstancias, es posible alterar el ambiente de los estanques de los reproductores para permitir completar el desarrollo sexual y el desove normal. En otras situaciones resulta rutinarío la práctica para inducir la maduraión final, ovulación y espermiación mediante el tratamiento de hormonas.
Por otra parte, se conoce que la inducción hormonal es mayormente aplicada en aquellas especies reófilas y de aguas calmas, que al ser confinadas, presisan de elementos estimulantes para desovar y producir la cantidad suficiente de semillas de peces que se requieren para la práctica normal de acuicultura. Sin embargo, por razones de orden logístico, de disponibilidad de alevines para atender la producción seriada de peces en las granjas en cantidad y calidad de acuerdo a la demanda de consumidor, también se aplica la inducción de reproducción aun en las especies que desovan fácilmente en cautiverio, como sucede con la carpa común, Cyprinius carpio, y los salmonidos, Salmo irideus, S. gairdniri, Oncorhynchus sp, etc. La reproducción de tales especies cultivadas comunmente, estan restringidas a un período y estación determinados cuando las condiciones ambientales son óptimas. El tratamiento con hormonas puede ser utilizado para:
obtener gametos variables fuera de la estación normal de desove, y de ese modo, permitir la hibridación interespecífica de stocks genéticamente distintos que se presentan por tanto, épocas de maduración diferentes;
permitir la hibridación interespecífica de especies relacionadas pero que presentan diferentes estaciones de desove;
obtención de gametos en una época más temprana, y de esa suerte, se alargará el período de disponibilidad para criar a los alevines durante un tiempo más prolongado y con anterioridad a las actividades del estabulamiento, transplante o liberación. (Donaldson et al., 1981 a.b; Hunter et al., 1981);
mejorar la eficiencia de la producción gracias a la sincronización de grupos de reproductores para ovular y espermiar en épocas predeterminadas (Donaldson et al., 1981 a.b; Hunter et al., 1981);
facilitar la colección de gametos de reproductores silvestres en localidades remotas, en donde las facilidades para mantener a los adultos son mínimas;
minimizar las pérdidas de gametos atribuidas a la mortalidad antes del desove debido a la aceleración de la maduración en los reproductores cautivos, los que son mantenidos en las instalaciones del vivero a veces, bajo condiciones ambientales que son óptimas (Hunter et al., 1978, 1979, Sower et al., 1982);
maximizar la sobrevivencia de a pregenie mediante la mayor producción de gametos, fertilización e incubación bajo condiciones relativas de asepsia en lugar de practicar el cultivo en estanques semi naturales;
estimular el comportamiento de desove en un pequeño número de individuos, los que son estabulados con una gran cantidad de peces sin tratamiento, para inducir el desove y producir ovas con un tiempo conocido de ovulación para estudios experimentales como la ginogénesis o triplodía (Donaldson y Hunter, 1982; Refstie et al., 1982).
La reproducción en las hembras de teleosteos está controlada por el eje hipotálamo-pituitaria-ovario (Donaldson, 1973). Este mecanismo secuencial permite la intervención en varios niveles para promover o interferir en el proceso de maduración. Hasta mediados de la década del 70, Los procedimientos de la ovulación inducida en los peces estaban limitados a lo que se conoció como la técnica de la primera generación. Esta, estaba constituida por la hipofisación (Von Ihering, 1937), al utilizar inyecciones de extractos de pituitaria homoplástica y heteroplástica que contenían gonadotropinas. En los primeros años de la década del 70, esta técnica fue refinada por Donaldson et al., 1972; Donaldson, 1973 en producciones a escala experimental, piloto y finalmente de aplicación de gonadotropinas pisciarias parcialmente purificadas expresamente con el propósito de inducir la maduración y ovulación final de teleosteos. Durante la misma época, se obtuvieron desoves exitosos con substancias inductoras de origen animal, tales como la gonadotropina coriónica humana (HGC), ya sea sola o mezclada con extractos pituitarios de peces.
El tamaño y la complejidad de la molécula gonadotrópica lo hace difícil para ser obtenido sintéticamente en escala industrial dentro de un futuro cercano, a menos, que ella sea producida con la ayuda de la ingeniería genética en micro-organismos, como han sido recientemente producidas la hormona del crecimiento humano y la insulina.
Justamente la búsqueda de alternativas de la gonadotropina sintética en los años 70, ha conducido al desarrollo de técnicas de la segunda generación para la inducción final de maduración, ovulación y espermiación en los peces. Estas técnicas operan o en niveles más elevados del eje mediante el estímulo de la producción y/o liberación de gonadotropina en la glándula pituitaria (por ejemplo, anti-estrógeno y hormonas liberadoras de gonadotropina) o también ellos operan en niveles más bajos del eje, al suplir hormonas a los ovarios (ej., 172, 2013-dihidroporgesterona y prostaglandinas), las que podría normalmente ser estimuladas por gonadotropinas endógenas o exógenas. Estos inductores de la ovulación de la segunda generación son todos moléculas pequeñas relativas a la gonadotropina, y por eso mismo, pueden ser producidas sintéticamente. También se espera que ellas sean relativamente libres de la especificidad de la especie. (Ver Fig 1, los posibles niveles de intervención en el eje hipotalámico-pituitario-ovárico) de Hoar, Randall y Donaldson, volumen IX, FISH PHYSIOLOGY, 1983.
Fig.1
Niveles de intervención extrerna en el eje hipotálamopituitaria-ovario, que
pueden ser utilizados para inducir la maduración y ovulación en teleosteos.
| HIPOTALAMO Hormona liberadora de gonadotropina (Gn RH) | Intervención exógena Antiestrógena Dopamina Antagonística |
| GLANDULA PITUITARIA Gonadotropina (GtH) | GnRH y GnRH (análogos) |
| OVARIO | Extractos pituitarios Preparaciones GtH |
| OOCISTO Maduración final Ovulación | Progestenos Corticoesteroides Prostagladines Catecolaminas |
| OVA Ovulos |
La secreción de gonadotropina en teleosteos como en vertebrados superiores, es regulado por la retroalimentación de esteroides gonadales. En la hembra de bagre Heteropneustes fossilis, inyecciones de estradiol y/o testosterona inhibían la vitelogénesis y causaban atesia de los oocitos maduros (Sundarraj y Goswani, 1968), y el estradiol, el crecimiento compensatorio ovárico después de una ovariosectomía unilateral (Goswani y Sundararaj, 1968). El el salmón Oncorynchus nerka, la gonadoctomía bilateral causaba la activación de gonadotropos (Mc Brile y Van Overbeeke, 1969), el que se hizo reversible por tratamiento con estradiol cepionato (Van Overbeek and Mc Bride, 1971). La presencia de este control retroalimenticio negativo de secreción de gonadotropinas por el estrógeno, condujo a pruebas de desove con antiestrógenos. Los antiestrógenos son compuestos sintéticos que son capaces de competir con el estrógeno al alcanzar lugares con los receptores de estrógeno. Dos de estos compuestos nonesteriodales de las series de trifeniletileno, que han sido usados en vertebrados superiores e inferiores son el citrato clourifeno y tamoxifeno. La inducción con éxito de la ovulación en la mujer con clourifeno fue informado por Greenblatt et al. (1961) y con tamoxifeno por Klopper y Hall (1971). La acción de estos anestrógenos no ha sido debidamente aclarada en los vertebrados superiores.
Los primeros estudios de la ovulación inducida con un antiestrógeno en teleosteos, fueron conducidos en el golfish (Carassius auratus). Las hembras grávidas mantenidas a 13°C y 16 horas de fotoperíodo fueron diariamente inyectadas intraperitonealmente con 1 mg/kg-10mg/kg de clourifeno en 0.6% de salinidad. En ambos grupos, 90% de los peces ovularon entre 1 a 4 días después del tratamiento, sin embargo, ninguna del grupo de control ovuló (Pandey y Hoar, 1972). Los goldfishes hipofisectomizados, 4a 7 horas antes de la inyección dejaron de ovular luego del tratamiento con clourífeno.
La inyección en la locha Misgurnus anguillicaudatus con clourífeno, 1 a 10mg/kg diariamente a 17°–22°C ovuló entre 2 a 4 días en dosaje bajo, y en 2 a 3 días con dosage alto.
Donaldson et al (1978b, 1981b) examinaron la factibilidad de inducir la ovulación final en el salmón del Pacífico con el antiestrógeno tamoxifeno. El salmo cho (Oncorynchus kisutch) recibió una primera inyección de 0.1 mg/kg de gonadotropina parcialmente purificada de salmón (SG-G 100), seguida en el tercer día por inyecciones intraperitoneales de 1 a 10mg/kg de tamoxifeno en aceite de maní. Los óvulos de ambos grupos tratados sufrieron la ruptura de la vesícula germinativa (GVBD) y 85% de ovulación, comparadas al 84.6% (GVBD) y 77% de ovulación en el grupo de control.
Hormona liberadora de hormona luteinizante (LHRH). El descubrimiento de que la producción y liberación de gonadotropina de la pituitaria es regulado en los mamíferos por un péptido que se origina en el hipotálamo, creó una nueva vía de investigación par el control de reproducción en los teleosteos. El decapéptido de la LHRH fue aislado y caracterizado primariamente de hipotálamo de los cerdos y ovinos en 1971 (Schally, 1978; Guillemen, 1978). La secuencia del mismo ácido de la gonadotropina de mamíferos (LHRH).
| plro | Glu- | Hls- | Trp- | Ser- | Tyr- | Glu- | Leu- | Arg- | Pro- | Gly- | NH2 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Muy pronto se hizo evidente que este péptido carece de especificidad para las especies (Schally y Kastin, 1972).
Basándose en los experimentos llevados a cabo con el factor de liberación-inhibición de gonadotropina (GRIF) en el goldfish Peter et al. (1978) Peter y Paulenco (1980) Peter (1982), surgieron otro mecanismo para inducir la ovulación en aquellos teleosteos en donde GRIF está presente. La catecolamina, dopamina y sus antagónicos como la apomorfina, reducen el incremento de concentración en el plasma de las gondotropinas asociadas con las lesiones preópticas, lo que sugiere que GRIF en el goldfish podría ser dopamina (Chang and Peter, 1982, 1983a; Chang et al., 1983), aun más, inyección de pimozide, un anatagónico de dopamina en un goldfish intacto, causó un aumento en la concentración de plasma de gonadotropina (Chang y Peter, 1982, 1983a).
Ellas son glicoproteínas hormonales de origen pituitario o placentario, que estimulan su desarrollo y función.
Las gonadotropinas utilizadas para inducir la ovulación en los peces pueden ser de dos orígenes: de mamíferos y/o de peces. Las primeras pueden ser de naturaleza pituitaria como la hormona luteinizante (LH), y hormona estimulante del folículo (FSH)o de origen placentario, tal como la gonadotropina coriónica humana (HCG) y la gonadotropina del suero de yegua (PMSG). Las preparaciones de gonadotropina de peces pueden subdividirse según el grado de purificación variando desde los extractos acuosos de glándulas pituitarias completas usadas en los procedimientos tradicionales de hipofisación mediante el polvo de pituitaria en etanol, hasta las gonadotropinas parcialmente purificadas preparadas por filtración del gel, con o sin intercambio de ión cromatográfico, o por afinidad de cromatografía de concanavalina A-sefarosa.
La gonadotropina de teleosteos tiene un peso molecular de 30.000(Burzawa-Gerard, 1971, 1974; Donaldson et al., 1972b; Idler et al. 1975a), y consiste de dos unidades (Donaldson, 1973; Burzawa-Gerard et al. 1976; Pierce et al., 1976; Lo et al., 1981) al igual que las gonadotropinas de otros vertebrados (Licht et al, 1977). Además de esta gonadotropina que normalmente contiene carbohidratos, puede existir una segunda hormona pituitaria en los peces de bajo contenido en carbohidratos presentan dos funciones gonadotrópicas, tal como la habilidad de acelerar la captación de vitelo en el oocito durante la vitelogénesis (Idler et al, 1975a; Idler y Ng, 1979; Ng y Idler, 1978b, 1979).
Como se indicara anteriormente, en los primeros tiempos eran empleados extractos de glándulas pituitarias homoplásticas y/o heteroplásticas. Las ventajas de esa técnica eran:
su simplicidad, requeriendo muy poco material y capital;
no requiere de un almacenamiento refrigerado;
el doseje puede ser facilmente calculado basándose entre las relaciones del peso corporal del recipiente y donador; y
otras hormonas presentes en el extracto pueden tener un efecto sinergético.
Las desventajas:
la falta de potencia de estandarización;
el pez donante que generalmente es de igual o menor valor que el recipiente, debe ser muerto en el lugar de desove para extraerle la glándula pituitaria;
el pez podrá desarrollar una reacción de inmunidad a la gonadotropina y otras proteínas del extracto en un determinado período de tiempo, especialmente en el caso de pituitarias heteroplásticas;
las hormonas no gonadotrópicas existentes en el extracto crudo, podrían causar efectos delectéreos y negar o modificar el efeto de la gonadotropina; y
es concebible, que la inyección de un extracto fresco de pituitaria podría transmitir alguna anfermedad del donante al recipiente. En las carpas comunes, las cabezas conservadas por 24 horas a 4°C, antes de extirparles las pituitarias, no desarrollan la potencia gonadotrópica, lo mismo, pituitarias obtenidas de peces maduros pequeños presentaron el mismo contenido gonadotropina como los peces más grandes. (Yaron et al., 1982).
La actividad de hipofisación fue debidamente revisada por Harvey and Hoar (1979); Sundararaj (1981); Rothbard (1981); Lam (1982), El proceso normal incluye 2 inyecciones intramusculares de extractos acuosos de pituitarias. La secuencia de esta actividad consta de los siguientes pasos:
selección de las especies donantes y grado de madurez;
evaluación de madurez del recipiente;
técnica de homogenización y temperatura;
separación del extracto de los residuos por centrifugación, filtración o sedimentación;
adición de otros componentes, ejemplo, glicerina para incrementar la viscosidad y de ese modo prevenir pérdida después de la inyección, o prolongar la captación;
localización de la inyección;
volumen de inyección;
temperatura del agua en el momento de la inyección;
división de la dosis, entre la primera (preparatoria) y la segunda (desencadenante);
hora del día cuando la primera inyección será suministrada;
intervalo entre la primera y segunda inyección;
determinación de la prontitud de la hora del desove;
uso de un anastésico; y
decisión entre el desove natural y/o la extrusión.
La existencia de este gran número de variables, ha significado que en la práctica ningún estudio con una sóla especie, o con varias especies hayan investigado todoas las variables relevantes.
Las variables de mayor importancia son:
especies donantes;
madurez de los desovantes;
dosage;
divisón del dosage;
determinación del tiempo; y
temperatura.
El próximo paso del procedimiento básico de hipofisación con extracto fresco de pituitaria, involucra el uso de glándulas pituitarias y extractos preservados. Las glándulas completas pueden ser deshidratadas y desgrasadas con polvillo de acetona fría, y luego almacenadas así completas o pulverizadas, o también las mismas, podrían ser liofilizadas o conservadas a -24°, o por debajo, durante varios años sin pérdida significativa de su potencia (Donaldson et al, 1978a).
Alternativamente, puede prepararse un extracto acuoso de las glándulas pituitarias o del polvo en acetona y luego conservarlo en forma liofilizada, o también, en presencia de una substancia preservante como el glicerol. En este último caso, el material puede ser conservado en ampolletas de vidrio. La ventaja del polvo en acetona o de los extractos preservados, es de que ellos pueden ser preparados en forma homogénea a partir de una buena cantidad de glándulas pituitarias, y posteriormente estandarizadas por bio ensayos de una pequeña alicuota. Otras ventajas son, que las glándulas de los peces donantes pueden ser colectadas y procesadas en varias veces y en localidades, eliminando así la necesidad de tener que ser donante de la propia localidad donde se va a realizar la hipofisación. Las pituitarias disecadas en acetona fueron originalmente empleadas por von Ihering y Azevedo (1936) para desovar Astyanax taenistus y A. bimaculatus, habiendo continuado el procedimiento extensivamente (Pickford y Atz, 1957). La pituitaria de carpa discecada en acetona ha sido utilizada con éxito después de 10 años de conservación (A.D. Hasler, R.K. Meyer and W.K. Meyer, and W.J. Wisby, 1950 en Pickford y Atz 1957). Las glándulas de pituitarias frescas pueden colocarse directamente en acetona enfriada en hielo seco (Burrows et al., 1952; Palmer et al., 1954); empero, podría ser más conveniente congelar las glándulas pituitarias frescas en una capa de hielo seco en un depósito de isopor y luego, porceder al secado o al proceso de extracción en el laboratorio. El uso del hielo seco la necesidad de utilizar un equipo eléctrico de regrigeración en el campo. En general, se recomienda que la acetona sea cambiada dos o tres veces para asegurar la deshidratación y desgrasado completo.
Una alternativa al secado en acetona es hacerlo en alcohol absoluto (de Azevedo y Oliveira, 1939; Fontenele, 1955; Pickford y Atz, 1957; Ibrahim y Chandhuri, 1966; Chondar, 1980; Rothbard, 1981). El peso de la pituitaria seca y desgrasada es 13– 17%del peso húmedo (Pickford y Atz, 1957) y el peso de las glándulas pituitarias del salmón del Pacífico después de la liofilización es 17% del peso húmedo (E.M. Donaldson, no publicado).
Los extractos acuosos de pituitarias frescas y/o secas pueden ser conservadas con la adición de glicerina 2:1 (Ribeiro and Neto, 1944, Ibrahim and Chandhuri, 1966; Ibrahim, 1969 2,b) o por liofilización. En goldfishes, la inyección de soluciones que contengan más del 10% de glicerina causa inflamación peritoneal (Clemens y Sneed, 1962).
Los extractos de glándulas pituitarias preservadas en etanol y acído tricloroacético no han dado resultado satisfactorios (Bhowmick y Chaudhuri, 1968).
En general, para inducir la ovulación, se podría recomendar como solución práctica, el empleo de extractos de glándulas pituitarias frescas y/o preservadas de peces maduros.
Se han producido preparaciones puras y/o parcialmente purificadas de gonadotropinas de peces desde el inicio de la década del 70, y las mismas tienen una mayor especialidad en su actividad comparadas con las soluciones de hipófisis completas. Todos los procesos de purificación implican alguna pérdida de su activad gonadotrópica y como consecuencia, elproducto dinal tiene mayor actividad fonadotrópica por unidad de peso, pero contiene menor actividad total que el material inicial.
Sin embargo, el material purificado resulta de más utilidades en estudios de investigación que en la aplicación directa para la piscicultura. Naturalmente, desde el punto de vista de la investigación, se pueden anotar las ventajas siguientes:
son más o menos libres de otras hormonas pituitarias;
pueden ser estandarizadas por bioensayos in vivo e in vitro, ensayo radioreceptor y/o radioinmuno ensayo;
puede ser almacenado durante muchos años;y
son facilmente solubles en agua y suero sin dejar residuos.
Estas gonadotropinas purificadas total o parcialmente a partir de glándulas pituitarias de teleosteos, ha sido preparadas con el empleo combinado de procedimientos de extractos y cromatográficos, Entre ellos se incluyen a los provenientes de carpa común Cyprinus carpio (Burzawa Gerard, 1971, 1974; Idler y Ng, 1979), salmón chinook, Oncorhynchus tshawytscha (Donaldson et al., 1972b; Donaldson, 1973; Pierce et al., 1976), salmón chum, Oncorhynchus keta (Idler et al. 1975 a, b; Yoneda y Yamazaki, 1976; Idler and Hwang, 1978; trucha arco iris Salmo gairdneri (Breton et al., 1976), tilapias (Farmer y Papkoff, 1977). En resumen se han extraído extractos puros o semipurificados de muchas especies, carpin, anguila, lenguado, inclusive del pacu, Colossoma mitrei (Castagnolli y Donaldson, 1981).
En referencia al dosage de gonadotropinas parcialmente purificado requerido para inducir la ovulación, son importantes dos factores, primero: la especificidad de la especie; los salmónidos precisan de dosis menores de SE-G100 que algunos otros peces, por ejeplo, lisas, Mugil cephalus (Kuo et al., 1974); segundo: el estadio de madurez del ovario en el momento del tratamiento es muy importante. Cuanto más maduro esté el pez, menor será la dosis requerida, esta afirmación ha sido claramente corroborada en las lisas, habiendo sido correlacionada con el diámetro de los huevos (Kuo y Nash, 1975, revisado por NASH Y Shehadeh, 1980). En el lucio, la gonadotrofina del salmón fue mucho más efectiva cuando era suministrada en el mismo día de captura. La tasa de ovulación cayó desde el 96% al 40% después de tres días de la captura u fue atribuído a la degeneración de los oocitos asociados al stress sufrido durante la captura y confinamiento (De Montalembert et al., 1978b).
Estas gonadotropinas son de origen pituitario y/o placentario. LH y FSH se derivan de la primer, mientras que HCG y PMSG, provienen de la segunda fuente. Estas hormonas son disponilbes individualmente bajo sus nombres genéricos, así como bajo sus nombres comerciales y también como resultado de la combinación de gonadotropinas de origen pituitario y placental. el producto comercial conocido como Synahorin, se situa dentro de un preparado combinado. Estas hormonas de mamíferos presentan ventajas sobre aquellas derivadas de los peces, ellas son:
fácilmente disponibles;
pueden almacenarse por tiempo prolongado;
son uniformes y estandarizadas;
de costos competitivos;
eliminan la necesidad de sacrificar a los peces donadores; y
eliminan las tareas de colección, procesamiento y preservación de los extractos pituitarios (Shehadeh, 1975).
Sin embargo, desde 1975, se dispone de venta en el comercio, de extractos estandarizados de pituitarias con ventajas similares a las indicadas anteriormente. Estas pueden ser adquiridas en laboratorios de prestigio como los de Syndel y otros. En adición a estos productos comerciales que se encuentran en grado clínico, HCG puede ser preparado también en la localidad a partir de orina de mujer grávida (Katzman y Doisy, 1932; Pullin y Kuo, 1980), ha sido empleado HCG para inducir la ovulación en la carpa de la India Labeo rohita (Bhowmick, 1979). El aspecto negativo de HCG es de que el uso repetido de esa hormona puede hacer de inmunización. Los altos preparados de gonadotropinas placentarias derivadas de PMSG, ha sido utilizadas solas en algunas especies como Heteropneustes fossiles (Sundararaj y Goswami, 1966).
La LH ha demostrado ser un efectivo inductor de la ovulación en los peces (Sundararaj y Goswami, 1966, 1969; Arrand y Sundararaj, Kapoor, 1976, y no efrece ninguna ventaja de precio en relación al aspecto de costo y/o de efectividad.
La acción de las gonadotropinas a nivel del ovario se considera que se debe grandemente a las hormonas esteriodes (Jalabert, 1976). Se han llevado a cabo numerosos estudios para determinar la factibilidad de inducir la maduración final y ovulación con los esteriodes, en lugar de hacerlos con gonadotropinas u otras substancias de naturaleza hipotalámica. En general los esteroides, desde su síntesis hasta convertirloen un producto puro, con una duración de almacenaje de muchos años, podrán ser producidos en escala comercial.
Derivados de progesterona (Prog) 17-hydroxiprogesterona (17 Prog) y 17-hidroxi-20B-dihidroprogesterona (17-20B-Prog) fueron detectados en cantidades significativas en el plasma del salmón Oncorhynchus nerka (Idler et al. (1960), Schmidt and Idler (1962). Estas progestinas, en particular 17, 20B-Prog también mostraron ser efectivas inductoras de la maduración final (migración de la vesícula germinal y ruptura) en los oocistos de los teleosteos (Jalabert, 1976). Fue inducido con éxito en vivo la inducción en truchas maduras que contenían oocitos con la vesícula en el estadio subperiferal, utilizando 2mg/kg 17-20B-Prog, o Prog después de 9 días, aproximadamente el 80% de los 17-20B-Prog, 55% del grupo Prog, y 30% del grupo de control habián ovulado. La progesterona podría haber formado un substrato para 17, 20-Prog biosíntesis (Jalabert et al., 1976). Cuando las truchas arco iris fueron inyectadas dos veces con 3mg/kg 17, 20-Prog, 4–8 semanas antes del desove y antes de la migración de la vesícula germinal, 94% alcanzaron la maduración final, pero solamente el 24% ovularon. La ovulación fue nuevamente inducida en truchas que presentaban los oocitos con la vesícula germinal en posición periférica (Jalabert et al., 1980; Bry, 1981). Al monitor la gonadotropina del plasma indicó una caída en su concentración 24 horas después de la inyección, quizás, como resultado de una retroalimentación negativa, seguida de un incremento gradual, la que continuó después, especialmente en peces que no fueron sometidos a la estrusión.
Son en su mayoría de origen renal, aunque también pueden ser sintetizados en el tejido gonadal (Colombo et al., 1973). Las concentraciones de corticoesteroides y su tasa de secresión tienden a incrementarse en muchos teleosteos durante el desarrollo reproductivo y el desove (donaldson y Fegerlund, 1970; Fagerlun y Donaldson, 1970; Katz y Eksein, 1974; Wingfield y Grimm, 1977; Cook et al., 1980). El primer empleo que tuvo éxito fue al inyectar corticoesteroides al Misgurnus fossilis “locha”, en la que aplicó una simple dosis de Img de DOCA/pez y se logró inducir la ovulación (Kirshenblatt, 1952, en Pickford y Atz, 1957, Kirshenblatt, 1959). También se ha inducido la ovulaciòn con DOCA en el bagre de la India que había sido hipofisectomizado (Ramaswami, 1962; Sundararaj y Goswami, 1966, 1972). En un estudio posterior, bagres intactos mantenidos a 25°C empezaron a ovular 6 horas después de una sóla inyección de 5mg DOCA por pez, comparados a 8 horas despés de la inyección de LH, acetato de cortisol y acetato de cortisona, fueron igualmente efectivos en bagres con 25 mg/pez (Sundararaj Gaswam, 1966). El bagre Claria lazera fue inducido para reproducirse en estanques mediante inyecciones intraperitoneales de hembra con 50 mg/kg DOCA suspendido en aceite (Hogendorn, 1979).
La dosis de 10mg de DOCA resultó más efectivo que 1000 UI de GCG, un tratamiento combinado de 300 UI de HCG seguido después de 1 día por 5mg de cortisol demostró ser tan efectivo como 10mg de cortisol y mucho más efectivo que HCG sola. La inyección de cortisol o de HCG acrecentó tanto el contenido de agua como la concentración de sodio en el ovario (Hirose y Ishida, 1974b). Efectos similares han sido registrados en Tilapias después de recibir inyecciones de corticoesteroides. En cambio, en carpas las inyecciones de DOCA a 1mg/kg fueron inefectivas (Jalabert et al., 1977).
Los corticoesteroides son indiscutiblemente eficaces para inducir la ovulación en la mayoría de los teleosteos cuando ellos son suministrados en dosis suficientemente altas solas y/o combinadas con gonadotropinas.
Las concentraciones del estrógeno en el plasma de los peces teleosteos hembras declina después de completarse la vitelogénesis y antes de la maduración final y ovulación (Wingfield y Grimm, 1977). Esta disminución en la concentración de estrógeno coincide con el incremento de concentraciones de 17-20B-Prog en el plasma, esto podría sugerir que los estrógenos podrían ser inapropiados para la inducción de la maduración final y ovulación. Esta está amparada en base a los datos encontrados en la maduración final in vitro, que indicaron que 17B-estradiol inhibe ligeramente el efecto de la gonadotropina (Jalabert, 1975, 1976). Sin embargo, en Tilapia nilotica 17B-estradiol a 190 mg/kg aumentó la concentración de sodio en el ovario e indujo la ovulación en 66% de las hembras. Administraciones de estrona o estril en dosis superiores de 65 a 245 mg/kg fallaron en inducir la ovulación (Baliker e Ibrahim, 1979). No fue de utilidad en la carpa forrajera ni en la carpa plateada el intento de inducir la ovulación empleando el estrógeno sintético, el dispropianato estilbestrol en combinación con PMSG (Brandt y Schoonbee, 1980).
Los andrógenos estan presentes en las hembras de teleosteos, pueden inducir in vitro la ovulación final (Goetz y Bergman, 1978; Iwamaysu, 1978), y puede bajar la dosis media efectiva para inducir in vitro la maduración final de la trucha arco iris (jalabert, 1975, 1976).
Estas están involucradas en el ruptura folicular de los peces (Jalabert y Szollosi, 1975; Kagawa y Nagahama, 1981).
De varias prostaglandinas probadas, la PGF2 resultó comunmenete la más efectiva. La indometación, un agente anti-inflamatorio que bloquea la síntesis de la prostaglandina, inhibe la ovulación. Naturalmente esta inhibición puede neutralizarse con el suministro de prostaglandina exógena (Stacey y Pandey, 1975; Kapur, 1979). En el plasma del goldfish se incrementaron los niveles de PGF seis veces después de la inducción de la ovulación a base de HCG (Fanfford), 1979, en Stacey y Goetz, 1982). No obstante, los resultados prometedores en los estudios experimentales, pocos investigadores han intentado usar las prostaglandinas para inducir la ovulación como rutina práctica. En bagre Heteropneustes fossilis, inyecciones diarias de PGE o PGF2 (100mg/pez con 41 a 47g de peso corporal) dió como resultado ovulaciones del 97% después de 5 a 6 días de tratamiento.
Las prostaglandinas tienen un evidente potencial como inyecciones desencadenantes después de haber tenido la acción de una inyección preparadora. En la trucha arco iris, los oocitos, en los cuales la inducción final de maduración había sido aplicada in vitro, ovularon in vitro utilizando PGF2 (Jalabert et al., 1978b). El hecho de que las prostaglandinas estan involucradas en la regulación central del comportamiento de desove, puede permitir estimular el desove natural bajo condiciones de cultivo.
Muchas hormonas, además de las mencionadas y discutidas, previamente juegan un rol en la reproducción (Fontaine, 1976), estas, inclueyn las catecolaminas, calcitonicas (Wats et al, 1975), las hormonas tiroides, las hormonas de la urohipófisis (Lederis, 1972), la hormona del crecimiento y la prolactina. Sin embargo, existe notoria diferencia entre una hormona que es conocida y/o sospechada acción directa o indirecta en uno o más aspectos sobre el desarrollo de la reproducción, y la factibilidad del empleo de la hormona como una aplicación práctica y de rutina.
En el caso de las catecolaminas, han demostrado su capacidad de inducir in vitro la ovulación de los oocitos de truchas que habían alcanzado la maduración final in vitro. La potencia de las catecolaminas probadas estuvieron en el orden epinefrina - fenilefrina - isoproterenol. El tiempo de respuesta fue de 20–24 horas en 15°C comparado entre 18 a 20 horas para PGF2 (Jalabert, 1976). Los inhibidores de los órganos (lugares) adrenergéticos previnieron el efecto de las catecolaminas en la ovulación. Jalabert (1976) propuso que las catecolaminas podrían causar la contracción folicular directamente y más aún por estímulo de la prostaglandina, la síntesis y/o la liberación. Se han hecho algunos ensayos invivo con las catecolaminas aplicadas a truchas de arroyo Salvelinus fontinalis, en proporciones de 100mg de epinefrina cada dos días durante 4 semanas notándose en consecuencia la aceleración del desarrollo sexual en machos y hembras, (Strand, 1958).
Las hormonas tiroides han sido consideradas desde hace mucho, por tener un rol importante en la reproducción de peces (Fontaine, 1976). En el esturión, Acipenser stellatus, los estudios en laboratorio indicaron que las hembras maduras alcanzan la maduración final y ovulación cuando eran mantenidas a temperatura baja. Inyecciones de triyodotironina (T3) juntamente con el extracto de pituitaria facilitó la maduración y ovulación.
En los peces machos, el desarrollo testicular está regulado por el eje hipotalámico-pituitario-testicular. La estructura, desarrollo y la endocrinología en los peces teleosteos fueron revisados por Crier (1981), Nagahama et al. (1982), Billard et al, (1982). El rango de hormonas que pueden inyectarse para la espermatogénesis y/o la espermiación es relativamente limitado comparado con la situación de las hembras. Sin embargo, el piscicultor tiene aún la opción de intervenir con las hormonas derivadas del hipotálmo, hipófisis y gónadas. Es mucho más fácil inducir a un macho inmaduro de teleosteos para desarrollar la vitelogénesis y la espermiación, debido a la simplicidad del control endócrino comparado con las hembras que no responden con tanta facilidad al tratamiento. En varias especies cultivadas, elmacho eyacula espontáneamente, pero en más de una especie, el macho que está en cautiverio se niega a eyacular o producir una pequeña cantidad de semen viscoso. Felizmente, es posible aumentar el volumen y la calidad del esperma con una sóla inyección de hormona. Si el macho es inmaduro y se niega a producir semen, habrá que inyectarle varias veces o implantar alguna hormona en el alimento peletizado para estimular la espertogénesis y subsecuentemente la espermiación.
Todavía es muy escasa la literatura sobre la espermiación inducida en teleosteos mediante el uso de LHRH o sus análogos. El deca y nonapéptido ha mostrado resultados positivos en anfibios. La espermiación ha sido inducida en la rama Hilla regilla con inyección de LHRH con 45mg/kg (Licht, 1974). En la Rana esculenta, una sóla inyección de LHRH a un nivel de 2–20 mg/kg indujo la espermiación del 100% entre 0.5 a 1 hora a 15°C. En una dosis más alta, la duración de la respuesta fue de 2 días, comparados a 5 días luego de recibir 100 UI/kg HCG (Billard et al., 1975).
En el goldfish, macho maduro, inyección de LHRH o LHRH a D-Ala indujo el incremento de la concentración de gonadotropina en el plasma, aunque nada se informa sobre la espermiación (Peter, 1980). En el salmón del Atlántico, Salmo salar, macho maduro, con 90g de peso corporal, mantenido a 8°C, se indujo la espermiación por una inyección intra peritonal de 0.75 mg/kg LHRH a D-Ala6 en suero o en glicol propileno, y tambièn por implantación de 1,5 mg/kg LHRH a D-Ala6, o 25 mg/pez D-Mal (2)6 LHRH en pelets de colesterol. La respuesta de espermiación fue notada en varios grupos de peces después de 8 a 12 días. En el grupo de control, la espermiación se produjo el día décimo segundo. El volumen de esperma producido se correlacionó con la concentración de gonadotropina en el plasma (Weil and Crim, 1982).
En las carpas chinas, indias y europeas, con las que por costumbre se induce la ovulación de las hembras, con dos inyecciones de extractos pituitarios, homoplásticos y heteroplásticos, también es correcto recomendar el suministro de una sóla dosis de extracto pituitario a los machos en el día que la hembra recibe la segunda inyección, para asegurar la espermiación satisfactoria del macho en el momento de ovulación de la hembra. En las carpas de la India, “rohu” (Labeo rohita); “catla” (Catla catla) se les aplicó a los machos una sola inyección de 2–3 mg/kg de extracto de pituitaria de carpa, y a dos machos se les permitió una hembra para el desove (Chandhuri, 1976; Blowmick et al., 1977). Sin embargo, al finalizar la estación de desove, es necesario inyectar al macho de “catla” dos veces para obtener una respuesta satisfactoria (Blowmick et al., 1978). En la carpa común la inyección de un extracto acuoso de polvo de pituitaria de carpa disecada en acetona, en dosis de 22 y 22mg/kg produjó un incremento de volumen de esperma dentro de un período de 24 horas a 22°C desde 0.12 ml en el grupo de control hasta 2.90 ml en el nivel más alto de la dosis (Clemens y Grant, 1965). En Israel, consiguieron que los machos de carpa común eyacularon en 24 horas a 16°C cuando aran inyectados con pituitarias homogenizadas de carpa en una dosis de 1 glándula/kg, sin tener relación con el mes en que fueran colectadas las glándulas pituitarias (Rothbard y Rothbard, 1982). En un estudio experimental, en un goldfish hiposectomizado se indujo la espermiación con 50 mg/kg de extracto de hipófisis de trucha (Billard, 1977). Cuando la espermiación fue cuantificada midiendo la producción de semen, en el momento de la respuesta máxima (1–2 días), el extracto de pituitaria proviene de una especie emparentada con la carpa, proporcionó los mejores resultados.
Aunque casi siempre se han empleado los extractos de pituitaria entera, se han llevado a cabo muchos estudios experimentales para inducir la espermiación con el empleo de gonadotropinas de peces purificadas y/o parcialmente purificadas. Indujieron en el goldfish la espermatogénesis, como la espermiación por inyecciones cada 3 días a 24°C con 10, 20, 60 o 120mg/kg de gonadotropina de pituitaria de carpa parcialmente purificada (Clemens y Reed, 1967). Con la dosis más alta, se produjo la espermiación a los 42 días. En un macho maduro hipofisectomizado de goldfish, una sóla inyección intraperitonal de gonadotropina parcialmente purificada de salmón (SG_G100) con un rango de 0.1 a 3.0 mg/kg, indujó la espermiación en 24 horas a 20°C (Yamasaki y Donaldson, 1968a). La espermiación ha sido también inducida en el lucio utilizando gonadotropina purificada de salmón en cantidades varibles de 5 a 100 mg/kg (Billard y Marcel, 1980).
Entre varias gonadotropinas de mamíferos, la más efectiva parece ser la HCG para inducir la espermiación en lo teleosteos. La espermiación ha sido confirmada en truchas (Clemens y Grant, 1965), en la hembra marina Sparus aurata (Arias, 1976), el sabalote Chanos chanos (Juario, 1981), anguila japonesa, Anguilla japónica, utilizando Synahorin (Ymamoto et al., 1972; Yamamoto y Yamauchi, 1974). La respuesta positiva del macho Pontius ticto a una dosis elevdada de FSH de ovinos que resultó ser una excepción al fracaso general del FSH de mamíferos para inducir la espermiación en teleosteos (Kapoor, 1978). La capacidad de inducir la espermiación mediante las preparaciones pituitarias en goldfishes hiposectomizados, fue estudiada por Billard (1977). Respuestas significativas se obtuvieron con extractos pituitarios de corderos a 200mg/kg y LH de ovinos a 2 mg/kg y no a 200 mg/kg, la prolactina ovina a 100mg/kg y ACTH a 10.000IV/kg. Las respuestas de FSH de ovinos a 200mg/kg y PMSG a 500mg/kg no fueron significativas.
Yamazaki y Donaldson (1969) fueron los primeros en demostrarla espermiación de teleosteos. Machos maduros de goldfish que habían sido hiposectomizados 3 a 7 días antes, se les administró intra peritonealmente una sóla inyección de 0.10 a 1 mg/kg de metiltestosterona o dehidroepiandroesterona y/o 10–200mg/kg 11 ketotestosterona. La dosis mínima que provocó la respuesta de espermiación fue de 50 a 100mg, y las máximas respuestas sólo fueron observadas con dosis muy altas. El metiltestosterona fue más efectivo que testosterona proionato. Con macho intactos, la respuesta a 100mg/kg de metiltestosterona fue similar a aquella obtenida con 10.000 IU/kg HCG (Billard, 1976). Sin embargo, en el goldfish hiposectomizado, 1mg/kg de metltestosterona resultó equivalente a 10.000 IU/kg HCG o 3mg/kg SG-G100 (Yamazaki y Donaldson 1968 a 1969). En la liza, Mugil cephalus, la espermiación ha sido inducida con metiltestosterona (Shehadeh et al., 1973b); en el salmón se utilizó 11-Ketestosterona (Idler et al., 1961), en la trucha arco iris se obtuvo resultado con testosterona, pero no así con 11- ketotesterona (Billard et al., 1981).
Ultimamente, se viene usando una preparación comercial de andrógeno, Durandron Forte 250, habiendo tenido éxito con el sabolete, Chanos chanos en el cual se ha inducido la espermiación. Esta preparación contiene 30mg de testosterona propianato, 60mg de testosterona isocaproato y 100mg de testosterona decanoato en 1 ml de vehículo y cuando inyectado a una tasa de 1 ml/pez (2–4kg), indujo la respuesta de la espermiación, la que duró 8 días comparada con 3 días después de una sóla inyección de 5.000 IU de HCG (Juario y Natividad, 1980; Juario, 1981). Por lo tanto, una sóla inyección en dosis de andrógeno en un vehículo apropiado, es un medio efectivo para inducir en términos prácticos.
La progesterona fue encontrada como un esteroide potente que el metilestosterona, tanto en goldfish intactos como en el hiposectomizado con una dosis cuyo rango osciló de 1 a 100 mg/kg, (Billard, 1976). 100mg/kg de cortisona indujo la respuesta en peces que eran de tamaño mayor que aquellos fueron inducidos por 10mg/kg metiltestosterona. También se obtuvo la inducción de la espermiación baja el estradiol en dosis bajas y no se obtuvo respuesta con dosis altas.
La superioridad de la progesterona sobre metiltestosterona en la inducción de la espermiación que fuera indicada por Billard (1976), ha sido confirmada en el lucio del Norte, donde la progesterona fue más efectiva que la testosterona (De Montalambert et al., 1978b). En la trucha arco iris, Scott y Baynes (1982), descubrieron que en la iniciación de la espermiación se produce una caída rápida de la concentración de andrógeno y un aumento en el plasma de los niveles de concentración de 17-hidroxiprogesterona y 17-hidro XY-20B-b deshidroprogesterona. Los niveles de progesterona permanecieron altos durante la espermiación y fueron positivos en correlación al volumen de esperma y al incremento de la producción de K + - Na+.
La práctica de la acuicultura es un arte muy antiguo cuya meta principal es el suministro de una fuente adicional de proteína de alta calidad en la dieta alimenticia. hoy en día la acuicultura aunque todaviá es por mucho aún un arte, ha llegado ha convertirse en una ciencia, en las últimas décadas se ha experimentado un tremendo desarrollo de la acuicultura a nivel mundial. Esto es como resultado de la declinación de las capturas oceánicas y del futuro incierto sobre la posibilidad de seguir contando con las pescas nativas como una fuente barata y segura de proteínas útiles en la dieta humana. Aparejados a estos factores estan la demanda creciente de miles de productos cultivados y el incremento substancial de los métodos de cultivo, y, de aquellos que tratan de optimizar la producción en cantidad y calidad.
Durante los últimos 30 años, muchas nuevas herramientas/equipos/reactivos, etc han creado para ayudar al acuicultor. En realidad, el acuicultor puede escoger una amplia variedad de vestimenta, equipos, fármacos, sustancias químicas, uchas de las cuales estan especificamente diseñados para satisfacer sus necesidades y para fortalecer la productividad de sus operaciones de entendimiento del rol crucial que juega la endocrinología en la acuicultura. Para este fin, numerosas hormonas han sido experimentadas y descubiertas de que tienen aplicaciones importantes.
Ya que el fin ulterior de la acuicultura es proporcionar una fuente segura, rentable y altamente rica en proteínas, cualquier herramienta/instrumento que se utilice será altamente valorizado. Son 5 las áreas principales de la piscicultura que resultan beneficiadas por el uso de los hormonas. Esas son la reproducción inducida, carnicultura, estímulo del crecimiento, control del sexo y maduración inducida. El uso apropiado de hormonas ayudará eficazmente a todas áreas y mejorará significativamente la rentabilidad de una operación de acuicultura.
El uso de hormonas para controlar la reproducción por la inducción selectiva del desove en los peces fue originalmente examinado en Argentina, en 1930. Poco tiempo después el método pionero de los argentinos fue tratado por los brasileros, los soviéticos y americanos. A partir de entonces, el empleo de hormonas se ha difundido como lo ha sido los estudios sobre fisiología de peces. Al estar capacitado el acuicultor de inducir el desove cuando le significa ventajoso, hoy, este acuicultor dispone de un valioso instrumento de manejo que le puede permitir incremetar su producción y rentabilidad.
El mayor problema que a menudo se ha encontrado en la crianza de larvas es la extremadamente alta tasa de mortalidad. En efecto, una vez que la dificultad de la inducción de maduración y desove ha sido superada, la inhabilidad de criar peces hasta sobrepasar el estado larval ha llevado por el suelo el éxito de muchos acuicultores. Aunque el empleo de hormonas que permiten el sustancial aumento y mejora, todavía no s una práctica común, sin embargo, hay evidencia como para sugerir que las hormonas pueden mejorar significativamente la sobrevivencia larval.
Las hormonas han sido también utilizadas exitosamente para el crecimiento, aunque el uso de hormonas para acelerar el crecimiento está mundialmente discriminado en el ganado y otros animales desde hade mucho tiempo, en la piscicultura la producción en escala comercial de esas hormonas estimulantes ha adquirido a parir de la última década espectacular importancia en piscicultura. La ventaja de estas condicines de aumentar selectivamente la tasa de crecimiento de determinado pez habla por sí sóla de la eficiencia de las hormonas. Sin duda alguna, el uso de hormonas aumentará en el afan de incrementar la tasa de producción de peces.
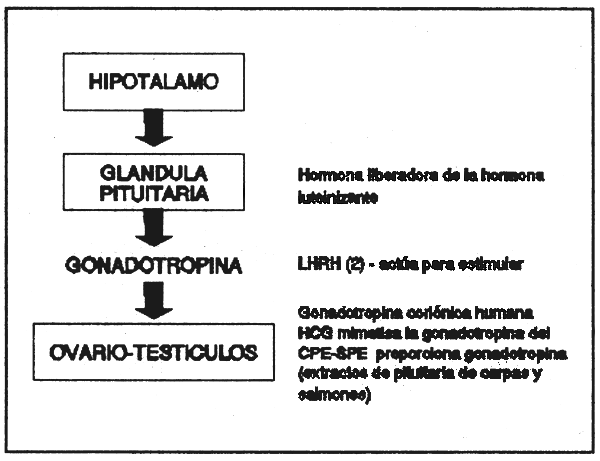
Fig 1.- Lugares de acción de los productos hormonales
Las hormonas han sido también empleadas para controlar el sexo de los peces, un medio de ecelerar el crecimiento mediante la prevención del drenaje de energía de las actividades reproductoras. Esta es un actividad ampliamente usada con Tilapia y Salmonidos quienes han recibido la mayor atención. La producción de monosexos, o peces estériles pueden proporcionar al acuicultor un filón competitivo.
Hasta hace poco, el acuicultor tenía que confiar sólo en las estaciones y en el ciclo de crecimiento de aquellas especies de valor comercial que estuvieran para reproducirse por inducción. Había un período relativamente corto de tiempo en el cual la reproducción podría inducirse con éxito, es decir, en la época en la que el pez estaba aproximádamente a la madurez. La manipulación hormonal ha sido exitosamente utilizado en una variedad de especies para acelerar la erpematogénesis y vitelogénesis. Esta práctica tiene aún que ser usado ampliamente.
Para resumir, el uso de las hormonas como herramienta para mejorar la calidad y rentabilidad de las actividades de acuicultura tiene un potencial muy amplio. Este potencial está siendo explotado y el gran futuro económico rentable apenas se está vislumbrando.
Los mecanismos mediante los cuales actúan las hormonas son complejos. Las hormonas son sustancias químicas mensajeras intrecelulares liberadas por tejidos específicos dentro del sistema endócrino tales como la glándula pituitaria. En el pez, la reproducción está controlada por la inter-acción del hipotálamo, pituitaria y por las glándulas del ovario y testículos (ver fig. 1). Las hormonas del crecimiento y las feminizantes, 17 alfa-metiltestosterona y 17 beta-estradiol no tienen un efecto inmediato sobre la reproducción y no estan representados en la figura.
Los cuatro mayores preparados de hormonas que existe en el mercado (Argent Laboratories) para la inducción del desove en escala comercial, (dos de ellos son las hormonas purificadas) como LHRH, HCG, SPE y CPE deshidratados en acetona, son extractos obtenidos de la pituitaria completa de salmón y carpa, respectivamente.
La LHRH (a) es una proteína sintética que ha demostrado inducir la secreción de gonadotropina en teleosteos. hormonas similares, aunque muchos menos potentes, son producidas probablemente en la glándula pituitaria de los peces. La LHRH es un inductor pobre de gonadotropina, LHRH (a) ha sido usada para acelerar la ovulación y espermiación en varias especies en estadios de desove, incluyendo a la carpa y salmón. No es específico de especies. Ha sido empleado sóla o en conjunto con una fuente de gonadotropina.
La gonadotropina coriónica humana (HCG) es una gonadotropina humana purificada que encubre (mimetiza) a las gonadotropinas endógenas. Ya que existe una correlación entre los niveles de sangre de la gonadotropina y la disponibilidad para el desove mediante el aumento de niveles de suero de la hormona gonadotropina en los animales que ya estan maduros. Muchas especies de peces han sido y son rutinariamente descovados por el uso de inyecciones de HCG. Es éstos se incluye a los bagres, lobina listada y carpa. AGC es empleada ocasionalmente en combinación con extractos de glándula pituitaria pura, no refinada. Esto mismo ha sido también aplicado con pexito en lisas, esturiones y sabalotes (milk fish).
SPE y CPE son preparados de glándula pituitaria completa cruda y deshidratada en acetona. Ellas son disueltas enteras o reducidas en polvo y deshidratas, como ellas son fuentes naturales de gonadotropinas de peces, no requieren técnicas complejas de purificación de sítesis para producirlas, son ampliamente usadas para inducir el desove en muchísimas especies de peces. En general, cuanto más cerca sea la afinidad filogenética del pez donador, mayor será la posibilidad de éxito del desove del pez recipiente sin requerir de dosis adicionales. Por esa razón, los salmónidos responden mejor, inmediatamente cuando son inyectados con extractos de hipófisis de otros salmónidos. La carpa, el bagre, etc. responden mejor a los extractos pituitarios de carpas. Sin embargo, una amplia gama de especificidad ha sido observada notablemente con SPE. Se ha empleado con mucho éxito para el desove de peces tropicales, tales como carpas y bagres.
Las tablas siguientes podrán ser de utilidad en la determinación de los dosajes de hormonas que deberían ser inyectadas y/o suministradas con el alimento. Los valores en esta tabla indican un muestreo de los resultados de una serie de estudios llevados a cabo por muchos investigadores. Los dosajes naturales que pueden estar basados en estos valores pero deberían adaptarse a sus aplicaiones particulares. Sin embargo, se proporcionan más abajo indicadores específicas. Cuando se administra hormonas a los peces, resulta mucho mejor evaluar antes un régimen particular en un pequeño numero de peces. Muchas variables, que incluyen su característica genética, la condición general de la salud del pez, el estadio de madurez sexual, tamaño delpez y su historia previa sobre factores tienen que ver en el impacto dela capacidad de las hormonas para funcionar efectivamente y que esté en condiciones de ser reproducibles.
| NIVEL | REGIMEN | ESPECIES | COMENTARIOS |
|---|---|---|---|
| 2–4 mg/1b (4.5–9 mg/kg) | dosis simple | carpa herbívora | |
| 4 mg& 1b (9 mg/kg) | dosis simple | carpa negra | Combinado con 1 mg CPE |
| 4 mg/1b (9 mg/kg) | dosis simple | carpa plateada | Pez sin desove previo |
| 90 mg/1b | dosis simple Mg = microgramos = 106 (o).000001g | salmón coho | Una o dos inyecciones sólas o en combinación con SPE |
Como los datos indican, LHRH (a) ha sido usado con éxito para inducir el desove en carpas y salmónidos, su uso sin embargo, está aún considerado en estado experimental por lo que debería emplearse con precaución. Es muy potente, requiriendo para su efectividad sólo de unos cuantos microorgamismos. A menudo, lo utilizan en combinación con extractos pituitarios.
HCG es útil para el desove en una variedad de especies. La regla general para determinar el nivel apropiado del dosaje es considerar aproximadamente 1 IU por gramo de pescado. La inyección intramuscular (IM) es la más empleada. Muchos acuicultores emplean HCG en combinación con extractos crudos y purificados de glándula pituitaria ya sea junto o en inyecciones separadas.
(xx IU = Unidad internacional de actividad de 1 HCG.
| NIVEL | REGIMEN | VIA | ESPECIE | COMENTARIOS |
|---|---|---|---|---|
| 125–150 IU/1b (275–330 IU/kg | dosis simple | IM | lobina listada | |
| 270–900 IU/1b (600–200 IU/kg) | dosis simple | IM | bagre de canal | |
| 300–500 IU/1b (660–1100IU/pez 70 IU/pez) | dosis simple | IM/IP | varias especies de carpas (goldfis/perca) | inyectado 72hrs aparte (intervalo) |
| 1500 IU/pez | dosis simple | IM | lobina de mar |
| NIVEL | FUENTE | VIA | ESPECIE | COMENTARIOS |
|---|---|---|---|---|
| 2.0 mgxxx (4.4 mg/kg) | CPE | IM | bagre | 3 inyecciones |
| 0.9 mg/1b 2.0 mg/kg 3.6 mg/1b (8.0 mg/kg) | CPE | IM | carpa india | 2 inyecciones 3–6 horas intervalo |
| 1.8 mg/1b 4.0 mg/kg 5.0 mg/1b (11.0 mg/kg) | CPE | IM | carpa china | 2 inyecciones 3–6 horas intervalo |
| 1.4 mg/1b | CPE | IM | cyprínidos | 2 inyecciones 2 horas intervalo |
| 0.7 mg/1b | SPE | IM | salmónidos | 2 inyecciones 3 días intervalo |
| 1.5 mg/1b 2.7 mg/kg 6.0 mg/kg |
xxxmg = miligramos o 10-3 gramo- .001 gramo
Como la inyección de pituitaria es mas utilizada para inducir el desove ya que hay literalmente cientos de ejemplos de su uso eficaz. Muchas especies de peces han desovado efectivamente usando CEP o SPE, ya sea sólos o en combinación con HCG que con otras hormonas acuosas. La metodología involucra el empleo de 2 a 3 inyecciones intramusculares de un preparado acuoso. El dosaje exacto varía de especie y debería ser determinado experimentalmente para los tres grupos de peces mencionados en la Tabla 3, un rango de 0.7 a 5.0mg de material seco por libra (1.5 a 8.0mg de materia, secado por kg) de pescado se ha encontrado ser suficiente en la mayoría de casos para inducir el desove.
| NIVEL | ESPECIES | COMENTARIOS |
|---|---|---|
| 14 mg/1b (30 mg/kg) | anguila | Inyección de CPE IP 3 veces a la semana durante 2 meses. |
| 21 mg/1b (45 mg/kg) | salmónidos | Inyección de SPE IM una vez por una semana durante 70 días. |
| 5 ppm en dieta | trucha arco iris | Alimentado con metiltestosterona aproximadamente durante 4 semanas. Se incrementó el índice gonadal significativamente de acuerdo a los controles. |
Aunque hay evidencia buena que las hormonas deben ser usadas para acelerar la tasa en la que el pez madura, hay sin embargo pocos datos disponibles sobre el mejor método a ser utilizado para una especie dada. La mayoría de los métodos incluyen inyecciones repetidas haciendolo un método poco deseable cuando sse trata de aplicaciones en gran escala. Mayor éxito se ha tenido en peces machos al acelerar con más facilidad la maduración, aunque el metiltestosterona aplicado por vía oral trabaja en ambos casos. Incrementando la tasa de crecimiento del pez no indica necesariamente que ellos madurarán precocemente. Metiltestosterona ha sido empleado experimentalmente para acelerar la tasa de crecimiento del goldfish y de varias especies de salmónidos, cuando alimentados por un período de 8 semanas a un nivel de 1ppm a 10% de incremento en el peso del pez en estudio, se notó diferencia en aquel pez sin tratamiento.
| NIVEL | ESPECIE | COMENTARIOS |
|---|---|---|
| 23 mg/1b alimento (50 mg/kg) 30 mg/kg | Tilapia | Alimento durante 28 días, produjo todos machos. Un mes después de nacer todos se conviertieron en machos |
| 1.4 mg/1b alimento (3.0 mg/kg) | Trucha arco iris | Alimento por 90 días, 94% machos. |
| 45.0 mg/1b alimento (100 mg/kg) | Carpa | Alimentado 36 días a partir de 8 a 62 días de post ecloción, 71.4 a 89% de machos. |
Además de acelerar la tasa de crecimiento, metiltestosterona ha sido utilizado también para producir una descencadenada sólo de machos, a un porcentaje mucho mayor de machos que lo usual. La hormona puede ser administrado en el alimento y en el agua, sin embargo, la vía preferida es la oral. Hay variaciones considerables sobre el dosaje óptimo para una determinada especie.
| NIVEL | ESPECIES | COMENTARIOS |
|---|---|---|
| 9.0 mg/1b | Trucha arco iris | Alimentado 30 días desde la alimentación inicial, 100% de hembras |
| 1.0 mg/gal (250 mg/I) | Trucha arco iris | Inmerciones de embriones, oculados (huevo oculados), de 2 en 2 horas y alevines, 30–56 días desde su primera alimentación, 100% hembras. |
| 1.3 mg/gal | Salmón coho | Alimentados 24–84 días, 100% hembras. |
Las hormonas pueden también ser empleadas para feminizar poblaciones de peces. Estradiol ha sido usado para producir poblaciones con todos los individuos hembras en varias especies. Como metiltestosterona que pueden emplearse ya sea oralmente o por inmersión. Ambos métodos han dado resultados eficaces.
| NIVEL | HORMONA | ESPECIE | COMETARIOS |
|---|---|---|---|
| 22 mg/lb alimento (50 mg/kg) | Metiltestosterona | Tilapia | Alimentado 60 días, 100% esterilidad |
| 11 mg/lb alimento 11 mg/lb alimento | "
" " " | Trucha Arco iris | Alimentados 110 días, 60% esterilidad |
| 100–800 mg/gal | " " | Salmón coho | 2-2 horas inmersión de huevos oculados y alevines alimentados 7,0 días, 94–100% estériles. |
| 9 mg/lb (20 mg/kg alimento) |
La metilestosterona, cuando es utilizada a niveles mucho más altos que los recomendados para iducir todos los machos, tiene el efecto de hacer que los peces se conviertan en estériles. Puede emplearse por inmersión o en el alimento, siendo con la alimentación el método preferido.
Cuando se está utilizando hormona para inducir el desove, se recomienda los siguientes procedimientos:
El pez deberá ser examinado externamene para asegurar si está listo para el desove.
Observar la distención abdominal debido a los ovarios, preferiblemente después que el tracto digestivo haya sido vaciado.
Examinar la condición de la abertura genital.
Examinar la coloración del pez, el grado de flacidez abdominal y cualquier patrón de comportamiento que se conocen como señales indicativas del comportamiento de predesove.
Para los machos, observaciones de sus actitudes frente a las hembras y en relación a otros machos. podróan ser útiles para determinar el estadio relativo a la proparación sexual. Un entendimiento completo de qué cambios fisiológicos externos esten conectados con el desove, facilitarán para determinar cuales de los peces estan listos para desovar. Para algunas especies, el manipuleo del ambiente externo podría jugar un rol esencial al asegurar que las hormonas funcionan tan efectivamente como sea posible.
Hay muchas técnicas diferentes disponibles para manejar el pez durante la inyección de hormonas tricaine metanosulfonato (MS 222) “Finquel” marca comercial servirá anestésico y luego el pez será inyectado con una dosis de extracto pituitario h/o otroas hormonas mezcladas en agua. Como se indicó anteriormente, el nivel exacto de hormona inyectada será dependiente de una serie de variables. Las indicaciones sugeridas estan en las tablas siguientes. Estas son sólo recomendaciones sugeridas. La experiencia propia podría ser a favor de otras dosis aplicadas y que tengan resultado buenas.
Para peces más pequeños, tales como los ornamentales, menos de 3 pugladas, el pez ser inyectado con no más de 0.2ml de material, usando una aguja de calibre 26 0 menor. Para peces más grandes, se puede inyectar mayor volumen pudiendose, como mucho, inyectarse hasta 2 ml en un pez grande utilizando una aguja de hasta 2ml, en un pez muy grande, utilizando una aguja de calibre 19 a 21.
Como previamente se recomendó, habrá de tenerse en cuenta el rol crusial que desempeña las variables ambientales que pueden afectar la eficiencia de cualquier preparación ambiental apropiada, el flujo de agua y la temperatura que son esenciales para asegurar que las hormonas funcionen efectivamente.
| Hormona | Forma de dosaje/Uso recomendado |
|---|---|
| LHRH (a) | Viene en paquetitos de 1mg, esto es equivalente a 1.000 microgramos. Al diluir este material, remueva cuidadosamente para disolver el contenido. No agite, ya que ello podría afectar a la potencia del preparado. Consulte la tabla intitulada: Preparando las diluciones para la preparación de las concentraciones apropiadas de las materiales. |
| HCG | Viene empacado en folletos de 5.000 a 10.000 UI. Para reconstituirlo agregue esterilizada con una geringa. Remueva con cuidado para disolver el contenido. Cuando reconstituido habrá 50–100 IU por 0.1 ml, dependiendo de la concentración en la ampolleta original. |
| SPE/CPE | El peso apropiado del material entero o en polvo, deberá suspenderse en agua de mode que el material suficiente pueda ser inyectado entre 0.1cc, dependiendo del tamaño del pez. |
| 17 alfa metil testosterona/ 17 beta estradiol. | Deberá ser agregada al alimento en nivel deseado, justo antes de alimentarse a los peces. Puede ser disuelto en agua y mezclado con aceites para que se adhieran a la dieta. |
| HORMONA | DOSAJE | METODO DE ADMINISTRACION | COMENTARIOS |
|---|---|---|---|
| LHRH | 4.5 mg/1b 9.0 mg/lb | Intraperitoneal | Una simple dosis usualmente efectiva |
| HCG | 450 lU/kg | Intramuscular | Dosis simple puede usarse con SPE o CPE |
| CPE/SPE | 4.5 a 55mg/1b 10 a 12 mg/kg | Intramuscular | Doble dosis. Según las especies, dependerá el intervalo de tiempo y se empleará con HCG |
| HORMONA | DOSAJE | METODO DE ADMINISTRACION | COMENTARIOS |
|---|---|---|---|
| 17 alfa metil testosterona | 05–045 mg/1b | Incorporado, adherido al alimento | Dosaje y duraión de la alirnentación depende de las especies |
| 17 beta estradiol | 2–9 mg/1b | Incorporado, adherido al alimento | Dosaje y duraión de la alimentación depende de las especies |
Una vez que el dosaje apropiado ha sido decidido y el efecto deseado se ha determinado, así como todo el material y equipo se tiene listo, entonces Ud. estará preparado para administrar la hormona. La siguiente tabla desribe la forma de dosaje de cada producto disponible y proporcionado por los laboratorios Argent.
| CONCENTRACION INICIAL | CANTIDAD DE AGUA AGREGADA | CONCETRACION FINAL |
|---|---|---|
| LHRH (a) | 10 ml 1 ml | 10 microgramos/0.1 ml 1 microgramo/0.1 ml |
| HGC -5000 IU | 10 ml 1 ml | 50 IU/0.1 ml 500 IU/0.1 ml |
| HCG -10000 IU | 10 ml 1 ml | 100 IU/0.1 ml 1000 IU/0.1 ml |
Anan, T.C. and Sundararaj, B.I., 1974 Temporal effects of artificial induction of ovulation on the hypothalmo-hypophisyal-ovarian system of the catfish. Heteropneustes fossilis (Bloch). Neuroendocrinology 15, 158–171.
Arias, A.M., 1976 Reproduction artficielle de la Daurade Sparus aurata (L.) Stud. Gen. Fish. Counc. Mediterr. 55, 159–173.
Atz, J.W. and Pickford, G.E., 1959 The use of pituitary hormones in fish culture. Endeavour 18, 125–129.
Babiker, M.M. and Ibrahim, J., 1979 Studies on the biology of reproduction in the cichlid Tilapia nilotica (L.): Efects of steroid and trophic hormones on ovulation and ovarian hydration. J. Fisk. Biol. 15, 21–30.
Bhowmick, R.M. and Chadhuri, H., 1968 Preliminary observations on the use the trichloroacetic acid for extraction of gonadotropic hormones in induced spawning of carps. J. Zool. Soc. India 20, 48–54.
Bhowmick, r.M,: Kowtal, G.V.; Jana, R.K. and Gupta, S.D., 1977 Experiments on second spwaning of major Indian carps in the same season by hypophysation. Aquaculture 12, 149–155.
Bhowmick, R.M.; G.V.; Jana R.K. and Gupta, S.D., 1978 Large scale production of the seed of catla, Catla (Ham.) by hypophysation. J. Inland Fish. Soc. 10, 52–55.
Bhowmuck, R.M., 1979 “Observations on the use of human chorionic gonadotropin prepared in the laboratory, in inducing spawning in major carp. Labeo rohita Ham. Rech. Pap. 16, 11–12. Simposium on Inland Aquaculture. Barrackpore, India.
Billard, R.; Lakomma, E, and Kimlstrom, J.E., 1975 Inductions of sperm release in Rana esculenta by LH/FSH releasing hormone. IRCS Med. Sci.: Libr. Compend. 3, 17.
Billard, R., 1976 Induction of sperm release in the goldfish by some steroids, IRCS Med. Sci.: Libr. Compend. 4, 42.
Billard, R., 1977 Efect of various hormones on sperm release in the hypophysectomized goldfish. IRCS Med. Sci: Libr. Compend. 5, 188.
Billard, R. and Marcel, J., 1980 Stimulation of spermiaton and inductionof ovulation in pike (Esox lucius). Aquaculture 21,181–195.
Billard, R.; Fostier, A.; Weil, C. and Breton, B., 1982 Endocrine control of spermatogenesis in teleost fish. Can. J. Fish. Aquat, Sci. 39, 65–79.
Billard, R., 1983 The control of fish reprodution in aquaculture. Proc. Wordl Conf. Aquacult., 1981. In press.
Brandt, F. de W and Schoonbee, h.J., 1980 Further observations on the induce spawinf of the phytophagous Cinese carp species Ctenopharyngodon idella (Val.( and Hypophtalmichthys molitrix. Water SA 6, 27–30.
Breton, B.; Jalabert, B. and Reinaud, P., 1976 Purification of gonadotropin from rainbow trout (salmo gairdneri Richardson) pituitary glands. Ann. Biol. Anim. Biochim. Biophys. 16, 25–36.
Bry, C., 1981 Temporal aspects of macroscopic changes in rainbow trout (Salmo gairdneri) oocytes before ovulation and of ova fertility during the postóvulation period; effect of treatment with 17a-hydroxy-20B-dhydroporgesterone. Aquaculture 24, 153–160.
Burrows, R.E.; Palmer, D.D. and Newman, H.W., 1952 Effects of infected pituitary material upon spawning of blueback salmon, Prog. Fish-Cult. 14, 113–116.
Burzawa-Gerard, E., 1971 Purification d'une hormone gonadotrope hypophysaire du poisson teleosteen, la carpe (Cyprinus carpio L.). Biochimie 53, 545–552.
Burzawa-Gerard, E., 1974 Etude biologique et biochemique de l'hormone gonadotrope d'un poisson téléostéen, la carpe (Cyprinus carpio L.) Men. Mus. Natl. Hist. Ser. A (Paris) 86, 1–77.
Burzawa-Gerard, 1976 E.; Goncharov, B.; Dumars, E. and Fontaine, Y.A., Further studies on carp gonadotropin (c-GtH), biochemical and biological comparison of cGtH a gonadotropin from acipenser stellatus (Chondrostei). Gen. Comp. Endrocinol. 29, 498–505.
Castagnolli, N. and Donaldson, E. M., 1981 Induce ovulation and rearing of the pacu (Colossoma mitrei). Aquaculture 25, 275–279.
Chang, J.P. and Peter, R.E., 1982 Actions of dopamine on gonadotropin release in golfish.
Carassius auratus. Proc. Int. Symp. Reprod. Physiol. Fish., 1982 p.51.
Chang, J.P. and Peter, R.E., 1983a Effects of dopamine on gonadotropin release in goldfish. Carassius auratus, Neuroendocrinology 36, 351–357.
Chang, J.P. and R.E., 1983b Effects of pimozide and des-G1y10Ala16 luteinizing hormone ethymamide on serum gonadotropon concentrations, germinal vesicle migration and ovulation in female golfish. Carassius auratus. Gen. Comp. Endocrinol. (In press).
Chaudhuri, H., 1976 Use of hormones in induce spawning of carps. J. Fish. Res. Board. Can. 33,940–947.
Chondar, S.L., 1980 “Hypophysation of Indian Major Carps”. Satish Book Enterprise, India.
Clemens, H.P. and Sneed, K.E., 1962 Bioassay and use of pituitary materials to spawn war-water fishes. Res. Rep.-U.S. Fish. Wildl Serv. 61, 30pp.
Clemens, H.P. and Grant, F.B., 1965 The seminal thinning response of carp (Cyprinus carpio) and rainbow trout (Salmo gairdneri) afther injectons of pituitary extracts. Copeia pp. 174–177.
Clemens, H.P. and Reed, C.A., 1967 Long-term gonadal growth and maturation of goldfish (Carassius auratus) with pituitary injections. Copeia pp. 465–466.
Colombo, L.; Bern, H.A.; Pieprzyk, J. and Johnson, D.W., 1973 Biosynthesis of 11-deoxycorticosteroids by teleost ovaries and discission of their posible role in oocyte maturation and ovulation and ovulatio. Gen. Comp. Endorcinol. 21, 168– 178.
Cook, A.F.; Stacey, N.E. and Peter, R.E., 1980 Prevulatory changes in serum cortisol levels un the goldfish Carassius auratus. Gen. Comp. Endocrinol. 40, 507–510.
Davy, F.B. and Chouinard, A., 1981 eds. “Induced Fish Breeding in Southest Asia”. IDRC-178e Int. Dev. Res. Cent., Ottawa.
De Montalembert, G.; Bry, D. and Billard, R., 1978b Control of reproduction in northern pike. Spec. Publ. - Am. Fish. Soc. 11, 217–225.
Donaldson, E.M. and Fagerlund, U.H.M., 1970 Effects of sexual maturation and gonadectomy at sexual maturity on cortisol secretion rate in socheye salmon (Oncorchynchus nerka). J. Fish. Res. Board Can. 27, 2287–2296.
Donaldson, E.M., 1973 Reproductive endocrinilogy of fishes. Am, Zool. 13, 909–927.
Donaldson, E.M., 1975 Physiological and physiochemical factors associated with maturation and spawning. EIFAC Tech. Pap. EIFAC/T25, 53–71.
Donaldson, E.M., 1977 Bibliografhy of fish reproduction 1963–1974. Part 1. General Nonteleostean species and Teleostei. Ambramis to Clinostomus. Part2. Teleostei, Clupea to Ompok. Oncorhynchus to Zygonectes and Addendum. Tech. Rep. - Fish. Mar.Ser. (Can.) 732, 1–572.
Donaldson, E.M.; Dye, H.M. and Wright, B.F., 1978a The effect of sorage conditions on the biological activity of salmon gondatropin. Ann. Biol. Anim. Biochim. Biophys. 18, 997–1000.
Donaldson, E.M.; Hunter, G.A. and Dye, H.M., 1978b Induced ovulation in the coho salmon (Oncorchynchus kisutch) using salmon pituitary preparations, gonadotropin releasing hormones and an antiestrogen. West. Reg. Conf. Gen. Comp. Endocrinol. 1978 Abstract, p.24.
Donaldson, E.M., 1981 The pituitary-interrenal axis as an indicator of strees in fish. In “Strees and Fish” (A.D. Pickering ed.), Chaper 2, pp. 11–48. Academic Press, New York.
Donaldson, E.M. and Hunter, G.A., 1982 Sex control in fish with particular reference to salmonids. Can. J. Fish. Aquat. Sci. 39, 99–110.
Fagerlund, U.H.M. and Donaldson,. E.M., 1970 Dynamics of cortisone secretion in sockeye salmon (Oncorchynchus nerka) during sexual maturation and after gonadectomy. J. Fish. Res. Board Can. 27, 2323–2331.
Farmer, S.W. and Papkoff, H., 1977 A teleost (Tilapia mossambica) gonadotropin that resembles luteinizing hormone. Life Sci. 20, 1227–1232.
Fontaine, M., 1976 Hormone and the control of reproduction in aquaculture, J. Fish. Res. Board Can. 33, 922–939.
Fostier, A. and Jalabert, B., 1982 Physiological basis of practical means to induce ovulation in fish. Proc. Int. Symp. Reprod. Physiol. Fish., 1982, pp. 164–173.
Gerbil'skii, N.L., 1938 Expedition for the study of the physiology of spawnung. Rybn. Khoz. (Moscow) 18 (10), 33–36.
Goetz, F.W. and Bergman, H.C., 1978 The effectos of steroids on final maturation and ovulation of oocytes brook trout (Salvelinus fontinalis) and yellow perch (perca falvescens). Biol. Reprod. 18, 293–298.
Greenblatt, R.B.; Barfield, W.E.; Jungck, E.C. and Ray, A.W., 1961 Induction of ovulation with MRL/41 preliminary report JAMA, J.Am. Med. Assoc. 178, 101–105.
Guillemin, R., 1978 Peptides in the brain: The new endocrinology for the neuron. Science 202, 390–402.
Harvey, B.J. and Hoar, W.S., 1979 “The Theory and Practice of Induced Breeding in Fish”, IDRC-TS21e. Int. Dev. Res. Cent., Ottawa
Hasler, A.D.; Meyer, R.K. and Field, H.M., 1939 Spawning induced prematurely in trout with the aid of pituitary glands of the carp. Endocrinology 25, 978–983.
Hasler, A.D.; Meyer, R.K. and Field, H.M., 1940 The use of hormones for the conservation of muskellunge, Esox. masquinongy inmaculatus Garrard. Copeia pp. 43–46.
Hirose, K. and Ishida, R., 1974b Effects of cortisol and human chorionic gonadotropin (HCG) on ovulation in ayu, Plecoglossus altivelis (Themminck and Schlegel) with special respect to water and ion balance. J.Fish. Biol. 6, 557–564.
Hogendoorn, H., 1979 Controlled propagation of the African catfish, Clarians lazera (C. and V.) I. Reproductive biology and field experiments. Aquaculture 17,323–333.
Houssay, B.A., 1930 Acción sexual de la hipófisis en los peces y réptiles. Rev. Soc. Argent. Biol. 6, 686–688.
Hunter, G.A.; Donaldson, E.M.; Stone, E.T. and Dye, H.M., 1978 Induced ovulation of female chinook salmo (Oncorhynchus tshawytscha) at a production hatchery, Aquaculture 15, 99–112.
Hunter, G.A.; Donaldson, E.M. and Dye, H.M., 1981 Induced ovulation in coho salmon (Oncorchynchus kisutch). I. Furtther studies on the use of salmon pituitary preparations. Aquaculture 26, 117–127.
Ibrahim, K.H. and Chaudhuri, H., 1966 Preservation of fish pituitary extract in flycerine for induced breeding of fish. Indian J. Exp. Biol. 4, 249–250.
Ibrahim, K.H., 1969a Techiques of collection, processing and storage of fish pituitary gland. FAO/UNDP Reg. Semin. Induced Spawning Cultiveted Fishes, l969, pp. 1–13.
Ibrahim, K.H., 1969b Preparation, preservation and ampouling of fish pituitary extract. FAO/UNDP Reg. Semin. Spawning Cultived Fishes, 1969, pp. 1–12.
Idler, d.R.; Fagerlund, U.H.M. and Roland, A.P., 1960 Isolation of pregn-4-ene-17a,20B-diol-3-one form plasma of Pacific salmon, Oncorhynchys nerka. Biochem. Biophys. Res. Commun. 2, 133–137.
Idler, D.R.; Schmidt, P.J. and Biely, J, 1961 The androgenic activity of 11-Ketotestosterona a steroid in salmon plasma. Can. J. Biochem. Physiol. 39, 317–320.
Idler, D.R. and Hwang, S.J., 1978 Conditions for optimizing recovery of salmon gonadotropin activity from Con a Sepharose. Gen. Comp. Endrocrinol. 34, 642–644.
Idler, D.R. and Ng, T.B., 1979 Studies on two types of gonadotropins from both salmon and carp pituitaries. Gen. Comp. Endocrinol. 38, 421–440.
Iwamatsu, T., 1978 Studies on oocyte maturation of the medaka, Orysis latipies. V. On the structure of steroids that induce maturation in vitro. J. Exp. Zool. 204, 401– 408.
Jalabert, B. and Szollsi, D., 1975 In vitro ovulation of trout oocytes, efffects of prostaglandins on smooth muscle like celle of the theca. Prostaglandins 9, 765–778.
Jalabert, B., 1976 In vitro oocytes maturation and ovulation in rainbow trout (Salmo gardneri), northen pike (Esox Iucius) and goldfish (Carassius auratus). J. Fish Res. Board Can. 33, 974–988.
Jalabert, B.; Breton, B. and Bry, C., 1980 Ovutation de la gonadotropine lasmatique t-GtJ aprés synchronisation des ovulations par injection de 17a-hydroxy-20B-dihydroprogestérone chez la Truite arc-en-ciel (Salmo gardneri R.) C.R. Hebb. Seances Acad. Sci. Ser. D 290, 1431–1434.
Juario, J.V. and Natividad, M., 1980 M., The induced spawning of captive milkfish. Asian Aquacult. 2, 4
Juario, J.V., 1981 “Induced Fish Breeding in Southeast Asia” (F.B. Davy and A. Chouirnard, eds.), IDRC-178e, Microfiche Annex 3/4 l8pp. Int. Dev. Res. Cent. Ottawa.
Kagawa, H. and Nagahama, Y., 1981 In vitro effects of prostaglandins on ovulation in goldfish Carasius auratus. Bull. Jpn. Soc. Sci. Fish. 47, 1119–1121.
Kapoor, C.P., 1976 Effects of luteinizing hormone on female Puntius ticto (Ham.) Z. Mikrosk-Anat. Forch. 90, 514–520.
Kapoor, C.P., 1974 Effects of follicle stimulating hormone on the testes of Puntius ticto (Ham.) Endokrinologie 72, 17–24.
Kapur, K., 1979 Effects of indomethacin on ovulation and spaening in exotic fish Cyprinus carpio. Indian J. Exp. Biol. 17, 517–519.
Katz, Y. and Eckstein, B., 1974 Changes in steroid concentration in blood of female Tilapia aurea (Teleostei, Chichlidae) during initiation of spawning. Endocrinology 95, 963–967.
Katzman, P.A. and Doisy, E.A., 1932 Preparation of extracts of the anterior pituitary like substance of urine of pregnancy. J. Biol. Chem. 98, 730–754.
Kirshenblatt, J.D., 1952 The action of hormones on the female Byull. Dokl. Eksp. Nauk SSSR 83, 629–632
Kirshenblatt, J.D., 1959 The effects of cortisone on ovaries of the loach. Byuull. Eksp. Biol. Med. 47, 108–112.
Klopper, A. and Hall, M., 1971 New synthetic agent for the induction of ovulation: Preliminary trials in women. Br. Med. J. I, 152–154.
Kuo, C.M.; Nash, C.E. and Shehadeh, Z.H., 1974 A procedural guide to induce spawning in the grey mullet (Mugil cephalus 1.). Aquaculture 3, 1–14.
Kuo, C.M. and Nash, C.E., 1975 Recent progress on the control of ovarian developmente and induce spawning of the grey mullet (Mugil cephalus L.). Aquaculture 5, 19–29.
Lam, T.J., 1982 Applications of endocrinology to fish culture. Can. J. Fish. Aquat. Sci. 39, 111–137.
Lederis, K., 1972 Recent progress in research on the urophysis. Gen. Comp. Endocrinol. Suppl. 3, 339–344.
Licht, P., 1974 Induction of sperm release in frogs by mammalian gonadotropin release hormone. Gen. Comp. Endocrinol. 23, 352–354.
Licht, P.; 1977 Papkoff, H.; Farmer, S.W.; Muller, C.H. and Crews D., Evolution of gonadotropin structure and function. Recent Prog. Horm. Res. 33, 169–248.
Lo, T.B.; 1981 Huang, F.L. and Chang, G.D., Separation of subunits of pike eel gonadotropin by hydrophobic interaction chromatography. J. Chromatogr. 215, 229–233.
McBride, J.R. and Overbeek, A.P., 1969 Cytological changes in the pituitary gland of the adult sockeye salmon (Onchorhynchus nerka) after gonadectomy. J. Fish. Res. Board Can. 26, 1147–1156.
Nagahama, Y.; 1982 Kagawa, H. and Young, G., 1982 Cellular sources of sex steroids in teleost gonads. Can. J. Fish. Aquat. Sci. 39, 56–64.
Nash, C.E. and Shehadeh, Z.H., 1980 ads., Review of breeding and propagation techniques for grey mullet, Mugil cephalus. ICLARM Stud. Rev. 3, 1–87.
Ng, T.B. and Idler, D.R., 1978a and little forms of plaice vitellogenic and maturational hormones. Gen. Comp. Endocrinol. 34, 408–420.
Ng, T.B. and Idler, D.R., 1979 Studies on two types of gonadotropin from both Amercian plaice and winter flounder pituitaries. Gen. Comp. Endocrinol. 38, 410–420.
Pnadey, S. and Hoar, W.S., 1972 Induction of ovulation in goldfish by clomiphene citrate. Can. J. Zool. 50, 1679–1680.
Peter, R.E.; 1978 Crim, L.W.; Goos, H.J.T. and J.W., Lesioning studies on the gravid female goldfish: Neuroendocrine regulation of ovulation. Gen. Comp. Endocrinol. 35, 391–401.
Peter, R.E., 1980 Serum gonadotropin levels in mature goldfish in response to luteinizing hormone-releasing hormone (LH-RH) and desGly10-(D-Ala6)-LH-RH ethylamide. Can. J. Zool. 58, 1100–1104.
Peter, R.E. and Paulencu, C.R., 1980 Involment of the preoptic region in gonadotropin release inhibition in goldfish Carassius auratus. Neuroendocrinology 31, 133– 141.
Peter, R.E., 1982 Neuroendocrine control of reproduction in teleosts. Can. J. Fish. Aquat. Sci. 39, 48–55.
Pickford, G.E. and Atz, J.W., 1957 “The Physiology of the Pituitary Gland of Fishes”. N.Y. Zool. Soc., New York.
Pierce, J.G.; Faith, M.R. and Donaldson, E.M., 1976 Antibodies to reduced S-carboxy-methylated alpha subunit of bovine luteinizing hormone and their application to the study of the purification of gonadotropin from salmon. Gen. Comp. Endocrinol. 30, 47–60.
Pullin, R.S.V. and Kuo, C.M., 1980 Developments in the breeding of cultured fishes. Symp. Adv. Food-Prod.Syst. Arid Semiarid Lands. 1980 Manuscript, 35 pp.
Ramaswami, L.S., 1962 Endocrinology of reproduction in fish and frog. Gen.Comp. Endocrinol. Suppl. 1, 286–299.
Refstie, T.; Sotss, J. and Donaldosn, E.M., 1982 Productions of all female coho salmon (Oncorchynchus kisutch) by diploide ginogenesis using irradiated sperm and cold shock. Aquaculture 29, 67–82.
Ribeiro, O.F. y Neto, J.F.T., 1944 Da obtencao de um extracto glicerinado para a hipofisacao de pexies. Rev. Fac. Med. Vet., Universidade de Sao Paulo 2, 227–232 (Engl. abstr.).
Rothbard, S., 1981 Induced reproduction in cultivated cyprinids-the common carp and the group of chinese carps. 1. The technique of induction spawning and hatching. Bamidgeh 33, 103–121.
Rothbard, S. and Rothbard, H., 1982 Spermiation response of carp to homologous pituitary gland. Proc. Int. Syp. Reprod. Physiol. fish, 1982, p. 201.
Schally, A.V. and Kastin, A.J., 1972 Hypothalmic releasing and inhibiting hormones Gen. Comp. Endocrinol., Suppl. 3, 76–85.
Schally, A.V., 1982 Aspects of hypothalamic regulation of the pituitary gland. Science 202, 18–28.
Schmidt, p.J. and Idler, D.R., 1962 Steroid hormones in the plasma of salmon at various states of maturation. Gen. Comp. Endocrinol. 2, 204–214.
Scott, A.P. and Baynes, S.M., 1982 Plasma levels of sex steroids in relation to ovulation spermiation in rainbow trout (Salmo gairdneri). Proc. Int. Symp. Reprod. Physiol. Fish. 1982, pp. 103–106.
Shehadeh, Z.H.; Madden, W.D. and Dolh, T.P., 1973b The effects of exogenous hormone treatment on spermiation and vitellogenesis in the mullet, Mugil cephalus L., J. Fish. Biol. 5, 479–487.
Shehadeh, Z.H., 1975 Induce breeding techniques-a review of progress and problems. EIFAC Tech. Pap. 25, 72–88.
Sower, S.A.; Schreck, C.B. and Donaldson, E.M. 1982 Hormone induced ovulation of coho salmon (Oncorhynchus kisutch) held in sea water an fresh water. Can. J. Fish. Aquat. Sci. 39, 627–632.
Stacey, N.E. and Pandey, S., 1975 Effects of indomethacin and prostaglandins on ovulation on goldfish. Prostaglandins 9, 597–608.
Stacey, n.E. and Goetz, F.W., 1982 Role of prostaglandins in fish reproduction. Can. j. fish. Aquat. Sci. 39, 92–98.
Strand, F.L., 1958 Effects of high carbohydrate diet and epinephrine in salmon and brook trout N.Y. Fish Game j. 5, 84–93.
Sundararaj, B.I. and Goswami, S.V., 1966 Effects of mammalian hypophysial hormones, placental gonadotropins, gonadal hormones and adrenal corticosteroids on ovulation and spawning in hypophysectomized catfish. Heteropneustes fossilis (Bloch). J. Exp. Zool. 161, 287–296.
Sundararaj, B.I. and Goswami, S.V., 1968 Effecto of estrogen, progesterone, and testosterone on the pituitary and ovary of catfish. Heteropneustes fossilis (Bloch) J. Exp. Zool. 169, 211–228.
Sundararaj, B.I. and goswami, S.V., 1969 Role interrenal in luteinizin hormone induced ovulation and spaening in the catfish. Heteropneustes fossilis (Bloch). Gen. Comp. Endocrinol. Suppl. 2, 374–384.
Sundararaj, B.I., 1981 reproductive physiology of teleost fishes. FAO Rome ADCP/REP/81/16, 1–82.
Swann, C.G. and Donaldson, E.M., 1980 Biblography of salmonid reproduction 1963–1970 for the family Salmonidae; Subfamilies Salmonidae, Coregonidae and Thimallinae. Can. Tech. Rep. Fish. Aquat. Sci. 970, 1–221.
Van Overbeek, A.P. and McBride, J.R., 1971 Histological effects of 11-ketestosterone, 17a-methyltestosterone, estraddiol cypionate, and cortisol on the sockeye salmon (Onchorhynchus nerka). J. Fish. Res. Board Can. 38, 477–484.
Von Ihering, R., 1935 Die Wirkung von Hypophyseninjektion auf den Laichakt von Fischen. Zool. Anz. 111, 273–279.
Von Ihering, R., A method for inducing fish to spawn. Prog. fish-Cult. 34, 15–16.
Von Ihering, R. and de Azevedo, P, 1936 As piabas dos acudes nordestions (Characidae, Tetragonopterinae). Arch. Inst. Biol. (Sao Paulo) 7, 75–106.
Watts, E.G.; Copp, D.H. and Deftos, L.T., 1975 changes in plasma calcitonin and calcium during the migration of salmon. Endocrinology 96, 214–218.
Weil, C. and Crirn, L.W., 1982 the effects of differents methods of administration of LH-RH analogs on spermation in the matute landlock salmon, Salmo. salar. Can. Soc. Zool. Bull. 13 (2), 60 (abstr.).
Wingfield, J.C. and Grimm, A.S., 1977 Seasonal changes in plasma cortisol, testosterone and oestradil-17B in the plaice, Pleuronectes platessa L. Gen. Comp. Endocrinol. 31, 1–11.
Woynarovich, E. and Horvath, L., 1980 The artificial propagation of warm-water finfishes; a manual for extensión. FAO Fish. Tech. Pap. 201, 183 pp.
Yamamoto, K.; Hiroi, O,; Hirano, T. and Morioka, T., 1972 Artificial maturation of cultivated male Japanese eels by Synahorin injection. Bull. Jpn. Soc. Sci. Fish. 38, 1083–1090.
Yamamoto, K. and Yamauchi, K., 1974 Sexual maturation of Japanese eel and producion of eel larvae in the aquarium. Nature (London) 251, 220–222.
Yamazaki, F. and Donaldson, E.M., 1968a The spermiation of goldfish (Carassius auratus) as a bioassay for salmon (Oncorhynchus tshawytscha) gonadotropin. Gen. Comp. Endocrinol. 10, 383–391.
Yamazaki, F. and Donaldosn, E.M., 1968b The effects of partially purified salmon pituitary gonadotropin on spermatogenesis, vitellogenesis, and ovulation in hypophysectomizaed goldfish, Carassius auratus. Gen. Comp. Endocrinol. 11, 292–299.
Yamazaki, F. and Donaldson, E.M., 1969 Involvement of gonadotropin and steroid hormones in the spermiation on the goldfish (Carassius auratus). Gen. Comp. Endocrinol. 12, 491–497.
Yaron, A.; Bogomolnaya, A. and Hilge, V., 1982 Aplication of an in vitro bioassay for fish GTH in improving harvest of carp pituitaries. Proc. Int. Symp. Reprod. Physiol. fish. 1982, p. 27.
Yoneda, T. and Yamazki, F., 1976 Purification of gonadotropin from chum salmon pituitary glands. Bull. Jpn. Soc. Sci. Fish. 42, 343–350.