G. BOVO
Il est quelquefois difficile d'établir un diagnostic clinique virologique, en raison de la superposition de maladies bactériennes et d'infections virales mixtes. Pour faire un diagnostic correct, il est nécessaire que chaque cas clinique suspect corresponde à un résultat de laboratoire obtenu par isolement et test sérologique de l'agent causal.
Dans notre laboratoire, nous effectuons le diagnostic des maladies virales des poissons et nous utilisons des lignes de cultures cellulaires sensibles à tous les virus connus affectant l'espèce de poissons soumise à l'examen.
Dans notre laboratoire, plus de 90 % des échantillons sont des truites arc-en ciel (Salmo gairdneri) et des truites fario (Salmo trutta) ; Les virus isolés jusqu'à présent, sur ces espèces, sont : SHV et NPI. La fig. 1 montre le nombre de cas, confirmés virologiquement, d'échantillons positifs diagnostiqués dans le Nord-Est de l'ltalie, depuis 1978. Le pourcentage de positivité, sur 1540 échantillons suspects, est de plus de 40 %. Nous n'avons jamais isolé d'autres virus capables d'affecter les espèces citées plus haut. (ni NHI, ni HS, par ex.)
L'isolement des virus est pratiqué en même temps sur des cultures cellulaires RTG2 et EPC qui sont inoculées avec une suspension d'un ensemble d'organes (rein, foie, rate et cerveau), à une dilution finale de 10-2 et de 10-3.
Les cultures inoculées sont observées pendant 14 jours en tout, pour détecter l'effet cytopathique des virus ; s'il est présent, le virus est identifié par la sérumneutralisation ou l'immunofluorescence comme cela a été décrit (BOVO et al, 1978 ; BOVO et al, 1979).
Une méthode de diagnostic très avantageuse est l'immunofluorescence sur les sections cryostatiques d'organes frais (SWANSON et al, 1981; JORGENSEN P.E.V. et al, 1972). Cette méthode nous donne une réponse diagnostique au bout de deux heures. Les contrôles SHV et NIP sont pratiqués avec succès par prophylaxie directe, en utilisant la méthode “stamping out” (KEHLET et al, 1980) lorsque l'on n'a pas d'autre méthode chimiothérapique ou de vaccin à disposition.
En ce qui concerne SHV, qui est, dans notre pays, la maladie qui entraîne les pertes économiques les plus importantes (- 15 billions/an), il y a, dans la province de Trento, un plan officiel pour 50 fermes d'élevage de truites sur les 70 existant dans toute la province. (ZANIN et al, 1983).
Les implantations ont été complètement vidées, désinfectées puis réempoissonnées avec du matériel exempt de maladie ou des oeufs désinfectés.
Jusqu'à présent, 40 fermes d'élevage de truites ont été vidées et désinfectées ; 14 ont été réinfectées et 26, représentant environ ⅓ du total de la surface d'élevage, sont, à cette date, exemptes de SHV.
A partir de ces données, il est possible de voir que le plan pour l'éradication du SHV n'est pas facile à réaliser, surtout à cause de la réinfection, qui, d'après notre expérience, est surtout liée, au réempoissonnement avec du matériel qui n'est pas exempt de maladie dans les fermes qui sont en amont de la rivière, à une mauvaise observation des mesures sanitaires d'hygiène, ainsi qu'à l'achat et à l'introduction de matériel qui n'est pas exempt de maladie.
En dépit du coût très élevé du plan et de la présence constante de risques de réinfection, nous sommes obligés de dire que, jusqu'à présent, c'est l'unique méthode possible de lutte contre le SHV.
En ce qui concerne la vaccination contre les maladies virales, nous avons fait des recherches pendant deux ans sur les possibilités d'utiliser une prophylaxie indirecte en employant contre le SHV, un vaccin vivant atténué qui doit être administré par bain à des alevins de 5 g.
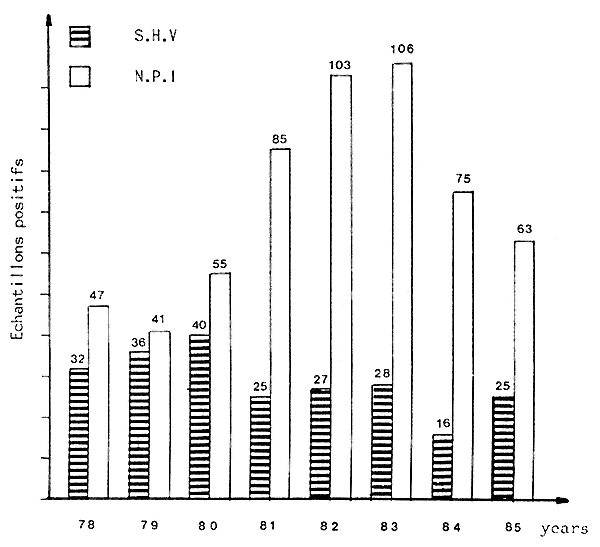
Fig. 1 - Echantillons de S.H.V et de N.P.I
REFERENCES
- BOVO G., GIORGETTI G. (1978) Isolamento su colture di tessuto ed identificazione sierologica del virus della Setticemia Emorragica virale ( SEV ) nelle trote di allevamento. Atti Soc.It.Sci.Vet.32, 354.
- BOVO G., GIORGETTI G. (1979) Isolamento su colture di tessuto ed identificazione sierologica del virus della Necrosi pancreatica infettiva ( NPI ) delle trote di allevamento. Atti Soc. It.Sci.Vet.,33, 295.
- JORGENSEN P.E. Vestergard, MEYLING A. (1972) Egtved virus : demonstration of virus antigen by the fluorescent antibody technique in tissues of rainbow trout affected by viral Haemorrhagic Septicaemia and in cell cultures infected with Egtved virus. Arch.f.die ges Virus f. 36,115-122.
- KEHLET N.P., GAEDE T., VESTERGARD J.M. (1980) Control measures of fresh water fish disease in Denmark. IX conf.O.I.E. Ref. Com. for Europe - Budapest ( Hungary), 23–26/9.
- SWANSON R.N., GILLESPIE J.H. (1981) An indirect fluorescent antibody test for the rapid detection of infectious pancreatic necrosis virus in tissues. J. of Fish Dis. 4, 309–315.
- ZANIN E., ALLEGRETTI M., GIORGETTI G., CESCHIA G. (1983) Initiation and appraisal of an official prophylactic policy against VHS in farmed trout in the province of Trento, Italy. Bull. EAFP 3, 5–6.
