Mr. P. BRONZI
L'aquaculture dérive de techniques de pêche développées dans un environnement naturel où les techniques utilisées se sont progressivement perfectionnées.
Au début, elle était pratiquée dans des aires de pêche protégées, comparables aux “réserves de chasse”, dans lesquelles auncune opération de contrôle de la qualité de l'eau, de la prophylaxie ou des méthodes thérapeutiques contre les maladies, n'était effectuée. C'était simplement un moyen de stocker des jeunes poissons capturés en pleine eau; L'aliment, quand il était fourni, n'était que du fourrage, et les animaux grandissaient en populations mixtes, sans aucune sélection de taille.
De telles entreprises étaient nécessairement liées à des caractéristiques favorables de l'environnement telles que des environnements restreints, hydrologiquement contrôlables et requerant peu de travail.
Une augmentation de l'intervention humaine, concernant la structure et la gestion du milieu, fut enregistrée rapidement, principalement pour la distribution d'aliment et pour le contrôle du circuit d'eau.
Plus tard, la demande croissante en produits, a conduit à une industrailisation de plus en plus en plus importante des systèmes de production avec, par conséquent un détachement progressif du contexte naturel et une plus grande présence humaine.
Le développement des méthodes de reproduction artificielle a été fondamental, car cette méthode fournit des alevins à la taille d'élevage permettant aux aquaculteurs de se libérer de la pêche.
Ainsi, l'aquaculture s'industrialise, créant des milieux artificiels équipés de systèmes de pompage, de contrôle de la qualité de l'eau, de production d'alevins, de formulation d'aliment et utilisant de plus en plus massivement des technologies et des opérations de gestion automatiques.
Malgrè tout, nous restons dans un domaine “agricole” et nous n'avons pas la possibilité de contrôler complêtement les cycles de production pour les accorder à la demande. Ces cycles dépendent, en fait, essentiellement des tendances thermiques saisonnières.
Les organismes aquatiques sont hétérothermes, c'est-à-dire qu'ils n'ont pas de température corporelle propre mais qu'ils adoptent la température de l'eau qui les entoure.
La température de l'eau est donc un facteur particulièrement important parce qu'il'conditionne toute la vie des organismes marins.
La figure 1 présente les relations existant entre poisson et température.
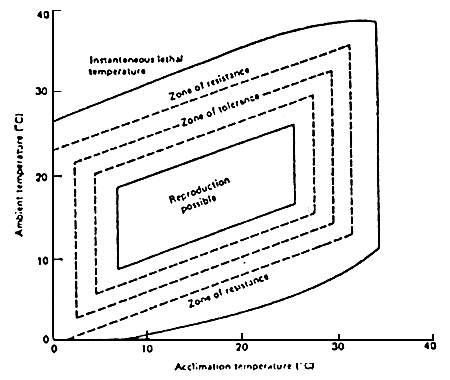
Figure 1: Diagramme des relations avec la température, pour les poissons (WEATON, 1977)
La courbe extérieure représente les valeurs extrêmes de température que le poisson peut tolérer. Comme toutes les autres valeurs de température (de résistance, de tolérance, etc…) les limites léthales inférieures et supérieures augmentent avec l'accroissement de la température d'acclimatation. La seconde courbe représente les valeurs extrêmes de température supportées indéfiniment par le poisson; dans la zone de tolérance, le poisson supporte différents niveaux de stress qui réduisent les taux de croissance et de conversion de l'aliment.
L'aire où la reproduction est possible indique les valeurs thermiques qui ne causent pas de stress.
Si nous utilisons la consommation d'oxygène pour mesurer le métabolisme (standard et actif), nous trouvons qu'en accroissant la température, entre des limites définies évidemment, les deux métabolismes augmentent (Figure 2).
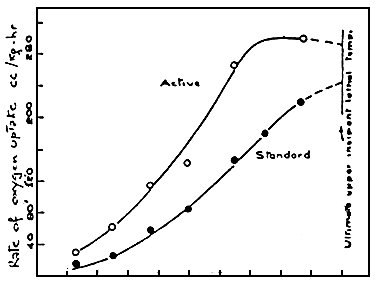
Figure 2: Courbe de consommation active ou standard d'oxygène pour le Goldfish. (FRY and HART, 1946)
La consommation standard est la quantité d'oxygène nécessaire pour maintenir le taux métabolique; la consommation active est composée du taux standard, plus l'oxygène nécessaire pour l'activité en général. La différence entre les consommations standard et active peut être mesurée par l'oxygène disponible pour permettre une activité, à n'importe température (Figure 3).
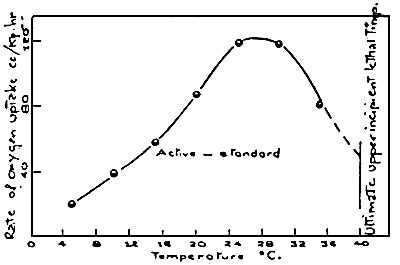
Figure 3: Différences entre les courbes de consommation ou standard d'oxygène, pour le Goldfish. (FRY and HART, 1946)
Mais, pour un aquaculturiste, il est plus intéressant de connaître l'influence directe de la température sur la croissance et sur le taux de consommation d'aliment.
La figure 4 montre un exemple de l'influence de la température sur le taux de croissance du poisson. Le taux de croissance augmente avec la température jusqu'à une valeur déterminée (27.5° C dan l'exemple) puis, le taux de croissance diminue.
| Figure 4: Taux de croissance des alevins de “Largemouth bass”, à différentes température. (STRAWN, 1961) | 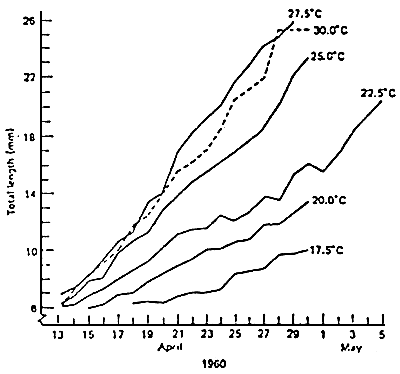 |
Cela veut dire qu'il existe un optimum de température pour un taux de croissance; à des valeurs supérieures à cet optimum, le taux de croissance diminue.
Ces considérations sont utiles si la nourriture est libre' comme dans la nature, mais lorsque l'on considère une pisciculture, nous devons prendre en considération les effets combinés de la température et de la quantité d'aliment consommée.
La figure 5 montre les relations existant entre la quantité d'aliment distribuée, le taux de croissance et la température, pour le saumon Sockeye.
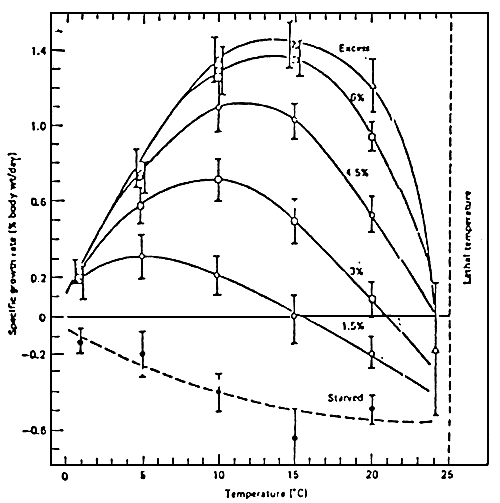
Figure 5: Effet de la quantité d'aliment distribuée sur la relation entre le taux de croissance et la température pour le saumon Sockeye. (BRETT et al., 1969)
Nous pouvons observer que:
- La croissance la meilleure est obtenue lorsque l'aliment est distribué
- A chaque niveau d'alimentation, il existe un optimum de température pour la croissance.
- Si le niveau d'alimentation diminue, le taux de croissance à toutes les températures diminue.
- Il n'y a pas de croissance (ou même perte de poids) aux environs du niveau de température léthal supérieur.
Mais l'aquaculturiste n'est pas seulement intéressé par le taux de croissance mais également par les coûts de production.
La figure 6 montre les relations existant entre le taux de conversion et le taux de croissance.
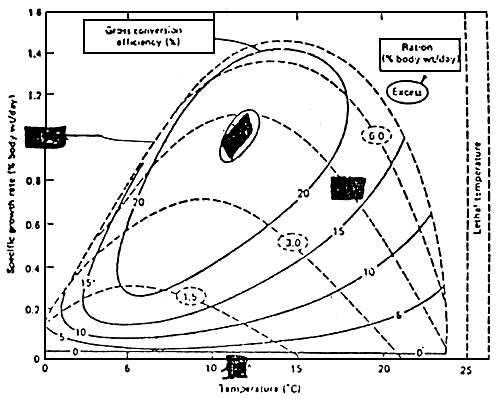
Figure 6: Rendement énergétique de l'aliment, en relation avec la température et avec la ration (BRETT et al., 1969)
Le rendement énergétique est calculé comme suit:
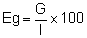
D'après cette figure, nous pouvons voir que le rendement énergétique S'étale entre O et 35 % et que le meilleur résultat est obtenu à 12° C (cette température est inférieure à l'optimum de température pour une meilleure croissance, qui est de 14,5° C) avec une quantité d'aliment égale à 4,5 % du poids par jour, obtenant ainsi un taux de croissance de 1 % par jour.
Cela veut dire que, pour chaque espèce, il existe deux combinaisons possibles entre la température et la quantité d'aliment distribué qui donnent soit le rendement énergétique maximum (du taux de conversion de l'aliment), soit le maximum de croissance.
En général, l'acuaculturiste peut faire varier la température de l'eau entre l'optimum pour la croissance et l'optimum pour le rendement énergétique, ce choix dépendant de la disponibilité en aliment ou de la disponibilité de pousser la croissance.
Mais nous pouvons observer que la croissance obtenue à la température et à la ration donnant la mellieure croissance est pratiquement similaire à celle obtenue à la température du meilleur rendement énergétique, en accroissant seulement la ration alimentaire. la meilleure solution est donc de maintenir la température de l'eau au niveau du meilleur rendement énergétique et de varier la ration alimentaire de façon à obtenir l'optimum économique, en considérant le coût de l'aliment et le coût de la gestion de l'installation.
De ces considérations biologiques, apparaît combien est importante la disponibilité d'une bonne température de l'eau pour la croissance des animaux et pour la gestion économique des installation aquacoles.
une température adéquate peut augmenter le rendement, le pourcentage d'utilisation des bassins, peut réduire de moitié le temps requis pour obtenir la taille commerciale et donc doubler la productivité des installation.
La possibilité de contrôler la température permet de poursuivre l'industrialisation de l'aquaculture.
L'aquaculture, en milieu thermiquement contrôle, permet non seulement une augmentation du taux du croissance et un meilleur facteur de conversion de l'aliment, mais aussi et surtout le contrôle des rythmes et des horaires de manière à optimiser les coefficients d'utilisation des structures, de l'approvisionnement en eau et par conséquent la productivité économique de l'exploitation.
C'est pourquoi il est possible d'employer en aquaculture les critères de gestions suivants:
1. Elevage en rotation - II concerne l'élevage d'espèces “frigophiles” et thermophiles. Ceci est possible en aquaculture thermiquement contrôlé, surtout en eau douce, à notre latitude, puis que nous y trouvons les fouchettes de température optimale pour la croissance de ces deux catégories d poissons.
2. Décalage des différents cycles de production:
Au cours de l'année, divers cycles de production peuvent être lancés, allant des alevins d'écloserie aux poissons de taille commerciale. Ceci est rendu possible grâce aux températures d'eau adéquates et disponibles tout au long de l'année d'élevage et implique une utilisation répétée des bassins qui conduit à l'optimisation du coefficient d'utilisation de l'approvisionnement en eau et des installations d'élevage.
3. Production spécialisée/
Elle consiste à développer uniquement les méthodes productives des phases qui peuvent tirer un avantage maximum du contrôle thermique. Ceci signifie, par exemple, produire les stades intermédiaires quand ceux-ci représentent la meilleure production possible dans les conditions disponibles et laisser les opérations de grossissement aux systèmes traditionnels où les coûts sont moindres. Ceci crée la possibilité d'intégrer différents systèmes de production.
4. Coordination entre l'offre et la demande:
L'aquaculture thermiquement contrôlée permet la production à taille commerciale en dehors de la saison naturelle, au moment où la demande du marché est forte et l'offre faible; de cette manière, les prix de vente peuvent être meilleurs.
Parmi ces critères de gestion, le plus important et le plus caractéristique que nous fournit l'aquaculture thermiquement contrôlée est le décalage des cycles de production.
Pour illustrer l'avantage obtenu decette manière, comparons deux hypothèses, la première en conditions traditionnelles et la seconde en aquaculture thermiquement contrôlée.
Dans la première hypothèse, nous utilisons les critères de gestion traditionnels et convenons que la taille commerciale finale doit être obtenue au moment où démarre l'alevinage puisqu'il a lieu dans les mêmes bassins d'élevage. On suppose que le premier cycle d'élevage sera achevé quand le deuxième commencera. (Figure 7).
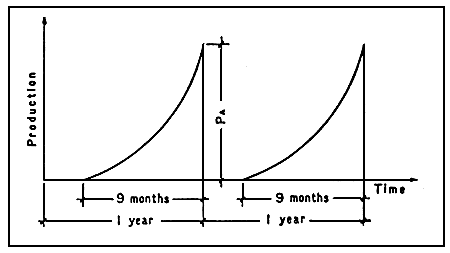
Figure 7: Production annuelle: Aquaculture traditionnelle
Dans ce cas, la production annuelle est:
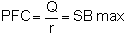
où:
PFC = Production finale (kg/an),
Q = Approvisionnement en eau (m3/h),
r = Exigence spécifique en eau (dm3/hr.kg),
SB max = Biomasse en stockage (kg).
Pour cette première hypothèse, l'écloserie, respectant les rythmes biologiques naturels, doit produire d'un seul coup tous les alevins requis par le système entier, et de ce fait ne sera utilisée qu'une fois par an.
En aquaculture thermiquement contrôlée, on estime que la taille commerciale peut être atteinte en un temps plus court (approximativement 2/3 du temps habituel).
En fait, dans ce cas, les fluctuations de température permettent à l'élevage d'avoir lieu pratiquement toute l'année, mais à différents taux de croissance, en fonction de la température de la saison. La période de 8 mois est une va valeur moyenne que nous utiliserons dans nos calculs.
Grâce à la possibilité de contrôler la tepérature, il est possible de décaler le commencement de chaque cycle de production, en produisant les alevins nécessaires pour chaque période de grossissement.
Si l'on choisit un décalage de 4 mois entre les cycles de grossissement et en considérant comme constante la quantité d'approvisionnement en eau qui limite la biomasse maximum possible dans le système à tout moment, la biomasse est obtenue, à n'importe quel moment, en additionnant les animaux de taille différente présents dans le système (Figure 8).
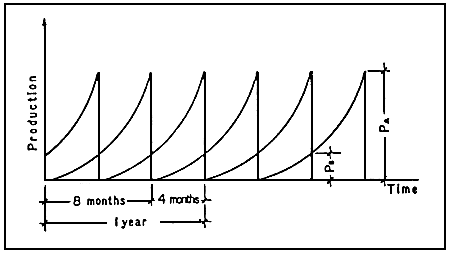
Figure 8: Production annuelle: Aquaculture “thermale”
La production de chaque d'élevage, PA est inférieure à SB max, puisque:
SB max = PA + PB
où PB est la biomasse de la population croissante décalée au moment où le cycle PA
est récolté.
Estimant, d'après les résultats expérimentaux que:
PB = 25 % PA,
Nous obtenons:
SB max = PA + 25 % PA
SB max = 1,25 PA
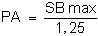
Cependant, comme la production annuelle dans le cas de n cycles, est
égale à n fois la production du cycle PA:
PFT = n PA
Nous avons:
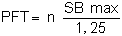
Dans l'exemple n = 3, donc
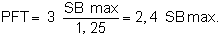
Dérivé de ceci, le taux entre la production annuelle, dans les deux cas
considéré ici, peut être obtenu de:
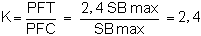
à partir de quoi:
PFT = 2, 4 PFC.
De plus, si n augmente, la production annuelle augmente aussi et par conséquent le coefficient d'utilisation des structures augmente également.
Cependant, les accroissements déclinent régulièrement alors que le coût de démarrage d'un nouveau cycle peut être considéré comme constant.
Tout ceci implique qu'il existe un nombre de cycles optimum par an, détermination exacte dépendra de l'économie et des facteurs de gestion.
C'est pourquoi il est clair que la possibilité de décaler les cycles de production, offerte par l'aquaculture thermiquement contrôlée, non seulement donne le temps d'atteindre les tailles commerciales, mais a aussi des avantages indubitables en termes de production et de gestion, tant pour les structures de grossissement que pour celles de reproduction.
En aquaculture marine, le temps nécessaire pour atteindre la taille commerciale prend normalement plus d'un an, et les considérations antérieures doivent être modifiées. En observant la croissance dans différentes conditions d'élevage (Figure 11), nous remarquerons que, dans de bonnes conditions“thermiques”, avec des eaux réchauffées, la première taille commerciale de 250 g peut être obtenue en 14 – 15 mois.
Elevage intensif dans des eaux chauffées recyclées (18 – 20° C)
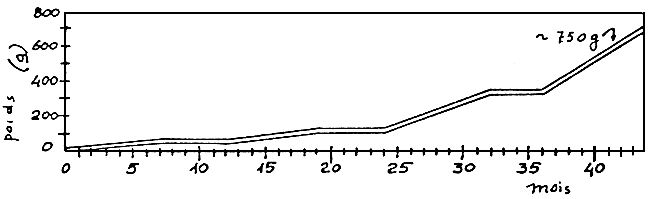
Elevage intensif dans des eaux naturelles (7° C en hiver)
Elevage intensif dans des eaux naturelles;
Figure 11: Comparaison entre la croissance du bar (Dicentrarchus labrax L) dans divers systèmes d'élevage (D'après RAVAGNAN, 1978).
Considérant qu'en eau de mer, la température de l'eau rejetée par la centrale énergétique convient aussi à la croissance en saison hivernale et qu'en écloserie, l'usage d'eau chauffée rend possible l'accélération de la croissance des alevins, ou encore que les eaux chauffées tout au long de l'année accélèrent généralement la croissance du poisson, nous pouvons espérer que la taille commerciale sera atteinte en un an.
De cette manière, nous pouvons employer, année après année, le mêmes bassins et la même écloserie.
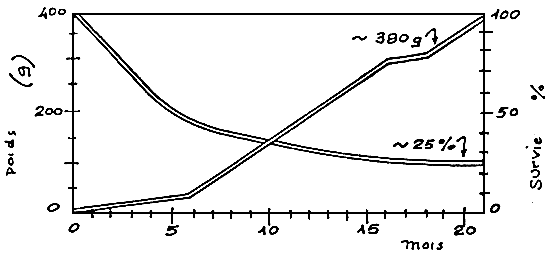
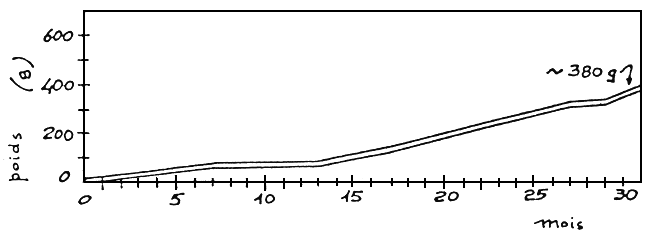
Si la reproduction s'effectue tôt, nous pouvons obtenir au même âge la situation reprise en figure 12.
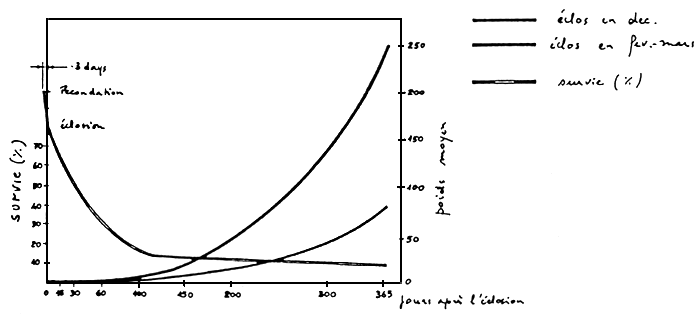
Figure 12: Croissance et survie de D.labrax jusqu'a un an.
La même situation est démontrée dans la figure 13, où le lot de“tête”, (issu de reproduction précoce et sélectionné par taille)est comparé à un lot mixte issu d'une reproduction conventionnelle.
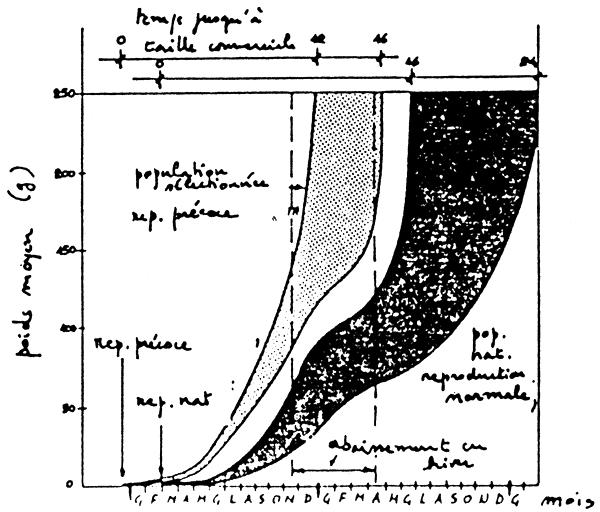
Figure 13: Croissance de populations de D. labrax, à diverses périodes de reproduction, élevées dans une ferme d'aquaculture “thermique”.
La figure 14 compare l'évolution de la croissance jusqu'à 500 g, d'une population reproduite précocement taille par taille et élevée en aquaculture “thermique”, avec celle d'une population analogue mais reproduite conventionnellement et celle d'une population d'aquaculture traditionnelle.
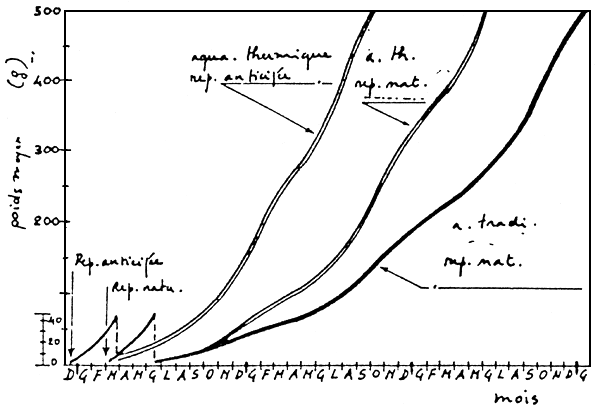
Figure 14: Croissance de D. labrax, jusqu'à 500 g, dans trois conditions d'élevage différentes
Il est évident aussi, au cas où le temps nécessaire pour atteindre la taille finale est supérieur à un an, qu'il est avantageux de raccourcir le temps de permanence des animaux dans les bassins, particulièrement en aquaculture “thermique” où les coûts de construction et de gestion sont élevés.
Cependant, l'aquaculture “thermique” est économiquement rentable uniquement lorsque la source énergétique est pratiquement gratuite, puisque de grandes quantités d'énergie sont nécessaires pour augmenter la température des énormes volumes d'eau utilisés, même s'il ne s'agit que de quelques degrés.
Si nous considérons, par exemple, un bassin artificiel pour l'élevage du poisson, il est caractérisé par une surface, une profondeur et une entrée d'eau. Sa température dépend d'une balance énergétique entre les entrées et les sorties d'énergie. A tout moment, l'équation suivante (B) doit être vérifiée:
ES = E in - E out
ES = Energie stockée
E in = Energie entrante
E out = Energie sortante
La figure 15 représente les principaux flux d'énergie pris en considération.
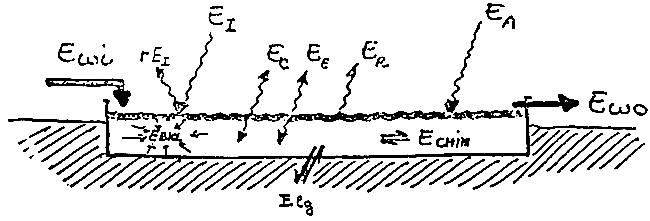
Figure 15: Balance énergétique d'un bassin avec son environnement.
Ewi = Energie de l'eau entrante
Ewo = Energie de l'eau sortante
Ei = Energie due aux radiations solaires
Ec = Energie de convection
Ee = Energie d'évaporation
Er = Energie Rayonnant de l'eau
Ea = Energie rayonnant de l'atmosphère
Ebiol = Energie utilisée par les processus biologiques
Echim = Energie utilisée par les processus chimiques
Elg = Energie perdue ou gagnée sur le fond.
Es, lorsqu'il existe, est représenté par l'augmentation de la température de l'eau dans les bassins ou par sa diminution si c'est négatif.
Si nous supposons une situation en équilibre, c'est è dire que la température du bassin ne change pas dans le temps et que nous voulons calculer le bilan énergétique dans cette situation particulière où les conditions de l'environnement sont connues, nous avons l'équation simplifiée:
Q.Cp. (Ti -Tb) + S.I -S. (Kc + Ke + Kr + Ka).(Tb - Ta) = 0
où: Q = Débit (kg/sec)
Cp = Chaleur spécifique de l'eau (J/kg °C)
Ti = Température de l'eau à l'entré (° C)
Ta = Température de l'air (° C)
Tb = Température de l'eau dans le bassin et de l'eau à la sortie en supposant un mélange homogène (° C)
= intervalle de temps
l = Intensité des radiations solaires (watt/m2)
S = Surface du bassin (m2)
H = Profondeur (m)
= Constante de Stefan - Boltzmann
Ke = Coefficient d'échnage de chaleur par évaporation (watt/m2. °C)
Kc = Coefficient d'échange de chaleur par convection (watt/m2. ° C)
Kr = Coefficient d'échange de chaleur par rayonnement (de l'eau vers l'air) (watt/m2. °C)
Ka = Idem (de l'air vers l'eau) (watt/m2. ° C)
Cette équation peut être utilisée de différentes façons:
Pour déterminer la température du débit d'entrée (Ti) de façon à maintenir la température du bassin (Tb) à une valeur désirée avec un débit d'entrée fixé (Q).
Pour déterminer le débit d'entrée (Q) nécessaire pour maintenir la température du bassin (Tb) à une valeur désirée, en ayant la température de l'eau à l'entrée = Ti.
Pour déterminer la température du bassin (Tb) dans un état d'équilibre, en connaissant le débit d'entrée (Q) et la température de cette eau (Ti).
Tout cela ne peut être obtenu que s'il est possible de connaître les valeurs des paramètres de l'environnement et les valeurs de leurs coefficients (Kc; Ke; Kr; Ka).
Ce genre de calcul, du fait de la complexité des variables, ne peut être généralement réalisé qu'en utilisant un ordinateur. Par exemple, si nous considérons le point l, ce que nous voulons connaître est Ti:
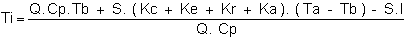
Nous pouvons considérer pour ces variables les valeurs suivantes comme étant représentatives de la situation sous nos latitudes:
S = 1 000 m2
Q = 100 kg/sec
Ta = 15° C
Tb = 25° C
I = 100 watt/m2
K = Kc + Ke + Kr + Ka (dans nos conditions climatiques, nous pouvons admettre une valeur s'étalant de 20 à 50 watt/m2. ° C, fonction éventuellement de la rapidité du vent et de l'humidité relative de l'air; en moyenne, nous pouvons admettre 30 watt/m2. ° C.
En utilisant l'équation précédente, nous obtenons:
Ti = 25,5° C
Dans les mêmes conditions, mais en considérant la température de l'air
à 0° C, nous obtenons:
Ti = 26, 5° C
La différence entre la température de l'eau à l'entrée et la température de l'eau du bassin n'est pas importante, mais néanmoins, si la température de l'eau à l'entrée est égale à 15° C, pour chauffer le bassin, il est nécessaire d'augmenter la température de l'eau à l'entrée de 10° C.
La puissance de chauffage nécessaire est:
P = Q.Cp. (Ti - Tn)
où Tn = Température de l'eau (naturelle)
L'énergie nécessaire, pour un jour, est =
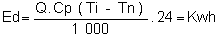
Dans notre exemple, nous avons besoin de 100 000 Kwh, et si nous utilisons
une chaudière à mazout, nous avons besoin de 8 600 000 Kcal/jour et d'après l'équation
:
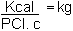
où PCI = Pouvoir calorifique du fuel (pour le mazout = 10 000 Kcal/kg)
c = Rendement de combustion (pour un bruleur = 0,7)
Cela nécessite 1,23. 104 kg/jour de mazout, à un prix très élevé.
De ce qui précède, nous pouvons voir que le coût du chauffage de l'eau d'une installation aquacole de grossissement est très élevé, et n'est pas valable d'un point de vue économique. L'utilisation d'eau réchauffée n'est possible que dans le cas où cette eau est obtenue gratuitement et consiste en eaux chaudes de rejets industriels.
Le cas le plus typique est représenté par les rejets des centrales thermiques où une grande quantité d'eau est utilisée pour refroidir les condensateurs.
uivant la seconde loi de thermodynamique, dans le procédé de fabrication de l'énergie électrique, toute l'énergie thermique obtenue par combustion ou par réactions de type nucléaire ne peut être convertie en énergie d'abord mécanique et ensuite électrique; en effet, une fraction de celle-ci, variable en fonction de l'efficacité de la transformation, s'échappe dans le milieu extérieur, sous forme d'énergie thermique à basse température.
Dans les centrales thermo-dynamiques de haute puissance, l'efficacité de transformation évaluée est telle qu'environ 50 % de l'énergie thermique entrant dans le système est déchargée dans le milieu (Figure 16).
 | Energie Utilisée |
| Pertes du chauffe-eau Installations auxiliaires Pertes dues aux machines | |
| Pertes de condensation |
Figure 16: Flux d'énergie
Dans les centrales utilisant des fuels fossiles, une partie de cette énergie est déchargée directement dans l'air, à travers les installations et les cheminées, tandis que la plupart de celle-ci est libérée dans l'eau grâce au systéme de refroidissement. Dans les centrales nucléaires, par contre, il n'y a pas de pertes par cheminée, et les pertes dans les installations sont minimales: ainsi, presque toutes les calories sont déchargées dans les eaux du systéme de refroidissement.
L'énergie apporté au condensateur, dans lequel la vapeur utilisée par la turbine pour produire de l'énergie est condensée sous forme liquide est d'environ 1 700 Kcal/Kw pour une centrale nucléaire et de 1 100 Kcal/kw dans des centrales conventionnelles au fuel ou au charbon.
Le système de refroidissement le plus couramment utilisé est le TYPE CYCLE OUVERT, dans lequel l'eau venant de la mer ou d'une rivière est employée comme fluide réfrigérant, et après son passage à travers le condensateur, est rejetée dans le milieu extérieur avec une augmentation de température d'environ 8 à 10°C.
Selons les lois de la thermodynamique, plus la température de la vapeur condensée est basse, plus le rendement (rapport entre l'énergie électrique et l'énergie thermique utilisée) est élevé et, en conséquence, plus est basse la température de l'eau de refroidissement à l'extérieur du condenseur. Dans une centrale au pétrole récente, où chaque unité vaut 320 Mw, suivant les considérations précédentes, on a besoin d'un débit d'eau de refroidissement d'environ 9 m3/sec/unité. Il est clair qu'une quantité énorme d'eau réchauffée est disponible.
Un autre système de refroidissement, utilisé pour les centrales situées dans des lieux où l'eau n'est pas disponible en très grandes quantités est le TYPE CYCLE FERME avec des tours de refroidissement humides.
Dans ce cas, l'eau venant des condensateurs est envoyée vers de grandes tours d'évaporation et après avoir libéré de la chaleur dans l'atmosphère, elle retourne aux condensateurs: les exigences en eau sont considérablement réduites puisque seules, les pertes par évaporation et par vidange doivent être compensées.
La température des eaux de refroidissement dans les tours est plus haute qu'en refroidissement à CYCLE OUVERT, mais dans les deux cas, des quantités non-négligeables d'énergie thermique sont disponibles.
Les secteurs principaux d'utilisation de cette chaleur déchargée sont l'agriculture et l'aquaculture où son faible niveau thermique peut être utilisé à profit dans les procédés biologiques qui s'opèrent à température ambiante et qui peuvent être rendus plus efficients en augmentant la température d'une façon contrôlée.
Une fois l'expérience de l'opérateur vérifiée dans le secteur spécifique ainsi que dans d'autres paramètres telś que la vocation socio-économique de la zone et la capacité d'assimilation du marché, un autre problème apparaît inévitablement c'est l'interférence gênante entre l'aquaculteur et le système qui produit la chaleur.
Pour le “producteur”, les principaux critères importants de jonction peuvent être résumés comme suit:
- Quantité de chaleur nécessaire et fiabilité exigée;
- Effet sur la production d'énergie électrique;
- Coût de déviation de la chaleur et éventuellement la place nécessaire;
- Effets possibles de la sécurité de l'installation;
- Compatibilité de cette application avec les restrictions légales.
Pour l“utilisateur”, les critères importants sont les suivants:
- Niveaux thermiques de l'eau et exigences de qualité;
- Fiabilité de la source thermique et besoin de sources supplémentaires;
- Coût de déviation de la chaleur et d'utilisation du système:
- Restrictions d'occupation de la zone.
Les deux premiers points des considérations précédentes concernent les caractéristiques physico-chimiques de l'eau déchargée par la centrale. Les principaux problèmes, à ce propos, sont résumés comme suit:
Valeurs thermiques fluctuantes: l'accroissement de chaleur causé par le système de refroidissement de la centrale n'est pas constant, mais dépend de l'activité du système producteur d'énergie, qui à son tour, dépend de la demande en électricité par les consommateurs, qui varie cycliquement durant le jour et la semaine. De plus, la centrale augmente la température des eaux naturelles qui chnage normalement au cours de l'année. C'est pourquoi nous avons de l'eau avec une température fluctuant pendant le jour et l'année, normalement de manière cyclique.
Valeurs extrêmes: La température de l'eau peut atteindre des valeurs inadéquates pour les espèces en élevage, en hiver, si la centrale travaille à bas régime ou s'arrête (Vacances de Noël, par exemple), et en été, quand les eaux naturelles atteignent déjà des températures élevées.
Celles-ci peuvent être léthales et inadéquates à la croissance et à la santé du poisson.
Choc froid: Si, dans un climat très froid, la centrale s'arrête soudainement, les animaux peuvent être exposés à un choc du au froid, qui peut être léthal ou très pénible.
Utilisation anti-fouling: Pour assurer une bonne exploitation de la centrale, des biocides sont emplyés périodiquement pour tuer les organismes qui, s'attachant aux surfaces immergées, peuvent boucher les tubes et autres mécanismes. Ceci et vrai, surtout dans les centrales centrales refroidies à l'eau de mer où, normalement, on utilise du chlore.
Pollution des eaux naturelles: Des pollutions d'origines diverses peuvent être présentes ou apparaître dans les eaux naturelles avant que la centrale ne les utilise et, dès lors, l'eau passée au travers du condensateur peut être polluée avant que la centrale ne puisse l'affecter.
Généralement, toutes ces situations ne sont pas critiques pour les poissons en élevage; cependant, certaines mesures de sécurité pourraient être programmées, par exemple un réservoir est utile pour limiter la chute de température et supprimer la pollution aigue en conditions défavorables.
La température élevée peut être supprimée en mélangeant ou en remplaçant les eaux de rejet de la centrale par des eaux naturelles, et de cette manière, il est généralement possible de maintenir les températures désirées dans les bassins d'élevage.
Après avoir tenu compte des considérations mentionnées ci-dessus et avoir vérifié que les risques sont limités, l'élevage peut se faire même directement dans le canal de décharge de la centrale, au moyen de cages flottantes.
Les cages ont beaucoup d'avantages évidents: elles n'interfèrent pas avec les opérations habituelles de la station; les frais de construction peuvent être très faibles et les cages sont installées rapidement.
Cependant, de sérieux problèmes peuvent apparaître: il n'est évidemment pas possible de contrôler les caractéristiques des eaux; les maladies des poissons ne peuvent être contrôlées que par traitement oral; la distribution d'aliments d'aliments aux poissons n'est pas régulière et dépend de la possibilité d'accéder aux cages (ceci est le cas, par exemple, de notre situation où la rivière du Po, lors des crues, ne permet pas d'atteindre les cages); la manipulation et le transfert sont difficiles et le stress apparaît fréquemment.
Dans les écloseries, où les besoins en eau sont de loin inférieurs et où il faut contrôler les caractéristiques physiques et chimiques de l'eau, il est également nécessaire de contrôler la température de l'eau au moyen d'un apport d'énergie extérieure.
Dans ce cas, il est intéressant d'utiliser un système de chauffage d'une efficacité supérieure aux systèmes conventionnels. Ceci peut être obtenu en utilisant un système' de recirculation fermé qui permet une réduction maximum du flot sortant. Mais cela nécessite un contrôle chimique et biologique des caractéristiques de l'eau. Il est intéressant d'utiliser une pompe à chaleur qui permet une réduction des côuts d'énergie.
La pompe à chaleur est une machine qui a pour but principal d'apporter de la chaleur à une température élevé; son principe de fonctionneemnt est identique à celui du réfrigérateur. La pompe à chaleur permet le transfert de chaleur d'un niveau thermique bas à un plus élevé.
Le cycle de la pompe à chaleur est représenté à la figure 17.
Un fluide (vapeur, fréon, ammoniaque) est compressé isentropiquement d'une pression et d'une température basses à une pression et à une température é élevées. l'énergie (w) est acquise par le fluide.
Le fluide est condensé à pression constante dans un condenseur et transfère l'énergie thermique (Q 2).
Le fluide est alors décompressé isentropiquement à sa pression originale et la température décroit.
Le fluide est finalement évaporé a pression constante en absorbant l'énergie (Q 1) dans l'évaporateur.
| Figure 17 | 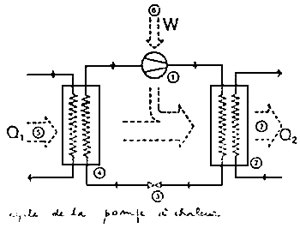 | 1. Compresseur |
| 2. Condenseur | ||
| 3. Valve d'expansion | ||
| 4. Evaporateur | ||
| 5. Chaleur absorbée à basse température | ||
| 6. Energie de compression | ||
| 7. Chaleur transférée à haute température |
L'énergie thermique transférée dans le condenseur est représentée par:
Q é = Q l + w
et le fluide à la fin du cycle contient la même énergie.
Le travail w du compresseur est lié à la différence de pression p l et p 2, et donc la température T 1 de la source où l'énergie est absorbée et à T 2 où elle est transférée.
Les caractéristiques d'une pompe à chaleur sont généralement exprimées par un “coefficient de performance”appelé C O P et défini de la façon suivante:
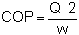
C'est à dire la quantité de chaleur donnée au fluide (chaud) Q 2 et la quantité de travail (w) nécessaire pour le chauffage.
En pratique, les valeurs du C O P s'étalent de 2,5 à 4, c'est-à-dire que les calories obtenues grâce à chaleur sont de 2,5 à 4 fois supérieures à celles qui peuvent être obtenues par un chauffage électrique de même puissance.
La figure 18 montre le schéma d'une pompe à chaleur pouvant être utilisée dans une écloserie d'espèces marines.
Les eaux chaudes déchargées par une centrale peuvent être utilisées à la fois en agriculture et en aquaculture. Les études sur l'optimisation de l'utilisation de ces eaux dans ces deux domaines ont été effectuées par plusieurs pays et reprises dans les figure 19 et 20.
Une étude a été conduite pour évaluer le dimensionnement d'un projet utilisant de manière correcte la totalité des effluents d'une centrale de taille moyenne.
Considérons une centrale avec 4 unités de 320 MW chacune, utilisant environ 40 m3/sec d'eau de refroidissement, localisée de 320 MW chacune, utilisant utilisant l'eau de la rivière Po.
Considérons seulement la moitié de la consommation d'oxygène pour déterminer le rapport biomasse/approvisionnement en eau et supposons que nous produisons 3 différentes espèces (anguille, poisson-chat et carpe); pour des raisons de sécurité, seuls 70 % des effluents de la centrale sont utilises.
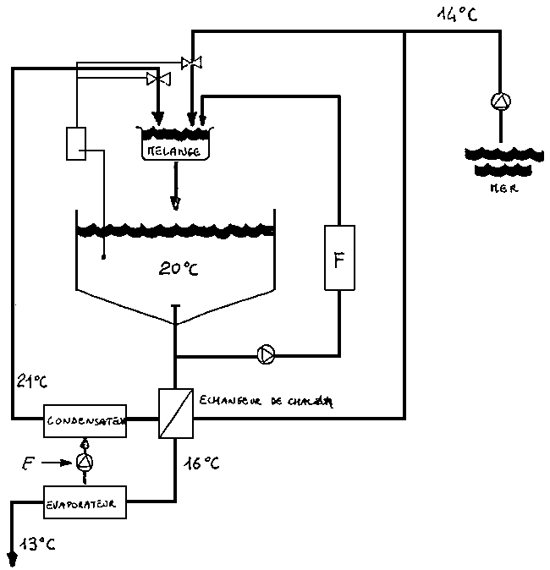
Figure 18: Représentation schématique de l'utilisation de la pompe à chaleur.
Le projet a programmé des bassins de grossissement, une écloserie avec un système de pompe à chaleur et des bassins de prégrossissement, des bassins à utiliser comme réservoirs et comme système de refroidissement supplémentaire pour les eaux déchargées et des installations appropriées.
La superficie totale occupée est de 400 ha, dont 36 pour le grossissement intensif en bassins et 360 pour les étangs. La production finale dépasse les 5 500 tonnes. (Figure 19 et 20).
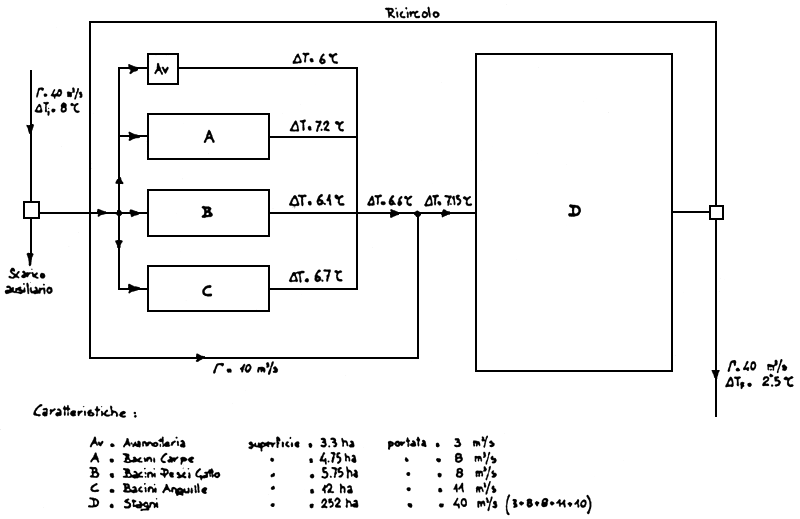
Figure 19: Balance énergétique
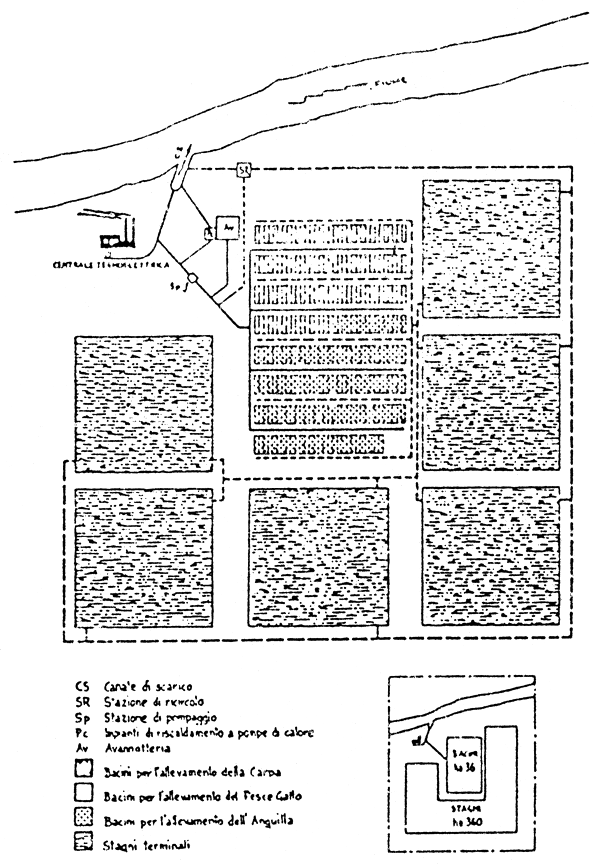
Figure 20: Ferme de poisson idéale, utilisant les eaux chaudes déchargées par une centrale.
BIBLIOGRAPHIE
HOAR, W.S.; RANDALL, D.J.; BRETT, J.R. 1979.
Fish Physiology. Vol.VIII. Bioenergetics and Growth. Academic Press.
ROGER, G.F.; MATHEW, Y.R., 1965.
Engineering Thermodynamic Work and Heat transfer. Longmans.
WHEATON, F.W., 1977.
Aquaculture Engineering. JohnWlley & Sons.
BRONZI, P; PARRINI, F. 1984.
The management optimization of a thermal aquaculture plant. XV annual
ESNA Meeting. September, 3 – 8. PLACENZA.
Mr. G.FANCIULLI
En aquaculture, la production d'aliment vivant á distribuer aux larves de poisons, crustacés ou mollusques marins constitue le point de départ, certainement le plus important, d'une bonne réussite.
En effet, un des premiers obstacles rencontrés lors des premières tentatives d'élevage larvaire était la nécessité d'avoir un aliment vivant, de petite dimension, en grande quantité et donc d'un élevage aisé.
Ceci fut un des obstacles les plus grands au plein développement des des différentes techniques de reproduction induite.
Dans le courant des années 60, dans une période relativement récente donc, au Japon, on s'est rendu compte, presque par hasard, de l'intérêt d'utiliser Brachionus plicatilis comme un premier aliment pour les larves de poissons marins.
Depuis, on s'est orienté dans cette direction en obtenant des résultats qui ont permis de porter la reproduction induite vers des niveaux industriels. Actuellement, on est même arrivé a sélectionner deux souches de rotifères, des petits et des grands á distribuer successivement. De plus, on a pu vérifier la possibilité de régler la croissance du rotifère en agissant sur l'aliment qui luiest distribué.
Dès que les Japonais ont commencé à utiliser Brachionus plicatilis, le problème de son élevage en grande quantité s'est posé. La méthode adoptée et ultérieurement perfectionnée était d'élever Brachionus plicatilis dans de grands bassins. Ceux-ci représentaient les conditions les plus voisines à celles rencontrées dans la nature ainsi que dans les bassins de grossissement d'anguilles où l'on avait observé le développement des rotifères.
La méthode consiste à provoquer un “bloom” algal dans des grands bassins en béton ou en plastique grâce auxquels on peut élever les rotifères.
Brièvement, la méthode est la suivante:
Remplissage du bassin avec de l'eau de mer enrichie des traditionnels nutrients (phosphates, nitrates et éventuellement vitamines)
Inoculation du phyto-plancton choisi comme aliment (au Japon, généralement Chlorella spp)
Lorsqu'une concentration cellulaire moyenne est atteinte, inoculation des rotifères à une densité de 15 à 30 ind/ml.
Lorsque la concentration utile est atteinte (150 à 200 ind/ml), prélèvement journalier ou alterné d'1/4 de la culture, en la remplaçant par de l'eau de mer et du phyto-plancton.
Cette méthodologie, si l'on connaît bien la physiologie et l'écologie du rotifère, devient facilement applicable et avec des résultats très appréciables.
Il y a 15 ans environ, lorsque l'on s'est décidé à faire les premiers pas vers l'aquaculture industrielle, on a cherché à copier les modèles japonais. Les résultats furent modestes et ceci, fort probablement, vu le peu de connaissance acquise dans le secteur et peut-être également, vu les conditions ambiantes différentes et sous-évaluées. On s'est orienté alors, aussi bein en France qu'en Italie, vers une production d'aliment vivant réalisée sous couvert, en bassins plus petits, en se dirigeant donc vers une technologie plus sophistiquée, rigoureusement sous contrôle, en essayant donc d'obtenir de plus grandes concentrations, dans des espaces plus restreints.
Au début, on plaça simplement les grands bassins de production d'algues et de rotifères sous couvert, occupant ainsi de vastes superficies. La superficie occupée par la production d'aliment vivant couvrait approximativement 30 % des structures d'élevage et augmantait ainsi fortement les coûts de production.
Successivement, et en ce qui concerne l'Italie, pas avant 1980, on essaya d'une part, de diminuer la superficie occupée et d'autre part, d'augmenter la capacité productive.
L'utilisation de la levure de bière (inovation venant de l'orient), aliment pour les rotifères, a provoqué un tournant décisif dans ce secteur.
Et, de cette façon, nous sommes arrivés aux temps présents. Avant d'exposer les problématiques actuelles et les technologies utilisées, tirées principalement de mon expérience personnelle, je voudrais parcourir brièvement les différences phases autour desquelles s'article la production de phyto-plancton et des rotifères et étudier ensuite la production massive, en volumes de traille moyenne.
Les algues les plus utilisées en aquaculture sont, suivant la description de PARKER et DIXON, les diatomées: Paecodactylum tricornutum, Skeletonema costatum, Cyclotella nana et Chaetoceros calcitrans, qui sont très utilisées dans l'élevage larval des pénéides.
Les haptophycées: Isochrysis galbana, Pavlova lutheri qui sont communément utilisées dans l'élevage des mollusques bivalves et depuis que l'on a mis en évidence leur contenu élevé (en comparaison aux autres espèces) en acides gras insaturés à longue chaîne.
La prasinophycée: Platimonas suecica, eat également utilisée comme aliment pour les rotifères ainsi que les chlorophycées: Dunaliella, Chlorella et Nannochloris.
Sur la figure 1, sont représentées les phases successives de culture des algues marines suivies par la plupart des pisciculteurs. Les différents passages vers un volume toujours plus grand sont liés à la diminution des temps de culture et à la division du cycle de production en différentes phases, ce qui permet, à chaque moment, un contrôle plus rigoureux. Le motif principal de ce fractionnement est donc de limiter les risques. En effet, de cette façon, si un problème se manifeste, il ne touchera qu'une partie du cycle et ne compromettra pas toute la production.
La souche est la partie de la culture la plus importante de tout le cycle. Le milieu de culture est constitué d'eau de mer stérilisée, enrichie à partir de nutrients, dont la dose est généralement in moitié de la normale. Les souches sont maintenues à basse illumination et à une température de 20 ±1 ° C.
L'erlenmeyer (vol.de ± 400 ml) sert de passage intermédiaire; son seul but est d'augmenter le volume de culture.
L'utilisation de ce volume peut se faire à n'importe quel moment, et la culture peut se maintenir durant 4 à 5 mois. Le volume successif est le ballon de deux litres qui constitue l'unité de base dans les repiquages de routine. Le schéma suivant montre la méthodologie de travail utilisée à partir des B2 (Figure 2).
Durant la pleine production, le B2 constitue le volume minimum de travail. Le schéma montre que dans la pratique quotidienne, d'une B2, on obtient, par simple dilution, un nouveau B2et au moins 2 B6 (en fonction de la concentration, il'est possible de faire varier ce rapport). Le B2 obtenu servira pour une dilution successive; les B6 peuvent servir, soit pour inoculer des volumes supérieurs (les sacs), soit pour constituer des cultures intermédiaires des rotifères.
L'utilisation des ballons en verre pyrex est destinée à disparaître, supplantée par l'utilisation plus économique et d'une gestion plus aisée de petits sacs en PVC, préparés avec les nutrients et placés au congélateur. Au moment opportun, on les remplit d'eau de mer et on fait l'inoculation. Cette pratique est encore, pour le moment, à l'étude mais pose les bases d'une accélération de de la procédure.
Depuis l'utilisation de la levure de bière, on peut considérer que le sac de 25 à 30 l constitue le volume le plus grand de cultures d'algues unicellulaires.
A l'opposé, jusqu'il y a quelques années, les volumes de production de phyto-plancton étaient constitués de bassins de plusieurs m3.
Comme nous l'avons déjà dit précédemment, l'utilisation de grands volumes (plus de 50 m3) pour les cultures de phyto-plancton et de rotifères est toujours en vigueur dans l'extrême orient. Leur grande expérience dans l'élevage des larves et des alevins, ainsi que le grand développement de cette activité, pratiquée sur une vaste échelle, leur permit d'obtenir des résultats très satisfaisants.
L'espèce élevée est le Brachionus plicatilis, universellement connue et utilisée dans toutes les installations de reproduction. Les études effectuées sur cette espèce, dans le but d'améliorer la production massive, ont couvert différents secteurs: l'influence de la concentration sur le taux de reproduction parthogénique, de la température, de la qualité et de la quantité de phyto, de la salinité …. De même, les aspects physiologiques ont été étudiés: l'uniformité métabolique, en relation avec les changements de température du milieu, les effets de la salinité et du pH sur la consommation de l'oxygène, la régulation osmostique.
Et dernièrement, toujours en suivant les Japonais, les études se sont tournées vers les situations écologiques qui se créent dans les cultures massives.
De grande importance, également, sont les études sur la composition biochimique des rotifères soumis à différents régimes. En effet, il apparaît clairement, suite aux premiers résultats obtenus, qu'il peut exister des carences, même graves, de certains composés indispensables au développement de la larve.
C'est le cas, en ce qui concerne les acides gras essentiels et particulièrement ceux, insaturés à longues chaînes d'atomes de carbone (ac.eichosapentaemic 20: 5 w 3 et ac. dochosahexaenoic 22: 6 w 3) qui sont vitaux chez les poissons marins et qui sont pratiquement absents chez les rotifères alimentés seulement avec de la levure de bière ou avec certaines algues.
Ces recherches nous ont donc amenés à étudier les principales espèces d'algues utilisées en aquaculture, afin de mettre en évidence les plus riches en acides gras.
De cette façon, a pu en constater la totale absence chez Dunaliella et dans une moindre mesure chez Tetraselmis, alors qu'il semble que le pourcentage d'acide gras insaturé le plus élevé se retrouve chez Isochrysis galbana et Pavlova lutheri.
Une autre ligne de recherche s'est développée vers la mise au point d'un aliment inerte équilibré, à distribuer au rotifère et qui servirait donc d'intermédiaire par rapport à la larve. Pour le moment, malgrè les progrès réalisés dans cette voie, on ne peut pas encore en définir la fiabilité et l'efficacité.
Le schéma (Fig. 3) montre bien plus clairement que toute explication le déroulement des opérations relatives à l'élevage du Brachionus plicatilis. Le dernier bassin, celui d'élevage“massif”, peut varier de 0.5 m3 jusqu'à plus de 50 m3, en fonction de la méthodologie utilisée. lci, nous décrirons la méthode qui prévoit l'utilisation de bassin jusqu'à 1,5 m3.
Avant de s'étendre sur la production massive, nous parcourerons brave ment les phases précédentes.
La souche, comme pour le phyto-plancton, est le point de départ de tout le cycle. On utilise l'éprouvette et l'erlenmeyer, c'est-à-dire des volumes de 50 jusqu'à 500 CC, mais l'on pourrait, surtout en période de routine, n'utiliser que l'enlenmeyer.
Le ballon de 6 1. constitue une culture intermédiaire apte à permettre un développement “massif” des rotifères qui, dans de bonnes conditions d'alimentation atteignent des concentrations supérieures à 300 ind/ml.
A partir d'un ballon, par dilution, on obtient, en général 5 sacs ( 30 1 ) avec une concentration de départ de 10 ind/ml. Ces sacs, constitués de cultures d'algues en phase de croissance exponentielle, sont prêts à être utilises 5 à 7 jours après l'inoculation, quand les rotifères ont atteint une concentration supérieure à 200 ind/ml.
Dans la méthode que je suis en train de décrire, les sacs servant à l'inoculation des volumes de production “massive”.
Au dessus de ces dimensions, il est probable qu'il sera nécessaire d'apporter des modifications à la méthode d'élevage.
Je m'arrêterai plus particulièrement sur ce point. Car après plusieurs années de travail dans ce secteur, j'ai pu me rendre compte combien il était difficile surtout pour les néophytes de bien gérer une série de ces volumes en parallàle avec le besoin journalier des larves en rotifères.
Je voudrais donc essayer de donner les indications les plus utiles pour une bonne gestion de ce secteur. Tous ceux qui élèvent des larves savent que cet objectif est rempli, si l'on est capable de fournir quotidiennement le maximum de rotifères et ceci pendant toute la période correspondante d'élevage larvaire.
Le tableau ci -dessous montre, en synthèse les paramètres abiotiques et biologiques de base pour la gestion d'un “grand volume”:
- Eau de mer filtrée et préférablement débactérisée (passage sous lampe U.V.)
- Température: 20–24° C
- Salinité: autour de 20 ‰
- Aération: 8 à 10 1/min.
- Alimentation: a) phyto-plancton: 2–4 %/jour du volume de culture proportionnellement à la concentration en rotifères.
b) levure: Jusqu'à 50 ind/ml: 4 gr/million de rot
Entre 50 et 100: 2 gr/million de rot
Supérieur à 100: 1 gr/million de rot
La forme du bassin pour ce type d'élevage “poussé” est préférablement de type cylindro-conique (comme les bassins d'élevage larvaire) parce qu'il permet aux excréments et à l'aliment non consommé de se concentrer plus facilement. II est également utile de prévoir une “vidange” dans le fond bassin afin d'éliminer quotidiennement les déchêts accumulés.
Une étude effectuée sur une période de 3 ans, sur le développement de différents bassins de culture m'a permis de focaliser, avec une bonne approximation, les paramètres moyens entre lesquels existe la probabilité maximum d'obtenir un développement régulier d'une culture.
Les graphiques (Fig. 4) montrent le développement, durant ces 3 années, de 4 indices utilisés pour évaluer la croissance d'une population, comparés à la concentration (par m3) de rotifères au moment de l'inoculation.
Ces indices sont:
- R: Taux intrinsèque de croissance journalière. C'est un indice qui exprime la capacité d'une population de croître exponentiellement.
- TD: Temps nécessaire à la population pour doubler II exprime le temps, en jours, pendent lequel le nombre d'individus d'une population double.
- NT: Concentration de rotifères por ml. au moment de l'utilisation.
- GG - Nombre moyen de jours de vie d'une culture.
Ces indices ont étés calculés sur un total de 70 cultures pour la saison 1981/82. 148 pour 82/83 et 81 pour 83/février 84.
Les moyennes obtenues aux diverses concentrations initiales ont été comparées entre elles au moyen du test de TUKEY qui permit de les réunir en groupes définis et d'établir une échelle de valeur (le test est significatif) entre les différences (si elles existent).
Ces tests ont permis de mettre en évidence que la valeur moyenne des 4 indices, obtenue à partir d'une concentration initiale de 15 rot/ml est significativement supérieure à tous les autres pour les 3 saisons.
On peut donc affirmer, avec une bonne approximation, qu'une concentration initiale oscillant entre 10 et 20 ind/ml est celle qui permit (en suivant la méthodologie d'élevage expliquée précédemment) d'obtenir une valeur de R entre 0,36 et 0,39, un temps de doublement qui varie entre 1,8 et 2 jours, une durée moyenne de la culture de 7 jours et une concentration finale comprise entre 175 et 315 ind/ml.
La même analyse effectuée sur des bassins de capacité double ( 1 200 1 ) n'a pas donné de résultats aussi constants d'une saison à l'autre.
Il se pourrait qu'à cette dimension, entrent en compte des facteurs aléatoires comme pour les volumes de plus grandes dimensions.
Un autre paramètre étudié durant cette période a été la valeur de Ro ou l'indice de fécondité, qui est le rapport entre le nombre total d'oeufs comptés dans un échantillon et le nombre d'individus. Plus simplement, cette valeur nous indique la capacité de reproduction d'une population: plus cet indice est élevé, meilleures sont les conditions de vie de cette population.
Des résultats, il apparaît, (comme on peut le voir sur la figure 5) que le 2ème et 3ème jour après l'inoculation sont ceux où la population présente le plus grand nombre d'oeufs, et ceci confirme de cette façon ( visiblement ) le bon développement de la population.
A côté de ces indices plus “mathématiques”, il existe d'autres parametres, plus empiriques, qui permettent de pouvoir contrôler le développement d'une culture et d'en prévoir l'évolution.
L'utilisation de la levure a permis, grâce à son intégration avec le régime algual, d'obtenir des concentrations en rotifère, plus élevées dans les cultures; une distribution excessive peut causer de graves phénomènes de pollution qui provoquent, en quelques heures, la destruction totale de la culture, et, en conséquence, les difficultés que l'on peut facilement imaginer au niveau de la production larvaire.
Les signes prémonitoires peuvent être l'apparition d'une couche plus ou moins épaisse de mousse en surface, riche en matériel protéique et la conséquence d'une augmentation du niveau d'ammoniaque, ou la persistance d'une odeur typique de fermentation.
Dans ce cas, l'eau de la culture a tendance à devenir blanchâtre et non plus transparente. II vaut mieux alors utiliser immédiatement la culture, vider le bassin et filtrer les rotifères avant leur destruction totale.
C'est pour ce motif que dans le tableau présent, j'ai indiqué 3 doses différentes de levures, inversement proportionnelles à l'augmentation de la concentration en rotifères.
Les données récoltées 3 années consécutives d'expérience montrent une augmentation progressive des résultats obtenus et prouvent ainsi la valeur de la méthodologie utilisée.
PRODUCTION DE ROTIFERES DURANT 4 SAISONS D'ELEVAGE
| Années | 1 | 2 | 3 | 4 | 5 | ||
| 1980–81 | 162.3 | 11.2 | 60.1 | 13.7 | 9 172.1 | 1 506 | 11 |
| 1981–82 | 142.5 | 9.9 | 81.3 | 9.1 | 8 494.8 | 764 | 6 |
| 1982–83 | 212.7 | 25.7 | 125.0 | 12.5 | 19 445.8 | 1 209 | 9 |
| 1983–84 | 205.1 | 75.9 | 123.1 | 45.5 | 10 281.0 | 560 | 9 |
| 1981–82 | 102.9 | 9.1 | 128.8 | 0.6 | 3 735.2 | 224 | 2 |
| 1982–83 | 182.1 | 26.9 | 225.0 | 6.8 | 4 505.0 | 157 | 2 |
Dans la colonne 1, est rapportée la concentration en rotifères par ml au moment de l'utilisation.
En colonne 2, la production moyenne pour chaque cycle de culture (exprimée en millions) est indiqué et en colonne 3, la production globale de toute la saison (exprimée en millions).
Cette colonne doit être lue en la confrontant à la colonne 4 où est exprimé le nombre total de jours descultures, c'est-à-dire le temps pendent lequel les bassins ont été en fonction.
Les premières expériences réalisées en 1980–81, à partir de bassins à fond plat (qui présentaient de gros problèmes d'accumulation des détritus) nous ont donné les premiers bons résultats. En 1981–82, la technique a pu être mise au point en utilisant des bassins de 600 I et utilisée en 1982–83, avec d'excellents résultats: concentration moyenne finale élevée, bon rendement par bassin.
Ce bon résultat de 600 000 alevins de 90 à 120 jours est à mettre en relation avec la production totale d'alevins de cette saison.
Enfin, 1983–84 (bien que limité à février) a confirmé les résultats précédents, soulignant ainsi la fiabilité de la méthode utilisée.
Nous avons pu, de cette façon, tripler la production de rotifères par rapport à I'époque où I'on n'utilisait que des algues comme aliment, et réduire la surface occupée d'au moins 50 %.
Comme je vous I'ai dit précédemment, il existe de nombreuses méthodes d'élevage du phyto et zoo-plancton, chacune valable en fonction des caractéristiques des installations et du milieu dans lequel on travaille. Une de ces méthodes est celle que j'ai essayé de vous décrire qui est adaptée. selon moi, à des installations situées dans des régions à climat hivernal froid (possibles gelées nocturnes et de longues périodes durant lesquelles la température est en dessous de 10° C), et où I'en est donc obligé de travailler sous couvert.
Dans cette situation, le prix élevé des constructions, joint à la difficulté (spécialement en Italic) d'obtenir les droits pour la construction de vastes bâtiments, nous ont obligés à réduire le plus possible l'espace réservé a l'élevage. Et c'est pourquoi nous avons poussé l'élevage de l'aliment vivant des concentrations très élevées. Et pour cela, il a fallu mettre and point une technique, suivie d'un contrôle constant.
FIGURE 1: CULTURE DU PHYTOPLANCTON
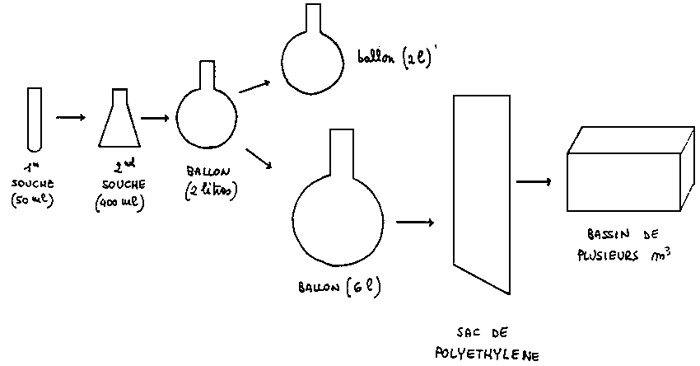
FIGURE 2: CYCLE DE ROUTINE DU PHYTOPLANCTON
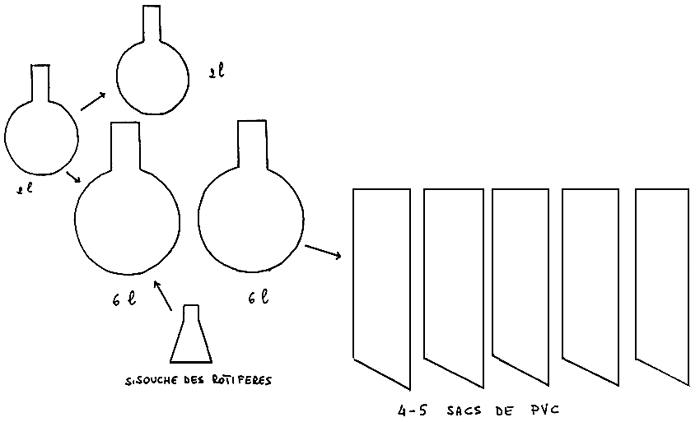
FIGURE 3: CULTURE DE ROTIFERES
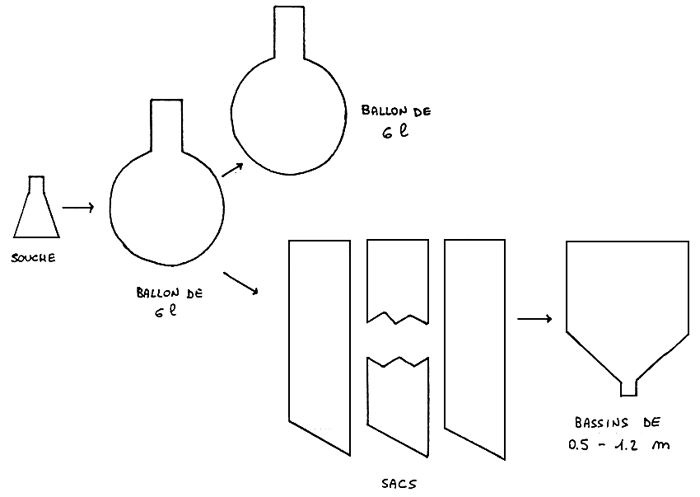
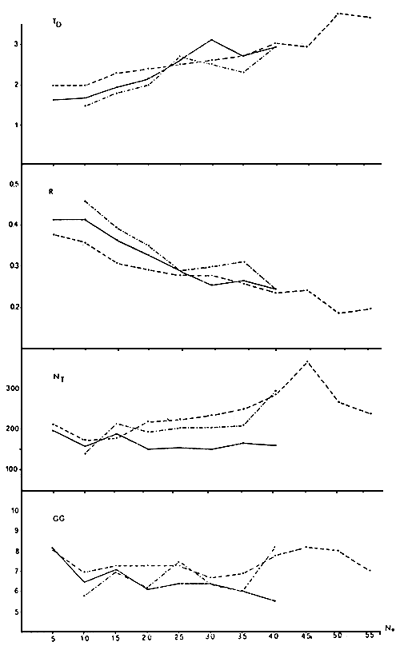
FIGURE 4: Evolution de 4 indices, sur 3 ans, permettant d'évaluer la croissance d'une population de rotifères
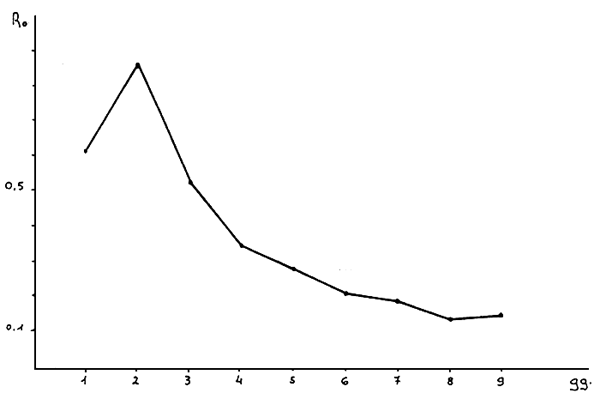
FIGURE 5: Evolution de I'indice de fécondité Ro
Mr.A.PONTICELLI
La production de phytoplancton et de zooplancton pour l'alimentation des larves des espèces marines demeure l'un des problèmes les plus importants dans la gestion d'une écloserie moderne.
La production d'aliment vivant, qui, il faut le rappeler est très coûteux, est toujours une voie obligée, à cause des très mauvais résultats des aliments inertes produits jusqu'à présent.
Les échecs, dans l'utilisation des micro-granulés, sont dus essantiellement à:
- L'absence de mouvement: Les larves sont, au contraire, attirées par le mouvement du zooplancton.
- Les granulés tombent, en général, très rapidement sur le fond.
- En conséquence, le bassin est pollué plus rapidement.
A tout cela, il faut ajouter que, particulièrement dans l'élevage de certaines espèces (mollusques et crustacés), le phytoplancton joue un rôle d'épuration et bactériostatique très important. Il apparaît donc que, dans les années à vepir, la production primaire et secondaire sera toujours irremplaçable dans le processus productif d'une écloserie.
Les systèmes de production intensive du zooplancton ont atteint un excellent niveau de fiabilité.
TRUTTA (1980 a; 1980 d; 1983)a récement décrit un module de production intensive de 160 millions de rotifères par jour. Un tel niveau de production peut largement satisfaire les exigences d'une écloserie moyenne.
La méthode de production intensive du zooplancton quoique sûrement valable et performante, montre aussi des désavantages, surtout au point de vue économique:
- Frais d'investissement très importants,
- Frais de gestion: Energie, personnel,
En particulier, la production intensive demande, surtout à cause des conditions aseptiques nécessaires, l'intervention d'un personnle spécialisé.
Les frais d'investissement et de gestion d'ne unité de production intensivé de phytoplancton et de zooplancton ne sont donc pratiquement à la porté que des grandes installations d'aquaculture.
La méthode de production intensive demeure toujours irremplaçable, mais peut être appuyée par d'autres systèmes de productions extensive ou en grands volumes.
La production de zooplancton (surtout de rotifères), selon cette méthode, prévoit l'utilisation de volumes de culture très importants (10–80 mètres cubes, ou plus).
Les différences fondamentales entre les cultures de zooplancton en grands volumes et les cultures intensives sont:
- Condition non monoxénique: dans la culture, il y a plusieurs espèces de plancton et de zooplancton, au même moments.
- La densité du plancton en élevage est plus faible (15–70 rotifères/ ml. en moyenne).
Nous prenons comme exemple un bassin 70 m3, équipé d'un système d'aération.
Dans le bassin, on introduit de l'eau de mer en ajoutant, si possible, de l'eau douce (optimum de salinité 25 ‰).
L'eau fertilisée par des engrais agricoles selon les formules du Tableau № 1; il est conseillé de nettoyar préalablement le bassin (eau de javel à l ppm) pour éliminer les organismes non désirés.
Dans le bassin, on inocule du phytoplancton, normalement Chlorella sp (3–4 mètres cubes de culture à la densité de 5–10 millions de cellules par ml.). En quelques jours, selon la saison et l'intensité lumineuse, le phytoplancton atteint la concentration de 10–15 millions de cellules par m).; à ce moments, des rotifères en provenance d'une autre culture, sont inoculés à la concentration initiale de 4–10 ind./ml.
La concentration en rotifères augmente assez rapidement; quand elle atteint 15–30 ind./ml. (la couleur de la culture vire, en très peu de temps, du vert, au brun), on commence à donner de la levure (jusqu'à un maximum de 500 grammes par jour, pour un bassin de 70 mètres cubes). Dans le cas d'une présence très important de protozoaires après quelques jours d'élevage, de l'eau de javel est utilisée, dans le milieu de culture lui-même, à raison de 0,3–0,5 ppm. Cette intervention permet d'éliminer les protozoaires sans effet dangereux pour la culture.
Avec ce type de culture, on atteint des concentrations de 30–60 rotifères/ml, avec un maximum de 114 rot./ml en été, correspondant à une production de 4 milliards de rotifères (PONTICELLI et al., 1985).
Normalement, à de telles concentrations, la culture dégénère en très peu de temps. Les techniciens ont donc intérêt à maintenir la concentration en dessous de 50–60 ind./ml, en collectent fréquemment les rotifères.
Ce type de culture est surtout prstiqué, pour le moment, au Japon, dans les grands centres de productions d'alevins destinés au repeuplement.
Une unité type de production de zooplancton est costituée par 8 bassins, munis d'une aération de 150 mètres cubes.
Après la fertilisation, on attend que le phytoplancton atteigne la la concentration de5–10 millions de cellules/ml. A ce moment, on introduit les rotifères, à raison de 100 ind./ml. Dès le deuxième jour de culture, de la levure, enrichie en huile de foie de poisson, est distribuée à raison de 500–2 000 g./jour par bassin.
Dans ce type de culture, la concentration en rotifères peut atteindre 400 ind./ml, mais la durée de la culture est beaucoup plus brève, deux semaines au maximum, (plus fréquemment, on ne dépasse pas 6–7 jours).
Dans chaque bassin, on peut donc filtrer, tous les jours, 2,3 milliards de rotifères pendant plusieurs jours.
Au centre de repeuplement de TAKEHARA, au Japon, on a atteint, pour la production de 4 millions de madai ((daurade japonaise), dans la période d'avril à juillet, 1 221,8 milliards de rotifères (HENOCQUE, 1984).
Cette méthode est donc basée sur des prélèvements et des renovellements de culture régulier (Tous les 6–10 jours).
Cependant, les quantités d'eau, de fertilisants et de nourriture nécessaires entraînent des coûts importants.
pour les écloserise placées à d'une lagune saumâtre, une autre possibilité est la récolte du zooplancton dans les endroits marginaux des lagunes, des endroits à faible taux de renouvellement d'eau et très eutrophisés.
Une deuxième possibilité consiste en la culture de zooplancton dans des bassins en terre fertilisés de façon appropriée (Voir GEIGER, 1983: DOYLE et al., 1984).
Ces techniques ont eu d'importantes applications, surtout dans le sud de la France, dans la région du Languedoc-Roussillon très riche en zones humides, lagunes saumâtres et marais salant (BARNABE, 1978; 1984 p; 1984).
Compte tenu du fait que la concentration de zooplancton est assez faible, le problème le plus important à résoudre, est la mise au point d'un appareil de récolte automatique; une récolte qui doit être rapide et qui, surtout, ne doit pas endommager le plancton.
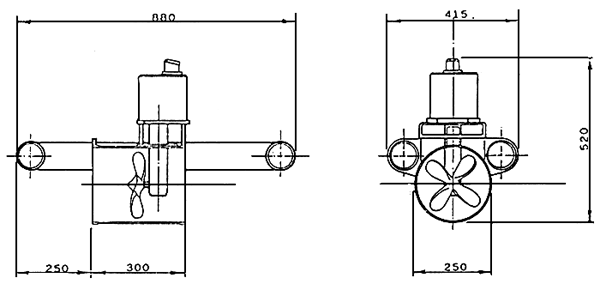
Un appareil servant à la récolte automatique du zooplancton (BARNABE, 1980; PORTICELLI et al., 1985)est constitué par un cylindre en PVC de 30 cm de diamètre et de 50 cm de longueur, au centre duquel tourne une hélice, grâce à moteur d'une puissance de 50 watts et à un système d'engrenage (Voir Fig.2) (MORETTI, 1985).
Le cylidre est maintenu horizontalement en dessous du niveau d'eau, par des flotteurs de volume appeoprié
L'hélice, en tournant dans le cylindre, provoque un flux d'eau constant qui est filtré par on filet de 4 mètres de longueur qui récolte le zooplancton; on utilise des filets á plancton avec un vide de maille différent selon les organismes que l'on veut pécher (le vide de maille varie entre 50 μm et 500 μm). La force motrice est assurée par un accumulateur de 60 ampères/heure, relié au moteur par un cable de 2 millimètres de section.
Un régulateur électronique, á très faible absorption de courant, permet de faire varier la vitesse de rotation de l'hélice entre 80 et 250 tours par minute.
Cela correspond á un débit d'eau dans le cylindre, variant entre 70 et 400 litres par minute.
La vitesse de rotation est choisie selon la concentration de zooplancton; en principe, on utilise une vitesse de rotation faible, en présence d'une concentration de zooplancton très importante, ou dans le d'une avec beaucoup de substances organique en suspension (le colmatage du filet peut provoquer, par un débit trop fort, sa déchirure et la perte du plancton collecté).
Le collecteur est aussi équipé d'une lampe de faible puissance (2 W) qui, pendant des pêches réalisées la nuit, attire le zooplancton et améliore, de cette manière, l'efficacité de la récolte.
Les groupes zoologiques les plus abondants sont les rotifères, les copépodes, les ostracodes et, pour les bassins d'eau sursalée, les Artemia.
Les salinités les plus intéressantes pour la production de zooplancton sont celles qui varient entre 10 et 20‰.
Le lagunage est le processus par lequel les eaux polluées de petites communautés sont épurées dans de grands bassins: à la fin du traitement, l'effluent possède des caractéristiques très proches de celles de l'eau de baignade.
Les bassins de lagunage ont des dimensions assez importantes (1 ha pour l'épuration des eaux usées d'un village de 1 000 habitants). Normelement, le lagunage s'effectue à partir de trois bassins, dits de stabilisation, dans lesquels l'eau circule de l'un à l'autre. Dans le premier bassin, il y a une activité très importante des bactéries, dans le deuxième, du phytoplancton et dans le troisième, du zooplancton.
Les trois bassins ont une faible profondeur (l m à 1,5 m) afin de favoriser l'oxygénation complète de toute la masse d'eau et la pénétration de la lumière. Les bassins ont une forme en “S” qui contribue à obtenir un effet hydrodynamique maximum dans le lagunage.
Le zooplancton est représenté essentiellement par 4 groupes d'animaux. Les ciliés qui consomment des bactéries, les rotifères qui consomment du phytoplancton et des bactéries et qui peuvent atteindre la concentration de 150 ind./ml, les copépodes (des crustacés de 200–500 μm) qui consomment essentiellement du phytoplancton et enfin les daphnies (crustacés de grande taille, 1à 3 mm).
Les daphnies peuvent atteindre une densité de quelques centaines au litre.
La production d'un bassin d'épuration est énorme, 40–60 tonnes/ha/an de phytoplancton et 8–9 tonnes/ha/an de (en biomasses fraîche).
Le zooplancton peut être collecté dans le bassin de lagunage:
- d'une façon passive en adaptant un manche filtrant sur les buses de sortie des effluents,
- par des collecteurs du même type que celui précédemment décrit,
- par des collecteurs-trieurs; dans ce cas, l'eau est pompée, envoyée à terre sur une série de tamis cylindriques rotatifs de vide de maille décroissant.
Le zooplancton récolté peut être utilisé directement pour l'alimantation des alevins d'espèces marines telles marines telles que le loup. BARNABE a obtenu de hautes survies d'alevins de loup, alimenté seulement à partir de zooplancton vivant, du 40 au 100è jour de vie. Le zooplancton peut être aussi congelé ou sêché.
L'écloserie municipal d'ORBETLLO (Italie) utilise depuis plusieurs années les techniques de zooplancton en grands volumes (SALVATORI et al., 1985).
Dans l'écloserie, on utilise 5 bassins de 70 m3 pour la culture des rotifères et des copépodes. L'élevage larvaire est réalisé dans 6 bacs de 18 m3 qui fonctionnent à circuit ouvert. En effet, un puits d'eau de mer donne jusqu'à 15 litres par seconde, d'eau à la température constante de 25° C. L'eau du puits est mélangée avec l'eau de mer froide, pour obtenir une température d'élevage de 12–15° C.
Les rotifères (produits selon la techniques décrite au paragraphe 3.1, dans des bassins de 70 m3)sont collectés soit mannuellement, soit par le collecteur automatique ou, plus fréquement, par un simple collecteur fonctionnant avec un air-lift (ANGELINI, communication personnelle; Voir Fig. 3).
Pour augmentre la température dans les bassins de culture de rotifères, un simple échangeur, constitué par un tuyau en PVC, a été essayé avec de très bons résultats.
L'eau du puits à 25° C, en circulant dans le tuyau (de plusieurs dizaines de mètres de longueur) chauffe l'eau de culture du zooplancton, ce qui a permis d'atteindre une augmentation de température de 3–4 degrés.
A l'extérieur de l'écloserie, deux bassin de 600 et 250 m2 sont utilisés aussi pour la production de zooplancton (rotifères, copépodes, ostracodes) en extensif.
Les bassins sont fertilisés avec des engrais agricoles organiques et inorganiques.
Dans ces bassins, la récolte du zooplancton est effectuée par un collecteur automatique. Le collecteur, dans le bassin de 600 m2, est installé à côté d'une passerelle et peut fonctionner d'une façon automatique, à l'heure désirée par les techniciens. En effet, une horloge permet le démarrage du collecteur pendant la nuit, ou le matin, très tôt. Les techniciens, en arrivant à l'écloserie, trouvent donc la collecte de plusieurs heures de fonctionnement prête pour l'émission dans les bassins d'élevage larvaire.
De temps en temps, des récoltes sont effectuées aussi dans des lieux éloignés de l'écloserie: par exemple, dans une partie de la lagune, d'environ 40 ha, à très faible profondeur et très eutrophisée, ou sur des terrains très bas, au dessous du niveau de la lagune, qui pendant l'hiver sont submergés par 30–40 centimètres d'eau et qui sont particulièrement riches, à cette époque, en zooplancton.
Dans une autre installation d'aquaculture dans le sud de l'Italie (ITTICA Ugento-LECCE), la production de zooplancton réalisée en intensif dans l'écloserie, est complétée par une production en grands volumes à l'extérieur.
En effet, après les ventes des anguilles, bars et daurades, au mois de décembre, une partie des bassins en béton reste vide jusqu'au mois d'avril. cette période correspond exactement à la période de besoin maximum de zooplancton pour l'alimentation des larves de bar et de daurade.
Les bassins en béton de 1 200 m3 sont donc fertilisés selon la formule précedemment donnée, et le zooplancton est collecté à l'aide de l'appareil de récolte automatique.
La production de zooplancton, cléf du processus productif d'une écloserie, demeure l'un des obstacles les plus importants du développement de l'aquaculture marine.
Le système de production intensive de zooplancton sur cultures monoxéniques de micro-algues, quoiqu'il soit vérifié et performant, demande des frais d'investissement et de gestion très importants.
Il demande aussi du personnel technique spécialisé qui n'est pas toujours à la portée des petites et moyennes entreprises.
La production de zooplancton en grands volumes ou sa récolte, par des systèmes automatiques, dans des milieux lagunaires très eutrophisés, représente une excellente oppertunité pour beaucoup de fermes aquacoles qui ont à leur disposition de grandes surfaces ou qui sont localisées à proximité de lagunes saumâtres.
On peut considérer comme optimum, une situation dans laquelle une production de zooplancton de type intensif, au niveau d'une écloserie, est soutenue par une production en grands volumes et par la récolte automatique, dans des bassins extensifs.
| Fertilisants | Quantité (g) | ||
| 1 | 2 | 3 | |
| Sulfate d'ammonium | 100 | 100 | - |
| Superphosphate d'oxyde de Calcuim | 20 | 20 | 15 |
| Clewat-32* | 4 | 4 | 5 |
| Urée | - | 4 | 50 |
| Clewat-32 | (en %) | ||
| Fecl3 .6H2o | 0,385 | cuso4 5H2O | 0,007 |
| Zncl2 | 0,166 | (NH4)6 Mo7 O24 4H2O | 0,632 |
| Mncl2 .4H2O | 0,776 | H3BO3 | 2,470 |
| CoCl2 .6H2O | 0,017 | (HOOCCH2)2 NCH2 N (CH2COOH)* (quantité appropriée) | |
* EDTA(Ethylene-diamine-tetraacetic acid)
TABLEAU 1 - Fertilisants utilisés selon trois formules différentes et composition du Clewat-32. Quantités indiquées pour 1 m3 d'eau. (d'aprés HENOCQUE 1984).
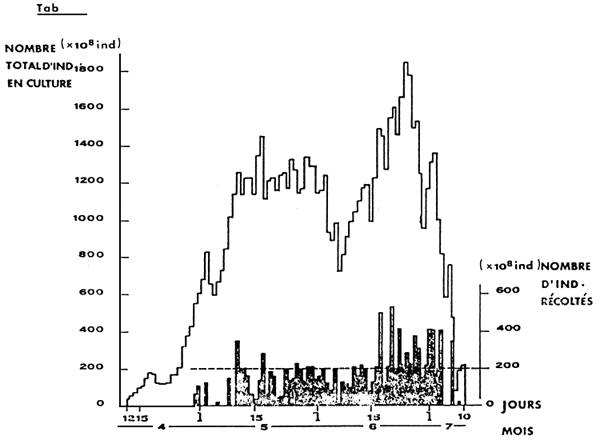
FIG. 2. CULTURES DE ROTIFERES, D'AVRIL A JUILLET 1982, AU CENTRE JAPONAIS DE TAKEHARA (D'APRES HENOCQUE 1984)
 | Poids | kg.13 |
| Tension | 12 v | |
| Puissance du moteur | 50 v | |
| Vitesse minimale | 80 RPN | |
| Vitesse maximale | 250RPN | |
| Portée maximale | 400 It/l. | |
| Protée minimale | 70 It/l. | |
| Absorption minimale | 2 A | |
| Absorption maximale | 3,2 A |
FIG. 3- COLLECTEUR AUTOMATIQUE DU ZOOPLANCTON
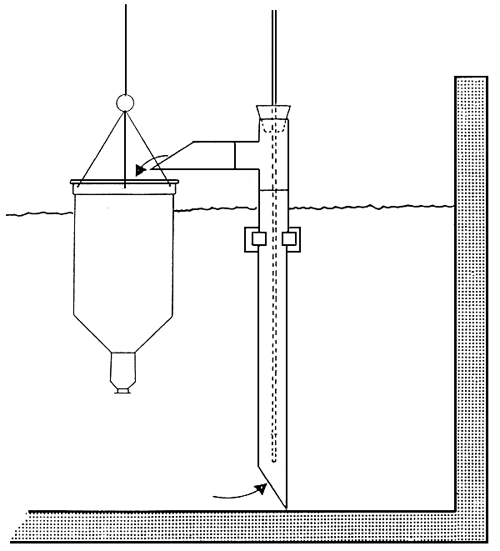
FIG. 4 COLLECTEUR DE ROTIFERES FONCTIONNANT AVEC UN AIR-LIFT (M.ANGELINI)
BIBLIOGRAPHIE
BARNABE G., 1978 - Utilisation des chaînes alimentaires naturelles et du recyclage des eaux usées dans la production à grande échelle de juvéniles pour l'aquaculture. Publ. Sci. Tech. CNEXO; Actes colloq., 7: 221 – 238.
BARNABE G., 1980 - Système de collecte du zooplancton à l'aide de dispositifs autonomes et stationnaires. In R. Billard, La Pisciculture en Etang. l.N.R.A. Publ. PARIS: 215 – 220.
BARNABE G., 1984 - Utilisation de plancton collecté pour l'élevage de poissons marins. In BARNABE G. et BILLARD R.Ed., L'aquaculture du Bar et des sparidés, I.N.R.A.Publ., PARIS, 185 – 207.
DOYLE K., BOYD C., 1984 - The timing of inorganic fertilisation of sunfish ponds. Aquaculture, 37:169 – 177.
GEIGER J.G., 1983 - A review of pond zooplankton production and fertilization for the culture of larval and fingerling striped bass. Aquaculture, 35 353 – 369.
HENOCQUE Y., 1984 - Production de nourriture à grande échelle en écloserie. Rapport de mission. Maison Franco-japonaise. 8 pp.
MORETTI A., 1985 - Utilizzo di zooplancton nei processi producttivi in acquacoltura. Rapp.Fin.di Attività. Contratto ENEA N-25073. 25 pp.
PONTICELLI A., ANGELINI M., LENZI M., SALVATORI R., 1985 - Raccolte di zooplancton in ambienti eutrofici a mezzo di un'apparecchiatura automatica. XVI Convegno S.I.B.M. - LECCE 25–30 Settembre 1984. Oebalia vol XI, N.S. 181 – 186.
SALVATORI R., ANGELINI M., LENZI M., FOMMEL F., PONTICELLI A., 1985, Allevamenti larvali di Dicentrarchus labraxmediante utilizzazione di acque ipotermali. Tre anni di esperienze. XVI Congresso S.I.B.N., LECCE, 25 – 30 Settembre 1984. Oebalia Vol.XI-2, N.S:729 – 736.
TROTTA P., 1980 a - A simple and inexpensive system for continuous monoxenic culture of Brachionus plicatilis Muller as a basis for mass production. In algae Biomass; eds Shelef, C.J. Soender and M. Balaban, Elsevier/North Holland Biomedical press, AMSTERDAM.
TROTTA P.,1980 b - A simple and inexpensive system for continuous monoxenic mass culture of marine microalgae. Aquaculture, 22: 383 – 7.
THOTTA P.,1983 - An indoor solution for Mass production of the marine microalga Tetraselmis suecica Butcher, Aquacultural Engineering, 2: 93 – 100.
Mr. P. Sorgeloos, Mr. Ph. Léger, Mr. P. Lavens et Mr. W. Teckaert
La production aquacole moderne passe par la domestication totale de l'espè à élever, poissons et crustacés. Ceci nécessite l'élaboration de techniques de culture “d'oeuf & oeuf”, contrairement à l'élevage d'alevins ramassés dans la nature qui était pratiqué dans le temps. Les reproducteurs sont induits à pondre en captivité. Leur progéniture est transférée dans des bacs d'élevage où les larves se développent jusqu'à un stade juvénile ou post-larvaire. Au cours du stade “nurserie”qui suit, les juvéniles sont conditionnés pour etre transférés vers le milieu naturel, dans les bassins ou les cages de grossissement, où ils seront élevés jusqu'à ce qu'ils atteignent une taille commerciale; pendant ce dernier stade ils sont nourris de plancton naturel et/ou de benthos, complétés par la suite par des aliments composés, Une petite partie de la récolte est utilisée pour stocker de nouveau l'unité de “maturation”, ce qui permet de boucler le cycle.
La production intensive de larves de la plupart des poissons et crustacés marins est toujours limitée par la demande en aliments vivants, du moins au cours des premiers Stades d'élevage. Etant donné que les techniques de collecte ou de culture de l'aliment naturel, caractérisé par une grande variété de plancton, sont soit impossible à pratiquer sur le plan commercial, soit difficiles à réaliser sur le plan technique, il était urgent de trouver un substitut au plancton naturel. L'aliment vivant utilisé couramment et avec succès dans l'élevage larvaire de poissons et de crustacés est l'Artémia. Do point de vue technique, l'avantage présenté par l'Artémia réside dans la possibilité de produire “sur commande” à partir d'une poudre sèche stockable des aliments vivants, c'est-à-dire, à partir de cystes (oeufs) secs qui, lorsqu'ils sont immergés dans l'eau de mer, reprennent leurs acitivités métaboliques et libèrent des larves (nauplii) nageantes d'une taille de 0,4 mm dans un délai de 24 heures. Actuellement plus de 100 tonnes de cystes secs d'Artémia sont vendus chaque année pour la production à l'échelle mondiale de nauplii d'Artémia nouvellement éclos destinés à etre utilisés comme aliments au stade de l'écloserie dans la culture de poissons et de crustacés.
L'historique de la production des cystes d'Arteémia s'avère très intéressant. Au cours des années 1960, l'approvisionnement commercial se faisait à partir de quelques sources en Amérique du Nord qui semblaient etre illimitées. Cependant, avec l'expansion de la production aquacole au cours des années 1970, la demande en cystes d'Artemia a rapidement dépassé l'offre, et par conséquent les prix ont augmenté rapidement. L'impact dramatique de la pénurie de cystes sur l'expansion de l'aquaculture-écloserie de poissons et de crustacés marins, a été souligné à maintes reprises dans les conférence internationales. En particulier, les pays du tiers monde ne peuvent guère se permettre d'importer ces cystes très coûteux.
La recherche fondamentale et appilquée sur l'Artémia a été lancée à l'Université de Ghent (Belgique) au début des années soixante-dix, Lors de la conférence technique sur l'aquaculture organisée par la FAO à Kyoto en 1976, nous avons déclaré sur la base de nos connaissances (théoriques) que la pénurie de cystes n'était qu'un problème aritficiel et temporaire. An cours des années qui ont suivi, plusieurs organismes de coopération nationale et internationale ont eu l'occasion de wérifier nos affirmations théoriques et ont donné la preuve de la possibilité de produire économiquement l'Artémia dans différents pays du tiers monde. Aujourd'hul l'Artémia est produit et exploité dans les cinq continents. Par ailleurs, des projets de démonstration d'unités intégrées de production d'Artémia ont été réalisées, ou sont en voie de réalisation, dans plusieurs pays du tiers monde, offrant ainsi des possibilités intéressantes pour l'amélioration de la situation socio-économique.
L'Artémia possède caractéristiques unigues offrant un potentiel important pour la production grande échelle:
- dans les conditions optimales, l'Artémia passe de l'état larvaire á l'état adulte en moins de deux semaines, avec un facteur de croissance en longueur de 20, et un facteur d'augmentation de la biomassse de 500;
- les besoins abiotiques et biotiques ne changent pas au cours du développement;
- l'Artémla peut être élevé dans un champ très étendu de salinité de l'eau; c'est-à-dire, de 10‰ jusgu'au niveau de saturation. Aucun prédateur ou compétiteur sur le plan alimentaire ne survit au delà de 100‰, ce qui crée une situation de monoculture en conditions naturelles;
- il existe plusieurs centaines de souches naturelles d'Artémia dans les salines côtières ainsi que dans les lacs salés intérieurs (riches en sels de chlore, de sulphate ou de carbonate) des cinq continents;
- ce crustacé peut se réproduire de deux façons, soit par la reproduction directe (les nauplii en nage libre) soit par la production des cystes (l'embryon se dévoloppe en gastrula, et à ce stade il est encapsulé dans une coquille cystique, son métabolisme étant interrompu de manière réversible);
- l'Artémla a un taux de fécondité très élevé (plus de 100 cystes ou nauplii tous les quatre jours) et une longue durée de vie (plus de six mois);
- vu que l'alimentation de l'Artémla est basée sur des particules, une gamme très large d'aliments et de fertilisants très économiques peuvent être utilisés dans sa culture, ex.: engrais organiques (guano de poulet), sous-produits agricoles (son de riz, petit lait, levure de bière), etc.;
- Il est possible d'élever avec succès l'Artémla á très grande densité (plus de 10 000 individus par litre) dans l'eau salée, de plus, il n'est pas très exigeant quant á la composition qualitative et quantitative de cette eau;
- l'Artémla adulte possède une valeur nutritionnelle très élevée: son exosquelette est très mince (moins de 1um), 60 % de son poids sec est constitué de protéines qui sont riches an acides aminés essentiels; l'Artémia contient également des concentrations importantes de vitamines, d'hormones, de caroténoides, etc…
Les connaissances exactes des caractéristiques biologiques et écologiques de l'Artémia (cycle de vie et habitat) révèlent le potentiel d'exploitation que représentent des sources natusrelles de cystes et de biomasse existantes dans les salines ou les lacs salés. La distribution (ou mieux encore “dispersion”) naturelle de l'Artémia peut être améliorée par l'intervention de l'homme, c'est-à-dire, par l'introduction (ou la “transplantation”)d'une souche sélectionnée d'Artémia dans un environnement approprié (ex.: une saline en exploitation), menant à l'établissement de nouvelles populations d'Artémiaqui seront par la suite exploitées commercialement. L'Artémia ne résiste pas aux prédateurs pendant la saison des pluies dans les régions où cette dernière est prolongée, ainsi il faut la réintroduire au début de la saison sèche lorsque les conditions de salinité s'accordent à la monoculture de ce crustacé. Des bassins de petite dimension, fertilisés au moyen de guano de poulet, peuvent produire jusqu'à 20 kg (poids sec) de cystes d'Artémia ou 1500 kg d'Arteémia adultes (poids vif - la biomasse) par hectare et par mois. Bien qu'il soit déjà réalisé à l'échelle commerciale dans des salines artisanales en Asie du sud est, ce type de production d'Artémia peut être optimiser davantage et nécessite une augmentation des services de vulgarisation. Vu l'effet bénéfique de l'Artémia sur l'exploitation solaire de sel, la production intégrée de se) et d'Artémia, éventuellement assortie avec l'élevage de crevettes, présente le meilleur rapport coOts-bénéfices. Par ailleurs, cette possibilité de valorise les salines abandonnée ou de réactiver les systèmes de production solaire de sel, actuellement exploités à la limite de la rentabilité (les exemples sont nombreux, dans plusieurs pays du tiers monde en Asie et en Amérique), offre des occasion intéressantes de développement socio-économique dans des régions économiquement défavorisées.
Lorsque les conditions ne sont pas favorables à la production d'Artémia dans les étangs (ex.; niveau de salinité trop bas pendant la saison des pluies) il est possible d'introduire au sein de l'élevage de poissons ou de crevettes, des techniques de culture intensive en utilisant l'eau de mer naturelle et les sous-produits agricoles micronisés tels que le son de riz. on utilisant des méthodes de culture en continu ou en discontinu, on peut obtenir des récoltes bi-hebdomadaires respectivement de 5 et 25 kg de poids vif d'Artémia pour chaque bac de 1 m3. Le coût de production de la biomasse d'Artémia en systèmes de culture intensifs est beaucoup plus important que celui de la biomasse récoltée en milieu naturel ou produit en étangs. Cependant, ce nouveau type de production contrôlée d'Artémia s'intègre facilement dans les opérations d'écloserie (exigences techniques similaires), se pratique tout au long de l'année, et de plus, offre la possibilité de jouer sur la qualité de ceux-ci par le contrôle/manipulation (taille, composition biochimique), les Artémias étant utilisés comme régime alimentaire pour la nurserie et la maturation (voir plus loin).
Des technologies améliorées de récolte de cystes/biomasse et de traitement (nettoyage, congélation/séchage, conditionnement) devraient être pratiquées parce qu'elles affectent la qualité du produit final.
Dans beaucoup de situations, l'emploi de l'Artémia dans l'élevage de poisson et de crevettes peut etre considérablement amélioré. Bien que la production de nauplii par l'éclosion de cystes parait être une procédure simple, il est nécessaire de prendre des précautions spéciales afin d'assure l'éclosion maximale lors de l'incubation d'une grande quantité de cystes (ex.: conditions optimales de température, de salinité, d'oxygène, de pH, de lumière et de propreté). L'emploi de cystes d'Artémia “décapsulés” est préférable dans les écloseries de poissons/crevettes pour plusieurs raisons. Par l'oxydation àl'hypochlorite il est possible de dissoudre la coque externe du cyste sans affecter la viabilité de l'embryon. Au moment de l'incubation en eau de mer, on constate que le pourcentage d'éclosion de ces embryons désinfectes et nus augmente, et que leurs nauplii ont une valeur énergé'tique plus élevée par rapport aux nauplii produits à partir de cystes n'ayant pas été traités. par ailleurs, l'emploi de cystes décapsulés élimine la tache encombrante que constitue la séparation des nauplii de leurs coques vides.
Etant donné que différentes souches d'Artémia sont commercialement disponibles à partir de sources géographiques très diverses, des différences significatives ont été signalées quant aux succès enregistrés dans l'élevage larvaire de plusieurs espèces de poissons et de crevettes. l e nauplius d'Artémia peut être d'une taille trop volumineuse pour être et ingéré par la larve. Il est donc conseillé de commencer la distribution d'aliments en ajoutant fréquemment les nauplii nouvellement éclos de souches sélectionnées d'Artémia produisant des nauplli de petite taille. Afin de réduire les opérations d'éclosion et pour obtenir la valeur maximale des nauplli, de hautes concentrations d'Artémia peuvent être stockées á une basse température pendant une durée allant jusqu'é48 heures.
Des analyses biologiques et biochimiques détaillées ont démontré que la composition nutritionnelle de certaines souches d'Artémia et même de certains lots appartenant à la même souche, ne sont pas toujours conformes aux besoins des larves de poissons ou de crevettes. Le facteur le plus critique déterminant la valeur nutritive de l'Artémia en tant que source d'aliment pour les larves de crevettes et de poissons marins est probablement la présence et la concentration d'HUFA (acides gras hautement insaturés 20: 5w3 et 22: 6w3) qui, en fonction de la souche ou même du lot de cystes provenant de la même source géographique, peuvent être en-deçà du minimum requis, voire mêeme comptètement absents. Afin de venir bout de ces variations dans l'efficacité biologique de certains types de cystes d'Artémia des régimes d'enrichissement ont été fixés et des techniques de bioencapsulation ont été développées.La mise en application de ces nouvelles techniques a pour résultat des améliorations significatives dans l'efficacité nutritionnelle des cystes de mauvaise qualité du type mentionné cl-dessus; c'est-à-dire, les régimes contenant des niveaux élevés d'HUFA sont bioencapsulés dans l'estomac du nauplius d'Artémia que le rendement de l'écloserie peut être augmente d'une manière considérable (taux de survie plus élevé, larves plus grandes, mellioure résistance à la maladie, moins de difformités, meilleure pigmentation, etc).
Du fait de leur disponibilité restreinte, l'emploi des Artémiasjuvéniles et adultes s'est généralement limité à des essais de culture a une échelle relativement petite. Toutefois, ces dernières années l'emploi, à l'échelle commerciale, de la biomasse d'Artémia récoltée dans les salines locales (surtout dans les pays de l'Asie du sud-est, mais également au Brésil, à Panama et en Equateur) devient de plus en plus répandu, surtout au stade de la nurserie (dans l'élevages des poissons ainsi que des crevettes) et à celui de la maturation de la crevette pénéide. l'emploi pendant une à deux semaines d'Artémia adulte pour alimenter les juvéniles dans les bassins de nurserie ou dans les raceways intensifs a pour résultat une auqmentation significative de la survie et de la croissance dans la nurserie. Un régime à base d'Artémia adulte ne constitue pas uniquement un régime optimal pour l'alevin écloserie, au moment de son transfert de l'environnement contrôlé aux conditions fluctuantes de la nature, mais il s'est également avéré très utile pour l'acclimatation de l'alevin sauvage (ex.: milkfish) souvent affaibli par une manipulation excessive et le transport.
Par ailleurs, il a été récemment découvert qu'un régime à base d'Artémia peut améliorer le succès de la maturation chez plusieurs espèces de crevette pénéide. II est possible de perfectionner davantage la biomasse d'Artémia par l'application de la technique de bioencapsulation avec des produits d'enrichissement (ex.: régimes émulsionnés pour le renforcement de la maturation, une meilleure pigmentation post-larvaire, le supplément de vitamines, le traitement prophylactique, etc,).
Le dévelopment de régimes d'enrichissement de l'Artémia mentionne ci-dessus a été à l'origine du développement de substituts pour les algues qui sont utilisés avec succès dans l'alimentation de la crevette pénéide au cours des premiers stades de son développement (zoé et mysis). La production d'algues unicellulaires (ex., Skeletonema, Tetraselmis, Chaetoceros est non seulement très coûteuse (investissements, énergie, produits et main d'oeuvre), mais il s'est également avéré à plusieurs reprises que leur efficacité nuiritionnelle peut varier de manière considérable au cours de l'année. De ce point de vue, la disponibilité comme aliment “tout pret” d'un substitut non-vivant garntissant une performance constante et égale constitue un progrès majeur pour l'élevage de la crevette.
REMERCIEMENTS
La recherche au centre de référence sur l'Artémia est subventionnée par la Fondation Nationale Belge des Sciences (subvention FXFO 32.0012.81) dont le responsable scientifique est P. Sorgeloos: par l'Administration Belge de la Coopération pour le Développement (ABOS); par l'institut pour la promotion de l'industrie et de l'Agriculture (IWONL) et par la S.A.Artemia Systems.
BIBLIOGRAPHIE
LAVENS, P., Ph. LEGER, P. SORGELOOS, 1986
Production, utilization and manipulation of Artemia as food source for
shrimp and fish larvae. Océanis, 12 (4), p, 229–247.
LEGER, ph., P. SDRGELOOS, 1985
Nutritional engineering improves outputs of brine shrimp Artemia.
Aquaculture Magazine, 11 (5), p. 24–30.
LEGER, Ph., D.A. BENGTSON, K.L. SIMPSON, PL SORGELOOS, 1985
The use and nutritional value of Artemia as a food source. Oceanogr. Mar.
Biol. Ann.Rev., 24, p. 521–623.
SORGELOOS, P., P. LAVENS, PH. LEGER, W. TACKAERT, D. VERSICHELE, 1986
Manual for the culture and use of brine shrimp Artemia in aquaculture.
Artemia Reference Center, State University of Ghent, Belgium, 319 pp.
SORGELOOS, P.E.BOSSUYT, P. LAVENS, PH. LEGER, P. VANHAECKE, D. VERSICHELE, 1983
The use of the brine shrimp Artemia in crustacean hatcheries and nurseries:
p. 71–96, In: CRC Handbook of Mariculture. vol. 1. Crustacean Aquaculture.
McVey, J.P. (Ed.). CRC Press, Inc., Boca Raton, Florida, USA, 442 pp.
PERSOONE, G., P. SORGELOOS, O. ROELS, E. JASPERS, (Eds), 1980
The brine shrimp Artemia, Volume 3. Ecology, Culturing, Use in Aquaculture.
Universa Press, Wetteren, Belgium 456 pp.
VERSICHELE, D., Ph. LEGER, P.LAVENS, P. SORGELOOS, 1986
L'utilisation d'Artémia. In: Aquaculture. Vol. 1. Barnabé, G. (Ed).
Technique et Documentation, lavoisier, Paris, France, 521 pp.
MM. V. Franicevic, D. Lisac, J. Buble, Ph. Léger, P. Sorgeloos
1. INTRODUCTION
La qualité des nauplii d'Artemia joue un rôle très important dans la nutrition des larves de poissons marins. La mortalité massive ou la léthargie chez les poisson ont très souvent été remarquées lors de l'utilisation d'aliments vivats de mauvaise qualité (comptes rendus dans watanabe, 1983, et Léger et al., 1986). il a été obseré que la qualité nutritionnelle de l'Artemia est déterminée principalement chez les larves de poissons marins par la teneur en acides gras essentiels, c'est-à-dire, les acides gras insaturés à longue chaine (HUFA) 20: 5w3 et 22: 3, Les expériences de laboratoire menées sur les larves du loup Dicentrarchus labrax, nourries à base de nauplii d'Artemia enrichis ont indiqué l'importance de ce problème (Robin et al.,; 1981, Van Ballaer et al., 1985).
L'objet de cette expérience consistait à déterminer l'infiuence de la qualité des nauplii d'Artemia (du point de vue des HUFA) sur le volume de la production larvaire dans l'élevage intensif à grande échelle du Dicentrarchus labrax.
2. EQUIPEMENT ET METHODES
25 bacs d'élevage larvaire de 2m3 de capacité ont été remplis de 40.000 larves et ont été nourris de rotifères de la même qualité (Brachionus pl,) pendant 9 jours. L'eau de culture (38‰ S, 19–20°C) a été renouvelée au taux de 30%/heur. Une photoériode naturelle a été utilisée sans avoir recours à la lumiére aritficielle. Au bout de neuf jours, cinq traitements (cinq essais par traitement) ont été entamés en utilisant des nauplii d'Artemia dont les acides gras w3 hautement insaturés étalent de différentes qualités (voir les tableaux I et II). Les techniques utilisées pour la production en grandes quantités de nauplii d'Artemia à partir de cystes dés ont déjà été décrites par Franicevic (1987). Les Artemia ont été enrichis à l'aide d'un régime émulsionné (SELCO, Artemia Systems, NV Ghent, Belgique) riche en HUFA. L'enrichissement a été fait dans le milieu d'éclosion selon la procédure décrite par Léger et al. (1987a).
Le profil en acides gras des nauplii nouvellement éclos et des nauplii enrichis a été déterminé suivant la méthode décrite par Léger et al. (1985b). Le poids humide, la longueur et la survie des larves de poissons ont été déterminés au bout de 9, 23 et 42 jours.
3. RESULTATS ET DISCUSSION
Les données relatives à la survie, à la longueur moyenne, au poids moyen et à la production de biomasse (= produit du nombre de larves ayant survécues et le poids individuel moyen) sont résumées dans le tableau III. Les facteurs HUFA ont été calculés pour 20: 5w3 et 22: 6w3 en multipliant les valeurs en mg/g de ces HUFA dans les Artemia par le nombre de jours que ces Artemia ont été utilisés comme aliment pour les larves.
Les données qui figurent dans le Tableau III indiquent que la croissance est similaire dans tous les traitements jusqu'au 20éme jour. Toutefois, à la fin de l'expérience, il a été remarqué des différences nettes dans la longueur moyenne ainsi que dans le poids moyen. Les traitements ayant reçus les nauplii d'Artemia enrichis par le HUFAw3 (traitements 3 et 5)ont donné les meilleurs résultats.
En faisant le rapport entre les HUFA qui ont été calculés et les données relatives à la croissance au bout de 23 jours, il ressort que les Artemia ne jouent pas un rôle important dans la croissance larvaire. Cependant, une autre image est observée après 42 jours de culture, c'est-à-dire, il existe une correlation nette entre la teneur des Artemia en 22: 6w3 et la croissance larvaire. La quantité de 20: 5w3 dans lesArtemia ne semble pas jouer un rôle déterminant dans la croissance (ex.:le traitement 1 par rapport au traitement 4).
A l'exception du traitement 2 ayant reçu des nauplii d'Artemia “Great Salt Lake” nouvellement éclos, les différences du point de vue de la survie ne sont pas trés prononcées. La mortalité dans le traitement 2 était complète au 35éme jour. Ceci confirme les observation précédentes de van Ballaer et al., (1985)qui ont pensé à la la possibilité d'une interaction provenant de la contamination de cette source d'Artemia par les pesticides. Etant donné que nous avons découvert un taux de survie et une croissance satisfaisants chez les larves nourries à base d'Artemiadu “Great Salt Lake” enrichis en HUFAw3, nous préférons minimiser l'interaction de la contamination et mettre plutôt l'accent sur l'effet nuisible provoqué par le manque de HUFAw3 dans ce régime. Une relation similaire a été singalée précédemment par Watanabe et al. (1982) chez les larves du Pagrus major.
Contrairement a la croissance larvaire, la survie semble, en effet, être affectée par la teneur des Artemia en 20: 5w3 (ex.; l'augmentation do taux de survie avec l'augmentation du facteur 20: 5w3). La production de cette biomasse larvaire chez le Dicentrarchus l. est liée directement à la teneur en 20: 5w3 et en 22; 6w3 chez les Artemia.
Nos résultats ont effectivement prouvé que le fait de donner un supplément en acides gras essentiels au moyen de l'enrichissement des Artemia peut améliorer le taux de réussit de la production larvaire dans l'élevage intensif du loup. Vu les variations dans la concentration de 20: 5w3 chez les différentes souches, et même chez des lots différents de la même souche d'Artemia, et étant donné que l'autre acide gras essentiel 22: 6w3 est généralement absent chez les Artemia nouvellement éclos (Léger et al., 1986) l'enrichissement systématique en HUFA est recommandé dans l'élevage larvaire du loup.
REMERCIEMENTS
Les auteurs désirent remercier le personnel de la Cenmar et de l'Artemia Reference Center de leur assistance technique dans la conduite des expériences et de l'analyse.
Tableau I: Régimes alimentaires
| Traitements | Régimes alimentaires |
| 1 | Nauplii d'Artemia AF 856/24 (Artemia Systems N.V., Ghent, Belgigue), novellement éclos pendant toute la durée de l'expérience (42j) |
| 2 | Nauplii d'Artemia GSL (Great Salt Lake, Utah, USA), novellement éclos pendant toute la durée l'expérience |
| 3 | Nauplii d'Artemia GSL nouvellement éclos pendant dlx jours + nauplii d'Artemia GSL/S (Great Salt Lake, 24h enrichis de Selco, Artemia Systems N.V.) jusqu'à la fin de l'expérience |
| 4 | Nauplii d'Artemia SFB (San Francisco Bay, San Francisco Bay Brand, CA-USA) nouvellement éclos pendant toute la durée de l'expérience |
| 5 | Nauplii d'Artemia AF 858/24 nouvellement éclos pendant dix jours + nauplii d'Artemia GSL/s jusqu'à la de l'expérience. |
Tableau II: Tenuer en HUFA w3 (exprimé comme pourcentage sur l'ensemble des acides gras et comme mg/g du poids sec d'Artemia) chez les nauplii d'Artemia nouvellement éclos et enrichis.
Artemia
| AF 858/24 | GSL | SFB | GSL/S | |||||
| Pourcentage | mg/g | Pourcentage | mg/g | Pourcentage | mg/g | Pourcentage | mg | |
| 20:5w3 | 5,3 | 7,7 | 0,3 | 0,4 | 1,9 | 2,3 | 4,9 | 8,1 |
| 22:6w3 | - | - | - | - | - | - | 3,1 | 5,1 |
Tableau III: Données relatives à la longuer individuelle moyenne, au poids humide moyen, à la survie et à la biomasse des larves du D. labraxnourries au moyen de nauplii d'Artemia de différentes qualités (voir le tableau I); les facteurs HUFAw3 calculés en tant la somme des produits ou mg/g de 20:5w3 ou de 22:6w3 chez les Artemia et le nombre de jours pendant lequel ces Artemia ont été nourris.
| Traitement | |||||
| 1 | 2 | 3 | 4 | 5 | |
| Longueur (mm) 23j | 6,99 | 7,46 | 7,74 | 7,35 | 6,82 |
| Longueur (mm) 42j | 14,38 | - | 17,25 | 14,51 | 16,48 |
| Poids humide (mg) 42j | 14,01 | - | 24,45 | 14,27 | 24,60 |
| Survie (%) 42j | 22,54 | 0 | 20,00 | 18,18 | 24,36 |
| Biomasse (g) 42j | 126,3 | - | 195,6 | 103,8 | 239,7 |
| HUFA23j Pour 20:5w3 | 177,1 | 9,2 | 109,3 | 52,9 | 182,3 |
| HUFA 23j pour22:6w3 | - | - | 66,3 | - | 66,3 |
| HUFA 42j pour 20:5w3 | 323,4 | 16,8 | 263,2 | 96,6 | 336,2 |
| HUFA 42j pour 22:6w3 | - | - | 163,2 | - | 163,2 |
BIBLIOGRAPHIE
- FRANICEVIC, V., 1987
Large scale Artemia cyst hatching at the CENMAR fish hatchery in Yugoslavia.
In: Artemia research and its applications. Vol.3. sorageloos, p.; Bengtson,
D.A.; Decleir, W.; Jaspers, e.(Eds). Universa Press, Wetteren, Belgique,
sous presse.
- ROBIN, J.H., F.J.GATESOUPE, R.RICARDEZ, 1981
Production of brine shrimp (Artemia salina) using mixed diet: consequences
on rearing sea-bass larvae (Dicentrarchus labrax). J. World Maricul. Soc.
12(2), p. 119–120
- LEGER, Ph, D.A.BENGTSON, K.L.SIMPSON, P.SORGELOOS, 1986
The use and nutritional value of Artemia as a food source. Oceanogr. Mar.
Biol. Ann. Rev., 24, p. 521–623
- LEGER, Ph, P.CANDREVA, E.NAESSENS-FOUQUAERT, P.SORGELOOS, 1987
Techniques for the manipulation of the fatty acid profile in Artemia
nauplii and the effect on its nutritional effectiveness for the marine
crustacean Mysidopsis bahia (m.). In: Artemia research and its applictions.
Vol.3.Sorgeloos, P., Bengtson, D.A., Declir, W., Jaspers, e.(Eds).
Universa Press, Wetteren, Belgigue, sous presse.
- LEGER, Ph., P. SORGELOOS, D.MILLAMENA, K.L.SIMPSON, 1985
International Study on Artemia. XXV. Factors determining the nutritional
effectiveness of Artemia: the relative impact of chlorinated hydrocarbons
and essential fatty acids in San Francisco Bay and San Pablo Bay Artemia. J.
Exp.mar.Biol.Ecol., 93, p. 71–82.
- VAN BALLAER, E., F.AMAT, F.HONTORIA, Ph.LEGER, P.SORGELOOS,1985
Preliminary results on the nutritional evaluation of W3-HUPA enriched
Artemia nauplii for larvae of the sea bass,Dicentrarchus labrax.
aquaculture,49, p. 223–229.
- WATANABE, T., 1983
Nutritional values of live organisms used in Japan for mass propagation of
fish: A review. Aquaculture,34, p. 115–143.
- WATANABE, T., M.OHTA, C.KITAJIMA, S.FUJITA, 1982
Improvement of dietary value of brine shrimp Artemia salina for fish by
feeding them on w3 highly unsaturated fatty acids. Bull.Jap.Soc..Sc.
Fish., 48(12), p. 1775–1782.