Mr.G.ROMAN
1. INTRODUCTION
Le dēmarrage de la culture des mollusques bivalves peut se faire soit par la collecte de semences naturelles ou par l'intermédiaire d'une écloserie.
Quelques avantages et inconvénients de ces deux méthodes sont cités dans le tableau suivant:
| Collecte naturelle | |
| Avantages | Inconvénients |
| - Bas prix | - Conditions du milieu non contrôlées |
| - Croissance du naissain dans les collecteurs | - Période de colonisation saisonnière et courte |
| - Main d'oeuvre pas nécessaire | |
| - Grand stock de géniteurs | |
| Ecloserie | |
| Avantages | Inconvénients |
| _ Conditions du milieu contrôlées | - Coût très élevé des constructions et de la maintenance |
| - Colonisation pendant toute l'année | - Croissance du naissain dans des nurseries |
| - Petit stock parental | - Main d'oeuvre nécessaire |
L'élevage des larves dans de grands bassins est une méthode intermédiaire et n'est guère utilisée. Le choix de l'une ou l'autre méthode dépendra, en premier lieu, des caractéristiques de l'endroit. Mais, en règle générale, la collecte naturelle est conseillée quand on travaille avec des coquillages peu chers ou lorsque l'on se trouve dans des zones possédant des stocks importants.
Les écloseries se sont développées á la suite d'une chute de la capture des huîtres.
Les causes de la disparition des huîtres juvéniles avaient été attribuées aux ravages provoqué par les chaluts de fond, aux maladies, aux catastrophes naturelles et à la pollution des estuaires. Comme l'ostréiculture industrielle nécessitè un grand nombre de larves que la collecte naturelle ne pouvait plus fournir, les écloseries se sont développées pour satisfaire à cette demande.
Une autre raison au dèveloppement des écloseries a été la possibilité d'obtenir des stocks génétiquement sélectionnés.
Beaucoup d'écloseries européennes, le long des côtes atlantiques travaillent avec les huîtres et les palourdes, jadis, Ostrea edulis et Venerupis decussata et, de nos jours, Crassostrea gigas et Venerupis semidecussata ( = Ruditapes philippinarum) plus simples à cultiver et montrant une croissance plus rapide.
Cependant, les huîtres et les palourdes ne sont pas les seuls mollusques commerciallement importants. Des efforts sont consacrés à la culture des pectinidés (Pecten maximus, Chlamys varia, Chlamys opercularis) avec des résultats prometteurs aussi bien en écloseries que par les collectes naturelles. Les écloseries de bivalves à échelle commerciale ont débuté dans les années 60 et ceci a été rapporté dans les publications suivantes: LOOSANOFF & DAVIS(1963), WALNE (1963, 1964, 1965,1966) et IMAI (1966), décrivant les techniques de culture, la circulation de l'eau, le conditionnement, la production de phytoplancton, etc…
Néanmoins, dans les années antérieures, il fallu déterminer les exigences alimentaires. LOOSANOFF (1945) avait découvert également que la maturité sexuelle pouvait être provoquée par une augmentation de la température et ceci permettait une période de travail plus longue et un développement plus rapide des techniques d'écloserie.
Cependant, encore maintenant, il existe de nombreux facteurs inconnus en ce qui concerne l'élevage larvaire, qui conduisent à des échecs sporadiques et intermittents.
2. CYCLES DE REPRODUCTION DES MOLLUSQUES BIVALVES
Si l'on veut faire l'élevage larvaire de bivalves, il est important de connaître la sexualité des mollusques. Il est nécessaire de savoir quand et comment les mollusques que l'on veut élever se reproduisent.
La plupart des espèces sont à sexes séparés, c'est à dire que les uns sont toujours mâles, les autres toujours femelles. Cependant, quelques espèces commercialement importantes sont hermaphrodites.
Les catégories d'hermaphrodisme mises en évidence par COE (1943, 1945) sont classées comme suit:
- Hermaphrodisme fonctionnel: Spermatozoïdes et ovules sont libérés simultanément et l'auto-fécondation peut se produire: Pecten maximus, Chlamys opercularis.
- Hermaphrodisme consécutif: Une seule inversion sexuelle dans le courant de la vie. D'habitude, l'individu jeune est mâle et l'adulte est femelle: Mercenaria mercenaria
- Hermaphrodisme consécutif rythmique: Une phase mâle est suivie d'une phase femelle, suivie d'une phase mâle et ainsi de suite: Ostrea edulis.
- Sexualité alternée: Dans ce cas, l'inversion sexuelle se produit chez les adultes qui fonctionnent saisonnièrement à sexes séparés. Ce phénomène est erratique et imprévisible: Crassostrea virginica.
Cependant, sans se soucier des différences de comportements sexuels, tous les bivalves commercialement importants libèrent leurs produits sexuels dans l'eau de mer où la fécondation a lieu (Excepté le genre Ostrea).
Le cycle de reproduction des pélécypodes peut être divisé en 3 principaux stades:
- Développement des gonades
- Ponte et fécondation
- Développement et croissance
Différents stades impliqués dans la gestion de l'écloserie
| Développement des gonades | Période de récupération | Conditionnement |
| Maturation | ||
| ------------------- Stimulation | ||
| Ponte et Fertilisation | Ovule + spermatozoïde | |
| Incubation | ||
| Embryogénèse | ||
| Larve trochophore | ||
| Développement et Croissance | Larve véligère | Elevage larvaire |
| Métamorphose | Fixation | |
| Juvéniles | ||
| Croissance | Pré-grossissement | |
| Mise en grossissement | Mise en grossissement | |
La partie droite de ce tableau montre la procédure caractéristique suivie en écloserie. Il faut ajouter à ceci la sélection des géniteurs, l'alimentation (culture de phytoplancton) et les systèmes de circulation et de traitement de l'eau.
2.1. Conditionnement
Habituellement, en eaux tempérées, les cycles reproduction des mollusques sont annuels et quelquefois biannuels, et la période de ponte est courte.
Avant les expériences de LOOSANOFF et DAVIS (1963), l'élevage larvaire était limité aux courtes périodes de ponte naturelle mais les techniques de conditionnement qu'ils ont développés ont permis d'étaler la période de ponte, du moins pour certaines espèces.
Cette méthode de conditionnement consiste à placer les mollusques dans l'eau dont on augmente quotidienneemnt la température jusqu'à ce qu'elle atteigne le niveau requis. La gamétogénèse peut être ainsi induite après un mois, chez des animaux en phase de repos. Si la gamétogénèse a déjà commencé, elle sera accéléré. Cette technique ne fonctionne pas si l'animal n'a pas passé par la période de récupération. Durant cette période, l'animal n'a pas passé par la période de récupération. Durant cette période, l'animal accumule des réserves nutritives, principalement constituées de glycogène. C'est pour cette raison qu'il faut avoir une connaissance approfondie des cycles de reproduction des animaux avec lesquels on travaille.
2.1.1. Sélection du stock de géniteurs
L'origine, l'aspect et la qualité de la chair sont les facteurs qu'il faut considérer pour la sélection des géniteurs. Les animaux en provenance d'une zone polluée ou infestée par des parasites sont obligatoirement rejetés. Ceux qui paraîssent vieux, qui présentent une croissance lente ou qui ont une mauvaise apparence sont, également à écarter. Quelques animaux doivent être ouverts et les lots avec le meilleur indice de condition sont sélectionnés.
Quand on travaille avec des animaux qui changent de sexe avec l'âge, il faut conditionner des lots d'âges différents afin d'être sûr de la présence des deux sexes.
Avant d'introduire les animaux dans le système de conditionnement, ils doivent être épurés et soigneusement brossés.
2.1.2. Nombre d'animaux à conditionner
Ce nombre dépendra du nombre de larves requis. Si nous pouvons déterminer le nombre moyen de larves produit par femelle et le nombre moyen de femelles qui vont pondre dans chaque période, il sera facile de déterminer le nombre requis d'animaux à conditionner. Le tableau suivant montre le pourcentage d'huîtres (Ostrea edulis) qui ont pondu après une période de 3 mois de conditionnement, à différents moments de l'année:
| Début du conditionnement | Pourcentage de pontes (essaimage)* | ||
| 1er mois | 2ème mois | 3ème mois | |
| Automne | 4,0% | 0,0% | 14,9% |
| Hiver | 2,0% | 12,1% | 10,5% |
| Printemps | 8,0% | 10,6% | 8,8% |
| Eté | 6,7% | 6,8% | 3,5% |
* Le nombre moyen de larves produites à chaque ponte: 0,96±0, 54x106
2.1.3. Les systèmes de Conditionnement
Il y a deux types de systèmes de conditionnement, un système ouvert (sans recirculation) et un système avec recirculation. Les meilleurs résultats sont obtenus avec le premier système, bien qu'il soit plus coûteux à cause des pertes en aliment et en eau chauffée.
Le débit d'eau dépendra du volume filtré par l'animal, mais d'habitude, on utilise un volume inférieur, ceci afin de réduire le coût du chauffage de l'eau et les pertes d'aliment. Quand on travaille avec Ostrea edulis, un fort débit peut aboutir à des pertes de larves, causées par le colmatage du filtre utilisé pour retenir les larves.
D'habitude, nous utilisons un débit de 1, 2 1/huûtre/heure. WILSON (1981) utilise 1 à 2 1/huître/heure, alors que DUPUY et al., 1977, utilise 10 1/huître/heure.
Ration alimentaire:
Les besoins énergétiques nécessaires à l'élaboration des gamètes sont obligatoirement fournis à l'animal par les aliments. L'eau rentrante sera ou ne sera pas filtrée. Dans ce dernier cas, l'eau peut contenir quelques aliments, mais d'habitude, ce n'est pas suffisant pour les besoins des mollusques, c'est pourquoi il faut toujours ajouter de la nourriture.
La plupart du temps, l'alimentation se fait sous forme d'algues unicellulaires vivantes accompagnées parfois d'amidon.
WILSON (1981) ajoute une quantité d'algue sêche équivalente à 6 % du poids de la chair sêche de l'huître. Pour un kg de chair sêche d'huître, il faut 60 mg d'algue sêche (= 2,64.108 cellules de Tetraselmis suecica ou 1,74.199 cellules de Isochrysis galbana).
HELM et al., (1973 ajoutent 10 Tetraselmis/μl et FLASSCH et al., (1973) 2, 16.108 cellules de Tetraselmis/huître/jour.
DUPUY et al., (1977) recommandent 2,0 mg/l d'amidon.
ROMAN (1985) nourrit les huîtres avec une mixture de 2,4.108 cellules de Tetraselmis suecica plus 3,1 x 108 cellules de Skeletonema costatum par huître et par jour (C'est à dire respectivement 8,3 et 10,8 cellules/μl).
Le système doit être régulièrement nettoyé, particulièrement lorsqu'on ajoute de l'amidon.
Lorsque l'on travaille avec des espèces autres que les huîtres (Ostrea) des contrôles fréquents de maturité doivent être effectués, ceci afin d'éviter des pertes spontanées dues aux hausses de température de l'eau. Lorsque l'animal est pratiquement mature, une légère baisse de la température est recommandée et il ne faut pas oublier que les mâles atteignent la maturité avant les femelles.
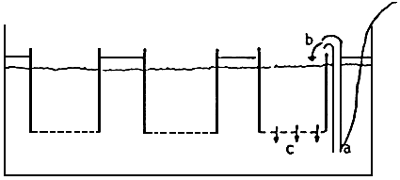
Les huîtres (Ostrea edulis) ont un comportement de reproduction très caractéristique. Je vais maintenant décrire le système que nous utilisons pour le conditionnement et la collecte des larves. La figure 1 montre le schéma des bassins où les huîtres sont mises. Dans ces bassins plastiques (60 × 54 × 40 cm), on peut mettre 25 huîtres. L'eau qui sort du bassin doit passer par 2 filtres (200 et 80 μm). Les larves lorsqu'elles sont libérées, ont tendance à nager à la surface et sont transportées avec le courant d'eau vers l'évacuation; les mailles de 80 μm servent donc à retenir les larves à l'intérieur du bassin (figure 2).
2.2. Stimulation
Dans les conditions naturelles, lorsque les gonades atteignent leur développement maximum et que les gamètes sont complètement matures, la ponte survient probablement à la suite d'un changement des facteurs du milieu (Tableau 1).
Il peut y avoir des pontes spontanées dans le système de conditionnement. Quand ceci se passe, la plupart des gamètes sont inaptes à la culture et doivent être rejetées.
Pour éviter ce problème, lorsque les animaux sont jugés matures, ils doivent être stimulés dans des conditions controlées, pour récolter les gamètes dès leur ponte.
Si la stimulation n'est pas possible au moment favorable, une baisse de température de l'eau dans le système de conditionnement est indispensable; Cependant, la stimulation est recommandée aussitôt que possible car de vieux gamètes peuvent donner de mauvaises larves.
Avant la stimulation, les animaux doivent être nettoyés, les déchets et fèces enlevés ainsi que les autres organismes installés à l'intérieur et à l'extérieur de la coquille car ceux-ci peuvent pondre au même moment que les mollusques
2.2.1. Méthodes utilisées pour la stimulation de la ponte des mollusques:
Dans une récente publication. LE PENNEC (1981) passe en revue les méthodes employées pour provoquer la ponte chez les mollusques. Les méthodes le plus souvent employées sont les changements thermiques, l'addition de gamètes ainsi que les chocs, physiques et chimiques. Il est évident que ces méthodes ne peuvent réussir que si les animaux sont matures.
- Changements thermiques: C'est le système, de loin, le plus souvent utilisé. Habituellement, la température est augmentée de 5 à 10° C. Une fois la température requise atteinte, elle peut être maintenue à ce niveau ou bien élevée ou abaissée pendant quelques temps.
- Addition de gamètes: Ce système est habituellement employé en association avec l'élévation de température. De cette façon, les résultats sont améliorés.
- Stimulation chimique: Le système le plus à la mode est l'injection de sérotonine. Dans ce cas, des pontes très rapides peuvent être obtenues, mais d'habitude, seuls les mâles éjaculent.
Quand on chauffe l'eau pour la stimulation, la solubilité des gaz diminue et il y a formation de petites bulles. Quand les animaux prêts à pondre sont au milieu des bulles, la ponte peut être empêchée. La présence des bulles est facilement notée par l'apparition de faeces en suspension. Pour éviter ce problème, l'eau chaude doit être aérée.
Après la stimulation, le temps d'attente avant la ponte dépend e l'espèce de la maturité, du système employé pour la stimulation, etc…
La ponte peut survenir quelques minutes après, ou avec un retard de plusieurs heures et peut même ne pas avoir lieu du tout.
En effet, dans nos expériences avec Pecten maximus, la libération des gamètes peut être retardée de 2 à 3 semaines.
Quand les animaux commencent è pondre, on doit les mettre séparément dans des recipients remplis d'eau à une température égale égale à celle utilisée dans les bassins de ponte. Lorsqu'une femelle a une ponte importante. elle doit être transférée dans un autre récipient.
Quand on travaille avec des hermaphrodites fonctionnels, les géniteurs doivent être surveillés continuellement. Habituellement, comme dans le cas des mollusques à sexes séparés, le mâle libère ses gamètes en premier lieu; et quand les testicules sont vides, les oeufs sont libérés à leur tour. Une inspection vigilante des récipients de ponte permet de détecter le moment de l'inversion sexuelle.
A ce moment, l'animal doit être mesuré etlavé extérieurement et intérieurement pour enlever le plus possible de sperme. Après, l'animal est placé dans un nouveau bassin pour lui permettre de libérer les oeufs. Le contrôle doit continuer car, dans certains cas, les testicules ne sont pas vides et une nouvelle libération de sperme peut se produire.
Avec cette méthode, nous obtenons, dans des bassins séparés, des oeufs et du sperme provenant de différents animaux. Suivant notre intérêt, nous pouvons prendre les oeufs séparément ou les rassembler dans un plus grand bassin. Dans tous les cas, et après l'addition de quelques gouttes de sperme, il faut examiner les oeufs au microscope, pour établir le pourcentage de fécondation. Si nécessaire, on ajoute de sperme. La fécondation doit être réalisée le plus rapidement possible, au plus tard, une heure après la ponte. (Avec P. maximus, il est pratiquement impossible d'empêcher qu'un pourcentage incontrôlé et variable d'oeufs ne soit fécondé avant l'addition du sperme).
Ensuite, afin d'éliminer les déchets, les oeufs sont passés sur un tamis à mailles de 100 μm et gardés soit sur un maillage de 20 μm, soit dans un bassin. Immédiatement après, les oeufs doivent être comptés et placés dans les bassins d'incubation. Toutes ces opérations doivent être effectuées le plus rapidement possible. Un retard dans l'addition du sperme peut engendrer un faible taux de fécondation. si les oeufs sont filtrés longtemps après la fécondation, quand le clivage a commencé, un grand nombre de larves anormales peut apparaître.
Le nombre d'oeufs qu'une femelle peut pondre dépend de l'espèce et de la taille de l'animal. Nous avons compté 7 à 14.106 oeufs de 68 μm de diamètre, pour des coquilles St. Jacques de 10 cm de longueur (ROMAN et PEREZ, 1976) et 1 à 2.106 oeufs de 70 μm, chez les palourdes (Venerupis decussata et V. pullastra) (PEREZ et al., 1977). Crassostrea virginica peut produire 25 à 100 millions d'oeufs (DUPUY et al., 1977).
2.3. Incubation
Après la ponte, la vésicule germinale est visible chez les oeufs sphériques. Plus tard, la vésicule germinale se détache et l'oeuf demeure ainsi jusqu'à sa fécondation. Ensuite, nous voyons apparaître rapidement le ler et le 2ème globule plaire, la fusion des pronuclei mâle et femelle avance et la division débute. 12 à 14 heures plus tard, la larve trochophore apparaît et 48 heures après la fécondation, la larve véligère est développé.
Ces différents stades de développement se font dans les bacs d'incubation qui ne doivent pas être touchés durant ces 48 heures. Ceci est une phase courte mais importante dans la culture des larves et au cours de celle-ci, ni aliments, ni aération ne sont fournis aux larves.
D'habitude, nous mettons 500 à 2 0000 oeufs par cm2 et avons 10 à 68 % de larves normales (PEREZ et al., 1977; GONZALEZet ROMAN, 1983; ROMAN et PEREZ, 1976).
Les bac que nous utilisons pour l'incubation ont les dimensions suivantes : soit 100 1 de volume et 1900 cm2 de surface de fond, soit 400 1 de volume et 9 500 cm2 de surface de fond. Après la période de 48 heures, les bacs sont vidés, l'eau passe à travers deux filtres de 100 μm et de 45 μm, le premier pour retenir les déchets et le deuxième pour retenir les larves juste au début du stade véligère, ou stade “charnière droite” mesurant plus ou moins 100 μm. Pour éviter le colmatage et les pertes de larves, le filtrage doit se faire lentement.
Ensuite, il faut compter le nombre de larves normales et anormales et placer les larves dans les bacs de culture, à la densité requise.
L'anormalité chez les larves est toujours présente mais à des dégrés et à des pourcentages très variables. La plupart des difformités appartiennent aux catégories suivantes:
- Pas de développement après la fécondation et les oeufs meurent
- Arrêt du développement avant le stade trochophore
- La trochophore ne sécrète pas la coquille
- Formation d'une coquille petite et difforme
- La coquille semble normale, mais le vélum ne peut pas se rétracter ou il est déformé
- La charnière est recourbée.
- La coquille et le vélum sont normaux, mais les larves ne se nourrissent et plus tard, elles deviennent blanchâtres.
La plupart de ces anomalies peuvent être attribuées aux causes suivantes:
- Mauvaises conditions physiques des géniteurs.
- Pontes tardives dans la saison.
- Forte stimulation qui aboutit à des oeufs avortés.
- Forte concentration d'oeufs sur le fond du bassin, pendant un long moment, avant le comptage ou l'addition de sperme, aboutissant à une baisse de l'oxygène.
- Retard dans l'addition de sperme.
- Mauvaises manipulations au début des clivages.
- Mise en incubation d'un trop grand nombre de larves pour un volume donné.
- Haute température pendant l'incubation
- Polyspermie.
Comme les larves anormales ne grossissent pas ou lentement, elles peuvent être écartées, après quelques jours de culture, à travers un tamis approprié.
2.4. Elevage larvaire
Comme nous l'avons déjà mentionnné, quand les larves trochophores, retenues dans les bacs d'incubation, deviennent larves véligères, l'eau est filtré à travers des filtres et les véligères retenues sont comptées et placées dans les bassins utilisés pour l'élevage larvaire.
Au début du stage véligère (ou à “charnière droite”), la coquille en forme de D couvre complètement toutes les parties du corps mou. L'organe larvaire le plus remarquable à ce stade est le vélum, fortement cilié, utilisé pour la nage et l'alimentation. En viellissant, la larve développe en premier lieu un ombilic plus ou moins proéminent et plus tard un pied cilié et rétractile, avec la glande de byssus. Quelques espèces montrent une tache oculaire dont la présence annonce la fixation proche.
2.4.1. Facteurs externes affectant la croissance des larves
Le taux de croissance est l'indice le plus utile pour détermination de la qualité de la culture, et d'habitude, plus la croissance est rapide, meilleur sera le taux de survie et le taux de fixation.
Il existe plusieurs facteurs qui influencent le taux de croissance. Certains d'entre-eux tels que qualité et quantité d'aliment (figure 3), température (figure 4), salinité, et densité larvaire (figures 5–6) sont facilement contrôlables mais d'autres comme la qualité de l'eau ou les maladies ne le sont pas.
2.4.1.1. Aliment
Durant de nombreuses années, un des plus grand problèmes de l'élevage des larves a été la détermination de leur alimentation. Plus tard, il a été découvert que les larves s'alimentent d'algues unicellulaires et ces dernières sont jusqu'à présent le seul aliment satisfaisant (Tableau Il).
En conséquence, des quantités considérables d'espèces d'algues ont été isolées et cultivées pour déterminer leur valeur nutritive.
Certaines conditions doivent être remplies pour qu'une espèce soit considérée comme une bonne source alimentaire:
- La taille:2 – 10 μmest la plus recommandable.
- Digestibilité Dans ce sens, la présence et l'épaisseur de la paroi cellulaire sont des facteurs importants.
- Des métabolites toxiques sont produits par certaines algues. Elles ne peuvent être utilisées comme aliment.
- La facilité d'élevage et un bon rendement sont aussi des facteurs très importants.
- Les algues doivent fournir aux larves les carbohydrates, protéines, lipides et vitamines nécessaires à leur bonne croissance.
- La mobilité n'est pas essentielle mais recommandable.
En règle générale, des aliments mélangés aboutissent à une amélioration du taux de croissance (Tableau III) (Figure 7 a). Cet effet de sinergie peut être attribué au fait que les exigences nutritionnelles sont mieux remplies.
La ration alimentaire qui est le nombre de cellules algales utilisé pour nourrir les larves, sans considérer la densité et la taille des larves, dépendra de la taille des algues. La ration la plus communément utilisée est l'équivalent en volume de 100 cellules de Isochrysis galbana par microlitre.
la valeur alimentaire des espèces peut changer selon l'âge et même les bonnes espèces peuvent devenir toxiques à cause d'un développement bactérien.
Les espèces les plus utilisées sont les suivantes:
Isochrysis galbana
Pavlova (monochrysis) lutheri
Tetraselmis suecica
phaedactylum tricornutum
Pseudoisochrysis paradoxa
Thalassiosira pseudonana (ex. Cyclotella nana)
Chaetoceros calcitrans
Skeletonema costatum
Isochrysis tahiti
Rhodomonas baltica
2.4.1.2. Température
Habituellement, la température est considérée comme le facteur le plus important dans la croissance des larves. Beaucoup d'espèces vivant dans des eaux tempérées voient leur taux de croissance augmenter quand la température s'élève, mais quand la température est légèrement supérieure à 30°C, la survie et la croissance diminuent sévèrement.
2.4.1.3. Salinité
Comme la plupart des espèces élevées vivent dans les estuaires, il est donc probable que la salinité n'affecte pas excessivement leur taux de croissance et que les larves peuvent être exposées à des fluctuations de la salinité. En effet, elles résistent à une relativement large gamme de salinités, et il semble que des animaux vivant dans un habitat typiquement estuarien ont une marge de tolérance plus large vis à vis des salinités basses. Par exemple, Ostrea edulis a sa limite inférieure à 20 ‰ (DAVIS & ANSELL, 1962), Crassostrea virginica entre 10 et 12,5‰ en fonction de la salinité du milieu où les parents ont vécu (LOOSANOFF & DAVIS, 1963).
2.4.1.4. Densité des larves
Ce facteur est en rapport avec la taille des larves. Cependant, il existe une large gamme de densites acceptables. Le taux de croissance diminue quand la densité augmente. Les meilleurs taux de croissance peuvent être obtenus avec les densités suivantes (CHANLEY, 1975):
| Taille des larves | Nombre/ml |
| 50 – 100μm | 15 |
| 100 – 200μm | 8 |
| 200 – 300μm | 5 |
| + 300μm | 1 |
La baisse du taux de croissance en élevage à haute densité est vraisemblablement, due à l'accumulation des métabolites et à l'augmentation du taux de collision entre les larves. Le manque de nourriture peut aussi affecter la croissance. Toutefois, une augmentation du taux d'alimentation peut, inversement, affecter le taux de croissance.
2.4.1.5. Qualité de l'eau
le problème de la qualité de l'eau est toujours présent quand on élève de petits animaux. e rapport surface-volume élevé chez les larves et leur exposition forcée à tous les matériaux présents dans l'eau, les rendent extrêmement sensibles aux produits toxiques ou aux agents pathogènes (CULLINEY et al., 1975).
Périodiquement, l'eau de met a un effet nuisible sur les larves. Cependant en dépit de l'importance de ce phénomène, très peu d'informations sont disponibles sur ce sujet et les échecs dans le grossissement des larves ont été attribués aux blooms de dinoflagellés, à la quantité de matière en suspension, aux métaux lourds at à des composants filtrables non identifiés.
Le choix d'un site pour une écloserie doit prendre en considération certains facteurs du milieu afin de prévenir, le plus possible, les problèmes de qualité d'eau:
- Variations de la salinité
- Matières en suspension et liées à celles-ci, la profondeur et l'exposition du rivage
- Pollution
- Marée rouge.
2.4.2. Méthodes de culture
Le volume des bassins dans lesquels les larves vont être elevées peut être compris entre 100 ou quelques centaines de litres. a culture peut se faire en circuit ouvert ou en système stagnant, ce dernier étant le plus commun. Dans ce cas, l'eau est changée périodiquement, d'habitude tous les deux jours. Les changements d'eau le lundi, le mercredi et le vendredi sont le modèle employé le plus souvent. L'eau peut aussi être drainée à travers une valve de fond, les larves et les déchets étant retenus et filtrés sur des tamis de tailles adéquates placés au dessous ou siphonnés au moyen d'un tuyau flexible. Dans ce cas, un autre filtre peut être placé à l'extrémité du tuyau, empêchant les larves de s'échapper, ou alors elles sont drainées avec l'eau mais retenues sur des tamis similaires à ceux utilisés sous les valves. Ce dernier système nous permet le rejet des larves mortes ou mourantes et des déchets accumulés sur le fond.
Après la vidange, les bassins doivent être attentivement et minutieusement nettoyés avec de l'eau douce et des détergents non-toxiques, puis rincés deux a trois fois avec de l'eau de mer filtrée avant de les remplir à nouveau.
Avant de remettre les larves dans les bassins de culture, les filtres retenant les larves doivent être placés dans des bacs et un examen au microscope doit être effectué sur un échantillon prélevé au moyen d'une pipette de Pasteur, pour les mesures et les contrôles.
Si nécessaire, un tamisage sélectif doit être fait pour enlever les coquilles mortes et celles qui grossissent lentement. Après avoir rempli les bacs, on y place les larves et on ajoute ensuite, si nécessaire, la nourriture et les antibiotiques. Cependant, quand les larves grandissent, il peut être nécessaire de les nourrir quotidiennement.
D'habitude, nous ajoutons une aération modérée.
2.5. Fixation
La vie pélagique des larves se termine lorsqu'elles se fixent. Avant la fixation, il y a quelques changements dans le comportement des larves. La larve prête à se fixer, nage avec le pied en saillie et quand elle touche une surface solide, le vélum est rétracté et la larve rampe en utilisant le pied.
Ce comportement peut changer soudainement, le pied étant rétracté; le vélum s'étend et la nage reprend. Quand l'huître est prête à se fixer, après avoir rampé et cherché un substrat convenable, le coquillage tourne et posant la valve gauche sur le substrat, il s'attache définitivement en sécrétant un ciment à partir de la glande byssale.
Cependant, beaucoup de mollusques se fixent temporairement par des filaments de byssus.
Des changements morphologiques commencent immédiatement pour marquer le passage du stade larvaire au stade juvénile (métamorphose), impliquant la disparition d'organes larvaires (vélum) et le développement de nouveaux organes.
2.5.1. Taille à la fixation
Variable selon les espèces. Généralement entre 220 et 320 μm.
Moment de la fixation
Il est aussi variable selon les espèces. Fortement influencé par les facteurs externes. D'habitude, Ostrea edulis se fixe à l'âge de 7 à 14 jours, Venerupis spp à environ 3 semaines et Pecten maximus à 4 semaines.
C'est probablement la phase la plus critique de l'élevage larvaire, car pendant ce temps, il est normal de trouver un mélange de larves rampantes matures, de jeunes larves nageantes, de coquilles mortes, de fèces, d'aliment et de déchets, en masse serrée.
Lorsqu'on arrive à cette phase, un calibrage convenable doit être fait, en sélectionnant les différents stades de développement par catégorie de taille et en les plaçant séparément dans des bassins.
2.5.2. Techniques de fixation
Comme nous l'avons déjà dit, quand la fixation approche, il est recommandé de séparer les larves de différentes tailles. Les petites mettront plus de temps à se fixer, elles sont donc replacées dans les bassins d'élevage tandis que les grandes qui sont sur le point de se fixer seront placées dans bassins de fixation.
Nous devons considérer que beaucoup d'espèces commercialement importantes se fixent temporairement tandis que les huîtres se fixent définitivement. De plus, en ce qui concerne les huîtres, nous pouvons travailler avec du naissain collecté ou non collecté.
Les espèces s'attachant toutes seules temporairement n'ont pas besoin de collecteur puisqu'elles se fixent sur le fond ou sur les parois des bassins de fixation, d'où elles peuvent être facilement détroquées en appliquant un jet d'eau, si nécessaire. Cependant, certains collecteurs de cordes (effilochées) peuvent s'utiliser pour quelques espèces comme Pecten.
Pour les huître, on utilise principalement deux systèmes: des petites particules ou des sortes de tuiles ou bien les méthodes de collecteurs. La dernière technique peut, ou non, impliquer un détachement quelques heures plus tard ou quand l'huître atteint une certaine taille, tandis que l'usage des petites particules (200 à 350 μm) nous permet d'obtenir des huîtres sans aucune technique de détroquage.
La fixation de certaines espèces telles que l'huître, peut être accélérée en ajoutant au substrat un extrait d'huître adulte.
2.6. Pré-grossissement (nursery)
Le naissain de bivalve produit en écloserie doit être pré-grossi en nursery avant d'être semé ou mis en grossissement.
Le naissain placé directement en mer peut souffrir de grandes mortalités dues aux prédateurs, à l'envasement, au temps défavorable, etc…
La taille adéquate pour le transfert du naissain en mer dépend de la région, des espèces et des techniques de pré-grossissement.
Le but du pré-grossissement est de permettre au naissain d'atteindre une taille correcte pour l'ensemencement et ceci, le plus rapidement possible, afin de diminuer au maximum les coûts d'alimentation, de chauffage et de main d'oeuvre, en se rappelant toutefois que l'ensemencement ne peut se faire à toutes les saisons.
Ces dernières années, des améliorations ont été faites dans les systèmes de pré-grossissement. L'ancienne méthode des “corbeilles” d'élevage a été remplacée par celle des colonnes à flux ascendant (upwelling) (Figure 7). Ce système consiste à faire remonter l'eau riche en phytoplancton au travers d'un bassin à fond maillé dans lequel le naissain est placé.
Avant de placer le naissain dans ces bassins, il est conseillé de réaliser les opérations suivantes:
- Travaillant avec des animaux à fixation temporaire, il faut changer l'eau tous les deux jours. Après avoir vidé les bassins de fixation, un faible jet d'eau est utilisé pour rincer le fond et les parois. De cette façon, seul le naissain fixé restera attaché sur les parois du bassin. A la sortie, l'eau passera à travers un filet à plancton et les larves retenues seront examinées afin de déterminer si elles doivent ou non être remises en élevage (Figure 9). Le naissain fixé, porteur de byssus, est détaché à l'aide d'un jet d'eau puissant, récolté sur un filet a mailles adéquates et placé dans les colonnes à courant ascendant (upwelling).
- Si nous avons affaire à des huîtres, nous souviendrons que deux techniques différentes peuvent être utilisées.
+ La méthode des collecteurs permet aux huîtres de croître jusqu'à la taille requise et ensuite, on détroque le naissain et on le place dans les colonnes “upwelling”. Ce système peut endommager le naissain au détroquage.
+ La fixation des huîtres sur particules leur permet de croître jusqu'à une taille suffisante pour permettre le passage sur tamis qui sépare les huîtres des particules quand la fixation n'a pas eu lieu. Ensuite, on place les huîtres dans la colonne à “upwelling”.
L'utilisation de ces colonnes à courant ascendant implique un contrôle du débit d'eau, du nombre de naissain par bassin et de la ration aliment'ire. Comme ces facteurs sont en relation avec la tuille, ils changent au fur et à mesure que le naissain grossit; On diminue la densité et on augmente le débit et la ration alimentaire.
WILSON (1981) suggère un débit minimum de 1 litre par minute pour 10 g de naissain et une biomasse constante maximale de 200 mg de naissain par litre.
Certaines expériences (URBAN et al., 1983) ont montré que la meilleure croissance obtenue à partir de la plus haute ration alimentaire testée, équivalait à un poids sec d'algues égal à 5 % du poids vivant des huîtres.
La demande alimentaire croissante du naissain grandissant est le “goulot de la bouteille” dans la culture des mollusques.
2.7. Cultures d'algues
Une écloserie exige de grands volumes d'algues et de nombreux comptages des cellules d'algues.
II existe deux méthodes principales pour cultiver les algues:
- Les cultures monospécifiques,
- Les blooms induits de cultures mixtes.
Cette dernière méthode n'est pas conseillée pour l'alimentation larvaire car les mélanges d'espèces ne remplissent pas toujours les exigences des larves et le développement des bactéries peut provoquer des mortalités importantes. Cependant, elle peut être la meilleure technique pour l'alimentation du naissain;
Il y a cinq paramètres majeurs qui règlent la croissance des algues:] lumière, pH, température, éléments nutritifs et turbulence. Ces paramètres doivent être contrôlés pour la culture des algues.
La culture monospécifique implique l'augmentation progressive des volumes de culture. Dans notre laboratoire, nous avons:
- Souches de culture en éprouvettes, obtenues à partir de laboratoires spécialisés;
- Cultures en Erlenmeyer de 250 ml. Stock (Figure 10 ) utilisé pour la multiplication algale. Après une période de croissance de 7 jours, les Erlenmeyer servent à l'inoculation des volumes de taille supérieure (ballons de 6 1). Pas d'aération.
- Ballons de 6 1 (Figure 11). IIs sont utilisés pour l'alimentation des larves et pour l'inoculation de volumes supérieurs. Ils sont utilisés de 5 à 15 jours après l'inoculation.
- Bassins de 100 et 1 000 litres pour le conditionnement et l'alimentation du naissain. Récolte partielle.
2.8. Traitement de l'eau
Avant son utilisation l'eau de mer doit être filtrée.
Elle doit être toujours filtrée afin d'enlever les organismes indésirables. Après filtration, quelques auteurs recommandent également la stérilisation de l'eau au moyen d'U.V., par exemple. En fait, les larves peuvent être êlevées dans une eau non stérilisée mais l'utilisation d'U.V. donne de meilleures garanties pour une survie maximale. Son utilisation est en effet une mesure efficace pour lutter contre le développement des mycoses ou des maladies bactériennes.
Le schéma suivant montre le traitement utilisé dans notre laboratoire:
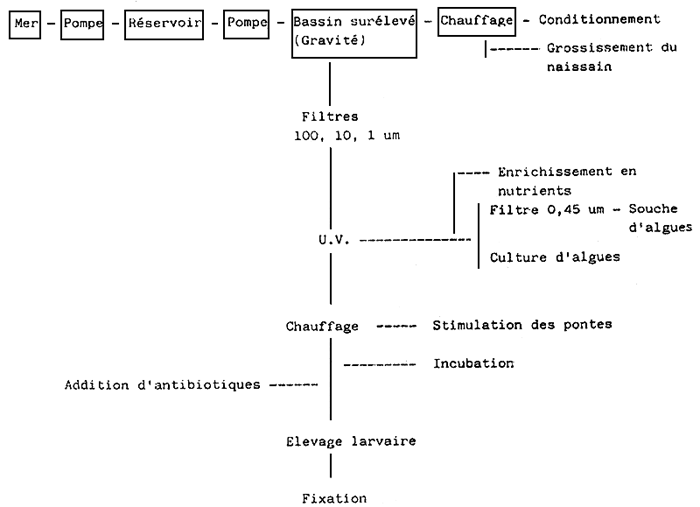
Quand un volume d'eau est stagnant, le nombre de bactéries augmente; donc, les techniques d'élevage larvaire stimulent la prolifération bactérienne, qui peut conduire à une mortalité larvaire totale.
En fait, l'apparition sporadique de mortalités massives en écloseries, ne sont pas rares et, en général, elles proviennent de bactéries pathogènes. La source principale de contamination bactérienne est la culture d'algues (PRIEUR et CARAVAL, 1979).
TUBIASH (1975) décrit une maladie très commune, la nécrose bacillaire, dont l'agent est un Vibrio qui détruit les cultures en quelques heures. L'utilisation d'eau de mer filtrée et stérilisée par U.V., accompagnée d'un bon nettoyage ne sont pas toujours des mesures suffisantes et certains auteurs recommandent I'utilisation d'antibiotiques. Habituellement, ils sont employés de manière préventive, contre les mortalités foudroyantes causées par des bactéries pathogènes, rendant le traitement impossible quand les premiers symptômes apparaissent.
La discipline sanitaire est la règle la plus importante à adopter.
Tableau I: Résultats des expériences de stimulation sur Venerupis pullastra
| Température de stimulation | Nombre d'expériences | Nombre d'expériences avec réponses positives | % | Nombre de coquillages stimulés | Nombre de réponses positives | % |
| 28 – 30° C | 8 | 1 | 12,5 | 162 | 16 | 9,9 |
| 23 – 26° C | 12 | 7 | 58,3 | 173 | 43 | 24,9 |
| 18 – 21° C | 11 | 6 | 54,5 | 190 | 43 | 22,6 |
Résultats de Venerupis decussata
| Température de stimulation | Nombre d'expériences | Nombre d'expériences avec réponses positives | % | Nombre de coquillages stimulés | Nombre de réponses positives | % |
| 23 – 24° C | 4 | 0 | 0 | 65 | 0 | 0 |
| 28 – 29° C | 8 | 8 | 100 | 194 | 68 | 35 |
Tableau II: Milligrammes de matière organique dans 108 cellules
| Chaetoceros calcitrans | 1,15 ± 0,39 |
| Isochrysis galbana | 2,45 ± 0,81 |
| Monochrysis lutheri | 2,72 ± 0,60 |
| Skeletonema costatum | 4,04 ± 1,15 |
| Phaeodactylum tricornutum | 4,88 ± 1,36 |
| Rhodomonas baltica | 7,09 ± 1,10 |
| Tetraselmis suecica | 16,23 ± 4,47 |
Tableau III: Effet de différents aliments sur le taux de croissance des larves de Pecten maximus
Toutes les valeurs sont comparées avec un mélange de I.galbana et de M. lutheri, et cet aliment
est considéré comme égal à 100.
| Espèces d'algues | Sk | Ph | Rh | I+M+Rh+PH | Rh+Ph | I+M+Ph | I+M | I+M+Rh | I+M+Ch | I+M+Rh+Ch |
| Croissance | 28,4 | 49,6 | 70,8 | 73,4 | 82,5 | 82,2 | 100 | 100,3 | 139,8 | 186,1 |
Sk = Skeletonema costatum
Ph = Phaeodactylum tricornutum
Rh = Rhodomonas baltica
I = Isochrysis galbana
M = Monochrysis lutheri
Ch = Chaetoceros calcitrans
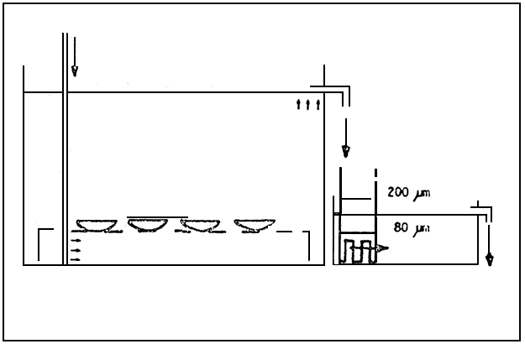
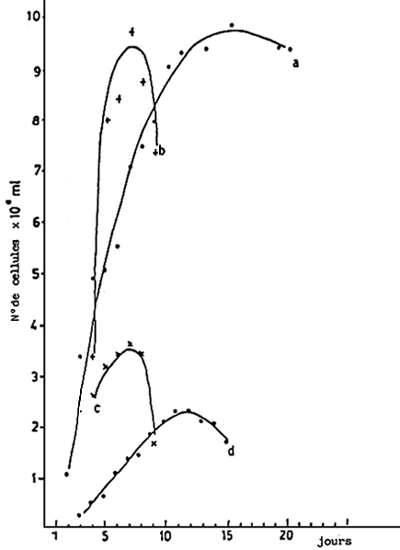
Fig. 1 - Schéma du système de conditionnemnt.
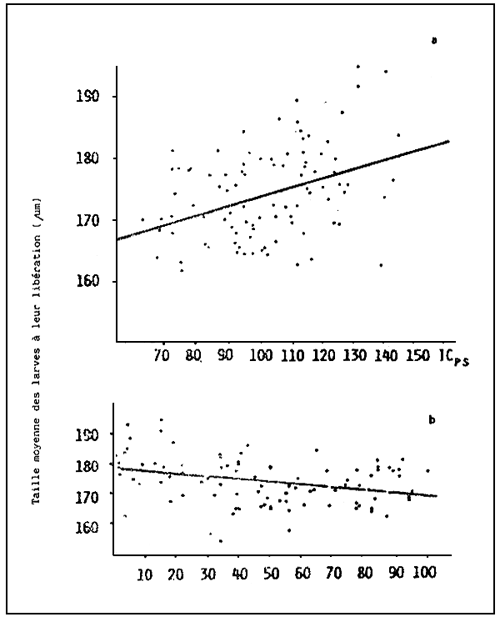
Fig. 2 - Jours de conditionnement
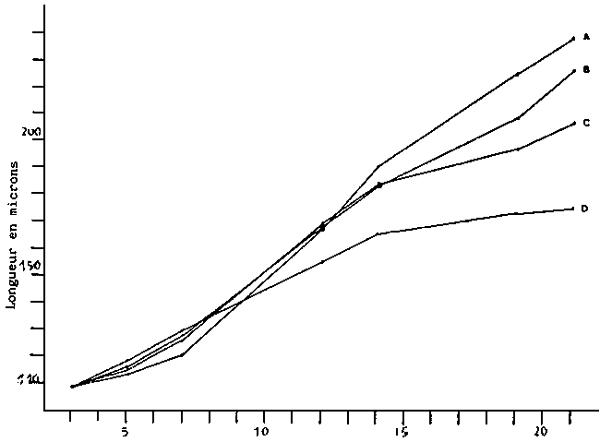
Fig. 3 - Croissance des larves de V. pullastra alimentées avec différentes
concentrations de M. lutheri.
A. 100 cellules/microlitre
B. 75 cellules/microlitre
C. 50 cellules/microlitre
D. 25 cellules/microlitre
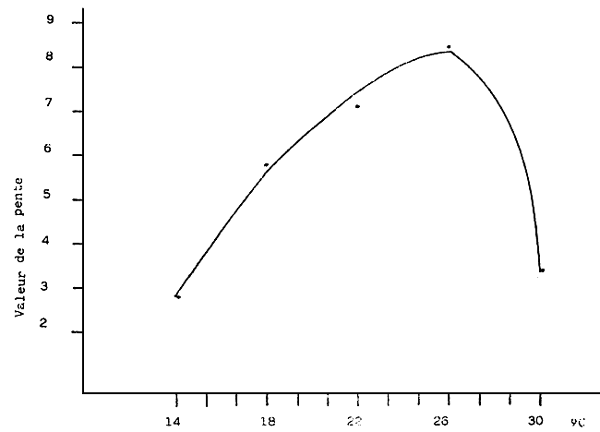
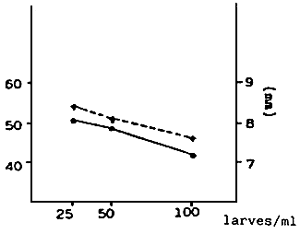
Fig. 4 - Pente de la courbe de croissance des larves de V. pullastra cultivées à différentes températures
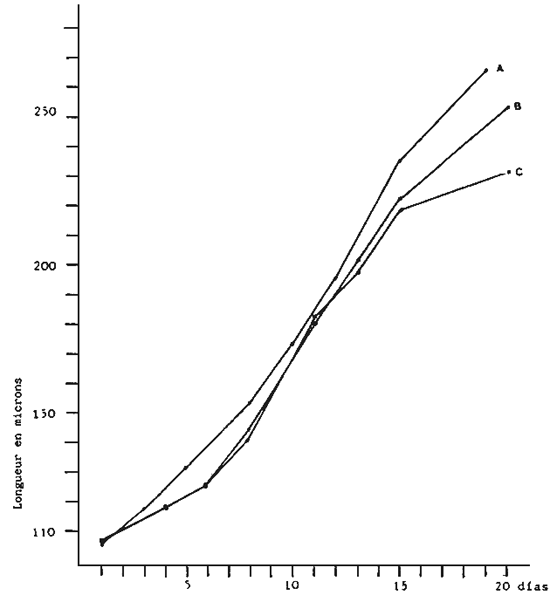
Fig. 5 - Croissance des larves de V. pullastra cultivées à
différentes densités
A. 1500 larvaes/1
B. 3000 larves/1
C. 6000 larves/1
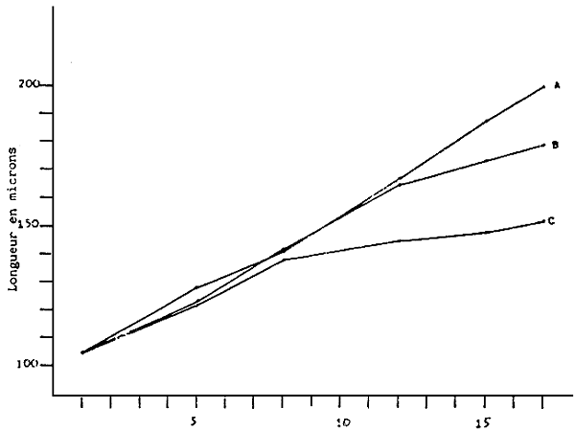
Fig. 6 - Croissance des larves de V. pullastra cultivées à différentes
densités
A. 10 000 larves/l - Equation de la droite Y = 94,77 + 6,11 × : r2 =0,99
B. 20 000 larves/l - Equation de la droite Y = 101,41 + 4,80 × : r2 = 0,99
C. 40 000 larves/l - Equation de la droite Y = 109,94 + 2,70 × : r2 = 0,90
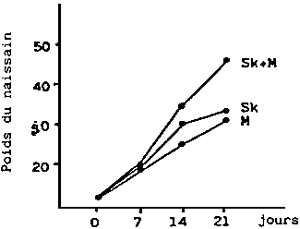 |  | ||
| Fig. 7 - | a - effet de deux régimes monoalgals et d'un mélange des deux sur la croissance de la larve (naissain) | b - | Effet de la densité de culture du naissain sur la croissance en poids (mg) et en taille (μm) |
Fig. 7 - Systèmes de prégrossissement
a) corbeilles d'élevage
b) Colonnes à flux ascendant
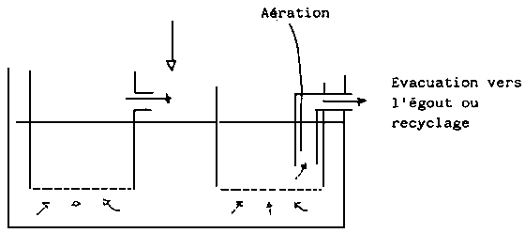
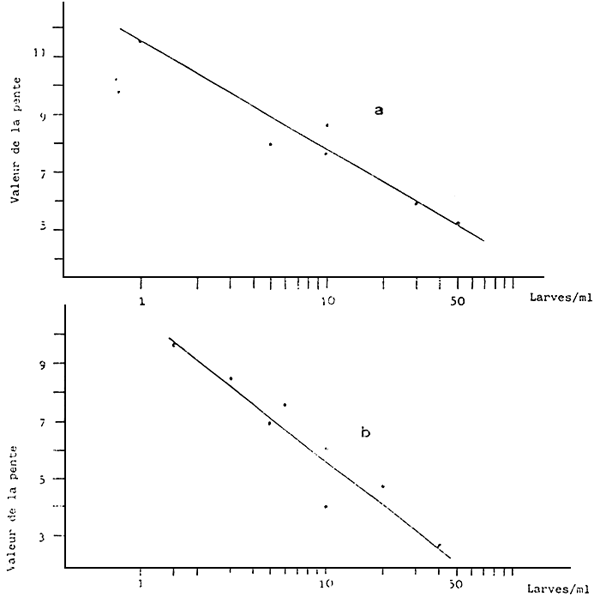
Fig. 8 - Dorite de régression enter la ligne de croissance Y
et le logarithme de la concentration des larves en culture de
V. decussata (a) y /V. pullastra (b)
a) Equation de la droite: Y = 20.15 - 3,38 × : r2 = o,94
b) Equation de la droite: Y = 25,68 - 4,99 × : r2 = o,91
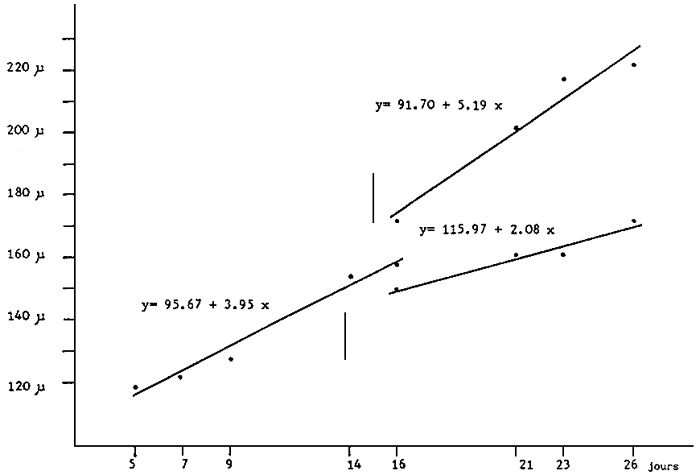
Fig. 9 - Courbes de croissances des larves de Pecten maximus, avant et après séparation en deux groupes à différents taux de croissance
Fig. 10
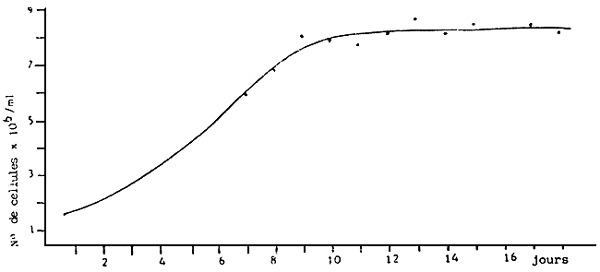
a) Croissance moyenne de Monochrysis lutheri en erlenmeyers de 250 cc.
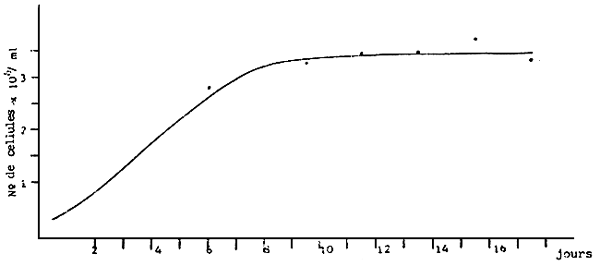
b) Croissance moyenne de Tetraselmis suecica en erlenmeyers de 250 cc
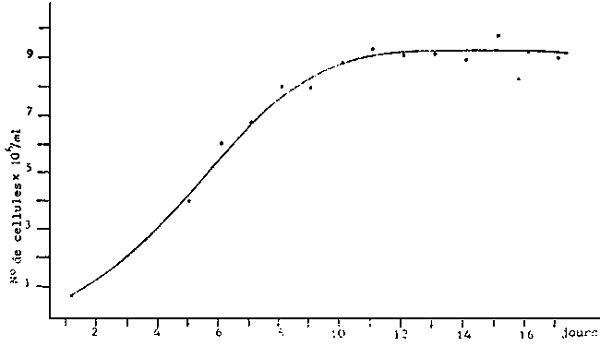
c) Croissance moyenne de Isochrysis galbana en erlenmeyer de 250 cc.
 | 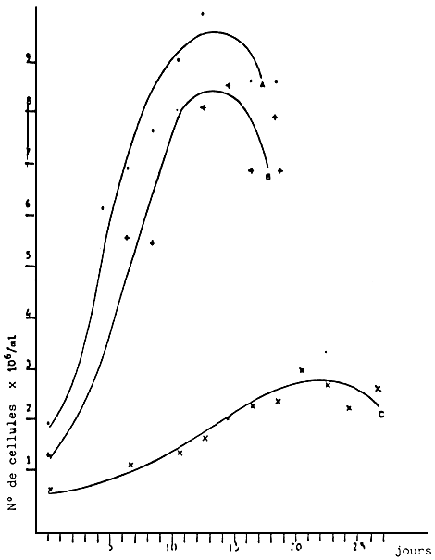 | ||
| - | Croissance moyenne des algues cultivées dans des ballons de 6 1: a) Ph. tricornutum: b)Ch. calcitrans: c) S. costatum; d)Rh. baltica. | - | Croissance moyenne de trois algues cultivées dans des ballons de 6 1: a) M. lutheri; b)I. galbana et c)I. suecica. |
Fig. 11 - Croissance des algues en ballons de 6 1. (D'après PERES et al.,1977)
BIBLIOGRAPHIE
COE, W.R. 1943, Sexual differentiation in mollusks. I. Pelecypods. Q. REV. Biol. 18: 154 – 164.
COE, W.R. 1945. Development of the reproductive system and variation in sexuality in Pecten and other pelecypod mollusks. Trans; Conn. Acad. Sci. 36: 673 – 700.
CHANLEY, P. 1975. Laboratory cultivation of assorted bivalve mollusks, P 297 – 318 in - W.L. SMITH & M.H. CHANLEY (edt): Culture of marine invertebrate animals, Plenum Press, N.Y.
CULLINEY, J.L., P.J. BOYLE & R.D. TURNER, 1975. New approaches and techniques for studying bivalve larvae, p 257 – 271. In W.L. SMITH & M.H. CHANLEY (edt): Culture of marine invertebrate animals. Plenum Press. N. Y.
DAVIS, H.C. & A.D. ANSELL, 1962. Survival and growth of larvae of the European oyster Ostrea edulis at lowered salinities. Biol. Bull., 122: 33 – 39.
DUPUY, J.L., N.T. WINDSOR & C.E. SUTTON, 1977. Manual for design and operation of an oyster seed hatchery for the American oyster Crassostrea virginica. Special report № 142, Virginia INst. Mar. Sci.104 P.
FLASSCH, J.P., Y. KOIKE & C. AVELINE, 1973. Production de naissain de bivalves à moyenne échelle: but, perspectives. Collogue sur l'aquaculture, 22 24 Oct. 1973, BREST. Publication du CNEXO. Ed. L. LAUBIER & D. REYSS.
GONZALEZ, G & G. ROMAN. 1983. Larval culture of the scallop (Pecten maximus). 4th International Pectinid Workshop. ABERDEEN, Scotland, May 1983. 10p. Mimeo
HELM, M.M., D.L. HOLLAND & R.R. STEPHENSON, 1973. The effect of supplementary algal feeding of a hatchery breeding stock of Ostrea edulis on larval vigour. J. mar. biol. Assu. U.K., 53: 673 – 684
IMAI, T. 1966. Mass production of moliuscs by means of rearing the larvae in tanks. 7th Pac. Sci. Congr. TOKIO. 2966. Venus: 159 – 167
LE PENNEC, M. 1981. Les méthodes expérimentales induisant ha ponte chez les mollusques bivalve marins. Haliotis, 11: 139 – 155
LOOSANOFF, V.L. 1945. Precocious gonad development in oysters induced in mid-Winter by high temperature. Science, 102: 124 – 125
LOOSANOFF, V.L. & H.C. DAVIS, 1963. Rearing of bivalve mollusks. In F.S. RUSELL (edt): Advances in marine Biology, Val. 1.pp 1 – 136. Academic press LONDON.
PEREZ CANACHO, A., G. ROWAN & M. TORRE, 1977, Experiencias en cultivos de larvas de tres especies de moluscos bivalvos: Venerupis pullastra (Montagu), Venerupis decussata(Linnaeus) y Ostrea edulis (Linnaeus). Bol. Inst. Esp. Ocean., 235: 7 – 62.
PRIEUR, D. & J.P. CARVAL, 1979. Bacteriological and physico-chemical analysis in a bivalve hatchery: techniques and preliminary results. Aquaculture, 17; 359 – 374.
ROMAN, G. 1985, Estudio sobre el acondicionamiento de la ostra plana (Ostrea edulis L) I Congreso Nacional de Acuicultura.O. GROVE, 8 – 11 Oct. 1985. In press.
ROMAN, G. & A. PEREZ CAMACILO, 1979. cultivo de larvas de vieira Pecten maximus (L) en laboratorio. Bol. Inst. Esp. Oceano. № 223: 17p.
TUBIASH, H.S. 1975. Bacterial pathogens of bivalve mollusc larvae. pp: 61 – 71. In: Culture of marine invertebrate animals. W.L. SMITH & M.H. CHANLEY (Edt). Plenum Press. N. Y.
URBAN, E.R., Jr, G.D. PRUDDER & C.J. LANGDON, 1983. Effect of ration on growth and growth efficiency of juveniles of Crassostrea virginica (Gmelin). Jour. Shellf. Res. 3. (1): 51 – 57.
WALNE, P.R., 1963. Observations on the food value of seven species of algae to the larvae of Ostrea edulis. 1: Feeding experiments. J. mar. biol. Ass. U. K. 43: 767 – 784.
WALNE, P.R., 1964. The culture of bivalve larvae, pp 197 – 210. In: Physiology of Mollusca. K.M. WILBUR & C.M. YONGE (Edt). Academic Press. N. Y. Vol. I.
WALNE, P.R. 1965. Observations on the influence of food supply and temperature on the feeding and growth of the larvae of Ostrea edulis, L. Fish. Invest. LONDON. Ser. 2. 24. (1): 45 pp
WALNE, P.R, 1966. Experiments in the large-scale culture of the larvae of Ostrea edulis L. Fish. Invest. LONDON. Ser. 11. 15 (4): 53 pp.
WILSON, J. 1981. Hatchery rearing of Ostrea edulis and Crassostrea gigas. Aquaculture Tech. Bull., Ireland (4): pp: 1 – 34.
Mr. C. NASH et R.M. KONINGSBERGER *
INTRODUCTION
L'élevage des Mugilidés est pratiqué protout dans le monde plusieurs siècles: à petite échelle (non-instensif), dons des lagunes, des estuaires ou des étangs.
Plus récents sont les travaux expérimentaux réalisés sur l'élevage intensif des mulets, travaux qui varient en fonction de la région, des besoins et de la pratique.
L'approvisionnement en juvéniles se fait encore grâce à la pêche dans la nature, mais la quantité diminue régulièrement, partout dans le monde. L'avenir de l'aquaculture est donc entièrement dépendant du succès de la reproduction artificielle. Ensuite, la génétique et la sélection des reproducteurs conduiront l'aquaculture sur une voie parallèle à celle suivie par l'agiculture intensive. Lorsque cela arrivera, les Mugilidés auront réellement un avantage sur toutes les autres espèces, grâce aux nombreuses espèces qui peuvent être utilisées pour développer un type particulier d'aquaculture, dans chaque région.
LES REPRODUCTEURS
La ré, en reproduction artificielle (de n'important quelle espèce de plantes ou d'animaux) ou d'animaux) dépend tout d'abord de la qualité et de la quantité des reproducteurs disponibles.
Une grande quantité d'individus sexuellement matures doit être maintenue en bonne santé.
Les paramètres de l'environnement qui influencent les changements physiologiques de la glande pituitaire et qui stimulent les gonades (maturation saisonnière) doivent être respectés.
Parmi les différents paramètres, la température et la photopériode sont les deux plus importants initiateurs de l'activité pituitaire des poissons dans les régions tempérées et sub-tempérées (HOAR, 1959).
En ce qui concerne le mulet (“grey mullet”), les reproducteurs grandissent bien en élevage, mais les stades finaux de la gamétogénèse ne sont pas complets, et il n'existe pas, dans la littérature, de texte relatant un développment naturel total jusqu'à la ponte.
Lieux'de reproduction naturelle
Les lieux de reproduction naturelle des mulets, qui ont été décrits ou déduits à partir de nombreux travaux effectués dans le monde, n'indiquent aucun modèle spécifique ou similarité de l'environnement.
On peut en conclure que les adultes migrent pour pondre dans la région favorable la plus proche, offrant aux oeufs et aux larves les plus grandes chances de survie. le tableau I résume les saisons de reproduction des Mugilidés, répertoriées dans la littérature.
Conditions de reproduction artificielle
La littérature ne rapporte aucune information sur la ponte de Mugilidés en conditions artificielles ou en captivité “sans aide”. Divers essais ont été réalisés, mais les résultats les plus prometteurs ont été obtenus à partir de poissons dont la maturation a eu lieu en captivité ou d'individus capturés en mer mais dont la gamétogénèse complète et la ponte ont été induites par l'injection d'hormones. La possibilité d'étendre la période de reproduction grâce aux changements de température et de photopériode a été prouvé et permettra une plus grande efficacité de la reproduction.
Comportement au moment de la ponte et fertilisation
De nombreuses observations concordent pour décrire le comportement des mulets sauvages au moment de la reproduction comme suit: une grande femelle, entourée de plusieurs mâles de dimensions plus petites.
En ce qui concerne la reproduction induite, 2 ou 3 mâles sont placés avec une femelle dans on aquarium, deux heures environ avant la ponte. Une femelle pond généralement 12 heures après avoir reçu la 2de et dernière injection.
L'efficacité des techniques d'hypophysation pour la ponte dépend beaucoup de la sélection des femelles qui doivent être au bon stade de développement des ovaires. Des caractéristiques anatomiques externes permettant de définir l'état de maturité des femelles, ont été décrites mais elles restent trop subjectives: forme du ventre, couleur et état de gonflement du cloaque. D'autres paramètres, comme 1'apparence des oocytes, la structure hystologique des oeufs, la concentration en protéines et en calcium dans le plasma ont été décrits. La méthode la plus fiable et la plus utilisée actuellement est le contrôle de la maturation des ovaires in vivo par le prélèvement des oocytes à l'aide d'une canule.
LES OEUFS
Fécondité
Le tableau II reprend la fécondité des femelles de plusieurs espèces de mulets:
Morphologie et qualité des oeufs
Les oeufs de Mugilidés sont sphériques et transparents; la surface de l'oeuf est lisse. le jaune n'est pas segmenté et comporte une grande gouttelette d'huile qui rend les oeufs extrêmement flottants. Les oeufs n'adhèrent pas.
La littérature nous rapporte que le diamètre des oeufs fertilisés (M. cephalus) varie entre 880 et 980 μm.
Bien que certaines éludes aient déjà été faites, il reste encore beaucoup de travail à rēaliser pour déterminer la composition biochimique des oeufs de Mugilidés. L'élevage de plusieurs espèces de mulets, à la suite d'une reproduction induite a déjà été réalisée avec un certain succès à Taiwan, à Hawai, en Israël et en Inde. IIest improbable que la qualité des oeufs produits par stimulation hormonale soit inférieure. L'échec concernant la survie des larves est probablement dû a des problèmes successifs, à une mauvaise manipulation et au manque de connaissance des besoins de l'élevage larvaire.
Comportement Le comportement de migration verticale des oeufs de Mugilidés a été décrite de nombreuses fois, par différents auteurs et ils s'accordent pour dire que lorsqu'on empêche les oeufs de se déposer sur le fond du bassin, par une forte aération, le taux de survie est accru et le temps d'incubation réduit de deux heures pour une même température. IIs concluent que la turbulance de l'eau et la température ont un effet sur le temps d'incubation. L'environnement artificiel d'un bassin utilisé pour l'éclosion des oeufs introduit des problèmes qui ne sont normalement pas recontrés par des oeufs libérés en mer. La densité des oeufs est un facteur clef influençant le taux d'éclosion. La surpopulation amène des problèmes tels que: agglutination, contamination bactérienne, abaissement du taux d'oxygène. Ces problèmes peunvent être résolus par la mise en suspension des oeufs grâce à la turbulence de l'eau.
Conditions du milieu pendant l'incubation
NASH et al. (1974), NASH et SYLVESTER (données non publiées) et NASH et KINO (1975) donnent les taux de survie des oeufs de M. cephalus à large spectre de température, salinité et oxygène dissous.
Les mortalités minimales apparaissent à une température de 22°C et à une salinité de 32‰ et â une température effective d'incubation comprise entre 11 et 24° C. KINO (données non publiées) rappelle le changement d'osmolarité des oeufs avant la ponte et que ceux-ci deviennent isotoniques à l'eau de mer au moment de la ponte. Ceci associé au comportement migratoire des adultes au moment de la reproduction (migration vers la mer) indique que la salinité est un facteur très important pour le développement des oeufs et que l'incubation devrait se faire en eau de mer.
Installation pour l'incubation
Le traitement, par antibiotiques, de l'eau des bassins d'incubation réduit l'activité bactérienne autour de la coquille de l'oeuf et empêche l'agglutination des filtres bactériens mais il ne faut pas toutefois sous-estimer l'utilité des antibiotiques.
La littérature rapporte peu d'informations en ce qui concerne les matériaux de construction utilisés pour les bassins d'incubation. SHELBOURNE (1964) recommande l'utilisation de matériaux inertes. La couleur est également importante; il faut que la surface ne soit pas réfléchissante afin que les larves puissent voir clairement les proies.
LES LARVES ET L'ELEVAGE LAHVAIRE
On considère que les mulets restent sous la responsabilité de l'écloserie jusqu'à ce qu'ils aient atteint au moins l'âge de 50 jours. De grandes pertes apparaissent si les larves sont manipulées ou transportées avant d'avoir fini la métamorphose.
Morphologie
les larves de Mugil cephalus, à peine écloses, ont une taille qui varie entre 2,2 et 3,5 mm. La goutte d'huile principale (ainsi que les plus petites) est située dans la partie postérieure du sac vitellin. Une description complète du développement et du comportement de M. cephalus a été réalisée par LIAO (1974).
Comportement
KUO et al (1973 a) rapporte que les larves à peine écloses sont inactives et restent en suspension obliquement dans l'eau avec, en général, l'abdomen tourné vers le haut. Diffétents auteurs décrivent deux migrations vers le fond du bassin au cours des lo premiers jours de vie de la larve.
Nutrition
Beaucoup d'éleveurs de poissons ou de mollusques marins pensent que, même si la présence de phytoplancton dans le bassin d'élevage est bénéfique, elle n'a pas toujours une valeur alimentaire directe. les bénéfices indirects liés au phytoplancton, sont probablement la stabilisation du milieu d'élevage, l'apport des vitamines ou acides aminés nécessaires, le maintien de la valeur nutritive du zooplancton qui sera ensuite consommé par les larves.
La sélection des proies par la larve est faite, très probablement, sur la base de la taille et du mouvement.
La quantité d'aliment au la densité des proies est un autre facteur de succès de l'élevage. Une surabondance d'aliment peut être aussi dangereuse qu'une insuffisance.
Les méthodes actuelles d'élevage larvaire qui rencontrent le plus grand succès sont celles ou les aliments vivants et artificiels sont utilisés ensemble. créant de cette façon un système écologique plus stable.
Les régimes mixtes sont également plus économiques puisqu'ils diminuent le nombre d'organismes qui doivent être produits journellement.
Un large choix d'organismes apporte probablement une qualité meilieure et permet à choque larve de se développer a son propre rythme en s'alimentant d'organismes proportionnés à sa taille.
Les conditions d'environnement de l'élevage
La salinité est probablement le paramètre le plus irrégulier et le moins contrôlé qui influence l'incubation et l'élevage larvaire des espèces marines.
La plupart des chercheurs concluent que lessalinités naturelles (32–35‰) sont optimales. La plupart des espèces de poissons marins ou d'eau saumâtre libèrent les oeufs dans l'océan et le développement des larves est donc adapté aux salinités élevées. Le développement larvaire est fonction de la température. Un contrôle strict de la température pour l'incubation des oeufs de Mugilidés est important. Les larves Jusqu'à la métamorphose tolèrent un large éventail de températures et leur taux de croissance est on rapport avec ces températures.
La tailie des systèmes d'élevage n'influence pas nécessairement le succès de celui-ci. Plusieurs chercheurs, utilisant de petites unités bien suivies, avec une quantité d'aliment élevée, mais une densité larvaire basse, ont obtenu des taux de survie exceptionnels. Mais, en ce qui concerne la production massive les bassins plus grands sont plus appropriés d'un point de vue économique.
La couleur des bassins d'élevage peut être importante. Les bassins les plus communément utilisés sont ceux en polyéthylène de couleur noire, non réfléchissante, empêchant ainsi la concentration de la lumière en certains point du bassin.
Une intensité lumineuse uniforme placée au-dessus des bassins évita le regroupement des proies vivantes et donc celui des larves. en certains points du bassin. L'élevage devrait te faire à l'intérieur, car il ne faut pas exposer les larves à la lumière solaire.
Développement post-larvaire
Une fois qu'elles ont traversé la phase critique (12 – 14 jours), les larves rencontrent peu de problèmes. Elles sont généralement fortes, se nourrissent bien et croissent rapidement. A la fin de la 3ème semaine, les écailles apparaîssent et les larves nagent en bancs.
La croissance est rapide; les larves se nourissent voracement de nauplii d'Artemia, de phytoplancton, de diatomées, de copépodes et d'aliment artificiel sec. Le renouvellement d'eau dans les bassins peut être augmenté. Le problème le plus grand, à cet âge, est le transfert.
TECHNIQUES D'ELEVAGE
Les géniteurs
Les géniteurs devraient avoir 4 ans, être maintenus en bonne santè, à une salinité de 32 – 35 ‰ et à une tempèrature de 20 – 22°C. Lee reproducteurs peuvent être choisis soit parmi les poissons en migration au moment de la période de reproduction, soit parmi ceux tenus en captivité en étangs. L'utilisation de ces derniers est plus intéressante, mais, de toutes façons, il faut prévoir le remplacement d'une partie du stock, tous les ans.
Lorsque de la gonadotropine de saumon est utilisée, il faut injecter en deux fois, avec un intervalle de 24 à 48 heures, en fonction du développement des oeufs, une dose de 12 à 21 μg/g de poids. En alternative, on peut utiliser une dose faite de2,5 à 6 glandes piutitaires de mulet, de 10 à 60 U.I. de synahorine et de O à 300 mg de vitamine E.
La ponte en saison naturelle
La ponte est précédée de l'hydratation des oocytes qui est caractérisée par le gonflement de l'abdomen et la dépot de calcium.
Deux heures avant la ponte, les mâles peuvent être mis avec les femelles en proportion de 3: 1, Les reproducteurs devraient être maintenus dans l'eau de mer, è une température de 20 – 22°C.
Dc préférence, les pondes devraient se faire dans des bassins situés à l'intérieur oû le centrôle de l'environnement (température, lumière, minimum de dérangement peut être plus facilement réalisé.
Les oeufs peuvent être récoltés très facilement à la surface de l'eau.
La ponte en dehors de la saison
les poissons doivent subir an conditionnement de 120 jours avant la période de ponte désirèe.
L'incubation des oeufs
L'incubation des oeufs se fait dans des récipients particuliers afin de maintenir un contrôle strict des paramètres de l'environnement.
Les oeufs récoltés à la surface du bessin de ponte sont lavés et ensuite plongés dans un bain d'eau de mer contenant les antibiotiques suivants: pénicilline G potassium (80 UI/ml) et sulphate de streptomycine (0,05 mg/ml., Les oeufs sont alors distribués de l'eau est de 32 à une densité maximum de 400 oeufs/l. La salinité de l'eau est de 32à35‰et la température de 20 à 22°C, L'eau est généralement filtrée et traintée aux antibiotiques à une dose de IO/ml de pénicilline et de0,01 mg/ml de streptomycine par jour.
Dans ces conditions, l'incubation prendra de 50 à 60 h/jour pour être complète. L'incubation devrait toujours se faire à l'intérieur, avec une illumination indirecte (1400 lux).
Elevage larvaire
Lorsque les larves éclosent, l'aération est arrêtée, ce qui entraine les larves en surface et les coquilles vides ainsi que les oeufs morts vers le fond.
Les bassins d'élevage larvaire sont préparés plusieurs jours à l'avance avec de l'eau de mer stérilisée et à une température de 20 – 22°C. Au même moment, ces bassins sont inoculés avec des algues, soit Dunaliella ou Chlorella, soit toute autre algue qui peut alimenter des rotifères.
l'objectif est d'atteindrs une densité de 104-105 particules/ml desquelles 10/ml devraient être des rotifères d'une taille de 100 à 250 μm. Cette méthode est valable jusqu'au troisième jour.
A partir os 140 jour, les nauplii d'Artemia sont ajoutés et ceci jusqu'au 40èe jour. Au moment du transfert, la densité ne doit pas être supérieure à 6/1 et au 21ème jour à0,33/1. Chaque bassin devrait être muni d'une illumination dont l'intensité à la surface ne dépass pas 1 400 lux.
A partir du 4ème jour après l'éclosion, l'eau dans les bassins d'élevage devrait être diluée avec de l'eau douce abaisserait la salinité de 0,5‰ par jour afin d'attenidre une salinité de 30‰ au 7ème jour. Ensuite, la salinité devrait décroître de telle façon qu'elle atteigne 20‰ au jour 30 etc qu'elle soit maintenue à cette salinité pendent encore 20 jours.
La tolérance des mulets à différents métabolites n'est pas encore bien connue mais l'un peut considérer comme acceptables les valeurs suivantes: nitrites jusqu'à 3,00 μg; nitrates jusqu'à 90,00 μg; ammoniaque jusqu'à 30,00 μg; phosphates jusqu'à 9,00 μg et sulfure d'hydrogène jusqu'à 5,00 μg au jour 1.
Le bassin devrait être syphonné quotidiennement.
Entre le 30ème et le 50ème jour, la croissance est rapide et les larves acceptent de l'aliment semi-humide ainsi que des nauplii d'Artemia et des copépodes. Les larves de mulets d'âge infèrieur à 40 jours ne doivent pas être manipulées, c'est pourquoi le transfert dans d'autres bassins ne se fait pas avant le 50ème jour.
LE FUTUR
Parmi tous les poissons d'eau de mer ou d'eau saumâtre, les Mugilidés ont probablement le futur le plus prometteur. La majorité a une chair d'une nature et d'un goût très bons et ceci particulièrement quand ils sont pêchés dans des eaux á forte salinité. Ils sont largement distribués et tolèrent des conditions extrèmes de température, de salinité et d'oxygène dissous.
Les nombreuses espèces de Mugilidés donnent è cette famille un potentiel génétique incomparable. Grâce à la manipulation des gènes et à la sélection des souches, ils deviendront l'animal marin le plus exploité