Mr. A.G.J. Tacon
1. INTRODUCTION
1.1 Cadre et objet du rapport
Quatre types d'organismes planctoniques vivants (diatomées, flagellates, rotifères et nauplii d'Artemia) sont généralement utilisés pour l'élevage & grande échelle des larves de crevettes pénéide, depuis le stade zoé l'au travers de la métamorphose, jusqu'au stade post-larvaire. Une écloserie moderne de larves de crevettes pénéide a essentiellement besoin d'un personnel hautement formé et qualifié et de la production d'aliments vivants sophistiqués, ce qui exige des investissements importants au niveau de l'espace utilisé, des installations et des services, voire même l'achat d'aliments coûteux tels que les cystes d'Artemia.
Une écloserie moderne et bien gérée pratiquant un système d'alimentation á base d'aliments vivants peut être économiquement très rentable. Toutefois, il est nécessaire de développer un système d'alimentation simple, économique, et pouvant être facilement adopté par le propriétaire/exploitant ou par un agriculteur disposant de peu de moyens. Le présent rapport présente l'évaluation d'un système d'alimentation en écloserie simple et peu économique qui a été dévelopé initialement en Inde. Basé sur l'emploi exclusif pendant tout le cycle d'écloserie d'un broyat de crustacés; ce système d'alimentation a été testé sur le Penaeus monodon au cours d'une série de tests conduits au Regional Lead Centre aux Philippines, installe au Département d'Aquaculture du Southeast Asian Fisheries Development Centre (SEAFDEC).
1.2Object de la mission
La mission avait pour objet: (a) de réunir les données publié sur l'emloi de broyat humide en suspension dans l'alimentation des larves et de déterminer les avantages et les Inconvénients de ce système; (b) de discuter avec le personnel de recherche du Central Marine Fisheries Research Institute (CMFRI)à Cochin, les progrès récents dans l'alimentation des larves de crevette (février 1985); (c) de se rendre au Centre pilote Régional aux Philippines (qui fait partie du Réseau Asiatique de Centres de Recherche en Aquaculture, NACA) pour assister Mr. P. Kungvankij, aquaculturiste (chercheur) au NACA, dans La programmation et l'exécution de tests d'alimentation larvaire à base de matières en suspension pour P. monodon. Le travail devait être entrepris à l'écloserie Leganes, Département d'aquaculture SEAFDEC, Iloilo, philippines (mars–avril 1985).
1.3Remerciements
L'auteur aimerait remercier Dr. T.V.R. Pillay (ancien chef de programme, ADCP) et Mr. P.G. Padlan (expert en aquaculture, ADCP), d'avoir reconnu la nécessité d'une telle mission. Des renseignements très utiles relatifs aux différentes expériences déjà réalisées ont été fournis par Dr. E.G. Silas (Directeur, CHFRI) et son équipe de recherche è Cochin en Inde. Les essais d'alimentation larvaire au département d'Aquarculture SEAFDEC ont été conduits avec la collaboration enthousiaste et les efforts soutenus de Mr, P. Kungvankij, aquaculturiste (chercheur) au NACA et de ses collègues chercheurs SEAFDEC à l'écloserie de Leganes, parmi lesquels je cite Mr. E. Borlongan, Ms. K.G. Corre, Ms. L.F. Gustilo, Mr.I.O. Potestas, Mr. B.J. Pudadera, Ms. G.A. Taleon et Mr. A. Unggi. L'auteur voudrait également exprimer sa reconnaissance à beaucoup d'autres personnes, de Particuliers ou de founctionnaires du NACA et du SEAFDEC, et notamment à Dr. F.P. Pascual (nutritionniste) exerçant à SEAFACE pour son soutien et sa collaboration Inlassables en tant qu'amie et consoeur.
2.HISTORIQUE
La quasi-totalité des écloseries de crevettes pénéide ont recoures á l'emploi exclusif d'une Série d'organismes vivants (généralement les diatomées, les algues, les rotifères et les nauplii d'Artemia) pour l'alimentation durant l'élevage larvaire (cf. CRC, 1983; Liao, 1984). Cette Pratique provient de l'absence d'un système d'alimentation alternatif. Jusqu'à tout récemment, les efforts fournis pour remplacer entièrement les organismes vivants par des aliments artificiels secs ont généralement eu pour résultat des taux de survie larvaire réduits et un développement larvaire retardé (New, 1970).
Deux nouveaux systèmes d'alimentation ont été récemment Introduits comme étant des alternatives “viables” au système de production d'aliments vivants: (i) l'emploi exclusif d'un aliment microencapsulé/microenrobé, réhydratable pour l'alimentation larvaire (Jones, 1984: Scura, Fischer et Yunker, 1984; Kanazawa, 1983), et (2) l'emploi exclusif d'un broyat de crevettes en suspension (Hameed Ali, Dwivedl and Alikunhi, 1982). Bien que les deux systèmes se basent sur un seul aliment non-vivant pour toute la durée de l'élevage larvaire, Ils sont différents du point de vue des moyens d'alimentation utilisés et du degré de sophistication de l'aliment préparé. Le présent rapport l'évaluation du système d'alimentation à base de broyat de crevettes en suspension.
3. BROYAT DE CREVETTES EN SUSPENSION - EXAMEN DES ETUDES ANTERIEURES EN INDE
Un système original et économique d'alimentation en écloserie a été utilisé dans l'élevage à grande échelle des larves de la crevette pénéide en Inde (Hameed Ali, Dwivedi) et Alikunhi, 1982). Le système est base sur l'emploi exclusif d'un broyat humide de crevettes en suspension servant d'aliment pendant tous les stades larvaires et post-Iarvaires. Il a été développé à partir d'une série d'essais conduits au Central Institue of Fisheries Education à Bombay, au Brackishwater Aquaculture Development Centre à Jepara en Indonésie, au Regional Shrimp Hatchery à Azhicode (Kerala) et au Mundra Experimental Shrimp Hatchery Gujarat, (Alimunhi et al., 1980, 1982, Hameed Ali, 1980; Hameed Ali et Dwivedi, 1977; Hameed Ali, Dwivedl et Alikunhi, 1982).
Tableau 1
Taille des particules et régime alimentaire recommandés pour lélevage larvaire des crevettes, en utilisant une préparation de broyat humide de crustacés
| Espèces de crevettes élevées | ||||||||
| Penaeus spp | Metapenaeus spp. | Parapenaeopsis spp. | ||||||
| Dimension des particules (μum) durant: | ||||||||
| Zoè | Z1 | 160 | 50 | 50 | ||||
| Z2 | 160 | 50 | 50 | |||||
| Z3 | 200 | 160 | 160 | |||||
| Mysis | M1 | 250–300 | 160 | 160 | ||||
| M2 | 300–400 | 250–300 | 250–300 | |||||
| M3 | 300–400 | 250–300 | 250–300 | |||||
| Post-Iarve | PL1 | 400–500 | 300 | 300 | ||||
| Dosage optimum de l'aliment (g matériel brut/1 000 larves/jour) durant: | Squilla * | Autres | Squilla | Autres | Squilla | Autres | ||
| Zoè- | Z1 | 1,0 | 0,5 | 0,5 | 0,3 | 0,5 | 0,3 | |
| Z2 | 1,25 | 0,75 | 0,75 | 0,5 | 0,75 | 0,5 | ||
| Z3 | 1,5 | 0,75 | 1,0 | 0,6 | 1,0 | 0,6 | ||
| Mysis | n1 | 1,75 | 1,0 | 1,25 | 0,75 | 1,25 | 0,75 | |
| M2 | 1,75 | 1,25 | 1,25 | 1,0 | 1,25 | 1,0 | ||
| M3 | 2,0 | 1,5 | 1,5 | 1,25 | 1,51 | 1,25 | ||
| Post-larve | PL1 | 2,0 | 2,0 | 1,75 | 1,5 | 1,75 | 1,5 | |
Parmi les crustacés utilisées avec succès pour faire le broyat humide en suspension fiqurent: La crevette Jinga Metapenaeus affinis; la crevette Kadal M. dobsoni(‘Thelli’); la crevette kiddi Parapenaeopsis stylifera; la pâta de crevette Jawla Acetes indicus; la “Splder prawn” Nematopaleamon tenipes; les mysidés Mésopodopsis spp. et le stomatopode Oratosquilla nepa ‘Chelly’. Ces crustacés ont été choisis pour leur disponibilité sur le marche local à un prix abordable, et parce qu'lis sont faciles à pécher. Les cractacés les plus utilisés jusque-Iá sont I'Acetes indicus, le stomatopode et laM. Dobsoni. Le tableau L indique le ré alimentale recommandé par Hameed Ali, Dwivedl et Alikunhi (1982) pour chacun des stades larvaires du Penaeus spp., du Metapenaeus spp., et du Parapenaeopsis spp., en utilisant un broyat humide de crevettes en suspension.
Les essais alimentaires ont été conduits en Inde sur neuf espèces de crevettes : Penaeus monodon, P. merquiensis, P. indicus, P. semisulcatus, Metapenaeus affinis, M. monoceros, M. brevicornis, M. dobsoniet Parapenaeus stylifera (cf. Hameed Ali, Dwivedl et Alikunhi, 1982). Les neuf espèces ont été élevées avec succès en utilisant le broyat humide de crevettes en suspension depuis le stade Z1, au travers de la métamorphose, jusqu'au début du stade post-larvaire. Parmi les différentes “suspensions” faisant l'objet de l'évaluation, un taux de survie larvaire plus élevé a été remarqué chez ‘Chelly’ (o. nepa) que chez‘Thelli’ M. dobsoni), P. indicus et P. mondon (Alikunhi et al., 1980). Hameed Ali, Dwivedl et Alikunhi (1982) estiment que plus de 150 millions de pénéides au stade nauplii ont été élevées au moyen de ce système d'alimentation, avec la production de plus 50 millions de larves (début stade post-larve). Ceci donne un taux de survie d'environ 33 % de N6 à PLI. Alikunhi et al., (1980) ont réalisé, entre 1979 et 1980, en utilisant une suspension soit de ‘Cheely’ soit de ‘Thelli’. un taux moyen de survie larvaire 43,8% de N6 à PLI Chez la P. indicus (78 essais d'élevage différents), de 25,3% chez la P. monodon (x7), de 72,0% Chez laP. semisulcatus(x2), de 32,9% chez la M. monoceres(x2), de 62,5% chez la M. dobsoni(x3) et de 30,8% chez la P. stylifera (x2). Toutefois, malgré un taux de survie supérieur à 90% pour beaucoup de cultures, avec la production de larves PL dépassant 200 PLI/1,18 sur un total 118 cultures qui avalent atteint le stade N6 ont dû être abandonnées au cours de l'élevage larvaire suite au développement d'intense “blooms” de diatomées à l'intérieur des bacs. Etant donné que ces éches se sont produits sans exception dans les bacs d'élevage exposés à la lumière directe, il a été présumé qu'ils n'ont pas été causés par le régime alimentaire lui-même, et, par conséquent, n'ont pas été inclus par Alikunhi et al. (1980) dans leurs estimations finales des taux survie des larves. Cependent, ces échecs représentent une perte de 15,8% sur toutes les cultures. Hameed Ali (1980) et Hameed Ali, Dwivedi et Alikunhi (1982) ont également fait part du développement d'algues et de diatomées à l'intérieur des bacs de culture au cours de la période de production des larves.
Bien qu'Alikunhi et al. (1980) et Hameed Ali (1980) Précisent que les larves de crevette sont nourries exclusivement d'aliments non-vivants, le développement d'algues et de diatomées dans les bacs de culture indique la présence d'organismes vivants pouvant servir éventuellement d'aliment pour la crevette. De même, quoiqu'ils déclarent qu'aucun cas de mortalit´ larvaire n'ait été enregistré suite à une suralimentation au moyen du broyat en suspension, ils ne commentent pas le fait que la présence des diatomées seraient éventuellement l'effet direct des substances nutritives incorporées dans le système d'alimentation utilisé (effet fertilisant). Si c'est le cas, il est possible que les pertes dans l'élevage attribuées par Alikunhi et al. (1980) à la présence d'un nombre excessif de diatomées, soient dûes à la sur-alimentation et à un renouvellement d'eau insuffisant.
4.BROYAT DE CREVETTE EN SUSPENSION - ESSAIS ALIMETAIRES A LEGANES
4.1Introduction
Vu les résultats très encourageants obtenus en Inde par Hameed Ali et ses coliègues suite à l'utilisation du broyat do crevettes en suspension dans l'alimentation larvaire, et compte tenu des discussions avec Dr. E.G. Silas et Mr. P. Kungvankij, trois essais expérimentaux ont été conduits sur des larves de P. mondon au stade de la première alimentation à l'écloserie de Leganes, Département d'Aquaculture SEAFDEC, Iloilo (du 10 mars au 4 avril 1985).1 Outre le système d'alimentation à base de broyat humide de crustacés en suspension utilisé par Hameed Ali, Dwivedi et Alikunhi (1982), un nonveau système d'alimentation à base de broyat sec de crustacés en suspension a également été testé.
Les broyats de crustacés ont été préparées à partir de l'Acetes sp., connu aux philippines sous le nom d''Alamang'. Cette espèce a été choisie à cause de sa disponibilité sur le marché à l'époque de la mission et du fait que cette famille de crevettes représentait l'une des sources initiales d'alimentation utilisées par Hameed Ali et ses collègues pour la préparation d'un broyat humide de crustacés en suspension (Acetes indicus; Hameed Ali, et al., 1982).
4.2 Matériel et méthodes
Trois essais successifs d'alimentation, applés, A, B et c, ont été faits avec des larves de P. monodon au stade de la première alimentation, obtenues à partir de reproducteurs pêchés dans la nature. Les essais d'alimentation ont été conduits soit dans des bacs d'élevage larvaire placés à l'extérieur (expériences A et C), soit dans des bac d'élevage larvaire placés à lintérieur (expérience B). Six régimes alimentaires différents ont été testés dans l'expérience A (I–IV, Fig. 1); 4 régimes à base de broyat de crustacés y compris le système d'alimentation à base de crustacés congelés décrit par Hameed Ali, et al., (1982), ainsi que deux régimes de contrôle à base d'aliments vivants similaires à ceux normalement utilisées à l'écloserie de Leganes. Les 3 régimes ayant donné les millleurs résultats durant l'expérience A ont alors été évalués d'abord dans l'expérience B en bacs situes à l'intérieur et ensuite dans l'expérience C en bacs placés à l'extérieur. Dans ce dernier cas un groupe de contrôle complémentaire ne recevant aucun aliment exogène, vivant ou artificial, a également été introduit.
4.2.1. Bacs d'élevage larvaire expérimental et qestion de l'eau
Deux installations d'élevage expérimental ont été utilisées dans les trois essais d'alimentation larvaire. Dans les expériences A et C les larves ont été élevées dans douze bacs de production de phytoplancton de forme circulaire, d'une capacité de 1,000 litres, fabriqués en fibres de verre, et placés à l'expérieur. Ces bacs étaient couverts d'une bâche transparente de midi jusqu'au lendemain matin afin de minimiser les fluctations de température de l'eau. Dans l'expérience B les larves ont été élevés dans neuf bacs circulaires, en fibres de verres, d'une capacité de 250 litres, placés é l'Intérieur de l'écloserie. Ces bacs ont été placés à coté d'une fenêtre en verre givré et n'ont reçu que la lumière du jour. Ces deux systèmes de bacs expérimentaux sont présentés sous forme de diagramme dans la Fig. 2.
Un système discontinu de renouvellement d'eau a été adopté à l'intérieur des bacs d'élevage larvaire, et ce pendant toute la durée du cycle d'élevage. Un pourcentage prédeterminé du volume global de l'eau se trouvant dans le bac était renouvelé une fois par jour à 08.00h par siphonnement (au travers d'un filtre) avant d'être rempli de nouveau d'un volume équivalent d'eau de mer filtrée (15 um). La proportion d'eau devant être remplacé chaque jour dépendait du stade de croissance des larves présentes. Les procédures adoptées pour le système d'eau au cours des trois essais d'alimentation sont indiquées au tableau 2.
L'aération continue et le mouvement ascendant de l'eau ont été maintenus dans les bacs d'élevage pendant toute la duré des essais au moyen d'un seul aérateur placé au centre et au fond de chacun des bacs. Chaque aérateur consistait en un tuyau de distribution d'air en PVC ouvert à l'extrémité, lesté et connecté à une soufflante centrale “Roots”. La circulation et l'agitation de l'eau étaient indispensables pour maintenir constament en suspension à l'intérieur de la colonne d'eau, les larves de crevette et les organismes utilisés comme aliments.
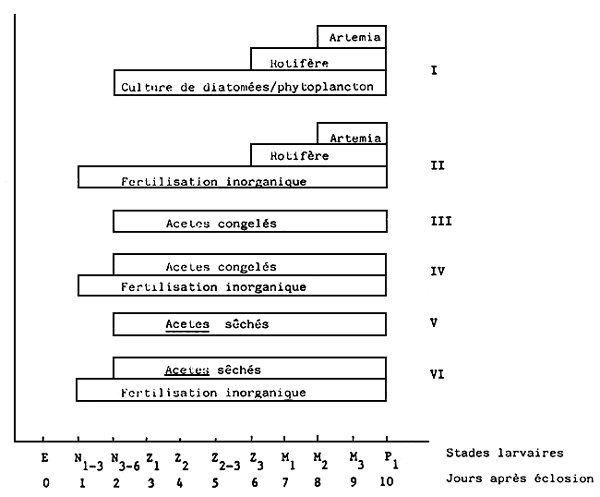
Fig. 1. Schéma de l'alimentation testée sur des larves de P. monodon


Fig. 2. Bassins d'élevage larvaire utilisés pendant les expériences A et C (a)
Tableau 2
Gestion de l'eau utilisée durant (1)
les expériences A, B et C
| Expériences | |||
| A | B | C | |
| N1 – 3 | 700 | 200 | 700 |
| N3 – 6 | 700 | 200 | 700 |
| Z1 | 700 + 200 | 200±60 | 700±150 |
| Z2 | 900±300 | 200±160 | 850±250 |
| Z2 – 3 | 900±400 | 200±160 | 850±350 |
| Z3 | 900±400 | 200±160 | 850±350 |
| M1 | 900±400 | 200±160 | 850±400 |
| M2 | 900±400 | 200±160 | 850±500 |
| M3 | 900±400 | 200±160 | 850±450 |
4.2.2. Espèces utilisées dans les expériences
Des reproducteurs P. monodon matures et prêts pour la ponte étaient capturés quotidiennement par les pêcheurs locaux et placés individuellement (en fonction de la disponibilité en bassins) dans les bacs de ponte circulaires en fibres de verre d'une capacité de 250 l, placés à l'intérieur de l 'écloserie. Chaque bac de ponte contenait environ 200 l d'eau de mer fraîche (température: 26–29; salinité: 34–36‰:, filtrée préablement au moyen d'un filtre à plancton de 15 um), L'aération se faisait par une seule chaîne de distribution d'air en PVC; le bassin était pourvu d'un couvercle amovible en contre-plaqué. Après la ponte, qui avait généralement lieu la nuit, la femelle était retirée du bassin et les oeufs fécondés étaient siphonés dans un collecteur d'oeufs en plastique formé de deux tamis successifs; d'abord, un tamis de 250 um destiné à retenir les dechêts indésirables, et ensuite, un autre de 80 um pour retenir les oeufs fécondés. Les oeufs de pontes individuelles collectés de cette manière étaient ensuite lavés dans l'eau de mer filtrée et puis immergés dans un bain de méthylène bleu (2mg/1), avant d'être placés de nouveau dans l'eau de mer filtrée dans le bac de ponte (devenu le bac d'éclosion). Dès l'éclosion les nauplii de crevettes ont été comptés en prélevant des échantillons semblables de 100 ml d'eau, et ensuite transférés dans les bacs d'élevage expérimentaux pour entamer les différents essais d'alimentation larvaire. la densité initiale des nauplii à l'intérieur des bacs d'élevage larvaire variait entre 60–100 nauplii/l (expériences A et C) et 150–200 nauplii/1 (expérience B). Au cours de chaque expérience les larves étaient élevées du stade nauplius (N1) au stade M3/P1 pendant une période totale de 10–12 jours en utilisant l'un des six régimes alimentaires différents.
4.2.3. Aliments et régimes alimentaires
Expérience A
Six régimes alimentaires différents ont été testés (I–IV; fig. 1).
A-I Culture d'aliment vivant:
Tetraselmis sp. (souche Batan) a été utilisée comme aliment en miantenant durant tout le cycle d'élevage une concentration d'environ 10.000 cellules/ml, et ce à partir du deuxième jour après l' éclosion (N3–6) jusqu'à M3/P1. Brachionus plicatilis a été utilisé comme aliment en maintenant une concentration de cinq organismes/ml depuis z3 jusqu'à M3/P1. Les nauplii d'Artemia salina ont été utilisés comme aliment en maintenant une concentration de deux organismes/ml depuis M2 jusqu'à M3 P1.
A-II Fertilisation de l'eau et alimentation à base d'aliment vivant:
Une fertilisation inorganique de l'eau a été pratiquée pendant toute la durée du cycle d'élevage pour permettre le développement d'une population mixte de diatomées - la dose quotidienne de fertilisants était de 4/0, 4mg/l de NaNO3/NAH2Po4 le Premier jour (N1–3) et de 3/0,3mg/l par la suite jusqu'à M3/P1. Les fertilisants de généralement utilisés à Leganes ètaient KNO3/Na2HPO4, mais ils n'étaient pas disponibles au moment de la mission. En plus des fertilisants inorganiques, les B. Plicatilis et les nauplii d'A. salina ont été utilisés comme aliment au taux de 5 organismes/ml de z3 à M3/P1 et de organismes/ml de M2 à M3/P1. Les méthodes utilisées pour la culture d'algues, de rotifères et d'Artemia ont déjà été décrites par Kungvankij et al., (1984).
A-III alimentation à base d'Acetes congelé:
Des crevettes fraîches (Acetes sp.) ont été obtenues auprès des pêcheurs locaux et ont été congélées à une température de -20°C. Le régime alimentaire utilisé était basé sur un taux initial de 0, 5 mg d'Acetes congelés/larve/jour de N3–6 à Z1 (les 2ème et 3ème jours après l'éclosion), avec par la suite une augmentation du taux d'alimentation à raison de 20%/jour jusqu'àM3/P1. Les taux d'alimentation ont été calculés à partir de l'hypothèse d'un taux de survie des larves de 100% afin de s'assurer d'une concentration minimale de particules alimentaires à l'intérieur de la colonne d'eau. l'aliment en suspension a été préparé en homogénéisant dans un mélangeur électrique la ration d'une journée avec un volume approprié d'eau de mer, et en passant l'homogénat à travers un tamis de mailles appropriées afin d'obtenir la gamme de tailles de particules requise pour les larves; <125 um N6-Z2/3; 125<250 um Z3-M2; 250<350 um M3-P1.
Tableau3
Composition approximative d'Acetes sp sêchés par air/soleil Echantillons de l'expérience A pour la période de mars 1977 à juillet 1982 (1)
| Composition(%) | Echantilions d'Acetes | ||
| Expérience - Mars 1977 – juillet 1982 | |||
| Valeurs extrêmes | Moyennes (2) | ||
| Humidité | 14, 09 | 3,5–14,0 | 7,94 |
| Matieres sêches (%) | |||
| Protéines brutes | 54,46 | 55,45–72,78 | 65,59 |
| Lipides bruts | 3,74 | 4,13–5,77 | 5,04 |
| Fibres brutes | 4,88 | 2,67–8,09 | 4,97 |
| Cendre | 15,20 | 7,34–25,42 | 16,29 |
| ERA (3) | 21,72 | NA (4) | 6,11 |
| Calcium | 3,44 | NA | NA |
| Phosphore | 1,25 | NA | Na |
(1) Les analyses ont été réalisées par le “Analytical laboratory division du SEAFDEC Aquaculture Department”.
(2) Noyenne de 5 échantillons
(3) Extraits non azotés = 100 - (Humidité + protéine brute + lipide + cendre + fibre brute)
(4) Pas disponible
A - V1 - Option fertilisation/Acetes secs:
Comme AV, mais incluant la fertilisation inorganique décrite en A - II
A-IV Fertilisation de l'eau et alimentation à base d'Acetes congélé:
Tel que décrit cl-dessus, mais comprenant également le régime de fertilisants organiques décrit sous A-II.
A-V Alimentation à base d'Acetessec:
L'Acetes séché à l'air/soleil a été acheté sur le marché local d'Iloilo et broyé au moyen d'un broyeur à marteau, sous forme de poudre fluide de particules de une taille appropriée (50<125 um N6-Z2/3; 125<250 um Z3-M2; 250<350 um M3-P1<). Un taux d'alimentation initial de 0,10 mg d'Acetes sec/larve/jour (= 0,50 mg Acetes congelé/larve/jour) a été distribué à N3–6 et z1 (les 2 et 3léme jours après l'éclosion), avec des augmentations par la suite au rythme de 20%/jour jusqu'à M3/P1. La composition approximative de l'Acetes utilisé est indiquée au tableau 3.
A-VI Fertilisation de l'eau et alimentation à base d'Acetes sec
Comme Pour A-V mais en ajoutant régime fertilisants inorganiques décrit sous A-II.
Expérience B
Trois options différentes ont été testées:
B-1 Alimentation à base d'base aliment vivant:
Identique à l'expérience a, mais en ajoutant la diatomée Chaetoceros calcitrans comme aliment, et ce pour maintenir une concentration de cellules d'environ 50000/ml pendant le cycle de N3–6 (2ème jour après l'éclosion) à M3/P1 (en plus du flagellate Testraselmis sp.).
B-II Alimentation à base d'Acetes congelé
Comme dans l'expérience A, mais avec un taux d'alimentation ajusté en fonction du nombre réel de larves présentes chaque jour jusqu'à Z3, le taux d'alimentation est ensuite calculé sur la base du nombre initial de larves stockées à N3–6 (c'est-à-dire que les taux d'alimentation de N3–6 à Z3 n'ont pas été basés sur un taux de survie de 100% mais plutôt sur l'effectif observé).
B-III Alimentation à base d'Acetes sec Comme dans l'expérience a, mais avec un taux d'alimentation adjusté tel que décrit ci-dessus.
Expérience C
Quatre options alimentaires ont été testées:
C-I Alimentation à base d'aliment vivant:
Comme pour l'expérience B.
C-II Alimentation à base d'Acetes congélé:
Comme pour l'expérience A.
C-III Alimentation à base d'Acetes sec:
Comme pour l'expérience A.
C-IV Test de contrôle:
Aucune algue et aucun aliment exogène sec/vivant n'a été utilisé; la
croissance larvaire dépend entièrement du plancton naturel présent dans l'eau de mer
filtrée.
4.2.4Gestion
Dans l'expérience A, l'étude consistait en six traitements alimentaires avec deux essais par traitement; dans l'expérience B en trois traitements alimentaires avec trois essais par traitement; dans l'expérienc C en quatre traitements alimentaires avec trois essais par traitement. Dans l'ensemble des trois expériences les traitements ont été affectés au hasard aux différents bacs d'élevage larvaire.
L'alimentation a commencé dans tous les cas immédiatement après le renouvellement d'eau (4.2.1), une fois par jour à 08h30 dans le cas des régimes alimentaires à base d'algues, d'aliments vivants et de fertilisants inorganiques, et quatre fois par jour dans le cas des régimes alimentaires à base d'Acetes congélé/sec (08h30, 12h00, 17h00 et 24h00; la ration quotidienne étant divisée en quatre parts égales).
Le comptage du phytoplancton et les relevés de la température, du pH et de la salinité de l'eau ont été assurés quotidiennement dans chaque bac de culture avant le renouvellement d'eau (08h00) et dans l'après-midi (15h00). Vu que peu ou aucune différence n'a été enregistrée entre les différents bacs en ce qui concerne les paramètres de la qualité chimique de l'eau, les valeurs extrêmes et moyennes enregistrées pendant toute la période de culture sont indiquées dans le tableau 4.
Tableau 4
Température, pH et salinité de l'eau de mer
dans les bassins d'élevage durant les expériences A, B et C
| Experience | Temperature (° C) | pH | Salinité(‰) | |||
| moyenne | écart | moyenne | écart | moyenne | écart | |
| A | 28,5 | 24–32,5 | 8,0 | 7,5–8,7 | 34,6 | 34–36 |
| B | 27,0 | 25,6–28,4 | 8,2 | 7,9–8.5 | 35,3 | 35–37 |
| C1 | 30,1 | 28–31,5 | 8,4 | 8,2–8,6 | 36,1 | 34–37 |
1 Donnés basées seulement jusqu'au stade Z 3 ou jour 6 après l'éclosion
Des échantillons d'un litre d'eau ont été prélevés immédiatement après le renouvellement d'eau pour faire une estimation du nombre de larves et pour évaluer la croissance de ces dernières. En plus des activités de routine mentionnés ci-dessus le comptage des organismes planctoniques a été également effectué au cours de l'expérience A dans un bac de contrôle ne contenant aucune larve de crevette et ne recevant aucune alimentation, et ce pour connaître la quantité de phytoplancton entrant avec l'eau.
4.3 Résultats
4.3.1 Expérience
Le comptage, la croissance et le taux de survie des larves de p. monodon pendant le cycle de culture de 10 jours sont indiqués dans le Tableau 5 et dans la Fig. 3. Le taux moyen de survie le plus élevé a été enregistré pour le régime alimentaire á base d'Acetes sec (46,7%), sulvi de celui à base d'Acetes congelé (29,4%), de celui à base d'aliments vivants (24,7%), de celui à base de fertilisants/Acetes sec (16,6%), de celui è base de fertilisants/aliments vivants et de celui à base de fertilisants/Acetes congélé (16,0%). Le développement larvaire était similaire dans tous les traitements,à l'exception des régimes alimentaires à base d'Acetes congelé, où au dixième jour (06h00) la métamorphose de la troisième sous-étape da mysis à la première sous-étape post-larvaire n'avait toujours pas eu lieu (Fig. 3).
Tableau 5
Comptage et développement des larves de P. monodon élevées en bassins extérieurs à partir de 6 régimes alimentaires différents - Expérience A (1)
| Jours après éclosion | Volume d'eau total (1) | Aliment vivant (A1) | Fertilisation/Aliment vivent (A n) | ||||||||||
| Essai I | Essai II | Essai I | Essai II | ||||||||||
| Compte total larves | Stade larvaire | Densité larvaire (№:/1) | Compte total larves | Stade larvaire | Densité larvaire (№:/1) | Compte total larves | Stade larvaire | Densité larvaire (№:/1) | Compte total larves | Stade larvaire | Densité larvaire (№:/1) | ||
| 2 | 700 | 57750 | N3 – 6 | 82 | 43400 | N3 – 6 | 62 | 58450 | N3 – 6 | 83 | 44100 | N3 – 6 | 63 |
| 3 | 900 | 58500 | Z1 | 65 | 54000 | Z1 | 60 | 62100 | Z1 | 69 | 32850 | Z1 | 36 |
| 4 | 900 | 75600 | Z2 | 84 | 42300 | Z2 | 47 | 58400 | Z2 | 76 | 32400 | Z2 | 36 |
| 5 | 900 | 40000 | Z2 – 3 | 54 | 36000 | Z2 – 3 | 40 | 62100 | Z2 – 3 | 69 | 28800 | Z2 – 3 | 32 |
| 6 | 900 | 54900 | Z3 | 61 | 28800 | Z3 | 32 | 40500 | Z3 | 45 | 18900 | Z3 | 21 |
| 7 | 900 | 53100 | ZM1 | 59 | 30600 | M1 | 34 | 20100 | M1 | 29 | 22500 | M1 | 25 |
| 8 | 900 | 47175 | ZM2 | 52 | 28475 | M2 | 32 | 8925 | M2 | 10 | 8500 | M2 | 9 |
| 9 | 900 | 33575 | ZM3 | 37 | 25500 | M3 | 28 | 4250 | M3 | 5 | 11475 | M3 | 13 |
| 10 | 900 | 15000 | P1 | 17 | 16000 | P1 | 18 | 200 | P1 | 0,2 | 14000 | P1 | 16 |
| Taux.de survie (%) | 19,8 | 29,6 | 0,32 | 31,7 | |||||||||
| Taux de survie moyen (%) | 24,7 | 16,0 | |||||||||||
| Acètes congelés (A III) | Fertilisation/Acètes congelés (A 1V) | ||||||||||||
| 2 | 700 | 52850 | N3 – 6 | 75 | 51450 | N3 – 6 | 73 | 55300 | N3 – 6 | 79 | 49700 | N3 – 6 | 71 |
| 3 | 900 | 60750 | Z1 | 87 | 66600 | Z1 | 74 | 57600 | Z1 | 64 | 18900 | Z1 | 21 |
| 4 | 900 | 63000 | Z2 | 70 | 45900 | Z2 | 51 | 52200 | Z2 | 58 | 12000 | Z2 | 13 |
| 5 | 900 | 48650 | Z2 – 3 | 54 | 41400 | Z2 – 3 | 46 | 45900 | Z2 – 3 | 51 | 9900 | Z2 – 3 | 11 |
| 6 | 900 | 49500 | Z3 | 55 | 42300 | Z3 | 47 | 45000 | Z3 | 50 | 9900 | Z3 | 11 |
| 7 | 900 | 44100 | M1 | 49 | 37800 | M1 | 42 | 35100 | M1 | 39 | 8000 | M1 | 9 |
| 8 | 900 | 36875 | M2 | 41 | 41650 | M2 | 46 | 29600 | M2 | 33 | 9775 | M2 | 11 |
| 9 | 900 | 49725 | M3 | 55 | 39625 | M3 | 44 | 21675 | M3 | 24 | 6800 | M3 | 8 |
| 10 | 900 | 22000 | M3 | 24 | 16000 | M3 | 18 | 8000 | M3/P1 | 9 | 9000 | P1 | 10 |
| Taux.de survie (x) | 34,9 | 24,0 | 13,9 | 18,1 | |||||||||
| Taux.de survie moyen (x) | 29,4 | 16,0 | |||||||||||
| Acètes secs (AV) | Fertilisation/Acètes secs (AVI) | ||||||||||||
| 2 | 700 | 47250 | N3 – 6 | 67 | 45850 | N3 – 6 | 65 | 69900 | N3 – 6 | 100 | 52500 | N3 – 6 | 75 |
| 3 | 900 | 54900 | Z1 | 61 | 54900 | Z1 | 61 | 68850 | Z1 | 76 | 50850 | Z1 | 56 |
| 4 | 900 | 62100 | Z2 | 69 | 62100 | Z2 | 69 | 60300 | Z2 | 67 | 47700 | Z2 | 53 |
| 5 | 900 | 62100 | Z2 – 3 | 69 | 46800 | Z2 – 3 | 52 | 54900 | Z2 – 3 | 61 | 45000 | Z2 – 3 | 50 |
| 6 | 900 | 45900 | Z3 | 51 | 37000 | Z3 | 42 | 59500 | Z3 | 62 | 49 500 | Z3 | 44 |
| 7 | 900 | 55500 | M3 | 62 | 49500 | M1 | 55 | 47700 | M1 | 53 | 33300 | M1 | 37 |
| 8 | 900 | 56950 | M2 | 63 | 49300 | M2 | 55 | 31450 | M2 | 35 | 20475 | M2 | 32 |
| 9 | 900 | 45450 | M3 | 54 | 36975 | M3 | 41 | 37025 | M3 | 42 | 11000 | M3 | 13 |
| 10 | 900 | 32000 | p1 | 36 | 26000 | P1 | 29 | 10000 | P1 | 11 | 10000 | P1 | 11 |
| Taux de survie (%) | 51,5 | 41,9 | 14,3 | 19,0 | |||||||||
| Taux de survie moyen (%) | 46,7 | 16,6 | |||||||||||
1: Taux de survie 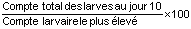
2: Très basse survie due à une infection à Z3 (zibrio)
Note: L'écart dans le compte total durant les premie states larvaires est du aux difficultés d'échatillonnage de camptage de grands nombres de
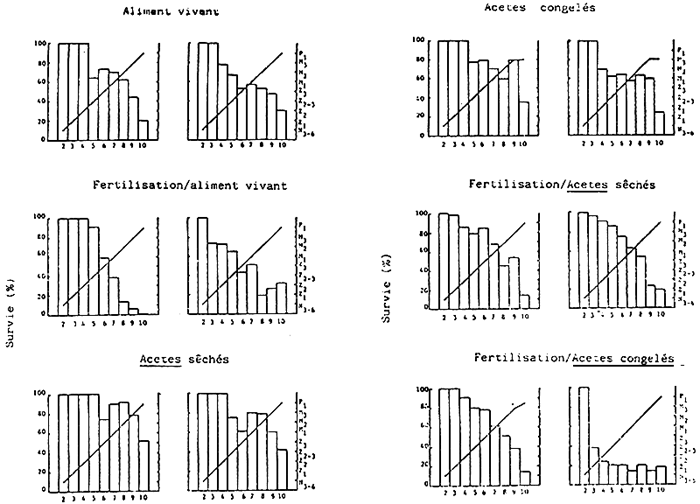
Fig.3. Croissance et taux de survie des larves de P. monodon, élevées en bassins extérieurs, à partir de 6 régimes différents - Expérience A.
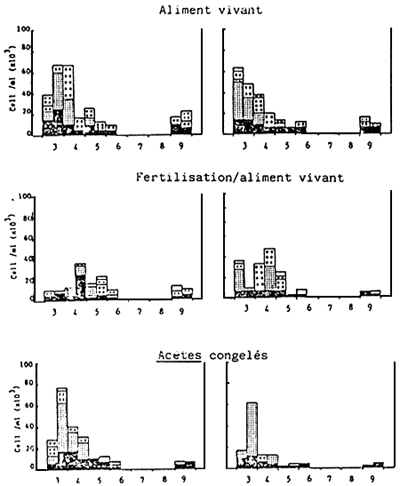 | 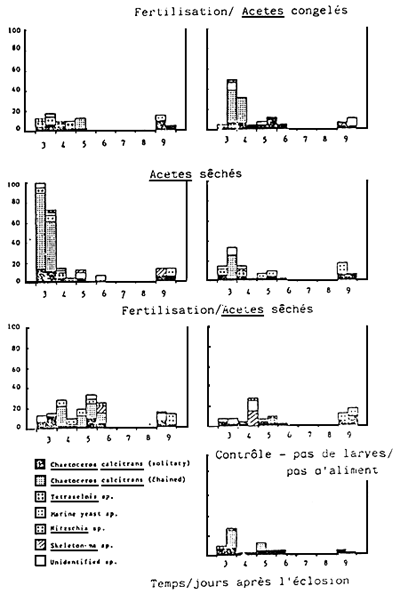 | |
| Fig. 4. | Histogramme représentant la communauté phytoplanctonique se trouvant dans les bassins d'élevage durant l'expérience A. Chaque partie est divisée en 2 comptages, matin et après-midi). | |
Note: Les espaces blancs indiquent qu'aucun échantillon n'a été prélevé ce jour-la.
Un histogramme représentant la communauté phytoplanctonique à l'intérieur des bacs d'élevage larvaire est présenté dans la Fig. 4. Blen qui'll n'ait pas été possible de contrôller le phytoplancton pendant les 10 jours d'élevage, tours les traitements ont montré une population phytoplanctonique plus importante que celle existant dams le bac de contrôle ne contenant aucune larve et ne recevant aucune alimentation. Les niveaux phytoplanctoniques le plus élevés ont été généralement observés avant le commencement du programme du renouvellement d'eau (Tableau 2), c'est-à-dire, soit le troisième jour soit le matin du quatrième jour après l'éclosion. L'espèce prédominante dans tous les traitements était celle de la forme solitaire ou enchaînée de la diatomée Chaetoceros calcitrans. chose étonnante, aucun effet bénéfique des fertilisants inorganiques n'était évident dans les traitements recevant des Acetes.
4.3.2 Expérience B
Le comptage, la croissance et le taux de survie des larves de P. monodon au cours des 11 jours du cycle de culture sent indiques dans le Tableau 6 et dans la Fig. 5. Contrairement á I'expérience A, tous les traitements ont donné un taux de survie très bas au cours de cet essai. Bien qu'il soit possible que ces divergences proviennent des variations dans la qualité des oeufs des reproducteurs, I'essai a été réalisé dans des bacs situés à l'intérieur et avec une densité initiale de larves double par rapport à l'expérience A (147–192 larves/1 par rapport á 62–100 larvae/1). Le taux moyen de survie le plus élevé (calculé après 10 jours de culture) a été enregistré pour L'alimentation à base d'Acetes congelé (12,7%), suivie de celle à base d'aliments vivants (9.5%) et de celle à base d'Acetes sec (8,2 %). Cependent, l'écart entre ces taux de survie n'étail pas significativement différent (p<0, 05). Il a été dans les régimes alimentaires á base d'Acetes que la mortalité larvaire s'est stabilisée une fois arrivées au stade zoé 3. Il est intéressant de noter que le régime á base d'Acetes utilisé a été changé durant le stade zoé 3. On est passé d'un taux d'alimentation quotidien basé sur le nombre réel de larves présentes dans le bac, à un taux d'alimentation quotidien basé sur le nombre de larves stockées le premier jour (de façon à maintenir un nombre minimal de particules alimentaires/unité de vólume d'eau).
Il a été observé que le développement larvaire a subi un retard d'au moins un jour dans tous les traitements où l'Acetes était utilisé comme aliment; la métamorphose entre le stade zoé et mysis nécessitait une journée supplémentaire (Fig. 5). Par ailleurs, toutes les larves nourries é á partir d'Acetes (congélé ou sec) étaient sensiblement plus petites que les larves correspondantes mourries à partir d'aliments vivants.
Un histogramme représentant la communauté phytoplanctonique dans les bacs d'élevage larvaire est présenté dans la Fig. 6. Contrairement à l'expérience A, la quantité de phytoplancton à l'intérieur des bacs recevant des aliments vivants était beaucoup plus importante (en cellules/ml) que les niveaux observés dans les traitements á base d'Acetes, et ce á base d'aliments vivants. Bien que les bacs larvaires n'aient pas été exposés á la lumière directe du jours, les niveaux phytoplanctoniques présents étaient du même ordre que ceux observés dans le cas des bacs recevant de l'Acetes sec ou congélé au cours de l'expérience A (Fig. 4). L'espèce prédominante dans tous les traitements était la diatomée solitaire C. calcitrans et non pas celle sous forme de chaîne. Deux nouvelles espèces étaient également présentes: la diatomée Navicula sp. et une algue bleue-verte non identifiée (quoiquo absente dans les traitements recevant del'Acetes congélé, Fig. 6).
Tableau 6
Comptage et développement des larves de P. monodon, élevées en bassins intérieurs à partir de 3 régimes alimentaires différents-Expérience B (1)
| Jours sprès éclosion | Volume d'eau total (1) | Escal I | Escal II | Escal III | |||||||
| Compte total larvee | Stada larvaire | Densite Larvaire (№:/1) | Compts total larvea | Stade larvaire | Densite larvaire (№:/1) | Compte total larves | Stades larvaire | Denalite larvaire (№:°/1) | |||
| Aliment vivant (B1) | 1 | 200 | 29500 | N1 – 3 | 147 | 38500 | N1 – 3 | 192 | 32000 | N1 – 3 | 160 |
| 2 | 200 | 30000 | N3 – 6 | 150 | 30000 | N3 – 6 | 150 | 31500 | N3 – 5 | 157 | |
| 3 | 200 | 25000 | Z1 | 125 | 21000 | Z1 | 105 | 15500 | Z1 | 77 | |
| 4 | 200 | 19000 | Z2 | 95 | 20000 | Z2 | 100 | 11000 | Z2 | 55 | |
| 5 | 200 | 10000 | Z2 – 3 | 50 | 17000 | Z2 – 3 | 85 | 13000 | Z2 – 3 | 65 | |
| 6 | 200 | 9700 | Z3 | 48 | 11200 | Z3 | 56 | 10700 | Z3 | 53 | |
| 7 | 200 | 2600 | M1 | 13 | 9600 | M1 | 48 | 9400 | M1 | 47 | |
| 8 | 200 | 3600 | M2 | 18 | 9600 | M2 | 48 | 9200 | M2 | 46 | |
| 9 | 200 | 2800 | M3 | 14 | 6300 | M3 | 31 | 4400 | M3 | 22 | |
| 10 | 200 | 2500 | P1 | 12 | 4200 | P1 | 21 | 3000 | P1 | 15 | |
| 11 | 200 | Transférées dans des bassins extérieurs (0730) | Transférées dans des bassins extérieurs (0730) | Transférées dans des bassins extérieurs (0730) | |||||||
| Taux de survie (%) | 8,3 | 10,9 | 9,4 | ||||||||
| Taux de survie moyen (%) | 9,5 | ||||||||||
| Acètes congelés (B II) | 1 | 200 | 35500 | N1 – 3 | 177 | 38000 | N1 – 3 | 190 | 33000 | N1 – 3 | 165 |
| 2 | 200 | 32000 | N3 – 6 | 160 | 34200 | N3 – 6 | 171 | 32000 | N3 – 6 | 160 | |
| 3 | 200 | 23000 | Z1 | 115 | 18000 | Z1 | 90 | 22500 | Z1 | 112 | |
| 4 | 200 | 7000 | Z2 | 35 | 9500 | Z2 | 47 | 13500 | Z2 | 67 | |
| 5 | 200 | 6000 | Z2 – 3 | 30 | 4500 | Z2 – 3 | 22 | 10000 | Z2 – 3 | 50 | |
| 6 | 200 | 3400 | Z3 | 17 | 4700 | Z3 | 23 | 7400 | Z3 | 37 | |
| 7 | 200 | 3600 | Z3-M1 | 18 | 2800 | Z3 | 14 | 6200 | Z3 | 31 | |
| 8 | 200 | 3200 | M1 | 16 | 3600 | M1 | 18 | 6100 | M1 | 30 | |
| 9 | 200 | 3600 | M2 | 18 | 2600 | M2 | 13 | 4200 | M2 | 21 | |
| 10 | 200 | 3000 | M3 | 15 | 2800 | M3 | 14 | 7400 | M3 | 37 | |
| 11 | 200 | Pas de données disponibles | Pas de données disponsibles | Pas de données disponibles | |||||||
| Taux de survie (%) | 8,4 | 7,4 | 22,4 | ||||||||
| Taux de survie moyon (%) | 12,7 | ||||||||||
| Acètes secs (B III) | 1 | 200 | 35500 | N1 – 3 | 177 | 28500 | N1 – 3 | 142 | 36000 | N1 – 3 | 180 |
| 2 | 200 | 30300 | N3 – 6 | 151 | 29500 | N3 – 6 | 147 | 32000 | N3 – 6 | 160 | |
| 3 | 200 | 23500 | Z1 | 117 | 23000 | Z1 | 115 | 20000 | Z1 | 100 | |
| 4 | 200 | 18500 | Z2 | 92 | 10500 | Z2 | 52 | 12000 | Z2 | 60 | |
| 5 | 200 | 5000 | Z2 – 3 | 25 | 3000 | Z2 – 3 | 15 | 7500 | Z2 – 3 | 37 | |
| 6 | 200 | 3400 | Z3 | 17 | 1200 | Z3 | 6 | 5800 | Z3 | 29 | |
| 7 | 200 | 4200 | Z3 | 21 | 1200 | Z3-M1 | 6 | 6200 | Z3 | 31 | |
| 8 | 200 | 2800 | M1 | 14 | 1100 | M1 | 5 | 5800 | M1 | 34 | |
| 9 | 200 | 3000 | M2 | 15 | 1600 | M2 | 8 | 5400 | M2 | 27 | |
| 10 | 200 | 2700 | M3 | 13 | 1200 | M3 | 6 | 4600 | M3 | 23 | |
| 11 | 200 | Pas de données disponibles | Pas de données disponibles | Pas de données disponibles | |||||||
| Taux de survie (%) | 7,6 | 4,1 | 12,8 | ||||||||
| Taux de survie moyen(%) | 9,2 | ||||||||||
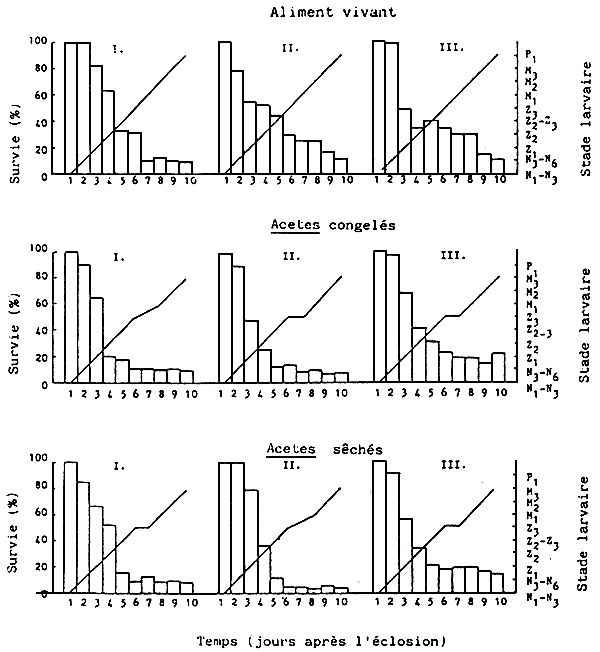
Fig. 5. Croissance et taux de survie des larve de P. monodon, élevées en bassins extérieurs, à partir de 3 repas différents. Expérience B.
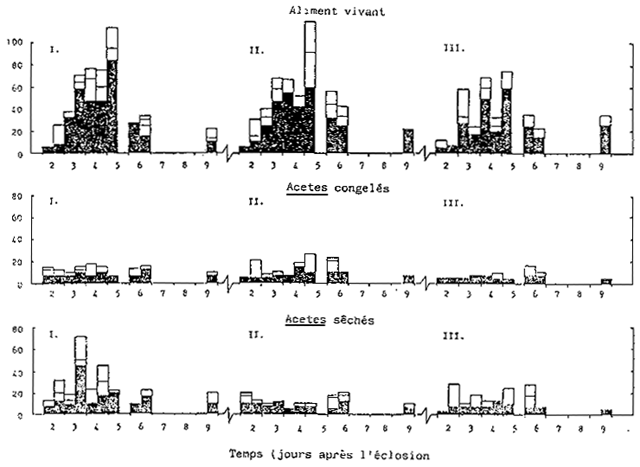
Fig. 6 - Histogramme représentant la communauté phytoplanctonique dans les bassins d'élevage larvaire, durant l'expérience B (Chaque jour étant divisé en matin et après-midi).
Note - Les espaces vides indiquent qu'aucan échantillon n'a été prélevé ce jour-la.
Tableau 7
Comptage et développement des larves de P. monodon élevées en bassins extérieurs à partir de 4 régimes alimentaires différents - Expériences C (1)
| Jours Après éclosion | Volume d'eau total (1) | Essal I | Essal II | Essal III | |||||||
| Compte total larves | Stade larvaire | Densité larvaire (№:/1) | Compte total larves | Stade larvaire | Densité larvaire (№:/1) | Compte total larves | Stade larvaire | Densité larvaire (№:/1) | |||
| Aliment vivant (C-1) | 2 | 700 | 50400 | N3 – 6 | 72 | 58800 | N3 – 6 | 84 | 58000 | N3 – 6 | 84 |
| 3 | 850 | 38675 | Z1 | 45 | 55675 | Z1 | 65 | 55675 | Z1 | 65 | |
| 4 | 850 | 27500 | Z2 | 32 | 49300 | Z2 | 58 | 51000 | Z2 | 60 | |
| 5 | 850 | 13600 | Z2 – 3 | 16 | 22525 | Z2 – 3 | 26 | 5525 | Z2 – 3 | 6 | |
| 6 | 850 | ||||||||||
| 7 | 850 | 2550 | M2 | 3 | 1700 | M2 | 2 | 5100 | M2 | 6 | |
| 8 | 850 | 2700 | M3 | 3 | 1700 | M3 | 2 | 1700 | M3 | 2 | |
| 9 | 850 | 2500 | 3 | 5600 | 7 | 5200 | 6 | ||||
| Taux de survie (x) | 5,0 | 9,5 | 8,8 | ||||||||
| Taux de survie moyen (x) | 7,8 | ||||||||||
| Acètes congelés (C-II) | 2 | 700 | 56700 | N3 – 6 | 81 | 50400 | N3 – 6 | 72 | 51100 | N3 – 6 | 73 |
| 3 | 850 | 61200 | Z1 | 72 | 34600 | Z1 | 76 | 67150 | Z1 | 79 | |
| 4 | 850 | 44200 | Z2 | 52 | 56100 | Z2 | 66 | 55000 | Z2 | 65 | |
| 5 | 850 | 14475 | Z2 – 3 | 17 | 10200 | Z2 – 3 | 12 | 6800 | Z2 – 3 | 8 | |
| 6 | 850 | ||||||||||
| 7 | 850 | 11050 | M1 | 13 | 8500 | M1 | 10 | 6800 | M1 | 8 | |
| 8 | 850 | 10000 | M2 | 12 | 4675 | M2 | 5 | 6375 | M2 | 7 | |
| 9 | 850 | 5000 | 6 | 5000 | 6 | 10000 | 12 | ||||
| Taux de survie (%) | 8,2 | 7,7 | 14,9 | ||||||||
| Taux de survie moyen (%) | 10,3 | ||||||||||
| Acètes secs (C-III) | 2 | 700 | 50400 | N3 – 6 | 72 | 63000 | N3 – 6 | 90 | 51800 | N3 – 6 | 74 |
| 3 | 850 | 55675 | Z1 | 65 | 55675 | Z1 | 65 | 45900 | Z1 | 54 | |
| 4 | 850 | 42200 | Z2 | 50 | 49300 | Z2 | 58 | 44200 | Z2 | 52 | |
| 5 | 850 | 33575 | Z2 – 3 | 39 | 22950 | Z2 – 3 | 27 | 29750 | Z2 – 3 | 35 | |
| 6 | 850 | ||||||||||
| 7 | 850 | 17000 | M1 | 20 | 47600 | M1 | 56 | 35700 | M1 | 42 | |
| 8 | 850 | 35275 | M2 | 41 | 45050 | M2 | 53 | 32725 | M2 | 38 | |
| 9 | 850 | 10000 | 12 | 35000 | 41 | 25000 | 29 | ||||
| Taux de survie (%) | 18,0 | 55,6 | 48,3 | ||||||||
| Taux de survie moyen (%) | 40,6 | ||||||||||
| Contrôle - Pas d'aliment (C-IV) | 2 | 700 | 51000 | N3 – 6 | 74 | 61600 | N3 – 6 | 88 | 54800 | N3 – 6 | 78 |
| 3 | 850 | 38250 | Z1 | 45 | 43775 | Z1 | 51 | 32300 | Z1 | 38 | |
| 4 | 850 | 38200 | Z2 | 45 | 19500 | Z2 | 23 | 17850 | Z2 | 21 | |
| 5 | 850 | 36550 | Z2 – 6 | 43 | 23375 | Z 2– 3 | 27 | 41225 | Z2 –3 | 48 | |
| 6 | 850 | ||||||||||
| 7 | 850 | 2550 | M1 | 3 | 32300 | M1 | 38 | ||||
| 8 | 850 | 3400 | M2 | 4 | 9350 | M2 | 11 | ||||
| 9 | 850 | Abandonné | Abandonné | Abandonné | |||||||
| Taux de survie (%) | |||||||||||
| Taux de survie moyen (%) | |||||||||||
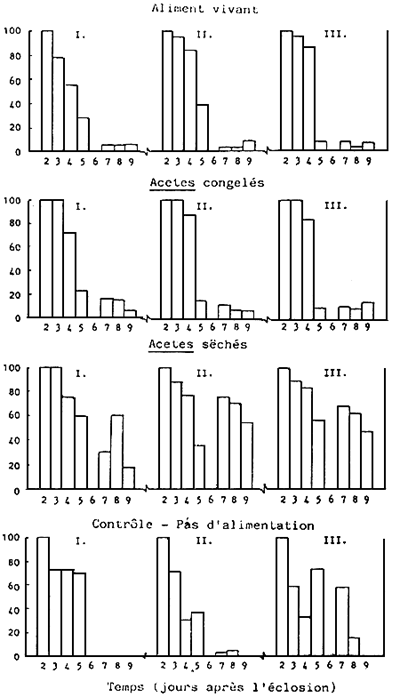
Fig. 7 Taux de survie des larves de P.monodon élevées en bassins extérieurs, à partir de 4 régimes différents. Expérience C.
4.3.3. Expérience C
Le comptage, la croissance et le taux survie larvaire au cours du cycle de 9 jours sont présenté dans Tableau et la Fig. 7. Comme il a été observé au cours de l'expérience A, le taux de survie moyen le plus élevé a été enregistré pour l'alimentation à base d'Acetes sec (40,6%), suivie de celle à base d'Acetes congélé (10,3%), et de celle à base d'aliments vivants (7,8%). Il n'existe pas de données relatives à la survie pour l'essai de contrôle - il n'y eu aucun traitement alimentaire, étant donné que tous les bacs ont été vidés le neuvième jour; le taux de survie pour les deux essais était respectivement de 5,5% et 17,1% au huitième jour, et ce au stade du mysis 2 (Tableau 7). Toutefois, toutes les larves n'ayant pas recu d'aliment étaient visiblement petites et faibles au cours du stade mysis. Malgré le taux de survie élevé chez les larves nourries á base d'Acetes sec, le développement larvaite a accusé (dans deux essais sur trois) un jour de retard par rapport aux larves nourries à base d'aliments vivants qui sont arrivées au stade mysis 2 sept jours seulement après l'éclosion (Tableau 7). Malheureusement, aucun commentaire n'est possible vu l'absence de données sur le phytoplancton,
4.4 Discussion
Bien que les études de Hameed Ali et ses collègues en Inde aient été limités au développement d'un broyat de crustacés en suspension sous forme congelé pour l'alimentation des larves, le présent travail de recherche pourrait suggérer qu'un broyat de crustacés ‘sec’ aurait même plus de potentiel en tant qu'aliment destiné aux larves de crevette. Par exemple, dans les deux essais d'alimentation conduits à l'extérieur (expériences A et B) le taux moyen de survie larvaire le plus élevé a été enregistré dans le cas de l'alimentation á base d'Acetes Sec - 46,7% et 40,6% (calculé respectivement à 9 jours de l'éclosion), suivi de celle d'Acetescongelè - 29,4% et 12,7%, et de celle è base d'aliments vivants - 24,7% et 9,5%. Toutefois, les résultats des trois systèmes d'aliments étaient faibles pour les bacs d'élevage situés à l'intérieur (expérience B); le taux moyen de survie le plus élevé a été enregistré pour l'alimentation á base d'Acetes congelé - 12,7 % (calculé 10 jours après l'éclosion), suivie de celle é base d'aliments vivants - 9,5%, et de celle è base d'Acetes sec - 8,2 %. Le faible taux de survie larvaire observé dans le système d'alimentation à base d'aliments vivants était particuliérement étonnant. étant donné que des taux de survie de 30 % à 40% de N à Pl sont normalement réalisés à Leganes au moyen de ce système d'alimentation (Kungvankij et al, 1984).
Malgré le taux élevé de survie larvaire enregistré, dans les bacs d'élevage situés à l'extérieur, au moyen du régime alimentaire à base d'Acetessec, tons les traitements à base d'Acetes ont été accompagnés d'un développement et d'une crosissance larvaires réduits par rapport au régime alimentaire à base d'aliments vivants; en effet, le développement larvaire a été retardé d'au moins un jour, á l'exception des larves nourries à partir d'Acetes sec dans le cadre de l'expérience A. Par ailleurs bien gue des “blooms” et des “chutes brutales” de phytoplancton n'aient pas été observés au moment du renouvellement d'eau dans les bacs de culture recevant de l'Acetes l'eau de culture bacs recevant l'Acetes congelé était visiblement couverte d'écume et odorante au moment de la dernière alimentation du soir (24h00, on bien 16h00 après le renouvellement en eau). Cepedent, mis è part le développement d'une vibriose aigue dans l'un des bacs recevant un régime á base de fertilisants/aliments vivants au cours de l'expérience A, aucune autre manifestation bactérienne n'a été observée. Cela était étonnant, étant donné qu'on aurait pu s'attendre au développement raide de flores bactériennes et fongiques contaminantes, surtout dans les bacs recevant l'Acetes congelé.
Les résultats du régime à base d'Acetes congelé du pré travail de recherche ont été du point de vue de la survie larvaire aussi bennes que ceux du régime à base d'aliments vivants. La survie s'est Larvaire s'est située bien à l'intérieur des limites enregistrées par Alikunhi et al. (1980) pour le P. monodon en utilisant une suspension humide - un taux moyen de survie de 25,3% de N6 à Pl aprè sept cultures.
5. AVANTAGES ET INCONVENIENTS D'UN REGIME ALIMENTATION A BASE DE BROYAT DE CREVETTES EN SUSPENSION
5.1 Avantages
Par rapport aux pratiques alimentaires traditionnelles à base d'aliments vivants, le développement d'un système adéquat d'alimentation à base d'une suspension offrirait de nombreux avantages aux éleveurs de crevettes:
Il nécessite l'emploi d'un seul aliments non-vivant pendant toute la durée du cycle de l'écloserie, de N à Pl.
Il s'agit d'un système alimentaire simple qui est facilement adoptable par le personnel de l'écloserie et qui n'exige qu'un minimum de formation, réduisant ainsi le niveau de capacités techiques requises pour l'exploitation d'une écloserie (du point de vue de la production d'aliments vivants).
Il se passe totalement de l'emploi d'installations sophistiquées destinées à l'élevage en monoculture d'algues/diatomées ainsi que de l'emploi d'autres organismes vivants tels que Brachionus spp. et les nauplii d'Artemia. A présent, les cultures d'organismes vivants constituent la majeure partie duc travail dans une écloserie.
En éliminant la nécessite de recourir aux systèmes de production d'aliments vivants, la conception de l'écloserie serait plus simple et les investissements nécessaires pour créer une écloserie de crevette seraient considérablement réduits, facilitant ainsi le développement d'écloseries à 'petite éhelle' par l'exploitant familial de ressources limitées. Par exemple, Kungvankij et al., (1984) estiment, que pour une écloserie de crevettes à petite échelle, du genre domestique, en Asie du sud-est, en utilisant un système d'alimentation à base d'aliments vivants de type classique, les investissement et les pontes d'exploitation ne s'éleveraient pas respectivement à plus de USS 30 000 et USS 10 000 (avec une capacité de production de l à 5 millions de post-larves par an ). Actuellement II est recommadé qu'au moins 20 % de la capacité globale des bacs d'élevage larvaire, dans les écloseries de crevettes de petite capacité (système Satul), soient réservés à la production d'algues (Kungvankij, 1982).
Il utilise un aliment disponible localement et à un prix inférieur à celui des aliments classique 'importés', tels que les cystes d'Acetes. Dans un grand nombre de pays en vole de développement l'importation de cystes d'Artemia nécessite des opérations de Dédouanement, le paiement de taxes et la disponibilité de devises. Par contre, la quantité totale de crevettes sergestide (Acetes) provenant de la pêche aux Philippines était de 26 217 tonnes en 1983 (FAO, 1984). Bien que la pêche soit saisonnière (selon la localité), les quantité nécessaires peuvent être achetées Pré-séchées et stockées pour être utilisés en fonction des besoins. Les prix de vente de l'Acetes et d'une gamme d'autres produits alimentaires utilisés couramment à Leganes sont indiqués dans le Tableau 8, Quoiqu'il n'ait pas été possible de calculer le coût par PL des aliments vivants produits à Leganes, le Centre océanologique de Bretagne (France) a estimé le coût de production d'un kilogramme de produit sec de nauplii d'Artemia et de Branchionus spp. à USS 220 et à USS 2 000 respectivement (Girin, 1979). Le coût des Acetes secs pour la production d'un million de larves P1 est estimé à P.Ps. 140, soit P.Ps. 0,00014/P1. Ce calcul est base sur un taux de survie larvaire de 40 % de N à PL, avec l'emploi de 0,10 mg d'Acetessec/larve de N3–6 et z1, avec par la suite une augmentation de 20 %/jour du taux d'alimentation jusqu'à P1 (équivalent à l'emploi de 3,5 kg d'Acetes sec pour une densité initiale de 2,5 millions de larves NI). Toutefois, ces coûts ne comprennent pas les frais de broyage et d'exploitation, (ex. main d'oeuvre). D'après Hameed Ali, Dwivedi et Alikunhi (1982) les frais d'exploitation pour la production de PL en utilisant un système d'alimentation à base de crustacés humides sont inférieurs à la moitié de ceux occasionnés par les systèmes classiques de production d'aliments vivants.
Le système d'alimentation comprend l'utilisation d'un aliment, dont le profil nutritionnel est proche des besoins nutritionnels de la larve de crevette elle-même. Théoriquement, le meilleur aliment de base gu'on puisse donner è une larve de crevette est, an effet, une autre larve de crevette.
Tableau 8
Coût des Acetes et d'autres aliments couramment utilisés (1)
| Type d'aliment | Prix du marché (P.Ps/kg(2)) |
| Aliment Frais | |
| Acetes (“Alamang”) | 10 |
| moule (Perna spp) | 20 (sans coquille) |
| Calmars | 25 |
| Déchets de poisson (Tilapia spp) | 2 |
| Déchets de poissons (sardines) | 15–17 |
| Oeufs de poulel | 1,75 pièce |
| Aliment sec | |
| Acetes | 40(3) |
| Cystes d'Artemia | 850 (4) – 2 000 (5) importé |
(1) Source - Ms K.G. CORRE (Mars 1985)
(2) Coût en mars 1985 P.Ps. 18 = US $ 1.00
(3) Tous les prix de l'Acetes ne comprennent pas le broyage
(4) Souche de San Francisco Bay
(5) Souche de Saunders (Great salt Lake)
5.2 Inconvénients
Il existe un risque de transmission de maladies aux larves en cours de développement lorsque les broyats sont prépares à partir d'organismes alimentaires similaires (ex.: “Thelli”, M. dobsoni). Il est essentiel, donc, d'être très prudent dans la préparation et le traitement (ébullition/séchage) des organismes destinés à l'alimentation.
La méthode indienne de stockage du broyat de crustacés après sa préparation est mise en question. Actuellement des particules d'aliments de taille appropriée sont dilués à 300 % (en poids) avec de l'eau et sont stockées, avant d'être distribuées, dans un réfrigérateur pendant des périodes allant jusqu' à 24 heures. Les études effectuées par Grabner et al. (1981) sur la question de savoir si le zooplacton (Artemia salina et moina, spp.) congelé ou lyophillsé convient comme aliment pour les larves de poisson ont démontré que la congélation cause des dommages importants aux cellules, ce qui occasionne lors de la décongélation un lessivage considérable de substances nutritives solubles dans l'eau. Par exemple, ces chercheurs ont indiqué qu'au bout de 10 minutes à 9∅C environ 70–75 pourcent de l'action des protéases et du l. lactate déshydrogénase, et un pourcentage même plus important des acides aminés libres, ont disparu de l'aliments et peuvent être récupérés sous forme soluble dans l'eau. Non seulement ces substances nutritive agiraient comme fertilisants pour la croissance d'algues/diatomées, mais leur perte, du broyat de crustacés en suspension, mènerait, avec le temps, à la baisse progressive de la valeur nutritive de cette suspension alimentaire pour les larves en cours de croissance. II serait plus avantageux de congéler directement les particules alimentaires de taille appropriée et d'introduire la matière congelée dans une suspension alimentaire lors de chaque repas. Ceci aurait pour effet d'améliorer la valeur nutritive de la suspension ainsi que d'éviter d'en préparer chaque jour. Alternativement, l'aliment pourrait tout simplement être séché et donné tel que.
Le système produisant un aliment sous forme de suspension humide dépend des installations de congélation/réfrigération qui nécessitent une alimentation électrique fiable avec sécurité adéquate.
L'éventuel effet nuisible sur la qualité de l'eau surtout au cas ou on laisse accumuler dans le bac de culture des aliments non consommés. Bien qu'il soit possible d'éviter ces problèmes en exerçant un contrôle stricte sur la gestion de l'eau, il serait éventuellement nécessaire de mettre des antibiotiques dans l'eau d'élevage pour arrêter le développement des bactéries et des champignons contaminants (Lewis et al., 182; Simon, 1981)
La main d'oeuvre et le matériel nécessaires pour le tamisage d'aliments “humides” ou le broyage d'aliments “secs”.
Vu l'éventuel effet nuisible du broyat de crustacés en suspension sur la qualité de l'eau, il est possible que le système d'alimentation à base d'une suspension convienne uniquement aux petits bacs d'élevage ou de gestion aisé d'une capacité de 1 à 2 m3 dans lesquels il est possibles de contrôler strictement la qualité de l'eau.
6. CONCLUSIONS
Malgré les résultats encourageants obtenus par l'utilisation d'un système d'alimentation à base d'une suspension humide, aussi bien par Hameed Ali et ses collègues en Inde qu'au cours des présents essais NACA/SEAFDEC, il serait peut-être plus avantageux à court terme d'axer la recherche sur le perfectionnement d'un système d'alimentation larvaire basé sur l'emploi d'un broyat de crustacé sec. Les résultats obtenus au cours de la présente étude indiquent clairement que les particules d'aliments secs sont consommées par les larves et qu'elles possèdent une qualité nutritive capable de maintenir la croissance et la survie de ces dernières, Toutefois, actuellement, on ne connaît pas le rôle que joue le phytoplacton naturel dans la nutrition des larves en cours de développement et dans le succès apparent du système d'alimentation à base d'un broyat de crevettes en suspension. Il est évident que des essais alimentaires à long terme doivent être effectués pendant une saison d'élevage entière et dans différentes conditions de climat et climat et d'écloserie avant de pouvoir évaluer comme il faut le véritable potentiel d'une suspension à base de crustacés. Une liste des suggestions relatives à des thèmes de recherche est présentée dans l'annexe 1.
ANNEXE
SUGGESTIONS POUR LA RECHERCHE FUTURE
Les essais indiqués Cl-dessous doi vent, dans le cas optimal, être effectués dans des bacs d'élevage de 1–2 m3 identiques en utilisant des concentration initiales de nauplii de 100–150/litre. Les nauplii devraient être obtenus à partir d'une même femelle et les essais devraient être effectués sur plus d'une espèce. Par exemple selon le site: P. monodon, P. indicus, P. merquiensis, P. semisuclatus, P. japonicus, P. aztecus, P. duorarum, P. setiferus, et P. vannamei.
A. PROPOSITION POOUR LA RECHERCHE SUR LE SYSTEMS EXISTANT D'ALIMENTATION A BASE D'ACETES SEC
1. Enquête sur l'Acetes en tant qu'aliment
pêche actuelle - volume, emploi actuel de l'Acetes, prévisions relatives à la pêche.
Disponibilité sur le marché - situtation géographique et saisons; coût suivant la forme disponible (frais/sec).
2. Qualité de l'Acetes en tant qu'aliment
Valeur nutritive
composition approximative - humidité, protéines, lipides, minéraux, fibre brutes
acides aminés, acides gras, minéraux et éventuellement teneur en vitamines
facteurs anti-nutritionnels/contaminants - résidus de pesticides, métaux lourds, activité des thiaminases.
caractéristiques relatives à la dégradation/durèe de conservation - oxydation des lipides, dégradation microbienne
Variation saisonnières de la valeur nutritive
Stabilité dans l'eau - taux de perte en nutrients en fonction de la taille des particules de l'aliment et de la période passée dans l'eau
3. Rôle du phytoplancton naturel dans la nutrition des larves alimentées á base d'Acetes
Reprenant les procédures normales d'écloserie, les observations suivantes devraient être faites en fonction de la croissance et de la survie larvaire:
composition des espèces de phytoplancton et leur densité dans le bac de culture pour des larves recevant une alimentation normale en broyat de crustacés
Composition des espèces de phytoplancton et leur densité dans le bac de culture ne contenant pas de larves mais recevant une alimentation normale
Composition des espèces de phyotoplancton et leur densité dans le bac de culture ne contenant pas de larves et ne recevant aucune alimentation
composition des espèces de phytoplancton et leur densité dans le bac de culture contenant des larves crustacéennes mais ne recevant aucune alimentation
Effet de l'éclairage (bacs intérieurs/extérieurs, couverts et non couverts) sur les conditions énumérées cl-dessus
Effet du renouvellement d'eau (% volume du dac/jour) sur les conditions énumérées ci-dessus
Effet de différentes préparations de broyat de crustacés sur les conditions énumérées ci-dessus
Effet de différents niveaux d'alimentation et de différentes tailles de particules sur les conditions énumérées cl-dessus
Lors du contrôle de la croissance et de la survie larvaire les données complémentaires énumérées cl-après doivent être récoltées si possible,:
Incidence de l'alimentation sur la population larvaire (présence des particules alimentaires dans l'estomac ou dans les fécès)
Comportement des particules alimentaires dans l'eau - flottabilité, propriétés de dispersion
Incidence des difformités larvaires
Renseignements relatifs à la qualité de l'eau - oxygène, PH, ammoniaque, phosphates, nitrats, nitrites, salinité
Contamination bactérienne/fongique de l'eau d'élevage
Développement de microflores sur les particules alimentaires dans l'eau
4. Comparaison entre les essais d'alimentation larvaire et les régimes alimentaires pratiqués dans d'autres écloseries
Ces essais alimentaires doivant être comparés sur la base de la croissance ef de la survie larvaire, de la fiabilité et des coûst de production par unité.
B. PROPOSITION POUR LA RECHERCHE EN FAISANT INTERVENIR DES MODIFICATIONS AU SYSTEM D'ALIMENTATION A BASE D'ACETES SEC
1. Régime alimentaire
Pour déterminer la taille optimale des particules alimentaires pour chaque étape do développement larvaire.
| Taille actuelle des particules alimentaires | Gamme de tailles suggérées pour les essais | |
| N3-6-Z2 | 50<125 | 10–200 |
| Z3-M2 | 125<250 | 100–500 |
| M3-P1 | 250<350 | 200–600 |
Pour déterminer le niveau optimal d'alimentation pour chaque étape du développement larvaire.
Le niveau d'alimentation actuel est de 0,10 mg/larve/jour à N3–6 et Zl, avec ensuite une augmentation de 20%/jour jusqu'à P1. Il faudrait tester les niveaux d'alimentation de 0,05; 0,10; 0,15 et 0,20 mg/larve/jour suivis d'augmentations quotidiennes de 10, 15, 20, 25 et 30%. Par exemple, le retard dans le développement larvaire observé chez les larves nourries á base d'Acetes pourrait être do á une sous-alimentation.
Pour déterminer la fréquence optimale de la distribution de l'aliment
La fréquence d'alimentation actuelle est de quatre repas/jour à 08h30, 12h00, 17h00 et 24h00. Vu la perte potentielle de substances nutritives solubles, par l'effet du lessivage, il faudrait tester l'effet d'une gamme de fréquences des repas. Dans le cas d'écloseries à grande échelle, il faudrait tester également l'utilisation de systèmes automatiques d'alimentation.
2. Préparation et formulation des aliments
Technique de séchage
Effet de différentes technique de séchage sur la qualité d'aliment; séchage á l'air (intérieur/extérieur), lyophilisation ou séchage au tambour.
Enrichissement en vitamines/lipides
Il faudrait l'effet produit par l'addition, avant la distribution, d'un supplément de vitamines /lipides aux Acetes secs. L'utilisation d'un tel supplément a pour but de fortifier l'Acetes par des vitamines essentielles et des acides gras polyinsaturés, de rendre les particules plus visibles aux larves (en utilisant le pigment rouge carophylle), et d'augmenter la stabilité des particules alimentairs dans l'eau, ce qui permet de réduire le lessivage des substances nutritives (par émulsionnement avec la lécithine de soya). Un tel régime pourrait être également testé comme substitut aux nauplii d'Artemia au du stade de Prégrossissement. Un test éventuel d'enrichissement en vitamines/lipides pourrait être comme suit:
| Pigment rouge carophylle 1 | 0,5 g |
| Lécithine de soya | 1,5 g |
| Huile de tete de crevettes 2 | 5,0 g |
| Mélange de vitamines 3 | 2,0 g |
1 Suspension à 10% de canthaxanthine dans une base huileuse
Le prémix de vitamines/huile devrait être préparé en dissolvant d'abord le rouge de carophylle et la léthicine de soya dans l'huile de poisson ou de crevette et en ajoutant ensuite le prémix de vitamines. Bien mélanger et homogénéiser avant d'appliquer ce mélange à la base sèche de protéines (c'est-à-dire, Acetes; en utilisant 9 g du prémix vitamines/huile pour chaque 91 g d'Acetes sec broyé). Lorsqu'on utilise l'huile de crevette ou de poisson il faut essayer de se procurer des produits préstabilisés avec 250–500 ppm dantioxydant.
3. Autres préparation á base de crustacés utilisables pour l'alimentation larvaire
Suivant la disponibilité, ces préparations pourraient comprendre: M. affinis, M. dobsoni, P. stylifera, N. tenipes, O. nepa, et Mesopodopsis spp.
BIBLIOGRAPHIE
ALIKUNHI, K.H., et al., 1980
Observation of mass rearing of penaeid and Macrobrachium larvae, at the Regional Shrimp Hatchery, Azhicode, during 1979 and 1980. Bull. Dept. Fish. Kerala, 2(1), 68pp.
ALIKUNHI, K.H., 1982
Report on mass rearing of shrimp larvae at the Regional Shrimp Hatchery, Azhicode, during 1981. Bull. Dept. Fish. Kerala, 3(1), 40 pp.
CRC, 1983
CRC Handbook of Mariculture, volume 1-Crustacean Aquaculture, J.P. McVey (Ed), CRC press Inc., Boca Raton, Florida, 42pp.
FAO, 1984
Yearbook of fishery statistics, 1983. Yearb. Fish. Stat., (56), 393 pp. (trilingue)
GIRIN, M., 1979
Some solutions to the problem of producing juvenile marine finfishes for aquaculture. European Mariculture society, Special Publication № 4, p. 4, p. 199–209.
GRABNER, M., W. WIESER, R. LACKNER, 1981
The suitability of frozen and freeze-dried zooplankton as food for fish larvae: A biochemical test program. Aquaculture, 26, p. 85–94.
HAMEED ALI, k., 1980
A new system for mass rearing of penaeid shrimp larvae. Proceedings of the first National Symposium on Prawn Farming, Bombay, 16–18 August, 1978, p. 254–62
HAMEED ALI, K., AND S.N. DWIVEDI, 1977
Acceleration of prawn growth by cauterisation of eye stalks and using Acetes indicus as supplementary feed. J. Ind. Fish. Assoc. Bombay, 3–4(1–2), p. 136–38.
HAMEED ALI, K., S.N. DWIVEDI AND X.H. ALIKUNHI, 1982
A new hatchery system for commercial rearing of penaeid prawn larvae. Bull. Central Inst. Fish. Education, Bombay, 2–3, 9pp.
JONES, D.A., 1984
Penaeid larval culture using microencapsulated diets. Paper presented at the First International Conference on the Culture of Penaeid Prawns/Shrimps, Iloilo City, Philippines, December 4–7, 1984.
KANAZAWA, A., 1983
Penaeid nutrition. In Proceedings of the second International Conferance on Aquaculture Nutrition: Biochemical and Physiological Approaches to Shellfish Nutrition, edited by G.D. Pruder, C.J. Langdon and D.E. Conklin Baton Rouge, Louisiana State University press, p. 87–105.
KUNGVANKIJ, P., 1982
The design and operation of shrimp hatcheries in Thailand. In Working Party on small-scale shrimp/prawn hatcheris in South East Asia, Semarang, Central Java, Indonesia, 16–21 November 1981. II. Technical Report, SCSFD & C.P., Manila, Philippines, May 1982, P. 117–20
KUNGVANKIJ, P., et al. , 1984
Shrimp hatchery design, operation and management. NACA Training Manual, Series №l, November 1964, sous presse.
LEWIS, D.H., J.K. LEONG AND C. MOCK, 1982
Aggregation of penaeid shrimp larva due to microbial epibionts. Aquaculture, 27, P. 149–55.
LIAO, I., 1984
A brief review on the larval rearing techniques of penaeld prawns. Paper presented at the first International Conference on the Culture of Penaeid Prawns/Shrimps, Iloilo city, Philippines, December 4–7, 1984, sous presse.
NEW, M.B., 1976
A review of dietary studies with shrimp and prawns. Aquaculture, 9, P. 101–44.
SCURA, E.D., J. FISCHER AND M.P. YUNKER, 1984
The use of microencapsulated feeds to replace live food organisms in shrimp hatcheries. Paper presented at the First International Conference on the Culture of Penaeid Prawns/Shrimps, Iloilo City, Philippines, December 4–7, 1984, sous presse.
SIMON, C.M., 1981
Design and operation of a large-scale, commercial penaeid shrimp hatchery. J. World Maricult. Soc., 12(2), P. 322–34.
WATANABE, T., C. KITAJIMA AND S. FUJITA, 1983
Nutritional value of live food organisms used in Japan for mass propagation of fish: A review. Aquaculture, 34, p. 115–43.