Ms. N. DEVAUCHLLE
INTRODUCTION
L'idéc même du développement des écloseries commerciales de poissons marins en Europe est récente (GIRIN, 1980). Mais il est d'ores et déjà admins que, sauf cas très exceptionnel, celui du bar, de la daurade, de la sole et du turbot repose sur la maîtrise des productions d'oeufs. Aussi est-il primordial pour l'aquaculteur, de connaître les réponses aux questions oè, comment, pendant combiens de temps et pour quels résultats doit-on, dès la création d'une écloserie, envisager la construction d'une unité de reproducteurs?
Dès le début du sièle, les pionniers de l'élevage montraient que le turbot (ANTHONY, 1910; BUCKLAND in MALARD, 1899) et la sole (BVTLER, 1895) pouvaient se reproduire en captivité. Mais, il restait encore à démontrer la reproductibilité du phénomène. Pour celà, vers 1960 – 1970, la plupart des travaux visaient à obtenir le plus vite possible des pontes de poissons capturés en mer. On pratiquait alors couramment l'induction hormonale de la maturation suivie de ponte et de fécondations mannuel les (BARNABE, 1976a; BRASOLA, 1974; BLUCHTER, 1972). Parallèlement, l'IFREMER Centre de BREST cherchait avant tout à mieux cerner les possibilités de reproduction des poissons dans des conditions de captivité les plus proches possibles du milieu naturel. Dans un premier temps, toute manipulation était évitée (GIRIN, 1979). Un peu plus tard, pour simplifier la gestion des stocks de reproducteurs et optimiser celle des écloseries, se sont développées des opérations telles que le décalage des productions saisonnières d'oeufs, oeufs, l'utilisation de géniteurs nés en écloserie, la modification des régimes alimentaires et les pontes artificielles.
Aujourd'hui, l'ensemble des résultats permet une comparaison de plusieurs techniques d'obtention d'oeufs.
1. GENERALITES
1.1. La constitution des stocks Tableaux 1 - 2 - 3)
A la création d'une écloserie, la première opération est de prélever en mer les reproducteurs de la plus grande taille possible. C'est ce que nous avons fait pour constituer les premiers stocks. Mais, peu à peu, une gestion à long terme s'est avérée plus efficace. Les principles sont les suivants: acquisition pour chaque espèce de 3 à 5 classes d'âge dans les limites indiquées au tableau l; remplacemént tous les 1 à 2 ans de la classe la plus âgée par des jeunes. Leur nombre est calculé à partir des productivés spécifiques (tableau 6), et tient compte du temps de latence généralement observé entre la capture en mer et la première ponte en captivité, soit 1 an pour le bar, 1 à 2 ans pour la daurade, 2 ans pour la sole et pour le turbot.
Le transport se fait par route, en cuves de 1,5 à 2 m3 pour les bars et les daurades. Les charges n'excèdent pas 100 kg/m3. Pour des trajets de 4 heures maximum, il n'est pas nécessaire d'oxygéner l'eau. A durée égale de transport, les poissons plats sont conditionnées en sacs plastique, sous atmosphère d'oxygène à raison de 1 volume de poisson pour 2 volumes d'eau. Lorsque les trajets durent moins de 2 heures, les turbots sent transportés sans dommages, à sec, en sacs plastique non fermés.
Au retour de pêche, les animaux sont sexés (DEVAUCHELLE, 1984) afin d'ajuster le choix des poissons aux besoins réels de la station. Aussitôt, les mâles sont séparés des femelles jusqu'au marquage. Dès leur arrivé dans les stations de reproduction, ils sont traités au formal vert malachite pour éviter la propagation des parasites au cheptel permanent (tableau 3). Si, de plus, les animaux ont des plaies, ils subissent des traitements antibiotiques. L'abaissement de la salinité jusqu'à 20 % pendant 2 – 3 jours permet ainsi un rétablissement rapide des daurades affaiblies. Néanmoins, par la suite, la vigilance est de règle: en effet, les premiers signes de faiblesse ou de parasitoses impliquent des traitements curatifs rapides. En plus des traitements indiqués au tableau 2, il est désormais conseillé de pratiquer des injections intrapéritonéales de vitamine C chez les turbots malades.
1.2. Les bassins de stabulation
Ils contiennent 5 à 40 m3 d'eau mer. La haute r d'eau varie de 0,7 à 1,7 m. Les matériaux utilisés pour la construction des bassins ne sont pas normalisés. qu'ils soient circulaires, de section subcarrée ou rectangulaire, en polyster, en ciment, en bois traité doublé de bâches en pvc… l'important est, (DEVAUCHELLE, 1980). Dans ce cas, les charges de maintenance sont alourdies. Le sable doit, en effet, être régulièrement purifié par assecs ou traitements chimiques (formol 38 %, 1 000 ppm ) pour enrayer le dévelloppement des parasites à spores résistantes. L'été, les bassins sont couverts de bâches individuelles qui limitent le dévelloppement des algues. L'éclairement moyen de surface est de 1 500–2 000 lux.
L'eau, distribuée aux bassins par tuyauteries en pvc, n'est pas recyciée. L'utilisation d'échangeurs thermiques (*a) impose une filtration (*b), mais en l'absence de régulation, l'eau brute est utilisée.
* a: Echangeurs à plaques de titane
A l'exception de la température, les caractéristiques de l'eau de mer reproduisent les variations naturelles de nos régions (tableau 4). Le taux de saturation en oxygène est cependant susceptible de varier dans des limites inquiétantes (50–130 %) en fonction essentiellement des taux de renouvellements et des changements induits de température de l' eau. ll nécessite des contrôles réguliers. La teneur en gaz dissous azotés peut aussi surprendre et créer d3es perturbations: une filtration d' air niveau des pompes, des turbulences dans les tuyauteries, le chauffage de l'eau sont autant de facteurs qui concourent à l'augmentation brutale des teneurs en gaz dissous. Elle se traduit, selon l'espèce, par l'apparition d'exophtalmies (bar) ou de bulles gazeuses accumulées sous la peau ou à l'extrémité des nageoires (sole, daurade). En général, le bullage intense des bassins évite les mortalités incidents et favorise la résorption rapide (24 heures environ) des bulles de gaz. Le phénomène est plus insidieux en bassins à fond de sable: l'air lift qui assure le drainage y concentre aussi le gaz en poches. En s'enfouissant, les poissons (sole) meurent alors rapidement d'embolie gazeuse.
En temps normal, les caractéristiques de l'au de mer sont contrôlées Les doses sont de 100 mg/kg de poisson, tous les 15 à 30 jours, jusqu'à complet rétablissement (MESSANGER, comm. pers., 1985). D'une manièrale, la fréquence des traitements augmente avec les manipulations et les variations thermiques importants de l'eau de mer.
Dans la semaine qui suit leur transfert, les poissons saints sont marquées (tableau 3 ); les autres le sont, après quelques semaines d'acclimation à la capativité, à l'exception des soles, pour lesquelles les techniques de marquage se sont avérées inopérantes, jusqu'à présent. Le marquage idéal pour les reproducteurs est celui qui permet de repérer, in situ, les poissons individuellment, par sexe et par classe d'âge. Pour le turbot, la technique retenue est l'estampillage au fer refroidi à l'azote liquide. l'opération dure 8 à 12 secondes et doit être renouvelée, selon la vitesse de croissance des individuals, tous les 6 à 12 mois. Pour le bar et la daurade, cette méthode ne satisfait pas. De même toutes les marques étiquettes proposées sur le marché ont été délaissées. Elles sont trop petites et de surcroît induisent plaies et nécroses. Le marquage magnétique, moins traumatisant, demeure onéreux et ne permet pas une reconnaissance des animaux dans le bac. Dans le cas particulier des reproducteurs, il n'a donc pas été reconnu comme efficace. Jusqu à maintenant donc, les bars et les daurades sont identifiés par simple injection d'encre de chine à la base des nageoires pectorales (SUQUET, 1986). L'absence de marquage individuel implique alors, avant toute induction hormonale de la maturation de contrôler l'état d'avancement de la gamétogénèse par cathétérisation (BEDIER, 1979) ou par biopsie (DEVAUCHELLE, 1984).
Les poissons ainsi sexés marqués sont installés pour 4 à 6 ans (bar, daurade et turbot ) ou plus (sole) dans les bassins dont les caractéristiques figurant au tableau 2. Mais il arrive que la place manque. Certains lots dent la saison de ponte n'est pas décalée, sont alors maintenus en cages en dehors de la période de ponte. peu courante, cette pratique vise surtout le turbot d'apparence moins fragile que les trois autres espèces. Dans tous les cas de figure, l'adaptation des poissons à la captivité est facilitée par la présence, dans un nouveau stock, de quelques “vétérans” qui incitent à la prise d'aliments inertes et réduisent du même coup la période de jeûne consécutive à la pêche (15 à 45 jours selon la saison). chaque jour par trois outils classiques: le thermographe, le refractomètre et l'oxymètre.
1.3. Les aliments
Les aliments sont distribués ad libitum 2 à 3 fois par semaine, frais qu congelés (temps de conservation inférieur à 3 mois). Sauf tests particuliers (cf§ 2.5), ils ne sont pas supplémentés en vitamines. Les quantités distribuées varient avec les températures saisonnières et la gamètogénèse. Elles se situent entre 4 et 24 % de moyenne hebdomadaire (poids frais d'aliments/poids frais de reproducteur x 100). La qualité des aliments dépend des pêches locales. Mais, le plis souvent, des poissons gras et maigres sont distribués alternativement aux turbots, bars et daurades. En plus, selon les possibilités d' approvisionnement, moules, clams, ou crabes sont distribués aux bars et aux daurades.
Les soles ont un régime alimentaire différent: mollusques (Callysta chione, Glycimeris glyscimeris, Laevicardium crassum) et Polychètes, (Nereis diversicolor et Nephtys hombergii).
1.4. Les techniques de ponte
En captivité, les quatre espèces peuvent produire, sans intervention humaine, des oeufs naturellement fécondés. Mais, dans certaines circonstances, nous avons eu recours aux techniques de pontes artificielles. Elles consistent pour le bar et la daurade en l' induction hormonale de la ponte. HCG (200–500 U.1./kg 0) et LHRII (1 μ/kg), sont alors utilisées sur les bases indiquées par SUQUET (1986). Ces hormones synchronisent les ovulations des femelles et peuvent être considérées comme une technique de décalage à court terme. Elle n'est efficace qu' en vitellogénèse avanceée: ovocytes de 650 μ ou plus pour le bar méditerranéen (SUQUET, 1986). Quelle que soit la qualité de l'hormone utilisée, les injections sont suivies de pontes et de fécondations naturelles.
La ponte artificielle du turbot consiste en des opérations de “stripping” et de fécondation artificielles à sec ou humide, sans utilisation d'hormones (BARTON, 1981).
La sole répond aussi mal aux inductions hormonales de la ponte qu' aux pressions abdominales. D'autre part, la fécondation artificielle, sans sacrifice du mâle, est difficilement envisageable du fait de la taille des testicules (RGS maximum 0,2 %, DENIL, 1981). Chez cette espèce, la reproduction artificielle n' est donc pas couramment pratiquée.
Les techniques artificielles de ponte sont de règle dans certaines écloseries. Mais n'étant pas normalisées, elles introduisent des biais importants dans l'interprétation des résultants. Pour mieux connaître les possibilités de reproduction en captivité, nous les avons volontairement écartées des principaux objectifs de recherche. La comparaison des pontes naturelles et artificielles reposera donc sur des données référencées extérieurieures à l'FREMER Centre de BREST.
1.5. Collecte et traitement des oeufs
- Mesures systématiques:
Chaque lot d'oeufs (ou ponte) collecté en sortie de bassin ou à l'issue des pontes artificielles fait systématiquement l'objet de mesures, sur aliquots, des diamètres et taux de viabilité. Les taux d'éclosion et les taux de malforamtion du squelette de larves vésiculées sont estimés à l'issue d'incubations standard en volumes de 0,1 litre (DEVAUCHELLE, 1980).
- Mesures particulières:
Par ailleurs, les poids des oeufs ont été sur 13 pontes de sole, 17 pontes de bar et 48 pontes de turbot couvrant une large gamme de diamètres d'oeufs (DEVAUCHELLE, CLADAS, 1983; DEVAUCHELLE, sous presse).
Les conditions optimales de température et de salinité pour l' éclosion, ainsi que les durées d'incubation ont aussi été déterminées en unité expérimentale d' incubation strictement contrôlée (DEVAUCHELLE et al., sous presse). D'autre part, des mesures de composition biochimique de l'oeuf ont été faites entre 1979 (DEVAUCHELLE et al., 1982).
Parallèlement à ces tests fins, des incubations de routine sont effectuées en incubateurs de 25 à 40 litres (DEVAUCHELLE, 1983). L'incubateur, mobile, est mis en mouvement par la rotation d'un moteur électrique à la fréquence de 1 tour/minute.
Quel que soit le volume de l'incubateur, l'embryogénèse déroule en conditions de photopériode naturelle. La température est réglable à volonté entre 7 et 25°C. L'eau filtrée mais ne subit aucun traitement chimique. Les charges n'excèdent pas 7 g. d'oeufs par litre, soit 5 000 à 10 000 oeufs par litre, selon l'espèce. Ces valeurs ont été définies comme limite supérieure optimale, pour la qualité de l'éclosion.
1.6. Principe des installations de reproduction/incubation (Figure 1)
Les installations sont indépendantes de celles de l'élevage des larves pour les raisons suivants: les volumes d'eau et la qualité d'eau nécessaires à ces deux stades sont très différentes. D'autre part, l'incubation en petits volumes permet, si besoin est, d'individualiser l'incubation, de mieux contrôler les mortalités anormales d'oeufs et les développements consécutifs des maladies. De même, les estimations de malformations et des taux d'éclosin sont facilitées, aidant ainsi à une meilleure interprétation des résultats en élevage larvaire.
2. RESULTATS
2.1. Maturation - Pontes et fécondations naturelles sans contrôle de températre ni de photopériode
2.1.1. Les reproducteurs
La mortalité annuelle (tableau 2 ) enregistrée sur les bars et les daurades est faible: 2–5 %. Elle se situe le plus souvent entre 5 et 10 % pour les soles et les turbots. Mais bien que sporadiques, les pertes de turbot peuvent être spectaculaires et anéantir plus de 50 % des stocks. Celà s'est produit 2 fois en 10 ans à des périodes où la température s'éléve brutalement. mortalités n'pas encore été identifiée mais elles s'apparentent á celles provoquées par des maladies bactériennes telles que la vibriose (LIEWES, 1984). Les mâles et les femelles en état de maturité avancée sont les plus touchés. Pour l'instant, un constate simplement que des injections intrapéritonéales de vitamine C à la dose de: 100 mg/kg de poisson réduisent les mortalités.
La croissance des reproducteurs sauvages captifs semble, en général, supérieure à celle observée en mer (Figure 2). La daurade fait cependant exception. A cela, deux explications: les données de référence sur la daurade sauvage concernent le golfe du Lion où les températures moyennes annuelles sont supérieures à celles de la région de Bretagne. D'autre part, la captivité, en contrariant les migrations hivernales, contraint la daurade à subir des températures plus basses qu'en mer.
2.1.2. Les volumes des bassins
Nous n'avons pas noté la différence claire de productions d'oeufs en 10/12 m3 et en 40 m3, pour des charges maximales de 7 kg/m3 de bar, de turbot ou de daurade. D'autre part, les résultats obtenus sur la sole sont comparables en 5 et 17 m3. De plus petits volumes n'ont pas été testes, bien que FONDS (1979) ait obsenvé des fécondations naturelles de soles en bassins de 1 500 litres. Cependant, dans le cas d'expérimentations, et à fortiori de production d'oeufs, les bassins de 5 m3 constituent à nos yeux une limite inférieure à ne pas dépasser: en plus petits bassins les résultats issus d'un très faible nombre de poissons: n'auraient pas une signification statistique.
L'expérience montre enfin que les ensembles de bassins de 10à 15 m3, de faible hauteur d'eau (o,7–1 m) conviennent bien aux écloseries dont le principal objectif est la rentabilité: l'état du cheptel peut ainsi être facilement contrôlés. De plus, l'entretien des bassins, les manipulations et la récupération des oeufs y sont aisés.
2.1.3. Gamétogénèse des femelles et saison de ponte (tableau 5)
L'utilisation récente des biopsies sur poissons marqués a permis de situer le début de la gamétogénèse des différentes espèces: septembre/octobre, soit 3 à 5 mois avant la ponte de bar et de daurade; janvier, soit 4 à 6 mois avant la ponte de turbot. Pour la sole, la période de repos sexuel n'a pu être nettement située. Comme en mer, les gonades de soles contiennent plusieurs générations d'ovocytes, à tout moment de l'année (LAHAYE, 1972). Pour les trois autres espèces, le temps écoulé entre les premières croissances ovocytaires et la première ponte demeure imprécis, car il dépend essentiellement des régimes thermiques saisonniers.
La température agit en effect à la fois sur la vitesse de vitellogénèse et comme seuil minimum-maximum pour l'oviposition. Son effet est tel qu'il peut réduire de 25% environ la durée de la gamétogénèse pour chacune des espèces considérées, totalement supprimer une saison de ponte, en avancer ou en retarder la date: chez le bar, par exemple, les gonades contiennent dès le début du mois de décembre des ovocytes dont le diamètre (800 à 1 000 μm) prédit une ovulation proche, comme en Méditerranée. Or, à cette époque, les températures de l'eau de mer (7 – 8° C) sont infraliminaires de la ponte. Malgrè une ovogénèse avancée il faudra donc attendre que le réchauffement printanier porte la température de l'eau à 9–10° C ou plus pour collecter les premières pontes de bar, ll est évident que ce temps de latence varie d'une année à l'autre. Cependant, les températures-seuil de la gamétogénèse et de la ponte étant désormais connues (tableau 5), on peut, moyennant une thermorégulation, parer aux effets des conditions saisonnierès exceptionnellement défavorables.
A l'inverse, si nécessaire, les variations de température permettent de bloquer les productions d'oeufs à certaines périodes. Pour les poissons fragiles comme les daurades, elles assurent une synchronisation des pontes, sans manipulations ou injections d'hormones. Chez cette espèce, des variations de 2 à 5°C en 24 heures sont bien supportées et désormais pratiquées dans certains centres de production de juvéniles. Mais le plus souvent, en l'absence de contrôles thermiques et photopériodiques, la ponte démarre en bassins un peu plus tard qu'en mer: fin février/début mars pour la sole et bar, fin avril à fin juin pour le turbot. Les daurades pondent en hiver si la température de l'eau dépasse 13° C mais cela ne s'est jamais produit naturellement en région Bretagne, dans les bassins alimentés en eaux de surface non thermo-régulées. Les saisons de ponte se poursuivent jusqu'en mai (sole), juin (bar) ou août (turbot). Par ailleurs, les périodes de repos sexuel, correspondant à la seule présence d'ovogonies dans les gonades, durent, tout au plus, deux mois: en été, pour le bar et la daurade, fin novembre/ décembre, pour le turbot.
On remarque enfin, que les mâles sont spermiants pendant toute la durée de la ponte, ou plus: novembre à août pour le bar, décembre à octobre pour le turbot.
2.1.4. Fécondité et qualité des oeufs (tableau 6)
En conditions non limitantes de température et de photopériode, la fécondité relative (*a) est plus faible de 20 à 50 % les deux premières années de ponte, pour les poissons en début d'activité reproductrice. Les adultes pêchés en mer ne récupèrent un niveau normal de fécondité qu'au second cycle de ponte réalisé en captivité. La fécondité se stabilise ensuite conformément aux données du tableau 6. On remarque alors que nos données sont proches des fécondités estimées sur le bar mûr en mer (tableau 6). les seraient par contre plus faibles de 2 à 3 fois, chez le turbot, la sole et la daurade.
(*a) = nombre d'oeufs récoltés par kg de femelle
Les poissons pondant une à douze fois selon l'espèce. Les oeufs de bar d'une femelle sont lâchés en totalité a quelques jours d'intervalle. La période de ponte est plus longue chez la daurade, la sole et le turbot: une femelle de turbot peut, par exemple, produire des oeufs pendant 7 à 8 semaines, tous les 3–5 jours.
Les taux de viabilité opposent poissons ronds et poissons plats. lls sont très élevés chez le bar et la daurade, car seulement 10 à 20 % des pontes ont un taux de viabilité inférieur à 70%, le plus souvent en début et en fin de saison. Chez la sole, bien que le taux de viabilité des oeufs soit en moyenne inférieur de 10% à celui du bar et la daurade, les résultats sont réguliers d'une année à l'autre.
Avec 33 % de taux de viabilité, le turbot est l'espèce la plus complexe. Ce chiffre résulte de moyennes effectuées sur plusieurs années. Mais l'observation détaillée des résultats montre des variations importantes des taux moyens annuels: O à81 %. Dans le cas des mauvaises saisons, l'absence de fécondation, et non la qualité des ovules, est en cause. L'inadaptation des volumes de bassins (GIRIN, 1979) ne permettent pas plus que la nécessité de fonds de sable (DEVAUBCHELLE, 1980) d'expliquer ce phénomène. En fait, une fois de plus, certains paramètres physiques de l'eau de mer paraîssent perturber les processus de fécondation.
2.1.5. Les oeufs: description et incubation (tableau 7)
L'oeuf fécondé est une sphère pélagique qui, en milieu d'incubation se déforme légèrement en ballon de rugby. Les espèces diffèrent par leur diamètre, leur poids et l'aspect des réserves lipidiques (Photos A, B, C, D). A maturité, l'oeuf de bar contient 1 à 5 gouttelettes lipidiques qui représentent environ 2 à 3 % du volume total. L'oeuf de sole présente une multitude de gouttelettes lipidiques diffuses. Les ocufs de daurades et de turbot ont un seul globule dont le diamètre varie peu: 180 à 210 μ (turbot), 210 à 240 μ (daurade). L'analyse des oeufs de bar, de sole et de turbot (tableau 12) indique leur teneur en eau, lipides, protéines et cendres.
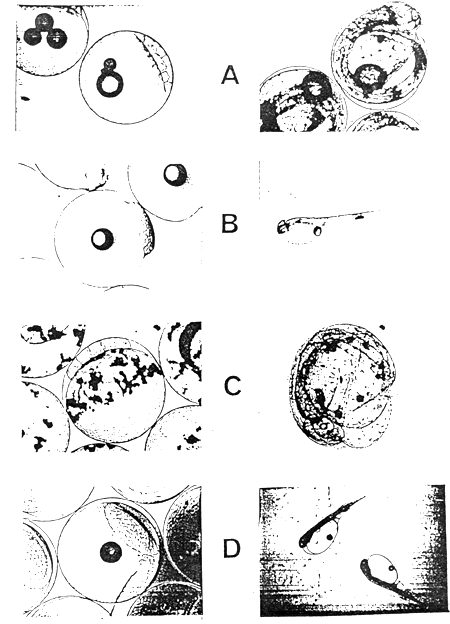
Oeufs et larves juste écloses ou en éclosion.
A: Bar - B : Daurade - C : Sole - D: Turbot.
Après la fécondation, l'oeuf s'hydrate. Le taux d'humidité augmente de 25 % environ. un espace périvitellin apparaît 15 à 60 minutes après l'émission de l'ovule, indépendamment de la fécondation. Les diamètres varient d'un lot à l'autre; de 6% pour le bar et la daurade et de 10% pour la sole et le turbot. Dans ces limites, il n'y a pas de corrélation nette entre le diamètre et les taux de viabilité ou les malformations du squelette (DEVAUCHELLE, 1980). Le poids sec de l'oeuf augmente par contre avec son diamètre (figure 3). La durée d'incubation dépend de la température de l'eau de mer et de l'espèce (figure 4). A titre indicatif, chez le turbot, les quatre grandes phases Moula, Gastrula, Neurula et Pré-éclosion représentent en moyenne 17, 15,52 et 16 % de la durée totale de l'embryogénèse. Les risques de mortalité sont réduits lorsque l'incubation dure de 3 à 6 jours (tableau 8), c'est a dire aux températures proches des optimum définis pour la ponte.
A IFREMER/Centre de BREST, la salinité a fait l'objet de tests expérimentaux précis sur le turbot et la sole. Ce paragraphe concerne donc exclusivement ces deux espèces. ll importe de savoir en premier lieu que la salinité n'affecte pas la durée d'incubation mais détermine, en synergie avec la température les taux d'éclosion et de malformations larvaires. L'effet est accentué aux staudes considérés comme fragiles: (figure 5). Toutefois, dans tous les cas, plus de 70% des oeufs viables éclosent sans déformation, entre 25 et 35 ‰ plus de 50% jusqu'à 15 ‰. La sole supporte mieux que le turbot les basses températures et salinités. Lorsque les oeufs testés sont aux stades Gastrula et Neurula considérés comme plus résistants que le stade Morula, les éclosions sont de qualité équivalente entre 15 et 35‰. Mais, dans tous les cas, 10‰constitue une limite à ne pas franchir pour le turbot, comme pour la sole. Aux conditions extrêmes d'incubation, les caractéristiques individuelles des différents lots d'oeufs s'expriment au niveau des taux de mortalité; en conditions optimales, les différence se situent advantage au niveau des malformations larvaires.
D'une manière générale, l'oeuf est fragile aux stades Morula et Prééclosion. Chez turbot, en particulier, tout stress d'ordre mécanique ou thermique doit être évite pendant le ler et le dernier cinquième de l'incubation. Il convient enfin de rappeler que la larve vésiculée, bien déroulée, résiste mieux que l'oeuf neurulé aux variations de température et aux chocs mécaniques. Ce stade larvaire est, par conséquent, propice aux transports. ll semble, par contre, plus sensible aux traitements chimiques, par le chlore en particulier (DEVAUCHELLE, 1980).
Les tests expérimentaux, menés en incubateurs automatiques de 1 litre (tableau 6), aux températures et salinités optimales, conduisent aux conclusions suivantes: les taux d'éclosion d'oeufs viable de bar et de daurade dépassent de 10% environ ceux du turbot et de sole. Les taux moyens de malformations sont faibles: 5 %. Dans ces conditions, les différences de résultats entre lots d'oeufs d'une espèce reflètent l'histoire antérieure à la mise en incubation: conditions de ponte ou facteur génétique. A traitement équivalent, elles peuvent atteindre 60% pour le taux d'éclosion et 30% pour le taux de malformation des oeufs de sole et de turbot. Chez le bar elles sont respectivement de 20 et 14% en moyenne. Généralement, les écolosions traînantes sont associées a des taux élevés de malformation.
Les plus grands incubateurs (25–40 litres) permettent en moyenne des taux d'éclosion de 60 à 70 % et des taux de malformation de 5 à 15 %. Les différences entre espèces y sont moins sensibles, car les résultats reflètent essentiellement les conditions générales d'incubation, en particulier les chocs mécaniques plus nombreux. D'autres techniques d'incubation sont utilisées pour ces espèces. Mais dans tous les cas, leur efficacité dépend, surtout à qualité d'eau éagle, des densités d'incubation, des niveaux de température, de la salinité et des chocs d'origine mécanique (DEVANCHELLE, 1980).
En l'état des choses, des choses, l'incubation n'est pas un facteur limitant de l'élevage. La sélection des pontes est essentiellement dictée par la gestion des élevages larvaires. On pourrait cependat envisager de trier les lots d'oeufs d'après leur moindre résistance aux chocs d'origine thermique ou saline, en début ou fin d'embryogénèse. L'étalement de l'éclosion représente une autre base de tri. On peut enfin conclure qu'une grande écloserie peut raisonnablement envisager l'utilisation de 50% des oeufs viables récoltés en rationalisant les techniques d'incubation, soit pour 1 kg de femelle; 100 000 larves de bar, 400 000 larves de daurade, 50 000 larves de sole, 25 à 60 000 de turbot.
2.2. Les pontes artificielles (tableau 6)
Dans nos régions, les pontes artificielles ne sont pas encore performantes chez la sole. Elles sont souvent inutiles chez la daurade qui pond chaque jour de grandes quantités d'oeufs. pendant plusieurs mois. On les pratique, par contre, chez le bar, pour synchroniser les pontes de plusieurs femelles et chez le turbot pour palier aux irrégularitiés de fécondation.
Chez le bar et la daurade, les inductions hormonales de la ponte élèvent la mortalité des reproducteurs à 10 % environ. D'autre part, elle paraît diminuer les exigences du bar vis à vis de l'environnement. En effet, le volume des bassins de ponte-fécondation peut être réduit à 4–5 m3 sans incovénient, alors que 10 m3 semble être le volume minimum compatible avec les maturation-ponte-fécondation naturelles (BARNABE, 1976b). Actuellement, les progrès effectués en matière d'induction hormonale de la ponte garantissent des fécondités relatives et des taux de viabilité élevés chez ces deux espèces. Les écarts avec la ponte naturelie s'estompent d'autant plus que la majorité des écloseries pratiquent alternativement les deux techniques, ll faut aussi noter l'engouement actuel pour la LHRH qui contrairement à la gonadotropine humaine évite des réactions antigéniques (BARNABE,1985).
Chez le turbout, le “stripping”, moins sélectif que l'oviposition naturelle, double la fécondité relative. Néanmoins, les taux de viabilité moyens sont très faibles. lls rappellent les premières fécondations artificielles du bar. En fait, chaque femelle de turbot a son propre rythme ovulatoire (Mc EVOY, 1985) et 6 heures après l'ovulation, les succès de fécondation diminuent. Du fait des horaires de travail, l'écloserie néglige le plus souvent ce rythme: la qualité des oeufs s'en ressent obligatoirement. Pour l'instant, les femelles sont rarement sélectionnées pour leur rythme ovulatoire, d'autre part, il n'existe pas encore de moyen efficace de synchronisation des pontes. En l'absence de fécondations naturelles, l'aquculteur doit donc baser ses calculs de rentabilité sur le chiffre maximum de 33 %du taux de viabilitié. Par ailleurs, les pressions abdominales correctement effectuées a'induisent aucune mortalité.
2.3 Le décalage des pontes saisonnières
2.3.1. Méthode
En zones tempérées, les processus de gamétogénèse dépendent essentiellement, on le sait, de la température et de la photopériode, lorsque la salinité se situe entre 30 et 40 %. Les premiers décalages de ponte ont donc naturellement été basés sur la simulation des cycles thermiques et photopériodes de notre région. lls ont été contractés (GIRIN et DEVABCUELLE,1973) ou retardés (DEVAUCHELLE, 1983) par rapport aux cycles normaux. Par la suite, nous avons procédé par étapes, en nous rapprochant le plus possible des conditions d'éclairement et des températures optimales relevées en saison non décalée (tableau 5). Cette démarche, assortie d'heureux hasards (variations brutales des températures) nous ont conduit à simplifier progressivement les techniques de décalage.
L'objectif était double:
Réduire au maximum les coûts de chauffage et de refroidissement de l'eau de mer, tout en maintenant élevée la qualité des oeufs.
Connaître l'effet respectif des deux facteurs température et photopériode sur la gamétogénèse et les processus de ponte.
Certains résultats, qui ne relèvent pas d'une démarche strictement expérimentale, ont été reproduits sur 2 à 3 saisons de ponte turbot (DEVAUCHELLE, en cours).
2.3.2. Résultats
La mortalité des reproducteurs est comparable à celle enregistrée sans décalage de ponte D'autre part, seuls les décalages supérieurs à 1,5–2 mois sont pris en compte ici. En deçà de ces valeurs, il s'agit décalage à court terme qui relèvent de simples régulations thermiques (cf § 2.1.3.).
Gèneralités: Schématiser des techniques idéales de ponte conduirait à exclure de nombreuses possibilités qui n'ont pas encore été testées. En zones tempérées, on peut cependant résumer les résultats ainsi: comme en période normale de ponte,;les conditions d'éclairement déterminent., le début de la gamétogénèse (phase de prévitellogénèse). Cette action est particulièrement nette chez le turbot. De ce fait, il est maintenant courant de décaler les pontes sur les seules variations de photopériode. Le niveau de température est contrôlé, en cas de nécessité selon la zone d'élevage. Les pontes des quatre aspèces considérées ici, peuvent être décalées, à tout moment de l'année, suivant les indications du tableau 9, d'ailleurs très proches des conditions des conditions optimales relevées en saisons de pontes naturelles.
Le démarrage d'un décalage: Les iots de poisson dont la ponte doit être décalée pour la première fois, doivent, de préférence, terminer une période de repos sexuel. La progression de poids devra, avant tout, être normale, soit, selon les données bibliographiques, de + 2 à + 20 % selon l'espèce et l'âge (figure 2) par rapport à la fin du précédent repos sexuel, les décalages débutent le plus souvent par des contractons de cycles photopériodiques et donc une accélération de la gamétogénèse, ou par éclairement continu long (turbot). Les retards de ponte de plus de 1,5 mois fréquents, mais possibles, par blocage du cycle photopériodique, en période de repos sexuel.
Dans tous les cas, la durée de la gamétogénèse peut être ramenée à la durée minimale relevée dons le milieu naturel, soit 3–4 mois selon la température. Compte tenu de la durée minimum de repos sexuel (2 mois)et de la durée moyenne des saisons de ponte, il est possible de provoquer une oviposition tous les 7 mois (tableau 10). Mais, l'abaissement de la fécondité et de la qualité des oeufs consécutif (tableau 11) à des contractions plus raisonnables des cycles (10 mois qu lieu de 12) nous incitent à considérer ce forçage comme une action de dernier recours. Les résultats médiocres obtenus sur la seconde oviposition de bars le confirment d'ailleures (SUQUET,1986).
L'idéal est, une fois le décalage obtenu, de stabiliser les cycles photopériodiques avancés ou décalés, à, 12 mois. Le contrôle de la température demeure circonstanciel, dans les limites indiquées précédemment. De ce fait, les débuts et fins de ponte échappent plus qu'en conditions naturelles aux caprices saisonniers de la température de l'eau de mer. La durée des saisons devient naturellement maximale: 5–6 mois pour la daurade, 3–4 mois pour le bar et le turbot, 3 mois pour la sole.
Par ailieurs, l'influence du décalage ne se ressent pas directament sur le diamètre des oeufs. Même si les oeufs pondus hors saison normale sont souvent plus petits, il convient plutôt de corréler ces variations aux régimes thermiques (cf Discussion).
Le décalage peut enfin s'accompagner de modifications de la composition globale des oeufs. Les premières analyses ont révélé chez le bar, la sale, et le turbot des augmentations de lipides totaux et des réductions de taux de protéines par rapport aux ovules de poissons sauvages ou aux oeufs de poissons captifs non décalés (tableau 12). Les rapports de classes de lipides diffèrent aussi, alors que les taux d'acides gras insaturés opposent plutôt pontes obtenues en captivité et ovules de poissons pêches en mer. Dans ce cas précis, la température, en moyenne plus élevée, provoquait une alimentation plus régulière des reproducteurs. On peut donc supposer que l'action du décalage est indirecte. Compte tenu des implications qu'elle pourrait avoir sur la survie des larves, elle doit néanmoins retenir l'attention. Avec l'amélioration des techniques d'élevage larvaire, notamment celle du bar (COVES, 1985), on dispose de moyens de vérifier les effets des différences de qualité d'oeufs sur la survie des larves et des juvéniles.
2.4. L'origine des reproducteurs
2.4.1. Méthodes
En l'absence de données de sélection génétique, les reproducteurs de poissons marins nés en écloserie, sont souvent choisis dans les têtes de lot. Pour éviter les déséquilibres importants de sex-ratio, le sexage est donc indispensable, avant toute installation définitive dans une unité de reproduction. Malheureusement, sexage et production de géniteurs nés en écloserie sont récents. En Bretagne, seules des données de croissance de sole et de turbot sont disponibles. D'autre part, un seul test comparatif a été conduit sur le turbot pour évaluer les différences de fécondité entre poissons issus d'écloserie et de poissons “sauvages”. ll est mené on parallèle d'un test d'alimentation (tableau 13).
2.4.2. Résultats
Soles et turbot d'écloserie connaissent une phase de croissance rapide à température, élevée. Mois dès lors qu'ils sont placés dans les conditions naturelles de température, leur taux de croissance ralentit par rapport à celui des poissons sauvages, ou lui est tout an plus égal (figure 2). Lorsque se réalise le premier cycle de maturation, leur poids est inférieur à celui des poissons sauvages de même âge physiologique, par ailleurs, dans les deux cas, les mâles sont fluents un an plus tôt que les femelles.
En ce qui concerne le suivi de la fécondité des turbots, il convient d'abord de préciser que, en sours de test, des mortalités anormales sont apparues. Elles ont été réduites par les injections intrapéritonéales de vitamine C (100 mg kg poisson). Dans ces conditions, le nombre d'nombre d'oeufs par les poissons d'écloserie est inférieur de 36 % et les pertes de poids consécutives à la ponte sont de 3,3 % contre 5,7 % pour les poissons sauvages.
Le niveau de fécondité, il faut le rappeler, résulte de l'influence d'un grand nombre de paramètres qui ont marqué l'histoire, même lointaine, du reproducteur (STEARNS et CRANDALL,1984; WOOTON,1982). Ces résultats doivent donc être interprétés comme la conséquence de perturbations importantes au cours d'un élevage encore mai contrôlé. Avec l'amélioraton des techniques d'élevage des larves et des juvéniles, la fécondité des poissons d'écloserie devrait favorablement évoluer et atteindre celle des poissons d'origine sauvage, comme c'est actuellement le cas du bar (COVES, 1986, Comm. pers.).
2.5. Effet de l'alimentation
Sur ce point particulier, les résultats sont peu nombreux. Leur originalité les rend néanmoins intéressants.
Sur le turbot (tableau 13) les pontes artificielles pratiquées ne nous autorisent pas à interpréter les taux de viabilité pour les raisons évoquées plus haut. Les résultats montrent toutefois que le turbots affaiblis pour des raisons non encore identifiées meurent en moins forte proportion lorsque leur nourriture est garnie de complexes vitaminiques. Ce traitement a aussi pour conséquence d'augmenter la fécondité relative des femelles survivantes de 33 %. Ce n'est par contre; pas le cas lorsque les lots de turbot paraissent en bonne santé (NOEL, 1985).
Dans le cas de la sole et du bar (tableau 14), les changements d'aliments n'ont aucune influence nette sur la fécondité. L'absence de polychètes pour les soles ou la distribution d'aliments artificiels aux bars induisent par contre on abaissement du taux de viabilité. Avec l'amélioration des aliments artificiels, il semble toutefois que cet inconvénient disparaisse davantage chez le bar (SUQUET, 1986).
Ainsi, ces premières observations indiquent l'intérêt de suivre attentivement les relations entre milieu d'élevage-régime alimentaire et survie des larves. L'amélioration des aliments artificiels destinés aux reproducteurs devrait d'ailleurs systématiquement s'accompagner de tests en élevage larvaire afin de déceler leurs effets à des niveaux plus subtil que fécondité ou confirmation des oeufs. Les travaux réalisés en eau douce montrent l'exemple en ce domaine (QUANTZ, 1980; LUQUET et WATANABE, 1985).
3. DISCUSSION/CONCLUSION
Ces résultats ouvrent des perspectives d'application en aquaculture, notamment pour les techniques de décalage de ponte, la standardisation des unités de stabulation des reproducteurs et l'incubation d'oeufs. D'autre part, de même que les observations du milieu naturel représentent une base de réflexion pour l'aquaculteur, les techniques artificielles de ponte disposent de références de base avec les résultats de reproduction naturelle en captivité. Par conséquent, aujourd'hui, l'adoption de l'une ou l'autre technique résulte d'arbitrages basés sur l'espèce, le lieu d'élevage o tout simplement des contraintes matérielles. En définitive, une meilleure connaissance des processus de reproduction permet désormais de stabiliser, d'augmenter ou d'étaler à volonté (figure 6) les périodes de production d'oeufs. Mais, ainsi que dans la plupart des études théoriques ou expérimentales menées sur la reproduction (HOAR, 1969; LILEY, 1980) force est d'admettre que la production d'embryons viables résulte d'un délicat compromis qui intègre l'action de facteurs externes et intrinsèques.
Il convient, en particulier, de reconnaître les différences spécifiques. Ainsi, les soles et les turbots s'adaptent moins bien que la daurade et le bar à la captivité; leur durée d'acclimatation est supérieure; les parasites s'y développent plus facilement; la mortalité annuelle est en moyenne double de celle des bars et des daurades; enfin, leur taux de viabilité est plus faible. D'autre part, la réalisation de la gamétogénèse et de la ponte de la sole et du turbot s'accomodent de basses températures. Comme le confinement en bassins ne permet pas aux poissons de fuir les réchauffements brutaux de printemps et d'été leur apparente inadaptation à la captivité pourrait être liée aux régimes thermiques défavorables à l'espèce.
Par ailleurs, les daurades, les soles et les turbots qui se distinguent du bar par de nombreuses ovipositions ont, en captivité, une fécondité relative inférieure à celles calculées sur des poissons mûrs pêchés en mer. Encore faut-il préciser les méthodes d'estimation; en captivité, la fécondité se réfère au nombre d'oeufs réellement pondus. De fait, il est difficile de le comparer à la fécondité calculée en milieu naturel à partir du nombre total d'oogonies et d'ovecytes observé dans une gonade (DENIEL, 1981), sachant en particulier que les derniéres vagues d'ovocytes sont souvent résorbées (LAHAYE, 1972). Logiquement donc, les différences entre ces deux valeurs s'accentuent avec le nombre d'ovipositions. La fécondité en captivité ne peut pas, par conséquent, être facilement reconnue comme anormalement basse.
L'âge des animaux est aussi, comme chez la plupart des espèces une source de variation de la fécondité. De ce fait, la bonne gestion d'une écloserie de poissons marins repose sur les choix judicieux de la taille, du poids ou de l'âge des reproducteurs. Les expériences de salmoniculture (BILLARD, 1986) ou de carpiculture (MARCEL, 1986)en témoignent aussi. ll est d'autre part intéressant de constater que le taux de viabilité ou le diamètre des oeufs varie peu avec l'âge des poissons.
Quant à l'environnement, ses effets sur la reproduction sont remarquables. Ainsi, sur les côtes de la Manche, de l'Atlantique et de la Méditerranée, la température paraît être le facteur extrinsèque le plus déterminant. Le respect des limites inférieure-supérieure conditionne en effet le bon déroulement de la gamétogénèse et de la ponte. Toutefois, lorsque le contrôle thermique est difficile, l'induction hormonale de la maturation, par la LHRH en particulier, peut être d'un grand secours (BARNABE et BARNABE - QUEST, 1985). Les conséquesences à long terme restent a préciser. Par ailleurs, certaines caractéristiques des oeufs (toux de viabilité, taux d'éclosion et taux de malformation des larves vésiculées) dépendent aussi directement de la température. Ses effets indirects doivent, en plus retenir l'attention; en medifiant les quantités d'aliments ingérés, la température peut, par exemple, influence la fécondité, les dates de ponte des poissons (WOOTON, 1982) et comme nous le suggérons, la composition biochimique et le diamètre des oeufs. En ce qui concerne ce paramètre, il est intéressant de noter son évolution, en fonction des températures enregistrées au moment de la ponte (figure 7).
La salinité ne nécessite, par contre, pas de contrôle particulier dans la gamme 33 – 36 %. En zones de fortes dessalures, la gamétogénèse peut cependant être freinée, chez le bar notament (BRUSLE et ROBLIN, 1983; ZANUY et CARILLO, 1983). Au contraire, en se reproduisant en mer Baltique à 15 % (KUHLMANN et al., 1980), le turbot affirme un fort caractère euryhalin.
Salinité et température conditionnent aussi le succès de l'incubation. On l'a vu pour la sole et le turbot, il en est de même chez la daurade (FREDDI et al,1981) et probablement chez le bar comme chez la plupart des Téléostéens (BLAXTER, 1969; HEMPEL, 1979).
Par ailleurs, l'ensemble des références (BILLARD, 1979; BYE, 1984) montre que, en zones tempérées, la photopériode a, avec la température, une action déterminante sur la gamétogénèse. Cependant, les niveaux de combinaison entre conditions d'éclairement et température demeurent encore imprécis. L'utilisation des techniques récentes de biopsie devraient contribuer à y palier. DEVAUCHELLE (sous presse) montre ainsi que chez le turbot, l'initiation de la gamétogénèse est sous le contrôle quasi exclusif de la photopériode, tandis que la température régule, en combinaison avec la photopériode, les vitesses de vitellogénèse. Il est clair que l'amélioration des techniques de décalage de ponte implique une progression des connaissances en ce domaine. En dehors de ses effets sur la maturation, le rôle de la photopériode est mal compris (WOOTON,1982) malgré une influence directe évidente sur le niveau d'activite des poissons.
En ce qui concerne l'alimentation, la plupart des auteurs (FONTAINE et OLIVEREAU, 1962; DEMPEL,1979;DASPOWSKI, 1984) s'accorde à reconnaître l'impact des rations alimentaires sur les fécondités et les dotes des pontes. L'effet sur la qualité des oeufs, même en conditions extrèmes est par contre controversé (LUQUET et WATANABE, 1985). En l'absence d'études approfondies sur les aliments “spécial reproduction”, la normalité des courbes de croissance et de la conformation peut à notre sens, être retnue comme indice de bonne alimentation.
D'une manière générale, les conditions de température, de salinité on d'éclairement considérées comme optimales en milieu d'élevage, sont, en fait proches des conditions normales de vie en milieu naturel. Ceci s'est vérifié pour la gamétogénèse, la ponte, l'incubation (présente étude) ainsi qu'à d'autres stades du développement; pour le juvénile de turbot notamment (SCHERRER, 1985). Selon les capacités de régulation des espèces, il n'est d'ailleurs par exclu que les conditions optimales de développement des parents et par conséquent celles des oeufs puissent varier d'un endroit à l'autre (BLAXTER, 1969). Mais, l'ensemble des observations tend à suggérer que le choix des techniques d'élevage devrait être basé, pour chaque espèce, à chaque stade du développement, sur les effets prévisionnels (survie, malformations, maladies, niveaux d'alimentation…) qu'entraînent des conditions d'élevage de plus éloignées des conditions de vie noemales observées en milieu naturel.
Hormis les aspects biotechniques, le coût de production des larves vésiculées peut influencer les choix de stratégies de reproduction. ll convient donc de préciser que nos conditions de travail, considérées comme sophistiquées, permettent un prix faible de l'oeuf (tableau 15)compare à celui du juvénile. Pour l'instant, la simplification à outrance des techniques de production d'oeufs dans l'etat actuel des élevages de bar, de daurade, de sole ou de turbot aurait un effet négligeable sur le coût de production des juvéniles.
Il convient d'ajoutor enfin, qu'une petite partie seulement des facteurs susceptibles d'orienter le succès de la reproduction dans les écloseries de poissons marins vient d'être discuttée. Le champ d'investigation en ce domaine demeure largement ouvert. Ainsi, les effets des cycles lunaires, des phénomones et des comportements particuliers a chaque espèce (LILEY,1980; COLOMBO et al., 1982; TAYLOR, 1984) offrent des sujets d'étude incontestablement intéressants. Mois aujourd'hui, pour mieux appréhender les processus qui mènent du reproducteur au poisson commercialisable, l'approche la plus prometteuse consiste à associer le plus possible l'élevage. L'amélioration rapide des techniques d'élevage larvaire, celles du bar notamment (COVES,1985) permet depuis peu de s'engager dans cette voie.
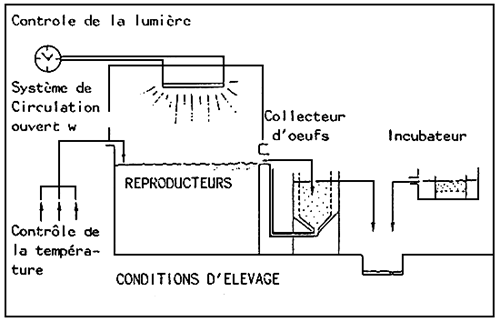
FIGURE 1: Schéma de principe des bassins de reproduction, des collecteurs et incubateurs d'oeufs.
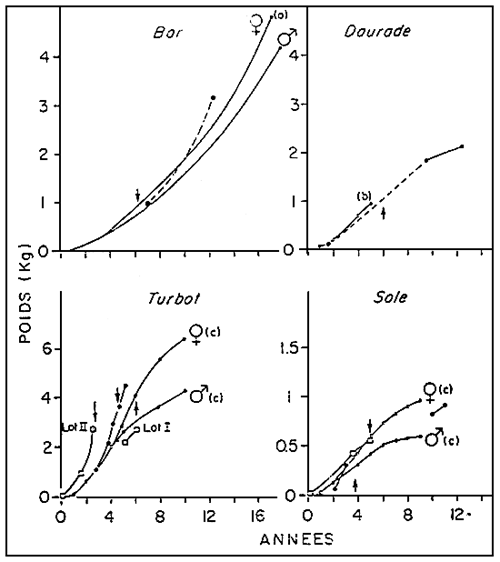
FIGURE 2: Courbes de croissance des poissons sauvages en milieu natuel (0),
en captivité (.) et des reproducteurs issus d'écloserie (), nourris
de morceaux de poisson frais ou congelés pendant 3 mois ou plus.
— =première ponte; ----=estimées; — =valeurs mesurées.
a: BOULINEAU, 1969; B: LASERRE, 1974; C: DENIEL, 1981.
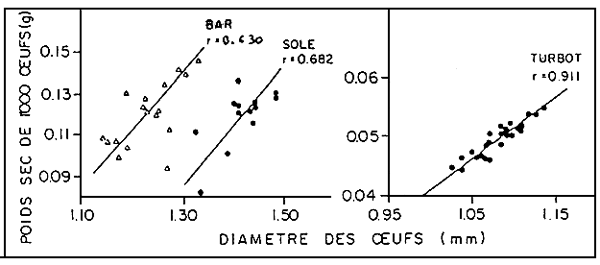
FIGURE 3: Relation taille-poids chez le bar, la sole et le turbot. Les corrélations
sont calculées selon le coefficient de BRAVAIS-PERSON
Bar: Y = 0,1824 × + 0,01037
Sole: Y = 0,2427 × + 0,26002
Turbot = Y = 0,192 × + 0,149
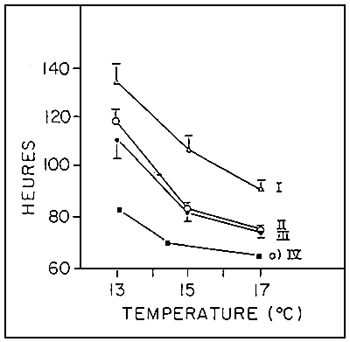
FIGURE 4: Durée du développement des oeufs de turbot (I), de bar (II) et de sole
(III) (de la fécondation à l'éclosion de 50% des oeufs viables) et des
oeufs de daurade (du stade 4 cellules à l'éclosion), en fonction de la
température d'incubation. Entre 13 et 17° C, 70 % au moins (bar, turbot
et daurade) ou 50 % (sole) des oeufs viables donnent naissance à des
larves normales dans nos conditions d'incubation.
a: CAMUS et KOUTSIKOPOULOS, 1984.
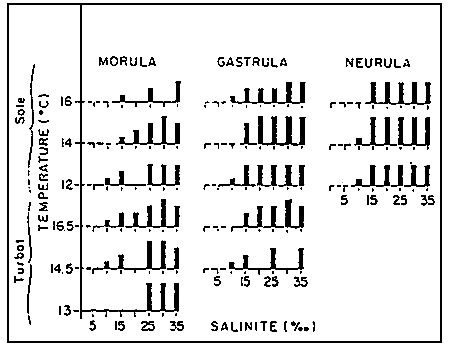
FIGURE 5: Pourcentage de larves normales issus d'oeufs viables de sole et de turbot aux températures de 12 à 16,5°C et de 0 et 35% de salinité.
| 0–20% | -- | 20–50% |  | 50 – 70% |  |
| 70–80% |  | 80% | 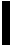 | - Tests non-effetués | |
FIGURE 6: Evolution entre 1976 et 1984 du poids total (kg) des reproducteurs, du nombre et du taux de, viabilité des oeufs récoltés. L'objectif était, pendant cette période, le maintien à niveau constant de la production d'oeufs de bar et de sole, pendant une saison unique, la saison normale de ponte, et l'étalement annuel des pontes de daurade et de turbot. En 1984, la ponte de bar a couvert une période de 87 jours. Le cycle thermique défavourable n'ayant pu être corrigé, leur saison de ponte fut raccourcie à 28 jours. Par contre, cette même année, deux bassins de daurade et trois bassins de turbot, ayant bénéficié de contrôles photopériodiques et thermiques, ont respectivement produit des oeufs, pendant 218 jours et 209 jours …: Données estimées - S 0 = Saison décalée - SN: saison normale.
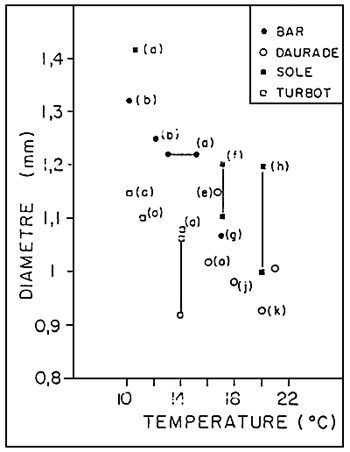
FIGURE 7: Relations entre taille des oeufs (D) et températures (T) de l'eau do mer au
moment de la ponte. D et T correspondent a des valeurs ponctuelles de la
littérature (b á k), et moyennes de l'lFREMER, Centre de BREST (a).
a : DEVAUCHELLE, 1980 et nos données
b : KENNEDY et FITZMAURICE, 1972
c : BRASOLA, 1974
f : BRASOLA, 1974
g : VILLANI, 1974
h : RAMOS, 1977
j : RAMOS, 1978
k : ALESSIO, 1975
| Espèce | Mise en dontitionnement | Réforme | |||||
| Poissons capturés en mer | Nés en écloserie | ||||||
| kg | kg | kg | ans | kg | ans | ||
| Bar | 0 | 0,6 | 5–8 | 0,7 | 4–7 | 2,5 | 9–12 |
| 0 | 0,8–1 | ,, | 1 | '' | 3 | 10–13 | |
| Daurade | 0 | 0,5 | 2–3 | 0,5a | * | - | |
| 0 | 0,8–1 | 3–5 | 0,6a, b | 3–4 | 10–13 | ||
| Sole | 0 | 0,5 | 3–4 | - | 1,2 | 15–20 | |
| 0 | 0,8–1 | 4–5 | - | 1,5 | 15–20 | ||
| Turbot | 0 | 0,5–2 | 2–4 | 2 | 3–4 | 5 | 8–10 |
| 0 | '' | '' | 2,5 | 4–5 | 7–8 | 10–12 | |
TABLEAU 1:Bases de choix des reproducteurs exprimées en âge
| Espèce | Technique de Pêchem | Volume des Bassins (m3) | Densité kg/m3 | Aliments | Mortalité%/an | |
| Qualité | Quantité %/S | |||||
| Bar | Ligne | 10–40 | 1,5–7 | Poissons | 12 | 2–5 |
| Daurade | Seine | 5–40 | 2–7 | Poissons Crabes Mollusques | 12 | |
| Sole | Seine | 5–17 | 1–3 | Mollusques Polychetes | 10 2 | 6 |
| Turbot | Chalut traits de 15 à 30 mm | 15–40 | 0,5–7 | Poissons | 15 | 5–10 |
TABLEAU 2: Conditions de pêche des reproducteurs sauvages. Indications générales sur les conditions de stabulation. Les quantitiés d'aliments se rapportent au poids frais d'aliments ingérés/poids du reproducteur × 100 par semaine.
| Espèce | Sexage biopsie + gonades | Marquage | Traitements Préventifs st curatifs | ||
| Bar | +a | Encre de chine b | Copépodes: | - | Dans le bassin de reproduction 200ppm F±0,6 ppm VM débit d'eau normal - 3 jours successifs |
| - | en beins 500ppm F-20mn | ||||
| Daurade | +a | '' | Abaissement de la salinité | ||
| Sole | +a | - | Monogènes: | - | en petits volumes aérés 300ppm Endebtelia solea + 1ppm VM - 3 heures |
| Turbot | +a | Azote | Copépodes: | - | dans le bassin de reproduction aéré - sans renouvellement d'eau: Neguvon 1ppm - 24 heures |
| Trichodina: | - | en bains: 200ppm F + 0,6 ppm VM - 20 mn | |||
| Metacercaires: | - | Bains: 200 ppm F+0,6 ppm 20mn | |||
| - | En grands bassins aérées avec renouvellement d'eau 100 ppm F+0,3 ppm VM - 3 fois | ||||
Tableau 3: principaux traitements subis par les reproducteurs.
a: EVAUCHELLE,1984 - b: SUQUET,1986
| Durée d'éclairement (heures) mini - maxi | 8.30–16.00 |
| Températures (° C) | 5–20 |
| Salinité ‰ | 33–36 |
| Taux moyen de saturation en oxygène % | 80–90 |
| Ammniqueμatg/1 | 0,5–1,5 |
| Nitrites μatg/1 | 0,1–0,2 |
| pH | 7,7–8,3 |
TABLEAU 4: Paramètres physicochimiques de l'eau de mer. Variations annuelles normales enregistrées dans les bassins de stabulation des reproducteurs à AFREMER/Centre de BREST.
| ESPECE | N. SAISONS | Durée/mois | GAMETOGENESE | Durée/jours | PONTE T°C | E (heures) | |||
| T° | C | E | (heures) | ||||||
| Bar | 6 | Sept/Janv. 3/4 | 20 | 8 | 14 | 8,30 | 16–94 (74) | 9 16 (13–15) | 8,30 16,00 (10–14) |
| Daurade | 6 | Automne 3 | 18 | 9 | 15/16 | 8,30 | 30–154 (107) | 12,5/13–24 (15–17) | 9 15,30 (9–11) |
| Sole | 10 | Oct/Janv.a 3 | 6 | 12 b | 10 | 8,30 | 13–83 (51) | 8 12 (10,5–11) | 11 16 (11,5–12) |
| Turbot | 6 | Dec/Janv-Avr/Mai 5 | 7 | 12 | 8,30 | 16/17 | 32–68 (50) | 9,5 17 (13–15 | 10,20 17 (15–16) |
TABLEAU 5: Reproducteurs soumis aux températures et photopériodes naturelles de la région Bretagne: Conditions extrêmes et optimales ()de photophase E et de température T enregistrées pendant la gamétogénèse et la ponte.
| Espèce | Technique de ponte | N.oeufs considérés ×106 | N.Ovipositions/0 | N.oeufs/10 kg | viabilitéen % | Eclosion d'oeufs viables en % | N. larves utilisables/kg 0/an | N. Oeufs/kg “O en mer” |
| Bar | 1 | 78 | 3 | 300 000 | 89 | 74 | 100 000 | 300 000a |
| 2 | c | 2 | 220 000 | 88 | 77 | |||
| Daurade | 1 | 70 | 12 | 700 000 | 83 | 76 | 400 000 | 1200 000b à 2 000 000 |
| 2 | c | 20–30 | 1 200 000 | 85 | 62 | |||
| Sole | 1 | 18 | 4 | 120 000 | 71 | 65 | 50 000 | 300 000c à 600 000 |
| 2 | - | - | - | - | ||||
| Turbot | 1 | 51 | 9 | 140 000 | 34 | 78 | 25 000 | 1 000 000d à 1 200 000 |
| 2 | 48 | 9 | 350 000 | 33 | 78 | 60 000 |
TABLEAU 6: Reproducteurs soumis aux températures et photopériodes naturelles de la région Bretagne: caractéristiques des pontes produites en captivité. L'avant dernière colonne du tableau donne à titre indicatif la quantité de larves qu'un éleveur peut raisonnablement mettre en élevage par kg de femelle et par an. La dernière colonne se réfère aux fécondités sur des animaux pêches en mer, à maturitè
a: BOULINEAU,1969
b: ZOHAR et al., 1984
c: LETALL, 1976
d: JONES,1974
e: SUQUET, 1986.
| ESPECES | Estimations effectuées le jour de ponte | Résultats d'incubation “moteur” | ||||||||
| Aliquotes prélevés sur N. Oeufs × 106 | Diamètre (mm) | Poids N. N.oeufs/gr | N.pontes Observées | Durée du développement larves ° C × heures-à 15° C | Eclosion de larves normales N. Pontes | % | ||||
| Moyen | Mini - Maxi | pontes | moyen | mini-maxi | ||||||
| Bar | 78 | 1,22 | 1,07 1,32 | 17 | 1030 | 811–1240 | 3 | 1215±45 | 10 | 85 |
| Daurade | 71 | 1,02 | 0,94 1,05 | - | 1755a | - | 659±18a | 7 | 85 | |
| Sple | 18 | 1,41 | 1,2–1,57 | 13 | 690 | 668–786 | 3 | 1390±91 | 12 | 74 |
| Turbot | 93 | 1,08 | 0,98–1,18 | 13 | 1550 | 1225–1772 | 3 | 1400±46 | 14 | 78 |
TABLEAU 7: Principales caractéristiques des oeufs. Les tests d'incubation ont eu lieu en incubateurs type “moteur” décrits par DEVAUCHELLE, 1984, à températures et salinités optimales.
| Espece | Temprature ° C | Duree de l'embryogénèse | ||
| Ponte | Incubation A | Incubation B | ||
| BAR | 13 – 15 | 13 – 15 | 13 – 17 | 3,6 – 4,6 |
| SOLE | 10,5 – 11 | 11 – 13 | 12 – 15 | 4,6 – 5,4 |
| TURBOT | 13 – 15 | 13 – 17 | 13 – 19 | 5,6 – 3,3 |
| DAURADE | 15 – 17 | 14,5a | - | 3 |
TABLEAU 8: Comparaison des fourchettes de températures optimales requises pour la ponte et. l'incubation. A ce sujet, deux cas de figure sont envisagés:
A = taux de larves normales 80%
B = 70% taux de larves normales 80%
a: CAMUS et KOUTSIKOPOULOS, 1984.
| Espéce | N. saisons de ponte | Durée (Jours) mini - maxi (moyenne) | Ponte | |
| T°C | E (heures) | |||
| BAR | 7 | 42–109 (71) | 9 16 (13–15) | 8,30 16 00 (10–14) |
| DAURADÉ | 6 | 36–154 (107) | 12,5/13 24 (15–17) | 8,30 15,30 (9–11) |
| SOLE | 7 | 13–128 (64) | 8 12 (10,5–11) | 11 16 (11,5–12) |
| TURBOT | 8 | 30–100 (62) | 9,5 17 (13–15) | 10 16,30 (15–16,30) |
TABLEAU 9: Reproducteurs soumis à des contrôles thermiques et photopériodiques. Durée de la saison de ponte et conditions de température et de photopériodes correspondantes ascendantes, descendantes ou stables Pour le bar, des températures élevées (16 – 20° C)ont été testées: les résultats indiquent que dans des conditions favorables d'éclairement (11–13 houres/jour), la gamétogénèse est freinée lorsque T 21–22° C. Le nombre de saisons de pontes auxquelles se rapportent les données équivaut au nombre de cycles annuels.
| ESPECE | DURCE NINIMUM (mois) | T (° C) | E (heures) |
| BAR | - 2,5 | 20 16 | 11 12 |
| DAURADE | - 3 | 12–14 | 16 14 |
| SOLE | - 3 | 11–15 | 11 15 |
| TURBOT | - 3 | 14 | 16,30 |
| - 3,6 | 10 | 16,30 |
TABLEAU 10: Conditions de température T et d'éclairement E testées pour réduire le temps de gamétogénèse.
| ESPECE | N. Oeufs observés S.N./S.D × 106 | N.Oeufs/ponte % | Viabilité % | Eclosion (d'oeufs viables %) |
| BAR | 17,6/3,4 | - 84 | - 17 | - 13 |
| SOLE | 4,4/1,2 | - 82 | - 13 | - 12 |
| TURBOT | 4,2/8,8 | - 55 | - 22 | - 30 |
TABLEAU 11: Réduction maximum observée (%) des volumes de pontes, des taux de viabilité et d'éclosion des oeufs lors de décalages de la reproduction par contraction des cycles photopériodiques
SN = Saison non décalé
SD = Saison décalée
| EAU | PROTCINES | LIPIDES % POIDS SEC | CENDRES | ||
| BAR | I | 65,2 | 63,9 | 26,2 | 4,2 |
| II | 88,4 | 54,2 | 33,1 | 6,2 | |
| I | 89,1 | 52,6 | 26,1 | 6,6 | |
| SOLE | I | 66,8 | 77,8 | 19,1 | 5,6 |
| II | 92 | 62,3 | 15,7 | 8,1 | |
| I | 92,1 | 67,8 | 13,1 | 9,8 | |
| TURBOT | I | 66,1 | 74,7 | 17,8 | 4,2 |
| II | 91,4 | 76 | 17,3 | 10,6 | |
| III | 91,6 | 62,9 | 15,6 | 11,3 |
TABLEAU 12: Composition globale des ovules mûrs prélevés sur des femelles capturées en mer (I), des oeufs issus de gamétogénèse, de pontes et de fécondationsnaturelles, avec (II) ou sans (III) contrôle de température et de photopériode - Extrait do DEVAUCHELLE et al., 1982.
| ESSAI 1(a) | ||||||
| Origine | Traitement | N.Poissons | Densité kg/m3 | P.M. (kg) | N.morts | N.Oeufs/kg O×106 |
| SAUVAGE | 1 | 12 | 4,1 | 5,15±1,43 | 1 | 408 |
| (S) | 11 | 12 | 3,2 | 4,56±1,62 | 7 | 278 |
| ECLOSERIE | 1 | 12 | 3 | 4,19±1 | 2 | 299 |
| (E) | 11 | 12 | 2,7 | 3,86±0,83 | 1 | 163 |
| ESSAI 2(b) | |||||
| Origine | Traitement | N.poissons | P.M. (kg) | N.morts | N.oeufs/kg larves O× |
| S + E | 1 | 32 | 3,3 | 0 | 12,7 |
| S + E | 11 | 32 | 3,3 | 0 | 22,8 |
TABLEAU 13: Effet de l'origine (essai I) et de l'alimentation (essais 1 et 2) de turbots sur la production d'oeufs ou de larves, par kg de femelle.
- L'alimentation est constituée de, morceaux de poisson distribué ad libitum, garnis (I) ou non (II) d'un cocktail de vitamines (C, E, B1, B6, biotine et inositol) à raison de 1 mg/kg de poisson/semaine (METAILLER, comm.pers., 1985), La consommation moyenne hebdomadaire (poids humide d'aliments/poids de reproducteur) est de 2 % (essai 1) et de 4 % (essai 2).
- Le traitement I comprend, en plus, une injection intrapéritanéale de vitamine C (100 mg/kg de poisson) 3 mois avant la ponte.
- Les bassins de stabulation font 20 m 3 (essai 1)et 30 m3 (essai 2).
| ESPICE | PERIODE | ALIMCNT | N. POISSONS AU DEPART | DCNSITE kg/m3 | MORTALITE/AN % | N. OEUFS COLLECTS×103 | TAUX DE VIABILITE PONDCERE MOYEN |
| BAR | 1976 | I | 20 | 1,2–1,5 | 0 | 81 | 89 |
| 1977 | II | 30 | '' | 0 | 143 | 57 | |
| III | 30 | '' | 0 | 521 | 86 | ||
| SOLE | 1976 | IV | 60 | 2,5–3,1 | 5,7 | 9600 | 77 |
| 1982 | |||||||
| 1983 | V | 66 | '' | 5,3 | 5200 | 54 | |
| 1984 |
TABLEAU 14: Effet de l'alimentation de bars et de soles sur la qualité des oeufs.
| ESPECE | Production de 107d'oeufs viables (F.F) | COUT ANNUEL Maintenance (F.F) d'un bassin de 10 m3 | Pompage % | Aliment % | Cheptel % | |
| BAR | 21 000 | 6 700 | 35 | 36 | 29 | |
| DAURADE | 5 500 | 7 000 | 21 | 21 | 58 | |
| SOLE | (a) | 46 000 | 3 500 | 38 | 44 | 17 |
| (b) | 140 000 | 10 500 | 11 | 83 | 5 | |
| TURBOT | 8 300 | 9 200 | 45 | 46 | 9 | |
TABLEAU 15: Prix de revient des oeufs hors amortissement et salaires, en saison normale de ponte, calculé sur la base de 3 kg de reproducteur par m3 d'eau de mer.Le coût des oeufs de sole varie en l'onction de l'alimentation: Mollusques seuls
(a) ou mollusques et polychètes
BIBLIOGRAPHIE
ALESSIO. G., 1975. Riproduzione artificiale di orata, Sparus aurata(L) (Osteichtyes Sparidae). 5° Primi risultati sull'allevamento ed alimentazione delle larve e degli avanotti.Bull. Pesca Piscic. ldrobiol., 30 (1): 71 – 92
ANTHONY, R., 1910. The cultivation of the turbot. Proceedings of the fourth international fishery congress, WASHINGTON, 1980. U.S.Bureau of fisheries Bull., 28(2): 859 – 870.
BARNABE,.G., 1976a. Rapport technique sur la ponte induite et l'élevage des larves du loup Dicentrarchus labrax et de la dorade Sparus aurata. In: Conseil général des pêches pour la Méditerranée, 55: 63 – 116.
BARNABE, G., 1976b. contribution à la connaissance de la biologie du loup (Dicetrarchus labrax). Poisson Serranidae. Thèse d'état. Fac.Sciences, MONTPELLIER: 426 pp.
BARNABE, G., et R. BARNABE - QUEST, 1985. Avancement et amélioration de la ponte induite chez le loup Dicentrarchus labrax (L) à l'aide d'un analogue de LIIRII injecté. Aquaculture, 49 (2): 125 – 132.
BARTON, A.L., 1981. Egg quality of turbot (Scophthalmus maximus) (L) kept in captive conditions. Thèse PHD présentée à l'université de LIVERPOOL, Grande Bretagne: 129 pp.
BEDIER, E. 1979. Production à l'échelle pilote d'alevins de loup (Dicentrarchus labrax - L) presented at the Early life history of fish. Symposium hold at woods Hole, USA, 2 – 5 avril 1979: 17 pp.
BILLARD, R., 1979. La gamétogénèse, le cycle sexuel et le contrôle de la reproduction chez les poissons téléostéens. Bull.Fr.Pisc., 273: 117 – 136.
BILLARD, R., 1986. La salmoniculture en eau douce. In: Aquaculture, Tome 2. Ed. Lavoisier. PARIS: 525 – 569.
BLAXTER, J.H.S. 1969. Development: eggs and larvae. Fish Physiology, 3. Academic press Inc., NEW YOUK, 178 – 271.
BONDARI, X., G.O. WARE, B.C. MULLINX, and J.A. JOYCE, 1985. Influence of brood fish size on the breeding performance of channel catfish. Prog. Fish. Cult., 47 (1): 21 – 27.
BOULINEAU, F., 1969 Contribution à l'étude biologique du bar Dicentrarchus labrax (Linné). Thèse de 3ème cycle, Fac. Sciences PARIS, Ronéo, 176 pp.
BRASOLA, V., 1974. Riproduzione artificiale della sogliola (Solea solea) effetuata con sucesso preso la laguna di Orbetello. Riv.Ital.Piscic.lttio. Patol., 9 (4): 99 – 101.
BRUSLE, J. et C. ROBLIN, 1984. Sexualité du loup Dicentrarchus labrax en condition d'élevage contrôlé. In: l'Aquaculture du bar et des sparidés. Actes du colloque sur l'aquaculture du bar (loup) et des sparidés tenu à SETE (France) les 15– 16 – 17 mars 1983: 33 – 44.
BUCKLAND in A.E. MALARD, 1899. Sur le développement et la pisciculture du turbot. C.R. Acad. Sc.PARIS, 129: 181 – 183.
BUTLER, GW., 1895. Report on the spawning of the common sole (solea vulgaris) in the aquarium of the Marine Biological Association's laboratory at PLIMOUTH, during April and May 1895. J. Mar. Biol. Ass. U. K., 4: 3 – 9.
BYE, V.J. 1984. The role of environmental factors in the timing of reproductive cycles, In: Fish Reproduction Strategies and tactics Ed. G.W. POTTS, R.J. WOOTON. LONDRES: 187 – 205.
CAMUS, P and C. KOUTSIKOPOULOS, 1984. Incubation and embryonic development of gilthead bream Sparus aurata (L) at a range of temperatures. Aquaculture, 42: 117 – 128.
COLOMBO, L., P.C. BELEVEDERE, A. MARCONATO and F. BENTIVEGNA, 1982. Pheromones in telcost fish. In: Reproductive physiology of fish. Proceedings of the International Symposium on reproductive physiology of fish, WACENINGEN, the netherlands, 2 – 6 août 1982.
COVES, D., 1985. Etat actuel de l'élevage du loup en écloserie. AQUA REVUE 3: 26 – 30.
DABRUWSKI, KK. 1984. The feeding of fish larvae: present “state of art”and perspectives. Reprod.Nutr.Develop., 1984 (6): 807 – 833.
DEVAUCHELLC, N., 1980. Etude expérimentale sur la reproduction, les oeufs et les larves de bar (Dicentrarchus labrax), daurade (Sparus aurata) mulet (Liza remada), rouget (Mollus surmalatus), sole (Solea solea) turbot (Scophthanaus maximus). Thèse 3ème cycle, UBO BREST: 117 pp
DEVAUCHELLE, N., 1984. L'incubation des oeufs de bar (Dicentrarchus labrax) et de daurade (Sparus aurata). In: L'aquaculture du bar et des sparides. Actes du colloque sur l'aquaculture du bar (loup) et des sparidés tenu à SETE (France) les 15 – 16 – 17 mars 1983: 117 – 124.
DEVAUCHELLE, N., 1984. Identification du sexe et prélèvements d'ovocytes sur turbots (Scophthalmus maximus) vivants. Bull. Fr. Piscic., 293 – 294: 65 – 71.
DEVAUCHELLE, N., et Y. CLADAS, 1982. Influence de la taille, du poids et du taux d'humidité d'oeufs de trois espèces de poissons marins sur les taux d'éclosion et d'anomalies des larves. Rapport ICES/CIEM, CM 1982/F: 19, 14 pp.
DEVAUCHELLE, N., G.BRICHON, F. LANOUR, G. STEPHAN, 1982. Biochemical composition of ovules and Fecund eggs of sea-bass (Dicentrarchus labrax), Sole, (Solea vulgaris) and turbot (Scophthalmus). In: Reproduction physiology of fish. Proceedings of the international Symposium on reproductive physiology of fish: 155 – 157.
DENIEL, C. 1981 Les poissons plats(Téléostéens, pleuronectiformes) en baie de DOUARNENEZ. Reproduction, croissance et migration des Bothidea, Scophthalmidae, Pleuronectidae et Soleidae. Thèse d'état, UBO-BREST: 476 pp.
DIVANACU, P., 1985. Contribution à la connaissance de la biologie et de l'élevage de 6 sparidés méditerranéens: Sparus aurata, Diplodus sargus, Diplodus vulgaris, Diplodus annularis, Litognathus mormyrus, Puntazzo puntazzo (poissons téléostéens). Thèse d'état. Univ. Sci.et tech. Languedoc: 479 pp.
FLUCHTER, J., 1972. Induction of spawning in the turbot (Rhombus maximus L) by injection of hypophyscal suspensions. Aquaculture, 1 (3): 285 – 287.
FONDS, M., 1979. Laboratory observations on the influence of temperature and salinity on development of the eggs and growth of the larvae of Solea solea (Pisces). Marine Ecology progress series 1(2): 91 – 99.
FONTALNE, M. et M. OLIVEREAU, 1962. Nutrition et sexualité chez les poissons. Annales de la nutrition et de l'alimentation: T. 16: A 125 – A 152.
FREDDL, A., L. DERG, and M. BILIO, 1981. Optimal salinity temperature combinations for the early life stages of Gilthead bream Sparus ouratus L., J. World. Maric. Soc., 12 (2), 130 – 136.
GIRIN, M. et W. DEVAUCHELLE, 1978. Décalage de la période de reproduction par raccourcissement des cycles photopériodiques et thermiques chez des poissons marins. Ann.Biol.Anim.Bioch.Biophys., 18 (4): 1059 – 1065.
GIRIN, N. 1979. Méthodes de production des juvéniles chez trois poissons marins, le bar, la sole et le turbot. Rapport CHEXO Scientifique et technique, 39: 202 pp.
GIRIN, M., 1980. L'élevage des poissons marins. La recherche: II (107: 36 – 44).
HEMPEL, G.,1979. Early life history of marine fish. The egg stage: Library of congress Cataloging in publication data: 71 pp.
HOAR, N.S., 1969. Reproduction. In fish physiology. Ed.By N.S. HOAR and R.J. RANDALL, VOL. 3: 1 – 72.
JONES, A., 1974. Sexual maturity, fecundity and growth of the turbot (Scophthalmus maximus L). J.Mar.Biol.Ass.U.K., 54: 109 – 125.
KENNEDY, M., and P. FITZAURICE, 1972 The biology of the bass, Dicentrarchus labrax, in irish waters. J. Mar.Biol.Ass.U.K. 52: 557 – 597.
KUHLMANN, D., G. QUANTZ, W. NELLEN and J. LENZ, 1980. The development of turbot eggs, Scophthalmus maximusL., from the Baltic Sea under different temperature and salinity condition. Presented at the ICES Meeting 1980/F; 31: 8 pp.
LAHAYE, J., 1972 Cycles sexuels de quelques poissons plats des côtes bretonnes. Rev.Trav.Inst.Pêches marit., 36 (2): 191 – 207.
LASSERRE, G., 1974. Recherches sur la dynamique des populations des daurades royales Sparus auratus L des régions de SETE et d'ARCACHON. Thèse 3ème cycle. Univ.sci.et Tech. Languedoc: 214 pp.
Le Foll, A., 1979. Fecondité de la sole Solea solea, et d'un arnoglosse, Arnoglossus latera en baie de DOUARNENEZ. Rapport de DEA, UBO, BREST: 54 pp.
LIEWES, E.W, 1984. Diseases of commercial flatfish species. Ed.A.A. BALXEMA, P.O. Box 1675, 3 000 Br ROTTERDAM, Netherlands: 103 pp.
LILCY, N.R., 1980. Patterns of hormonal control in reproductive behaviour of fish and their redevance to fish management and culture programs. In: Fish behaviour and its use in the capture and culture of fishes. Ed. J.E. BARDACH, J.J. NAGNUSON, R.C. MAY and J.M. RELNIART, ICLARM conference proceedings 5: 210 – 246.
LUQUET, P. and T.WATANABE, 1985 Interaction “Nutrition-Reproduction” in fish Presented at the 7th Conference of the European society for comparative physiology and biochemistry. BARCELONE, 26 – 28 août 1985 – 23 pp.
MARCEL, J., 1986. La pisciculture en étang. In: Aquaculture, Tome 2. Coordonnateur G. BARNABE. Ed. LAVOISIER: 1123 pp.
Mc EVOY, L.A., 1985. Double ovalutory cycles in same captive turbot, Scophthalmus maximus L., J. Fish. Biol. 26: 63 – 66.
NOEL, T., 1985. Bilan trimestriel sur la reproduction du turbot à la SODAB, TREDARZEC, Côtes du Nord, France, 25.07.85: 3 pp.
QUANTZ, G., 1980. Uber den Einflub von czrotinoidreichen trockenfutter auf die Eibefruchtung der regonbogenforelle (Salmo gairdneri R). Arch.Fish, Wiss., 31 (1): 29 – 40.
RAMOS, J. 1977. Primeras experiencias de cria del lenguado (Solea soles L). Inf. Tech del inst. de invest. Pesqueras. BARCELONA, Sept. 1977. 48: 16 pp.
RAMOS, J. 1978. Experincias de cultiva de dorada (Sparus aurata L) en tanques. Informes technicos del instituto de investigaciones posqueras. BARCELONA, 55: 20 pp.
SCHERRER, P., 1985. Influence de la température et de la salinité sur la croissance et la consommation d'oxygène du juvénile de turbot Scophthalmus maximus l. (phase nurserie). Thèse 3ème cycle, UBO - BREST: 151 pp.
STEARNS, S.C. and R.E. CRAMDALL, 1984. Plasticity for age and size at sexual maturity : a life history response to unavoidable stress, In: fish reproduction. Strategies and tacties. Ed. G.W. POTTS, R.J. WOOTON. LONDRES: 13 – 33.