Mr. C. KITAJIMA
La daurade japonaise ou madai (en japonais), Pagrus major (TEMMINCK et SCHLEGEL) est distribuée tout au long des côtes japonaises jusqu'à l'est de la mer de Chine et au sud-est des eaux asiatiques. Sa croissance peut aller jusqu'à, l mètre (L.T.), et c'est un des poissons les plus importants et les plus chers au Japon, pour sa chair délicate et son apparence élégante; il est très souvent consommé lors de fêtes comme les mariages, les anniversaires, le nouvel an,…
La pêche annuelle de la daurade, le long des côtes japonaises, atteint 20 000 tonnes, mais récemment, le stock naturel a eu tendance à décliner. L'élevage de cette espèce, à d'alevins pêchés, débute aux environs de 1965 et devint rapidement très populaire dans la partie Sud-Quest du Japon. Depuis 1975, la production d'alevins en écloserie, s'est développée rapidement et le nombre d'alevins produits en écloserie dans le pays a atteint 40 millions, en 1983. Actuellement, la plus grande partie des alevins utilisés pour l'élevage provient d'écloseries.
D'autre part, les expériences visant à repeupler las eaux côtières pour promouvoir la pêche, débutèrent en 1975.
Actuellement, au Japon, à côté des 13 écloseries nationales et des 40 préfectorales, nombreuses sont celles gérées par le secteur privé. Les alevins utilisés pour le repeuplement sont souvent produits par les écloseries gouvernementales, tandis que ceux destinés à l'élevage proviennent des décloseries privées. Le nombre d'alevins stockés et élevés en était respectivement, de 23 milllions (pour 39 écloseries) et de 16 millions (pour 32 écloseries) (Fig. 1et 2)
Les premiers essais sur la production d'alevins ont été réalisés par KAJIYAMA et ses collaborateurs en 1917, mais les études complètes débutèrent à la fin des années 50. ll n'y a que 25 ans que l'on travaille sur la production d'alevins et beaucoup de problèmes restent à résoudre.
Lorsque les premières expériences de reproduction controlée débutèrent les oeufs et le sperme étaient prélevés sur des femelles et des mâles sauvages par la méthode du “stripping”. De nos jours, les oeufs fertilisés sont récoltés á partir du bassin où se trouvent les géniteurs. En captivité, la maturité sexuelle apparaît dans la seconde ou la troisième année, à une taille minimale pour les femelles de 30 cm de longueur et 500 grammes (KITAJIMA, 1978), mais la taille souhaitable pour les parents est de l à 3 kg. (3 à ans).
L'élevage des reproducteurs est similaire à celui des poissons commerciaux; ils sont placés dans une cage (dans une baie) et alimentés à partir d'aliment artificiel ou de poisson, frais ou surgelé, tel que sardine, anchois, maquereau et krill.
La saison de reproduction de cette espèce s'étale d'avril à juillet, lorsque la température de l'eau varie de 15 à 22° C.
Les géniteurs, prêts pour la ponte, sont transférés des cages dan les bassins de ponte à terre: la densité est de 2 poissons par m3, avec un même nombre de femelles et de mâles. La détermination du sexe est très aisée, vu que le mâle, durant la période de reproduction, devient partiellement noir. Une femelle de 1 kg donne 50 000 à 100 000 oeufs chaque jour, au coucher du soleil et ceci durant 50 jours ou plus. Le nombre total d'oeufs (Fig. 3) pondus respectivement par une femelle de 1, 1,5 ou 2 kg, en une saison, est de 3 000 000, 5 000 000 et 9 000 000. (KITAJIMA, 1978) (Fig. 4). Les oeufs sont récoltés grâce à un filet à plancton placé la sortie d'eau du bassin. L'estimation du nombre d'oeufs récoltés se fait à partir du poids; 1 g - 1 800 oeufs.
Des oeufs normaux flottent, alors que ceux qui ne sont pas fertilisés ou pas développés tombent dans le fond du bassin. Donc, la proportion d'oeufs flottants par rapport au nombre total donne une idée de la qualité des oeufs. Le poids total des oeufs pondus par une femelle en une saison atteint 1, 5 fois son poids corporel; il est donc nécessaire de l'alimenter suffisamment chaque jour. Des études récentes montrent que la quantité et la qualité des oeufs pondus est en relation étroite avec la qualité nutritionnelle de l'aliment donné aux géniteurs. Des études supplémentaires sont à faire dans ce domaine (WATANABE et al., 1984 a, b, c; 1985 a et b).
Il existe différentes méthodes pour allonger la saison de reproduction en controlant la température d'élevage.
Les premières étapes de l'élevage sont les suivantes (KITAJIMA, 1978):
| stade de development | Age en jours | Longuer totale | |
| Stade larvaire | |||
| Stade pré-larvaire | 0 -- 3 a 5 | 2,3 -- 3,0 mm | |
| Stade post-larvaire | -- 25 | -- 10 | |
| Stade juvénile | -- 60 | -- 40 | |
Les alevins de 40 mm peuvent être utilisés soit pour l'élevage, soit pour le repeuplement.
Les larves sont planctoniques et occupent tout le bassin. Elles sont élevées à de hautes densités, 20 000 à 30000 par m3. Au stade d'alevins, elles vont vers le fond du bassins et leur capacité de s'améliore remarquablement. A ce stade, les alevins commencent à se battre et le cannibalisme apparaît. II est donc nécessaire d'élever les alevins des densités moins élevées et dans un espace plus vaste.
Les larves sont surtout alimentées à partir d'organismes vivants comme les rotifères et les nauplii d'Artemia, alors que les alevins reçoivent généralement un aliment non-vivant, aliment artificiel ou chair de poisson. Ceci provoque souvent, è ce stade, des problèmes de pollution de l'eau. Généralement, les larves sont élevées dans des bassins et sont ensuite transférées dans des cages en mer, au stade d'alevins, à une taille de 12- 13 mm.
Les oeufs fertilisés sont placés en bassins d'élevage de 50 à 100 m3. à une concentration de 20 000 à 30 000 oeufs par m3. L'incubation des oeufs a lieu dans ces bassins en utilisant une faible aération avec 10 à 15 pierres poreuses
L'éclosion a lieu après 50 heures à 18°c ou heures à 20° C après la ponte. Les jounes larves ont une taille de 2,3 mm (L.T.) et vivent sur les réserves du sac vitellin pendant 4 à 5 jours, à une température de 18°C.
Pendant la première semaine ou les 10 premiers jours après l'éclosion, nous ne changeons pas l'eau du bassin. Ensuite, de l'eau de mer filtré est ajoutée au bassins. Ensuite, de l'élevage larvaire, la quantité d'eau renouvelé par jour est presque égale à la capacité du bassins.
Dans le cas d'un bassin situé à l'extérieur, celui-ci est ombragé à l'aide d'un filet afin de réduire au maximum l'intensité lumineuse jusqu'à 5 000 lux á la surface de 'eau.
Dans une écloserie bien située, les larves sont siphonnées du bassin d'élevage larvaire vers les cages. Les dimensions ordinaires d'une cage sont 5 × 5 × 3 m. Les alevins de 12 é 14 mm sont stocké à une densité de 2 000 à 3 000 par m3. Les mailles des filets des cages sont de 2 mm.
Avec la croissance des alevins, leur densité est réduite par transfert, tous les 7 à 10 jours, dans de nouvelles cages à mailles de taille supérieure.
La croissance des larves et des juvéniles est étroitement liée à la température de l'eau. Par exemple, à 20 – 23°c, les larves á peine écloses mesurent 2,3 mm L.T.; 4, 4 mm á 10 jours; 8, 1 mm á 20 jours; 14.8 mm á 35 jours: 23, 7 mm á 42 jours; 41, 3 mm á 56 jours (Fig. 5; KITAJIMA, 1978).
Les équations suivantes représentent la relation existant entre la longueur totale (L mm) et le poids humide (W mg) (XITAJIMA, 1978).
| w1=0,0013 L4,1045 | (3,55 mm < L <5,75 mm) |
| w2=0,0038 L3,5486 | (6,75 mm < L <10,25 mm) |
| w3=0,0154 L2,9735 | (10,25 mm < L <10,25 mm) |
| w4=0,0091 L3,4078 | (42,5 mm < L <85 mm) |
Le taux de survie est pratiquement de 100 % jusqu'au 10 ème jour après l'éclosion à la taille de 5,5 mm. ensuite, la mortalité augmente fortement jusqu'au 30 ème jour (12 – 13 mm L.T.). Enfin, elle diminue graduellement et après le 50ème jour (25 mm L.T.), le taux de survie se stabilise à 80 % ou plus (Fig. 5; KITAJIMA, 1978).
Donc la période critique (grade mortalité) s'étale entre le 10 ème et le 50 ème jour (de 5,5 mm à 25 mm L.T.) et spécialement entre le 10ème et le 30ème (5,5 à 13 mm). Cette période correspond à la métamorphose, passage du stade larvaire au stade juvénile. Dans les dernières productions en écloserie, le taux de survie est de 40 à 50 % durant l'élevage larvaire on bassin et de 50 à 60% pour l'élevage des alevins en cases, ce qui donne 20 à 25 % pour tout l'élevage, avec, bien sûr, des différences entre les écloseries.
Dix ans, du milieu des années 50 á 1965, ont été nécessaires pour découvrir l'alimentation adéquate pour les larves de poisson. De nombreuses espèces de micro-crustacés, de larves d'invertébrés marins et divers aliments artificiels ont été testés afin d'en connaître la valeur diététique pour les larves. Actuellement, après cette période de recherches, la série des régimes alimentaires généralement adaptés aux larves et aux alevins des principales espèces est la suivante:
Les post-larves de 4 à 30 jours après l'éclosion sont alimentées à partir de rotifères.
Durant la métamorphose, l'alimentation des larves consiste en rotifères distribués avec du plancton de crustacés comme des nauplii d'Artemia, du Tigriopus japonicus et des copépodes récoltés dans la nature.
Les alevins sont alimentés a partir d'aliment non vivant tel que des déchets de poisson broyés, de la chair de mollusques et de crevettes ou d'aliments artificiels.
Il est nécessaire de connaître la quantité d'aliment consommé par larve et par jour, à chaque stade de la croissance, afin de pouvoir produire et distribuer la quantité souhaitable d'aliment. Si le nombre de larves et la densité de proies dans un bassin étaient connues, la consommation journalière d'aliment pour une larve pourrait être calculées à partir de la diminution de la densité des organismes.
La relation existant entre le nombre de rotifères (R) ou Tigriopus japonicus (T) mangés par une larve, par jour, et la longuer totale (L mm) de la larve est donnée par la formule suivante (KITAJIMA, 1976; KITAJIMA et al., 1976)
H = 0,3927 L3,675 et T =0,06728 L3,466 (Fig. 6 et 7)
Le poids moyen d'un rotifère est de 0,003 mg et celui de T. japonicus de 0,034 mg; la quantité consommée dans cette expérience est approximativement égale à 60 % du poids humide de la larve à doit toujours être maintenue supérieure à dans les bassins d'élevages larvaire doit toujours être maintenue supérieure à 5 ind./m) afin d'éviter le jeûne chez la larve et les déviation dans la croissance larvaire. On considère que la quantité d'aliment nécessaire doit être 1,3 a 1,5 fois celle mangée par les larves, vu la quantité d'organismes perdus par la circulation de l'eau.
FUSHIMI (1977) a démontré que la croissance et le taux de survie des larves de daurade japonaise restaient inchangés même si la quantité journalière de rotifères distribués était supérieure à 80 % du poids de la larve.
Avant 1972, seule la Chlorella marine était utilisée comme aliment pour les rotifères. Avec l'accroissement de la production de larves de daurade japonaise, la quantité de rotifères nécessaire est devenue énorme et l'utilisation de levure de boulanger a la place de Chlorella a commence. Comme résultat, on a vu la densité de rotifères passer de 30 – 50 á 100 ind/ml ou plus.
Si les larves de daurades élevées à partir de rotifères alimentes par chlorella (chlorella - rotifères) grandissaient normalement, de lourdes mortalités étaient observées sur les larves élevées à partir de rotifères alimentés avec la seule levure (levure-rotifères) pendant 10 –13 jours. Il a été démontré qu'il était possible d'éviter cette mortalité en alimentant les “levures-rotifères” secondairement, pendant plusieurs heures avec de la chlorella ou en élevant ensemble “levures-rotifères” et algue (KITAJIMA et KODA, 1976).
A partir de ces résultats, des analyses chimiques ont été réalisées aussi bien sur les “levures-rotifères” que sur les “chlorella-rotifères” dans le but de clarifier leur valeur nutritive. Comme il y avait peu de différences entre la composition en acides aminés et en minéraux entre les deux types de rotifères, il semblait qu'ils n'étaient pas les principaux facteurs responsables de la valeur nutritive (WATANABE et al., 1978a, 1978b).
D'autre part, on a remarqué qu'il existait une nette différence dans la composition en acides gras; par exemple, les “levure-rotifères” contenaient peu d'acides gras poly-insaturés ω3 (ω3 HUFA high unsaturated fatty acid) tels que le 20: 5 ω 3 (acide eichosapentaenoique) et le 22: 6 ω 3 (acide dochosahexanoique), qui sont les acides gras essentiels pour les poissons marins (YONE et FUJII, 1975 a, b; COWNEY et al., 1976), alors que les “Chlorella-rotiférences” contenaient une grande quantité de 20: 5ω3. On a découvert que la différence de concentration de 20: 5 ω 3 pouvait être attribuée è différence de composition en acides gras entre la levure et chlorella (WATANABE et al., 1978 c).
Des expériences ont été réalisées en vue d'améliorer la valeur nutritive des “levure-rotifères”, en les aliment avec de la Chlorella marine, a intervalles réguliers, pendant 10 minutes a 24 heures, avant qu'ils ne soient distribues aux larves de daurades. II a été prouvé que la valeur nutritive des “levures-rotifères” s'améliorait en les aliment ensuite avec de la Chlorella. Les larves alimentées avec les “levures-rotifères” nourries pendant plus de 6 h. avec Chlorella, étaient en bonnes conditions et avaient un taux de survie éléve, comparable celui obtenu pour des larves alimentées avec des “Chlorella-rotiferes” (Tableau 2).
Lorsque la Chlorella marine était utilisée comme milieu de culture, la faible quantité d'acides gras ω 3 contenue dans les rotifères alimentes avec la levure, augmentait proportionnellement à la période d'élevage, par suite de l'incorporation progressive de 20: 5 ω 3 en provenance de chlorella, et atteignait un maximum de 27 % en 2 jours d'alimentation (WATANABE et al., 1979).
Ces résultants montrent que le contenu des rotifères en a.g ω 3 était le facteur principal au niveau de la valeur nutritive de ceux-ci et que la mortalité élevée observée fréquemment chez les larves de daurades, provoquée par l'alimentation uniquement en “levure-rotifères” était due au déficit en acides gras essentiels, dans le poisson.
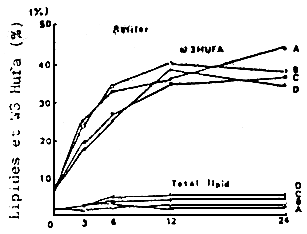
A la suite de ces résultats, un nouveau type de levure (appelée ω levure) a été produite en adjoutant de l'huile de poisson ou de foie de seiche somme supplément au milieu de culture, avec comme résultat un contenu plus élevé en acides gras essentiels ω 3 (IMADA et al., 1979) (Tableaux 3 et 4, Fig. 8 et 9). Les rotifères cultivés avec 1'ω levure possédaient une grade quantité, non seulement d'a.g. ω 3, mais é de lipides. On a observé que l'incorporation d'a.g. ω 3 à partir d'ω levures atteignait un maximum après 12 heures d'alimentation La valeur nutritive des rotifères pour les larves de poisson a été significativement améliorée, et est comparable à celle des “chlorella-rotifères” (KITAJIMA et al., 1980 a).
Les mêmes résultats que ceux obtenus avec la daurade japonaise ont été retrouvés avec d'autres espèces de poissons marins, comme Oplegnathus fasciatus (FUKUSHO et al., 1978), (Takifugu rubripes (ARAKAWA et al., 1978) et plecoglossus altivelis (KITAJIMA et al., 1980 à).
De plus, le contenu en a.g. ω 3 est le facteur le plus important en ce qui concerne la valeur nutritive non seulement des rotifères mais aussi d'autres organismes vivants comme les nauplii d'Artemia et les copépodes. Effectivement un contenu faible en a.g. ω 3 chez l'Artemia cause fréquemment un affaiblissement de la larve et en conséquence une grande mortalité chez beaucoup d'espèces de poissons marins. Ceci varie en fonction de l'espèce et du lieu de production de l'Artemia. La composition eu a. g. des oeufs d'Artemia en provenance de différentes localités a été déterminée afin d'en clarifier la valeur nutritive (WATANABE et a)., 1978 d, 1980; FUJITA et al., 1930). A partir des résultats présentes dans le tableau 5, les oeufs d'Artemia peuvent être classes en deux groupes typiques selon leur composition en a. g. (WATANABE et al., 1978 d). Le premier type continent une grande quantité de 18: 3 ω 3 (acide linolénique). qui est l'acide gras essentiel pour les poissons d'eau douce, alors que le second est riche en 20: 5ω3 qui est l'a. g. essentiel pour les espèces marines.
On a découvert que la valeur nutritive de l'Artemia du type “eau douce” peut être efficacement améliorée en lui donnant des aliments riches en a. g.ω3 comme la Chlorella ou l'ω-levure. De plus, il est possible d'améliorer la valeur nutritive en donnant directement à l'Artemia une émulsion de lipides contenant une grade quantité d'a.g.ω3 (WATANABE et al., 1982).
Les copépodes comme (T. japonicus et Acartia spp possédent une grande quantité d'a g.ω3 et sont donc d'excellents aliments pour les larves de poissons marins.
Les principales causes de mortalité semblent être provoquées par des maladies infectieuses et des microparasites. Leur étude vient juste de commencer et il reste beacucoup de problèmes à résoudre. Les bains ou l'administration d'antibiotiques par vole orale sont utiles pour les maladies bactériennes aux stades larvaire et juvénile.
Avec l'augmentation de la production de larves de daurade japonaise, un certain nombre de malformations comme corps trapu, brachygnathisme, prognathisme, développement incomplet de l'opercule, anomalies du squelette, et …sont apparues Elles peuvent devenir un grand problème lorsque ces malformations représentent un large pourcentage dans la production.
Depuis 1973, dans pratiquement toutes les écloseries et tous les laboratoires du Japon, une lordose de forme V (courbure de la colonne) a fréquemment été observée. Comme la proportion atteignait fréquemment 20 à 50 %, elle devint un problème grave. (Tableau 6; Fig. 10).
Nous avons étudié les causes de cette malformation de 1975 á 1980 et nous avons pratiquement déterminé son origine.
La lordose est généralement visible chez des juvéniles de 20 mm. Ensuite, la proportion et le degré de courbure augmentent graduellement avec la croissance. A la taille de 120–130 mm, tant la proportion que le degré de courbure sont pratiquement fixes fixés (KITAJIMA et al., 1975; KITAJIMA, 1977) (Fig. 11)
En 1977, on a démontré qu'il existant une relation étroite entre la lordose et le non-développement de la vessie natatoire (KITAJIMA et al., 1977 (Fig. 12,13)
Les larves de daurade japonaise aspirent l'air à la surface de l'eau pour le gonflement initial de la vessie, durant une semaine, entre la période de première alimentation (âge 3 – 7 jours) à la taille de 4,5 mm (10 à 12 jours) (KITAJIMA et al., 1981). YAMASHITA (1966) a observé histologiquement que la première apparition de gaz dans la vessie natatoire a lieu approximativement l'âge de 8 jours et que le conduit pneumatique se ferme et dégénère graduellement à l'âge de 10 – 12 jours. Donc, la période durant laquelle le conduit pneumatique fonctionne correspond au moment de l'aspiration d'air et au gonflement initial de la vessie natatoire.
Les larves qui-pour une raison ou une autre-n'ont pas réussi à aspirer l'air a la surface de l'eau pendant la période où le conduit pneumatique est fonctionnel (3.5 à 4,5 mm) grandissent sans que la vessie natatoire soit gonflée et par conséquent, la majorité d'entre elles ont des lordoses quand elles passent au stade juvénile. (Tableau 7,8; Fig. 14,15).
La gravité spécifique des individus possédant une vessie natatoire normale est approximativement 1,04 alors que celle des individus n'ayant pas la vessie natatoire gonflée est de 1,07 (KITAJIMA, 1978; Fig. 16). Donc, les poissons ayant la vessie natatoire non fonctionnelle éprouvent des difficultés a rester dans la partie supérieure et moyenne du bassin.Ils nagent en position oblique des individus n'ayant pas la vessie natatoire vers la surface avec de rapides battements de nageoires. La lordose semble être due au fait l'animal doit compenser la direction oblique de l'axe du corps en provoquant une distorsion de la colonne vertébrale.
L'alimentation des larves avec des rotifères ayant un faible contenu en a.g.ω3 provoque un accroissement du nombre de poissons n'ayant pas la vessie natatoire activée (KITAJIMA, 1978; WATANABE, 1978;Fig. 17). De plus, ISEDA et al., 1978, ont découvert que la proportion de poissons ayant la vessie natatoire non activée a tendance à s'accroître dans les bassins ayant une aération trop forte (Tableau 9).
De ces résultats, il est possible de tirer des conclusions concernant l'aspiration d'air par les larves:
Les larves de daurade japonaise alimentées avec des rotifères ayant un faible contenu en a.g.ω3 montrent une faible activité, peu d'endurance et des réflexes lents; il peut être difficile pour elles d'aspirer l'air à la surface de l'eau tout en luttant contre le courant provoqué par l'aération.
Le même type de lordose a été observé sur d'autres poissons élevés en écloserie et ayant la vessie natatoire non activée: Acanthopagrus schlegeli (KITAJIMA, 1979), Lateolabrax japonicus (HAYADHIDA et al., 1984), Sparus sarba (KITAJIMA, non publié), et les causes et mécanismes semblent être semblables à ceux concernant la daurade.
Une vingtaine d'années ont passé depuis introduction du rotifère Branchionus plicatilis, comme aliment pour l'élevage de larves de poissons marins par ITO (1960). Ensuite, la technique d'élevage de la daurade japonaise a progressé rapidement en parallèle à l'amélioration des techniques de reproduction des rotifères.
Il existe 2 types de rotifères élevées dans tout le Japon. Le premier, appelé S-type, est relativement petit (longueur de la lorica 150 υm) et sa lorica qui possède des épines pointues dans la partie antérieure est de forme ronde, alors que le second, appelé L-type, est de taille supérieure (250 υm), a une forme plus allongée et des épines antérieures moins pointues. Les premiers croissent activement à une température de 20 à 27∅C, alors que la température adéquate pour les derniers est de 10 à 17∅ C.
De récentes études ont montré que ces deux rotifères appartiennent a des souches génétiques différentes et sont classés en sous-espèces: Brachionus plicatilis rotundiformis (S-type) et B. plicatilis typicus (L-type) (SUZUKI, 1983).
La quantité maximale de rotifères produits quotidiennement dans une écloserie atteint plusieurs milliards. C'est pourquoi, récemment, de grands bassins de 50 à 150 m3 ont généralement été utilisés pour l'élevage de rotifères. La densité maximale d'élevage est habituellement de 150 – 300 rot/ml de S-type et de 100 – 150 rot/ml de L-type.
Il existe deux méthodes pour la culture massive de rotifères, méthode en semi-continu ou en discontinu.
Dans la première méthode, les rotifères sont récoltés quotidiennement suivant le taux de croissance journalier qui est de 10 à 25%. Les rotifères sont récoltés en faisant passer l'eau au travers d'un filet à maille fine. La même quantité d'eau contenant de la Chlorella à une concentration de 107 à 2 times 107 cell./ml est ajoutée dans le bassin. Généralement, la méthode en semi-continu est poursuivie durant une période de 1 à 2 semaines, après quoi toute la population est récoltée.
Dans la seconde méthode, tous les rotifères sont récoltés à la densité maximale qui est atteinte plusieurs jours après l'inoculation initiale (densité de 100 rot/ml). Une partie de ces rotifères est utilisée pour inoculer un nouveau volume. Dans cette méthode, plusieurs bassins sont utilisés en rotation. Cette méthode présente l'avantage de systématiser la production de rotifères.
La Chlorella marine, la levure de boulanger et ω-levure sont généralement utilisées comme aliment pour les rotiféres. Chlorella est le meilleur aliment mais son élevage requiert une grande quantité de bassins. Si Chlorella est utilisée seule comme aliment pour les rotifères, le volume total nécessaire est de 1,5 à 2 fois le volume des bassins d'élevages des rotifères. La production de rotifères, a considérablement augmente a la suite de la substitution de Chlorella par la levure. Chorella est toujours nécessaire pour stabiliser les cultures de rotifères, elle est surtout essentielle pour les premiers jours de l'élevage (1 à2 jours).
Les fertilisants agricoles suivant sont généralement ajoutés dans le milieu de culture de la Chlorella: sulphate d'ammonium: 100 g; superphosphate 10 -20g; urée: 10 g; agent chélatant: 5 – 10 g/m3 d'eau.
Les résultats obtenus au “HIROSHIMA Prefectural Fish Farming Center”, (d'avril á juillet 1982, ont permis d'identifier une méthode pratique de production de rotifèeres, Le Centre utilises 8 bassins extérieurs de 150 m3 chacun (1 200 m3 au total) pour la culture des rotifères et 12 autres bassins extérieurs de 200 m3 chacun (2 400 m3 au total), pour les cultures de Chlorella. La période pour la récolte complète était de 5 jours après l'inoculation. La Chlorella était utilisée seulement le jour de l'inoculation et le lendemain. Les jours suivants, on distribuait seulement de la ω-levure. La population était composèe d'un mélange de rotifères L-type et S-type et les premiers étaient dominants en mai et en juin alors que les derniers dominaient fin-juin et juillet. La récolte totale était de 1 200 x 109 (±2,5 m3), la récolte/jour était de 19,2 x 109 individus et cela a permis de produire 6,3 x 106 alevins de daurade et 4 x 106 crabes bleus, Portunus trituberculatus (FUSHIMI, 1982).
Bien que les copépodes marins soient une nourriture très importante pour les post-larves et les alevins de daurade, une technique complète de culture massive n'a pas encore pu être mise au point.
Toutefois, il faut noter qu'il est possible d'élever de façon massive le T. japonicus en combinaison avec les rotifères sur des périodes de 2á 3 mois. En utilisant comme aliment la levure, la densité de T. japonicus s'accroît jusqu à 20 à 30 ind/ml en 3à semaines après l'inoculation. Il est possible de récolter 2 kg de cette espèce chaque jour, sur une période de 50 jours, dans un bassin de 200 m3 (FUKUSHD, 1978).
Certains problèmes restent encore à résoudre.
D'abord, il est nécessaire de systématiser le procédé dé production d'alevins en automatisant les opéerations, que ce soit l'élevage massif de larves et d'alevins ou celui de l'aliment vivant. Pour cela, les aliments vivants, particulièrement les rotifères doivent être remplacés par un aliment artificiel.
De plus, il est important de clarifier les causes et de rémédier aux mortalités élevées rencontrées dans l'élevage des larves et des alevins des daurades japonaises.
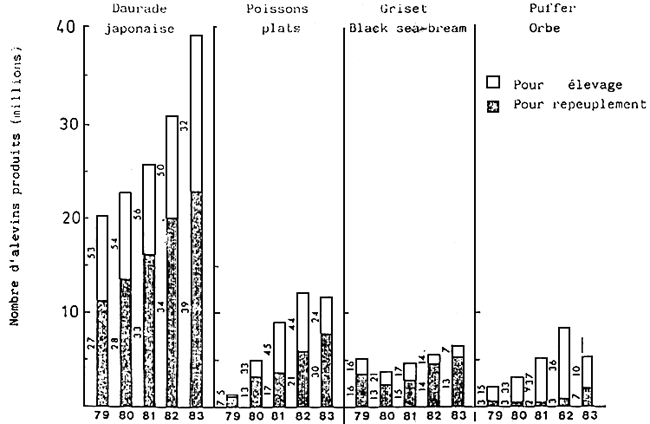
Fig. 1 - Nombre d'alevins produits en écloserie au Japon. Les chiffres indiquent le nombre d'écloseries qui produisent des alevins de différentes espèces.
 | 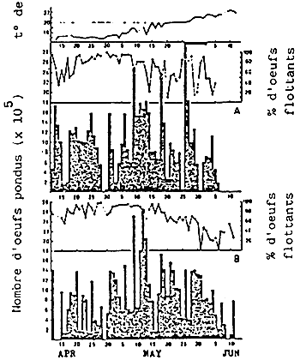 |
| Fig. 2 - Localisation des écloseries nationales et préfectorales (°) | Fig. 3 - Changements journaliers du nombre d'oeufs pondus par la daurade japonaise, en bassins extérieurs de 40 m3, avec respectivement 20 femelles et 20 mâles (A) et 30 femelles et 31 mâles (B). |
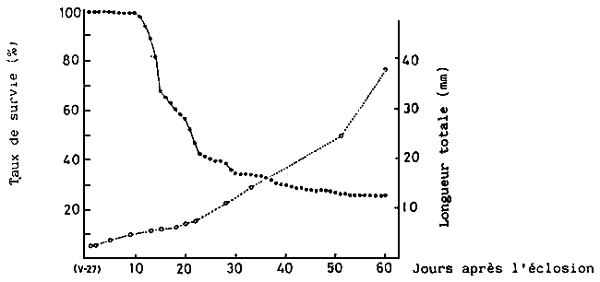
Fig. 5 - Croissance et taux de survive de la daurade japonaise en élevage.
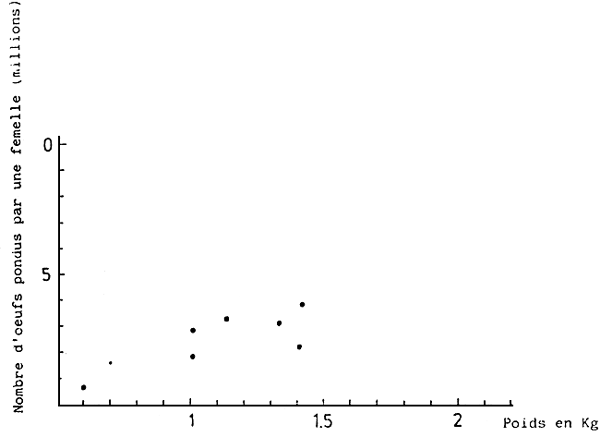
Fig. 4 - Relation entre le poids d'une femelle et le nombre d'oeufs pondus durant une saison de reproduction.
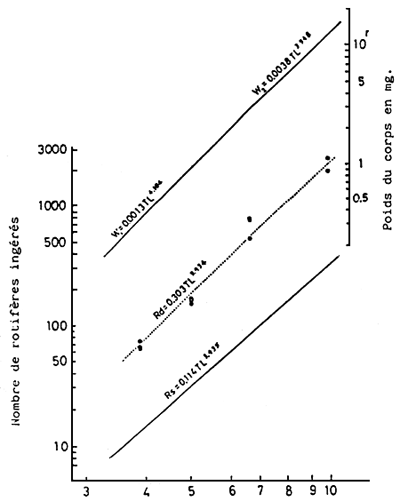 | 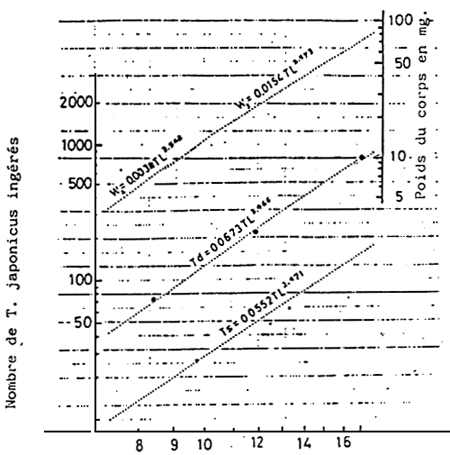 | ||
| Fig. 6 - | Relation entre la longueur totale et la quantité rassasiante (Rs) ou la quantité d'aliment quotidien (Rd) en rotifères, pour les larves de daurade. | Fig. 7 - | Relation entre la longueur totale et la quantité rassasiante (Ts) ou la quantité d'aliment quotidien (Td), en Tigriopus japonicus pour les larves et les alevins de daurade. |
Tableau 1 - Certains acides gras sur le total ses lipides du rotifère brachionus plicatilis élevé avec de la levure de boulanger, Saccharomyces cerevistae et de la Chlorella marine, au NAGASAK. Prefectoral institute of Fisheries, de 1975 à 1977 (en pourcentage)
| Acide gras | November 1975 | Mai 1977 | Mai 1977 | ||||||
| Levure | Levure+chlorelle | chlor | Levure | Levure+Chlorelle | Chlor | Levure | Levure+Chlorelle | Chlor | |
| 16:0 | 6.1 | 4.2 | 14.4 | 7.1 | 13.2 | 19.4 | 8.7 | 11.7 | 16.6 |
| 16:1ω7 | 27.2 | 26.7 | 20.4 | 26.5 | 22.6 | 22.4 | 24.7 | 16.6 | 24.3 |
| 18:0 | 3.5 | 4.4 | 2.2 | 4.3 | 3.6 | 1.9 | 4.8 | 6.0 | 1.7 |
| 18:1ω9 | 26.8 | 25.8 | 10.1 | 29.1 | 21.5 | 11.0 | 33.8 | 22.8 | 10.1 |
| 18:2ω6 | 8.8 | 5.1 | 4.7 | 6.9 | 6.3 | 3.4 | 6.8 | 10.4 | 3.2 |
| 18:3ω3 | 0.6 | 0.8 | 0.1 | 0.2 | 0.5 | 0.2 | 0.8 | 2.2 | 0.4 |
| 20:1 | 3.8 | 3.4 | 1.7 | 4.2 | 4.1 | 2.3 | 6.0 | 3.3 | 2.4 |
| 20:4ω6 | 2.0 | 2.3 | 4.1 | 0.9 | 3.0 | 4.2 | 0.4 | 2.3 | 4.4 |
| 20:4ω3 | 0.4 | 0.6 | 0.2 | 0.4 | 0.4 | tr | 0.5 | 0.8 | 0.2 |
| 20:5ω3 | 1.5 | 11.8 | 27.7 | 1.4 | 11.1 | 22.8 | 1.0 | 8.1 | 24.1 |
| 22:1 | 0.9 | 2.1 | 1.8 | 0.9 | 0.4 | 0.4 | 1.7 | 1.6 | 1.3 |
| 22:5ω3 | 0.3 | 1.8 | 3.0 | tr | 2.9 | 3.4 | 0.2 | 1.7 | 3.8 |
| 22:6ω3 | 0.5 | 0.5 | tr | tr | tr | tr | 0.5 | 0.9 | 0.5 |
| ∑ω3HUFA | 3.1 | 14.7 | 30.9 | 2.7 | 14.4 | 26.2 | 2.2 | 11.3 | 28.8 |
| Lipid τ | 1.4 | 2.8 | 3.7 | 1.7 | 2.2 | 4.2 | 2.3 | 2.3 | 3.8 |
Tableau 2 - Effets sur la valeur nutritive de daurades alimentées avec des rotifères
élevés avec de la levure de boulanger et, secondairement, avec de la
Chlorella marine. Changements dans la distribution des acides gras sur
les lipides totaux dans ces rotifères.
(KITAJIMA et al., 1979; WATANABE et al., 1979)
| Rouferes | Nombre de poissons | Longueur (mm) totale à la fin de l'alimentation | Taux de survie (%) | % survie après le test d'activité | Contenu en 20: 5w 3 (%) | |
| Experiment I | ||||||
| Y-rotifer | 23000 | 5.38±0.53 | 20.2 | 9.2 | ** | 3.2 |
| Y 10mC | 23000 | 6.18±.0.49 | 58.7 | 54.3 | - | |
| Y 30mC | 23000 | 7.68±0.61 | 71.7 | 67.8 | - | |
| Y 60mC | 23000 | 7.79±0.76 | 76.1 | 60.7 | - | |
| Y 2h C | 23000 | 8.01±0.54 | 65.4 | 94.3 | 8.7 | |
| C -rotifer | 23000 | 8.76±0.55 | 79.8 | 99.8 | 27.0 | |
| Experiment II | ||||||
| Y-rotifer | 24000 | 4.56±0.30 | 22.1 | 45.6 | *** | 3.2 |
| Y 2h C | 24000 | 5.98±0.52 | 49.5 | 79.2 | 8.7 | |
| Y 6h C | 24000 | 6.31±0.54 | 50.9 | 90.7 | 10.9 | |
| Y 6h C | 24000 | 5.03±0.45 | 50.8 | 82.4 | 4.8 | |
| Y 12h C | 24000 | 6.76±0.38 | 49.6 | 87.9 | 12.8 | |
| Y 24h C | 24000 | 7.03±0.01 | 60.4 | 96.1 | 16.7 | |
| C-rotifer | 24000 | 7.15±0.52 | 56.1 | 92.7 | 27.0 | |
Tableau 3 - Certains acides gras de levure de boulanger, avec supplément d'huile de fore de seiche (ω - levure). Les rotifères sont cultivés avec ces levures.
| Acides gras | Levures de boulanger | ω - levure | Rotiteres cultivés | |
| levure de boulanger | ω-levure | |||
| 16:0 | 8.3–20.0 | 13.4–16.9 | 6–7 | 10–12 |
| 16:1ω7 | 14.2–38.2 | 6.0–6.6 | 26–27 | 10–11 |
| 18:0 | 3.4–8.4 | 2.3–2.6 | 3–4 | 2–3 |
| 18:1ω9 | 26.1–43.9 | 15.5–16.4 | 26–30 | 22–24 |
| 18:2ω6 | 2.8–15.1 | 1.0–1.1 | 7–9 | 2–4 |
| 18:3ω3 | 0.5–6.4 | 0.8–0.9 | 0.7–0.8 | |
| 20:1 | 1–1.6 | 8.4–9.2 | 3–4 | 8–10 |
| 20:3ω3 | 3.0–3.4 | 1–2 | 3–4 | |
| 20:5ω3 | 13.4–17.4 | 1–2 | 9–12 | |
| 22:5ω3 | 0.9–1.4 | 0–0.4 | 2–3 | |
| 22:6ω3 | 12.8–15.6 | 7–9 | ||
| ∑ω3 HUFA | 33.5–35.8 | 25–26 | ||
| Lipid % | 1.0–1.6 | 12.3–15.6 | 1.4–1.9 | 3.3–6.4 |
Tableau 4 - Comparaison de la croissance et du survie de larves de daurades alimentées avec des rotifères cultivés avec de la levure ou de laω-levure.
| Rotiferes utilisés | Nombre de larves | Longueur totale â la fin(mm) | taux de survie (%) | Survie après le test d'activité (%) | |
| Expt. I | ω levure | 30 000 | 9.28±0.77 | 73.5 | 86.0 |
| levure | 30 000 | 7.10±0.78 | 13.0 | 12.5 | |
| Expt. II | ω levure | 15 000 | 10.11±0.87 | 76.2 | 92.9 |
| Chlorella | 15 000 | 10.21±1.60 | 57.1 | 91.7 | |
| Y 12 h C | 15 000 | 9.11±1.24 | 27.9 | 93.2 | |
| Expt. III | ω levure | 24 000 | 10.32±1.28 | 76.9 | 92.5 |
| Chlorelle | 24 000 | 9.78± | 70.1 | 91.5 | |
| Y3h C | 24 000 | 8.85±1.09 | 27.6 | 55.8 | |
| Expt.IV | ω levure | 10 000 | 10.91±0.94 | 68.9 | 95.5 |
| 10 000 | 6.24±0.62 | 3.2 | 46.9 |
Tableau 5 - Certains acides gras d'oeufs d'Artemia en provenance de différents sites (WATANABE et al., 1982)
| Acides gras | San Fracisco | Brazil | Tien-tain | ||||||
| A | B | C | A | B | C | A | B | C | |
| 14:0 | 3.6 | 1.3 | 2.1 | 3.3 | 3.4 | 2.1 | 3.0 | 2.8 | 2.0 |
| 16:0 | 25.9 | 14.9 | 23.7 | 18.0 | 18.2 | 13.7 | 12.1 | 12.7 | 12.7 |
| 16:1ω6 | 12.9 | 5.5 | 7.4 | 18.6 | 14.4 | 13.8 | 22.8 | 24.0 | 22.4 |
| 18:0 | 3.7 | 3.5 | 4.1 | 1.8 | 2.9 | 3.2 | 3.5 | 2.8 | 3.3 |
| 18:1ω9 | 19.6 | 28.0 | 23.7 | 21.8 | 23.7 | 28.8 | 26.2 | 20.2 | 28.3 |
| 18:2ω6 | 2.5 | 8.3 | 5.4 | 7.2 | 6.4 | 8.5 | 4.1 | 3.8 | 4.4 |
| 18:3ω3 | 4.8 | 22.4 | 14.7 | 3.3 | 1.1 | 3.2 | 5.5 | 6.0 | 5.1 |
| 18:4ω3 | 0.6 | 0.8 | 0.8 | 2.7 | 3.2 | 4.5 | 0.9 | 1.0 | 0.7 |
| 20:1 | 1.1 | 0.3 | 1.0 | 0.9 | 1.2 | 0.4 | 0.2 | 0.4 | - |
| 20:4ω6 | 0.6 | 0.8 | 0.0 | 2.7 | 3.2 | 4.5 | 1.2 | 1.1 | 1.3 |
| 20:5ω3 | 0.9 | 2.7 | 0.8 | 3.8 | 3.5 | 3.9 | 9.2 | 10.2 | 11.3 |
| 22:1 | 0.3 | 0.6 | 0.0 | 0.7 | 1.0 | 0.4 | - | - | - |
| 22:6ω3 | 0.2 | 0.1 | 0.1 | 0.4 | 0.8 | tr | - | - | - |
| ω3 HUFA | 1.1 | 3.0 | 1.2 | 4.1 | 4.1 | 0.3 | 9.2 | 10.2 | 11.3 |
 |  |
| période de culture en heures |
Fig. 8 - Méthode directe pour améliorer la valeur nutritive de l'aliment vivant.
Fig. 9 - Incorporation de lipides émulsionnés avec différents types de réactifs (A, B, C et D) dans les rotifères par la méthode directe. Reproduction autorisée par Bull. jap. Soc. Sci. Fish. WATANABE et al., 1983.
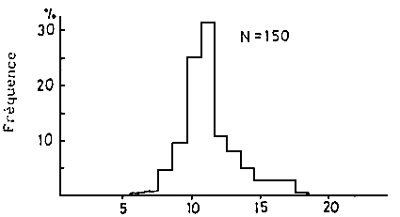
Fig.10 - Point de courbure du squelette dans les lordoses de la daurade
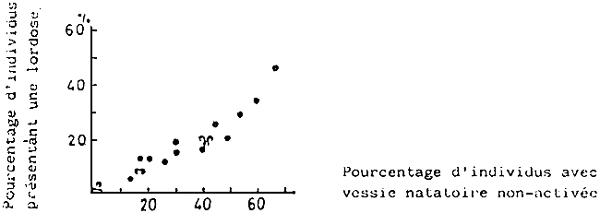
Fig. 12 - Relation entre la vessie natatoire non activée et les déformations (lordoses) dans 20 groupes de jeunes daurades d'une taille de 50 mm (L. T)
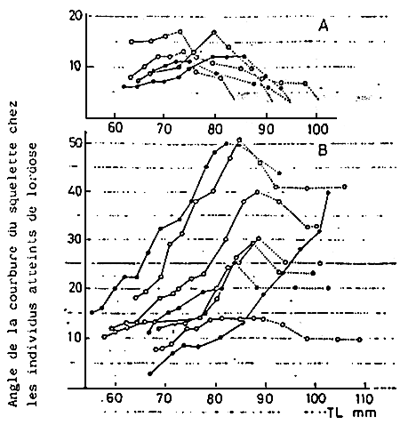
Fig. 13 - Changement de l'angle de courbure (lordose), par des observations répétées. Les continus montrent la période pendant laquelle la vessie natatoire n'est pas activée alors que les traits discontinus représentent la période où la vessie natatoire est normalement activée.
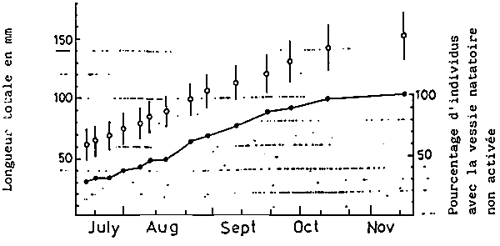
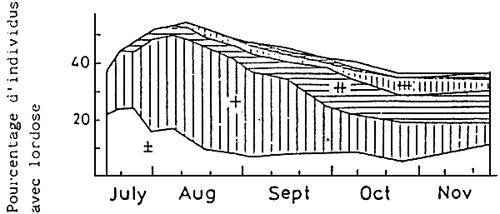
Fig. 11 - Variations en pourcentage de daurades marquées ayant la vessie natatoire activée et des déformités (lordose)
| + = | 10° > Courbure du squelette |
| + = | 10° > 20° |
| ++ = | 20° < 30° |
| +++ = | 30° > 40° |
Tableau 6 - Variations dans les déformations de daurades produites à l'Aquaculture Research Laboratory of NAGASAKI Prefectoral Institution of Fisheries, durant plusieurs années.
| Année | 1974 | 1975 | 1976 | ||
| Nombre d'alevins produits X 103 | 420 | 270 | 490 | ||
| Date des examens | 12 | 1 sept | 26 | ||
| 30 | |||||
| Nombre de poissons examinés | 497 | 152 | 1024 | ||
| Longueur totale (mm) | 93.3 | 118 | 64.9–112.3 | ||
| Arc de l'angle | |||||
| <10 | 3.4 | 4.6 | 4.5 | ||
| Lordoses | %<20 | 20.5 | 13.2 | 8.3 | |
| <30 | 9.3 | 7.9 | 2.3 | ||
| 30> | 8.2 | 3.3 | 1.9 | ||
| Total | 41.4 | 28.9 | 17.0 | ||
| Taille rèduite | 2.8 | 2.0 | 5.7 | ||
| Autres difformités | 5.0 | 5.9 | 6.5 | ||
| Total | 49.2 | 36.8 | 29.0 | ||
Tableau 7 - Quantité de larves de daurades avec vessie natatoire activée, élevées dans bassins fermés par une couche de paraffine, ou en bassins ouverts (Exp. 1)
| Date (Jours après 1'éclosion) | Bassin + paraffine | Bassin ouvert | ||||
| N | TL (X-S D) (mm) | (%) | N | TL (mm) | (%) | |
| May 6(8) | 9 | 3.61±0.17 | 0 | 9 | 3.61±0.17 | 0 |
| 8(10) | 28 | 3.95±0.14 | 0 | 23 | 3.98±0.22 | 41.7 |
| 10(12) | 30 | 4.12±0.21 | 0 | 30 | 4.29±0.27 | 73.3 |
Tableau 8 - Quantité de larves de daurades avec vessie natatoire activée, élevées dans des bassins fermés par une couche de paraffine, ou en bassins ouverts (Exp. 2)
| Date (Jours après l' éclosion) | Bassins + Paraffine | Bassin ouvert (C) | |||||||
| Sans aération | Aération (B) | ||||||||
| N | TL (mm) | (%) | N | TL (mm) | (%) | N | TL (mm) | (%) | |
| May 15(8) | 27 | 3.70±0.70 | 0 | 23 | 3.92±0.40 | 0 | 26 | 3.82±0.26 | 53.3 |
| 17(10) | 28 | 3.91±0.32 | 0 | 28 | 4.37±0.24 | 0 | 23 | 4.11±0.25 | 76.7 |
| 19(12) | 25 | 3.93±0.26 | 0 | 29 | 4.74±0.44 | 0 | 27 | 4.62±0.55 | 65.5 |
| 21(14) | 30 | 5.33±0.51 | 0 | 29 | 5.21±0.46 | 70.0 | |||
| 23(16) | 30 | 5.75±0.48 | 0 | 30 | 5.49±0.50 | 31.8 | |||
| 25(18) | 30 | 6.11±0.48 | 0 | 30 | 6.30±0.56 | 90.0 | |||
| 29(22) | 30 | 7.38±0.53 | 0 | 25 | 7.52±0.89 | 92.0 | |||
Tableau 9 - Quantité de larves de daurades avec vessie natatoire activée, élevées dans des bassins dont la surface a été agité à l'aide d'un vent, lateur, ou en bassins normaux (Exp. 3)
| Date (jours après l'éclosion) | Bassin + agitation en surface | Bassin sans agitation | ||||
| N | TL (mm) | (%) | N | TL (mm) | (%) | |
| Jun. 9(4) | 18 | 3.28±0.12 | 0 | 22 | 3.28±0.14 | 9.1 |
| 11(6) | 30 | 3.63±0.18 | 3.3 | 30 | 3.70±0.20 | 46.7 |
| 13(8) | 23 | 4.06±0.18 | 0 | 29 | 4.08±0.27 | 69.0 |
| 16(11) | 30 | 5.08±0.37 | 0 | 28 | 5.24±0.45 | 60.7 |
| 20(15) | 30 | 6.84±0.54 | 6.7 | 30 | 6.62±0.60 | 66.7 |
| 27(22) | 30 | 11.37±1.50 | 13.3 | 30 | 11.92±1.09 | 73.3 |
| Jul. 1(26) | 30 | 17.34±1.95 | 10.0 | 32 | 17.39±1.83 | 84.4 |
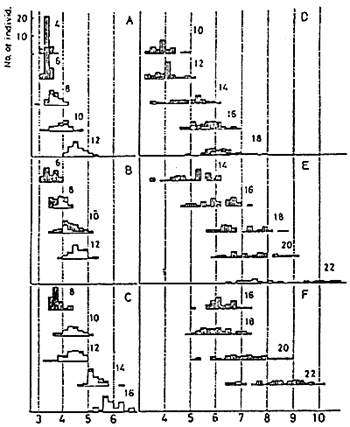
Fig. 14 - Comparaison de l'activation de la vessie natatoire dans un groupe
de daurades transférées dans des bassins ayant une surface libre après un
élevage, dans des bassins dont la surface était recouverte de paraffine,
pendant 2 à 16 jours après l'éclosion (A - F). Les chiffres dans le graphique
indiquent les jours après jours après l'éclosion au moment ou les larves ont été transférés.
En gris: individus avec vassie natatoire non activée
En blanc: Individus avec vessie natatoire activée
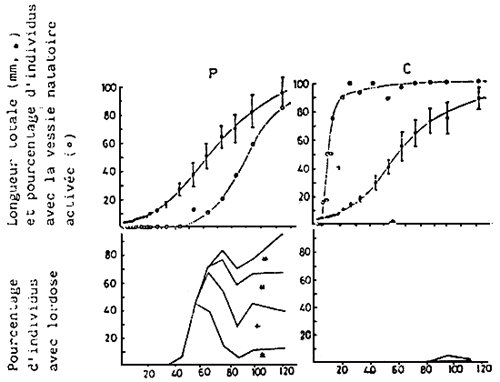
Fig. 15 - Comparaison du pourcentage d'individus avec vessie natatoire activée
et de la difformité (lordose) des larves de daurades élevées en
bassins recouverts de paraffine liquide (p) et en bassins “libres”(C).
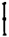 = moyenne ± S D (n = 30 ). Les degrés des lordoses sont exprimées par l'angle supplémentaire
au point de courbure: ±, <10°; +, 10° à 20°; -, 20° à 30°; - 30° à 40°.
= moyenne ± S D (n = 30 ). Les degrés des lordoses sont exprimées par l'angle supplémentaire
au point de courbure: ±, <10°; +, 10° à 20°; -, 20° à 30°; - 30° à 40°.
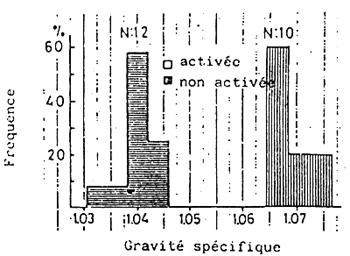
Fig. 17 - Comparaison de la gravité spécifique des larves de daurades avec ou sans vessie natatoire activée.
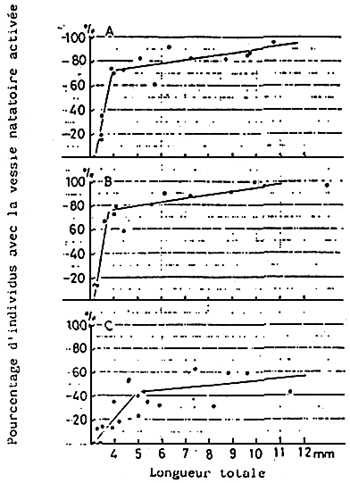
Fig. 16 - Comparaison du pourcentage de vessies natatoires non activées chez les larves de daurades alimentées respectivement avec de la “Chlorella rotifère” (A), de la “- levure rotifère” (B) et de la “Y 3C rotifère” (C).
BIBLIOGRAPHIE
ARAKAWA, T., T. YOGATA, and T. WATANABE, 1979. Rearing of larvae of puffer (Fugu rubripes rubripes) by rotifer (Brachionus plicatilis) cultured with various foods. Bull. NAGASAKI Pref. Inst. Fish. 5: 5–8(In Japanese with English synopsis).
COWEY, C.B., J.M. ADRON, and C. MIDDLETON, 1976. Studies on the nutrition of marine flat fish. The effect of different dietary fatty acids on the growth and fatty acid composition of turbot Scophthalmus maximus). Br. J. Nutr. 36: 479 – 486.
FUJITA, S., T. WATANABE, and C. KITANJIMA, 1988. Nutritional quality of Artemia from different localities as living feed for marine fish from the view point of essential fatty acids. The brine shrimp Artemia. 3. Ecology, culturing, use in aquaculture. PERSOON G., P. SORGELOOS, O. ROELS, and E. JASPERS, Universa Press, Wetteren Belgium: 456 p.
FUKUSHO, Y., H. IWAMOTO, M. MATSUOKA, and M. IMADA, 1978a. The mass production of juveniles of the period fish, Oplegnatus Fasciatus, using the rotifer Brachionus plicatilis fed on the special yeast. The aquaculture, 26 (2) 71 – 81(In Japanese with English synopsis).
FUKUSHO, K., H. IAWAMOTO, T. SEIKAI, and C. KITAJIMA. 1978b. Effect of initial supply of Chlorella sp, on the copepod Tigriopus japonicus production in combination with the rotifer Brachionus plicatilis, feeding baker's yeast. Bull. NAGASAKI Pref. Inst. Fish., 4: 47 – 56. In Japanese with English synopsis).
FUSHIMI T. 1975. Foods. Feeding and development of fish larvae and fry (Edited by Japan Soc. Sci. Fish.) KOSEISHA - KOSEIKAKU, TOKYO: 122 (In Japanese).
FUSHIMI, T. 1982. Rotifer culture in HIROSHIMA Prefectural Fish Farming Center (Personal communication).
HAYASHIDA, G., Y. TSUKASHIMA, K. MATSUKIYO, and C. KITAJIMA, 1984. Relationship between swim bladder un inflation and lordotic deformity in hatchery reared Japanese sea bass, Lateolabrax japonicus. NAGASAKI Pref. Inst. Fish., 10; 35 – 40. (In Japanese with English synopsis).
IMADA, O., Y. KAGEYAMA, T. WATANABE, C. KITAJIMA, S. FUJITA, and Y. YONE, 1979. Development of a new yeast as a culture medium for living feeds used in the production of fish seed. Bull. Japan. Soc. Sci. Fish., 45 (8) 955 – 959. (In Japanese with English synopsis).
ISEDA, H. 1982. Prevention of deformation in the juveniles of red sea-bream, Pagrus major reared in ponds - III. Relationship between the initial conditions of rearing environment and gas content in air bladder. Bull. KUMAMOTO Pref. Fish. Expr. Stn. 2: 25 – 46. (In Japanese).
ISEDA, R., M. ISHIHARA, S. SUMIDA, M. OWAKI and S. TABATA, 1979. Prevention of deformation in the juveniles of red sea bream, Pagrus major reared in ponds - II. Relationship between the initial rearing conditions and lordotic deformity. Bull. KUMAMOTO Pref. Fish. Exper. Stn. 1: 9 – 17 (In Japanese).
ITO, T. 1960. On the culture of maxohaline rotifer Brachionus plicatilis O. F. MULLER in the sea water. Rep. Fac. Fish. Mie Pref. Univ. 3(3) 708 – 740. (In Japanese with English synopsis).
KITAJIMA C. 1976. Amount of the copepod, Tigriopus japonicus consumed by red sea bream larvae, Pagrus major. Bull. NAGASAKI Pref. Inst. Fish. 2: 105 – 112. (In Japanese).
KITAJIMA, C. 1978. Acquisition of fertilized eggs and mass-culture of juvenile of red sea bream, Pagrus major. Special Rept. NAGASAKI Pref. Inst. Fish. 5: 1 – 91. (In Japanese with English synopsis).
KITAJIMA, C. 1979. Swim bladder deformity and lordosis in hatchery reared black sea bream, Acanthopagrus schlegeli. Bull. NAGASAKKI Pref. Inst. Fish 5: 27 – 32. (In japanese).
KITAJIMA, C., T. ARAKAWA, F. OOWA, S. FUJITA, O. IMADA, T. WATANABE, and Y. YONE, 1980a. Dietary value for red sea bream larvae of rotifer Brachionus plicatilis cultured with a new type of yeast. Bull. Japan. Soc. Sci. Fish., 46 (1): 43 – 46. (In Japanese with English synopsis).
KITAJIMA, C. S. FUJITA, F. OOWA, Y. YONE, and T. WATANABE, 1979. Improvement of dietary value for red sea bream larvae of rotifer Brachionus plicatilis cultured with baker's yeast Saccaromysea cerevisiae. Bull. Japan. Soc. Sci. Fish. 45(4): 469 – 471. (In Japanese with English synopsis).
KITAJIMA, C., K. FUKUSHO, R. RWAMOTO, and R. YAMAMOTO, 1976. Amount of rotifer, Brachionus plicatilis, consumed by red sea bream larvae, Pagrus major. Bull. NAKASAKI Pref. Inst. Fish., 2: 105 – 112. (In Japanese).
KITAJIMA, C., H. IWAMOTO, and S. FUJITA, 1977. Relation between curvature of vertebral column and undeveloped swim bladder in hatchery reared red sea bream, Pagrus major. Bull. NAGASAKI Pref. Inst. Fish., 3 – 23 – 32. (In Japanese).
KITAJIMA, C., H. IWAMOTO, and K. MATSUKIYO, 1975. Abnormity of hatchery-reared juvenile of red sea bream, Pagrus major. Bull. NAGASAKI Pref. Inst. Fish., 1: 19 – 27. (In Japanese).
KITAJIMA, C, and K. KODA, 1976. Lethal effects of the rotifer cultured with baking yeast on the larval red sea bream, Pagrus major, and the increase of survival rate using the rotifer recultured with Chlorella sp. Bull. NAGASAKI Pref. Inst. Fish. 2: 113 – 116. (In Japanese).
KITAJIMA, C., Y. TSUKASHIMA, S. FUJITA, T. WATANABE, and Y. YONE, 1981. Relationship between uninflated swim bladders and lordotic deformity in hatchery-reared red sea bream Pagrus major. Bull Japan. Soc. Sci., 47 (10): 1289 – 1294. (In Japanese with English synopsis).
KITAJIMA, C., M. YOSHIDA, and T. WATANABE, 1980b. Dietary value for ayu Plecoglossus altivelis of rotifer Brachionus plicatilis cultured with baker's yeast Saccaromyces cerevisiae supplemented with cuttlefish liver oil. Bull. Japan. Soc. Sci. Fish., 46(1): 47 – 50. (In Japanese with English synopsis).
SUZUKI, M., 1983. Taxonomical study on rotifers cultured for fry production. Zool. Mag., 91(4): 657. (In Japanese).
WATANABE., T., 1978. In “Dietary lipids in aquaculture” (Ed. by Japan Soc. Sci. Fish.), KOSEISHA - KOSEIKAKU, TOKYO: 93 – 111. (In Japanese).
WATANABE, T., T. ARAKAWA, C. KITAJIMA, S. FUJITA, 1978a. Nutritional evaluation of proteins of living feeds used in seed production of fish. Bull, Japan, Soc. Sci. Fish., 44(9): 985 – 988. (In Japanese with English synopsis).
WATANABE, T., T. ARAKAWA, C. KITAJIMA, and S. FUJITA, 1984a. Effect of nutritional quality of broodstock diets on reproduction of red sea bream. Bull. Japan. Soc. Sci. Fish., 50(3): 495 – 501.
WATANABE, T., T. ARAKAWA, C. KITAJIMA, K. FUKUSHO, and S. FUJITA. 1978b. Proximate and mineral composition of living feeds used in seed production of fish. Bull. Japan. Soc. Sci. Fish., 44 (9): 979 – 984. (In Japanese with English synopsis).
WATANABE, T., A. ITOH, C. KITAJIMA, and S. FUJITA. 1984b. Effect of dietary protein level on reproduction of red sea bream. Bull. Japan. Soc. Sci. Fish., 50 (6): 1 015 – 1 022.
WATANABE, T., A. ITOH, A. MURAKAMI, Y. TSUKASHIMA, C. KITAJIMA, and S. FUJITA. 1984C. Effect of nutritional quality of diets given to broodstock on the verge of spawning on reproduction of red sea-bream. Bull. Japan. Soc. Sci. Fish., 50(6): 1 023 – 1 028.
VATANABE. T., A. ITOH, S. SATOH, C. KITAJINA, and S. FUJITA, 1985a. Effect of dietary protein levels and feeding period before spawning on chemical components of eggs produced by red sea bream broodstock. Bull. Japan. Soc. Sci. Fish., 51(9): 1 501 – 1 509.
WATANABE, T., C. KITAJIMA, T. ARAKAWA, K. FUKUSHO, and S. FUJITA. 1978c. Nutritional quality of rotifer Brachionus plicatilis as a living feed from the view point of essential fatty acids for fish, Bull. Japan. Soc. Sci. Fish., 44(10): 1 109 – 1 114. (In Japanese with English synopsis).
WATANABE, T., T. KOIZUMI, B. SUZUKI, S. SATOH, T. TAKEUCHI, N. YOSHIDA, T. KITADA, Y. TSUKASHIMA. 1985b. Improvement of quality of red sea bream eggs by feeding broodstock on a diet containing cuttlefish meal or on raw krill shortly before spawning. Bull. Japan. Soc. Sci. Fish., 51(9) 1 511 – 1 521.
WATANABE, T., F. OOWA, C. KITAJIMA, and S. FUJITA. 1978d. Nutritional quality of brine shrimp, Artemia salina, as a living feed from the view point of essential fatty acids for fish, Bull. Japan. Soc. Sci. Fish., 44 (10): 1 115 – 1521. (In Japanese with English synopsis).
WATANABE, T., F. OOWA, C. KITAJIMA, and S. FUJITA. 1980. Relationship between dietary value of brine shrimp Artemia salina and their content of ω 3 highly Unsaturated fatty acid. Bull. Japan. Soc. Sci. Fish., 46(1): 35 – 41.
WATANABE, T., M. OOWA, C. KITAJIMA, and S. FUJITA, 1982. Improvement of dietary value of brine shrimp Artemia salina for fish larvae by feeding them on w 3 highly unsaturated fatty acid. Bull. Japan. Soc. Sci. Fish., 48(12): 1 775 – 1 782.
WATANABE, T., F. OOWA, C. KITAJIMA, S. FUJITA, and Y. YONE, 1979. Relationship between the dietary value of rotifers Brachionus plicatilis and their content of w 3 highly unsaturated fatty acids. Bull. Japan. Soc. Sci. Fish., 45(7) - 883 – 889. (In Japanese with English synopsis).
YAMASHITA, K. 1966. Fundamental studies for the culture of Chrysophrys major IV. On disease of larval and young fish (2). Abnormal expansion of the swim bladder. Bull. Japan. Soc. Sci. Fish., 32(12): 1 006 – 1 014. (in Japanese with English synopsis).
YONE, Y., and M. FUJII, 1975a. Studies on nutrition of red sea bream-XI. Effect of w 3 fatty acid supplement in a corn oil diet on growth rate and feed efficiency. Bull. Japan. Soc. Sci. Fish., 41(1): 73 – 77.
YONE, Y., and M. FUJII, 1975b. Studies on nutrition of red sea bream-XII. Effect of w 3 fatty acid supplement in a corn oil diet on fatty acid composition of fish. Bull. Japan. Soc. Sci. Fish.,41(1): 79 – 86.