Propriétés physiques
C'est un liquide fumant à l'air si la teneur en H Cl est supérieure à 20%.
Les acides purs sont incolores et limpides. Les acides techniques sont légèrement colorés en jaune.
Concentration commerciale:
Propriétés chimiques
C'est un acide fort: il se dissocie totalement.
Il attaque la plupart des métaux avec un dégagement d'hydrogène (les métaux très purs sont peu attaqués), c'est pour cette raison qu'il est utilisé pour décaper.
Les molécules d'H Cl se dissolvent dans l'eau avec dégagement de chaleur.
Propriétés détergentes
Très bon pouvoir détartrant
Léger abaissement de la tension superficielle: (68,7 dynes/cm)-1 à 5%
Dissolution du fer: 734 g/m2/heure (solution à 15%)
Pas de fonction passivante
Pas de fonction dispersante
Pas de pouvoir oxydant
Réservé aux grosses opérations de détartrage mais dans ce cas, il convient d'utiliser des produits complets comportant, entre autres, des inhibiteurs de corrosion
C'est un des acides les plus courants, seulement, il est d'une utilisation difficile par les vapeurs corrosives qu'il émet. Même sur l'inox, il présente de gros risques de corrosion (piqûres)
| Acide chlorhydrique | HCl | ||||||||
| Poids moléculaire 36,47 | |||||||||
| Densité D 20° 4° | % en poids HCl | Densité D 20° 4° | % en poids HCl | Densité D 20° 4° | % en poids HCl | Densité D 20° 4° | % en poids HCl | Densité D 20° 4° | % en poids HCl |
| 1,000 | 0,3600 | 1,045 | 9,510 | 1,085 | 17,45 | 1,125 | 25,22 | 1,165 | 33,16 |
| 1,005 | 1,360 | 1,050 | 10,52 | 1,090 | 18,43 | 1,130 | 26,20 | 1,170 | 34,18 |
| 1,010 | 2,364 | 1,055 | 11,52 | 1,095 | 19,41 | 1,135 | 27,18 | 1,175 | 35,20 |
| 1,015 | 3,374 | 1,060 | 12,51 | 1,100 | 20,39 | 1,140 | 28,18 | 1,180 | 36,23 |
| 1,020 | 4,388 | 1,065 | 13,50 | 1,105 | 21,36 | 1,145 | 29,17 | 1,185 | 37,27 |
| 1,025 | 5,408 | 1,070 | 14,495 | 1,110 | 22,33 | 1,150 | 30,14 | 1,190 | 38,32 |
| 1,030 | 6,433 | 1,075 | 15,485 | 1,115 | 23,29 | 1,155 | 31,14 | 1,195 | 39,37 |
| 1,035 | 7,464 | 1,080 | 16,47 | 1,120 | 24,25 | 1,160 | 32,14 | 1,198 | 40,00 |
| 1,040 | 8,490 | ||||||||
Propriétés physiques
Liquide visqueux et incolore
Concentration commerciale: 75 à 85%
à 85% d = 1,69
à 75% d = 1,58
Soluble dans l'eau et dans l'alcool
Propriétés chimiques
C'est un triacide non oxydant. Il est moins agressif et plus faible que les autres acides minéraux, mais attaque quand même, les métaux ferreux, l'aluminium et le zinc.
Propriétés détergentes
Il est sans conteste le meilleur détergent et en milieu acide phosphorique, il est possible d'utiliser de nombreux tensio-actifs. Cependant tous les tensio-actifs moussent en milieu acide et pour obtenir la même efficacité qu'en milieu alcalin, il faut souvent utiliser des concentrations dix fois plus élevées. Les tensio-actifs auront un effet inhibiteur en présence des métaux mais cet effet sera très variable en fonction des impuretés du métal.
Il a une très bonne fonction dispersante.
Il n'abaisse pas la tension superficielle.
L'effet passivant dépend du pH (il augmente de pH 0 à pH 6).
H3 PO4 est utilisé quand l'emploi de l'acide nitrique est trop dangereux.
Bon pouvoir détartrant, remplace l'acide chlorhydrique trop dangereux d'emploi et trop corrosif.
Inconvénient: forme des sels calciques peu ou pas solubles.

Propriétés physiques
C'est un produit cristallin, blanc, stable, non hygroscopique et non corrosif. Il offre donc une grande facilité de manipulation et une grande sécurité d'emploi.
Solubilité:
à 0 °C: 14,68 g d'acide/100 g d'eau
à 20 °C: 21,32 g d'acide/100 g d'eau
à 60 °C: 37,10 g d'acide/100 g d'eau
à 80 °C: 47,08 g d'acide/100 g d'eau
La solubilité de l'acide sulfamique dans l'eau relativement faible à froid augmente avec la température.
Par contre, les sels de l'acide sulfamique sont extrêmement solubles dans l'eau.
La solubilité du sulfamate de calcium obtenue par action de l'acide sulfurique sur le carbonate de calcium est de: 79 g dans 100 g d'eau.
Sa solubilité dans l'eau est réduite par la présence d'acide sulfurique ou de sulfate de sodium.
L'acide sulfamique est pratiquement stable en solutions aqueuses à température ordinaire.
Propriétés chimiques
C'est un acide ayant une force comparable à celles des acides minéraux. Il se place entre les acides chlorhydrique et phosphorique.
Il attaque les métaux tels que l'acier doux, la fonte, le zinc et le magnésium, mais il est moins corrosif que les autres acides minéraux.
Les problèmes de piqûres et de fissures, inconvénients lorsqu'on emploie l'acide chlorhydrique, sont supprimés avec l'utilisation de l'acide sulfamique.
Il peut donc servir au nettoyage du matériel en acier inox, en cuivre, en laiton et, à l'occasion, en aluminium.
Propriétés détergentes
C'est un agent de nettoyage et de détartrage. Il sera utilisé dans les cas où les risques de corrosion sont très importants.
Il est utilisé dans les cas où la précipitation des sels insolubles doit être évitée.
On utilise l'acide sulfamique dans l'industrie laitière car le sulfamate de calcium est très soluble. (Il sera utilisé pour le nettoyage des machines à traire à l'eau bouillante).
L'acide sulfamique peut dissoudre son poids de carbonate de calcium.
Les produits servant à éliminer les voiles de ciment sur des sols neufs sont généralement à base d'acide sulfamique.
L'acide oxalique
C'est un diacide de formule COOH - COOH. Il est pulvérulent. Il entre dans la composition des produits acides pour enlever les taches de rouille sur les carrelages. Il est également utilisé pour enlever les taches de rouille sur les textiles.
Il peut entrer dans la formulation de certains produits de rénovation de l'acier inoxydable.
L'acide citrique
C'est un composé à fonctions multiples
(triacide mono alcool)

Il est pulvérulent. Il entre souvent dans la composition des produits de rinçage pour les tunnels de lavage ou les machines à laver industrielles.
Il peut également entrer dans la formulation de produits de rénovation de l'acier inoxydable.
L'acide fluorhydrique
De formule chimique HF. Il est utilisé en association avec l'acide nitrique pour le décapage acide de l'acier inoxydable. Pour cette application il est également possible d'utiliser du fluorure de sodium en remplacement de l'acide fluorhydrique à 65%.
L'acide acétique
Il se présente sous forme cristallisable (96–100% en poids; d = 1,06) ou sous forme diluée (30% en poids; d = 1,04). Il est utilisé dans la formulation de produits de rinçage dans les tunnels de lavage et dans les machines à laver la vaisselle industrielles.
La propriété fondamentale des solutions aqueuses d'agents de surface est une adsorption préférentielle en surface et aux interfaces. Dans la pratique, cela signifie que leur concentration y est plus importante qu'au sein même de la solution.
Les propriétés des agents de surface étant déterminées par leur structure, le caractère fondamental de ces produits est l'amphiphilie, c'est à dire la présence dans la molécule de deux groupements ayant des caractères de solubilité totalement différents:
Un groupement soluble dans l'huile ou les solvants qui est dit lipophile.
Un groupement soluble dans l'eau et insoluble dans l'huile qui est dit hydrophile.
Tous les agents de surface sont conformes à ce schéma et le trait d'union de ces produits très différents est bien leur amphiphilie.
Grâce à leur action sur la tension superficielle de l'eau, ils accélèrent très sensiblement la vitesse du nettoyage en permettant le mouillage, l'hydratation et le décollement rapide des souillures avant même qu'elles ne soient complètement dissoutes par les éléments minéraux contenus dans la solution détergente. Leur action est également très importante en désinfection car ce sont eux qui permettent le contact entre les principes désinfectants et les micro-organismes à détruire.
On distingue quatres grands types de tensio-actifs:
L'hydrophylie est amenée par des groupements polaires tels que O, OH, CoNH.
La plupart des tensio-actifs non ioniques utilisés dans les industries agro-alimentaires sont des produits de condensation d'un radical hydrophobe (qui est souvent un phénol ou un acide gras) et d'oxyde d'éthylène ou de propylène en présence de catalyseurs. Les dérivés d'oxyde d'éthylène sont les plus importants.
Dans la pratique industrielle, il ne se forme pas un composé défini mais un mélange d'homologues plus ou moins éthoxylés.
D'une façon générale, les agents de surfaces non ioniques moussent moins que les dérivés anioniques.
Contrairement aux ioniques, la solubilité des non ioniques diminue lorsqu'on augmente la température alors qu'ils donnent à froid des solutions limpides, elles se troublent à partir d'une certaine température appelée température de trouble.
Il est bon de remarquer que ce trouble correspond à une insolubilisation du produit, phénomène parfaitement réversible. On a constaté qu'au voisinage de cette température ces composés possèdent avec un pouvoir moussant minimum un pouvoir détergent maximum. Ces propriétés expliquent l'intérêt des non ioniques dans la fabrication des détergents à mousse contrôlée.
Leur champs d'application se trouve encore élargi du fait de leur stabilité en eaux dures et dans une large gamme de pH, toutefois limitée vers les milieux les plus alcalins où ils ont tendance à relarguer par hydrolyse, tout comme ils s'insolubilisent dans les solutions salines très concentrées.
Ce sont les plus utilisés à cause de leurs propriétés détergentes excellentes. Il en existe une multitude et leur nombre ne cesse de croître.
Le type de tensio-actif anionique le plus ancien est le savon. A l'heure actuelle, les savons sont de plus en plus abandonnés au profit des produits de synthèse ou naturels, sulfonés ou sulfatés.
Ils entrent dans la formulation des savons liquides pour les mains et pour les autres applications où le produit est en contact avec un épiderme (savon liquide moussant pour la mamelle des vaches).
Certains acides gras s'adsorbent très fortement sur les surfaces. Ils seront donc un élément capital pour la lubrification des chaînes transporteuses.
On reprochait aux tensio-actifs anioniques de mousser abondamment. Pendant très longtemps, ils n'ont pas pu être utilisés en aspersion. Aujourd'hui, des combinaisons judicieuses avec des non ioniques peu moussants ou antimousse permettent de les utiliser même en aspersion.
Ils entrent dans la composition de beaucoup de produits d'entretien général.
Leur pouvoir mouillant est augmenté par l'élévation de température, par contre, la présence d'électrolytes diminue cette propriété.
Les grandes familles de tensio-actifs anioniques sont:
i) Les sels des acides carboxyliques
Ils sont préparés par saponification des corps gras ou par neutralisation d'acides gras. Ils se présentent à l'état solide (savons de sodium) ou pour des applications particulières à l'état liquide ou pâteux (savon de potassium, d'ammonium, de triéthanolamines).
Les savons sont peu coûteux, stables en milieu alcalin, mais présentent l'inconvénient de précipiter avec des cations alcalino-terreux. L'utilisations des séquestrants permet maintenant d'éviter cette sensibilité aux eaux dures. Cependant, il existe aujourd'hui de nombreux anioniques ne présentant pas ce défaut qui sont souvent retenus de préférence aux savons.
ii) Les dérivés sulfonés
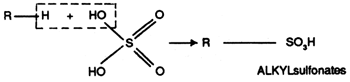
Les alkylbenzènes sulfonates (ABS) sont les premiers détergents anioniques synthétiques qui ont été fabriqués industriellement.
Ces ABS sont progressivement abandonnés en raison de leur biodégra-dabilité difficile liée à la structure ramifiée. Pour répondre aux législa-tions relatives à la biodégradabilité, de nouveaux procédés permettant la production d'alkylbenzènes à chaîne linéaire, ont été mis au point. Leur sulfonation conduit aux alkylbenzènes sulfonates linéaires (LAS).
iii) Les dérivés sulfatés
On les obtient en traitant l'alcool correspondant par H2 SO4

Les sulfates d'alcools gras sont en général de bons mouillants, de bons moussants, aux propriétés tensio-actives très actives.
iv) Les dérivés phosphatés
Ils ont un excellent pouvoir dispersant.
Ils possèdent un ou plusieurs groupements fonctionnels s'ionisant en solution aqueuse pour fournir des ions organiques chargés positivement et responsables de l'activité de surface. Du fait de leur coût de reviént élevé, ils sont généralement utilisés en désinfection.
Leur formule générale est:

R = longue chaîne hydrocarbonée;
R1; R2; R3: groupes à faible poids moléculaire;
X est un anion tel que Cl- ou Br-.
Les industries alimentaires utilisent les dérivés cationiques surtout en tant que désinfectants. Ils sont utilisés, soit seuls soit en présence de formol qui pallie leur faiblesse vis-à-vis des bactéries gram-.
Ils sont peu utilisés comme mouillants car ils sont trop réactifs avec les composés anioniques et sont trop sensibles à la présence des ions Ca++ et Mg++.
Ils peuvent également être utilisés comme floculants.
Ce sont des agents mouillants excellents avec un pouvoir moussant important. Il faut donc prendre des précautions particulières pour contrôler le rinçage.
Les composés d'ammoniums quaternaires sont stables en milieu acide et alcalin non oxydants.
L'efficacité est maximum à pH 7 à 9 et vers 40 à 50° C. A partir de 80° C, ils sont détruits.
Les tensio-actifs amphotères ou plus exactement les ampholytes possèdent un “zwitterion” (ou ion hybride) c'est-à-dire qu'ils forment en milieu acide des cations et en milieu alcalin des anions. Le caractère anionique des ampholytes est dû à la présence d'un groupe acide (CO2H ou SO3H) et le caractère cationique à un groupe azote lié à une longue chaîne grasse.
Un groupe intéressant d'amphotères tensio-actifs est constitué par les dérivés de la bétaine.
On peut résumer les propriétés des tensio-actifs amphotères comme suit:
Ils sont insensibles aux agents de dureté.
Ils sont compatibles avec les électrolytes, les tensio-actifs anioniques et non ioniques.
Ils sont compatibles avec la peau et les muqueuses.
Ce sont des agents antimicrobiens.
Leur sensibilité dépend du pH.
Ils sont encore appelés:
Ils ont pour mission d'assurer la fonction antitartre. Aussi on retrouve dans le commerce des agents complexants vendus sous le nom d'antitartre.
Ils “séquestrent” les cations (ions positifs) métalliques et les empêchent de se lier à des anions (ions négatifs) sous forme de sels insolubles. Parmi ces cations on aura le calcium (Ca++) le magnésium (Mg++), le fer (Fe++), le cuivre (Cu++), le Zinc (Zn++), l'aluminium (Al+++).
Les complexants employés devront être choisis en fonction du pH d'utilisation et du métal à complexer.
Pratiquement, toutes les formules de détergents industriels comprennent des complexants car la déminéralisation de l'eau, qui serait une autre alternative reste un procédé coûteux.
Si les agents tensio-actifs ont été en général étudiés pour résister aux eaux dures, il n'en reste pas moins qu'ils sont meilleurs détergents en eau douce ou déminéralisée.
Les complexants peuvent se classer en deux grandes familles:
Le mécanisme par lequel les complexants permettent l'élimination des ions calcium et magnésium peut être illustré schématiquement de la façon suivante:
Elimination par formation de complexes
Les complexants minéraux et organiques peuvent conduire à l'élimination des ions calcium et magnésium en formant des complexes solubles dans l'eau.
Retard de la précipitation des sels insolubles de calcium et des magnésium par des additifs. Ces additifs bien qu'ils soient utilisés en très petites quantités apportent une contribution importante. Ces additifs comprennent des phosphates à bas poids moléculaires et des composés macromoléculaires polyioniques. Quand ils sont utilisés en quantités sous stoechiométriques, ces additifs ne peuvent pas empêcher la précipitation des sels de calcium ou de magnésium. Ils la retardent seulement pour qu'elle se produise après le processus de lavage.
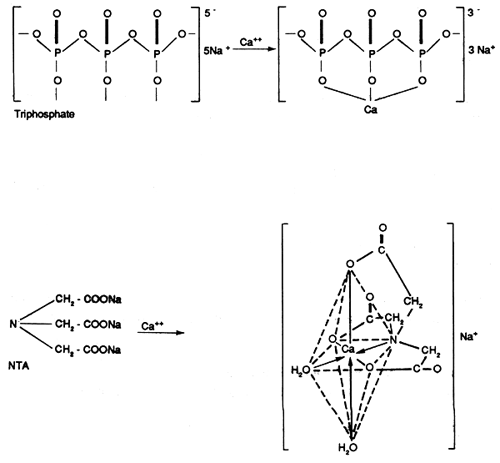
Elimination par échange d'ions
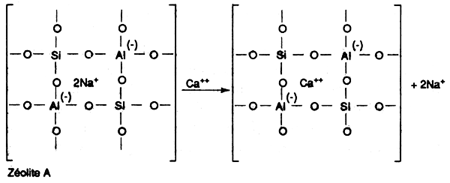
Les phosphates polymères
On utilisera particulièrement:
Les polyphosphates possèdent, non seulement une action chélatante, mais une action inhibitrice de précipitation se manifestant même lorsqu'une faible proportion seulement de la dureté des eaux est chélatée (ils agissent en sous-stoechiométrie). Une eau dans laquelle 10 ou 20% de la dureté est chélatée par un polyphosphate, est efficacement stabilisée vis-à-vis de la précipitation à chaud ou par les alcalis alors que pour l'EDTA, les gluconates et les glucohéptonates, la dureté non chélatée se précipite sans inhibition. Dans le cas des phosphates polymères, la cristallisation, quand elle se produit, donne naissance à des boues. C'est la cristallisation amorphe.
Les complexants minéraux présentent les avantages suivants:
Leurs inconvénients sont:
Les aluminosilicates de sodium
Ils sont connus sous le nom de Zéolites.
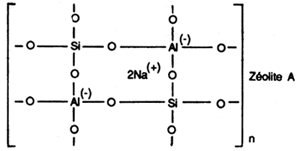
Les zéolites tendent à supplanter au moins partiellement les phosphates dans les détergents pour le linge. Ils sont généralement utilisés en association avec d'autres complexants afin de bénéficier d'un effet synergique maximum. Le zéolite est obtenu en faisant réagir de l'aluminate de sodium avec du silicate de sodium. La matière première pour l'aluminate de sodium est la bauxite. Les zéolites peuvent également être produits à partir de kaolin. Les matières premières pour la fabrication du zéolite sont donc disponibles en quantités pratiquement illimitées car approximativement 79% de la croûte terrestre est constitué d'aluminosilicates.
Parmi les plus utilisés, nous citerons:
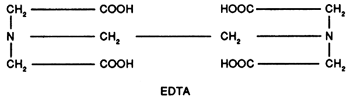
i) L'acide éthylène diamine tétracétique (EDTA)
L'acide n'est pas soluble dans l'eau: on utilise donc en général les sels de sodium.
Un rejet riche en EDTA peut être acidifié et le précipité obtenu peut être récupéré.
Outre son pouvoir séquestrant optimum entre les pH 10 et 13 pour le calcium, il a l'avantage d'être stable en milieu alcalin à chaud contrairement aux complexants minéraux dont l'EDTA retarde d'ailleurs la décomposition.
Il stabilise aussi les silicates qui floculent à la longue.
Il a un pouvoir dispersant faible mais il exerce une action synergique sur les autres dispersants.
Par effet de complexation du calcium, on constate une augmentation de la mousse.
Le pouvoir complexant est très influencé par le pH (voir tableau).
L'EDTA accroît de façon considérable le pouvoir antiredéposition d'un détergent composé.
Ordre de séquestration préférentielle
| pH 3,5 | pH 3,5 à 5 | pH 5 à 7,5 | pH 7,5 à 9,5 | pH 9,5 à 12 | pH 12 |
| Fe + + + | Fe + + + | Cu | Cu | Cu | Cu |
| Hg | Cu | Fe + + + | Pb | Ni | Fe + + |
| Cu | Pb | Pb | Ni | Fe + + + | Ca |
| Pb | Ni | Ni | Zn | Ca | Ni |
| Zn | Zn | Fe + + + | Pb | Mg | |
| Ca | Ca | Ca | Zn | ||
| Mg | Mg | Mg | Mg |
ii) Les gluconates
Les gluconates et heptogluconates de sodium sont utilisés pour leur bon effet dispersant sur les souillures pigmentées ainsi que pour leur effet complexant sur les métaux de valence 3. On obtient des complexes de fer, de cuivre et de nickel relativement stables. Cette stabilité apparaît surtout à des pH au dessus de 12,0 ce qui fait qu'ils sont utilisés dans des bains très alcalins.
Ces complexes sont facilement biodégradables dans les stations d'épuration. Ils peuvent être oxydés par l'eau de Javel et sont partiellement détruits en milieu neutre.

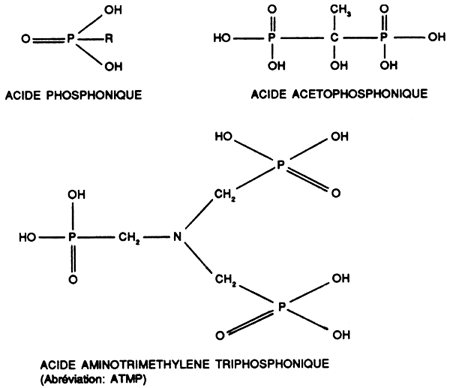
iii) Solution aqueuse des acides organophosphoniques et de leurs sels alcalins
Ils complexent en quantité sous-stoechiométrique avec formation d'un dépôt mou.
Ils résistent à l'oxydation et peuvent être utilisés en présence d'hypochlorite.
Ce sont d'excellents complexants du calcium, du magnésium et des métaux lourds.
Ne s'hydrolysent pas.
Ne précipitent pas les ammoniums quaternaires dans leurs solutions aqueuses comme les polyphosphates.
Ont un effet inhibiteur sur l'attaque de l'aluminium.
iv) Les citrates et le NTA
 | NTA |
| ACIDE NITRILOTRIACETIQUE |
Ils complexent fortement les métaux lourds et sont souvent cités comme produits de remplacement des phosphates.
Le NTA soupçonné d'être cancérigène a été interdit par l'Etat de New York.
v) Les polycarboxylates
Ils agissent en tant qu'additifs, dans cette famille nous citerons:
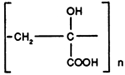 | ACIDE POLYα ET HYDROXY ACRYLIQUE (Abréviation: PHAS) |
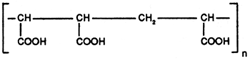 | COPOLYMÈRE DES ACIDES MALEIQUE ET ACRYLIQUE (Abréviation: CP4) |
Tableau récapitulatif des agents séquestrants
| Agent séquestrant | mg/1 séquestrant par degré TH dans 1 % (NaOH) | Action
stoechiométrique = S Sous-stoechiométrique = SS | Stabilité | Solubilisation des cations | |
| milieu oxydant | dans le temps | ||||
| Pyrophosphate de Na | 71 | S + SS | oui | non | Ca - Mg - Fe Zn - Cu |
| Tripolyphosphate de Na | 36 | S + SS | oui | non | Ca - Mg - Fe Zn - Cu |
| Hexamétaphosphate de Na | 25 | S + SS | oui | non | Ca - Mg |
| EDTA - HNa | 36 | S | (oui) | oui | Ca - Mg - Fe |
| Gluconate de Na | 30 | S | non | (oui) | Fe - Al |
| Glucoheptonate de Na | 35 | ||||
| Acétophosphonate de Na | 26 | S + SS | oui | oui | Ca - Mg |
Un grand nombre d'additifs peuvent entrer dans les formulations. Nous citerons ciaprès les principaux types d'additifs utilisés en industrie alimentaire. Il faut se rappeler cependant que cette liste n'est pas limitative.
Les charges
Ce sont des composés à réaction neutre qui n'apportent pas de propriétés spéciales au niveau de la détergence.
Elles peuvent servir par exemple à fixer les tensio-actifs liquides dans les produits poudreux mais souvent elles seront utilisées principalement pour diminuer le coût de revient d'un produit industriel.
L'exemple type de charges dans les produits pulvérulents sera le sulfate de sodium. Il a une action pratiquement nulle sur la détergence sauf peut-être en eau très douce. Il possède cependant un pouvoir de synergie sur une solution de dodécylbenzène-sulfonate.
On explique cette propriété par la diminution de solubilité de l'agent tensio-actif ce qui provoque une augmentation de la concentration moléculaire en surface du liquide et une amélioration du pouvoir mouillant de la solution.
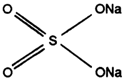 | SULFATE DE SODIUM |
Abrasifs et récurants
Leur rôle est de renforcer au cours du nettoyage l'action mécanique au niveau des salissures. Ils sont utilisés uniquement manuellement.
Les produits le plus couramment utilisés sont:
| - Le kiéselgur | |
| - La silice | |
| - Le silicate de magnésium | |
| - L'oxyde de titane | abrasifs doux |
Il faut faire attention à ce que la dureté de l'abrasif soit plus grande que celle de la salissure et plus petite que celle du support.
Les épaississants
Ils sont souvent de la famille des carboxyméthyl-celluloses. Ils servent à épaissir et à stabiliser certaines formulations liquides. Ils améliorent le pouvoir antiredéposition des solutions détergentes.
Certaines préparations tensio-actives s'épaississent avec du chlorure de sodium.
Les agents dispersants
Ils aident à conserver en suspension les souillures non dissoutes. Des exemples types sont l'amidon, le carboxyméthyl-cellulose et les polyphosphates.
Les inhibiteurs
Ils sont utilisés afin de réduire l'effet corrosif des acides et des alcalins sur les métaux. Par exemple le sulfate de sodium est utilisé pour protéger les surfaces en étain contre les alcalins, et les silicates de sodium sont utilisés pour protéger l'aluminium et ses dérivés contre les alcalins légers.
Les amines grasses
La plus utilisée est la triéthanolamine:
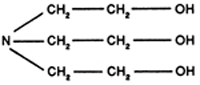
La triéthanolamine et les autres alcanolamines sont utilisées dans de nombreux bains de dérouillage alcalins, de détergents neutres, comme anti-rouille, pour l'élimination des souillures pigmentées ainsi que dans les dissolvants à froid. Du point de vue toxicologique, la triéthanolamine est sans danger (autorisée en industrie alimentaire). Les amines grasses seront utilisées dans les produits de lubrification de chaîne car outre leur excellent pouvoir lubrifiant elles donnent de bons résultats de nettoyage et de désinfection.
Les additifs organiques (types enzymes)
Ils sont utilisés pour éliminer des souillures organiques lorsque les produits détergents classiques se révèlent trop agressifs.
Ce sont des produits chers et souvent très sensibles à la chaleur et au pH.
Perborate de sodium
Il est actif en milieu alcalin.
Il possède des fonctions désinfectantes mais il est utilisé surtout pour ses propriétés blanchissantes.
Le principal péroxyde utilisé en blanchiment est le perborate de soude tétrahydraté. Sous forme cristallisée il se présente sous forme de péroxydiborate et dans la pratique on utilise la plupart du temps la formule brute simplifiée Na BO3, 4 H2O.
L'effet blanchissant du perborate est très marqué pour des températures comprises entre 80 et 90 °C. A des températures comprises entre 40 et 60 °C, l'effet de blanchiment peut être mesuré mais il est pourtant souvent insuffisant dans la pratique. Il faut alors utiliser des activateurs de perborate. Parmi de nombreux composés, c'est le TAED (Tétra acétyléthylénediamine) qui s'est imposé pour le moment sur le marché.
Percarbonate de sodium
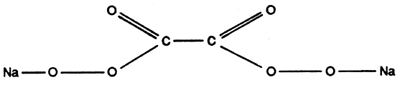
Il est un peu moins stable que le perborate de sodium. On l'utilise dans certaines poudres de lavage mais aussi comme renforçateur de nettoyage ou produit détachant.
Les tiers solvants
Souvent les différents ingrédients d'une formulation liquide ne sont pas solubles et l'on observe un relargage.
Pour pallier cet inconvénient on est contraint d'ajouter des tiers solvants à la formulation. Le plus utilisé est certainement l'alcool iso-propylique (IPA).
Les antimousses
Le cassage des mousses peut être obtenu de diverses manières:
Par addition, si le mouillant est ionique d'un mouillant ionique de signe opposé au premier. On annihile ainsi l'effet du mouillant et la mousse tombe.
Par addition d'électrolytes amenant le mouillant dans la zone de pH ou il devient inactif par addition de sels formant avec le mouillant un précipité insoluble.
Par addition en très petites quantités de silicones, alcool octylique, alcool amylique, stéarate de glycol, oléate de potassium, sels de dialkyl orthophosphates, sels de trialkylthiophosphates, huiles fluorées, esters phtaliques, etc.
Avant d'utiliser un antimousse en industrie alimentaire, il faudra prendre soin de vérifier s'il est autorisé ou non.
Pour obtenir un résultat maximum, l'antimousse doit renfermer plusieurs agents ayant chacun des qualités particulières. Le nombre des composés actifs est relativement élevé et l'on peut dire que pour chaque effluent, une composition bien déterminée sera la mieux appropriée pour juguler les mousses qui s'y développent.
Il faut rappeler que les antimousses ne sont qu'un des moyens mis à la disposition des industriels pour réduire les mousses géantes.
Tout d'abord, il est nécessaire de réduire les phénomènes de spumation:
En évitant l'introduction de gaz ou d'air dans les milieux considérés. Il faudra réduire les agitations et éviter l'emploi des pompes défectueuses à entrée d'air. Il faudra calculer les rayons de courbures des conduites pour éviter les turbulences, et prendre des diamètres de tuyauterie importants.
En alternant la nature ou en modifiant la concentration des colloïdes présents.
En éliminant ou en absorbant les gaz indésirables.
En faisant varier les pH de manière à changer les degrés de dispersion des impuretés organiques ou minérales, en favorisant leur précipitation ou leur solubilisation, par abattage physique (pulvérisation d'eau).
En n'utilisant pas de composés capables de provoquer des dégagements gazeux.
En jouant sur les températures.